Газета «Новости медицины и фармации» 19 (476) 2013
Вернуться к номеру
Ревматоидный артрит: диагностика, клиника, лечение
Авторы: Дядык А.И., Здиховская И.И., Шпилевая Н.И., Христуленко А.Л., Мальцева Н.В. - Донецкий национальный университет им. М. Горького
Разделы: Медицинское образование
Версия для печати
Введение
Последние два десятилетия ознаменовались значительными достижениями в изучении патофизиологии и лечении ревматоидного артрита (РА). Широко распространенный в 60–80-е годы прошлого века афоризм: «Мы не лечим РА, а только оказываем помощь больному с РА» («We don’t treat RA, we manage the patient with the disease») — сегодня может рассматриваться как анахронизм. Своевременное назначение (т.е. на ранних этапах заболевания, в идеале — в первые три месяца) болезнь-модифицирующих антиревматических препаратов (БМАП) в адекватных дозировках самостоятельно, а при необходимости — в различных комбинациях позволяет во многих случаях успешно контролировать активность заболевания, предотвращать или замедлять развитие эрозивных процессов. Крупным достижением стало создание и внедрение в клиническую практику лечения РА так называемых биологических агентов — медицинских препаратов, полученных методом генной инженерии, мишенями для которых являются ключевые провоспалительные цитокины, их рецепторы и иммунокомпетентные клетки. Результаты ряда исследований позволяют с оптимизмом смотреть на возможности низких дозировок глюкокортикоидов (Гк) как в контроле активности заболевания, так и в замедлении прогрессирования суставных поражений.
Идентификация новых маркеров воспаления, применение ультразвукового исследования (УЗИ) и магнитно-резонансной томографии (МРТ) позволило существенно улучшить диагностику РА и динамический контроль эффективности проводимой терапии.
Определение, медико-социальная значимость, распространенность
Ревматоидный артрит — широко распространенное аутоиммунное заболевание неизвестной этиологии, характеризующееся симметричным эрозивным синовитом, деструкцией хрящевой и костной тканей, а также нередко развитием широкого спектра системных проявлений. В большинстве случаев заболевание имеет хроническое течение, ведущее (при отсутствии своевременной адекватной терапии) к прогрессирующим деструкции, деформации и нарушению функции суставов, существенному снижению качества жизни, инвалидизации и преждевременной смерт.
РА представляет серьезную социально-экономическую проблему, что связано с его широкой распространенностью, неблагоприятным прогнозом (при несвоевременной и неадекватной терапии), а также необходимостью длительного (а нередко — постоянного) приема лекарственных препаратов, обычно в различных комбинациях. Кроме того, часть больных РА нуждается в различных ортопедических вмешательствах. Современные подходы к лечению РА сопряжены с огромными финансовыми затратами. Сказанное объясняет существенные социально-экономические потери, связанные с РА, которые сопоставимы с таковыми при ишемической болезни сердца (ИБС).
РА является наиболее частым системным заболеванием соединительной ткани. По данным различных исследовательских групп, РА болеют 0,5–2,5 % взрослого населения. РА может возникать в детском возрасте (ювенильный РА), но наиболее часто возраст начала заболевания составляет 52 ± 15 лет. Среди лиц моложе 35 лет распространенность РА — 0,38 %, а в возрасте старше 55 лет — 1,4 %. Женщины болеют чаще мужчин — 2–3 : 1. Высокую частоту развития РА отмечают у родственников первой степени родства (3,5 %), особенно у лиц женского пола (5,1 %).
Этиология
Этиология РА остается неизвестной. Изучается роль широкого спектра экзогенных, в том числе инфекционных (вирус Эпштейна — Барр, парвовирус В19, ретровирусы, антигены и стрессовые белки бактерий) и неинфекционных (курение, угольная пыль, некоторые компоненты минеральных масел, различные химические соединения, лекарственные вещества), а также эндогенных (цитруллиновые белки и пептиды) факторов. Предполагается, что экзогенные факторы принимают опосредованное участие в развитии РА на фоне генетической предрасположенности.
В последние годы активно изучается роль генетических факторов в развитии РА, риск развития которого ассоциирован с носительством антигена главного комплекса гистосовместимости класса ІІ HLA-DR4 и DR1, который включает более 22 аллелей. При изучении индивидуальных аллелей было идентифицировано два наиболее тесно ассоциированных с РА: DRB1*0401 и DRB1*0404, носительство которых выявляют у 50–61 % и 27–37 % пациентов с РА соответственно. Характерная аминокислотная последовательность этих аллелей получила название «общий эпитоп» (shared epitips — SE). Носительство SE ассоциируется с тяжестью течения РА. Так, носительство одного или двух аллелей DR4 связано с двукратным увеличением риска формирования эрозий суставов. Носительство SE 0401, 0404 или 0408 увеличивает риск внесуставных проявлений РА (васкулит, поражение легких, синдром Фелти). Носительство двух аллелей DR, имеющих SE, связано с более тяжелым течением РА, чем носительство одного.
Интерес представляют данные о связи между SE и аутоиммунными нарушениями при РА, в частности с наличием ревматоидного фактора (РФ) и антител к циклическому цитруллиновому пептиду (АЦЦП). Образование цитруллина — результат дезаминирования положительно заряженной аминокислоты аргинина, которое регулируется ферментами семейства пептидиларгининдезаминазы. Появление нейтральной аминокислоты цитруллина приводит к изменению структуры и увеличению иммуногенности модифицированных белков, возрастанию их аффинности к DR4 и способности активировать Т-лимфоциты. Цитруллинирование белков — универсальный процесс, ассоциированный с воспалением, а также с влиянием факторов внешней среды, в первую очередь с курением. В качестве артритогенных цитруллированных белков рассматриваются фибриноген, виментин, фибронектин, a-энолаза, антигены и ядерные белки вируса Эпштейна — Барр, аутоэпитопы антигенсвязывающих участков рецепторов Т- и В-лимфоцитов. В недавних исследованиях показано, что сочетание носительства SE с курением, злоупотреблением кофеином, приемом контрацептивов существенно увеличивает риск развития РА, позитивного по РФ и особенно по АЦЦП. В то же время при отсутствии носительства SE такая связь не наблюдается.
Обсуждается роль других генетических факторов в развитии РА, непосредственно не связанных с HLA-DR. К ним относят полиморфизм генов, кодирующих синтез белков и регулирующих процессы активации Т-лейкоцитов.
Патогенез
Патогенез РА представляется сложным, а ряд его звеньев остаются малоизученными. В развитии заболевания предполагается участие различных агентов, обусловливающих активацию иммунной системы генетически предрасположенного больного. Ведущей мишенью системного аутоиммунного воспаления, характеризующего РА, является синовиальная оболочка суставов.
Синовиальная оболочка — это внутренний слой капсулы сустава, не покрывающий хрящ (рис. 1) и представляющий собой пласт соединительной ткани, состоящий из покровного, коллагенового и эластического слоев. Со стороны суставной полости синовиальная оболочка выстлана прерывистым слоем синовиоцитов (синовиальных клеток), между которыми находится основное вещество и межклеточный матрикс соединительной ткани с сетью кровеносных и лимфатических сосудов и нервных окончаний. Основные функции синовиоцитов — синтез протеогликанов (компонентов матрикса и синовиальной жидкости), а также элиминация продуктов тканевого и клеточного распада. В синовиальной оболочке присутствуют дендритоподобные (антигенпрезентирующие) и тучные клетки, небольшое количество лейкоцитов.
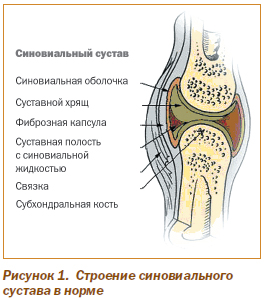
Полость сустава заполнена небольшим количеством синовиальной жидкости, являющейся транссудатом плазмы, с продуктами синтеза синовиоцитов и небольшим количеством клеточных элементов. Ее основные функции — трофическая, метаболическая, барьерная и локомоторная.
Ведущий морфологический признак РА — формирование эктопированного очага синовиальной оболочки в виде ее ворсинчатого разрастания (гиперплазии). Инвазивный рост этой структуры (паннуса) приводит к разрушению суставного хряща и субхондральной кости. При этом в суставном хряще определяются эрозии, трещины, щели; в суставных полостях — увеличенное количество вязкой мутной синовиальной жидкости. Отмечаются утолщение, склероз и фиброзные наслоения суставной капсулы. Полная облитерация суставной полости ведет к развитию фиброзного анкилоза. Пролиферация остеоидной ткани сопровождается развитием остеофитов и костных анкилозов.
Гистологически в синовиальной оболочке отмечается увеличение числа синовиоцитов, утолщение интимы, инфильтрация иммунными воспалительными клетками (макрофагами, Т- и В-лимфо-цитами, плазматическими и дендритными клетками), образование фолликулов из воспалительных клеток, разрастание грануляционной ткани, склероз, липоматоз коллагенового и эластического слоев синовиальной оболочки. Повышается проницаемость стенок сосудов микроциркуляторного русла, сопровождающаяся выходом фибринозного экссудата и образованием очагов фибриноида в синовиальной собственной пластинке и фибриноподобных наложений на поверхности синовиальной оболочки. На ранней стадии заболевания отмечается неоангио-генез. В глубоких слоях синовиальной оболочки изредка определяются ревматоидные узелки — небольшие участки фибриноидного некроза, окруженные макрофагами и лимфоцитами. В 80 % случаев встречаются гиперплазия и гипертрофия синовиоцитов с характерным палисадообразным их расположением. Иммуноморфологически в очагах фибриноида и в фибриноподобных наложениях выявляются фибрин, иммуноглобулины (G, А, М) и С3-фракция комплемента.
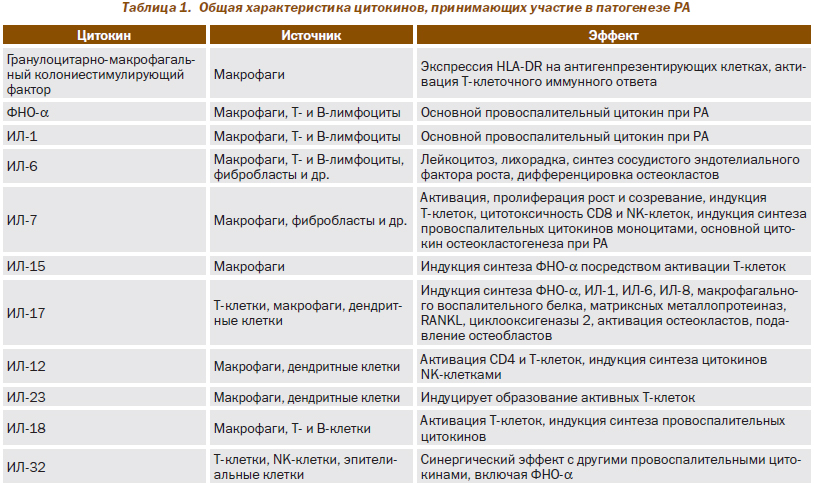
Развитие РА связано с Т-клеточным иммунным ответом, для которого характерна гиперпродукция провоспалительных цитокинов, таких как интерлейкины (ИЛ): ИЛ-1, -12, -7, -17, -6, -18, -2, фактор некроза опухоли a (ФНО-a), гамма-интерферон (табл. 1).
Подавляющее большинство Т-лимфоцитов, участвующих в развитии РА, принадлежит субпопуляции CD4+ с фенотипом, характерным для клеток памяти. Они проявляют активность хелперных клеток, стимулирующих синтез аутоантител В-клетками. Кроме того, в синовиальной ткани при РА отмечают накопление CD8+ и CD28– Т-клеток, обладающих активностью аутореактивных естественных киллерных клеток. Увеличение их числа коррелирует с развитием эрозий суставов. При РА также наблюдается угнетение супрессорных механизмов (субпопуляции Т-лимфоцитов CD25+) при увеличенной продукции ИЛ-15 и ИЛ-17, что поддерживает аутоиммунные процессы. В-клетки участвуют в активации CD4+-лимфоцитов, выполняя функцию специфических антигенпрезентирующих клеток. В-лимфоциты, синтезирующие РФ, взаимодействуют с иммунными комплексами и презентируют широкий спектр аутоантигенов и костимуляторных молекул, необходимых для активации Т-клеток.
В развитии синовита при РА принимают участие тучные клетки, активированные с участием компонентов комплемента, аутоантител, цитокинов. Тучные клетки синтезируют широкий спектр медиаторов воспаления (гистамин, ФНО-a, триптаза, химаза и др.), стимулирующих хондроциты, синовиальные фибробласты и макрофаги, которые, в свою очередь, синтезируют воспалительные медиаторы, вызывающие отек и деструкцию тканей сустава.
Под влиянием провоспалительных цитокинов покровные синовиоциты приобретают так называемый трансформационный фенотип (характерный для опухолевых клеток). Хотя в отличие от опухолевых синовиальные клетки не метастазируют, они приобретают способность к инвазии ткани хряща и связок и стимулируют активацию и дифференцировку остеокластов, вызывающих резорбцию костной ткани. Синовиальные клетки, а также макрофаги синтезируют матриксные металлопротеиназы, играющие важную роль в деструкции хрящевой и костной ткани. При этом процессы деструкции кости существенно преобладают над процессами репарации.
К другим стимуляторам воспаления и деструкции относят продукты активации комплемента, образование которых связано с РФ-содержащими иммунными комплексами, АЦЦП-антителами, а также широким спектром неиммунных медиаторов, включая оксид азота, нейропептиды, метаболиты арахидоновой кислоты, факторы свертывания и фибринолиза.
Таким образом, патогенез РА представляется многогранным, а многие его звенья нуждаются в дальнейшем изучении и уточнении.
Клиническая картина
Ведущим клиническим проявлением РА является различной степени выраженности суставной синдром. Развитию артрита от нескольких недель до нескольких месяцев могут предшествовать повышенная утомляемость, снижение аппетита, похудение, артралгии, субфебрильная температура, повышенная потливость, умеренная анемия, повышенная скорость оседания эритроцитов (СОЭ), лимфоаденопатия.
Варианты начала (дебюта) РА могут быть разнообразными:
— симметричный полиартрит с постепенным нарастанием боли и скованности, преимущественно в мелких суставах кистей;
— острый полиартрит с преимущественным вовлечением суставов кистей и стоп, выраженной утренней скованностью;
— моно- или олигоартрит коленных или плечевых суставов с последующим быстрым вовлечением мелких суставов кистей и стоп;
— острый моноартрит крупных суставов;
— острый олиго- или полиартрит с системными проявлениями (лихорадка, лимфаденопатия, гепатоспленомегалия);
— рецидивирующий бурсит и теносиновит лучезапястных суставов;
— острый полиартрит у лиц пожилого возраста с множественным поражением мелких и крупных суставов, выраженными болями, диффузным отеком и ограничением подвижности суставов;
— генерализованная миалгия, скованность, двусторонний синдром запястного канала, похудение. Обычно наблюдается у пожилых пациентов. Признаки, характерные для РА, появляются позже.
По характеру течения и прогрессирования деструкции суставов и внесуставных проявлений выделяют несколько вариантов течения РА:
— быстро прогрессирующее течение: высокая активность заболевания, быстрое развитие деструкции суставов, тяжелые внесуставные поражения;
— прогрессирующее течение: нарастает деструкция суставов, вовлекаются новые суставы, развиваются внесуставные поражения;
— интермиттирующее течение: периодически наблюдается полная или частичная ремиссия (спонтанная или индуцированная лечением), сменяющаяся обострением с вовлечением в процесс ранее не пораженных суставов;
— длительная спонтанная клиническая ремиссия.
Вовлечение в патологический процесс суставов является ведущим в клинической картине РА. В начальном периоде у 1/3 больных отмечаются артралгии, усиливающиеся при движениях, у 2/3 — симметричный артрит мелких суставов кистей и стоп. Характерный признак синовиального воспаления — утренняя скованность в суставах, ее длительность обычно коррелирует с интенсивностью воспаления и составляет не меньше 1 часа. Боль и скованность наиболее интенсивны в утренние часы и постепенно стихают к вечеру.
Первыми, как правило, при РА вовлекаются вторые-третьи пястно-фаланговые, проксимальные межфаланговые суставы и суставы запястья, реже — плюснефаланговые. Затем по частоте поражения следуют коленные, локтевые, голеностопные суставы.
Ряд суставов в дебюте РА остаются интактными («суставы исключения») — дистальные межфаланговые, первый пястно-фаланговый сустав большого пальца кисти, проксимальный межфаланговый сустав мизинца.
Поражение суставов при РА имеет свои клинические особенности.
Вовлечение суставов кистей наиболее типично для РА (рис. 2). Первыми поражаются пястно-фаланговые и проксимальные межфаланговые суставы. Вначале появляется боль и отечность сустава, связанные с воспалением и утолщением синовиальной оболочки и мягких тканей сустава, накоплением избыточного количества синовиальной жидкости. Движения ограничены из-за болевых ощущений. Пациент удерживает сустав в состоянии сгибания, с тем чтобы уменьшить натяжение суставной капсулы.
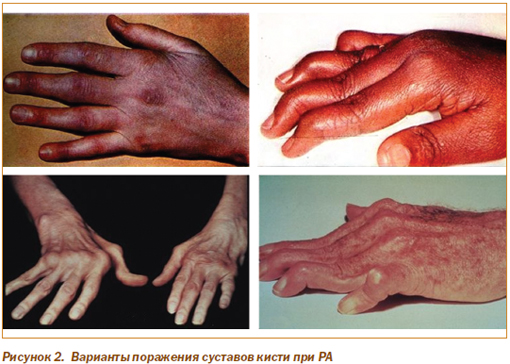
Пальцы приобретают веретенообразный вид из-за воспаления проксимальных и интактности дистальных межфаланговых суставов. Позже развивается фиксированная деформация сустава, обусловленная фиброзным или костным его анкилозом или контрактурами мягких тканей. Артрит суставов запястья приводит к деструкции мелких костей с последующим формированием единого костного блока с анкилозированием их с запястно-пястными суставами. Развитие подвывихов и контрактур при прогрессировании РА приводит к формированию характерных деформаций суставов кистей: ульнарная девиация (отклонение пальцев в сторону локтевой кости — «плавник моржа»), сгибательная контрактура в пястно-фаланговых суставах при переразгибании в проксимальных и сгибании в дистальных межфаланговых суставах («шея лебедя»), сгибательная контрактура в пястно-фаланговых и проксимальных межфаланговых суставах при переразгибании в дистальных межфаланговых суставах. К относительно ранним признакам РА относят атрофию межкостных (червеобразных) мышц. При длительном течении заболевания и вовлечении других суставов наблюдается гипо- и атрофия мышц других локализаций.
Артрит лучелоктевого сустава проявляется болезненной пронацией и супинацией. Поражение локтевого сустава чаще наблюдается при длительном течении РА, приводит к ограничению сгибания и разгибания с последующим формированием контрактуры в положении полусгибания и полупронации. При этом нередко происходит ущемление локтевого нерва с парестезией иннервируемой области.
Поражение плечевого сустава характеризуется не только его синовитом, но и вовлечением в патологический процесс дистальной трети ключицы, синовиальных сумок и мышц плечевого пояса, шеи и грудной клетки. При накоплении выпота в плечевом суставе припухлость и болезненность определяются как по передней поверхности, так и со стороны подмышечной впадины.
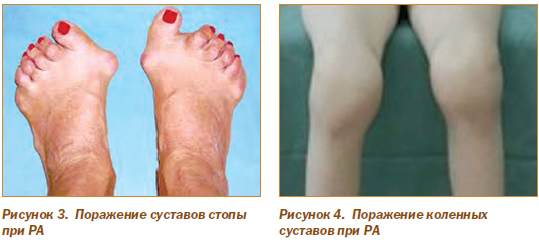
Суставы стоп (рис. 3) поражаются у трети больных в раннем периоде заболевания. Процесс чаще локализуется в плюснефаланговых суставах второго–четвертого пальцев и проявляется болью при ходьбе, подпрыгивании или стоянии на пальцах. Постепенно развивается деформация стопы с опусканием переднего свода, формированием вальгусной деформации большого пальца и молотообразной деформацией остальных пальцев с подвывихами в плюснефаланговых суставах.
Коленные суставы (рис. 4) — место частой локализации РА. Выпот в суставе определяется баллотированием при пальпации сустава в направлении с переднелатерального отдела к медиальной стороне. Сгибание коленного сустава повышает внутрисуставное давление, что может приводить к выпячиванию заднего заворота суставной сумки в подколенную ямку и формированию кисты Бейкера.
Тазобедренные суставы обычно поздно вовлекаются в патологический процесс, что проявляется болью, иррадиирующей в паховую область или нижний отдел ягодичной области. Бедро обычно фиксируется в положении небольшого сгибания. Резко ограничивается внутренняя ротация.
Нередко при РА поражается височно-нижнечелюстной сустав, что ограничивает открывание рта и затрудняет прием пищи.
Поражение суставов позвоночника отмечается редко и на поздних стадиях РА. Страдает в основном шейный отдел вследствие артрита атланто-аксиального сустава. При этом боль возникает при поворотах головы. Вовлечение дугоотростчатых суставов шейного отдела позвоночника проявляется болью и скованностью и может приводить к смещению и сдавлению спинного мозга.
У 80 % больных РА развивается поражение скелетных мышц, наиболее часто проявляющееся их атрофией и имеющее прямую связь с активностью и тяжестью суставного синдрома. Сочетание атрофии тыльных межкостных мышц, мышц тенара и гипотенара с припухлостью пястно-фаланговых, проксимальных межфаланговых суставов и суставов запястья создает картину типичной ревматоидной кисти (рис. 5).
При РА нередко развиваются внесуставные поражения, как правило, в сочетании с артритом, но иногда доминируя в клинической картине заболевания. Внесуставные проявления РА, такие как васкулит, полисерозиты, нейропатия, поражение глаз, сердца, легких и почек, считаются прогностически неблагоприятными. В рамках данного сообщения мы не останавливаемся на детальном рассмотрении внесуставных проявлений РА, а приводим лишь краткое описание наиболее частых из них (табл. 2).
Диагностика
Диагностика РА базируется на оценке клинической картины заболевания, лабораторном обследовании и рентгенографии суставов.
Данные лабораторных исследований
При РА отсутствуют специфические лабораторные показатели. Однако, как правило, выявляется ряд патологических параметров, которые при сопоставлении с клинической картиной играют важную роль в диагностике заболевания.
При активном ревматоидном процессе часто развивается умеренная, нормо- или гипохромная анемия, как правило, коррелирующая с активностью патологического процесса. Нередко развитие анемии может быть следствием приема ряда лекарственных препаратов, таких как соли золота, пеницилламин, цитотоксические иммунодепрессанты, нестероидные противовоспалительные препараты (НПВП).
Лейкоцитарная формула крови обычно не изменяется, за исключением особых форм РА. Так, для синдрома Фелти характерна лейко- и нейтропения, а для синдрома Стилла взрослых — лейкоцитоз со сдвигом влево.
Повышение СОЭ наблюдается у 90 % больных РА. Ее уровни ассоциируются с активностью заболевания и его тяжестью. Стойкая нормализация СОЭ свидетельствует о ремиссии процесса, а ее стойкое повышение является важным предиктором неблагоприятного прогноза РА. Активность воспалительного процесса при РА отражают и количественные колебания уровня С-реактивного белка (СРБ) в крови пациентов. Повышение СРБ при РА выявляется у 70–80 % больных.
Для диагностики РА важно определение ревматоидного фактора (РФ). РФ — это общий термин, обозначающий аутоантитела к антигенным компонентам Fc (кристаллизуемого) фрагмента иммуноглобулина G. Реакция Ваалера — Роуза считается положительной при титре выше 1 : 32, а латекс-тест — выше 1 : 40. В обеих реакциях определяется РФ, относящийся к классу IgM, имеющий при РА ведущее значение.
РФ у больных РА обладает высокой чувствительностью и специфичностью, его обнаруживают в значительных титрах (чаще от 1 : 64 до 1 : 1024) у 75–80 % больных. У здоровых и пациентов с другими заболеваниями (туберкулез, бактериальный эндокардит, злокачественные опухоли и др.) РФ выявляется редко и в низких титрах. Наличие РФ в высоких титрах часто указывает на высокий риск развития тяжелых суставных поражений и внесуставных проявлений РА.
Для РА с тяжелым поражением внутренних органов характерно наличие в сыворотке крови различных антител. У 8–27 % больных обнаруживают LE-феномен, у трети больных выявляются антирибосомальные антитела, антитела против двуспиральной ДНК. Кроме того, при РА выявляются антитела к различным вирусам (Эпштейна — Барр, краснухи, цитомегаловируса).
Для подтверждения диагноза и определения местной воспалительной активности большое значение имеет исследование синовиальной жидкости, которая при РА становится темно-желтой или бурой, мутной, с пониженной вязкостью и рыхлым муциновым сгустком. Число лейкоцитов в синовиальной жидкости повышается за счет нейтрофилов (25–90 %). Содержание белка повышается до 40–60 г/л, а уровень глюкозы снижается до 2,0 ммоль/л.
В последние годы большое внимание уделялось выяснению патогенетической значимости цитруллированных производных и антител к ним (АЦЦП) в развитии РА. В экспериментальных и клинических исследованиях получены доказательства тесной взаимосвязи АЦЦП и воспаления при РА. Это послужило основанием для создания новых диагностических тестов с применением цитруллированных пептидов для выявления антител к ним в плазме крови. Сегодня в рутинной практике широко используется иммуноферментный метод выявления АЦЦП. АЦЦП высокоспецифичны, являются предиктором раннего эрозивного поражения суставов у больных с РА и фактором риска его развития у здоровых лиц.
Рентгенологическая картина поражения суставов
Ранний рентгенологический признак РА — околосуставной (эпифизарный) остеопороз, выявляющийся уже в первые недели развития суставной патологии. Наряду с остеопорозом наблюдается атрофия субхондральной пограничной пластинки и размытая структура костной ткани эпифиза. При развитии остеопороза эпифизы пораженного сустава выглядят более прозрачными, чем в норме. Околосуставной остеопороз может быть диффузным или очаговым. Вследствие разрушения суставного хряща суживается суставная щель, которая в дальнейшем может совсем исчезнуть. Эти изменения не являются специфическими для РА и встречаются при других артритах.
Наиболее характерно для РА образование эрозий и узур (дефектов костной ткани) на суставной поверхности в результате разрушения субхондральной кости грануляционной соединительной тканью — паннусом. В первую очередь образуются краевые поверхностные узуры, так как паннус начинает разрушать кость с краев суставной поверхности. Узуры при РА имеют нечеткие края.
Вследствие узурации и остеопороза суставные поверхности выглядят неровными, изрытыми, нечеткими, что создает характерную рентгенологическую картину. Узурация суставов, как правило, начинается с плюснефаланговых суставов (головки V плюсневых костей). Далее эрозии появляются в пястно-фаланговых и проксимальных межфаланговых суставах. Суставы I пальцев кистей и стоп поражаются при РА редко.
В толще эпифизов обнаруживаются микрокисты различных размеров. Иногда (при быстропрогрессирующем или длительном течении РА) на рентгенограмме видны обширные разрушения суставных поверхностей, вплоть до полного исчезновения головок пястных костей (остеолитическая форма).
При значительных разрушениях суставов образуется анкилоз. В первую очередь анкилозу подвергаются мелкие суставы запястья, сливающиеся в единый костный блок. Одновременно с этим наблюдаются подвывихи в пястно-фаланговых суставах с отклонением пальцев в локтевую сторону.
Сегодня наиболее широко используется рентгенологическая классификация РА по О. Steinbrocker, согласно которой выделяют 4 стадии заболевания.
I стадия. Небольшой околосуставной остеопороз. Единичные кистовидные просветления костной ткани. Незначительное сужение суставных щелей в отдельных суставах.
II стадия. Умеренный (выраженный) околосуставной остеопороз. Множественные кистовидные просветления костной ткани. Сужение суставных щелей. Единичные (1–4) эрозии суставных поверхностей. Небольшие деформации костей.
III стадия. Умеренный (выраженный) околосуставной остеопороз. Множественные кистовидные просветления костной ткани. Сужение суставных щелей. Множественные (> 5) эрозии суставных поверхностей. Множественные выраженные деформации костей. Подвывихи и вывихи суставов.
IV стадия. Умеренный (выраженный) околосуставной (распространенный) остеопороз. Множественные кистовидные просветления костной ткани. Сужение суставных щелей. Множественные эрозии костей и суставных поверхностей. Множественные выраженные деформации костей. Подвывихи и вывихи суставов. Единичные (множественные) костные анкилозы. Субхондральный остеосклероз. Остеофиты по краям суставных поверхностей.
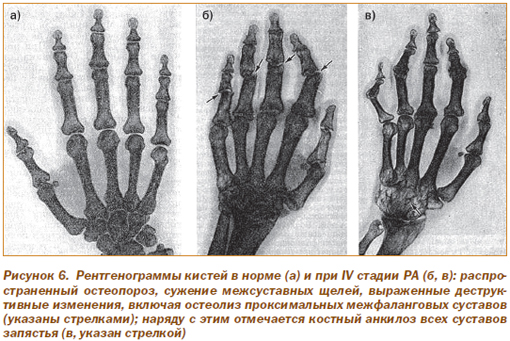
На рис. 6 приведены рентгенограммы кистей при РА IV стадии в сравнении с нормой.
В последние годы в диагностике РА наряду с рентгенографией используются такие методы визуализации, как магнитно-резонансная томография и ультразвуковое исследование суставов. Преимущества МРТ и УЗИ в диагностике воспалительного процесса и деструкции суставных тканей продемонстрированы в многочисленных исследованиях последних лет, а в марте 2013 года опубликованы рекомендации Европейской лиги борьбы с ревматизмом (EULAR), посвященные их применению у больных с РА (EULAR recommendation for the use of imaging of the joints in the clinical management of rheumatoid arthritis). Основные положения этих рекомендаций мы приводим ниже.
1. Когда диагноз сомнителен, Ро-графия, УЗИ или МРТ могут быть использованы для уточнения диагноза РА в дополнение к клиническим критериям.
2. Наличие воспаления, видимое при УЗИ или МРТ, может быть использовано для прогнозирования прогрессирования клиники недифференцированного артрита в РА.
3. УЗИ и МРТ превосходят клиническое исследование в определении наличия воспаления суставов; эти исследования должны рассматриваться как более точные для оценки воспаления.
4. Ро-графия кистей и стоп должна быть использована как первоначальное исследование в определении повреждения суставов. Однако проведение УЗИ и/или МРТ должно рассматриваться, если конвенциальная Ро-графия не показала наличия повреждения, а также они могут использоваться для выявления деструкции суставов в начальном периоде заболевания (особенно при раннем РА).
5. Отек кости, определенный при МРТ, является сильным независимым предиктором последующего рентгенологического прогрессирования при раннем РА и должен рассматриваться для использования в качестве прогностического критерия. Воспаление сустава (синовит) устанавливается при МРТ или УЗИ, в то время как деструкция суставов — при рентгенографии. Данные, полученные при МРТ или УЗИ, могут рассматриваться для прогнозирования будущего суставного повреждения.
6. Воспаление, выявленное методами визуализации, может быть лучшим предиктором терапевтического ответа, чем клинические проявления активности заболевания; визуализация может быть использована в прогнозировании ответа на терапию.
7. Принимая во внимание то, что воспаление лучше обнаруживается при МРТ или УЗИ, чем при клиническом исследовании, они могут использоваться для мониторинга активности заболевания.
8. Для периодической оценки суставного повреждения обычно должна рассматриваться возможность проведения рентгенографии кистей и стоп. МРТ и, возможно, УЗИ более информативны в определении динамики в суставной деструкции и могут быть использованы для мониторинга прогрессирования заболевания.
9. Мониторинг функциональных нарушений шейного отдела позвоночника с помощью рентгенографии в боковой проекции в нейтральном положении и при сгибании шеи должен проводиться пациентам с подозрением на вовлечение шейного отдела позвоночника. Когда рентгенограмма позитивна или имеются специфические неврологические симптомы и проявления, должна быть выполнена МРТ.
10. МРТ и УЗИ могут выявлять воспаление суставов, прогнозирующее последующее их повреждение, даже тогда, когда имеет место клиническая ремиссия; они могут использоваться для оценки персистирования воспалительного процесса.
Диагностические критерии
В течение многих лет в диагностике РА принято использовать диагностические критерии Американской ревматологической ассоциации (АРА, 1987), которые приведены ниже.
При формулировке диагноза РА, согласно отечественным рекомендациям, необходимо указывать клинические особенности заболевания (артрит, внесуставные поражения), вариант (по наличию РФ), особенности течения, степень активности (с учетом клинико-лабораторных данных), рентгенологическую стадию, степень нарушения функциональной активности.
Пример формулировки диагноза РА: ревматоидный артрит, полиартрит, серопозитивный вариант, быстропрогрессирующее течение, активная фаза, активность III, Ro-стадия III, ФН 2.
Отдельного обсуждения требует проблема ранней диагностики РА. В последние десятилетия представлены убедительные доказательства развития серьезных поражений суставных структур уже на ранних этапах заболевания: приблизительно у 75 % больных с впервые выявленным диагнозом РА, не получающих своевременную адекватную терапию, выявляются эрозивные повреждения суставных поверхностей. Результаты многочисленных контролируемых рандомизированных исследований (КРИ) свидетельствуют о высокой эффективности болезнь-модифицирующих антиревматических препаратов (в виде монотерапии и в различных комбинациях), принимаемых на ранних этапах заболевания (в течение первых трех месяцев от его начала), существенно превосходящую таковую, проводимую в более отдаленные сроки от начала заболевания. Это касается как синтетических, так и биологических БМАП.
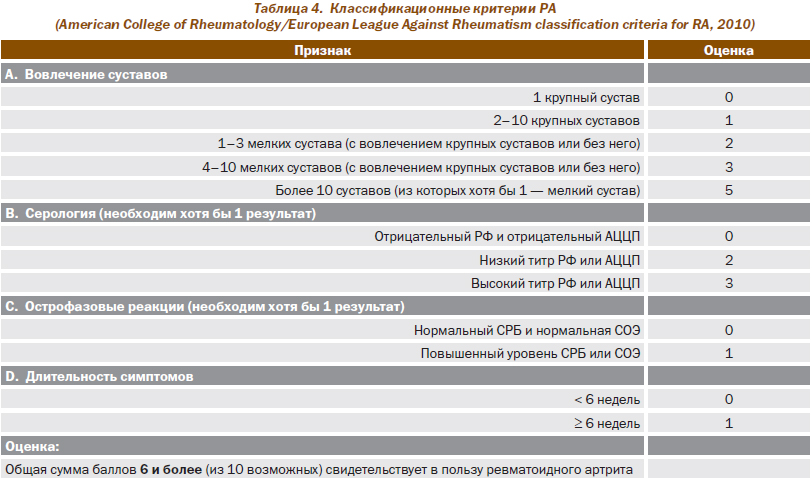
Несвоевременное назначение больным РА оптимальных лечебных режимов, включающих БМАП, обусловлено прежде всего запоздалой диагностикой заболевания, что связано как с пролонгацией обращения пациента к врачу после появления первых признаков заболевания, так и с трудностями диагностики РА на ранних стадиях заболевания. В связи с этим мы сочли необходимым привести недавно опубликованные диагностические критерии РА, разработанные ведущими ревматологами Европы и США (табл. 4).
Широкое использование этих критериев, представленных в виде 10-балльной шкалы, по мнению их разработчиков, позволит улучшить раннюю диагностику РА, облегчить обоснованный выбор терапии БМАП, усовершенствовать критерии вовлечения пациентов с ранним РА в клинические исследования.
Лечение
Цели лечения больных с РА: уменьшение симптомов или их устранение; замедление или предотвращение деструкции, деформации и нарушения функции суставов; сохранение и улучшение качества жизни пациентов; достижение ремиссии заболевания; снижение риска развития коморбидных заболеваний; увеличение продолжительности жизни пациентов.
Немедикаментозное лечение
После постановки диагноза РА необходимо разъяснять пациенту, что это серьезное хроническое заболевание, с которым ему придется жить. В связи с этим больной должен активно участвовать в лечебном процессе, что во многом определяет успех лечения.
В основе лечения РА лежит мультидисциплинарный подход, основанный на использовании нефармакологических и фармакологических методов, привлечении специалистов других специальностей (ортопедов, физиотерапевтов, кардиологов, нефрологов, неврологов, психологов и др.).
При отсутствии серьезных деформаций суставов трудоспособность пациентов сохранена, однако значительные физические нагрузки им противопоказаны. Пациентам следует избегать факторов, которые могут провоцировать обострение заболевания, в частности интеркуррентных инфекций. Рекомендуется прекратить курение и ограничить прием алкоголя.
Поддержание идеальной массы тела способствует уменьшению нагрузки на суставы и снижению риска развития осложнений, в том числе остеопороза. Необходимо соблюдать сбалансированную диету, включающую пищу с высоким содержанием полиненасыщенных жирных кислот (рыбий жир, оливковое масло), фрукты, овощи.
Важное значение имеют программы обучения пациентов (изменение стереотипа двигательной активности), лечебная физкультура, направленная на укрепление мышечной системы (плавание, ходьба, езда на велосипеде). Необходимость применения физиотерапевтических методов лечения и их характер определяются ревматологом и физиотерапевтом на основании углубленной оценки больного. Ортопедические методы направлены на профилактику и коррекцию деформаций суставов и нестабильности шейного отдела позвоночника.
Санаторно-курортное лечение рекомендуют только пациентам с минимальной активностью РА или в стадии ремиссии.
Следует подчеркнуть, что немедикаментозные (в т.ч. физиотерапевтические) методы оказывают умеренный и кратковременный благоприятный эффект, а влияние их на прогрессирование заболевания не доказано.
Фармакотерапия РА
Для лечения РА в настоящее время используются БМАП, НПВП, глюкокортикоиды, обычно применяемые в различных комбинациях. Характер терапии определяется особенностями клинической картины РА, ответом на первоначально выбранный лечебный режим и наличием сопутствующей патологии.
Очевидно, необходимо информировать больного о возможных побочных эффектах препаратов, применяемых при лечении РА, перед началом проведения терапии.
Нестероидные противо-воспалительные препараты
НПВП занимают важное место в лечение РА на начальных этапах применения БМАП и при обострении заболевания. Они способны довольно быстро и эффективно устранять боль в суставах, их припухлость, а также улучшать функцию суставов, уменьшать утреннюю скованность. Эти благоприятные клинические эффекты НПВП обусловлены их анальгетическими и противовоспалительными свойствами. Однако, обладая высокой противовоспалительной и анальгетической активностью, НПВП не способны модифицировать течение заболевания и превентировать деструкцию суставов. В связи с этим они не должны использоваться в качестве самостоятельной терапии у больных с РА.
Глюкокортикоиды
В клинической практике сегодня используются исключительно синтетические Гк, обладающие выраженной противовоспалительной и иммуносупрессивной активностью при минимальных и даже нулевых минералокортикоидных эффектах.
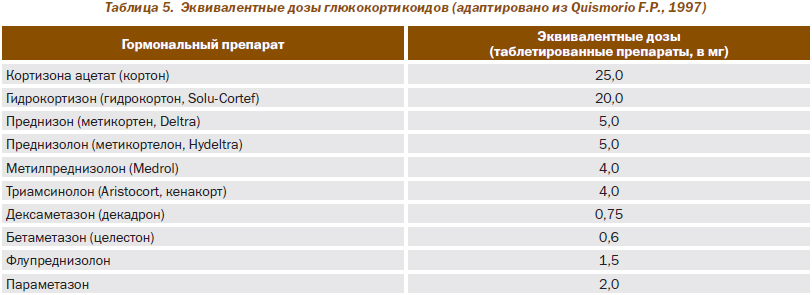
В табл. 5 представлены эквивалентные по своим противовоспалительным эффектам дозировки глюкокортикоидных препаратов.
Хорошо известные противовоспалительные и иммуномодулирующие свойства Гк обеспечивают их высокую клиническую эффективность при РА. Отсутствуют убедительные доказательства, что какой-либо из представленных в табл. 5 препаратов оказывает более специфическое действие на патологические процессы, развивающиеся при РА и других ревматических заболеваниях. Вместе с тем некоторые особенности механизма действия, времени полувыведения и метаболизма позволяют рекомендовать определенный дифференцированный подход к выбору препарата и характеру его введения. В целом среди используемых Гк наилучшей переносимостью обладает метилпреднизолон, который является препаратом выбора для больных с нестабильной психикой, артериальной гипертензией, избыточной массой тела и предрасположенностью к язвенным поражениям желудочно-кишечного тракта, что аргументирует предпочтительность его применения у больных РА и другими ревматическими заболеваниями.
Более полувека остается предметом оживленных дискуссий ряд вопросов, касающихся места Гк в лечении РА: во-первых, являются ли Гк антидеструктивными препаратами, т.е. следует ли их относить к категории БМАП; во-вторых, каковы оптимальные дозировки Гк и сроки их применения; в-третьих, оказывают ли низкие дозы Гк неблагоприятные эффекты на костную ткань, т.е. способствуют ли развитию или прогрессированию остеопороза.
Высокая частота побочных эффектов, наблюдающихся в 60–70-х годах XX века при применении высоких доз Гк (более 30 мг в сутки преднизолона), породила пессимизм о возможности и необходимости их использования при РА и явилась серьезным аргументом для прекращения дальнейшего изучения эффективности высоких доз Гк при РА.
Сегодня результаты многочисленных исследований позволяют констатировать способность низких доз Гк (преднизолон ≤ 7,5 мг/сут или эквивалентные дозировки других Гк) успешно контролировать ревматоидное воспаление, не уступая в этом отношении другим классам медикаментозных средств и обладая при этом приемлемым профилем токсичности.
Недавно опубликованные крупные контролируемые исследования, продемонстрировавшие способность низких доз Гк ингибировать деструкцию суставов у больных РА, а также оказывать благоприятный эффект на клинические проявления заболевания и увеличивать частоту наступления ремиссий, позволяют сегодня рассматривать включение низких дозировок Гк в лечебные режимы при РА как приемлемые и даже необходимые, особенно при высокой активности заболевания и наличии прогнознегативных факторов.
При лечении РА используются следующие варианты применения Гк:
— локальное — внутрисуставное и периартикулярное;
— местное (накожное) в виде мази;
— системное:
— пероральное;
— парентеральное (внутримышечное или внутривенное).
Показаниями к применению низких доз Гк при РА является необходимость:
— снизить до минимума активность заболевания, пока не начнут действовать БМАП;
— снизить активность заболевания при его обострениях или осложнениях базисной терапии;
— контролировать активность заболевания (в частности, наличие дискомфорта и/или ограничения функции суставов), сохраняющуюся, несмотря на применение адекватных дозировок НПВП и БМАП;
— способствовать достижению ремиссии у части больных РА (в комбинации с БМАП);
— использования при противопоказаниях к применению НПВП (больные с высоким риском развития НПВП-ассоциированных гастропатий) или при развитии серьезных побочных эффектов при их использовании;
— замедлить (или приостановить) скорость суставных повреждений (в комбинации с БМАП).
В современных рекомендациях по ведению больных с РА подчеркивается необходимость индивидуального подхода к назначению низких доз Гк, с оценкой при этом ожидаемого благоприятного эффекта и возможных осложнений глюкокортикоидной терапии (ГКТ), включающих остеопороз, артериальную гипертензию, задержку жидкости, увеличение массы тела, гипергликемию, катаракту, нарушение трофики кожи, преждевременное развитие атеросклероза или его прогрессирование и др.
Частота и тяжесть осложнений ГКТ существенно ниже при использовании низких дозировок. В связи с этим применение умеренных или высоких доз Гк должно быть строго лимитировано случаями РА, протекающего с жизнеопасными системными проявлениями, или особыми вариантами РА — синдромом Фелти или синдромом Стилла. При этом продолжительность использования высоких или умеренных доз Гк должна по возможности быть ограниченной. При этих вариантах течения РА в ряде клиник предпочитают начинать лечение Гк в виде пульс-терапии, т.е. в/в введения около 1,0 г метилпреднизолона, осуществляемого в течение 1,5–2 часов и повторяемого на протяжении 3 дней.
РА сам по себе ассоциируется с повышенным риском развития остеопороза независимо от ГКТ, а у больных, получающих Гк даже в низких дозах, этот риск увеличивается. В связи с этим больным, получающим длительное время Гк, должна регулярно осуществляться денситометрия для оценки потери костной ткани. Пациенты, находящиеся на ГКТ, должны получать около 1500 мг природного кальция в сутки (включая пищу и добавки) и 400–800 ME витамина D в сутки. У женщин в постменопаузе возможно проведение гормонозаместительной терапии. При планировании ГКТ и ее проведении следует рассматривать возможность применения антирезорбтивных препаратов, превентирующих потерю костной ткани.
Целью внутрисуставного и/или периартикулярного применения Гк является быстрое устранение или уменьшение воспаления в суставах и околосуставных тканях, что ведет к уменьшению болевого синдрома и улучшению суставной подвижности у больных с активным РА (как в начале заболевания, так и при его обострениях), а также в части случаев — к снижению системных проявлений РА. Локальное применение Гк характеризуется быстрым эффектом, однако кратковременным. Локальное применение Гк особенно эффективно при наличии активного воспаления в одном или нескольких суставах.
Внутрисуставное и периартикулярное применение Гк является не только эффективным, но и безопасным методом лечения, если осуществляется квалифицированными специалистами при строгом соблюдении гигиенических требований, а также показаний и противопоказаний. Абсолютными противопоказаниями для локального применения Гк являются: инфекционный процесс в суставе или околосуставных тканях; общее септическое состояние больного; наличие геморрагического синдрома; отсутствие признаков активного воспаления в суставе «сухой сустав»; невоспалительный характер боли; выраженная деформация сустава (резкое сужение суставной щели, анкилоз) или костная деструкция, а также нестабильность сустава как исход артрита; асептический некроз формирующих сустав эпифизов, выраженный околосуставной остеопороз, пресуставной перелом кости. К относительным противопоказаниям относятся: общее тяжелое состояние пациента; отсутствие или кратковременный эффект двух предыдущих введений Гк. Внутрисуставное введение Гк не следует повторять в один и тот же сустав чаще, чем один раз в три месяца. Необходимость в повторных локальных введениях Гк обычно свидетельствует о недостаточной базисной терапии и требует ее пересмотра.
Болезнь-модифицирующие антиревматические препараты:базисная терапия
БМАП могут уменьшать и/или предотвращать повреждение суставов, сохранять их функцию и структуру и в конечном итоге уменьшать финансовые затраты на лечение и обслуживание больных с РА, улучшать (поддерживать) трудоспособность пациентов. Во многих КРИ продемонстрирована высокая эффективность базисной терапии при РА, включающая хороший контроль над клиническими проявлениями заболевания, улучшение функции суставов, качества жизни и замедление или прекращение формирования эрозий.
Начало базисной терапии не должно быть отсрочено для пациентов с установленным диагнозом РА. Выбор конкретного БМАП определяется многими факторами, такими как индивидуальные особенности заболевания, предполагаемая эффективность препарата, характер побочных эффектов, особенности контроля за эффективностью и безопасностью, время наступления клинического эффекта от начала лечения, а также примерная стоимость годового применения выбранного препарата. Кроме того, необходимо оценить состояние жизненно важных органов и систем и наличие сопутствующих заболеваний. В связи со сказанным индукционная терапия РА и регулярное наблюдение должны осуществляться ревматологом. При РА в основном используют следующие синтетические БМАП: метотрексат (Мт), лефлуномид (Лн), гидроксихлорохин (Гх) и сульфасалазин (Сс). Реже применяются азатиоприн, D-пеницилламин, соли золота, миноциклин и циклоспорин.
Метотрексат
Использование Мт в ревматологической практике было начато более 50 лет назад. В настоящее время препарат рассматривается как одно из ведущих антиревматических средств, относящихся к базисным препаратам (БП). Широкое применение и достаточно высокая эффективность в лечении РА дают основания рассматривать его в качестве золотого стандарта терапии РА и использовать в качестве препарата сравнения при оценке эффективности других, более новых БП. Важными положительными характеристиками препарата являются его достаточно хорошая переносимость и относительная дешевизна. В многочисленных КРИ представлены доказательства того, что Мт уменьшает темпы прогрессирования эрозивного процесса в суставах.
В практике лечения РА Мт в режиме монотерапии или в качестве компонента комбинированного лечения обычно назначается больным с активным течением заболевания, которые еще не принимали БП. Обычно первоначальная доза Мт составляет 7,5 мг 1 раз в неделю (по 2,5 мг с интервалом в 12 ч). После достижения клинического эффекта и развития стойкой ремиссии дозу можно снизить до 5 мг в неделю. Используют и парентеральное введение Мт. При необходимости еженедельная доза препарата может быть увеличена до 10–25 мг в неделю.
Противопоказания для терапии Мт включают паренхиматозные заболевания печени, почечную недостаточность, болезни легких и злоупотребление алкоголем. Такие побочные реакции Мт, как стоматит, тошнота, диарея и, возможно, алопеция, могут уменьшаться при сочетанном применении препарата с фолиевой кислотой без снижения эффективности Мт. Наиболее широко используемые сегодня дозы фолиевой кислоты составляют 5–7 мг в неделю.
Учитывая, что наиболее частой токсической реакцией на Мт является повышение уровней печеночных энзимов, до начала терапии у больных должна быть изучена функция печени, хотя риск развития этого побочного эффекта достаточно низкий. Редкое, но серьезное токсическое поражение легких (интерстициальный пневмонит) может возникнуть в любое время, независимо от дозы Мт, т.е. не является время- и дозозависимым. Учитывая потенциальную тератогенность Мт, женщинам детородного потенциала рекомендуется обязательная контрацепция при лечении Мт.
Лефлуномид
Дериват изоксазола и ингибитор пиримидинового синтеза de novo Лн представляет относительно новый класс БМАП. Результаты КРИ, посвященных оценке его эффективности и токсического потенциала, а также сравнительной оценке эффективности Лн с такими традиционными представителями БМАП, как Мт и сульфасалазин, у больных РА позволяют с достаточным оптимизмом рассматривать Лн как перспективный патентный БМАП. Лн отличается быстрым началом действия, уменьшает клинические проявления РА и улучшает двигательную активность уже через 4 недели и не снижает своей клинической эффективности как минимум до 5,8 года. Важно отметить хорошую переносимость препарата. По некоторым данным, при длительном применении Лн частота развития таких побочных эффектов, как диарея, тошнота, алопеция, головная боль, гипертензия, зуд, гастроинтестинальная боль, может иметь тенденцию к уменьшению.
Режим приема Лн подразумевает использование нагрузочной дозы препарата по 100 мг в течение 3 дней, что обеспечивает быстрое достижение стабильного уровня его активного метаболита. Начиная с 4-го дня Лн применяется в поддерживающей дозировке, составляющей 20 мг/сут. При таком лечебном подходе клинический эффект проявляется уже через 3–4 недели от начала лечения.
В настоящее время накапливается клинический опыт комбинированного применения Лн с другими представителями БМАП (например, с сульфасалазином). Сообщается об увеличении эффективности такой комбинированной терапии. В связи с возможностью увеличения частоты и тяжести побочных эффектов при комбинации различных представителей БМАП необходимо осуществление строгого наблюдения за больным и проведение необходимых лабораторных исследований. Так, например, совместное применение Лн с Мт характеризуется усилением гепатотоксического эффекта. При этом повышение уровней печеночных ферментов наблюдается приблизительно в 60 % случаев в отличие от 5 % — при самостоятельном применении Лн.
Гидроксихлорохин
Последние 10 лет многочисленные исследования демонстрируют положительный клинический эффект Гх, особенно у пациентов с ранним РА и низкой активностью заболевания. Хотя монотерапия Гх не дает замедления рентгенографически выявляемого повреждения, включение Гх в комплекс базисной терапии улучшает прогноз РА.
Интерес представляют данные об определенном антитромботическом и гиполипидемическом потенциале антималярийных средств (в том числе Гх). Сочетание противовоспалительных свойств, синергической активности с другими противоревматическими препаратами, низкой токсичности, а также антитромботическое и гиполипидемическое действие позволяют обсуждать целесообразность включения антималярийных препаратов в комбинированную терапию, особенно у больных с повышенным риском сердечно-сосудистых осложнений и длительно получающих Гк.
Гх назначают по 100–200 мг в сутки внутрь. При длительном приеме могут развиться лейкопения, дерматит, а также ретинопатия, что требует осмотра окулистом 1 раз в 4–6 месяцев. Риск ретинопатии низкий в случае, когда доза не превышает 6 мг/кг м.т.
Сульфасалазин
В последние годы к разряду базисных средств отнесен Сс. Положительное влияние Сс на выраженность симптомов заболевания и лабораторных показателей его активности наступает чаще в течение первых 4 недель лечения, в ряде случаев — 12 недель. Представлены доказательства способности Сс замедлять прогрессирование РА, устанавливаемое по рентгенологическим параметрам поражения суставов.
Лечение начинают с дозы 0,5 г в сутки, постепенно (через каждые 5–7 дней) повышая суточную дозу до целевой, составляющей 2 г. Сс обычно хорошо переносится. Побочные эффекты включают тошноту, диспепсию, возникающие в первые несколько месяцев терапии. Возникновение этих побочных эффектов снижается при постепенном увеличении дозы препарата. Лейкопения может развиваться чаще в первые 3 месяца лечения. Периодические лабораторные исследования (анализ крови с лейкоцитарной формулой и функциональные печеночные тесты) должны проводиться каждые 2 недели на протяжении первых 3 месяцев, затем — 1 раз в месяц в течение последующих 3 месяцев; затем 1 раз в 3 месяца. Клинический ответ должен быть оценен в пределах 4 месяцев, и при неэффективности Сс показана коррекция базисной терапии.
Биологические базисные препараты (биологическая терапия)
Несмотря на определенные успехи в лечении РА, достигнутые после широкого внедрения в практику раннего назначения БМАП, у значительной части больных не удается достичь удовлетворительных результатов при использовании одного БМАП, что требует последовательной замены препаратов.
Эволюция представлений о роли клеток иммунной системы и продуцируемых ими цитокинов в патогенезе РА позволила уяснить новые точки приложения терапии, замедляющей прогрессирование заболевания. Большим достижением последних десятилетий стало создание и внедрение в практику лечения РА так называемых биологических агентов — медицинских препаратов, получаемых методами генной инженерии, мишенями для которых являются ключевые провоспалительные цитокины, их рецепторы и иммунокомпетентные клетки. Важные достоинства иммунобиологических агентов — их относительная безопасность и высокая специфичность, обеспечивающая селективность влияния на конкретные звенья иммунопатогенеза при минимальном воздействии на нормальные механизмы функционирования иммунной системы. Последнее чрезвычайно важно с точки зрения значительного снижения риска генерализованной иммуносупрессии, присущей синтетическим базисным препаратам и Гк. Наиболее широко применяемые препараты этого ряда представлены в табл. 6.
В последние годы биологическая терапия стремительно развивается, что обусловлено положительными результатами в лечении РА и ряда других ревматических заболеваний, демонстрируемыми в многочисленных КРИ. Эти агенты существенно повысили частоту развития полных клинико-лабораторных ремиссий. К сожалению, у части больных после их отмены развиваются обострения. Кроме того, необходимо уточнение их долгосрочной эффективности.
Проведение биологической терапии сопряжено с риском развития целого ряда побочных эффектов, включающих риск развития различных инфекций (в том числе герпес зостер, туберкулез); инфузионные и инъекционные реакции; реакции гиперчувствительности, риск развития лимфопролиферативных заболеваний.
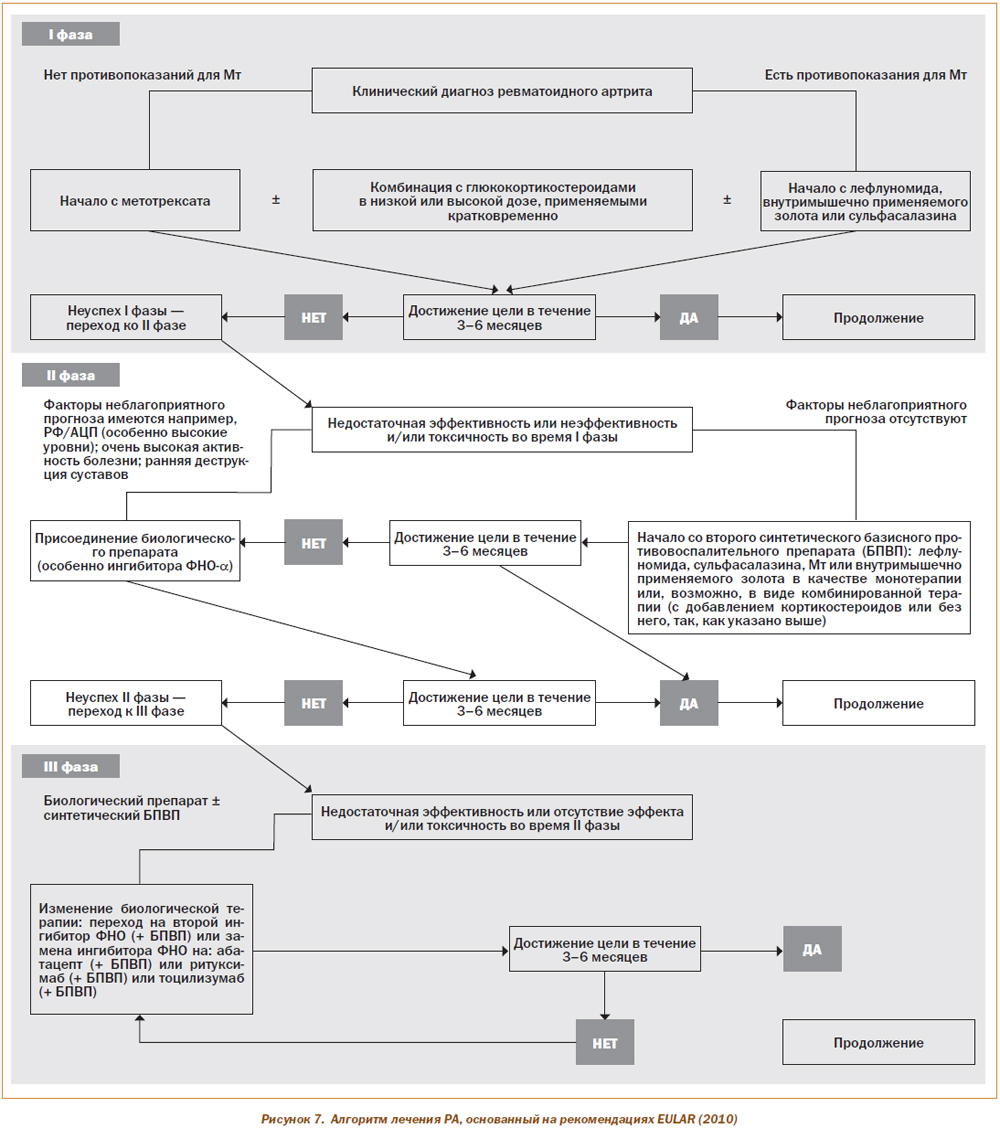
Считаем важным привести основные положения современных рекомендаций, касающихся лечения РА синтетическими и биологическими препаратами, разработанных Европейской лигой борьбы с ревматизмом в 2010 году.
Общие принципы:
А. Наблюдение и ведение пациентов с РА должны осуществлять специалисты-ревматологи.
Б. Лечение пациентов с РА должно быть направлено на выбор наилучшего варианта и основано на совместном решении ревматолога и пациента.
В. Медицинские затраты и потери от снижения работоспособности при РА значительны, что должно учитываться лечащим ревматологом при выборе тактики ведения больного.
Основные рекомендации по лечению РА
1. Лечение синтетическими БМАП должно начинаться сразу после установления диагноза РА.
2. Для каждого пациента целью лечения должно быть стремление к максимально быстрому достижению ремиссии или к существенному снижению активности заболевания. Если эта цель не достигается, лечение должно пересматриваться путем частого (каждые 1–3 месяца) и строгого мониторирования.
3. У пациентов с активным РА препаратом начального этапа лечения должен быть метотрексат.
4. Если метотрексат противопоказан (или не переносится), в качестве компонентов стартового лечения следует выбирать следующие БМАП: лефлуномид, сульфасалазин или инъекционные препараты золота.
5. У пациентов, ранее не получавших синтетических БМАП, монотерапия предпочтительнее комбинированного лечения препаратами этой группы (независимо от добавления Гк).
6. Гк, добавленные в низких или средних дозах к монотерапии синтетическими БМАП (или к их комбинации), полезны для первоначального краткосрочного лечения, но должны быть отменены так быстро, как позволяет клиническая ситуация.
7. Если цель лечения в результате применения индукционной терапии БМАП не достигнута, то при наличии факторов неблагоприятного прогноза должно рассматриваться добавление биологического препарата. При отсутствии факторов неблагоприятного прогноза* следует обсуждать переход на другой синтетический БМАП.
8. В случае недостаточной эффективности метотрексата и/или других синтетических БМАП, применяемых в комбинации с Гк или без них, рекомендуется терапия биологическими агентами. В соответствии с существующей практикой показано применение ингибиторов ФНО-a (адалимумаба, цертолизумаба, этанерцепта, голимумаба, инфликсимаба), которые должны применяться в комбинации с метотрексатом.
9. При неэффективности адалимумаба должен быть применен другой ингибитор ФНО-a (абатацепт, ритуксимаб или тоцилизумаб).
10. В случаях рефрактерного высокоактивного РА или при наличии противопоказаний к применению биологических агентов, или к указанным выше синтетическим БМАП, возможно применение следующих синтетических БМАП (в виде монотерапии или в комбинации с Гк): азатиоприн, циклоспорин А (или, как исключение, циклофосфамид).
11. Стратегии интенсивного лечения должны рассматриваться у каждого пациента, особенно при наличии факторов неблагоприятного прогноза*.
12. Если у пациента достигнута стойкая ремиссия, может рассматриваться вопрос о постепенной отмене биологических агентов (после предварительного постепенного отказа от Гк), особенно если это лечение комбинируется с синтетическим БМАП.
13. В случае длительно сохраняющейся ремиссии может рассматриваться вопрос о медленном снижении (титрование) дозы синтетического БМАП (при согласии больного).
14. У пациентов, ранее не получавших БМАП, при наличии факторов неблагоприятного прогноза* возможно применение комбинированной терапии метотрексата и биологического агента.
15. В ходе подбора терапии следует принимать во внимание не только активность болезни, но и другие факторы, например прогрессирование структурных изменений, наличие сопутствующих заболеваний и риск развития побочных эффектов.
На рис. 7 представлен алгоритм лечебной тактики у больных с РА, согласно рекомендациям EULAR (2010).

Список литературы находится в редакции