Газета «Новости медицины и фармации» Гастроэнтерология (478) 2013 (тематический номер)
Вернуться к номеру
Абдоминальные боли при органической патологии кишечника
Авторы: Дорофеев А.Э., Руденко Н.Н., Томаш О.В., Иваненко А.А., Элин А.Ф. - Донецкий национальный медицинский университет им. М. Горького, ИНВХ им. В.К. Гусака, ЦГКБ № 16 г. Донецка
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Как известно, абдоминальная боль является одним из наиболее распространенных клинических синдромов. Причем около половины всех абдоминальных болей связаны с острыми или хроническими заболеваниями кишечника. Так, при клинически значимой абдоминальной ишемии боли беспокоят практически всех пациентов, при обострении воспалительных заболеваний кишечника (ВЗК) они встречаются в 50–70 % случаев, а при раке кишечника — в 40 % (Millham F.H., 2010; Yarze J.C., Friedman L.S., 2010). В зависимости от давности возникновения/длительности боли делятся на острые (возникшие не более недели назад) и хронические, длящиеся более 6 месяцев. Промежуточное положение занимают подострые боли. Чаще всего под острой болью подразумевается интенсивная боль, возникшая более 6 часов назад, требующая срочной диагностики и лечения (обычно хирургического) (Makrauer F.L., Greenberger N.J., 2009). Практически все остро возникшие боли в кишечнике требуют исключения хирургической патологии: в первую очередь аппендицита (17–25 % всех острых болей) и острой кишечной непроходимости (15 %), значительно реже — дивертикулита (4 %) и мезентериального тромбоза (Millham F.H., 2010). Хронические боли в кишечнике в большинстве случаев вызваны функциональной патологией — СРК. Тем не менее важное место в их структуре занимают такие органические заболевания, как ВЗК, рак кишечника и хроническая абдоминальная ишемия. А с учетом того, что они угрожают жизни больного, своевременная диагностика и лечение данной патологии имеют первостепенное значение.
Несмотря на то что заболевания кишечника достаточно несхожи, патогенетические механизмы кишечной боли универсальны и в разной пропорции встречаются при различных болезнях. Чаще всего патология кишечника сопровождается висцеральными болями. Как известно, восприятие боли начинается с периферических рецепторов. В слизистой оболочке желудочнокишечного тракта нет болевых рецепторов. Боль воспринимается при стимуляции хемо и механорецепторов. Максимальное количество механорецепторов расположено в мышечной оболочке, на границе мышечной и подслизистой оболочек, в висцеральной брюшине и по ходу крупных сосудов брыжейки. Эти рецепторы воспринимают напряжение/растяжение, что наблюдается при кишечной непроходимости, спастических сокращениях гладкой мускулатуры (коликах), а также при натяжении брыжейки и проходящих в ней сосудов (опухоли или заворот кишечника). Хеморецепторы в основном локализованы в слизистой и подслизистой оболочках кишки. Их естественными стимуляторами являются ионы калия и водорода, гистамин, брадикинин, серотонин, субстанция Р, лейкотриены и простагландины, выделяющиеся при воспалении, некрозе, ишемии, механическом, термическом и радиационном поражениях. Терминальные разветвления афферентных нейронов энтеральной нервной системы локализуются в подслизистом (мейсснеровском) и межмышечном (ауэрбаховом) нервных сплетениях кишечника, а также в брыжейке и висцеральной брюшине. Далее болевые импульсы распространяются по симпатическим немиелинизированным афферентным волокнам Стипа через ганглии и спинной мозг в центральную нервную систему (гипоталамус и кору). Активация эфферентных парасимпатических нервов этих же сплетений приводит к изменению кишечной моторики и секреции, что также может сопровождаться болью. Следует отметить, что благодаря нервным сплетениям иннервация кишечника носит мультисегментарный характер. Поэтому висцеральные боли не имеют строгой локализации, распространяясь по обе стороны от средней линии, а также выше и ниже места поражения. Боли описываются пациентами как жгучие, «грызущие», схваткообразные. Достаточно характерны и такие эффекты вторичной вегетативной стимуляции, как тошнота, рвота, потливость, бледность кожи. Часто пациенты беспокойны, вынуждены менять положение тела в попытке облегчить боль. Соматические боли развиваются изза раздражения болевых рецепторов париетальной брюшины, что при патологии кишечника наблюдается при присоединении перитонита. Они характерны для острых хирургических заболеваний или осложненном течении хронических. По своему характеру такая боль острая, хорошо локализованная, сопровождающаяся напряжением мышц передней брюшной стенки и симптомами раздражения брюшины.
Следует отметить, что ряд заболеваний кишечника сопровождаются гиперчувствительностью нервных окончаний. При этом стимулы, в обычном состоянии не воспринимающиеся человеком, начинают ощущаться как боль. Дело в том, что, помимо «активных» ноцицепторов, в кишечнике присутствуют так называемые механически нечувствительные афференты (mechanically insensitive afferents), которые активируются под влиянием различных факторов. Каковы же механизмы висцеральной гиперчувствительности? В первую очередь это воспаление, как инфекционное, так и иммунное. При любом воспалении начинают активно выделяться лейкотриены, интерлейкины, простагландины, биогенные амины, раздражающие хеморецепторы кишечника. Кроме того, происходит стимуляция синтеза ноцицептивспецифических мембранных протеинов transient receptor potential vanilloid 1 (TRPV1) и transient receptor potential channel, subfamily A, member 1 (TRPA1) вследствие повышения экспрессии соответствующих генов и выработки факторов роста нейронов и глиальных клеток (nerve growth factor (NGF) и glial cell linederived neurotrophic factor (GDNF)) (Malin S. et al., 2011). Воспаление вызывает висцеральную гиперчувствительность также путем активации глиальных клеток цитокинами и интерлейкином1 с последующим увеличением ими синтеза простагландина E2 (ПгE2). В свою очередь, ПгE2 увеличивает чувствительность нейронов ауэрбахова сплетения к брадикинину, в большом количестве выделяющемуся при воспалении (Srinath A.I. et al., 2012). Важное значение в висцеральной гиперчувствительности отводится тучным клеткам и повреждению нейронов оксидом азота, синтез которого увеличивается в очаге воспаления (van Hoboken E.A. et al., 2011; Srinath A.I. et al., 2012). Еще одним выделяющимся при воспалении веществом является серотонин (5HT). Он служит медиатором передачи импульсов от кишечника к ЦНС и способствует их восприятию в виде боли. Другим фактором с доказанной ролью в развитии гиперчувствительности является кортикотропинрилизингфактор (CRF), выделяющийся гипоталамусом при любом стрессе. Его действие на кишечник достаточно многообразно. Помимо увеличения гиперчувствительности рецепторов, он способствует повышению кишечной проницаемости и моторики, что тоже может приводить к развитию боли (Kanazawa M. et al., 2011). При любом воспалении в слизистой оболочке кишечника наблюдаются утрата барьерных функций и повышение проницаемости кишечной стенки. Объясняться это может снижением активности глутаматсинтетазы в очаге воспаления, что приводит к понижению резистентности слизистой с последующим повреждением энтеро и колоцитов. Попадание микробных токсинов и метаболитов под слизистую приводит к постоянному раздражению висцеральных сплетений с развитием их гиперсенсизации, причем не только висцеральной, но и соматической (Zhou Q., Verne G.N., 2011). Интересно отметить, что соматическая боль развивается при термальном, а не механическом раздражении кожи, и только нижней части тела (Zhou Q., Verne G.N., 2011). Объясняется это взаимосвязью висцеральных и соматических путей на уровне задних рогов спинного мозга с развитием спинномозговой гиперсенситизации.
Восприятие любой боли во многом зависит от состояния центральной нервной системы. Кишечная боль не является исключением. Установлено, что у пациентов с кишечной болью (как функциональной, так и органической) достоверно чаще встречаются депрессия, тревожные состояния, а также другие психосоматические заболевания. Важное значение в появлении такой боли имеют воспитание в семье и модель поведения родителей. У однояйцевых близнецов, воспитанных в разных семьях, боли в кишечнике развивались только там, где у родителей были аналогичные боли. Не менее значимыми являются психотравмирующие ситуации, перенесенные как в детстве, так и во взрослом возрасте. У пациентов с болями в кишечнике ухудшение чаще отмечается именно после стрессовых ситуаций (Tanaka Y. et al., 2011). А стресс может приводить к снижению активности нисходящей импульсации (diffuse noxious inhibitory control), которая в норме ингибирует боль.
Определенную роль в возникновении боли в кишечнике может играть увеличение количества микроорганизмов в его просвете — синдром избыточного бактериального роста (СИБР). К развитию этого синдрома ведет множество причин. В первую очередь — уменьшение барьерной функции верхних отделов ЖКТ, отмечающееся при снижении желудочной секреции (атрофический гастрит или прием ингибиторов протонной помпы), уменьшении концентрации желчных кислот (холестаз, тяжелое паренхиматозное поражение печени) и панкреатических ферментов (внешнесекреторная панкреатическая недостаточность при хроническом панкреатите). Важное значение в развитии этого синдрома имеет нарушение кишечного клиренса, что может быть связано с замедлением кишечной моторики, врожденным или приобретенным угнетением иммунитета, активацией патогенной флоры на фоне приема антибактериальных препаратов. Возможна транслокация избыточной флоры из нижних отделов кишечника в верхние при недостаточности илеоцекального клапана, воспалении/резекции терминального отдела подвздошной кишки, развитии межпетельных свищей (что очень характерно для болезни Крона). СИБР может вызывать боли за счет нарушения переваривания пищи с накоплением в просвете кишечника газов и его растяжением. Помимо газов микроогранизмы продуцируют большое количество биологически активных веществ, влияющих на кишечную проницаемость, моторику, восприятие боли, а также вызывающих микровоспаление (Bures J. et al., 2010). Согласно обзору, опубликованному Римским фондом в 2013 году, изменение кишечной микрофлоры, воздействуя на локальный иммунитет, вызывает воспаление, увеличение кишечной проницаемости, гиперальгезию и дисбаланс энтеральной нервной системы (Simrén M. et al., 2013).
Традиционно нарушение кишечной моторики рассматривается как важный фактор развития абдоминальной боли. Ведущую роль в регуляции гладкомышечного сокращения играет уровень кальция. Вход ионов Na+ в клетку вызывает деполяризацию и открытие потенциалзависимых кальциевых каналов, что приводит к увеличению концентрации ионов Са2+ в клетке. Формирование комплекса Са с кальмодулином вызывает активацию легких цепей миозина и способствует сокращению гладкой мускулатуры. Однако изменение чувствительности сократительного аппарата к Са и активация хемоуправляемых Саканалов также могут приводить к развитию мышечного сокращения. Как известно, моторика кишечника регулируется на нескольких уровнях. К первому относится энтеральная нервная система, представленная подслизистым (мейсснеровским) и межмышечным (ауэрбаховым) нервными сплетениями. Второй уровень — спинальный, третий — таламический. Симпатическая адренергическая иннервация кишечника преимущественно спинальная. Она оказывает релаксирующее влияние на перистальтику, в то же время увеличивая тонус сфинктеров. Парасимпатическая холинергическая иннервация — церебральная и может оказывать как стимулирующее, так и ингибирующее воздействие на перистальтику. Помимо традиционных медиаторов (ацетилхолин и адреналин), важное значение в регулировке моторики имеет серотонин. 5HT в энтеральных нервных сплетениях стимулирует возбуждающие моторные нейроны с выделением ацетилхолина и субстанции Р, что активирует перистальтику. В то же время стимуляция им ингибирующих моторных холинергических нейронов приводит к выделению оксида азота, ВИП, АТФ, NAD с релаксацией мускулатуры. Благодаря последовательному сокращениюрасслаблению гладкой мускулатуры и происходит кишечная перистальтика. В патологических условиях изменение кишечной моторики стимулирует механорецепторы с развитием боли. Например, при стрессе перистальтика стимулируется за счет выработки в гипоталамусе CRF с последующей активацией парасимпатического пути. Помимо изменения иннервации, на кишечную моторику оказывает воздействие и воспаление. Например, выделение таких провоспалительных интерлейкинов, как IL4 и IL13, приводит к повышению кишечного тонуса и развитию спастических болей.
Рассмотрим особенности диагностики и лечения боли в кишечнике в зависимости от заболевания. Как уже подчеркивалось выше, большинство острых болей в животе обусловлены патологией, требующей наблюдения и лечения у хирурга, поэтому в данном разделе мы коротко коснемся вопросов своевременной диагностики этих заболеваний.
Хорошо известны классические симптомы острого аппендицита. Прежде всего это острые боли, вначале возникающие в околопупочной области, а затем перемещающиеся в правую подвздошную. Обычно боли сопровождаются тошнотой и рвотой. Чаще всего отмечается раздражение брюшины (симптом Блюмберга). При отсутствии адекватной помощи быстро нарастает ухудшение общего состояния. К сожалению, такая симптоматика наблюдается только у 30–60 % больных. Атипичное течение аппендицита наиболее характерно для пожилых пациентов и беременных. У молодых женщин до 20 % аппендэктомий оказываются необоснованными (чаще при наличии в анамнезе СРК). Поэтому возникновение острой боли в животе требует обязательного осмотра хирургом и исключения угрожающей жизни больного патологии. При подозрении на острый аппендицит для уточнения диагноза всем больным рекомендуется проводить сонографическое исследование или компьютерную томографию (в зависимости от оснащенности лечебного заведения и опыта врачей в интерпретации полученных данных). В настоящее время достаточно широко дискутируется тактика ведения неосложненного аппендицита. Все больше данных о целесообразности консервативного лечения этих больных. Так, по данным ряда метаанализов, применение антибиотиков оказывается достаточным у 60 % пациентов (Mason R.J. et al., 2012; Varadhan K.K. et al., 2012). Осложненный аппендицит лечится только оперативно.
Клиника острого дивертикулита напоминает аппендицит и более чем у 50 % больных сопровождается классической триадой симптомов: абдоминальной болью, лихорадкой и лейкоцитозом. Боли обычно локализуются в гипогастрии: у европейцев чаще слева, а у азиатов — справа. Достаточно характерны тошнота и рвота. У части пациентов изменяется характер стула — запор либо диарея. При распространении воспаления на стенку мочевого пузыря может появиться дизурия. Дивертикулит чаще развивается у пожилых людей, страдающих длительными запорами (Longstreth G.F. et al., 2012). Дифдиагностика острого дивертикулита достаточно сложна. При правосторонней локализации у большинства пациентов, даже в странах Азии, выставляется предварительный диагноз острого аппендицита. Для уточнения диагноза целесообразно делать КТ или УЗИ. Как и при неосложненном аппендиците, больным с дивертикулитом показано назначение антибиотиков широкого спектра, хотя четких доказательств их эффективности в РКИ не получено. Осложненное течение предусматривает госпитализацию в хирургическое отделение и оперативное лечение (Fox J.M., Stollman N.H., 2010; Andersen J.C. et al., 2012).
Ведущим симптомом острой кишечной непроходимости являются схваткообразные боли в мезогастрии, сопровождающиеся рвотой, вздутием живота и остро возникшим запором. При проксимальной обструкции боли чаще всего локализуются в околопупочной области, повторяются каждые 3–5 минут, сопровождаются обильной рвотой и умеренным вздутием живота. Следует помнить, что при этом варианте достаточно долго может наблюдаться отхождение кала и газов из дистальных отделов кишечника. При дистальном варианте обструкции боли возникают через большие промежутки времени, рвота не столь обильна, зато выражено вздутие живота. Изза размножения кишечной микрофлоры рвота обычно имеет фекальный запах. При странгуляционной кишечной непроходимости боли обычно более локализованы и носят постоянный характер. В случае частичной непроходимости боли менее выражены, сохраняется отхождение газов и кала. При объективном исследовании обращает на себя внимание значительное вздутие живота без симптомов раздражения брюшины. На ранних этапах аускультативно выслушиваются громкие кишечные шумы и урчание, особенно в моменты гиперперистальтики, что сопровождается усилением боли. Больным с подозрением на кишечную непроходимость необходимо сделать обзорную рентгенограмму живота, на которой видны характерные чаши Клойбера. Больные с кишечной непроходимостью подлежат срочной госпитализации в хирургическое отделение.
Острая абдоминальная ишемия проявляется интенсивными разлитыми болями в животе, при этом отсутствует напряжение мышц передней брюшной стенки. Боли, как и при большинстве других острых заболеваний брюшной полости, могут сопровождаться тошнотой, рвотой и гипотензией. Подобные боли, длящиеся дольше 2 часов, у пациентов с факторами риска ишемии требуют исключения данной патологии. К факторам риска относятся: возраст старше 50 лет, выраженная хроническая сердечная недостаточность, фибрилляция/трепетание предсердий, свежий инфаркт миокарда, гиповолемия, шок, сепсис, артериальные и венозные эмболии в анамнезе, васкулит, состояние гиперкоагуляции. Следует помнить, что отсутствуют какиелибо специфические симптомы острой абдоминальной ишемии. Поэтому у всех пациентов с интенсивной болью и факторами риска целесообразно проводить сонографию с допплеровским исследованием магистральных артерий живота. При осложнении ишемии кишечной непроходимостью обычно возникает значительное вздутие, затрудняющее трансабдоминальную сонографию. В таком случае рекомендуется проведение МРТ в сосудистом режиме или ангиографии. Лечение острой абдоминальной ишемии проводится в сосудистом отделении и, при отсутствии признаков перитонита, начинается с тромболизиса либо оперативного восстановления кровотока (Dewitte A. et al., 2011).
После установления диагноза все пациенты с острыми болями в животе, не нуждающиеся в оперативном лечении, должны быть адекватно обезболены. В данной ситуации предпочтение отдается опиоидам и современным НПВП.
После исключения острых хирургических заболеваний дальнейшая дифдиагностика проводится с острыми инфекциями. Следует помнить, что заболевания, приводящие к развитию хронических болей в животе, могут начинаться с острых болей. У трети пациентов причины острых болей в животе даже после тщательного обследования остаются неясными.
Среди органических заболеваний кишечника, приводящих к возникновению болей, на первом месте стоят воспалительные заболевания кишечника (ВЗК). К ним относятся неспецифический язвенный колит (НЯК) и болезнь Крона (БК). Этиология и патогенез ВЗК сложны и до конца не ясны. Повидимому, ВЗК являются полиэтиологическими заболеваниями, в возникновении которых значительную роль играет наследственная предрасположенность. Воспалительная природа заболевания подтолкнула ученых к мысли об инфекционной этиологии ВЗК, однако поиски специфического возбудителя ВЗК — вируса или бактерии — оказались безрезультатными. Вероятно, большее значение имеет состав собственной кишечной микрофлоры, ее влияние на формирование кишечной иммунной системы, а также взаимодействие с пищевыми продуктами. В связи с ухудшением экологической ситуации правомочна теория о роли неблагоприятных факторов окружающей среды в этиологии ВЗК. Увеличение поступления в организм аллергенов и токсинов приводит к дисбалансу цитокиновой регуляции, формированию выраженных иммунологических нарушений и аутоагрессии. Таким образом, ВЗК развиваются при сочетании генетической предрасположенности, неблагоприятного воздействия окружающей среды, изменения кишечной микрофлоры и нарушения иммунного ответа организма на указанные изменения.
Боли при ВЗК носят мультифакторный характер. Ведущее значение в их возникновении имеет воспаление. Как уже упоминалось выше, у 50–70 % этих пациентов при обострении заболевания отмечаются боли (Srinath A.I. et al., 2012). Так, при выраженной активности воспалительного процесса наблюдается вовлечение париетальной брюшины с развитием типичной соматической боли, передающейся по ноцицептивным афферентным путям. Однако и при малоактивном воспалении больные продолжают испытывать боли. В данной ситуации они носят висцеральный характер и обусловлены гиперчувствительностью афферентных нервных волокон. Как и при других видах воспаления, повышается экспрессия генов с увеличением выработки NGF и GDNF, а также стимуляция синтеза TRPV1 и TRPA1 (Malin S. et al., 2011). У пациентов с ВЗК отмечается достоверная гипертрофия и гиперплазия глиальных клеток, причем при болезни Крона эти изменения более значимы, чем при неспецифическом язвенном колите. Воспалительный каскад выделения интерлейкинов, простагландинов, оксида азота и биогенных аминов повышает чувствительность хеморецепторов кишечника. Одним из источников этих веществ являются тучные клетки. Имеется достаточно тесная корреляция между количеством/степенью дегрануляции тучных клеток, тесно прилежащих к нервным окончаниям, и ректальной гиперчувствительностью при НЯК. Причем эта взаимосвязь сохраняется и в стадии ремиссии заболевания (van Hoboken E.A. et al., 2011).
Возникающее при воспалении увеличение количества и активация пептидергических чувствительных нейронов стимулируют выделение различных медиаторов, вызывающих вазодилатацию и отек, а также воздействующих на моторику и секрецию. Это, в свою очередь, может приводить к возникновению боли (Srinath A.I. et al., 2012). Однако даже в стадии ремиссии, т.е. при отсутствии значимого воспаления, у 20–50 % лиц с ВЗК сохраняется абдоминальная боль (Siegel C.A., MacDermott R.P., 2009). Одной из причин таких болей может быть нарушение кишечной моторики, обусловленное формированием стенозов, что более характерно для БК. Основное значение в восприятии данного типа боли имеют механорецепторы, воспринимающие растяжение стенки кишки (Srinath A.I. et al., 2012). Достаточно часто (более 25 % при БК) при ВЗК развивается синдром избыточного роста микрофлоры в тонкой кишке, чему способствуют развитие стенозов и оперативные вмешательства на кишечнике (Klaus J. et al., 2009). При этом синдроме также происходит растяжение кишечной стенки с активацией соответствующих рецепторов и возникновением болей.
Важное значение в восприятии боли отводится центральным механизмам. Одним из таких факторов является депрессия. При ВЗК от 16 до 44 % пациентов отмечают ее присутствие. Около 30 % больных с депрессией предпринимали суицид, причем только 40 % из них адекватно лечатся, принимая антидепрессанты (FullerThomson E., Sulman J., 2006; Graff L.A. et al., 2009). Следует отметить, что у пациентов с депрессией боли значительно более выражены и сохраняются в периоде ремиссии ВЗК. Повышенная тревожность является еще одним фактором, усиливающим боли при ВЗК. Как и у пациентов с депрессией, при чрезмерной тревожности и преобладании панических мыслей снижается порог восприятия боли (Srinath A.I. et al., 2012). К снижению центрального порога восприятия приводит насилие в семье (особенно перенесенное в детском возрасте), а также повторяющиеся стрессовые ситуации. Достаточно важен и фактор наследственности. Известно несколько генов, определяющих формирование различных рецепторов, воспринимающих боль (5HTTLPR, TRPV1), хотя их значение в генезе болевого синдрома при ВЗК в клинике не изучено.
Как уже упоминалось выше, даже в период ремиссии у больных с ВЗК сохраняются боли. По своему характеру они напоминают боли при СРК. Так, при БК критерии СРК встречаются у 60 % больных, а при НЯК — у 39 % (Keohane J. et al., 2010). Такая симптоматика объясняется общими механизмами возникновения боли при этих заболеваниях. В первую очередь — микровоспаление, периферическая и центральная гиперчувствительность, нарушение моторики, СИБР. Поэтому для лечения боли при ВЗК с минимальной активностью или в стадии ремиссии применяются те же группы препаратов, что и при СРК (Srinath A.I. et al., 2012).
Лечение боли при ВЗК в первую очередь направлено на подавление воспаления. Тактика ведения больного с НЯК зависит от локализации, распространенности и активности воспаления. В большинстве случаев лечение начинается с препаратов 5аминосалициловой кислоты (5АСА), чаще — месалазина. Его применяют как системно в виде таблеток или саше, так и локально в виде клизмы или свечей. Одним из доступных месалазинов, выпускаемых в виде кишечнорастворимых таблеток, является месакол. При отсутствии эффекта от 5АСА и/или тяжелом, распространенном процессе к лечению добавляют топические (будесонид) или системные глюкокортикоиды. Тяжелое обострение НЯК требует стационарного лечения с использованием системных глюкокортикоидов, цитостатиков (циклоспорин, такролимус) или биологических препаратов — антител против фактора некроза опухоли альфа (аntiTNF — инфликсимаб). Отсутствие эффекта от консервативного лечения с сохранением высокой активности и/или развитие серьезных осложнений является показанием к тотальной колэктомии (Dignass A. et al., 2012). Лечение БК также зависит от активности процесса и распространенности заболевания. При изолированном поражении толстой кишки и умеренной активности возможно использование препаратов 5АСА, а при более высокой активности — глюкокортикоидов и цитостатиков. При тонко/толстокишечном поражении лечение обычно начинают с назначения: топических глюкокортикоидов (будесонид) при умеренной/средней активности, а при высокой активности — системных глюкокортикоидов и цитостатиков (азатиоприн, 6меркаптопурин). При отсутствии эффекта используют биологические препараты (аntiTNF) (Dignass A. et al., 2010).
К сожалению, даже полное устранение воспаления, т.е. достижение ремиссии заболевания, приводит к устранению только одного механизма формирования боли. Так как у большинства пациентов имеются моторные нарушения, препаратами выбора являются спазмолитики. По своему механизму действия они делятся на антихолинергические препараты и непосредственные релаксанты гладкой мускулатуры. Подобный же эффект на гладкую мускулатуру кишечника оказывает масло перечной мяты, вызывающее расслабление мышц за счет блокады кальциевых каналов. Для лечения ВЗК нецелесообразно применять классические холиноблокаторы (белладонну и атропин), так как они дают множество побочных эффектов. Имеются работы, свидетельствующие об умеренной эффективности более селективных холинолитиков — пирензепина и скополамина, хотя и они не вполне безопасны (Adeyemo M., Chang L., 2008; Ruepert L. et al., 2011; Ford A.C., Talley N.J., 2012). По мнению S. Evangelista (2004), их целесообразнее применять при коликах, а не для систематического лечения. Обычно используются третичные амины (тримебутин и мебеверин) и четвертичный амин — отилония бромид. Чаще всего применяется именно последний препарат. В нашей стране отилония бромид представлен препаратом спазмомен. По данным нашей клиники, он достаточно хорошо устраняет кишечные боли как при активной стадии ВЗК, так и у больных без активного воспаления (Дорофеев А.Э., 2011). Особенно эффективны спазмолитики у больных ВЗК при отсутствии/минимальной воспалительной активности и умеренной/легкой боли (Makharia G.K., 2011). Следует помнить, что боли при ВЗК (особенно БК) могут быть связаны с механическим препятствием вследствие развития стенозов. В такой ситуации для облегчения боли рекомендовано соблюдение малошлаковой диеты и назначение спазмолитиков. Клинически значимые стенозы кишечника целесообразно лечить эндоскопически (баллонная дилатация) или оперативно (Srinath A.I. et al., 2012).
В случае развития СИБР применяются пробиотики и невсасывающиеся антибиотики. Механизмы действия пробиотиков достаточно разнообразны. Они уменьшают висцеральную гиперчувствительность, нормализуют кишечную моторику, иммунную систему, состав кишечной микрофлоры, уменьшают избыточную проницаемость слизистой. Следует отметить, что конкретные механизмы действия зависят от штамма, входящего в пробиотик. Препарат пробиотика должен содержать достаточное количество микроорганизмов, которые в живом виде способны достигать полости кишечника, преодолевая агрессивные желудочный и желчный барьеры (Simrén M. et al., 2013). Как уже упоминалось ранее, в период ремиссии ВЗК механизмы развития болей аналогичны таковым при СРК. Поэтому при назначении таким пациентам пробиотиков опираются на исследования, проведенные у больных СРК. Так, в метаанализе 19 РКИ (1650 больных) оценивались разные штаммы микроорганизмов Lactobacillus, Bifidobacterium, Streptococcus и препараты на основе их комбинаций. Во всех исследованиях под действием пробиотиков отмечалось достоверное уменьшение абдоминальной боли (в среднем на 60 %) и вздутия живота. Также подчеркивается высокая, сопоставимая с плацебо безопасность пробиотиков. Ни в одном из исследований не регистрировались существенные побочные эффекты, связанные с их приемом (Moayyedi P. et al., 2010). Оценивать эффективность пробиотиков рекомендуется не ранее чем после месяца применения (Simrén M. et al., 2013). Лучшую доказательную базу при СРК имеют пробиотики на основе штаммов Bifidobacterium bifidum, Bifidobacterium lactis и Bifidobacterium infantis. Поэтому они и их смеси рекомендованы экспертами Римского фонда для лечения таких пациентов (Simrén M. et al., 2013). Уровень доказательности эффективности пробиотиков выше при НЯК, чем при БК (Whelan K., Quigley E.M., 2013). В РКИ доказана роль комбинированного пробиотика VSL#3 и пробиотика на основе E.coli Nissle у больных с активным и неактивным НЯК (Jonkers D. et al., 2012). В нашей стране препарат на основе E.coli Nissle представлен под названием мутафлор. Роль антибиотиков в лечении боли при ВЗК в настоящее время недостаточно изучена. Имеются единичные исследования, показавшие эффективность различных антибиотиков (в первую очередь метронидазола, ципрофлоксацина и рифаксимина) в достижении ремиссии и уменьшении боли при БК. При НЯК антибиотики менее эффективны (Wang S.L. et al., 2012). С учетом потенциального развития антибиотикорезистентности широкое использование антибиотиков для лечения боли при ВЗК пока считается нецелесообразным. Применение невсасывающихся антибиотиков может рассматриваться у отдельных пациентов с БК при наличии боли, резистентной к обычной терапии.
С учетом доказанной роли центральной и периферической нейрональной гиперчувствительности для лечения боли при ВЗК широко применяются психотропные препараты. По сравнению с другими, более безопасными группами препаратов, они относительно часто дают побочные эффекты, в том числе и серьезные. Поэтому при их назначении приходится взвешивать пользу и риск для каждого конкретного больного. Обычно таким пациентам назначают антидепрессанты. Трициклические антидепрессанты оказывают эффект путем повышения порога болевой чувствительности, улучшения настроения и сна, а также торможения кишечной моторики за счет антихолинергического действия, что особенно полезно у больных с диареей. Однако следует учитывать их проаритмогенное действие, связанное с удлинением интервала QT. Селективные ингибиторы обратного захвата серотонина оказывают антидепрессивный эффект за счет повышения концентрации серотонина в пресинаптических нервных окончаниях ЦНС. Благодаря этому улучшается настроение и уменьшается тревожность. Хотя их основной терапевтический эффект реализуется путем воздействия на серотонинергические волокна в энтеральных нервных сплетениях. Благодаря этому они нормализуют кишечную моторику и уменьшают восприятие боли. При ВЗК антидепрессанты не только облегчают симптомы (в том числе и боли), но и увеличивают продолжительность ремиссии. Трициклические антидепрессанты чаще дают побочные эффекты, поэтому используются редко. К тому же высказываются сомнения в их клинической эффективности у больных с ВЗК (MikockaWalus A. et al., 2009). Поэтому в основном применяются ингибиторы обратного захвата серотонина. Из этой группы препаратов при ВЗК исследовался сертралин, показавший достоверное уменьшение болей. Одним из сертралинов, зарегистрированных в нашей стране, является серлифт. Для лечения кишечных болей антидепрессанты рекомендованы в качестве препаратов второй линии (уровень доказательности А). Их дозировка подбирается индивидуально и должна быть ниже, чем при лечении депрессии (Andresen V. et al., 2011). Помимо депрессии, у части пациентов с ВЗК отмечаются тревожные расстройства, для коррекции которых показано назначение анксиолитиков. Для уменьшения выраженности болевых восприятий возможно использование такого нового для нашей страны препарата, как гамалате В6. Основным действующим веществом этого препарата является такой нейромедиатор, как ГАМК, в сочетании с ионами магния, брома и глутаминовой кислотой. Благодаря увеличению концентрации ГАМК в рецепторах ЦНС препарат оказывает анксиолитический эффект без выраженной седации.
При упорном характере болей, особенно связанных с центральной и нейрональной воспалительной и поствоспалительной гиперчувствительностью, рекомендуется применять антиконвульсанты. Механизм их действия основан на блокаде вольтажзависимых кальциевых каналов, которые расположены на нейронах ЦНС и кишечных сплетений, ответственных за восприятие боли. Причем максимальный эффект они оказывают при гиперчувствительности нейронов, в то время как в нормальных условиях их действие минимально. Доказано их тормозящее влияние при болях различного генеза, как висцеральных, так и соматических. Боли, вызванные выделением субстанции Р, достаточно эффективно купируются габапентином, что имеет важное значение при лечении воспалительных болей. У больных с ВЗК габапентин уменьшает выраженность висцеральной гиперчувствительности. Следует отметить, что у здоровых добровольцев такого эффекта не наблюдалось (Gale J.D., Houghton L.A., 2011). Подчеркивается высокая безопасность этой группы препаратов и редкость развития побочных эффектов (Srinath A.I. et al., 2012). Антиконвульсанты вместе с антидепрессантами являются препаратами выбора в облегчении кишечных болей, резистентных к обычному лечению (Streitberger K. et al., 2011).
Для лечения боли при ВЗК изза потенциальной возможности спровоцировать обострение процесса не следует назначать НПВП. Также не оправдались большие надежды, возлагавшиеся на селективные СОХ2ингибиторы. Хотя в клинических условиях они не столь часто, как НПВП, вызывали обострение ВЗК (7–20 %), их противовоспалительный и обезболивающий эффекты оказались недостоверными (Srinath A.I. et al., 2012). Применение опиатов при ВЗК ограничивается купированием острой боли в пред и послеоперационный период. Систематическое их применение достаточно часто осложняется развитием кишечной непроходимости и токсической дилатации толстой кишки.
НЯК — хроническое негранулематозное воспалительное поражение слизистой оболочки прямой кишки, часто распространяющееся и на другие отделы толстой кишки, характеризующееся рецидивирующим течением. НЯК достаточно часто встречается в странах Европы и Северной Америки, где его распространенность составляет 21–243 на 100 тыс. населения. Распространенность этой патологии в Украине составляет ориентировочно 12–40 на 100 тыс. населения.
В 2005 году была предложена Монреальская классификация НЯК, учитывающая его распространенность (Е1 — язвенный проктит; Е2 — левосторонний НЯК; Е3 — панколит), возраст начала заболевания (A1 — до 16 лет; A2 — 16–40 лет; A3 — старше 40 лет) и тяжесть течения (S0 — ремиссия: симптомы отсутствуют; S1 — легкий НЯК: частота дефекаций менее 5 раз в сутки при отсутствии системных проявлений и маркеров воспаления; S2 — НЯК средней тяжести: дефекация 5 раз в сутки и более, системные проявления минимальны; S3 — тяжелый НЯК: кровянистый стул 6 раз в сутки и более, ЧСС более 90 ударов в минуту, температура выше 37,5 °C, гемоглобин ниже 105 г/л, СОЭ выше 30 мм/ч) (Dignass A. et al., 2012).
Клинические проявления НЯК в первую очередь зависят от распространенности и активности воспалительного процесса. Чаще всего отмечаются частый неоформленный стул с примесью крови (до 90 % больных), ректальные кровотечения, тенезмы и схваткообразные боли, облегчающиеся после дефекации. В отличие от функциональных заболеваний кишечника при НЯК диарея отмечается и в ночное время. Из системных проявлений при тяжелом течении заболевания отмечаются недомогание, анорексия и лихорадка. К достаточно часто встречающимся внекишечным проявлениям относятся поражения кожи, суставов, печени и желчевыводящих путей, глаз, сердечнососудистой и нервной систем. Как видно из перечисленного, симптоматика НЯК неспецифична, поэтому на начальных этапах диагностики в первую очередь требуется исключение кишечных инфекций и инфекций, передающихся половым путем (при незащищенном анальном сексе). Для этого крайне важно правильно собрать анамнез и жалобы, а также обязательно произвести бактериологическое исследование кала. В связи с отсутствием специфических диагностических признаков окончательный диагноз НЯК выставляется только после эндоскопического и морфологического исследования.
Неспецифический язвенный колит может протекать с осложнениями (наиболее частое — кровотечение), лечение которых может потребовать хирургического вмешательства. Перфорация и токсическая дилатация толстой кишки относятся к показаниям для экстренного хирургического вмешательства. На фоне НЯК у больных могут развиваться карциномы толстой кишки — через 10 лет у 1,6 % пациентов, а через 30 — у 18,4 %. К факторам риска возникновения карциномы относятся длительность течения НЯК более 10 лет, распространенное поражение толстой кишки, частые обострения, выявление дисплазий.
Лечение НЯК требует воздействия на воспалительный процесс и зависит от локализации, распространенности и активности воспаления. В большинстве случаев лечение начинается с препаратов 5АСА (чаще месалазина). Его применяют как системно в виде таблеток или саше, так и локально в виде клизмы или свечей. При отсутствии эффекта от 5АСА и/или тяжелом, распространенном процессе к лечению добавляют топические (будесонид) или системные глюкокортикоиды. Тяжелое обострение НЯК требует стационарного лечения с использованием системных глюкокортикоидов, цитостатиков (циклоспорин, такролимус) или биологических препаратов — антител против фактора некроза опухоли альфа (AntiTNF) (инфликсимаб). Отсутствие эффекта от консервативного лечения и сохранение высокой активности являются показанием к тотальной колэктомии (Dignass A. et al., 2012).
Болезнь Крона — значительно реже встречающееся ВЗК. В Украине ее распространенность составляет 8–10 случаев на 100 тыс. населения. Отличительными чертами БК являются гранулематозное поражение преимущественно подслизистого слоя любого отдела ЖКТ, сегментарное поражение и формирование стенозов и свищей. Как правило, при этом поражается тонкая кишка (чаще — подвздошная) — до 80 %. Через 10 лет от начала заболевания в 75 % случаев имеется поражение и толстой кишки. Однако вовлечение в патологический процесс ее дистального отдела, в отличие от НЯК, встречается относительно редко. При наличии проктита часто формируются свищи.
Монреальская классификация болезни Крона (2005) учитывает возраст начала заболевания (А1 — моложе 16 лет; А2 — от 17 до 40 лет; А3 — старше 40 лет), его локализацию (L1 — в подвздошной кишке; L2 — в толстой кишке; L3 — в толстой и подвздошной кишке одновременно; L4 — изолированное поражение верхних отделов ЖКТ — от полости рта до подвздошной кишки) и течение (В1 — нестенозирующее, непенетрирующее; В2 — стенозирующее; В3 — пенетрирующее; р — с перианальным поражением).
В клинической картине БК, как и при НЯК, сочетаются кишечные и внекишечные проявления. Чаще всего это хроническая диарея, абдоминальные боли и немотивированное снижение массы тела. Из системных проявлений отмечаются общая слабость, анорексия и лихорадка. При вовлечении тонкого кишечника может формироваться синдром мальабсорбции (с развитием железо и/или В12дефицитной анемии, ЖКБ, оксалатурии и мочекаменной болезни). При объективном исследовании у некоторых пациентов в животе пальпируются инфильтраты, а на брюшной стенке и в перианальной области обнаруживаются свищи. При проведении дифдиагностики в первую очередь исключаются инфекционные и медикаментозные поражения кишечника. Диагноз подтверждается эндоскопией и морфологическим исследованием множественных биоптатов. Помимо толстокишечной эндоскопии пациентам с БК следует назначить обследование верхних отделов ЖКТ и тонкой кишки. Для этих целей используются эндоскопия (в том числе капсульная), КТ, МРТ и более доступная в наших условиях сонография (Van Assche G. et al., 2010).
Для диагностики БК предложены следующие диагностические критерии (LennardJones, 1989):
— хроническое гранулематозное поражение от полости рта до анального канала;
— сегментарный характер процесса;
— трансмуральное поражение с развитием язв, трещин, абсцессов, свищей;
— морфологическое обнаружение лимфоидной ткани в виде афтозных язв или трансмуральных лимфоидных скоплений;
— развитие фиброза с формированием стриктур;
— нормальное содержание муцина в зоне активного воспаления слизистой оболочки толстой кишки;
— формирование гранулем.
Диагноз считается достоверным при обнаружении гранулем и наличии еще одного (любого) критерия. В отсутствие гранулем необходимо наличие любых 3 критериев. О степени активности БК судят на основании индекса активности (CDAI).
Лечение БК зависит от активности процесса и распространенности заболевания. Как и при НЯК, в первую очередь оно направлено на подавление воспаления. При изолированном поражении толстой кишки и умеренной активности возможно использование препаратов 5АСА, а при более высокой активности — глюкокортикоидов и цитостатиков. При тонко/толстокишечном поражении лечение обычно начинают с назначения топических глюкокортикоидов (будесонид) при умеренной/средней активности, а при высокой активности — системных глюкокортикоидов и цитостатиков (азатиоприн, 6меркаптопурин). При отсутствии эффекта используют биологические препараты AntiTNF (Dignass A. et al., 2010).
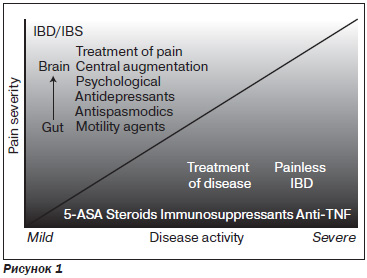
Схематично лечение боли при ВЗК представлено на рис. 1 (по Srinath et al. // Therap. Adv. Gastroenterol. — 2012 September; 5(5): 339357).
Под синдромом хронической абдоминальной ишемии (СХАИ) понимают хроническую недостаточность кровоснабжения в бассейнах непарных висцеральных ветвей брюшной аорты: чревного ствола, верхней и нижней брыжеечных артерий. В клинической практике СХАИ диагностируется редко в связи с многообразием клинических проявлений, маловыраженной их специфичностью и недостаточной осведомленностью врачей общего профиля об этом заболевании. В частности, в терапевтических и гастроэнтерологических стационарах этот диагноз фигурирует у 3,2 % больных. В то же время, по данным вскрытий, патологию непарных висцеральных артерий находят у 19–70 % умерших. При аутопсии умерших от атеросклеротического поражения других сосудистых бассейнов (ИБС, церебральный и облитерирующий атеросклероз) поражение брюшного отдела аорты и ее ветвей обнаружено в 75,5 % случаев. При целенаправленном ангиографическом исследовании больных с облитерирующим атеросклерозом поражение непарных висцеральных артерий обнаружено у 56–75 % из них.
Боль при СХАИ возникает вследствие раздражения висцеральных хеморецепторов в первую очередь водородными ионами вследствие тканевого ацидоза и медиаторами при вторичном воспалении. Присоединяющееся нарушение кишечной моторики приводит к раздражению механорецепторов. Достаточно важна роль сопутствующего СИБР, закономерно развивающегося у таких больных.
Хроническую абдоминальную ишемию обычно разделяют на неокклюзивную (синдром обкрадывания) и окклюзивную (одно и многососудистую, а также синдром внешней окклюзии чревного ствола) (Kolkman J.J., 2008).
Основной жалобой больных при синдроме хронической абдоминальной ишемии является боль в животе как результат ишемии и гипоксии органов пищеварения. По характеру боль может быть схваткообразной, ноющей или тупой, иррадиировать в спину, правое подреберье. При поражении чревной артерии боль может быть обусловлена ишемией печени и не иметь четкой связи с процессом пищеварения. У некоторых больных она возникает при ходьбе или физической нагрузке. При брыжеечной форме боль появляется через 15–30 минут после еды и продолжается 2–2,5 часа, т.е. в течение всего периода пассажа пищи по кишечнику. Боль локализуется преимущественно в эпигастральной области, иногда иррадиирует в спину или правое подреберье (бассейн чревного ствола), может появляться в мезогастрии (бассейн верхней брыжеечной артерии) или левой подвздошной области (бассейн нижней брыжеечной артерии). Болевой синдром уменьшается при резком ограничении приема пищи. В начальной стадии заболевания боль носит периодический характер, появляется после употребления мясной, молочной и другой трудно перевариваемой пищи. По мере прогрессирования заболевания боль усиливается, возникает после приема любой пищи, что заставляет больных резко ограничивать себя в еде. В дальнейшем боль становится постоянной, очень интенсивной, усиливающейся после приема любой пищи в небольшом количестве, больные почти перестают есть. На уменьшение боли может влиять ряд факторов: прием спазмолитиков (нитроглицерина), коленнолоктевое положение (более эффективно при экстравазальных компрессиях). Иногда больным приходится прибегать к приему опиоидов.
Вторым основным симптомом хронической абдоминальной ишемии является дисфункция кишечника, проявляющаяся тяжестью в животе, метеоризмом, диареей или запорами, позывами на дефекацию вскоре после еды, дискомфортом, наличием непереваренной пищи в кале. Возможны изжога, отрыжка, чувство переполнения желудка, тошнота, рвота. Окклюзия нижней брыжеечной артерии обычно проявляется запорами. Третий характерный симптом хронической абдоминальной ишемии — прогрессирующее исхудание. Оно связано с тем, что изза боли пациенты ограничивают себя в количестве и качестве пищи: принимают ее малыми порциями, переходят на малокалорийную, легкоусвояемую однообразную диету. Потеря веса у больных за время болезни иногда составляет до 20–30 кг.
Жалобы больных на упорные боли в животе, связь их с приемом пищи, исхудание, поражение других сосудистых бассейнов, многократные обследования в различных лечебных учреждениях, безрезультатность консервативного лечения дают врачу основания предположить синдром хронической абдоминальной ишемии. Единственным специфическим симптомом данного заболевания является систолический шум в эпигастральной области, однако выслушивается он менее чем у половины больных. Наиболее современным, достаточно информативным методом диагностики является ультразвуковое дуплексное сканирование. Исследование проводят в сагиттальном, продольном и поперечном направлениях. Продольное сканирование в эпигастральной области позволяет получить изображение чревного ствола и верхней брыжеечной артерии. Преимуществами метода являются его неинвазивность, возможность динамического наблюдения. Однако ультразвуковое исследование не дает возможности судить о характере коллатерального кровотока и о состоянии нижней брыжеечной артерии изза малого ее диаметра. Оно может быть скрининговым методом для отбора больных на ангиографию. Ангиография является заключительным и наиболее информативным методом исследования висцеральных артерий.
Лечение синдрома хронической абдоминальной ишемии должно быть хирургическим. Это прерогатива сосудистых и эндоваскулярных хирургов. Целью лечения является восстановление нормальной проходимости висцеральных артерий. Консервативное лечение показано пациентам в компенсированной стадии и оперированным больным с целью реабилитации в послеоперационном периоде. В стадии субкомпенсации при первом обращении к врачу обычно тоже назначают консервативное лечение. Оно может быть продолжено при условии его эффективности. Консервативное лечение синдрома хронической абдоминальной ишемии является симптоматическим и включает диетотерапию, нитраты, антиагреганты и антисекреторные препараты (ИПП). Питание должно быть частым, малыми порциями. При атеросклеротическом генезе заболевания используют препараты, направленные на нормализацию липидного обмена (статины). При неспецифическом аортоартериите и облитерирующем тромбангиите в стадии обострения воспалительного процесса проводится противовоспалительное лечение глюкокортикоидами, в т.ч. пульстерапия их высокими дозами, часто в комбинации с цитостатиками, при необходимости — гемосорбция, плазмаферез. Оперативное вмешательство (открытое или эндоваскулярное) показано больным в стадии субкомпенсации и декомпенсации.
Наибольшую опасность представляют опухоли толстой кишки (колоректальный рак — КРР). В 2011 году в Украине опухоль этой локализации была выявлена более чем у 20 тысяч человек (менее 15 % при профосмотрах). На поздних стадиях (III–IV) КРР выявлялся почти у половины пациентов, поэтому более трети больных не прожили и года после установления диагноза (Украинский канцеррегистр, 2013). В развитых странах КРР по распространенности и смертности занимает 4е место среди опухолей всех локализаций, причем даже в этих странах на ранней стадии диагностируется не более 40 % опухолей.
К вероятным факторам риска опухолей данной локализации относится высококалорийная диета с избыточным содержанием животных жиров красного мяса (говядина, свинина, баранина), а также недостатком растительных волокон. К возможным факторам риска относятся употребление пива, курение, пищевые гетероциклические амины, содержащиеся в копченом мясе и рыбе, сахарный диабет и т.п. Вероятный протективный эффект оказывают аспирин, НПВП и коксибы, кальций, эстрогены (в т.ч. в виде заместительной терапии), физическая нагрузка, низкая масса тела. Предположительно защищает от колоректального рака пища с большим содержанием волокон, витаминов А, С, D и каротина, некоторые овощи (капуста, брокколи и другие крестоцветные).
Как и другие опухоли, КРР чаще встречается в возрасте старше 50 лет. К предопухолевым заболеваниям относятся аденоматозные полипы (так, при величине полипа менее 5 мм риск малигнизации составляет 1 %, а при полипе более 2 см — 40–50 %), ВЗК, длящиеся более 10 лет, тяжелая дисплазия эпителия, семейный анамнез толстокишечного рака и семейный кишечный полипоз, акромегалия.
КРР — медленно растущая опухоль. Считается, что от момента возникновения клеточной мутации до появления визуализируемой опухоли может пройти около 15 лет, а затем еще 2–5 лет до появления первых симптомов. Клинические проявления КРР во многом зависят от его локализации. Чаще всего опухоль расположена в ректосигмоидном отделе толстой кишки (до 55 %), а левосторонние (до селезеночного изгиба) опухоли составляют 60 %. Такие опухоли обычно проявляются запором, появлением крови в кале и чувством неполного опорожнения кишечника, на поздней стадии — кишечной непроходимостью. Правосторонние опухоли очень долго протекают бессимптомно или проявляются железодефицитной анемией. Следует заметить, что КРР любой локализации может манифестировать метастазами — чаще всего в печень или, значительно реже, в легкие.
Появление болей при КРР является признаком далеко зашедшего, чаще всего осложненного течения заболевания. При кишечной непроходимости возникают классические схваткообразные боли, чаще в левой половине живота. Значительно реже развивается тонкокишечная непроходимость с болями в мезогастрии при локализации опухоли в илеоцекальном отделе слепой кишки. Ректальные опухоли в далеко зашедшей стадии (чаще при прорастании соседних органов) могут проявляться болями в промежности или крестце.
С учетом широкой распространенности и столь длительного развития КРР в развитых странах считается целесообразным проведение скрининга для раннего выявления опухоли на курабельной стадии. У людей со средним риском развития КРР (т.е. у всех после 50 лет) рекомендовано раз в два года определять скрытую кровь в кале (предпочтение отдается высокоточным иммунохимическим методам), а раз в 10 лет выполнять сигмоидоскопию. Для скрининга нецелесообразно использовать другие диагностические мероприятия (в т.ч. ирригографию, КТ и тотальную колоноскопию). У людей с более высоким риском развития КРР (аденоматозные полипы более 1 см в диаметре или более 3 небольших полипов) рекомендовано через год после удаления полипов проведение тотальной колоноскопии. У пациентов с ВЗК, длящимся более 10 лет, также целесообразна тотальная колоноскопия (желательно хромоскопия), т.е. с прижизненной окраской, позволяющей визуализировать участки дисплазии, с множественной биопсией. Больным с наследственным семейным полипозом и наследственным раком толстой кишки рекомендовано проведение генетического типирования мутаций с целью определения степени риска развития КРР и тактики лечения. В нашей стране эти рекомендации малодоступны, поэтому таким людям проводится колоноскопия с биопсией, а при обнаружении дисплазии — резекция кишечника. В последние годы в развитых странах все чаще применяется виртуальная колоноскопия — трехмерная реконструкция изображения кишечника при спиральной КТ или МРТ. Это более безопасное для пациента исследование позволяет с высокой точностью визуализировать образования толстой кишки размером в несколько миллиметров. Для ранней диагностики колоректального рака возможно определение некоторых мутаций ДНК, обладающее высокой специфичностью и чувствительностью.
Лечение КРР комбинированное — оперативное + хемотерапия. В далеко зашедших стадиях — симптоматическое: в первую очередь восстановление кишечной проходимости и адекватное обезболивание. Как и при других опухолях, используется ступенчатая терапия: вначале легкие анальгетики (парацетамол, НПВП), при отсутствии эффекта — наркотические анальгетики с минимальными побочными эффектами (трамадол, пропоксифен), затем — опиаты (морфин). Потенцирует анальгетический эффект обезболивающих препаратов добавление разных классов антидепрессантов и блокаторов 2 потенциалзависимых кальциевых каналов — прегабалин и габапентин (особенно эффективны при повреждении нервных стволов). При резистентных болях показано комбинированное лечение несколькими анальгетиками в сочетании с антидепрессантами и антиконвульсантами, а также малоинвазивная блокада/деструкция солнечного сплетения. У пациентов с костными метастазами рекомендована лучевая терапия (Garg R. et al., 2012). Следует помнить о таком побочном эффекте опиатов, как запоры, которые у больных с КРР могут быть ведущим проявлением. В такой ситуации рекомендовано добавлять к лечению селективные блокаторы µопиоидных рецепторов налтрексон и альвимопан (Anjan Т., Singh P.M., 2012).

