Газета «Новости медицины и фармации» Гастроэнтерология (478) 2013 (тематический номер)
Вернуться к номеру
Особенности национальной антихеликобактерной терапии: что может врач общей практики?
Авторы: Томаш О.В., Дорофеев А.Э., Руденко Н.Н., Сибилев А.В., Томаш Л.А. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Со всей полнотой горькие плоды так называемого реформирования национального здравоохранения предстоит вкусить, вероятно, в будущем. Однако уже сегодня можно оценить некоторые очевидные последствия этого процесса. Вопервых, доступность медицинской помощи для основной массы населения резко снизилась. Особенно это касается квалифицированной помощи, оказываемой узкими специалистами, в том числе и гастроэнтерологами. Вовторых, как следствие этого, возросла нагрузка на врачейтерапевтов, именуемых в новаторском стиле семейными врачами, или врачами общей практики. При этом основной проблемой является расширение спектра курируемой патологии. В недавнем прошлом терапевт, предполагая у пациента наличие кардиологического (нефрологического, гастроэнтерологического) заболевания, имел возможность оперативно направить его к врачу того или иного профиля и в дальнейшем проводил и контролировал лечение в соответствии с полученными рекомендациями и назначениями. Сегодня же врач общей практики должен самостоятельно решать вопросы диагностики и лечения в сфере, где у него зачастую не хватает ни теоретической подготовки, ни практического опыта.
Что же необходимо для того, чтобы врач общей практики мог болееменее адекватно решать проблемы, которые раньше были прерогативой узкого специалиста? Мы убеждены, что прежде всего необходимо повысить информированность терапевта, предоставляя ему в доступной форме современные, ориентированные на практику данные по той или иной проблеме. Настоящая статья адресована исключительно врачам общей практики. Она представляет собой попытку объяснить, что такое хеликобактерная инфекция и почему с ней следует бороться.
Хеликобактерная инфекция — это инфекция, вызванная микроорганизмом Helicobacter pylori (Нр), который всего 30 лет назад открыли австралийские ученыеJ.R. Warren и B.J. Marshall. Обнаружив эти бактерии на слизистой оболочке желудка (СОЖ) пациентов с хроническим гастритом и эрозивноязвенными поражениями гастродуоденальной зоны, они предположили, что именно хеликобактер играет ведущую этиопатогенетическую роль в данной патологии. Среди многочисленных теорий о причинах и механизмах возникновения указанных заболеваний инфекционная была, пожалуй, наименее популярной. Считалось, что кислая среда желудка полностью исключает возможность жизни в нем какихлибо микроорганизмов. Последние, попадая в желудок, должны либо погибнуть, либо переместиться в кишечник, где условия их обитания более благоприятные. Доминировавшая в 80е годы прошлого века точка зрения указывала на приоритет агрессивного кислотнопептического фактора, то есть основных компонентов желудочного сока — соляной кислоты (HCl) и пепсинов. Тем самым постулировалась идея загребского хирурга Карла Шварца, сказавшего еще в 1910 году: «Нет кислоты — нет язвы».
Однако и кислотная концепция имела слабые места. Главной нерешенной проблемой было рецидивирующее течение язвенной болезни. Почему даже постоянный прием появившихся в нашем арсенале эффективных антисекреторных препаратов не предотвращал повторного возникновения (обострения) язв и эрозий гастродуоденальной зоны? Этот вопрос оставался без ответа.
Тем не менее на первых порах медицинский мир с настороженностью и недоверием отнесся к сообщению J.R. Warren и B.J. Marshall. Однако в последующие десятилетия были получены неоспоримые доказательства их правоты, и в 2005 году австралийским ученым была вручена Нобелевская премия по физиологии и медицине «За открытие бактерии Helicobacter pylori и ее роли в возникновении гастрита и пептических гастродуоденальных язв».
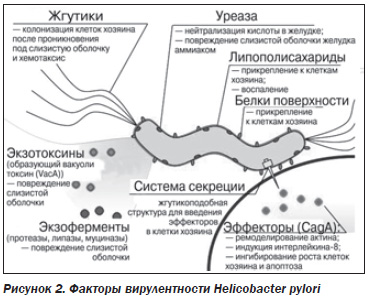
Что представляет собой этот микроорганизм? Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4–6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи. Эта бактерия микроаэрофильна, то есть требует для своего развития наличия кислорода, но в концентрациях, значительно меньших атмосферной (именно в таком количестве кислород содержится в желудке). В неблагоприятных условиях, а также в зрелых или старых культурах Нр обладает способностью превращаться из спиралевидной в более устойчивую круглую или шарообразную (кокковидную) форму. Это благоприятствует ее выживанию и может являться важным фактором в распространении бактерии.
Путь инфицирования — фекальнооральный, как и при традиционных кишечных инфекциях. Поэтому хеликобактерная инфекция максимально распространена в странах с низким социальноэкономическим уровнем, где зачастую не соблюдаются санитарногигиенические нормы; инфицирование при этом нередко возникает в детском или молодом возрасте. Оно сопровождается неспецифическими симптомами острого гастроэнтерита, хотя может протекать и бессимптомно.
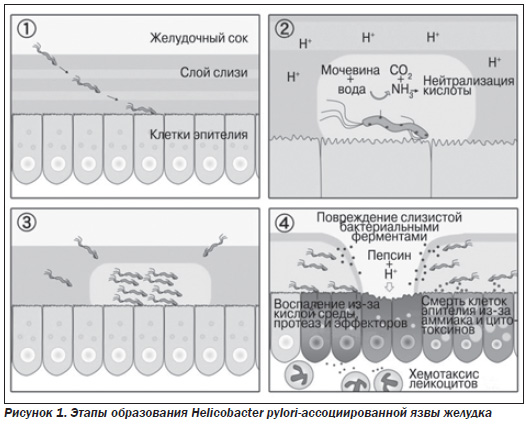
На начальном этапе после попадания в желудок Нр быстро двигается при помощи жгутиков в места скопления других бактерий данного вида (это обеспечивает быструю колонизацию слизистой) и достигает защитного слоя слизи. В принципе слизистобикарбонатный барьер (СББ), покрывающий практически всю поверхность СОЖ, достаточно устойчив к потенциальным повреждающим факторам, в том числе и к собственной соляной кислоте и пепсинам. Однако вырабатываемые бактерией ферменты муциназа, протеаза и липаза деполимеризуют (растворяют) белки этого барьера. В итоге соляная кислота и пепсины получают непосредственный доступ к оголенной слизистой желудка и начинают ее разъедать, вызывая химический ожог, воспаление и изъязвление. Сам же Нр, находясь в слое слизи, защищен от контакта с HCl.
Достигнув поверхности слизистой оболочки (эпителиальных клеток), бактерия фиксируется на них с помощью структурных компонентов своей наружной оболочки — липосахаридов и белков, которые обладают способностью адгезировать («прилипать») к желудочному эпителию. Закрепившись на поверхности слизистой, Нр начинает вырабатывать уреазу. Этот фермент является ключевым в жизнедеятельности бактерии. Уреаза расщепляет имеющуюся в желудочном содержимом мочевину, в результате чего образуется аммиак. Он нейтрализует соляную кислоту желудка и обеспечивает хеликобактеру локальное поддержание комфортного для него pH (около 6–7). Таким образом, вокруг микроорганизма возникает щелочное «облачко», представляющее собой своеобразный скафандр, который защищает Нр от кислотнопептического фактора. Одновременно с этим аммиак вызывает химическое раздражение и воспаление, а впоследствии и гибель клеток СОЖ. Кроме того, обусловленное аммиаком повышение рН в слизистой оболочке и слое защитной слизи поблизости от растущей колонии микроорганизмов по механизму отрицательной обратной связи сопровождается компенсаторным повышением секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов. Это усугубляет повреждение слизистой оболочки (рис. 1).
Нр обладает способностью формировать биопленки, защищающие его от иммунного ответа хозяина и способствующие невосприимчивости к антибиотикотерапии, что также повышает выживаемость бактерии.
Зафиксировавшись на поверхности эпителия, Нр начинает выделять различные токсины (экзотоксины), которые усиливают повреждающий слизистую оболочку потенциал. Эндотоксины бактерии посредством специальной «инжекторной системы» впрыскиваются непосредственно внутрь эпителиальных клеток. Привлеченные воспалением лейкоциты вырабатывают различные медиаторы воспаления, что приводит к прогрессированию воспаления и изъязвления слизистой. Нр также вызывает окислительный стресс и запускает механизм программируемой клеточной смерти клеток эпителия желудка (апоптоз).
Итогом длительного действия разнообразных повреждающих факторов является изменение структуры клеток и нарушение клеточного обновления в СОЖ. Длительное персистирование инфекции в желудке закономерно приводит к атрофии его слизистой оболочки и нередко способствует формированию эрозий, язв и рака желудка (РЖ). Поэтому еще в 1994 году входящее в структуру Всемирной организации здравоохранения Международное агентство по изучению рака (IARC) признало хеликобактер канцерогеном первого порядка в отношении рака желудка.
Способность Hр колонизировать слизистую желудка, вызывая те или иные заболевания, зависит прежде всего от индивидуальных особенностей конкретного штамма бактерии (вирулентность и патогенность; рис. 2), а также состояния иммунитета организма хозяина. В нашей стране, к сожалению, ульцерогенные и канцерогенные штаммы распространены достаточно широко.
В заключение этой части добавим, что этиологическая роль хеликобактера доказана всеми 4 постулатами Коха. Таким образом, совершенно очевидно, что Нр — безусловный патоген, а не комменсал, как продолжают безосновательно считать некоторые наши коллеги.
Поэтому с конца прошлого века во всем мире растет интерес к вопросам диагностики и лечения хеликобактерной инфекции. Наиболее авторитетным документом на эту тему является Маастрихтский консенсус — рекомендации по диагностике Нр и лечению ассоциированных с ним заболеваний, разработанные специально созданной в 1987 году Европейской группой по изучению Helicobacter pylori. Первая редакция этого соглашения была опубликована в 1997 году. В дальнейшем, по мере накопления новой информации в сфере хеликобактериологии, раз в 4–5 лет рекомендации обновлялись, оперативно реагируя на появление новых данных относительно методов диагностики, а также целей, задач и принципов лечения хеликобактерной инфекции. Последняя, четвертая, версия была опубликована в мае 2012 года.
Занимаясь антихеликобактерной терапией (она же — эрадикационная, от слова «эрадикация» — искоренение, то есть полное уничтожение инфекции) с 1994 года, мы накопили достаточно большой опыт диагностики и лечения Нринфекции в юговосточном регионе Украины. Именно сквозь призму этого опыта мы изложим основные положения Маастрихтского консенсуса, стараясь сделать их понятными для негастроэнтерологов.
Хотя адекватных эпидемиологических исследований в Украине не проводилось, ориентировочная Нринфицированность взрослого населения нашей страны составляет 80 %. Кого же следует рассматривать в качестве кандидатов на эрадикационную терапию?
Прежде всего это Нрположительные пациенты с пептическими гастродуоденальными язвами. Тут впору вспомнить афористическое высказывание академика В.Х. Василенко: «Язвы заживают при лечении, без лечения и вопреки лечению». Однако успешная эрадикация решает проблему, с которой не позволял справиться даже постоянный прием антисекреторных препаратов, — она прекращает рецидивирование язвы, то есть фактически излечивает ее. Именно поэтому с появлением антихеликобактерной терапии отошло в прошлое определение язвенной болезни как «хронического, протекающего с периодическими обострениями» заболевания. Да и сам диагностический термин «язвенная болезнь» традиционно употребляется только на постсоветском пространстве. Его ограниченность связана с тем, что подобная формулировка диагноза всего лишь констатирует наличие патологического образования (язвы) соответствующей локализации без всякого указания на ведущие этиопатогенетические механизмы ее образования. Наши зарубежные коллеги в подобных случаях говорят о Нрпозитивной пептической язве желудка и/или двенадцатиперстной кишки. Эта формулировка представляется более удачной, так как сразу обозначает ведущие факторы язвообразования — хеликобактерную инфекцию и кислотнопептическую агрессию. Таким образом, на смену постулату К. Шварца «Нет кислоты — нет язвы» пришел обновленный доказательный тезис: «Нет хеликобактера и нет кислоты — нет язвы». Обращаем внимание на то, что в этом дуэте именно Нр, а не кислота занимает приоритетную позицию. Еще раз подчеркнем, что успешная эрадикационная терапия сегодня составляет основу адекватного лечения пептических гастродуоденальных язв, поскольку она способна избавить человека от заболевания, ранее считавшегося неизлечимым. Поэтому в лечении Нринфекции нуждаются не только пациенты с имеющейся сейчас язвой, но и те, у кого она была раньше («язвенная болезнь вне обострения» по прежним представлениям).
Совершенно очевидно, что антихеликобактерную терапию следует проводить и при осложненном течении язвенной болезни. Так, было показано, что успешная эрадикация у пациентов, перенесших язвенное кровотечение, в 5—10 раз снижает риск повторного кровотечения. Доказательства этого столь убедительны, что в современных Международных рекомендациях по ведению больных с эрозивноязвенными кровотечениями из верхних отделов ЖКТ 2010 года настоятельно рекомендуется назначать эрадикационную терапию сразу после перевода пациента на энтеральное питание. К сожалению, в Донецком центре по лечению больных с острым кровотечением в просвет пищеварительного канала эта тактика полностью игнорируется. Ни при стационарном лечении, ни в рекомендациях при выписке не учитывается Нрстатус пациента. Наш коллегахирург однажды пошутил: «Мы, хирурги, в микробов не верим — мы их никогда не видели». В связи с этим вспоминается персонаж Ильфа и Петрова — ничья бабушка. «Она, как известно, жгла на своей антресоли керосин, так как не доверяла электричеству». Итог недоверия был плачевен — «Воронья слободка» сгорела дотла…
Пользуясь удобным случаем, заметим, что медицина — это не только вера в свою правоту, но и знание доказательной информации, и вернемся к нашей теме.
Еще одна патология, в рамках профилактики и лечения которой следует проводить эрадикационную терапию, — эрозивноязвенные поражения гастродуоденальной зоны, индуцированные приемом нестероидных противовоспалительных препаратов (НПВП). С 1986 года для обозначения этой патологии существует термин «НПВПгастропатия». Патогенетические механизмы НПВПгастропатии отличаются от таковых при «классической» язвенной болезни (пептической язве). Вкратце напомним о них.
Ключевым объектом воздействия НПВП является фермент циклооксигеназа (ЦОГ), посредством которого запускаются ведущие механизмы воспалительных реакций. Однако ЦОГ существует в виде 2 изоферментов: ЦОГ1 и ЦОГ2. При определенном структурном сходстве они, тем не менее, реализуют разные (иногда противоположные) функции. Так, провоспалительные реакции «осуществляет» ЦОГ2. При посредстве же ЦОГ1 происходят различные физиологические процессы, в том числе и те, которые обеспечивают нормальную структуру и функцию уже упоминавшегося слизистобикарбонатного барьера желудка. Следовательно, для эффективного подавления воспаления необходима блокада ЦОГ2. Однако вследствие структурного сходства между двумя изоферментами одновременно в большей или меньшей степени блокируется также и ЦОГ1, что приводит к нарушению структуры СББ и снижению его защитной функции. В результате этого повышается уязвимость СОЖ при воздействии на нее агрессивных факторов, прежде всего соляной кислоты и пепсинов. Как следствие, в желудке возникают эрозии и/или язвы — чаще множественные, локализованные в желудке, с более высоким, чем у «классических» язв и эрозий, риском кровотечений. Зачастую эти эрозии и язвы не сопровождаются характерными клиническими симптомами, что также способствует их прогрессированию вплоть до осложнений. Наиболее эффективной стратегией профилактики НПВПгастропатии является одновременный прием антисекреторных препаратов, которые снижают повреждающий потенциал кислотнопептического фактора. Кроме того, если пациент, принимающий НПВП, имеет хеликобактерную инфекцию, для уменьшения суммарного повреждающего действия на СОЖ обязательно следует проводить эрадикационную терапию. Иными словами, если врач вынужден «наградить» больного одним фактором риска язвообразования — НПВП, он обязан избавить его от второго фактора риска — хеликобактера. Успешная эрадикация способна снизить риск развития НПВПгастропатии в 60 (!) раз. Особенно это актуально для лиц с пептическими язвами (прежде всего осложненными) и явлениями НПВПгастропатии в анамнезе.
Все сказанное в отношении НПВП в полной мере относится и к ацетилсалициловой кислоте (АСК). Сегодня АСК, используемая в минимальных дозах (75–100 мг), востребована прежде всего как препарат для профилактики кардио и цереброваскулярных тромбозов. Однако снижение агрегации тромбоцитов также реализуется посредством блокады ЦОГ1. Кроме того, АСК обладает дополнительной способностью повреждать СОЖ при непосредственном контакте с ней (т.е. не только ЦОГ1опосредованными механизмами). К тому же с антитромбоцитарной целью препарат, как правило, назначается неопределенно долго. Поэтому всех пациентов, принимающих АСК, следует тестировать на наличие у них Нр, а в случае Нрпозитивности проводить эрадикационную терапию.
Как уже было сказано, Нр, персистируя на слизистой оболочке желудка, вызывает ее хроническое воспаление, т.е. хронический гастрит (ХГ). Хронический неатрофический гастрит со временем трансформируется в атрофический гастрит. Атрофия СОЖ закономерно сопровождается ее метаплазией и дисплазией. Дисплазированный эпителий имеет высокий риск злокачественной трансформации. Именно поэтому Нр и рассматривается как потенциальный канцероген, способствующий возникновению рака желудка. Последовательность изменений в СОЖ от неатрофического гастрита до атрофического с метаплазией, дисплазией, приводящих в итоге к развитию у предрасположенных лиц РЖ, носит название каскада желудочного канцерогенеза, или каскада P. Correa (по фамилии впервые описавшего его ученого).
Пользуясь случаем, напомним нашим коллегам о том, что на сегодняшний день во всем мире хронический гастрит является не клиническим, а морфологическим диагнозом. Почему? Вопервых, потому, что ХГ не болит и болеть не может по определению, так как слизистая оболочка лишена чувствительной иннервации. Вовторых, доказать наличие ХГ (как неатрофического, так и атрофического) может только морфолог, которому для этого нужны взятые во время фиброгастроскопии биоптаты из различных (обязательно!) отделов желудка. Сам эндоскопист при этом может судить об атрофии СОЖ только по косвенным признакам. Что же касается эндоскопических признаков метаплазии и атрофии, то их попросту не существует. Абсолютно неадекватными являются столь популярные в 70е годы прошлого века попытки диагностировать ХГ при помощи рентгенологического исследования желудка или путем анализа желудочного сока.
Таким образом, если объединенные усилия эндоскописта и морфолога подтверждают наличие у пациента хронического атрофического гастрита на фоне Нринфекции, то такой пациент нуждается в антихеликобактерной терапии. Успешная эрадикация в данном случае позволит прервать упомянутый каскад и предотвратить развитие РЖ.
Как уже было сказано, взаимосвязь хеликобактерной инфекции и рака желудка на сегодняшний день четко доказана и не вызывает сомнений. В связи с этим эрадикация Нр рассматривается современной медициной как наиболее эффективная стратегия профилактики РЖ в популяциях с высоким риском этой патологии. Этот подход четко оговорен в последних редакциях Маастрихтского консенсуса. Той же точки зрения придерживаются и ведущие украинские специалисты, которые считают целесообразным проведение скрининга (выявления) Нрпозитивных лиц с последующим их лечением в масштабах всей страны. Это связано с тем, что в Украине РЖ занимает 3–4е место по распространенности и 2е — по смертности среди всей онкопатологии. Кто же имеет максимальный риск возникновения РЖ и в связи с этим нуждается в эрадикации Нр? Вопервых, это уже упомянутые лица с морфологически доказанным атрофическим гастритом. Вовторых, это родственники больных раком желудка первой степени родства (последняя описывает связь между родителями и детьми, а также родными братьями и сестрами). С чем это связано? Воспалительный ответ слизистой на Нринфекцию (как ведущий, так и не ведущий в итоге к РЖ) генетически предопределен. Поэтому вероятность того, что хеликобактер вызовет предраковые изменения, а затем и сам рак желудка у человека, чей ближайший родственник уже имеет это заболевание, достоверно выше, чем в общей популяции. Повышенный риск отмечен также у лиц, которые не являются ближайшими родственниками больного раком желудка, но, проживая совместно с ним, имеют более высокую вероятность инфицирования потенциально канцерогенным штаммом хеликобактера. Поэтому в случае Нрпозитивности им также следует проводить эрадикацию.
Антихеликобактерная терапия эффективна в рамках не только первичной, но и вторичной профилактики РЖ. Доказано, что его рецидив после комбинированного лечения (резекция желудка + химиотерапия) у Нрнегативных пациентов возникает достоверно реже, чем у Нрпозитивных.
Эрадикация в качестве первого лечебного вмешательства должна быть проведена Нрпозитивным больным с функциональной диспепсией. Именно она (а не хронический гастрит!) чаще всего и беспокоит пациента, жалующегося на периодические боль и/или дискомфорт в эпигастрии (тяжесть, переполнение после еды, патологически раннее насыщение), при обследовании которого мы не выявляем ничего, кроме упомянутого ХГ. Но поскольку функциональная диспепсия — патология исключения многочисленных органических заболеваний, попрежнему являющихся «предметом заботы» гастроэнтеролога, в данной статье, ориентированной на терапевтов, мы всего лишь ограничимся констатацией этого факта.
Многие исследователи пытаются рассматривать Нр как возможную причину различной внежелудочной патологии (дерматологические, неврологические, кардиологические заболевания). Однако на сегодняшний день считается доказанной взаимосвязь хеликобактерной инфекции только с иммунной тромбоцитопенией и идиопатической Feдефицитной анемией, которые ассоциированы с Нр в 40 и 50 % случаев соответственно. Эрадикационная терапия может оказаться полезной в том случае, если тщательное обследование пациента с указанной патологией не выявило других причин, способных объяснить ее наличие.
Таким образом, мы видим, что перечень заболеваний, для лечения или профилактики которых необходима антихеликобактерная терапия, достаточно велик. В связи с этим возникает вопрос: как правильно диагностировать наличие инфекции в организме?
Самым простым и доступным способом является определение антител класса IgG к хеликобактеру. Если человек контактировал с инфекцией, то его иммунная система отреагировала на это выработкой упомянутых антител. Поскольку самопроизвольная элиминация (удаление) хеликобактера из организма — явление крайне редкое, то наличие антител к инфекции можно считать доказательством присутствия самой инфекции в организме. Разумеется, при этом необходимо убедиться, что пациент не принимал препараты с антихеликобактерным эффектом, которые могли его излечить. Поэтому данный метод можно использовать в качестве скринингового для первичной диагностики Нринфекции. Однако определение антител не годится для контроля после лечения, поскольку даже в случае эффективной эрадикации инфекции антитела к ней могут сохраняться и, соответственно, определяться от нескольких месяцев до 2 лет (так называемый «серологический рубец»).
Более широкие диагностические возможности имеют уреазные тесты: дыхательный уреазный и уреазный с гастробиоптатом. Не вдаваясь в технические тонкости соответствующих методик, заметим, что их суть — в выявлении присутствующей в желудке уреазы, которая, как мы помним, является ключевым ферментом жизнедеятельности Нр. Дыхательный тест неинвазивен, более точен и выявляет присутствие уреазы в желудке по анализу выдыхаемого пациентом воздуха. Именно он рекомендован в качестве стандартного метода диагностики хеликобактерной инфекции — как до лечения, так и после (в качестве контроля). Однако он достаточно дорогой и не слишком доступен в национальной практике. Тест с гастробиоптатом определяет наличие уреазы в слизистой оболочке желудка, для чего, разумеется, нужен биоптат и, соответственно, фиброгастроскопия. Последняя позволяет провести осмотр слизистой верхних отделов ЖКТ, что чаще всего необходимо для диагностики Нрассоциированной патологии. Этот метод в наших условиях доступнее и зачастую дешевле дыхательного теста.
Для повышения информативности уреазных тестов следует соблюсти определенные условия, которые мы предлагаем рассмотреть на конкретных примерах. Предположим, эрадикация оказалась успешной и хеликобактер в желудке уже отсутствует. Но накопленная в слизистой за время его существования уреаза еще сохраняется, постепенно сходя на нет. Поэтому во избежание ложноположительного результата уреазный контрольный тест следует проводить не раньше чем через 1 мес. после окончания лечения. Обратная ситуация: лечение оказалось неэффективным, и хеликобактер попрежнему персистирует на слизистой оболочке желудка. Но препараты, с помощью которых мы с ним боролись, подавляют активность уреазы, в связи с чем она может не определяться. Направив пациента на контрольный тест сразу после окончания лечения, мы можем получить отрицательный результат, но он будет ложноотрицательным. Поэтому и в данном случае необходимо соблюсти тот же интервал в 1 мес. Если бактерия остается в желудке, за этот период ее уреаза восстановит свою активность и будет выявлена при контрольном уреазном тесте.
Достоинства и недостатки остальных диагностических методов мы обсуждать не будем, поскольку они, к сожалению, практически недоступны в нашей повседневной клинической практике.
Какой же должна быть антихеликобактерная терапия и почему? Попробуем, разобравшись в этом вопросе, сделать сложное простым или по крайней мере понятным.
Вернемся к модифицированному постулату Шварца: «Без H.pylori и без кислоты нет язвы». Два основных «виновника» обозначены четко. Логично предположить, что эрадикационные схемы должны работать в 2 направлениях: с одной стороны, подавлять солянокислую секрецию желудка, а с другой — обладать антибактериальной (антихеликобактерной) активностью.
Наиболее эффективными антисекреторными препаратами на сегодняшний день являются ингибиторы протонной помпы (ИПП). Они широко представлены в нашей практике: от первого препарата этой группы омепразола до представителя последней генерации эзомепразола. Все ИПП принципиально сходны по своей клинической эффективности, в связи с чем любой из них может быть использован в схемах эрадикационной терапии.
Антибактериальных препаратов с антихеликобактерной активностью достаточно много. Принципы их рационального использования оговорены Маастрихтским консенсусом. В соответствии с этими рекомендациями лечение Нринфекции предполагает несколько этапов. Первый этап — выбор стартовой терапии, или терапии первой линии. Она является трехкомпонентной (тройная терапия) и включает в себя ИПП и 2 антибактериальных препарата: амоксициллин + кларитромицин или амоксициллин + метронидазол; продолжительность лечения составляет 7–14 дней. В случае неэффективности терапии первой линии следует использовать терапию второй линии. Она представлена четырехкомпонентной схемой (квадротерапия) и включает в себя ИПП в сочетании с 3 антихеликобактерными препаратами: тетрациклином, метронидазолом и препаратом висмута. Что делать, если и квадротерапия не обеспечила эрадикацию? Наиболее эффективным в данном случае является выделение от пациента возбудителя и определение чувствительности этого штамма к конкретным антибиотикам. Это позволяет перейти от эмпирической антимикробной терапии к лечению инфекции при установленной чувствительности возбудителя. К сожалению, культуральные методы диагностики в нашей стране недоступны. Поэтому остается второй вариант: продолжить эмпирическое лечение, используя для этого терапию третьей линии, или «терапию спасения». Она включает в себя измененные дозы и режимы приема препаратов, использовавшихся на предыдущих этапах, а также другие антимикробные препараты — АП (чаще всего респираторные фторхинолоны и рифабутин). Таковы рекомендации последнего Маастрихтского консенсуса.
Однако какими бы обоснованными и авторитетными ни были международные рекомендации по любой антимикробной терапии, универсальными являются только принципы ее проведения, а не конкретные рекомендуемые схемы. Эффективность или неэффективность последних связана прежде всего с региональной устойчивостью микроорганизмов к антибиотикам. Так, в странах Северной Америки и Западной Европы, где эрадикация активно проводится уже со 2й половины 90х годов ХХ века, эффективность многих лечебных схем снижается, и это вынуждает исследователей рекомендовать новые режимы антихеликобактерной терапии. Однако в Украине ситуация совершенно иная, поскольку в национальную медицинскую практику широкое использование эрадикации пришло гораздо позднее. К тому же резистентность Нр широко варьирует не только в разных странах, но и в различных регионах одной и той же страны. Поэтому выбор конкретных схем эрадикации должен определяться исключительно региональными уровнями антибиотикорезистентности Нр.
На что же следует ориентироваться терапевту, выбирая тот или иной вариант стартовой антихеликобактерной терапии в Украине и, в частности, в ее юговосточном регионе?
Как мы видим, принципиально возможны 2 схемы: с кларитромицином и с метронидазолом. Какой из них отдать предпочтение? Согласно данным, изложенным в Приказе Минздрава Украины от 03.08.2012 № 600 «Про затвердження та впровадження медикотехнологічних документів зі стандартизації медичної допомоги при диспепсії», средние национальные показатели резистентности Нр к кларитромицину и метронидазолу составляют 6,7 и 26 % соответственно. Общеизвестно, что устойчивость микроорганизма к антибиотику растет пропорционально длительности его использования. Совершенно очевидно, что кларитромицин появился в нашей практике гораздо позднее метронидазола и схемы с его использованием обеспечивают более высокий уровень эрадикации. Именно поэтому в упомянутом Приказе № 600 кларитромицинкомпонентная тройная терапия официально рекомендована в качестве приоритетной. К тому же, как показывает наш личный опыт, в случае неудачи стартовой терапии эффективность метронидазолкомпонентной квадротерапии выше, если метронидазол в этой стартовой терапии не использовался.
Второй вопрос: какой должна быть оптимальная продолжительность терапии? У наших зарубежных коллег отчетливо прослеживается тенденция к увеличению продолжительности лечения с 7 до 10–12, а затем и до 14 дней. К сожалению, это неизбежно приводит не только к удорожанию лечения, но и к росту побочных эффектов, наиболее частыми из которых являются антибиотикоассоциированная диарея (ААД) и аллергические реакции. К тому же, согласно Маастрихтскому консенсусу, удлинение лечения с 7 до 14 дней повышает частоту успешной эрадикации всего лишь на 5 %. Как показывает наш опыт, тройная кларитромицинкомпонентная терапия и сегодня способна обеспечить высокий уровень эрадикации (более 90 %) при 7дневном курсе. В своей практике мы используем другие способы повышения эффективности антихеликобактерной терапии: удвоение доз ИПП (согласно Маастрихтскому консенсусу, это повышает эрадикацию в среднем на 8 %) и включение в схему лечения пробиотика, содержащего большое количество лактобактерий. Последний не только улучшает переносимость антибиотиков, предотвращая тем самым ААД, но и обладает собственным антагонизмом по отношению к Нр.
Если врач общей практики, преодолев скепсис и недоверие, осознает необходимость проведения антихеликобактерной терапии, он в силу дефицита опыта наверняка столкнется с проблемой выбора оптимальной схемы лечения с учетом адекватных комбинаций препаратов, их дозировок, продолжительности курса лечения. Эта проблема успешно решается путем использования фиксированных комбинаций для эрадикации хеликобактера. Кроме того, схема приема комбинированного препарата понятнее пациенту, что, в свою очередь, повышает его приверженность терапии и способствует полному соблюдению предписаний врача. Немаловажно, что фиксированный препарат дешевле «набора» из отдельных препаратов. Кроме того, не секрет, что зачастую этот «набор», составленный по рекомендациям сотрудников аптечной сети, претерпевает существенные изменения (другие дозировки, оставляющее желать лучшего качество лекарственного средства и т.д.). И последнее: в случае неудачи эрадикационной терапии, проведенной самостоятельно подобранными препаратами, вопрос о том, какой из них «не сработал», остается без ответа. Фиксированные препараты помогают успешно решать эти проблемы.
Сегодня на фармацевтическом рынке Украины есть 3 комбинированных препарата, формально соответствующих требованиям к стандартной тройной терапии: Пилобакт Нео (ИПП [омепразол] + амоксициллин + кларитромицин), бетаклатинол (ИПП [пантопразол] + амоксициллин + кларитромицин) и орнистат (ИПП [рабепразол] + амоксициллин + орнидазол). В проведенном нами сравнительном исследовании их эффективности максимальный уровень эрадикации — 91,7 % — продемонстрировал Пилобакт Нео. Эффективность орнистата составила 73,3 %. Этот результат вполне ожидаем, поскольку орнистат содержит компонент, являющийся производным метронидазола, распространенность устойчивых штаммов Нр к которому встречается в Украине примерно в 4 раза чаще, чем к кларитромицину. Самый скромный результат — 61,7 % успешной эрадикации — оказался у бетаклатинола. Последнее вызывает вопрос хотя бы потому, что формально Пилобакт Нео и бетаклатинол являются аналогичными кларитромицинкомпонентными комбинациями для проведения тройной терапии. Ответ, очевидно, следует искать в ненадлежащем качестве некоторых генерических препаратов, попадающих на национальный фармацевтический рынок. Добавим, что продолжительность приема всех препаратов составила 7 дней. Именно данное обстоятельство позволяет нам утверждать, что стандартная 7дневная кларитромицинкомпонентная терапия в юговосточном регионе Украины продолжает сохранять высокую эффективность, и это делает неактуальным широкое использование альтернативных схем эрадикации. Аналогичной точки зрения придерживается один из ведущих украинских специалистов по вопросам диагностики и лечения Нрассоциированной патологии профессор С.М. Ткач. Он рекомендует строго следовать положениям Маастрихтского консенсуса IV, прежде всего относительно показаний к эрадикации, методов диагностики Нр и контроля эффективности лечения. Что касается самого лечения, то с учетом относительно невысокой резистентности к кларитромицину стандартную кларитромицинкомпонентную терапию 1й линии в Украине вряд ли стоит менять. При этом следует рассматривать проведение стандартной терапии в течение 10 и 14 дней, а также ее комбинацию с пробиотиками как возможные пути повышения эффективности эрадикационного лечения.
В связи с этим нам представляется уместным привести отдельные положения Декларации по борьбе с антимикробной резистентностью, которая была принята 16 сентября 2000 года на Всемирном дне резистентности в Торонто (Канада):
— антимикробные препараты — это невосстановимые ресурсы;
— резистентность коррелирует с клинической неэффективностью;
— резистентность создается человеком, и только человек может решить эту проблему;
— антибиотики — это социальные препараты;
— избыточное применение АП населением, неправильные представления и недооценка проблемы резистентности врачами и фармацевтами, назначающими АП, ведут к распространению резистентности.
Совершенно очевидно, что преждевременный переход на активное использование «терапии спасения» как раз и является примером нерационального использования антибактериальных ресурсов.
В заключение хотелось бы еще раз акцентировать внимание коллегтерапевтов на наиболее важных аспектах антихеликобактерного лечения.
1. Круг патологии, при которой с позиций доказательной медицины следует проводить эрадикационную терапию, достаточно широк и распространен в популяции. Нередко Нрассоциированные заболевания представляют собой междисциплинарную проблему. В связи с этим, а также с уменьшением доступности квалифицированной гастроэнтерологической помощи стандартную антихеликобактерную терапию, очевидно, должны назначать и врачи общей практики (терапевты).
2. Эффективная фиксированная комбинация позволяет избежать врачебных ошибок, самыми частыми из которых являются выбор неоптимальных комбинаций, дозировок и продолжительности лечения. В условиях, когда антихеликобактерная терапия назначается врачом общей практики (терапевтом), а не более опытным в данном вопросе гастроэнтерологом, это особенно важно.
3. Из всех имеющихся на рынке фиксированных комбинаций для эрадикации в юговосточном регионе Украины, по нашим данным, максимально эффективен Пилобакт Нео, который при 7дневном приеме в комбинации с пробиотиком обеспечивал успешную эрадикацию без клинически значимых побочных эффектов в 91,7 % случаев.
4. Оценка эффективности антихеликобактерной терапии требует обязательного проведения контроля эрадикации не ранее чем через 1 мес. после окончания приема как ИПП, так и антибиотиков.
5. Широкое использование новых эрадикационных схем/препаратов на сегодняшний день в Украине следует признать нерациональным и нецелесообразным.
6. В национальной практике в качестве возможных путей повышения эффективности эрадикации следует рассматривать удвоение доз ИПП, удлинение антихеликобактерной терапии до 10–14 дней и ее комбинацию с определенными пробиотиками.