Газета «Новости медицины и фармации» Гастроэнтерология (478) 2013 (тематический номер)
Вернуться к номеру
Роль генома микрофлоры при воспалительных заболеваниях кишечника
Авторы: Рассохина О.А. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Целью данного исследования была оценка изменений качественного и количественного состава кишечной флоры у больных воспалительными заболеваниями кишечника (ВЗК), анализ генетической предрасположенности к нарушению иммунного ответа при дисбиотических процессах в толстом кишечнике у пациентов с неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК). У большинства обследованных больных ВЗК имелась генетическая предрасположенность к нарушению микробиоценоза кишечника. При этом сочетание полиморфизма TLR-3 с изменениями микрофлоры кишечника свидетельствует о преобладании избыточного иммунного ответа на антигены облигатных и факультативных бактерий у больных НЯК. В то же время у пациентов с БК преобладание полиморфизма TLR-4 в сочетании с наличием условно-патогенной микрофлоры в кишечнике может отражать снижение реактивности к кишечным патогенам.
воспалительные заболевания кишечника, микрофлора кишечника.
Воспалительные заболевания кишечника (ВЗК) представляют серьезную медицинскую и социальноэкономическую проблему [1, 2]. Генетические мутации, увеличивающееся влияние неблагоприятных внешних факторов приводят не только к росту частоты ВЗК, но и к учащению внекишечных поражений и осложнений заболевания [1, 3]. Характер заболеваний (мультифакторный), особенности влияния предрасполагающих и провоцирующих факторов, ведущий патогенетический механизм при различных формах ВЗК существенно различаются. В то же время существует некоторая общность клинических симптомов и этиопатогенетических факторов, существенно затрудняющих дифференциальную диагностику между неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК), что пролонгирует назначение своевременной адекватной терапии данных заболеваний. Рост заболеваемости ВЗК в экономически развитых странах исследователи связывают с увеличением экологической нагрузки, нарушением характера и режима питания, употреблением рафинированных продуктов, высоким уровнем стресса у жителей мегаполисов. Низкая заболеваемость ВЗК отмечается в странах Азии, Японии, Южной Америки. В Российской Федерации по данным 1997 г. заболеваемость НЯК составляла 20,6, а болезнью Крона — 3,4 на 100 000 жителей. По результатам П.Н. Олейникова (1996), частота НЯК в СНГ составляла 0,7–1,0 на 1000 населения. При этом соотношение числа случаев НЯК и БК составляло 1: 10–1: 5. В Украине показатели распространенности ВЗК различны в зависимости от региона. Так, в экологически неблагоприятных промышленных областях частота встречаемости НЯК и БК выше, чем в сельскохозяйственных регионах [5, 6]. Пик роста заболеваемости НЯК в Восточной Украине приходится на вторую половину 90х годов прошлого века, а в настоящее время отмечаются предпосылки к началу роста БК. Частота возникновения (первичная заболеваемость) болезни Крона составляет 2–4 случая на 100 000 жителей, и в последние годы этот показатель возрастает. Встречаемость болезни Крона составляет 30–50 случаев на 100 000 населения и также имеет тенденцию к росту. Значительное число диагностических ошибок, не всегда эффективная терапия приводят к увеличению длительности нетрудоспособности, инвалидизации, а иногда и смерти таких больных, что обусловливает особую актуальность, необходимость глубокого изучения данной патологии [1, 2, 4].
НЯК и БК являются полиэтиологическими заболеваниями, в возникновении которых значительную роль играет наследственная предрасположенность, реализующаяся под воздействием стрессов, пищевых погрешностей и кишечных инфекций посредством иммунологических нарушений. Микрофлора толстой кишки является одним из факторов, определяющих нормальное функционирование слизистого барьера кишечника [1, 2]. Интоксикация продуктами жизнедеятельности бактерий толстого кишечника способна угнетать метаболическую и секреторную активность клеток кишечного эпителия, снижая резистентность слизистых барьеров, а вирусы могут изменять метаболизм колоноцитов, оказывать влияние на местный иммунный ответ [3, 4]. Кишечная палочка и бифидобактерии выполняют витаминообразующую функцию, способствуют синтезу незаменимых аминокислот, принимающих непосредственное участие в процессах регенерации слизистой кишечника [2, 5]. При изменениях микробиоценоза кишечника эти функции микрофлоры нарушаются. Кроме того, при нарушениях баланса анаэробноаэробной флоры изменяется энергообеспечение колоноцитов [5, 6]. При этом нарушается секреторная функция бокаловидных клеток, снижается синтез муцинов, изменяются их состав и свойства, нарушаются соотношения сульфатированных и несульфатированных гликозаминогликанов, что приводит к нарушению защитных свойств слизи и поддерживает дисбактериоз. Нарушается и белковая структура муцинов, что снижает регенераторные возможности слизистой. Следовательно, нарушения микробиоценоза толстого кишечника у больных ВЗК вызваны изменением трофики колоноцитов, нарушением секреторной функции бокаловидных клеток, процессов пролиферации, дифференцировки и регенерации клеток кишечного эпителия.
Дисбиотические процессы в толстом кишечнике непосредственно влияют на изменения мукозного слоя слизистой оболочки толстого кишечника [1, 5]. Облигатная микрофлора кишечника способствует синтезу муцинов. Муцины, в свою очередь, являются трофическим, энергетическим сырьем для жизнедеятельности бактерий, формирования колонизационной резистентности. Вследствие нарушения хотя бы одного из компонентов слизистого барьера кишечника возникает феномен повышенной кишечной проницаемости, и кишечник становится источником поступления в организм большого количества антигенов, токсических соединений, которые способствуют поддержанию воспаления. Воспалительный процесс в кишечнике, вызванный патогенной флорой, ксенобиотиками или аллергенами, стимулирует клетки иммунной системы и поддерживает системный воспалительный процесс. Подтверждением важной роли слизистого барьера кишечника является уменьшение активности заболевания у больных ВЗК после восстановления микробиоценоза кишечника и уменьшения кишечной проницаемости [4, 6].
Характер изменения слизистого барьера кишечника отличается при различных типах ВЗК. При болезни Крона наблюдается нарушение микробиоценоза толстого кишечника за счет микобактерий, псевдомонад, иерсиний, патогенных штаммов эшерихий [1, 4, 6]. В то же время для больных НЯК характерен дисбактериоз со снижением количества бифидобактерий и лактобацилл, облигатной флоры и увеличением факультативных бактерий [2, 4, 5]. При НЯК определяется дефицит защитного слоя муцинов, а при БК отмечается избыток слизеобразования в кишечнике [4]. Одной из причин, определяющих различия в патогенезе изменений свойств кишечного барьера при НЯК и БК, может быть генетическая предрасположенность к восприятию антигенной нагрузки в кишечнике.
Определена локализация генов, ответственных за развитие ВЗК. Наиболее значимые находятся на 16, 22, 10, 2 и 19й хромосомах. Генетическую предрасположенность к ВЗК связывают с полиморфизмом генов NOD2/CARD15, DLG5, TNF, TLR4, IL1, IL10. В нескольких исследованиях было установлено, что домен CARD15, расположенный на 16й хромосоме и кодирующий белок NOD2, приводит к модификации иммунного ответа, изменяет проницаемость слизистого барьера кишечника и достаточно часто выявляется у пациентов с ВЗК, обусловливая тяжелое течение заболевания [10, 12]. Полиморфизм DLG5 также способствует развитию ВЗК, преимущественно БК. В последнее время особое внимание уделяется генам, кодирующим синтез фактора некроза опухолей (TNF) и антагониста рецепторов интерлейкина1 (IL1). Выявлен выраженный полиморфизм гена, находящегося на второй хромосоме и определяющего уровень антагониста рецепторов к IL1 в слизистой оболочке толстой кишки у больных НЯК, который стимулирует активность Т и Влимфоцитов и индуцирует иммунный ответ. В то же время полиморфизм группы генов, определяющих уровень TNF, более характерен для пациентов с болезнью Крона [16].
В настоящее время особое внимание уделяется системе tollподобных рецепторов (TLRs 113), отвечающих за распознавание компонентов клеточной стенки бактерий, активацию каскада провоспалительных цитокинов и интерлейкинов, формирование колонизационной резистентности и бактериальную транслокацию [7–9]. TLR в большом количестве представлены на поверхности кишечного эпителия, а также обнаружены на моноцитах, макрофагах, в системной циркуляции и периферических органах и тканях, что свидетельствует о важной роли tоllподобных рецепторов в регуляции как местного, так и системного иммунного ответа [7, 9]. Тоllподобные рецепторы активируются различными бактериальными или вирусными клеточными компонентами. Рецепторы распознают микробные структуры, так называемый патогенассоциированный микробный паттерн, и являются ключевым звеном в регуляции противомикробной протекции кишечника. Связывание рецепторов с бактериальным или вирусным антигеном приводит к активации факторов ядерной транскрипции (NF B, JAK2), изменению экспрессии провоспалительных цитокинов и индукции воспалительного ответа [7–10]. Повышенная экспрессия TLRs способствует активации цитокинов и интерлейкинов, избыточной продукции TNF, IL1, IL6, IL8 [10, 11]. Точечная мутация в экзоне гена TLR4 (хромосома 9q32–33) приводит к замене аспарагиновой кислоты на глициновую, потере отрицательного заряда в позиции 299 (Asp299Gly), что нарушает распознавание липополисахаридов бактерий как in vitro, так и in vivo, и развитию грамотрицательного сепсиса у животных, снижению ответа на бактериальный эндотоксин в эксперименте у человека [7, 12]. TLR4 экспрессируется не только в кишечнике, но и на кардиомиоцитах, в головном мозге, лейкоцитах периферической крови [1, 7]. Изменение его экспресии может быть обусловлено как внешними факторами, так и генетической предрасположенностью, что может влиять на характер иммунного ответа у пациентов с ВЗК [12–14]. В то же время TLR3 экспрессируется только на дендритных клетках [8, 13, 14, 16], следовательно, может являться первичным звеном, контактирующим с антигеном, распознающим и презентирующим компонентом иммунной системы кишечника. В эксперименте клетки TLR3дефицитных мышей характеризовались сниженной продукцией TNF, IL6, IL12 и нормальным ответом на бактериальные полисахариды [11, 15, 17]. Возможно, различные нарушения экспрессии TLRs в кишечнике вследствие генетической предрасположенности способствуют формированию различных типов ответа на вирусные и бактериальные антигены, изменению качественного и количественного состава кишечной микрофлоры. Поэтому изучение ассоциаций нарушений микрофлоры кишечника в сочетании с анализом мутаций TLRs у пациентов с ВЗК представляется актуальным.
Целью данного исследования была оценка изменений качественного и количественного состава кишечной флоры у больных ВЗК, анализ генетической предрасположенности к нарушению иммунного ответа при дисбиотических процессах в толстом кишечнике у пациентов с НЯК и БК.
Материалы и методы
Было обследовано 98 пациентов с ВЗК. Среди обследованных было 56 (57,1 %) больных НЯК и 42 (42,9 %) пациента с болезнью Крона. Всем больным была проведена ДНКдиагностика в отделе молекулярногенетических исследований ЦНИЛ ДонНМУ им. М. Горького, включавшая анализ мутаций toolподобного рецептора 3 — TLR3 (мутация Phe412Leu) и tollподобного рецептора 4 — TLR4 (мутация Asp299Gly). ДНК выделена из лейкоцитов цельной крови с помощью реагента «ДНКэкспресскровь». В работе были использованы диагностические тестсистемы «SNPэкспресс», разработанные НПФ «Литех».
Анализ полиморфных ДНКлокусов осуществляли методом полимеразной цепной реакции синтеза ДНК с последующей электрофоретической детекцией. Реакция проводилась при следующих условиях: первичная денатурация при 93 °С в течение 1 мин, после которой следовали 35 циклов, состоящих из денатурации при 93 °С в течение 10 с, отжига праймеров при 64 °С в течение 10 с, элонгации при 72 °С в течение 20 с. ПЦР проводили на амплификаторе Gene Amp® PCR System 2400 (Applied Biosystems). Анализ амплифицированных фрагментов производили путем электрофореза в 3% агарозном геле, окрашенном в бромистом этидии. Визуализацию результатов проводили в ультрафиолетовом трансиллюминаторе TFX20.M (Vilber Lourmat, Франция).
Для оценки изменений кишечного микробиоценоза проводили изучение облигатной и факультативной кишечной флоры, ее количественного и качественного состава. Забор кала проводился утром в стерильную посуду и в течение 1 часа доставлялся в микробиологическую лабораторию. Определяли количество бифидобактерий и лактобацилл, кишечной палочки; изучали количественный и качественный состав факультативной флоры с исследованием количества стафило, стрепто и энтерококков, клебсиелл, протея, энтеробактера, цитобактера, грибов рода Candida. Помимо определения количества микроорганизмов, изучали их ферментативные свойства.
Результаты и обсуждение
Полиморфизм TLR3, TLR4 наблюдался более чем у половины обследованных больных ВЗК — 60 (65,2 %) пациентов. Мутация TLR3 (Phe412Leu) встречалась чаще, чем TLR4, и отмечалась у 37 (41,1 %) больных ВЗК. Преобладающее количество мутаций были гетерозиготными. Полные мутации (Leu/Leu) были отмечены только у 6 (16,2 %) обследованных пациентов с ВЗК. Частота встречаемости точечной мутации TLR3 отличалась в зависимости от типа ВЗК. Гетерозиготные мутации (Phe/Leu) преобладали среди больных НЯК — 24 (64,9 %). Неполные мутации встречались с меньшей частотой при БК — 13 (35,1 %) пациентов. Гомозиготные мутации TLR3 (Leu/Leu) также преобладали среди пациентов с НЯК — 4 (10,8 %), по сравнению с больными БК — 2 (5,4 %) пациента, однако данные отличия не были достоверными. Таким образом, полиморфизм TLR3 чаще наблюдался у больных НЯК, что может свидетельствовать о преобладании избыточного ответа на бактериальные полисахариды как облигатной, так и факультативной микрофлоры кишечника, запускающего каскад провоспалительных цитокинов (TNF, IL6, IL12), играющих ключевую роль в формировании ВЗК.
Мутация TLR4 (Asp299Gly) у обследованных больных наблюдалась несколько реже, чем TLR3, и встречалась только у 23 (25,0 %) пациентов с ВЗК. У всех больных отмечались только гетерозиготные мутации TLR4 (Asp/Gly). Полиморфизм TLR4 превалировал у больных БК — 15 (65,2 %) случаев, в отличие от больных НЯК, среди которых данная мутация наблюдалась лишь у 8 (34,8 %) пациентов. Следовательно, снижение или отсутствие способности к адекватному распознаванию бактериальных липополисахаридов вследствие мутации TLR4 более характерно для больных БК. Это приводит к снижению ответа на бактериальный эндотоксин грамотрицательной флоры, индукции и хронизации воспалительного процесса в кишечнике. Возможно, это объясняет тот факт, что нарушение микробиоценоза толстого кишечника за счет патогенной микрофлоры, кишечные инфекции предшествуют развитию, а также провоцируют обострения у пациентов с болезнью Крона чаще, чем у больных НЯК.
Генетическая предрасположенность с сочетанной мутацией TLR3 и TLR4 наблюдалась только у 9 (9,8 %) больных ВЗК. При этом сочетанные мутации встречались с равной частотой у больных как НЯК, так и БК, что, возможно, связано с небольшим количеством наблюдений.
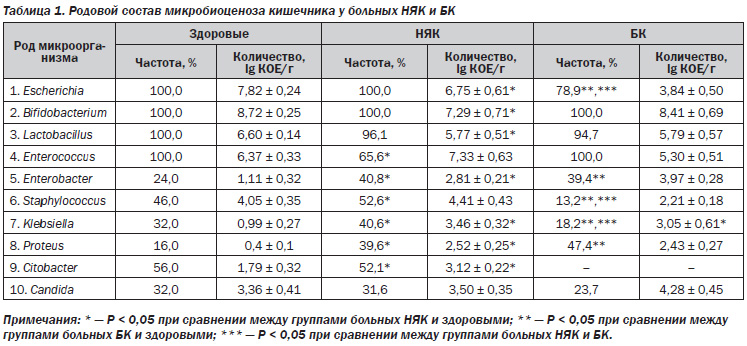
У всех 92 больных ВЗК были выявлены изменения количества и состава кишечной микрофлоры (табл. 1).
При этом как у больных НЯК, так и БК патогенные микроорганизмы не определялись, а облигатная флора (бифидобактерии, лактобациллы и кишечная палочка) высевались почти у всех пациентов, однако их количество было значительно снижено. У пациентов с БК частота высеваемости E.coli была ниже — 30 (78,9%) случаев, чем у здоровых лиц, причем как ее общего количества, так и кишечной палочки со слабовыраженными ферментативными свойствами за счет увеличения удельного веса гемолизирующей E.coli (до 50 %). У больных НЯК отмечалось только снижение количества кишечной палочки (6,75 ± 0,61). Энтерококки были выделены лишь у 63 (65,6 %) пациентов с НЯК (P < 0,05), а у пациентов с БК отмечалось снижение количества энтерококков (5,30 ± 0,51) при 100% высеваемости.
Снижение количества облигатной флоры приводило к понижению колонизационной резистентности и росту факультативных бактерий. Энтеробактер у больных НЯК высевался достоверно чаще, чем у здоровых (40,8 и 24,0 % соответственно, P < 0,01), при этом его количество также достоверно превышало показатели здоровых лиц. Частота встречаемости стафилококков у больных НЯК была выше — 52,6 %, чем у здоровых лиц, однако их количество достоверно не отличалось, при этом чаще высевались S.epidermidis, S.aureus. У пациентов с БК частота встречаемости стафилококков была значительно ниже — 5 (13,2 %), чем у здоровых (P < 0,03), а также пациентов с НЯК (P < 0,01). Клебсиеллы высевались достоверно чаще у больных НЯК — 39 (40,6 %) пациентов, при этом их количество превышало норму в 2,7 раза. У больных БК высеваемость клебсиелл была достоверно ниже — 7 (18,2 %) случаев, однако их количество превышало норму (3,05 ± 0,61 lg КОЕ/г) и достоверно не отличалось от показателей больных НЯК. Частота высеваемости протея у больных НЯК была выше в 2 раза, а у больных БК — в 3 раза, чем у здоровых лиц. Протей был выделен у 38 (39,6 %) пациентов с НЯК, и его количество 2,12 ± 0,22 lg КОЕ/г значительно превышало норму — 0,48 ± 0,19 lg КОЕ/г (P < 0,001). Чаще высевался протей рода P.mirabilis. У 18 (47,4 %) пациентов с БК был выявлен протей, причем его количество также превышало допустимые значения (2,43 ± 0,27). У пациентов с БК чаще высевался P.vulgaris. Цитобактер не определялся у пациентов с БК и был выявлен только у больных НЯК — 50 (52,1 %) пациентов (P < 0,05), его количество достоверно превышало нормальные показатели (3,12 ± 0,22 и 1,79±0,32 lg КОЕ/г соответственно, P < 0,05). Грибы рода Candida у больных НЯК высевались чаще, чем у больных БК, однако их количество при БК несколько превышало нормальные показатели (4,28 ± 0,45). Следовательно, на фоне снижения количества облигатных бактерий у больных НЯК повышается количество, удельный вес факультативной флоры, что приводит к нарушению колонизационной резистентности. Повышается частота высеваемости клебсиелл, клостридий, энтеробактера и протея.
Наличие полиморфизма TLR3 и TLR4 у обследованных больных ВЗК приводило к более выраженным изменениям качественного и количественного состава микрофлоры кишечника по сравнению с больными, не имеющими генетической предрасположенности. Так, у пациентов с полиморфизмом TLR3 чаще высевались E.coli и Enterobacter, а у больных с полиморфизмом TLR4 преобладала высеваемость Klebsiella, Proteus и Enterococcus.
Качественные изменение микрофлоры при ВЗК, обусловленные генетической предрасположенностью, могут носить более стойкий характер, способствовать развитию ВЗК, рефрактерных к лечению. Данные изменения могут быть обусловлены нарушениями содержания биогенных аминов, продуцируемых микрофлорой кишечника, что усиливает кишечную моторику, секрецию слизи, провоцирует болевую импульсацию. При дисбиозе кишечника нарушается инактивирование ферментными системами микрофлоры биологически активных веществ, гистамина и серотонина. Гиперпродукция серотонина и гистамина бактериями толстого кишечника приводит к образованию избыточного количества токсических веществ, усилению пропульсивной активности кишечника, что усугубляет симптомы ВЗК. Снижение продукции гистидазы поврежденной слизистой оболочкой кишечника также приводит к увеличению концентрации гистамина в крови, развитию сенсибилизации к условнопатогенной флоре. Дисбиоз кишечника способствует развитию и поддержанию моторноэвакуаторной дисфункции, являющейся предрасполагающим фактором возникновения кишечного дисбиоза. При прогрессировании дисбиотических процессов в слизистой оболочке прослеживаются морфологические изменения эпителия: снижение серотонинпродуцирующих ЕСклеток, что способствует угнетению перистальтики, возрастает количество воспалительных клеток, инфильтрирующих эпителиальный пласт эозинофилов, лимфоцитов, плазмоцитов, нейтрофилов, фибробластов стромы, уменьшается количество лаброцитов, продуцирующих гистамин, что приводит к отеку и дальнейшей инфильтрации соединительной ткани клеточными элементами [13, 14]. Возможно, это способствует формированию рефрактерных к медикаментозной терапии клинических типов ВЗК.
Таким образом, у обследованных больных ВЗК имелась генетическая предрасположенность к нарушению микробиоценоза кишечника, связанная с изменением экспрессии tollподобных рецепторов (TLR3 и TLR4). При этом сочетание полиморфизма TLR3 с изменениями микрофлоры кишечника свидетельствует о преобладании избыточного иммунного ответа на антигены облигатных и факультативных бактерий у больных НЯК. В то же время у пациентов с БК преобладание полиморфизма TLR4 в сочетании с наличием условнопатогенной микрофлоры в кишечнике может отражать снижение реактивности к кишечным патогенам.
1. Григорьев А.В. Желудочнокишечный тракт как среда обитания бактерий. Раздел 1. Морфология желудочнокишечного бактериального биотопа. — Москва; Киев, 2004. — 95 с.
2. Дисбиоз кишечника: Руководство по диагностике и лечению / Под ред. Е.И. Ткаченко, А.Н. Суворова. — СПб.: Спецлит, 2007. — 238 с.
3. Дубинин А.В., Бабин В.Н., Раевский П.М. Трофические и регуляторные связи макроорганизма и микрофлоры // Клиническая медицина. — 1991. — № 7. — С. 2428.
4. Дорофеев А.Э., Звягинцева Т.Д., Харченко Н.В. Заболевания кишечника. — Горловка: ПП «Видавництво Ліхтар», 2010. — 532 с.
5. Ардатская М.Д. Диагностическое значение короткоцепочечных жирных кислот при синдроме раздраженного кишечника // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2000. — № 3. — С. 3641.
6. Ардатская М.Д. Дисбактериоз кишечника // Materia Medica. — 2003. — № 2–3. — С. 28.
7. Крючко Т.О. и др. Генетичний поліморфізм Tollподібного рецептора 4 у дітей з атопічною бронхіальною астмою // Клиническая иммунология. Аллергология. Инфектология. — 2011. — № 5. — С. 5254.
8. Толстопятова М.А., Буслаева Г.А., Козлов И.Г. Роль рецепторов врожденного иммунитета в развитии инфекционной патологии у новорожденных детей // Педиатрия. — 2009. — Т. 87, № 1. — С. 115120.
9. Moser M. Dendritic cell regulation of TH1/TH2 development / M. Moser, K.M. Murphy // Nat. Immunol. — 2000. — Vol. 1. — P. 199205.
10. Schwartz D. The Genetics of Innate Immunity / David A. Schwartz // CHEST. — 2002. — Vol. 121. — P. 6268.
11. The TollLike Receptor 4 Asp299Gly and Thr399Ile Polymorphisms Influence the Late Inflammatory Response in Human Endotoxemia / C. Marsik, B. Jilma, C. Joukhadar et al. // Clinical Chemistry. — 2005. — Vol. 51, № 11. — Р. 21782180.
12. Functional Consequences of Tolllike Receptor 4 Polymorphisms / B. Ferwerda, M.B. McCall, K. Verheijen, B.J. Kullberg // Mol. Med. — 2008. — Vol. 14, № 56. — Р. 346352.
13. Garcia Rodriguez С. Tolllike receptor 4 dependent pathways as sensors of endogenous «danger» signals. New evidences and potential therapeutic targets / C. Garcia Rodriguez // Inmunologia. — 2007. — Vol. 26, № 4. — Р. 210215.
14. Medzitov R. Tolllike receptors and innate immunity // Nature Rev. Immunol. — 2001. — 1. — 136144.
15. Harju K., Glumoff V., Hallman M. Ontogeny of TLR2, TLR4 in mice // J. Pediatr. Res. — 2001. — 49. — 8183.
16. Brikos C., O’Neill L.A. Signaling of tolllike receptors // Handb. Exp. Pharmacol. — 2008. — V. 183. — P. 2150.
17. Akira S., Takeda K. Tolllike receptors in innate immunity // Immunology. — 2005. — 17(1). — 114.