Газета «Новости медицины и фармации» Гастроэнтерология (478) 2013 (тематический номер)
Вернуться к номеру
Перспективы использования новой методики ультразвукового исследования желудка с питьевой нагрузкой в диагностике функциональной диспепсии
Авторы: Куглер Т.Е. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
В статье представлены результаты оценки моторноэвакуаторной и сенсорной функций желудка при помощи проведения УЗИтеста с питьевой нагрузкой у пациентов с функциональной диспепсией в сравнении с группой контроля. Было проведено клиническое, лабораторное и инструментальное обследование больных с функциональной диспепсией. Исследование аккомодационной и эвакуаторной функций проводилось путем измерения площади сечения свода желудка во время и после питьевой нагрузки. При этом оценивалась интенсивность болевого синдрома по трехбалльной визуальноаналоговой шкале. Было выявлено, что у пациентов с функциональной диспепсией наблюдаются статистически значимое уменьшение аккомодации желудка, задержка эвакуации и понижение порога болевой чувствительности (p < 0,05).
Введение
Функциональные заболевания желудочнокишечного тракта являются актуальной проблемой современной гастроэнтерологии, поскольку симптомы диспепсии — одна из наиболее частых причин обращения за медицинской помощью. Как известно, диспепсия не является специфичным синдромом и может встречаться при различной патологии желудочнокишечного тракта (ЖКТ), как структурной, так и функциональной. По данным исследования H. Suzuki и соавторов (2013), примерно у 75 % пациентов с диспепсией при проведении фиброэзогастродуоденоскопии не обнаруживают патологических изменений [7]. Большинство из них рассматриваются как пациенты, страдающие функциональной диспепсией (ФД), которая в МКБ 10го пересмотра выделена в отдельную нозологическую форму под шифром К30.
Функциональная диспепсия является чрезвычайно распространенным заболеванием и встречается у 15–20 % населения [9]. Сравнительные показатели распространенности ФД у мужчин и женщин, приводимые в литературе, неоднозначны. Все же в настоящее время преобладает точка зрения, что, в отличие от таких функциональных расстройств, как синдром раздраженного кишечника, синдром функциональной абдоминальной боли, функциональные запоры и др., которые чаще встречаются у женщин, показатели распространенности ФД среди мужчин и женщин существенно не различаются [3].
Пациенты с ФД имеют обычную продолжительность жизни, но качество ее значительно снижается. Степень социальной дезадаптации при ФД близка к таковой у пациентов с бронхиальной астмой и воспалительными заболеваниями кишечника [1, 2]. Это сопряжено с огромными расходами, которые несет здравоохранение любой страны по обследованию и лечению таких больных. Почти 25 % больных ФД обращаются к врачу более 4 раз в год. Пациенты с ФД в 2,6 раза чаще берут больничный лист по сравнению с другими работниками и пребывают в течение года на больничном листе на 3–4 недели больше по сравнению со средними показателями, рассчитанными для всего населения [3].
В соответствии с Римскими критериями III (2006), диагноз ФД правомочен при наличии у пациента как минимум одного из следующих, длящихся не менее 3 последних месяцев и возникших впервые не менее полугода назад симптомов: чувства переполнения после еды, тревожащего больного; раннего насыщения; эпигастральной боли; эпигастрального жжения. При этом указывается, что обязательно должны отсутствовать органические, системные или метаболические заболевания, которые могли бы сопровождаться аналогичными симптомами. В современной классификации клинические формы ФД сведены к 2 ее вариантам: постпрандиальному дистресссиндрому (ПДС) и эпигастральной боли (ЭБ). Возможно сочетание ПДС с ЭБ у одного и того же пациента, а также трансформация одной формы ФД в другую [1].
Установлено, что в основе развития ФД лежит взаимодействие нескольких патологических процессов, но причины, их формирующие, малоизучены. Одним из важнейших патогенетических факторов ФД служат различные расстройства двигательной функции желудка и двенадцатиперстной кишки (ДПК). Однако, рассматривая изменения моторноэвакуаторной функции, необходимо разграничивать нарушение тонуса желудка, ДПК, работы сфинктерного аппарата (гипо или атония, гипертонус или спазм, дисмоторика, проявляющаяся нарушением координации сократительной активности) и эвакуации (замедление или ускорение эвакуации, гастро или дуоденостаз, ретроградная перистальтика, рефлюксы). Существуют различные комбинации данных нарушений. Так, например, спазм привратника может сочетаться с дуоденостазом и замедлением эвакуации при нормальной сократительной активности желудка, а снижение тонуса желудка — с повышенной сократительной активностью ДПК, дуоденогастральным рефлюксом и нормальной эвакуацией. Нарушение каждого компонента двигательной активности желудка приводит к появлению соответствующей клинической симптоматики. Расстройства аккомодации желудка (способности фундального отдела желудка расслабляться после приема пищи) приводят к быстрому попаданию пищи в антральный отдел желудка, его растяжению и появлению чувства раннего насыщения. Ослабление моторики антрального отдела желудка и нарушение антродуоденальной координации вызывают чувство тяжести и переполнения в эпигастрии после приема пищи. Данные нарушения наиболее характерны для постпрандиального дистресссиндрома. Существенное место в патогенезе ФД занимает повышенная чувствительность рецепторного аппарата стенки желудка и ДПК к растяжению (так называемая висцеральная гиперчувствительность). Установлено, что у таких больных боли в эпигастральной области возникают при значительно меньшем повышении внутрижелудочного давления по сравнению со здоровыми лицами [3].
Исследование моторноэвакуаторной и сенсорной функций желудка доступно в клинической практике, однако не существует золотого стандарта, т.к. используемые методы имеют ряд недостатков. Желудочный баростаттест не используется широко, поскольку процедура является инвазивной. На результаты электрогастрографии четко влияет расположение электродов, гиперсекреция кислоты или дуоденогастральный рефлюкс дают погрешности при измерении. Рентгенологический метод и сцинтиграфия желудка с изотопами технеция (99Tc) или индия (111In) не могут быть повторены многократно для изучения процесса в динамике вследствие лучевой нагрузки. Видеоэндоскопическая капсула является очень дорогостоящим методом и не применима в рутинной практике. 13Сдыхательные тесты для исследования моторноэвакуаторной функции желудка доступны только в специализированных клиниках [4, 6].
Целью данной работы было выявить различия между показателями моторноэвакуаторной и сенсорной функций желудка в норме и у пациентов с ФД при помощи проведения УЗИтеста с питьевой нагрузкой.
Материалы и методы
В данное исследование был включен 81 пациент с диагнозом ФД. С учетом клинической симптоматики больные были поделены на три группы согласно Римским критериям III. Первую группу составили 37 (46,0 %) пациентов с ПДС, вторую — 23 (29,0 %) пациента с сочетанным вариантом ЭБ и ПДС, третью — 21 (25,0 %) пациент с синдромом ЭБ. Возрастные пределы исследуемой группы больных составили 24–76 лет (в среднем 51,4 ± 12,2 года). Среди обследованных мужчин было 40 (49,4 %), а женщин — 41 (50,6 %).
Клиническое обследование больных проводилось с использованием методики, включающей сбор жалоб по всем органам и системам, анамнеза заболевания, анамнеза жизни, характера питания, объективное физикальное обследование (осмотр, перкуссия, пальпация, аускультация). Кроме уточнения и детализации жалоб, выявлялись «тревожные» симптомы для исключения альтернативного диагноза: возраст 50 лет и старше, примеси крови в кале, необъяснимая потеря массы тела, отсутствие аппетита, ночные позывы к дефекации, лихорадка. Инструментальные и лабораторные методики служили для исключения органической патологии в процессе дифференциальной диагностики, а также выявления клиникопатогенетических особенностей различных форм ФД.
Для оценки моторики желудка и показателей висцеральной гиперчувствительности был разработан УЗИтест с питьевой нагрузкой. На данном этапе в исследование были включены 25 человек. В качестве нормы были приняты результаты обследования группы контроля, состоящей из здоровых добровольцев. При сравнении обследуемых в группе контроля и ФД не было выявлено статистически значимых отличий распределения по полу, возрасту, ИМТ, росту и весу, следовательно, эти группы можно считать идентичными: группа контроля состояла из 10 человек (2 мужчин и 8 женщин), средний возраст которых составил 39,2 ± 14,8 года (18–59 лет), а средний ИМТ — 22,8 ± 4,3 кг/м2, группа ФД состояла из 15 человек (1 мужчина и 14 женщин), средний возраст — 44,3 ± 19,9 года (18–69 лет), а средний ИМТ — 24,8 ± 6,3 кг/м2. Во время проведения УЗИ желудка с питьевой нагрузкой обследуемые пили по 200 мл минеральной воды без газа из пластикового стакана на каждом этапе. Исследование аккомодационной и эвакуаторной функций осуществлялось путем измерения врачом функциональной диагностики (со стажем работы более 10 лет) площади сечения свода желудка до питьевой нагрузки, после каждых 200 мл воды с интервалом в 3 мин, всего — 5 раз (1000 мл), а также через 5, 10 и 15 минут после окончания питьевой нагрузки на ультразвуковом аппарате Ultima PA (датчик 1–5 МГц). Во время исследования фиксировались ощущения тяжести, дискомфорта или боли, возникающие на различных временных этапах. Интенсивность болевого синдрома оценивалась по трехбалльной визуальноаналоговой шкале, где 0 — отсутствие симптомов, 1 балл — незначительный дискомфорт, 2 балла — умеренная интенсивность боли, 3 балла — выраженный болевой синдром.
Статистическая обработка данных проводилась с использованием методов описательной статистики (среднее значение ± стандартное отклонение) в программе Microsoft Excel, посредством сравнения средних для двух независимых выборок при помощи параметрических тестов и сравнения центров при помощи непараметрических тестов в программе Medstat. Результаты, полученные при p < 0,05, считались статистически значимыми.
Результаты и обсуждение
Во время проведения УЗИ желудка с питьевой нагрузкой изучались аккомодационная, эвакуаторная и сенсорная функции желудка. В начале исследования аккомодационной способности желудка в группах сравнения статистически значимой разницы не было. До выполнения питьевой нагрузки средняя площадь сечения свода желудка в группе контроля составила 8,64 ± 1,78 см2, в группе ФД — 8,98 ± 1,80 см2, p = 0,650, после питьевой нагрузки 200 мл воды — 12,21 ± 2,94 см2 против 11,9 ± 2,1 см2, p = 0,759, после 400 мл — 18,57 ± 4,60 см2 против 15,76 ± 2,14 см2, p = 0,097, после 600 мл — 25,75 ± 5,92 см2 против 21,37 ± 3,00 см2, p = 0,052, после 800 мл — 31,21 ± 7,69 см2 против 25,70 ± 4,21см2, p = 0,060. Средняя площадь сечения свода желудка после 1000 мл воды была достоверно ниже в группе ФД (29,34 ± 4,90 см2) по сравнению с контрольной группой (34,92 ± 7,20 см2, p = 0,031), что свидетельствует об уменьшении аккомодационной способности желудка (рис. 1).
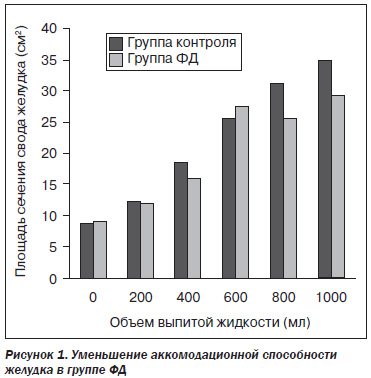
Распространенность нарушения аккомодации — одного из основных патофизиологических механизмов развития симптоматики у пациентов с ФД — достигает 40 %. Механизм нарушения аккомодации желудка до конца не ясен, но высказываются предположения о связи с n.vagus. Так как блуждающий нерв несет парасимпатические волокна ко всем органам грудной полости и большинству органов брюшной, то его раздражение может вести к брадикардии, бронхо и эзофагоспазмам, к усилению перистальтики, к повышению секреции желудочного и дуоденального сока. Снижение функции n.vagus ведет к расстройствам дыхания, тахикардии, угнетению ферментативной деятельности пищеварительного тракта [6, 9].
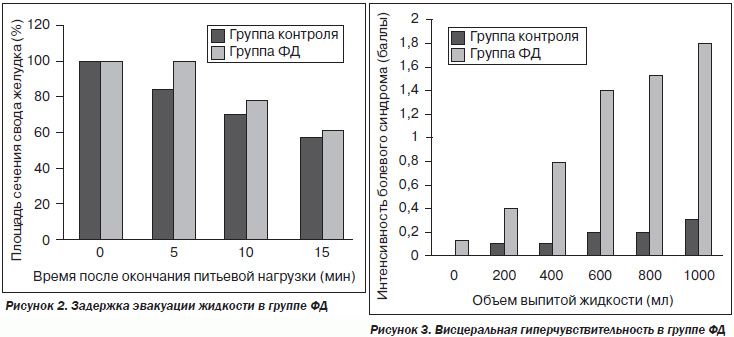
В группе ФД также наблюдалась резкая задержка эвакуации. Процент от площади поперечного сечения свода желудка через 5 минут после окончания питьевой нагрузки в группе ФД составил 100,4 ± 15,1 %, а в группе контроля — 83,47 ± 8,44 %, что достоверно выше, т.к. средние значения отличаются на уровне значимости p = 0,002. Процент от площади сечения свода желудка через 10 минут в группе ФД составил 78,2 ± 16,7 %, а в группе контроля — 69,4 ± 8,8 %, p = 0,131; через 15 минут — 61,46 ± 13,80 и 57,4 ± 9,2 % соответственно, р = 0,426 (рис. 2). Из этого следует, что в дальнейшем время проведения исследования можно сократить и производить оценку только через 5 минут после окончания питьевой нагрузки, учитывая, что разница на этом этапе статистически значима.
В зависимости от исследования распространенность задержки эвакуации колеблется от 20 до 50 %. Различия, вероятно, связаны с тем, что основная часть исследований имела небольшой объем. В метаанализе, в который были включены 868 пациентов с ФД и 397 здоровых лиц в качестве группы контроля, задержка эвакуации была выявлена у 40 % пациентов группы ФД [6, 9].
При исследовании висцеральной чувствительности результаты сравнения значительно отличались между группой ФД и контроля на каждом этапе исследования, а после питьевой нагрузки 400 мл воды разница была статистически значима (после 200 мл — 0,40 ± 0,63 против 0,10 ± 0,31, р = 0,189; после 400 мл — 0,80 ± 1,01 против 0,10 ± 0,31, р = 0,047; после 600 мл — 1,40 ± 1,05 против 0,20 ± 0,42, р = 0,004; после 800 мл — 1,53 ± 1,12 против 0,20 ± 0,42, р = 0,04; после 1000 мл — 1,80 ± 1,08 против 0,30 ± 0,48, р = 0,02), что свидетельствует о висцеральной гиперчувствительности в группе ФД (рис. 3).
Результаты многочисленных исследований подтвердили, что повышенная чувствительность рецепторного аппарата стенки желудка и ДПК к растяжению является одним из механизмов патогенеза ФД. Распространенность висцеральной гиперестезии, по данным разных исследований, составляет от 34 до 66 %. Висцеральные ощущения передаются из кишечника в ЦНС через афферентные нервы, идущие через спинной мозг. Исследования, посвященные реакции ЦНС на растяжение рецепторного аппарата стенки желудка и ДПК, показали, что у пациентов с ФД эта реакция значительно выше нормы [8, 9].
Выводы
Недостаточная выявляемость, трудности объективной и дифференциальной диагностики, значительный социальноэкономический ущерб являются отражением сложной, неоднозначной и далекой от окончательного понимания природы функциональной патологии ЖКТ. Учитывая вышеизложенное, очевидно, насколько важно проведение новых экспериментальных и клинических исследований, тщательное изучение клиникопатогенетических особенностей ФД.
Разработанный нами УЗИтест с питьевой нагрузкой является безопасным, неинвазивным методом, который не несет лучевой нагрузки и не требует применения химических веществ. Во время исследования питьевая нагрузка осуществляется через равные промежутки времени, позволяя отследить динамику изменения площади сечения проксимального отдела желудка на каждом этапе. Такой подход позволяет одновременно дать оценку аккомодационной, эвакуаторной и сенсорной функциям желудка, интерпретировать клинические проявления с точки зрения патофизиологической классификации, следовательно — адекватной коррекции. Несмотря на большое количество лекарственных препаратов, корригирующих моторику, представленных на нашем рынке, они назначаются практически вслепую, так как у лечащего врача нет данных о моторной функции верхних отделов желудочнокишечного тракта в норме и при патологии, при проведении лечения. УЗИ желудка с питьевой нагрузкой позволяет дифференцировать здоровых лиц и пациентов с функциональной диспепсией, независимо от ее подтипа. Немаловажно, что данная методика не является высокозатратной, что позволяет ее использовать в рутинной практике в любом медицинском учреждении: от амбулатории до высокоспециализированных клинических центров.
1. Дорофеев А.Э., Томаш О.В., Руденко Н.Н. Функциональная диспепсия: современные представления, механизмы и тактика ведения пациентов // Новости медицины и фармации («Гастроэнтерология»). — 2012. — С. 407.
2. Звягинцева Т.Д. Функциональная диспепсия // Ліки України. — 2011. — № 4(150). — С. 1824.
3. Ивашкин В.Т., Шептулин А.А., Лапина Т.Л., Картавенко И.М. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению функциональной диспепсии // РЖГГК. — 2012. — Т. 22, № 3. — С. 8092.
4. Швец Н.И., Бенца Т.М. Синдром нарушения моторики верхних отделов пищеварительного тракта в практике терапевта: диагностика и лечение // Новости медицины и фармации («Гастроэнтерология»). — 2010. — № 323.
5. Drossman D.A. The functional gastrointestinal disorders and the Rome III process // Gastroenterol. — 2006. — Vol. 130. — № 5. — Р. 13771390.
6. Hata T., Kato M., Nishida M. Pathophysiological classification of Functional Dyspepsia using a Novel DrinkingUltrasonography Test // Digestion. — 2010. — Vol. 82. — P.162166.
7. Suzuki H., Moayyedi P. Helicobacter pylori infection in functional dyspepsia // Nat. Rev. Gastroenterol. Hepatol. — 2013. — Vol. 10. — P. 168174. doi:10.1 038/nrgastro.2013.9.
8. Van Oudenhove L. et al. Regional brain activity in functional dyspepsia: a H2(15)OPET study on the role of gastric sensitivity and abuse history // Gastroenterology. — 2010. — Vol. 139. — P. 3647.
9. Vanheel H., Farré R. Changes in gastrointestinal tract function and structure in functional dyspepsia // Nat. Rev. Gastroenterol. Hepatol. — 2013. — Vol. 10. — P. 142149. doi:10.1038/nrgastro.2012.255.