Газета «Новости медицины и фармации» Гастроэнтерология (478) 2013 (тематический номер)
Вернуться к номеру
Нарушение моторики верхних отделов кишечника при сахарном диабете
Авторы: Дорофеев А.Э., Богатырев А.Б. - Кафедра внутренней медицины № 2 Донецкого национального медицинского университета им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Сахарный диабет (СД) является серьезной медикосоциальной проблемой в силу своей высокой распространенности, сохраняющейся тенденции к увеличению количества больных и хронического течения, определяющего кумулятивный характер заболевания. В 2012 г., согласно данным Международной федераци диабета (IDF), 371 млн человек в мире страдали СД, не учитывая пациентов моложе 20 лет, при этом ежегодно от этого недуга погибает около 4,8 млн. В Украине зарегистрировано более 1,3 млн больных СД (около 2 % всего населения), при этом эпидемиологическими исследованиями показано, что истинная заболеваемость в 2–3 раза больше. Чем же опасен СД? Прежде всего полиорганностью поражений, а также таким ранним и частым осложнением, как диабетическая нейропатия [2, 4]. Она встречается у 90–100 % больных СД, а в некоторых случаях предшествует появлению клинических признаков СД. Диабетическая автономная нейропатия (ДАН) обычно сопутствует соматической, но иногда ее проявления выходят на первый план. Одной из форм ДАН, согласно клинической классификация ДАН (P. Kempler, 2002 г., в модификации), является гастроинтестинальная, которая может проявляться такими нарушениями со стороны верхних отделов желудочнокишечного тракта (ЖКТ), как вкусовая гиперсаливация, рефлюксэзофагит, дисфагия, гипо и атония пищевода, желудка (гастропарез) [2].
Основной причиной этих патологических проявлений является гипергликемия, в условиях которой реализуются нарушения моторноэвакуаторной функции ЖКТ. По данным различных источников, частота гастроэзофагеальной рефлюксной болезни (ГЭРБ) при СД выше, чем у пациентов без СД (18,8–26,7 % по сравнению с 10–17 %) [4]. Получены доказательства того, что ГЭРБ чаще встречается при СД 2го типа в сравнении с СД 1го типа (31,1 % по сравнению с 19,6 %), а кетоацидоз способствует этому развитию. Особенностью течения ГЭРБ у пациентов с СД является мало или бессимптомный характер, что объясняется наличием нейропатии. Наличие последней приводит к снижению давления желудочного сфинктера (гипергликемия увеличивает время «переходных расслаблений» сфинктера пищевода); уменьшению амплитуды и частоты перистальтических волн и возрастанию асинхронных и неэффективных волн пищеводных сокращений; к запаздыванию желудочной секреции. Учитывая, что 80 % пациентов с СД 2го типа имеют избыточную массу тела, следует обратить внимание на то, что эта категория пациентов подвержена развитию частых эпизодов рефлюкса в сравнении с пациентами с нормальной массой тела [4]. Интересны результаты метаанализа, которые обнаружили факт низкой чувствительности (29 %) изжоги как диагностического критерия ГЭРБ у пациентов с выраженным ожирением и неудовлетворительной компенсацией углеводного обмена. У этих пациентов бессимптомное течение ГЭРБ при наличии анормальной экспозиции кислоты в пищеводе в ходе проведения рНметрии и/или наличие эзофагита было более распространенным явлением, чем течение заболевания с очерченной клинической симптоматикой [3]. Для объяснения увеличения риска развития ГЭРБ у этих пациентов было предложено несколько гипотез. В частности, утверждалось, что высокий индекс массы тела и увеличение длины окружности талии связаны с увеличением внутрибрюшного давления и гастроэзофагеального градиента давления — фактора риска развития рефлюксов [6]. У 75–80 % пациентов с СД именно неудовлетворительные показатели компенсации углеводного обмена приводят к формированию диабетической гастропатии (ДГ). Под термином «диабетическая гастропатия» понимают комплекс нейромышечных расстройств в гастродуоденальной зоне у больных СД, включающий нарушение сократительной функции желудка и проявляющийся электрической нестабильностью, которая характеризуется желудочной дизритмией, гастропарезом, снижением двигательной активности антрального отдела желудка и его дилатацией, антродуоденальной дискоординацией, что приводит к развитию желудочной дисфункции — синдрому диспепсии [1]. В настоящее время механизм развития ДГ продолжает оставаться предметом острых дискуссий. На сегодня это состояние рассматривается как мультифакторное, являющееся следствием автономной нейропатии, микроангиопатии и прогрессирующей дегенерации нейромышечного проведения в желудке. Однако подобно таким осложнениям, связанным с СД, как нейропатия, ретинопатия и периферическая нейропатия, предполагается существование нескольких механизмов, ответственных за возникновение ДГ: автономная нейропатия, постпрандиальное влияние гормонов и «токсическое» действие глюкозы. С открытием клетокпейсмейкеров (КП) в теле желудка, расположенных вдоль большой кривизны, деятельность которых контролируется n. vagus и не связана с приемом пищи, стало более понятным возникновение и прогрессирование нарушений моторики у пациентов с СД. Установлено, что КП способны генерировать медленные волны — slow waves (SW). Ритм SW координирует перистальтическую активность желудка. У пациентов с СД ритм SW коррелирует с желудочной дизритмией. КП являются не только пейсмейкерами, но и посредниками нейромышечного проведения, а также имеют специфическую чувствительность к оксиду азота (NO) через активацию их внутриклеточного циклического гуанозинмонофосфата (цГМФ). Повреждение или снижение активности NOзависимых нейрональных клеток желудка или КП, возможно, изменяет коммуникацию нейромышечного проведения, приводя к развитию апоптоза. В этом случае сокращение NOзависимой нейротрансмиссии, вероятно, является критическим и обусловливает потерю координированного механического ответа гладкой мускулатуры у больных СД [3]. У пациентов с СД регистрируются изменения постпрандиальных эффектов гормонов — глюкагона и гастроинтестинальных пептидов (АРUDсистема).
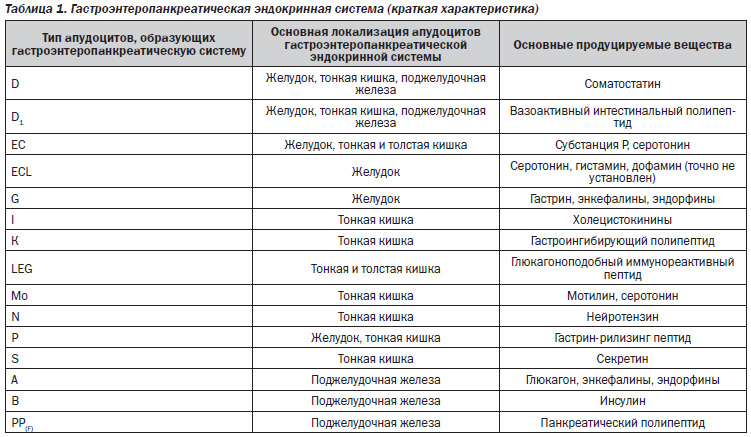
APUDсистема (APUD — аббревиатура, образованная из первых букв англ. слов amines — амины, precursor — предшественник, uptake — усвоение, поглощение, decarboxylation — декарбоксилирование; синоним — диффузная нейроэндокринная система) — система клеток, способных к выработке и накоплению биогенных аминов и/или пептидных гормонов и имеющих общее эмбриональное происхождение. APUDсистему составляют около 40 типов клеток, обнаруживаемых в центральной нервной системе (гипоталамусе, мозжечке), железах внутренней секреции (гипофизе, шишковидном теле, щитовидной железе, островках поджелудочной железы, надпочечниках, яичниках), в желудочнокишечном тракте, легких, почках и мочевых путях, параганглиях и плаценте. Предполагают, что единым эмбриональным предшественником клеток APUDсистемы является так называемый нейроэндокриннопрограммированный эпибласт. Кроме способности к синтезу биогенных аминов (катехоламинов, серотонина, гистамина) и физиологически активных пептидов, клетки APUDсистемы апудоциты имеют еще одну общую черту — наличие в них особого фермента нейронспецифической енолазы. Апудоциты располагаются диффузно или группами среди клеток других органов.
Созданию концепции APUDсистемы способствовало одновременное обнаружение в пептидпродуцирующих эндокринных клетках и нейронах большого числа пептидов, играющих роль нейромедиаторов или секретирующихся в кровоток как нейрогормоны. Было установлено, что биологически активные соединения, вырабатываемые клетками APUDсистемы, выполняют эндокринную, нейрокринную и нейроэндокринную функции. При выделении пептидов, образующихся в апудоцитах, в межклеточную жидкость они выполняют паракринную функцию, оказывая влияние на соседние клетки.
Наиболее изученной является APUDсистема желудочнокишечного тракта и поджелудочной железы, объединяемая в отдельную гастроэнтеропанкреатическую эндокринную систему, на долю которой приходится около половины всех апудоцитов (табл. 1).
Клетки этой системы могут быть экзокринными клетками открытого типа (их апикальные концы достигают просвета желудочнокишечного тракта), реагирующими на пищевые раздражители и изменения рН содержимого желудочнокишечного тракта количественным и качественным изменением секреции. Клетки гастроэнтеропанкреатической системы, являющиеся клетками закрытого типа, не имеют выхода в просвет желудочнокишечного тракта и реагируют на физические (растяжение органа, давление, температура) и химические факторы.
Таким образом, при СД происходит нарушение секреции — секретина, вазоактивного интестинального пептида, реализуемые посредством нейротрансмиттеров. Эти обстоятельства подводят к вариабельным «желудочным» ответам на различные пищевые провокации и снижают моторноэвакуаторную функцию желудка. Причиной нейромышечных расстройств может быть «токсичность» глюкозы. Гипергликемия воздействует на внутриклеточные метаболические пути и функцию мембран нервных окончаний. После изучения эффектов гипергликемии у здоровых лиц и пациентов с СД стало очевидным, что сокращения антрального отдела желудка в постпрандиальный период были значительно снижены в течение всего времени индуцированной гипергликемии. На сегодня известно, что на двигательную активность желудка влияет не только хроническая, но и острая гипергликемия. Было показано, что наиболее тяжелые нейромышечные расстройства, связанные с ДГ, являются проявлением гастропареза, который диагностируется при документированном замедленном опорожнении содержимого желудка. Предполагается, что гастропарез возникает в результате сниженной двигательной активности желудка и антродуоденальной дискоординации, однако автономная нейропатия не может считаться абсолютным предиктором гастропареза [8]. Такие симптомы, как абдоминальная боль, ощущение «переполнения», тошнота и рвота, встречаются у пациентов с СД 1го и 2го типа. По данным K.L. Koch, 76 % больных СД испытывают такие постоянные или периодические проявления синдрома диспепсии, как раннее насыщение и чувство распирания после еды. В то же время не менее 50 % больных СД 1го типа имеют замедленную желудочную эвакуацию. Тошнота и рвота — наиболее часто встречаемые симптомы у пациентов с ДГ. Помимо них, нередко отмечается ощущение переполнения в верхней части живота или вздутие, а также эпигастральная боль или эпигастральное жжение, которое воспринимается как неприятное субъективное ощущение жара. Перечисленные симптомы чаще возникают после приема густой пищи (постпрандиальный диспептический синдром). У некоторых пациентов, имеющих замедленную желудочную эвакуацию, возможно бессимптомное течение ДГ. Прогрессированию ДГ способствует неадекватная компенсация углеводного обмена. Некоторые пациенты испытывают эпизоды гипогликемии вследствие замедленной желудочной эвакуации, длительное существование которой может привести к развитию осложнений. Наиболее частое осложнение диабетического гастропареза — синдром спонтанного бактериального роста и формирование безоара, которые возникают на фоне сниженной иммунологической реактивности больных СД. Как правило, эта клиническая ситуация протекает бессимптомно, однако в случае локализации безоара в дистальных отделах желудка он блокирует поступление пищи в тонкий кишечник [5]. Вместе с тем показано, что далеко не все больные СД с клиническими проявлениями синдрома диспепсии могут иметь гастропарез, поэтому другие причины, имеющие отношение к нарушению эвакуаторной функции желудка (действие лекарственных препаратов, беременность, заболевания центральной нервной системы, другие регуляторные пептиды), также должны учитываться при постановке диагноза ДГ.
Следовательно, можно сделать вывод, что при нарушении моторики верхних отделов кишечника недостаточно глубоко исследована взаимосвязь регуляторных пептидов, секреции инсулина и уровень гипогликемии на ранних стадиях СД.
1. Ивашкин В.Т., Шептулин А.А. Методические рекомендации по обследованию и лечению больных с нарушениями двигательной функции желудка. — М., 2008.
2. Лейтес Ю.Г., Невмержицкий В.И., Клефортова И.И. Моторноэвакуаторные нарушения верхних отделов пищеварительной системы как проявление автономной нейропатии у больных сахарным диабетом 1 типа // Сахарный диабет. — 2007. — № 2. — С. 2532.
3. Hasler W.L. Gastroparesis — current concepts and considerations // Medscape J. Med. — 2008. — Vol. 10, № 1. — Р. 16. Review.
4. Jacobson B.C., Somers S.C., Fuchs C.S. et al. Bodymass index and symptoms of gastroesophageal reflux in women // N. Engl. J. Med. — 2006. — Vol. 354. — P. 23402348.
5. Mason R.J., Lipham J., Eckerling G. et al. Gastric electrical stimulation an alternative surgical therapy for patients with gastroparesis // Arch. Surg. — 2005. — Vol. 140, № 9. — Р. 841846.
6. Ortiz V., Ponce M., Fernandez A. et al. Value of heartburn for diagnosing gastroesophageal reflux disease in severely obese patients // Obesity. — 2006. — Vol. 14. — P. 696700.
7. Pandolfino J.E., ElSerag H.B., Zhang Q. et al. Obesity: a challenge to esophagastric junction integrity // Gastroenterology. — 2006. — Vol. 130. — P. 639649.
8. Punkkinen J., Frkkilа М., Mtzke S. et al. Upper abdominal symptoms in patients with Type 1 diabetes: unrelated to impairment ingastric emptying caused by autonomic neuropathy // Diabet. Med. — 2008. — Vol. 25. — Р. 570577.
9. Szarka L.A., Camilleri M.D. Stomach dysfunction in diabetes mellitus: emerging technology and pharmacology // J. Diabetes Sci. Technol. — 2010. — Vol. 4, № 1. — P. 180189.
10. Ya О., Babak Е.V. Kolesnikova Pathology of the upper gastrointestinal tract and diabetes: where the threat for a patient is hidden? // УТЖ. — 2012. — № 2.