Газета «Новости медицины и фармации» 20-22 (477, 483-484) 2013
Вернуться к номеру
Диагностика и лечение бронхиальной астмы. Сообщение 1
Авторы: Дядык А.И., Ефременко В.А., Вишнивецкий И.И., Цыба И.Н., Бабанина Т.В., Щукина Е.В. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Семейная медицина/Терапия, Аллергология , Пульмонология
Разделы: Медицинское образование
Версия для печати
Бронхиальная астма (БА) характеризуется высокой распространенностью и морбидностью, что делает ее серьезной медицинской и социально-экономической проблемой. По данным эпидемиологических исследований, в мире около 300 млн человек болеют БА. Однако истинная ее распространенность значительно превышает эту цифру, так как у довольно большого количества больных заболевание диагностируется с существенным запозданием. БА болеют лица обоих полов и всех возрастных групп. Она сопровождается необходимостью постоянного медикаментозного контроля, значимыми финансовыми затратами на лечение, снижением качества жизни, потерей трудоспособности, а при неадекватных лечебных подходах — увеличением летальности. В последние десятилетия в большинстве стран (особенно с низким экономическим уровнем) отмечается увеличение распространенности БА. Вместе с тем в странах с высоким экономическим уровнем наблюдаются стабилизация распространенности заболевания и существенное снижение смертности, что объясняется определенным уменьшением загрязненности окружающей среды, своевременной диагностикой и адекватным применением высокоэффективных лечебных подходов.
Настоящий семинар посвящен вопросам диагностики, лечения и профилактики БА.
Определение
БА — хроническое воспалительное заболевание дыхательных путей, в патогенезе которого задействованы различные клеточные элементы, включая преимущественно тучные клетки, эозинофилы, Т-лимфоциты и многочисленные маркеры воспаления. Хроническое воспаление ассоциируется с развитием бронхиальной гиперреактивности, что ведет к повторным эпизодам свистящих хрипов, одышки, удушья, ощущениям сдавления грудной клетки и кашля, особенно в ночное время или ранние утренние часы. Эти эпизоды обычно сопровождаются распространенной обструкцией дыхательных путей, которая в подавляющем большинстве случаев обратима спонтанно или под влиянием лечения.
Сегодня мы располагаем убедительными доказательствами, что клинические проявления БА, включая симптоматику, нарушения сна, ограничения физической активности, нарушения дыхательной функции, могут успешно контролироваться адекватными лечебными подходами. При этом рецидивы развития симптомов заболевания существенно снижаются, а тяжелые обострения астмы наблюдаются редко.
Распространенность
Данные о распространенности БА существенно разнятся в различных сообщениях, что объясняется неоднозначными подходами к определению заболевания, его запоздалой диагностикой и значимыми отличиями частоты заболевания в различных регионах мира. В крупных эпидемиологических исследованиях распространенность БА в различных странах составляет от 1 до 18 %. Очевидно, более реальная распространенность БА среди взрослого населения может базироваться на результатах крупного эпидемиологического исследования World Health Survey, проводимого экспертами Всемирной организации здравоохранения (ВОЗ). В общей популяции среди 178 215 человек из 70 стран распространенность БА составила от 4,3 до 8,6 % (колебания зависели от используемого определения заболевания). В ряде масштабных эпидемиологических исследований показано увеличение распространенности БА во многих регионах мира (прежде всего в странах с низким социальным уровнем и загрязненной окружающей средой). В мире около 300 млн человек страдает БА, и эта цифра увеличивается на 50 % каждые 10 лет. Определенный оптимизм внушают данные о прекращении роста распространенности БА, а также существенное снижение летальности в странах с высоким социальным уровнем.
Морбидность, смертность, экономический ущерб
В проведенном экспертами ВОЗ исследовании (The Global Burden of Asthma), посвященном изучению глобального бремени БА, показано существенное увеличение распространенности, морбидности и экономического ущерба, связанного с этим заболеванием, во многих регионах мира (Африка, Азия, Латинская Америка), прежде всего в странах с низким социальным уровнем и плохими экологическими характеристиками. При этом отмечается высокий уровень запоздалой диагностики заболевания, увеличение частоты госпитализаций по поводу обострений (особенно у детей), а также летальности.
Ежегодно около 250 000 летальных исходов связано с БА. Причем летальность значительно выше в странах с низким социальным уровнем, где имеют место несвоевременная диагностика заболевания и неадекватная лечебная тактика в стабильном периоде (прежде всего ограниченное использование ингаляционных глюкокортикоидов — ИГК), а также ограниченные возможности оказания качественной помощи при обострениях.
По оценкам экспертов ВОЗ, ежегодно БА обусловливает потерю 15 млн так называемых DALY (disability adjusted life year — год жизни, потерянный в связи с нетрудоспособностью), что составляет около 1 % общего всемирного ущерба от болезней.
Существенные финансовые затраты обусловлены как прямыми медицинскими затратами на лечение БА (стоимость лекарственных препаратов, пребывание в стационарах), так и затратами, обусловленными днями нетрудоспособности и инвалидизации. В глобальном масштабе финансовые расходы на ведение больных с БА превышают таковые у больных туберкулезом и у лиц, инфицированных ВИЧ.
Этиология
БА является многофакторным заболеванием, характеризующимся сложными взаимодействиями многочисленных факторов, включая генетические, климатические особенности, загрязненность окружающей среды, социально-экономический уровень, расовую принадлежность и др.
Факторы риска БА можно разделить на обусловливающие ее развитие и/или провоцирующие обострения. Выделяют:
1) так называемые факторы макроорганизма (внутренние факторы):
— генетические:
- гены, предрасполагающие к атопии;
- гены, предрасполагающие к бронхиальной гиперреактивности;
— ожирение;
— пол (мужской в детском возрасте, женский у взрослых);
2) факторы окружающей среды (внешние факторы):
— аллергены:
- аллергены помещений (домашние клещи), шерсть домашних животных (собак, кошек, мышей), аллергены тараканов, грибы (плесневые, дрожжевые);
- наружные аллергены (пыльца, грибы — плесневые, дрожжевые);
— инфекции (преимущественно вирусные);
— профессиональные сенсибилизаторы;
— табакокурение:
- активное;
- пассивное;
— загрязнение воздуха внутри и снаружи помещений;
— особенности питания.
Патогенез
Патогенез БА представляется сложным, многогранным и недостаточно изученным. БА — воспалительное заболевание дыхательных путей, в развитии которого участвуют ряд воспалительных клеток и множество медиаторов воспаления, что приводит к характерным патофизиологическим изменениям.
Различные сочетания и сложные взаимоотношения указанных выше этиологических факторов у предрасположенных лиц обусловливают развитие хронического воспаления в дыхательных путях, сопровождающегося бронхиальной гиперреактивностью и астматическими симптомами.
Несмотря на разнообразие клинических проявлений БА и особенностей патофизиологических механизмов, хроническое воспаление дыхательных путей является фундаментальной характеристикой заболевания. При этом воспалительный процесс в дыхательных путях персистирует, даже когда симптомы заболевания эпизодические, а тяжесть астмы и интенсивность воспаления далеко не всегда коррелируют. Воспалительные процессы наблюдаются во всех отделах респираторного тракта, включая верхние дыхательные пути, нос, но более выражены в бронхах среднего калибра. Воспаление дыхательных путей присутствует при всех клинических формах БА — аллергической, неаллергической и аспириновой.
Воспалительные клетки и медиаторы воспаления
Воспаление при БА имеет ряд особенностей, характерных для аллергических заболеваний. К ним относятся наличие активированных тучных клеток, повышенное количество активированных эозинофилов и рецепторов неизмененных естественных киллерных Т-клеток, а также Т-лимфоцитов-хелперов 2-го типа (Th2), продуцирующих воспалительные медиаторы, обусловливающие развитие симптомов заболевания.
Функциональные характеристики воспалительных клеток в дыхательных путях больных БА
Тучные клетки: активированные тучные клетки слизистой высвобождают бронхоконстрикторные медиаторы (гистамин, цистеинил-лейкотриены, простагландин D2). Эти клетки активируются аллергенами посредством высокочувствительных IgE-рецепторов, а также осмотическими стимулами. Увеличенное количество тучных клеток в гладкой мускулатуре дыхательных путей обусловлено гиперчувствительным ответом дыхательных путей.
Эозинофилы, представленные в повышенных количествах в дыхательных путях, высвобождают белки, повреждающие эпителиальные клетки дыхательных путей. Они также могут играть роль в высвобождении факторов роста и ремоделировании дыхательных путей.
Т-лимфоциты, представленные в увеличенных количествах в дыхательных путях, высвобождают специфические цитокины, включая интерлейкины (Ил)-4, -5, -9 и -13, которые обусловливают эозинофильное воспаление и продукцию IgE В-лимфоцитами.
Дендритные клетки захватывают аллергены на поверхности дыхательных путей и мигрируют в региональные лимфатические узлы, где они взаимодействуют с регуляторными Т-клетками и в конечном итоге стимулируют продукцию Th2-клеток.
Макрофаги: их количество в дыхательных путях увеличено, они могут активироваться аллергенами посредством низкочувствительных IgE-рецепторов, высвобождая при этом воспалительные медиаторы и цитокины, усиливающие воспалительный ответ.
Нейтрофилы: количество их повышено в дыхательных путях и мокроте больных с тяжелой БА и курящих астматиков. Их патофизиологическая роль окончательно не установлена, а увеличенное количество, возможно, обусловлено глюкокортикоидной терапией.
Место структурных клеток дыхательных путей в патогенезе БА
Эпителиальные клетки дыхательных путей, контактируя с факторами окружающей среды (в том числе с вирусами), экспрессируют множество воспалительных протеинов, высвобождают цитокины, хемокины и липидные медиаторы.
Гладкомышечные клетки дыхательных путей экспрессируют воспалительные протеины, подобно эпителиальным клеткам.
Эндотелиальные клетки играют роль в рекрутировании из бронхиальной циркуляции воспалительных клеток в дыхательные пути.
Фибробласты и миофибробласты продуцируют такие соединительнотканные компоненты, как коллаген и протеогликаны, вовлеченные в процесс ремоделирования дыхательных путей.
Нервы дыхательных путей также участвуют в патофизиологии БА. Холинергические нервы при активации вызывают бронхоконстрикцию и секрецию слизи. Сенсорные нервы, активированные воспалительными стимулами, включая нейтрофилы, вызывают развитие рефлекторных изменений и симптомов, таких как кашель, сдавливание грудной клетки.
Ключевые медиаторы в патогенезе БА
Хемокины играют важную роль в привлечении воспалительных клеток в дыхательные пути и экспрессируются преимущественно эпителиальными клетками.
Цистеинил-лейкотриены, являющиеся потенциальными бронхоконстрикторами и провоспалительными медиаторами, продуцируются главным образом из тучных клеток и эозинофилов. Они являются единственными воспалительными медиаторами, ингибирование которых ассоциируется с улучшением легочной функции и симптомов астмы.
Цитокины индуцируют воспалительный ответ и определяют его тяжесть. Ключевыми цитокинами являются Ил-1b и фактор некроза опухоли, которые усиливают воспалительный ответ; гранулоцитарно-макрофагальный колониестимулирующий фактор пролонгирует персистенцию эозинофилов в дыхательных путях. Ил-5, продуцируемый Th2, необходим для дифференциации и выживания эозинофилов; Ил-4 играет важную роль в дифференциации Th2-клеток; Ил-13 необходим для формирования IgE.
Гистамин продуцируется тучными клетками, способствует бронхоконстрикции, определяет выраженность воспалительного ответа.
Оксид азота (NO) — активный вазодилататор, формирующийся преимущественно в результате взаимодействия индуцибельной синтазы оксида азота с эпителиальными клетками дыхательных путей.
Простагландин D2 — бронхоконстриктор, продуцируемый преимущественно тучными клетками, также рекрутирует Th2-клетки в дыхательные пути.
Таким образом, при БА наблюдается воспаление, характерное для аллергических заболеваний, с наличием активированных тучных клеток, повышенным количеством активированных эозинофилов, неизмененных естественных Т-киллеров и Th2-лимфоцитов, которые продуцируют медиаторы, обусловливающие развитие клинических проявлений заболевания. Структурные клетки дыхательных путей также продуцируют воспалительные медиаторы, что способствует персистенции воспаления. Известно, что более 100 различных воспалительных медиаторов вовлечены в развитие комплекса воспалительных процессов в дыхательных путях у больных БА.
Финальным этапом описанных патофизиологических процессов является констрикция дыхательных путей, обусловливающая клинические проявления и физиологические изменения при астме. Развитие констрикции дыхательных путей обусловлено многочисленными факторами.
Важное место в развитии и персистенции БА отводится гиперчувствительности дыхательных путей, механизмы которой изучены недостаточно. Гиперчувствительность обусловливает функциональные нарушения, приводящие к сужению дыхательных путей в ответ на различные стимулы, не оказывающие негативного влияния на здоровых людей. В свою очередь, сужение дыхательных путей ведет к вариабельным нарушениям воздушных потоков и развитию интермиттирующих симптомов. Гиперчувствительность дыхательных путей частично обратима под влиянием лечения.
Механизмами развития бронхиальной гиперреактивности являются увеличение объема и/или контрактильности гладкомышечных клеток бронхов, десинхронизация сокращений гладкой мускулатуры дыхательных путей, изменение геометрии бронхов и сенсибилизация афферентных нервов, что ведет к чрезмерному сокращению гладких мышц дыхательных путей и бронхоконстрикции. В патогенезе бронхиальной обструкции важное место также отводится отеку дыхательных путей, утолщению стенки бронхов вследствие их ремоделирования и гиперсекреции слизи.
Структурные изменения дыхательных путей
Наряду с воспалительным ответом и бронхиальной гиперреактивностью у больных БА развиваются характерные структурные изменения, часто обозначаемые как ремоделирование дыхательных путей, обусловливающее плохую обратимость бронхообструкции.
Структурные изменения характеризуются:
— субэпителиальным фиброзом, развивающимся вследствие депозиции коллагеновых фибрилл и протеогликанов под базальной мембраной и наблюдающимся у всех больных БА, включая детей, еще до развития симптомов. Фиброз наблюдается и в других слоях стенки бронхов, где он также обусловлен депозицией коллагена и протеогликанов;
— увеличением толщины гладких мышц дыхательных путей, что обусловлено как их гипертрофией (возрастание размера клеток), так и гиперплазией. Это ведет к увеличению толщины стенки дыхательных путей. Интенсивность этого процесса коррелирует с тяжестью заболевания, а его развитие обусловлено воспалительными медиаторами, например факторами роста;
— пролиферацией кровеносных сосудов в стенке дыхательных путей под влиянием таких факторов, как сосудистый эндотелиальный фактор роста. Это способствует увеличению толщины стенки дыхательных путей;
— гиперсекрецией слизи в результате увеличения числа бокаловидных клеток в эпителии дыхательных путей и размера подслизистых желез.
Патофизиологические особенности БА при ряде специфических ситуаций
Обострения астмы. Транзиторные ухудшения течения БА могут быть результатом экспозиции таких факторов риска, как чрезмерная физическая нагрузка, загрязнение воздуха и некоторые погодные факторы. Более длительные ухудшения обычно обусловлены вирусной инфекцией верхних дыхательных путей (особенно риновирусами и респираторно-синцитиальными вирусами), а также экспозицией аллергенов, усиливающих воспаление в нижних дыхательных путях (острое или хроническое), которое может сохраняться в течение дней или недель.
Ночная астма. Ухудшение астмы в ночное время связывают с циркадными ритмами циркулирующих гормонов, таких как норадреналин, кортизол или мелатонин, а также нейрогенными механизмами (ночное увеличение холинергического тонуса). В ночное время наблюдается усиление воспаления в дыхательных путях, что может быть связано со снижением эндогенных противовоспалительных механизмов.
Необратимая бронхообструкция (irre-versible airflow limitation). У части больных с тяжелой астмой развивается прогрессирующее нарушение дыхания, которое полностью необратимо под влиянием современных лечебных подходов.
БА, трудно поддающаяся лечению. Остаются неизвестными причины, почему у некоторых больных астма довольно плохо контролируется и снижена чувствительность к глюкокортикоидам. В части случаев это связано с плохой приверженностью больных к лечению. Иногда такой вариант астмы обусловлен генетическими особенностями.
Курение и астма. Табакокурение существенно затрудняет контроль БА, ассоциируется с более частыми обострениями и госпитализациями, более быстрым развитием нарушения легочной функции и повышением риска летальных исходов. У таких больных воспаление носит нейтрофил-доминирующий характер, а также отмечается плохой ответ на глюкокортикоиды.
Клиника, диагностика, классификация и лечебная тактика
Клиническая картина
Жалобы. Типичные для БА жалобы включают эпизоды одышки, свистящего дыхания, кашля (с мокротой или без таковой) и ощущение сдавления грудной клетки. Эти симптомы не являются специфическими для БА и могут наблюдаться при различных острых и хронических заболеваниях дыхательных путей. Рассматриваемые симптомы также могут наблюдаться у части больных с хроническим обструктивным заболеванием легких (ХОЗЛ), при этом дифференциальная диагностика между БА и ХОЗЛ нередко вызывает затруднения.
Некоторым пациентам затруднительно оценить тяжесть собственных симптомов, около 10 % больных во время приступа не ощущают удушья и одышки, отмечая лишь свистящее дыхание и кашель.
Для БА характерно появление симптомов после контакта с аэроаллергенами и ирритантами. Часто развивается сенсибилизация к аллергенам домашних животных, клещей, домашней пыли, тараканов. У ряда больных наблюдаются сезонные обострения БА, связанные с сенсибилизацией к пыли цветущих растений.
Кашлевой вариант БА. При кашлевом варианте БА кашель является ведущим, а в части случаев — единственным симптомом заболевания. Кашлевая БА чаще наблюдается у лиц молодого возраста и детей. При постановке диагноза у таких больных важную роль играют исследования вариабельности показателей функции легких, выявление бронхиальной гиперреактивности и определение эозинофилов в мокроте.
Кашлевой вариант БА следует отличать от ряда состояний, проявляющихся кашлем и эозинофилией мокроты. Например, при эозинофильном бронхите наблюдаются хронический малопродуктивный кашель, повышение содержание эозинофилов в мокроте или бронхиальных смывах, но показатели функции легких остаются неизменными. Также следует учитывать возможность развития кашля, индуцированного приемом ингибиторов ангиотензинпревращающего фермента, гастроэзофагеальным рефлюксом, хроническим синуситом и дисфункцией голосовых связок.
Бронхоконстрикция, индуцированная физическими нагрузками. У многих больных ведущей (а в некоторых случаях — единственной) причиной развития симптомов бронхоконстрикции является физическая активность. Постнагрузочный бронхоспазм обычно развивается через 5–10 минут после прекращения физической активности (реже — во время нагрузки), при этом у пациентов наблюдаются типичные симптомы БА или иногда упорный кашель, самостоятельно проходящий через 40–45 минут. Некоторые виды физической активности (например, бег) провоцируют бронхоспазм чаще. Он также значительно более часто наблюдается при вдыхании сухого холодного воздуха. Быстрое устранение симптомов постнагрузочного бронхоспазма после ингаляции b2-агонистов свидетельствует о наличии БА.
Таким образом, на высокую вероятность наличия БА указывают: вариабельность симптомов (одышка, свистящее дыхание, кашель, сдавление грудной клетки), развитие их при контакте с аэроаллергенами, ирритантами или после физической нагрузки, появление или ухудшение симптомов в ночные часы, эффективность антиастматической терапии (при их применении ex juvantibus).
При постановке диагноза БА важное место занимает тщательно собранный анамнез, включая ответы на следующие вопросы:
— был ли у пациента эпизод (эпизоды) свистящего дыхания?
— отмечается ли у пациента мучительный ночной кашель?
— бывают ли у пациента свистящее дыхание и/или кашель через 5–10 минут после физической нагрузки?
— наблюдаются ли у пациента свистящее дыхание, сдавление в грудной клетке или кашель после контакта с аэроаллергенами или поллютантами?
— отмечает ли пациент, что у него часто «простуда опускается в грудную клетку» или продолжается более 10 дней?
При расспросе больного и оценке медицинской документации также важно установить наличие различных факторов, способных указывать на наличие БА или усугублять ее течение. К ним следует отнести:
— патологию носа или околоносовых пазух;
— атопический дерматит/крапивницу/поллиноз;
— пищевую аллергию;
— гастроэзофагеальный рефлюкс;
— непереносимость аспирина.
Физикальное обследование
Из-за вариабельности проявлений БА симптомы заболевания дыхательной системы при физикальном обследовании часто могут отсутствовать.
Для острого приступа и обострения БА характерно наличие тахипноэ до 25–30 в минуту и тахикардии около 100 в минуту. Примерно в 25–30 % случаев частота дыхания может быть более 30 в минуту, а пульса — более 120 в минуту.
Развитие синусовой тахикардии нередко связывают с применением b2-агонистов и теофиллина для купирования обструкции. Тем не менее ведущей причиной тахикардии во время острого приступа БА является гипоксемия. Тахикардия обычно устраняется при применении b2-агонистов на фоне разрешения бронхообструкции.
Для больных с острым приступом БА характерно ослабление везикулярного дыхания, удлинение выдоха, наличие свистящих хрипов, прослушивающихся на вдохе и выдохе.
У части больных при наличии выраженной обструкции дыхательных путей свистящие хрипы могут отсутствовать или прослушиваться только на форсированном выдохе («немое легкое»). Этот феномен обусловлен тяжелыми нарушениями вентиляции. У таких больных обычно также имеют место цианоз, тахипноэ, тахикардия, сонливость, ступор, вздутие грудной клетки, участие в акте дыхания вспомогательных мышц и втяжение межреберных промежутков, парадоксальный пульс и обильное потоотделение.
Дополнительные методы диагностики и мониторирования БА
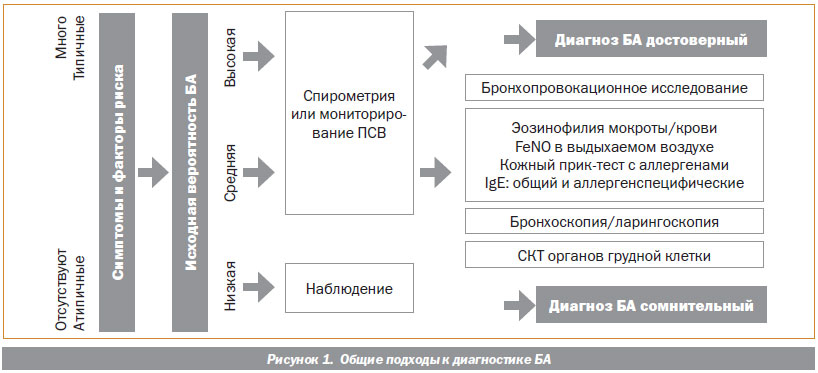
Постановка диагноза БА базируется на сочетании характерных клинических симптомов и инструментальных доказательств наличия гиперреактивности бронхов при изучении функции внешнего дыхания (ФВД). Вспомогательную роль в диагностике также имеют методы исследования, подтверждающие связь с сенсибилизацией и эозинофильным характером воспаления в дыхательных путях. Количество дополнительных методов исследования, которые следует использовать при диагностике БА, зависит от исходной, так называемой претестовой вероятности диагноза, основанной на наличии и выраженности характерных клинических проявлений. В общих чертах подходы к диагностике БА показаны на рис. 1.
У лиц с типичными клиническими проявлениями и высокой претестовой вероятностью БА изучение ФВД является необходимым не столько для подтверждения диагноза, сколько для оценки степени тяжести заболевания. У бессимптомных пациентов или у лиц с недостаточно характерными проявлениями без факторов риска (с низкой претестовой вероятностью БА) изучение ФВД и других инструментальных и лабораторных параметров не имеет существенной диагностической ценности из-за высокой частоты ложноположительных результатов. Наиболее информативны результаты дополнительных исследований у лиц со средней вероятностью наличия БА. При этом наличие признаков обратимой бронхиальной обструкции при спирометрическом исследовании или значительная вариабельность пиковой скорости выдоха (ПСВ) в течение суток являются достаточными для постановки точного диагноза БА. В случае их отсутствия при стандартном исследовании ФВД необходимо проведение бронхопровокационного тестирования, которое способно выявить ключевой признак БА — гиперреактивность бронхов.
Наличие лабораторных и инструментальных данных об эозинофильном характере воспаления в дыхательных путях (эозинофилия мокроты и крови, фракция оксида азота в выдыхаемом воздухе (FeNO)) и аллергической сенсибилизации может свидетельствовать о наличии БА. Но отрицательные результаты не позволяют исключить наличие астмы. Ряд других методов исследования (рентгенологические, эндоскопические) может представить дополнительные данные, позволяющие провести дифференциальную диагностику. Ниже представлено описание методов, используемых для диагностики и мониторирования течения БА.
Спирометрия и бронходилатационный тест. Спирометрия является методом выбора для оценки наличия, выраженности и обратимости бронхиальной обструкции. Объем форсированного выдоха за первую секунду (ОФВ1) и форсированную жизненную емкость легких (ФЖЕЛ) определяют с помощью спирометра при форсированном выдохе.
Спирометрическим критерием, подтверждающим наличие обструкции, является отношение ОФВ1/ФЖЕЛ, составляющее менее 0,7. Критерием диагностики БА также в течение длительного времени считалось наличие обратимости бронхиальной обструкции после ингаляции 400 мкг сальбутамола (т.е. после проведения бронходилатационного теста). Критерием обратимой бронхиальной обструкции считают наличие прироста ОФВ1 ≥ 12 % или ≥ 200 мл при выполнении бронходилатационного теста. Однако в последние годы в целом ряде масштабных исследований показано, что выраженный ответ на бронходилатацию (т.е. прирост ОФВ1 более 12 %, а иногда и до 30–40 %) может наблюдаться более чем у 1/3 больных ХОЗЛ. При этом обструкция является лишь частично обратимой, то есть полностью не разрешается после пробы с бронходилататором. Кроме того, примерно у 30 % больных с тяжелой или длительно текущей астмой после ингаляции сальбутамола не отмечается значительный прирост ОФВ1 и обструкция у них также является не полностью обратимой. Приведенные данные свидетельствуют, что наличие прироста ОФВ1 ≥ 12 % или ≥ 200 мл после бронходилатации не может служить надежным спирометрическим признаком БА. Достаточно характерным для БА признаком является полное устранение обструкции после ингаляции 400 мкг сальбутамола (в среднем у 2/3 пациентов).
Кроме того, результаты бронходилатационного теста не могут служить основанием для выбора бронходилатационной терапии (b2-агонисты или антихолинергические средства) из-за отсутствия соответствующей доказательной базы.
Пикфлоуметрия. Для оценки степени бронхиальной обструкции и эффективности терапии также используется пикфлоуметрия — измерение пиковой скорости выдоха (ПСВ). Обычно ПСВ измеряют утром, до приема препаратов; при этом чаще всего получают близкое к минимальному значение ПСВ. Вечером ПСВ измеряют перед сном, как правило, получая более высокие значения. Суточную вариабельность ПСВ обычно определяют следующим образом.
1. Проводят измерение ПСВ несколько раз в сутки и рассчитывают среднее значение (ПСВср). Предпочтительнее рассчитать усредненную ПСВ за 7–14 дней.
2. Рассчитывают амплитуду ПСВ в течение суток (ПСВмакс — ПСВмин).
3. Вычисляют отношение (ПСВмакс — ПСВмин)/ПСВср, выраженное в процентах.
Изменение ПСВ в течение суток более чем на 20 % (при его измерении 2 раза в сутки — более чем на 10 %) указывает на наличие БА.
Другим способом оценки вариабельности ПСВ является определение минимальной ПСВ за 1 нед. в процентах от лучшего показателя за этот же период (Min%Max). Предполагается, что данный метод имеет ряд преимуществ, поскольку он проще и лучше коррелирует с бронхиальной гиперреактивностью.
Оценка бронхиальной гиперреактивности. У пациентов с характерными симптомами БА, но с нормальными показателями функции легких значительную диагностическую ценность имеет исследование реакции бронхов на метахолин, гистамин, маннитол, аденозин, гипертонический солевой раствор или физическую нагрузку. Бронхиальная реактивность отражает чувствительность дыхательных путей к так называемым триггерам, т.е. факторам, способным вызывать появление симптомов БА. Результаты теста обычно приводятся в виде провокационной концентрации (или дозы) агента, вызывающего определенное снижение ОФВ1 (как правило, на 20 %). Достигнутая концентрация характеризует наличие и степень выраженности бронхиальной гиперреактивности.
Неинвазивное определение маркеров воспаления дыхательных путей. Для оценки наличия и активности воспаления в дыхательных путях при БА проводится специальное цитологическое исследование спонтанно продуцируемой или индуцированной ингаляцией гипертонического солевого раствора мокроты. Стандартная микроскопия мокроты не может быть заменой данному исследованию, так как не позволяет полноценно оценить характер и интенсивность воспалительных явлений.
Кроме того, в качестве неинвазивных маркеров воспаления в дыхательных путях при БА были предложены уровни оксида азота в выдыхаемом воздухе. У больных БА отмечается повышение уровня FeNO по сравнению с лицами без БА.
Оценка аллергического статуса. У части больных выявляется тесная взаимосвязь БА с различными атопическими состояниями, и особенно аллергическим ринитом. Выявление у больных БА аллергии (подтвержденной с помощью кожных проб или определения специфических IgE в сыворотке крови) позволяет установить факторы риска и триггеры ухудшения течения заболевания.
Кожные пробы с аллергенами представляют собой основной метод оценки аллергического статуса. Они просты в применении, не требуют больших затрат времени и средств и обладают высокой чувствительностью. Однако неправильное выполнение проб может привести к получению ложноположительных или ложноотрицательных результатов. Определение специфических IgE в сыворотке крови не превосходит кожные пробы по надежности, но является более дорогостоящим методом. Главным недостатком методов оценки аллергического статуса является то, что положительные результаты тестов не обязательно указывают на аллергическую природу заболевания и на связь аллергена с развитием БА, так как у части лиц специфические IgE могут обнаруживаться в отсутствие симптомов заболевания и не играть какой-либо роли в развитии БА.
Дифференциальная диагностика
Дифференциальную диагностику следует проводить со следующими заболеваниями:
— гипервентиляционный синдром и панические атаки;
— обструкция верхних дыхательных путей и аспирация инородных тел;
— дисфункция голосовых связок;
— гастроэзофагеальная рефлюксная болезнь;
— другие обструктивные заболевания легких, в особенности хроническое обструктивное заболевание легких;
— необструктивные заболевания легких (например, интерстициальные);
— нереспираторные заболевания (например, левожелудочковая недостаточность).
БА может сочетаться с любым из перечисленных выше состояний, что нередко затрудняет диагностику, оценку степени тяжести и уровня ее контроля.
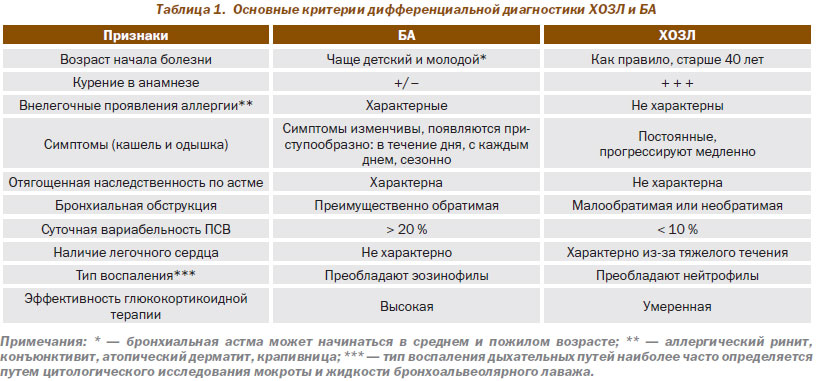
Отдельного обсуждения заслуживает проведение дифференциальной диагностики между БА и ХОЗЛ, учитывая их высокую распространенность и принципиально разные подходы к лечению. Основные дифференциально-диагностические критерии ХОЗЛ и БА приведены в табл. 1.
Классификация БА
Традиционно при классификации БА используют три параметра: этиологию, тяжесть заболевания и степень достижения его контроля.
По этиологии. Возможности классификации БА на основе этиологии с учетом сенсибилизирующих внешних факторов заметно ограничены, так как у некоторых больных не удается выявить внешние факторы риска. Руководство GINA (2012) указывает, что выделение аллергической (атопической, экзогенной) и неаллергической (эндогенной) БА нецелесообразно, так как причиной БА редко является единственный специфический аллерген. Несмотря на это, поиск внешних факторов развития БА (например, профессиональной, аспириновой) должен обязательно проводиться у каждого пациента. Кроме того, указание на этиологию при формулировке диагноза является привычным и в ряде случаев полезным для определения тактики лечения.
По степени тяжести. Классификация БА по степени тяжести также является традиционным подходом, который основывается на результатах анализа комплекса клинических и функциональных признаков бронхиальной обструкции. Прежде считалось, что классификация БА по степени тяжести может оказаться полезной при выборе тактики лечения заболевания. Однако далеко не всегда первоначальная оценка выраженности клинических проявлений у больного может служить надежным критерием выбора оптимальной лечебной тактики и прогноза. Кроме того, тяжесть клинических проявлений у конкретного больного может существенно меняться с течением времени под влиянием адекватной терапии.
Тяжесть БА тесно коррелирует со сложностью достижения медикаментозного контроля над астмой. В совместных рекомендациях Американского торакального общества и Европейского респираторного общества, а позже и в Рекомендациях GINA (пересмотр 2012 г.) эксперты пришли к заключению, что целесообразно выделять тяжелую (или трудноконтролируемую) и легкую (или легкоконтролируемую) БА. Тяжелая БА диагностируется, когда для достижения полного контроля необходим большой объем терапии (например, высокие дозы ИГК в сочетании с пролонгированными b2-агонистами) или, несмотря на большой объем терапии, контроля БА достигнуть не удается. В случае достижения полного контроля заболевания при относительно небольшом объеме терапии (например, монотерапия низкими/средними дозами ИГК) БА обозначается как легкая.
По уровню контроля БА. Для оценки ответа пациента на назначенную терапию введено понятие контроля БА.
Термин «контроль» обозначает устранение проявлений заболевания. В идеале это должно относиться не только к клиническим проявлениям, но и к лабораторным маркерам воспаления и патофизиологическим признакам заболевания (например, гиперреактивности бронхов). В клинической практике целесообразно использовать классификацию БА по уровню контроля над заболеванием (табл. 2).
Полный контроль над БА обычно достигается с помощью терапии, направленной на достижение и длительное поддержание контроля, с учетом должного внимания к переносимости лечения, риску развития побочных эффектов и стоимости лекарственных средств, необходимых для достижения этой цели.