Газета «Новости медицины и фармации» 20-22 (477, 483-484) 2013
Вернуться к номеру
Безпека та нормативно-правовий супровід лікарських засобів: від розробки до медичного застосування
Разделы: Медицинские форумы
Версия для печати
Закінчення.
Початок у № 19 (476), 2013
СЕКЦІЯ 5
була присвячена темі «Раціональна фармакотерапія: роль клінічного провізора у забезпеченні ефективності і безпеки ліків».
Ведучими на даній секції були д.м.н. Г.О. Батіщева (Воронезька державна медична академія, кафедра клінічної фармакології); завідувач кафедри клінічної фармації, фармакотерапії та медичної стандартизації Львівського національного медичного університету ім. Данила Галицького, д.м.н., професор А.Б. Зіменковський; асистент кафедри клінічної фармації, фармакотерапії та медичної стандартизації Львівського національного медичного університету ім. Данила Галицького О.Ю. Городнича.
З доповіддю «Організація служби клінічної фармакології в лікувальному закладі» виступила д.м.н. Г.О. Батіщева. Доповідач надала інформацію щодо формування служби клінічної фармакології в Російській Федерації (РФ), що проходило на підставі нормативного законодавства Російської Федерації.
Наказом МОЗ РФ № 131 від 05.05.1997 р. була введена посада лікаря — клінічного фармаколога (1 посада на 150 ліжок у стаціонарі чи на 500 відвідувань за зміну в поліклініці). Також був затверджений Наказ МОЗ РФ № 494 від 22.10.2003 р. «О совершенствовании деятельности врачей — клинических фармакологов». У 2010 р. був прийнятий «Порядок предоставления медицинской помощи населению по специальности «Клиническая фармакология» (1 посада на 250 ліжок у стаціонарі чи на 500 відвідувань за зміну в поліклініці).
Наказом комітету охорони здоров’я адміністрації Воронезької області № 155 від 08.04.1998 р. було введено в штат лікувальнопрофілактичного закладу (ЛПЗ) спеціалістів, які займаються клінічною фармакологією. Наказом № 186 від 23.04.1998 р. затверджена посада «обласний клінічний фармаколог».
Структура служби клінічної фармакології Воронезької області представлена обласним клінічним фармакологом, міським клінічним фармакологом, стаціонарами, ЦРЛ, поліклініками, Обласним дитячим будинком, Обласним діагностичним центром, Дитячим протитуберкульозним санаторієм, Фізкультурним диспансером, Шпиталем МВС, Дорожньою лікарнею, Центром СНІДу.Служба клінічної фармакології в ЛПЗ обласного підпорядкування представлена 18 лікувально-профілактичними закладами. Служба клінічної фармакології в ЛПЗ м. Воронежа представлена 13 лікувальнопрофілактичними закладами. Особливості штатного розкладу залежать від типу ЛПЗ.
Основні напрямки праці лікарів — клінічних фармакологів:
1. Розробка лікарського формуляра.
2. Фармакоекономічний аналіз (ABC і VEN).
3. Експертиза фармакотерапії.
4. Консультація хворих.
5. Формування заяви ЛПЗ на лікарські засоби.
6. Організація конференцій, семінарів, інформаційних повідомлень з актуальних питань фармакотерапії.
7. Робота у складі лікарняних комісій (КЕК, комісій з вивчення летальних випадків).
8. Участь у тематичних перевірках.
9. Комплектація наборів для надання невідкладної медичної допомоги.
10. Участь у перевірках інших ЛПЗ.
11. Експертиза заявок на лікарські засоби інших ЛПЗ (за дорученням обласного Департаменту охорони здоров’я).
Робота клінічних фармакологів проводиться шляхом фармакоекономічних досліджень:
1. АВС/VEN-аналізу.
2. DDD-аналізу.
3. Розрахунку індивідуальної вартості фармакотерапії.
Програмне забезпечення представлено такими документами:
1. Фармакоекономічний аналіз руху лікарських засобів в лікувально-профілактичному закладі (свідоцтво про реєстрацію № 2006613701).
2. Розрахунок індивідуальної вартості лікування (свідоцтво про реєстрацію № 2011610459).
У Воронезькій області Регіональний центр з контролю несприятливих побічних реакцій (НПР) заснований у 2009 р. при Воронезькому центрі з контролю якості та сертифікації лікарських засобів. Післядипломна перепідготовка є основою працездатності служби.
Структура циклу професійної перепідготовки:
1. Лекційний курс, семінари, практичні заняття.
2. Заліки з основних розділів клінічної фармакології (n = 9).
3. Підготовка курсової роботи за результатами експертизи фармакотерапії.
4. Фармакоекономічний аналіз закупівель препаратів в лікувальному закладі (АВС-, VEN-аналіз).
5. Формування лікарського формуляра ЛПЗ.
6. Заключний іспит (тестовий контроль, практичні навички, співбесіда).
Перспективи розвитку регіональної служби клінічної фармакології:
1. Розробка програмного забезпечення для формування річного звіту роботи служби клінічної фармакології в ЛПЗ регіону.
2. Утворення єдиної системи моніторингу антибіотикорезистентності і використання антимікробних засобів в стаціонарах м. Воронежа та Воронезької області.
3. Організація безперервної післядипломної освіти для клінічних фармакологів (кредитно-модульна система) на базі кафедри клінічної фармакології Воронезької області.
Наступним виступив д.м.н. А.Б. Зіменковський із доповіддю «Менеджмент DRP, медикаментозний процес, клінічний аудит — нові можливості фармаконагляду». Доповідачем були розглянуті нові можливості розвитку вітчизняної системи фармаконагляду. Зазначено, що передбачається поєднання системи контролю безпечності ліків протягом усього медичного процесу з менеджментом системи DRP (drugrelated problems — пов’язані з ліками проблеми) та клінічного аудиту фармакотерапії.
Система DRP передбачає будь-які обставини або випадки, що виникають під час медикаментозного процесу в даного пацієнта, які дійсно або потенційно можуть утруднювати досягнення оптимальних результатів лікування.
Доповідач зазначає, що у процесі оцінки (експертизи) призначень лікарських засобів клінічний провізор повинен звертати увагу на такі фокусні зони:
- призначення понад 5 лікарських засобів у листах призначень;
- повторне призначення одного і того самого антибіотика (АБ);
- призначення 2 і більше нестероїдних протизапальних препаратів одночасно;
- призначення нестероїдних протизапальних препаратів хворим, які перенесли інфаркт міокарда;
- призначення 2–3 антибіотиків одночасно;
- дублювання препаратів з однаковою активною субстанцією тощо.
Саме ці фокусні зони підлягають клінічному аудиту в першу чергу.
Клінічний аудит — це сучасна система внесення змін у практику застосування препаратів, що базується на доказовій медицині та даних про безпеку фармакотерапії. Це не тільки оцінка та виявлення недоліків фармакотерапії, в першу чергу внесення змін у практику застосування лікарських засобів і їх моніторинг. Доповідач вважає, що слід змінити ставлення лікарів до даного питання, проте інформація про ці помилки зазвичай замовчується. Доповідач навів декілька практичних прикладів застосування методики клінічного аудиту у фокусних зонах фармакотерапії.
З доповіддю «Нові методологічні підходи клінічного провізора до підвищення безпеки фармакотерапії» виступила О.Ю. Городнича.
Доповідач розглянула ряд питань, серед них актуальність нових методологічних підходів клінічного провізора до підвищення безпеки фармакотерапії. Попередження чи мінімізація ризику виникнення небажаних наслідків застосування лікарських засобів є одним із пріоритетних завдань світової та вітчизняної медичної практики і головним завданням діяльності клінічного провізора. Встановлено, що близько 1/3 небажаних реакцій лікарських засобів (ЛЗ) можна уникнути, попередньо спрогнозувавши їх можливий розвиток. Таким чином, одним з основних шляхів підвищення безпеки медикаментозного лікування є опрацювання нових методологічних підходів, спрямованих на зниження ризику виникнення ускладнень фармакотерапії (ФТ) через прогнозування ймовірності розвитку побічних реакцій ЛЗ.
Метою дослідження, результати якого наведені доповідачем, було опрацювання системи прогнозування розвитку небезпечних дерматопатологій — синдрому Стівенса — Джонсона (ССД) та синдрому Лайєлла (СЛ) шляхом градації ФТ груп ЛЗ за ступенем ризику.
Для реалізації поставленого метою дослідження завдання було проаналізовано усі формулярні статті чинного на момент дослідження Державного формуляра ЛЗ V випуску (2013 р.) та обрано ті ЛЗ, при застосуванні яких можуть виникати прояви ускладнень ФТ дерматологічної складової — симптомокомплексу ССД та СЛ, що у формулярних статтях зазначаються як «висипання», «висипка», «виразка», «виразкування шкіри», «гіперемія», «гіперемія шкіри», «гіперемія шкірних покривів», «десквамація», «дерматит», «кропив’янка», «лімфаденіт», «набряки», «почервоніння на шкірі», «почервоніння шкіри», «почервоніння у місці ін’єкції», «рум’янець», «свербіж», «сверблячка», «токсикодермія», «уртикарний висип», «уртикарний набряк», «уртикарія», «фіксована пігментна еритема». Для уникнення некоректного трактування назв дерматологічних ускладнень ФТ, а відтак неправильного підрахунку кількості небажаних реакцій при застосуванні ліків дослідниками було проведено стандартизацію шкірних проявів побічних реакцій (ПР) ЛЗ згідно з МКХ-10 у форматі таких нозологічних одиниць: «висип та інші неуточнені висипи на шкірі»,«гострий лімфаденіт», «дерматит внаслідок внутрішнього застосування речовин», «зміни структури шкіри», «інші еритематозні стани», «інші та неуточнені зміни шкіри», «кропив’янка», «набряк, не класифікований в інших рубриках», та «свербіж».
Встановлено, що застосування 351 ФТ групи ЛЗ, об’єднаних з інформаційного масиву ЛЗ за АТС-кодом 4-го рівня, може призвести до клінічних проявів ПР із боку шкіри (загальною кількістю від 1 до 7 ПР), що належать до симптомокомплексу ССД та СЛ. З отриманого переліку ФТ груп ЛЗ, 73 ФТ групи ЛЗ можуть спричинити ССД та СЛ.
Кожній вибірці ФТ груп ЛЗ, застосування яких пов’язане із ризиком виникнення ССД та СЛ, було присвоєно окремий код від 1 до 7 під загальним позначенням «СДН» — ступінь дерматологічної небезпеки. Значення СДН відповідає кількості потенційних шкірних проявів ПР ЛЗ та позначає ризик виникнення ССД та СЛ.
Як зазначила доповідач, за результатами дослідження були зроблені такі висновки: результати дослідження можуть бути використані для прогнозування розвитку ускладнень фармакотерапії, а відтак попередження виникнення загрозливих станів для здоров’я та життя пацієнтів, зокрема небезпечних індукованих ліками дерматопатологій — синдромів Стівенса — Джонсона та Лайєлла.
СЕКЦІЯ 6
«Безпека лікарських засобів» була присвячена розгляду питань безпеки антибіотикотерапії в дітей, сучасним підходам до управління ризиками біоподібних лікарських засобів та фармакоекономічної оцінки в умовах жорсткої конкуренції на фармацевтичному ринку.
Ведучими секції були Л.Є. Зіганшина, Пітер де Він, Л.В. Беш.
Основні аспекти безпеки антибіотикотерапії в дітей розкрила Леся Василівна Беш, професор кафедри факультетської та шпитальної педіатрії Львівського національного медичного університету імені Данила Галицького. Доповідач наголосила на тому, що перш за все лікарі повинні визначитися, чим же необхідно керуватися, об’єктивно оцінюючи безпеку антибіотикотерапії. Серед основних критеріїв були визначені: інструкція до медичного застосування, затверджена МОЗ України; наявність препарату серед рекомендованих у міжнародних та національних протоколах лікування; клінічні контрольовані дослідження ефективності та безпеки, метааналізи; особисті спостереження та досвід колег тощо.
Як зазначила доповідач, якщо говорити про безпеку антибіотиків у глобальному масштабі, то перш за все треба шукати шляхи зниження антибіотикорезистентності. У цьому контексті особливо актуальним є контроль над чинниками, що зумовлюють зростання антибіотикорезистентності: невиправдане часте призначення (!); призначення на вимогу пацієнта або батьків (понад 90 % очікують призначення антибіотика); безконтрольне й неправильне застосування (неповний курс, неправильний режим дозування); необґрунтовано агресивна антибіотикотерапія резерву при нетяжких інфекціях уже в пологовому будинку тощо.
Невиправдане призначення антибіотиків нерідко має місце при гострих респіраторних захворюваннях (ГРЗ), які є найбільш частою причиною звернень до лікаря. Сьогодні доведено, що антибіотикотерапія показана не частіше ніж в 10–20 % всіх випадків ГРЗ. Водночас 75 % призначень системних антибіотиків в медичній практиці припадає на частку ГРЗ. Більше того, і сьогодні окремими лікарями підтримується міф про те, що застосування антибіотиків при ГРВІ запобігає розвитку бактеріальних ускладнень.
Серед небажаних реакцій при системному застосуванні антибактеріальних засобів особливе занепокоєння викликають: алергічні реакції; порушення з боку травного тракту; гепатотоксичність; кардіотоксичність; хондротоксичність; нефротоксичність; нейротоксичність; гематотоксичність препаратів.
Протягом останніх років суттєво зросла частота призначення цефалоспоринів, особливо цефтріаксону, як стартової терапії при лікуванні позалікарняних пневмоній. Відповідно зросла частота реєстрації алергічних реакцій на цей препарат. У порядку зниження ризику алергічних реакцій препарати цефалоспоринового ряду можна розмістити так: цефтріаксон > цефоперазон > цефокситин > цефтазидим > цефотаксим > цефуроксим. Саме тому починати лікування респіраторної інфекції у дитини з цефтріаксону нераціонально з позицій безпеки.
Сьогодні доведено, що найбезпечнішим є ступінчастий підхід до призначення антибіотиків, коли у стаціонарних умовах антибіотикотерапію слід починати з парентерального введення антибіотика, а через кілька днів за умови позитивної клінічної і лабораторної динаміки при нормальній гастроінтестинальній абсорбції препарат призначається перорально (напівсинтетичні пеніциліни, цефалоспорини і макроліди присутні на фармацевтичному ринку в ін’єкційній формі й у формі для перорального застосування). Таке лікування є більш комфортним для дитини, оскільки не лише зменшує число ін’єкцій і ризик післяін’єкційних ускладнень, але й скорочує терміни перебування в стаціонарі і знижує ризик виникнення нозокоміальних інфекцій. У цьому контексті доповідач підтримала слова професора В.К. Таточенка (Росія), який відзначає, що понад 85 % усіх позалікарняних пневмоній у дітей можна вилікувати без жодної ін’єкції антибіо-тика, використовуючи лише пероральні препарати.
У своїй доповіді «Фармакоекономічна оцінка побічних реакцій лікарських засобів на прикладі різних фармакологічних груп» д.фарм.н., проф. О.М. Заліська, завідувач кафедри організації і економіки фармації та технології ліків факультету післядипломної освіти Львівського національного медичного університету імені Данила Галицького, висвітлила напрями використання методів фармакоекономіки для оцінки побічної дії ліків.
За даними міжнародних досліджень, у США реєструють 400 тис. повідомлень про побічні реакції, це спричиняє більше ніж 700 000 візитів до відділень невідкладної допомоги лікарень, загалом витрати на лікування становлять до 10 млрд доларів щорічно. В Австралії неналежне застосування ліків призводить до 140 000 госпіталізацій, при цьому 69 % із них можна було б уникнути. В умовах страхової медицини постійно проводяться фармакоекономічні оцінки витрат на альтернативні препарати, які відрізняються за частотою побічних реакцій.
Доповідач зазначила, що у світі і в Україні найбільш часто виникають побічні реакції при прийомі нестероїдних протизапальних лікарських засобів (НПЗЛЗ). У публікації проф. О.П. Вікторова і співавт. (2008) було досліджено, що на фармацевтичному ринку України представлено 335 торгових назв та 543 лікарські форми НПЗЛЗ. Встановлено, що серед повідомлень щодо НПЗЛЗ, які викликають ПР, 60 % повідомлень у трьох областях Західного регіону та 65 % повідомлень по Україні в цілому припадають на НПЗЛЗ зарубіжного виробництва. В Україні корекція проявів зареєстрованих ПР при призначенні НПЗЛЗ застосовувалася майже у 30 % випадків. Для фармакокорекції зареєстрованих ПР, викликаних НПЗЛЗ, використовували від 1 до 5 препаратів у досліджуваних західних областях, а також від 1 до 9 ЛЗ по Україні в цілому. Тому аналіз витрат на усунення побічної дії ліків є необхідною умовою для визначення загальних витрат при оцінці медичних технологій. Перші оцінки витрат на побічні дії НПЗЛЗ були проведені у фармакоекономічному дослідженні НПЗЛЗ та ЦОГ-2 О.М. Заліською (2002). Подальші вітчизняні дослідження оцінки витрат при застосуванні альтернативних НПЗЛЗ були розглянуті на 14-му Європейському конгресі Міжнародного товариства фармакоекономічних досліджень — ISPOR (Zaliska O., Tolubaiev V., 2011).
Для проведення оцінки витрат необхідно набуття знань з фармакоекономіки. Фармакоекономіка — сучасна фармацевтична дисципліна, яка включена за ініціативи кафедри організації і економіки фармації та технології ліків факультету післядипломної освіти ЛНМУ ім. Данила Галицького у типові уніфіковані програми та навчальні плани післядипломної підготовки провізорів зі спеціальностей «організація та управління фармацією» та «загальна фармація» (МОЗ, 2003, 2009). Для навчально-методичного забезпечення були видані у 2001 році типова навчальна програма «Фармакоекономіка», у 2002-му — навчальний посібник «Основи фармакоекономіки» (автор Заліська О.М., за ред. Парновського Б.Л.), затверджений МОЗ, у 2007 році — типова навчальна програма «Фармакоекономіка» для студентів за спеціальністю «фармація» (у співпраці зі спеціалістами НФаУ); у 2007 році — навчальний посібник «Фармакоекономіка» (автор Заліська О.М., за ред. Парновського Б.Л.), затверджений МОЗ для післядипломної освіти провізорів-інтернів та слухачів курсів. Заліська О.М. розповіла про напрямки розвитку навчально-методичного забезпечення з фармакоекономіки у вищих навчальних закладах України та впроваджень наукових досліджень із фармакоекономічного аналізу. За 2004–2013 роки по Україні було захищено більше ніж 30 дисертаційних робіт, які містили результати фармакоекономічного аналізу груп лікарських засобів.
Доповідач зазначила, що при вивченні фармакоекономіки важливим є обґрунтований вибір схеми профілактики, лікування захворювання, медичних технологій на основі даних доказової медицини і доказової фармації та даних про безпечність ліків з оптимальним показником «витрати — ефективність». Результати фармакоекономічного аналізу використовуються на суспільному рівні, зокрема при розробці формулярів для лікувально-профілактичних закладів. Також значна увага приділяється участі провізора в економічній оптимізації та індивідуалізації фармакотерапії для конкретного хворого з урахуванням біофармацевтичних характеристик лікарського засобу, фармакокінетичної сумісності препаратів, а також витрат на усунення їх побічної дії.
СЕКЦІЯ 7
проходила за темою «Активний фармаконагляд».
Ведучими секції були С.Б. Сєткіна (УП «Центр експертиз та досліджень в охороні здоров’я», м. Мінськ, Республіка Білорусь); к.м.н. О.І. Коняєва, зав. кафедрою клінічної фармакології і фармакотерапії Кримського ДМУ ім. С.І. Георгієвського.
С.Б. Сєткіна виступила з доповіддю «Впровадження активних методів моніторингу безпеки лікарських засобів в Республіці Білорусь».
Доповідач зазначила, що одним з актуальних завдань систем фармаконагляду є підвищення їх ефективності. Вкрай важливо підвищити результативність діючих систем у напрямку вивчення профілю безпеки лікарських засобів, які перебувають в обігу, виявлення сигналів, вжиття заходів щодо забезпечення їх застосування при перевищенні користі над ризиком, отримання даних для розробки рекомендацій, які можуть допомогти у прийнятті фармакотерапевтичних рішень, сприяють оптимізації фармакотерапії, особливо у пацієнтів груп ризику.
Одним із способів підвищення ефективності діяльності фармаконагляду по найбільш значущих напрямках моніторингу безпеки лікарських засобів є впровадження методів активного моніторингу. Серед даних методів одним із широко використовуваних і результативних є метод когортного моніторингу, розроблений і вперше впроваджений у Новій Зеландії наприкінці 1970-х років. Когортний моніторинг являє собою не пов’язаний із втручанням інтенсивний метод післяреєстраційного моніторингу безпеки та ефективності зазначеної фармакотерапії у певної когорти пацієнтів.
У Республіці Білорусь можливість впровадження та реалізації першого когортного моніторингу безпеки антиретровірусної терапії (АРВТ) була пов’язана з роботою європейського проекту Monitoring Medicines Programme 7, глобальною метою якого було зниження смертності і несприятливих наслідків для здоров’я пацієнтів, обумовлених наявністю недостатньо вивчених аспектів профілю безпеки лікарських засобів. У завдання проекту входила розробка допоміжних методів фармаконагляду, які доповнюють метод спонтанного репортування. У Республіці Білорусь проект стартував з пілотної фази в грудні 2012 року. П’ять моніторингових центрів були визначені з огляду на епідеміологічний розподіл популяцій, що моніторуються. Когорту становлять ВІЛінфіковані пацієнти, які раніше не одержували АРВТ, з CD4 числом ≤ 350 клітин/мм3 або мають 3-тю або 4-ту стадію ВІЛ-інфекції, а також супутній туберкульоз незалежно від CD4 числа. Антиретровірусні схеми, що підлягають моніторингу, включають два режими згідно з національними протоколами лікування, зараховані до першої лінії: AZT ++ 3TC + EFC (NVP) або TDF + 3TC + EFC (NVP). Для виконання дослідження були розроблені спеціальні форми реєстрації даних кожного пацієнта під час початкового і наступного візитів. Форми передбачають клінічну, лабораторну та анамнестичну оцінку стану пацієнтів до призначення АРВТ і в подальшому оцінку всіх змін стану протягом року після початку прийому терапії.
Під час моніторингу фахівцями фіксуються всі зміни порівняно з первісним станом, включаючи побічні явища, несприятливі зміни лабораторних показників, відсутність ефективності, зміну (виникнення, погіршення, поліпшення) супутньої патології, а також сприятливі зміни стану.
Частота моніторингових візитів під час когортного дослідження збігається з частотою рутинних візитів пацієнта, обумовлених національним протоколом лікування.
За 7-місячний період проведення дослідження в когорту було включено 402 ВІЛ-інфікованих пацієнти, які задовольняють критеріям включення. Частка пацієнтів, які вибули з когорти, за минулий період становила 11,7 %, з яких найбільша частина вибуття (5,7 %) була обумовлена відсутністю прихильності до терапії або втратою можливості спостереження. Внаслідок розвитку побічних реакцій і неможливості корекції або заміни терапії в рамках режимів моніторингу були виключені 3,7 % пацієнтів. У цілому близько 36 % пацієнтів, включених до когорти, відчували побічні реакції, при цьому основна частина були очікуваними, частими, корегованими. Найбільше число побічних реакцій було визначено як ті, що мають причинно-наслідковий взаємозв’язок із прийомом ефавіренцу, і включало різні неврологічні порушення, алергічні реакції й оборотні зміни активності печінкових ферментів. Проте були виявлені також і побічні реакції, частота яких визначається як нечасті, а також 7 випадків очікуваних серйозних побічних реакцій. Серйозні побічні реакції були пов’язані з прийомом зидовудину (тяжкі анемії) і невірапіну (системні імуноалергічні реакції з боку шкіри, гепатобіліарної системи).
Крім даних із безпеки, когортний моніторинг дозволяє також зробити оцінку ефективності фармакотерапії, ефективності коригуючих заходів, виявити й оцінити фактори ризику, оцінити безпеку та ефективність АРВТ у груп пацієнтів зі складною супутньою патологією, множинною супутньою терапією. Декілька потенційних сигналів знаходяться на етапі верифікації та експертної оцінки.
Крім вищевказаного, важливими стратегічними цілями активних форм моніторингу безпеки є впровадження системи репортування і постійного моніторингу безпеки та ефективності фармакотерапії, принципів раціонального застосування лікарських засобів, а також ефективної системи раннього виявлення можливих змін/відмінностей очікуваного профілю безпеки/ефективності та інших проблем, пов’язаних із застосуванням лікарських засобів.
К.м.н. О.І. Коняєва виступила з доповіддю, присвяченою стратегії контролю антимікробної терапії (СКАТ) на прикладі КРУ «КТМО «Університетська клініка».
У своєму виступі вона наголосила, що резистентність до антимікробних препаратів є проблемою глобального масштабу. Це явище спостерігається як у лікарнях, так і поза стаціонарами, спричинює зростання захворюваності та смертності, призводить до збільшення економічних витрат й обмежує можливості лікаря у терапії інфекцій. Було зазначено, що шляхами стримування резистентності антимікробної терапії є:
- допомога освітніх та інформаційних програм навчання лікарів принципів раціональної АБ-терапії;
- проведення адекватної антибіотикопрофілактики в хірургії;
- постійний моніторинг й аналіз антибіотикорезистентності;
- широке застосування ступінчастої терапії;
- заборона безрецептурного продажу антибіотиків;
- гігієна рук медичного персоналу;
- зміна культури призначення антибіотиків (частіше — не призначати!).
На думку експертів, серйозною і швидко зростаючою загрозою є поширення штамів ряду грамнегативних бактерій (K.pneumoniae, Escherihia coli, Proteus spp. та ін.), які продукують так звані b-лактамази розширеного спектра (БЛРС), що гідролізують майже всі b-лактамні антибіотики за винятком карбапенемів й інгібіторозахищених пеніцилінів, зокрема амоксицилін/клавуланат.
Доповідач визначила цілі й завдання програми СКАТ, а саме:
1. Проведення освітніх курсів (6 лекцій) для лікарів хірургічних спеціальностей.
2. Вивчення поширеності збудників інфекцій сечовивідних шляхів й інтраабдомінальних інфекцій у відділеннях урології, хірургії та реанімації, їх чутливість і резистентність до антимікробних препаратів.
3. Виявлення БЛРС-продукуючих мікро-організмів.
4. Стратифікація пацієнтів за групами ризику.
5. На підставі отриманих даних створення локальних протоколів емпіричної антимікробної терапії.
Стратифікація пацієнтів була проведена за 3 групами ризику. СКАТ проводилася у двох відділеннях КРУ «КТМО «Університетська клініка» (хірургічне та урологічне відділення).
Було визначено розподіл збудників у хірургічному відділенні — грамнегативні МО — 25 (73 %); грампозитивні МО — 9 (27 %).
Була визначена чутливість E.coli до різних антибіотиків за групами ризику — 100% чутливість у всіх групах до іміпенему, ертапенему.
Найбільша чутливість грамнегативних мікроорганізмів до різних антибіотиків за групами ризику виявлена до іміпенему.
100% чутливість грампозитивних мікроорганізмів до різних антибіотиків за групами ризику виявлена до гентаміцину, ципрофлоксацину, ванкоміцину.
У результаті проведеної роботи був представлений протокол емпіричної антимікробної терапії інтраабдомінальних інфекцій. У протоколі зазначені антибіотики, що проявляють максимальну чутливість до різних груп збудників. Був розроблений алгоритм вибору стартової емпіричної антибактеріальної терапії для лікування інтра-абдомінальних інфекцій.
Стратифікація ризику пацієнтів залежно від типу пацієнтів зводиться до наступних послідовних кроків:
1. Надіслати матеріал для мікробіологічного дослідження.
2. Вибирається антибіотик(и) для емпіричної антибактеріальної терапії.
3. Вибирається альтернативна терапія.
4. Через 72 години отримують результати бакпосіву.
5. Проводиться модифікація схеми (продовження стартової терапії або зміни антибіотика).
Такі самі протоколи емпіричної антимікробної терапії інфекцій сечовивідних шляхів і стратифікація ризику пацієнтів були розроблені за результатами СКАТ у відділенні урології.
Доповідачем було відзначено, що існують проблеми у здійсненні програми СКАТ — мікробіологічні та клінічні. Без підтримки й розуміння важливості проекту СКАТ адміністрацією клініки якісне здійснення проекту неможливе.
СЕКЦІЯ 7 (23.10.2013)
«Інформаційне поле як складова ефективного та безпечного лікування» була спрямована на вивчення інформаційного поля.
Секцію вели Л.Є. Зіганшина, Н. Ольберт-Сінько, Г.В. Гусєва
У доповіді Ю. Багмут, яка працює в агентстві PRP, були висвітлені питання ролі комунікацій із засобами масової інформації (ЗМІ) у сфері охорони здоров’я. За даними соціологічного дослідження Інституту Горшеніна1, здоров’я є головною цінністю для українців: понад 80 % громадян цінують здоров’я навіть вище за матеріальний добробут. Тому до сфери охорони здоров’я в цілому та до тематики якості медичних препаратів зокрема постійно прикута увага суспільства та засобів масової інформації. Відповідно, комунікації у сфері охорони здоров’я мають низку особливостей на відміну від інших галузей. По-перше, це одна із найбільш резонансних сфер, яка через брак кваліфікованих коментарів в інформаційному просторі перенасичена негативними повідомленнями та скандалами, що мають властивість поширюватись із блискавичною швидкістю. По-друге, до процесу комунікацій постійно залучена держава, яка має гарантувати своїм громадянам безпечне лікування. Крім того, кінцева аудиторія комунікацій у даній сфері — пацієнт — з кожним роком перетворюється із пасивного «спостерігача» та «отримувача» інформації на активного «шукача», який стає дедалі більш розбірливим та вимогливим у медичних питаннях, не обмежується рекомендаціями представників медичної сфери. Важливий також і той факт, що медична галузь — це сфера науки, інновацій, проривних рішень, тому існує потреба в адекватному та зрозумілому донесенні досягнень галузі до пересічних осіб.
Як показує практика, високий попит на інформацію у сфері охорони здоров’я зумовлює постійне виникнення так званих інформаційних вакуумів, які так само швидко наповнюються різною, не завжди коректною, інформацією. Саме тому сьогодні представникам медичної сфери більш ризиковано мовчати, ніж залучатися до спілкування із пацієнтами, адже якщо фахівці не заповнять інформаційний вакуум, за них це зроблять інші.
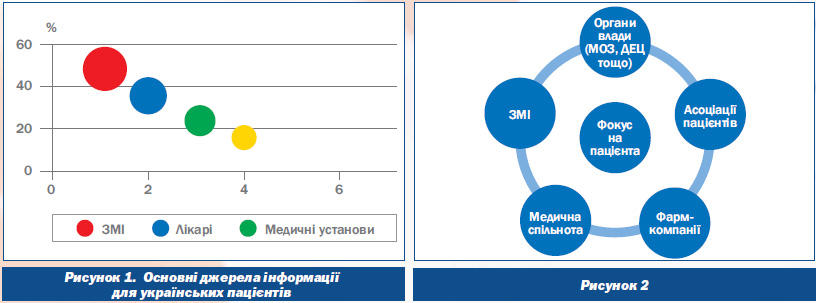
Автор зауважує, що на даний момент ЗМІ є основним джерелом інформації щодо сфери охорони здоров’я для українських пацієнтів2, випереджаючи навіть лікарів та загалом медичні установи. При цьому з різних видів ЗМІ телебачення є ключовим каналом для отримання повідомлень про здоров’я, на другому місці — преса, на третьому — радіо.
Якщо проаналізувати основні джерела інформації для українців щодо найбільш суспільно небезпечних захворювань, таких як туберкульоз та СНІД, то можна простежити аналогічну тенденцію: 59 % українців дізнається новини про це захворювання з телебачення, 44 % — із газет та журналів та 28 % — по радіо.
Довіра, наголошує автор, — суб’єктивний фактор, на основі якого відбувається прийняття рішень пацієнтом у сфері охорони здоров’я. Тоді як ефективні комунікації — це основа, на якій вибудовується довіра. Важливо, що, за даними українських соціологів3, телебачення є не лише основним джерелом для інформування українських пацієнтів, але й тим каналом, якому в Україні найбільше довіряють в питаннях здоров’я, навіть більше, ніж медичним працівникам. Так, наприклад, у питаннях діагностики та лікування туберкульозу телебаченню довіряє майже 37 % українців, тоді як щодо ВІЛ/СНІДу цей показник сягає 75 %. Загалом ЗМІ є другою за ступенем довіри українською інституцією після церкви, якій довіряє більшість українців у різних сферах життя4.
Важлива складова ефективних комунікацій у сфері охорони здоров’я — переорієнтація всіх учасників комунікаційного процесу на пацієнта. Ключовою активною ланкою у цих комунікаціях мають бути органи державної влади (Міністерство охорони здоров’я, Державний експертний центр тощо). Крім того, активна робота всіх учасників даної сфери у спільному векторі комунікацій, участь у подіях для журналістів представників різних сторін, які доноситимуть спільні ключові повідомлення до кінцевої аудиторії, будуть викликати більше довіри у пацієнта.
Несвоєчасне заповнення інформаційного вакууму в медичній сфері кваліфікованою інформацією може зумовити виникнення низки негативних наслідків. По-перше, відсутність коректних повідомлень може призвести до збільшення в інформаційному просторі обсягів непрофесійної інформації щодо лікарських засобів або методів лікування та профілактики: заповнення вакууму «чужою» інформацією (конкуренти, опоненти), використання журналістами посередників або некваліфікованих, але достатньо авторитетних коментаторів у ролі експертів, активізації пацієнтів із негативними повідомленнями у соціальних мережах тощо. Це, у свою чергу, призводить до погіршення репутації відповідальних органів та установ, а також до невизначеності, помилкових суджень пацієнтів щодо медичних питань або до відмови від лікування.
Серед труднощів, які можуть виникати в комунікаціях у сфері охорони здоров’я, доповідач виділила три напрями: освіченість, звички та вміння. По-перше, незважаючи на активну позицію українських пацієнтів, їх професійна обізнаність у питаннях медицини залишається на досить низькому рівні: більшість не має відповідної медичної освіти для прийняття рішень щодо використання того чи іншого медичного засобу. По-друге, питання здоров’я та лікування значною мірою пов’язане зі звичками кожної конкретної людини, упередженнями та стереотипами, які доводиться долати при донесенні повідомлень про інновації у даній сфері. По-третє, актуальним залишається вміння представників медичної галузі у доступній формі доносити потрібну інформацію до пацієнтів.
На завершення Ю. Багмут наголосила, що з огляду на ключову роль комунікацій у медичній сфері у розвинених країнах протягом останніх десятиріч створені та активно функціонують окремі асоціації із комунікацій у сфері охорони здоров’я. Згідно з їхніми дослідженнями5, ефективні комунікації, які є актуальними, системними, вичерпними та зрозумілими для всіх сторін, зменшують кількість небажаних явищ у сфері охорони здоров’я та підвищують безпеку пацієнтів.
ЧАСТИНА 1 СЕКЦІЇ 8
«Забезпечення безпеки пацієнтів при застосуванні лікарських засобів» була присвячена проблемам, що зустрічались у практичній діяльності благодійної організації. Зазначено, що пацієнти мають право на отримання якісної медичної допомоги, яка характеризується стандартами високого технічного рівня і людськими взаєминами між пацієнтом і надавачами медичної допомоги.
Секцію вели В.Г. Сердюк, президент Всеукраїнської благодійної організації «Рада захисту прав і безпеки пацієнтів»; Є. Найштетик, віце-президент Всеукраїнської благодійної організації «Рада захисту прав і безпеки пацієнтів», директор ТОВ «Медіа Центр «Вектор».
Є. Найштетик у своїй доповіді зупинився на питаннях щодо сертифікації закладів охорони здоров’я відповідно до вимог ISO 9001.
Доповідач підкреслив, що стан здоров’я громадян України є основою економічної продуктивності і добробуту. Забезпечення належного балансу в галузі охорони здоров’я населення сприяє зростанню соціальної згуртованості і стабільності. Процвітаюче і стабільне населення — це важливе надбання будь-якої країни світу. З введенням ринкових відносин в охороні здоров’я питання якості надання медичної допомоги стає все більш актуальним. З метою її підвищення розроблено та впроваджено такі механізми: ліцензування діяльності з медичної практики та контроль за виконанням ліцензійних умов; акредитація закладів охорони здоров’я; система стандартів у сфері охорони здоров’я; здійснення контролю якості медичних послуг; сертифікація медичних установ відповідно до стандарту ISO 9001:2008.
Є. Найштетик зазначив, що стандарт ISO 9001:2008 «Системи управління якістю, вимоги» є базовим для розробки системи менеджменту якості у клініці для її сертифікації. Принципи менеджменту якості, визначені та встановлені у стандартах ISO 9000 та ISO 9001, враховані в стандарті ІСО 9001. Стандарт ІСО 9001 базується на двох методологічних аспектах: 1) процесному підході та орієнтації на споживача послуги (пацієнт орієнтований на медичну послугу (допомогу)); 2) задоволенні очікувань споживачів (пацієнт залишився чи не залишився задоволеним медичною послугою (допомогою)). Внутрішня документація з якості описує взаємодії процесів та послуг у відповідних протоколах, положеннях, інструкціях тощо, а також передбачає обов’язковий моніторинг та контроль всіх процесів з аналізом отриманих результатів, метою якого є постійне поліпшення якості й вибору оптимальних та ефективних методик надання послуг.
Доповідач зупинився на основних характеристиках якості.
Професійна компетенція: стосується рівня навичок і вмінь, що реалізуються в процесі діяльності людей, які надають медичну послугу (допомогу), діяльності керівництва та обслуговуючого персоналу.
Доступність медичної послуги (допомоги): під нею ми розуміємо рівень, у якому медична послуга (допомога) може безперешкодно надаватися незалежно від географічних, економічних, соціальних, культурних, організаційних чи мовних факторів.
Результативність: мається на увазі ступінь, у якому лікування пацієнта призводить до поліпшення його стану або до бажаного результату.
Міжособистісні відносини: цей фактор стосується якості взаємодії між надавачами медичних послуг (допомоги) та пацієнтами (споживачами), а також між керівництвом і персоналом, медичними працівниками та пацієнтами.
Ефективність: це постійно існуюче напруження між потребою в обслуговуванні і наявними ресурсами надання допомоги. Проект забезпечення якості визначає ефективність як надання оптимальної медичної послуги (допомоги) населенню, тобто оптимальної кількості та обсягу медичної послуги (допомоги), досяжного при використаних ресурсах.
Безперервність: це ступінь, у якому пацієнт отримує необхідні йому медичні послуги (допомогу) без перерв, зупинок або зайвих повторень діагнозу або лікування.
Безпека: стосується ступеня, у якому система медичної послуги (допомоги) знижує ризик пошкоджень, інфікування, шкідливих побічних явищ або іншого збитку, що завдається в процесі надання медичної допомоги.
Комфортність: належить до тих характеристик медичної послуги (допомоги), які безпосередньо не стосуються клінічної ефективності, але можуть позитивно вплинути на задоволеність пацієнта якістю обслуговування. Комфортність визначається як зовнішній вигляд і чистота всіх використовуваних приміщень, обладнання та персоналу, а також заходи, що реалізуються для забезпечення комфорту і зручності пацієнта.
Є. Найштетик наголосив на тому, що відповідно до вимог ISO 9001 діяльність щодо забезпечення якості медичної допомоги в закладі охорони здоров’я має бути спрямована як на клінічний, так і на організаційний аспект медичних послуг (допомоги). Впровадження стандарту ISO 9001 і подальша сертифікація системи якості дають можливість виявити неефективні ланки у діяльності закладу охорони здоров’я, підвищити ефективність використання ресурсів, уникнути як дублювання робіт, так і «оголення» окремих ділянок, документувати всі виробничі операції, встановити відповідальність за кожну з них, провести структуризацію виробничих процесів і вибудувати чіткі технологічні схеми, а найголовніше — підвищити якість медичних послуг (допомоги). Крім того, впровадження та сертифікація системи менеджменту якості підвищує престиж самого закладу охорони здоров’я.
Доповідач відмітив також, що впровадження ISO 9001 й подальша сертифікація системи управління якістю в закладі охорони здоров’я — етап структурно-функціонального розвитку, що забезпечує бездоганний сервіс і зручність, насамперед для пацієнта. Така сертифікація передбачає постійну адаптацію менеджменту до нових умов, як внутрішніх, так і зовнішніх. Зростає значення нової системи менеджменту якості і в умовах страхової медицини, коли страхові компанії, які оплачують лікування, вимагають гарантії високого рівня обслуговування для своїх клієнтів.
Головною вимогою Міжнародної організації зі стандартизації є стабільне проведення роботи щодо поліпшення якості наданих послуг, у нашому випадку — медичних послуг (допомоги). Контроль за відповідністю закладу охорони здоров’я вимогам ISO 9001:2008 проводиться динамічно, після первинної сертифікації укладається контракт з установою на три роки, і кожні 12 місяців проводиться повторна оцінка системи менеджменту, здійснювана спеціальною міжнародною аудиторською групою.
За інформацією Міжнародної організації зі стандартизації, всього у світі у 2011 році видано 1 111 698 сертифікатів ISO 9001, із них 1935 — закладам охорони здоров’я.
Крім того, доповідач зупинився на основних аспектах Європейської програми грамотності з питань охорони здоров’я, метою якої є становлення клієнт-орієнтованого ринку медичних послуг, пацієнт-орієнтованої системи охорони здоров’я, стимулювання медичних працівників до безперервного післядипломного самовдосконалення.
Далі Є. Найштетик особливу увагу приділив питанням просування лікарських засобів та безпеки пацієнтів, оскільки чутливість українців до реклами лікарських засобів є значною перешкодою для встановлення пацієнт-орієнтованої системи охорони здоров’я. Чинниками цього феномену є перманентне порушення права на охорону здоров’я через обмеження доступу до якісної та безпечної медичної допомоги, відсутність стандартів медичної допомоги й уніфікованих клінічних протоколів із більшості захворювань та системні проблеми післядипломної освіти лікарів. Як наслідок, за даними уряду України, 85 % усіх ліків відпускаються без рецепта лікаря. Крім того, численні дослідження доводять, що 82,3 % українців переважно купують лікарські засоби за власні кошти.
У той же час споживчий вибір формується за допомогою маркетингових інструментів, безпосередньо спрямованих на пацієнтів або впроваджених опосередковано через медичних і фармацевтичних працівників. Диспропорція маркетингових зусиль призводить до того, що українці купують ліки від одних хвороб, а помирають від інших. Критичність ситуації також обумовлена стрімкими темпами смертності. Більшості з випадків смертей в Україні (до 70 %) можна запобігти за допомогою ресурсів охорони здоров’я.
Доповідач підкреслив, що для врегулювання ситуації, яка сталася, було прийнято низку законодавчих актів, серед яких найбільш дієвими стали поправки до Закону України «Про рекламу» від 20.12.2011 р. та до «Основ законодавства з охорони здоров’я» від 04.07.2012 р. Проте правове регулювання нашої держави ще потребує гармонізації з існуючими європейськими нормами. Так, зокрема, згідно зі ст. 86 Директив Європейського парламенту 2001/83/ЄС, до реклами лікарських засобів належить не лише рекламне повідомлення для широкого загалу, а й рекламування лікарського засобу для осіб, які призначають або поставляють препарати, візити медичних (торгових) представників у заклади охорони здоров’я з метою збільшення призначень конкретних лікарських засобів, поширення зразків лікарських засобів, а також будь-які стимули й винагороди за призначення лікарських засобів та спонсорування наукових або просвітніх заходів. Для гарантування безпеки пацієнтів вищеназвані директиви забороняють поширювати будь-яку інформацію про препарат, яка не міститься в інструкції для медичного застосування. Сама реклама має заохочувати до раціонального використання лікарського засобу, висвітлюючи об’єктивні дані та не перебільшуючи властивостей препарату. Крім того, у ст. 92 норми встановлено обов’язкові критерії щодо рекламної інформації, спрямованої на осіб, які призначають лікарські засоби.
Через тотальний дефіцит лікарських засобів у державних закладах охорони здоров’я особливо складним питанням в останні роки є використання зразків лікарських засобів. Цей механізм просування має використовуватись дуже обмежено. Зокрема, у ст. 96 європейськими парламентарями було вказано на те, що зразки допускаються в дуже обмежених кількостях і лише тих препаратів, які нешироко використовуються на ринку. Надання зразків може бути лише за письмовим запитом особи, яка призначає препарат, та за умови наявності адекватної системи контролю та обліку. Ця норма може бути застосована і в Україні, незважаючи на жорстке обмеження, передбачене ст. 781 Основ законодавства з охорони здоров’я. Для цього реципієнтом медикаментів на безоплатній основі має бути лікувально-профілактична установа. Водночас через недоліки чинного законодавства України будь-яка передача лікарських засобів на безоплатній основі ідентифікується як благодійна допомога. Поза тим необхідно не забувати і про ризики, які несе у собі будь-яка поставка безкоштовних препаратів. Так, згідно з Керівництвом з пожертвувань медикаментів ВООЗ лише за період із 1988 до 1999 року було зареєстровано приклади неефективного або нераціонального використання благодійної допомоги, невідповідність благодійної допомоги медичним потребам та навіть приклади серйозних наслідків для здоров’я пацієнтів. Через це будь-які пожертви медикаментів мають відповідати таким принципам:
1. Максимальна користь для пацієнта.
2. Повага до побажань та повноважень отримувача.
3. Відмова від подвійних стандартів.
4. Ефективне спілкування між донором та отримувачем.
Для відповідності наведеним принципам ВООЗ рекомендує, щоб усі пожертви медикаментів базувалися на сформульованій потребі та відповідали епідемічній ситуації; щоб усі медикаменти, що жертвуються, були зареєстровані згідно з чинним законодавством та входили до Національного переліку основних лікарських засобів і виробів медичного призначення або у Приблизний перелік ВООЗ основних лікарських засобів, окрім випадків, коли отримувач спеціально запитує лікарський засіб, який не входить у наведені переліки. Крім того, ліки, що жертвуються, мають максимально відповідати стандартам та протоколам, затвердженим в Україні. Разом із цим донор має гарантувати, що пожертви надходять із надійного джерела та відповідають чинним стандартам якості, а також іншим принципам, викладеним у наведеному керівництві.
Завершуючи свій виступ, доповідач наголосив, що маркетингові зусилля на фармацевтичному ринку мають перш за все відповідати потребам пацієнтів у відновленні та збереженні їх здоров’я. Жодні дії, що несуть у собі ризики для здоров’я пацієнтів, є неприпустимими та мають бути жорстко регламентованими законодавством України.
В.Г. Сердюк звернув увагу учасників на важливість стрімкої зміни стратегій та відносин на споживчому ринку, а саме: орієнтацію на технологію, результат та клієнта. Адже на сьогодні з точки зору пересічного, «маленького» українця бренд української медицини — це гарантія отримання допомоги з невідомим рівнем безпеки та якості, з невизначеним кінцевим результатом за невизначені кошти або неотримання зовсім. Саме тому зі швидкою глобалізацією та покращенням якості життя необхідне покращення якості надання медичних послуг, необхідне використання всіх можливих технічних засобів для цього.
Розуміючи дану проблему, Всеукраїнська рада із захисту прав та безпеки пацієнтів виступила ініціатором перекладу та презентації в Україні довідника з внутрішніх хвороб у 2013 році, над перекладом і оптимізацією якого безперервно працювали провідні українські та зарубіжні фахівці в галузі охорони здоров’я понад 18 місяців. Видання існує в електронній версії та є безкоштовним для українських спеціалістів. Створено так званий кишеньковий варіант для лікарів (книга поміщається в кишеню халата). На даний час проводиться робота з розробки електронної версії для пристроїв, що працюють на ОС Android (планшети, смартфони тощо).
СЕКЦІЯ 9
«Раціональна фармакотерапія: сучасні підходи до здійснення лікування з точки зору ефективності та безпеки ліків» була спрямована на пошук шляхів подолання поліпрагмазії, сучасних підходів до раціонального лікування артеріальної гіпертензії, підходів до оцінки співвідношення користі/ризику вакцин у програмах імунопрофілактики, вирішення питань ефективності та безпеки лікарських засобів у сучасних підходах лікування гіпертонічної хвороби, виявлення факторів, що впливають на ефективність та безпеку лікарських засобів, що використовуються при захворюваннях серцево-судинної системи, ефективного та безпечного лікування туберкульозу та виявлення несприятливих наслідків застосування протитуберкульозних засобів з боку органів зору, здійснення фармаконагляду при проведенні антиретровірусної терапії, безпеки фармакотерапії легеневої гіпертензії, використання методичних підходів у здійсненні аналізу лікарями лікарських засобів рослинного походження.
Секцію вели: к.м.н. Г.С. Анікін, проф. Ю.М. Сіренко, Ю.А. Гамазін, к.м.н. В.А. Васильєва (частина 1); проф. Є.П. Свіщенко, д.м.н. О.В. Давидович (частина 2); О. Дужа, У.М. Тілєкєєва, С.М. Антоняк (частина 3); проф. О.О. Яковлева, д.м.н. В.В. Чоп’як, С. Лур’є (частина 4).
Розпочав роботу секції Г.С. Анікін, співробітник Першого Московського державного медичного університету ім. І.М. Сєченова, який у своїй доповіді надав інформацію про сучасні підходи до боротьби з поліпрагмазією та їх значення в підвищенні безпеки фармакотерапії.
Продовжив роботу секції д.м.н., професор Ю.М. Сіренко, завідувач відділу симптоматичної гіпертензії ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, доповіддю «Сучасні підходи до раціонального лікування артеріальної гіпертензії».
Доповідач зазначив, що метою лікування хворих на артеріальну гіпертензію є максимальне зниження ризику розвитку серцево-судинних ускладнень. Лікуванню підлягають усі фактори ризику, що коригуються, асоційовані клінічні стани, підвищений артеріальний тиск (АТ) per se. Цільовим є рівень АТ < 140/90 мм рт.ст. для усіх хворих, при добрій переносимості терапії це значення може бути меншим. При цукровому діабеті (ЦД), ішемічній хворобі серця (ІХС), цереброваскулярних захворюваннях (ЦВЗ) потрібно прагнути досягти рівня АТ < 130/80 мм рт.ст., а для хворих з ураженням нирок та протеїнурією ≥ 1 г/добу — < 125/70 мм рт.ст.
Для максимального зниження ризику розвитку серцево-судинних ускладнень лікуванню підлягають: усі фактори ризику, що коригуються, асоційовані клінічні стани, підвищений АТ per se.
Юрій Миколайович зазначив, що антигіпертензивні засоби представлені такими класами: бета-блокатори, тіазидні діуретики, іАПФ, блокатори рецепторів ангіотензину ІІ (БРА) та антагоністи кальцію, які, за даними метааналізу, не відрізняються між собою за здатністю знижувати АТ.
При обговоренні b-блокаторів не слід ігнорувати те, що вони є неоднорідним класом і що судинорозширюючі b-блокатори, такі як целіпролол, карведилол та небіволол, не мають деяких негативних властивостей, указаних для інших агентів.
Доповідач сказав про те, що існують міфи щодо застосування БРА, а саме, що вони:
- мають той самий механізм дії, що й іАПФ;
- менш ефективні в зниженні АТ;
- їх ефективність недостатньо досліджена;
- менш ефективні у хворих похилого віку;
- збільшують ризик виникнення інфаркту міокарда;
- збільшують ризик виникнення раку;
- менше знижують смертність, ніж іАПФ;
- рідко призначають, лише при непереносимості ІАПФ.
Юрій Миколайович приділив увагу питанню застосування комбінації у фіксованій дозі в одній таблетці та зазначив, що призначення фіксованих комбінацій двох препаратів можливо у початковій монотерапії у випадках, коли необхідно додавати другий препарат для контролю АТ, або може бути першим кроком лікування при високому серцево-судинному ризику, коли бажано досягти раннього контролю АТ. Прийом комбінації двох антигіпертензивних препаратів не дозволяє досягти адекватного контролю АТ приблизно у 15–20 % пацієнтів з артеріальною гіпертензією (АГ), тому при необхідності можуть призначатися 3 лікарських засоби. Найбільш раціональною є комбінація блокатора ренін-ангіотензинової системи, блокатора кальцієвих каналів та діуретика в ефективних дозах.
Доповідач зупинився на проблемах лікування АГ у хворих на цукровий діабет та зазначив, що вважається за доцільне рекомендувати у хворих з цукровим діабетом досягнення цільового рівня систолічного АТ до 130 мм рт.ст. (клас C) і діастолічного АТ ≤ 80 мм рт.ст. (клас А). Пороговим рівнем для призначення антигіпертензивної терапії пацієнтам із ЦД вважається АТ, що перевищує 130/80 мм рт.ст. Пацієнтам із ЦД, у яких систолічний АТ на 20 мм рт.ст. та/або діастолічного АТ на 10 мм рт.ст. перевищує пороговий, доцільно розпочинати лікування з призначення комбінованої антигіпертензивної терапії з використанням двох препаратів першого ряду (клас B).
Юрій Миколайович окреслив актуальність застосування статинів. Всі хворі на АГ з установленими серцево-судинними захворюваннями або з ЦД 2-го типу повинні отримувати терапію статинами, спрямовану на зниження рівня загального холестерину (ХС) і ХС ліпопротеїдів низької щільності (ХС ЛПНЩ) у крові до < 4,5 ммоль/л (175 мг/дл) і < 2,5 ммоль/л (100 мг/дл) відповідно і до більш низького рівня, якщо це можливо. Хворі з АГ, які не мають серцевосудинних захворювань, але мають високий серцево-судинний ризик (≥ 20 % упродовж наступних 10 років) також повинні отримувати терапію статинами, навіть якщо рівень загального ХС або ХС ЛПНЩ у них не підвищений.
Стосовно антитромбоцитарної терапії доповідач зазначив, що антитромбоцитарні засоби, зокрема низькі дози ацетилсаліцилової кислоти (АСК), слід призначати хворим на АГ, які уже перенесли серцевосудинні події, за умови відсутності надмірного ризику кровотечі. Потрібно розглянути доцільність призначення низьких доз АСК хворим на АГ, старшим за 50 років, без серцево-судинних ускладнень в анамнезі, які мають високий та дуже високий додатковий ризик, та пацієнтам із підвищенням вмісту креатиніну у крові навіть у випадку помірного його підвищення. Для зменшення ризику геморагічного інсульту лікування антитромбоцитарними препаратами потрібно розпочинати після досягнення ефективного контролю АТ.
Доповідач дав визначення поняття «резистентна (рефрактерна) АГ»: такою є АГ, якщо за умови призначення трьох або більше антигіпертензивних препаратів в адекватних дозах (один із яких обов’язково є діуретиком) не вдається досягти цільового рівня АТ. Причинами істинної резистентної АГ є: невиявлена вторинна гіпертензія, цукровий діабет, гіпертонічна хвороба або вторинна гіпертензія з тяжким перебігом. Стратегіями щодо зміни терапії у таких хворих є, з одного боку, раціоналізація, яка полягає у зміні препарату на брендові препарати, або призначення препаратів, які посилюють ефект один одного, обов’язкове застосовування діуретика (хлорталідон, петльовий диуретик при ШКФ < 30 мл/хв або комбінація діуретиків), застосування препаратів тривалої дії, фіксованих комбінацій, призначення препаратів на ніч. З іншого боку, підсилення, що полягає у застосуванні максимальної добової дози (можливо за 2 прийоми), додаванні спіронолактону (еплеренон менш ефективний), b-адреноблокатора, препарату центральної дії, можливо розглянути застосування інших вазодилататорів та інтервенційних технологій.
Підбиваючи підсумок, Юрій Миколайович визначив, що лікування хворого з АГ у 2013 році — це застосування антигіпертензивного препарату (комбінованого), статину та антитромбоцитарного препарату (за показаннями).
Начальник відділу моніторингу медичних імунобіологічних та вакцинних препаратів Департаменту післяреєстраційного нагляду ДП «Державний експертний центр МОЗ України» к.м.н. Валерія Анатоліївна Васильєва висвітлила основні питання імунопрофілактики в доповіді «Підходи до оцінки співвідношення користі/ризику вакцин у програмах імунопрофілактики».
Доповідач зазначила, що вакцинація є одним із найбільших досягнень людства і надійним способом запобігання інфекційним хворобам. Широке застосування вакцин дозволяє щорічно зберігати мільйони людських життів, попереджати інвалідизацію населення, у сотні разів знижувати захворюваність на інфекційні хвороби, збільшувати тривалість життя, попереджати розвиток онкозахворювань, впливати на рівень уродженої патології, а також соматичної, що є наслідком перенесених інфекційних хвороб.
Історичний аналіз програм імунізації відображає, що при достатньому охопленні щепленнями показник захворюваності на інфекційні хвороби знижується. Доведено: якщо вакцинація припиняється — хвороба повертається і забирає життя незалежно від соціальних умов. Безумовно, вакцинація — це велике досягнення медицини, безперечною є її користь як для окремо взятої людини, так і для населення в цілому.
Застосування вакцин не виключає ризик розвитку побічних реакцій, які можуть бути обумовлені властивостями вакцинного препарату або процесом вакцинації. Безпека та ефективність вакцин, що застосовуються, залежить від типу вакцини, допоміжних речовин, що входять до їх складу, схеми та способу введення, віку щепленого, дотримання температурних умов зберігання.
На підставі даних післяреєстраційного нагляду за безпекою вакцин в Україні частота місцевих реакцій при використанні вакцин, що містять у своєму складі ад’ювант як допоміжну речовину, вища (1,0–1,5 %) порівняно з вакцинами без ад’юванта (0,2 %). Частота алергічних реакцій практично однакова (0,0002–0,0004 %), їх розвиток обумовлений підвищеною чутливістю організму щепленого до компонентів, що входять до складу різних типів вакцин. Побічні реакції у вигляді холодного та післяін’єкційного абсцесів обумовлені процесом вакцинації та пов’язані з підшкірним введенням вакцин БЦЖ і БЦЖМ (0,01 %) або поверхневим введенням адсорбованих вакцин АДСМ і гепатиту В (0,00005–0,00008 %). Ризик розвитку побічних реакцій зростає зі збільшенням числа ін’єкцій за рахунок можливого збільшення технічних помилок, пов’язаних з процедурою вакцинації.
Загальний принцип оцінки співвідношення «користь/ризик» при застосуванні вакцин проводиться щодо всієї популяції в цілому за кожним з показників. Нові ризики зазвичай «кваплять» з оцінкою, проте необхідно оцінювати співвідношення ефективності та безпеки конкретної вакцини, а не тільки ризик розвитку поодиноких побічних реакцій. Як правило, поодинокі випадки не можуть розглядатися як підстава для зміни співвідношення «користь/ризик».
Також Валерія Анатоліївна наголосила на тому, що, незважаючи на складність і трудомісткість проведення епідеміологічних досліджень з вивчення ризиків після імунізації, вони проводяться і вказують на те, що одночасне введення декількох вакцин не перевантажує імунітет; комбінована вакцина для профілактики кору, паротиту, краснухи та вакцини, які містять у своєму складі ртуть як консервант, не збільшують ризик розвитку аутизму; вакцини не призводять до розвитку синдрому раптової дитячої смерті й алергічних захворювань.
Роботу другого засідання розпочав член-кор. НАМН України д.м.н., професор Б.М. Маньковський (ДП «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка» НАМН України) доповіддю щодо підходів до вирішення питання взаємозамінності лікарських засобів.
Наступна доповідь д.м.н., професора Є.П. Свіщенко (завідувач відділу есенціальної гіпертензії ДУ ННЦ «Інститут кардіології імені академіка М.Д. Стражеска») була присвячена питанням ефективності та безпеки лікарських засобів у сучасних підходах до лікування гіпертонічної хвороби.
Доповідач звернула увагу на те, що у 2012 році за середньою тривалістю життя Україна порівняно з такими країнами світу, як Монако, Японія, Франція, Канада, США, Чехія, Польща, посіла восьму сходинку, відсунувши на дев’яте місце за даним критерієм Росію.
У структурі смертності населення внаслідок різних системних патологій смертність від хвороб кровообігу в країнах Євросоюзу за станом на 2008 рік становила 37,5 %.
Смертність в Україні від патології серцево-судинної системи у 2012 році становила 65,8 %.
Щороку 7,5 млн смертей у світі (13 %) пов’язано з артеріальною гіпертензією. АГ є фактором ризику смерті № 1.
Рекомендації ESH/ESC (2013) зі зниження рівня артеріального тиску такі: АТ < 140/90 мм рт.ст. для всіх хворих, крім хворих із діабетом, у яких цільовий АТ < 140/85 мм рт.ст. (у разі можливості діастолічний артеріальний тиск (ДАТ) 80–85 мм рт.ст); хворих із протеїнурією на тлі нефропатії (діабетичної та недіабетичної — для них цільовий систолічний артеріальний тиск (САТ) < 130 мм рт.ст.); літніх хворих (цільовий САТ 150–140 мм рт.ст. і, якщо можливо, < 140 мм рт.ст.).
Препаратами вибору при АГ відповідно до рекомендацій ESH/ESC (2013) є: діуретики (тіазиди, хлорталідон, індапамід), b-адреноблокатори, блокатори кальцієвих каналів, блокатори рецепторів ангіотензину II.
Однією з особливостей тіазидних діуретиків є їх органопротекторна дія. До різновидів органопротекторної дії діуретиків належать: церебропротекція, кардіопротекція (запобігання таким захворюванням, як ішемічна хвороба серця (ІХС), серцева недостатність (СН), а також регрес гіпертрофії лівого шлуночка (індапамід)) і нефропротекція.
У цілому, зі слів доповідача, за даними низки дослідників (Clement D.L., 2011; ASCOT; Rotwell et al.), основні групи антигіпертензивних препаратів мають як переваги, так і недоліки:
- блокатори кальцієвих каналів найбільш ефективно зменшують варіабельність АТ;
- b-адреноблокатори не зменшують варіабельність АТ;
- при використанні діуретиків спостерігається тенденція до зменшення варіабельності АТ;
- інгібітори АПФ та брадикініну (БРА) не призводять до очевидного зниження варіабельності АТ.
Також у доповіді наведені дані зарубіжних дослідників щодо ризику деменції при антигіпертензивній терапії, частоти припинення лікування антигіпертензивними засобами, методів визначення резистентності до лікування.
Доповідь к.м.н. О.В. Давидович, доцента кафедри терапії та геріатрії НМАПО ім. П.Л. Шупика, була присвячена факторам, що впливають на ефективність та безпеку ліків, які використовуються при лікуванні гіпертонічної хвороби.
Доповідач зазначила, що артеріальна гіпертензія є одним із головних чинників ризику розвитку церебральних (інсульту, дисциркуляторної енцефалопатії, транзиторної ішемічної атаки) та кардіальних (інфаркту міокарда, серцевої недостатності та артеріальної аневризми) ускладнень і є основною причиною хронічної ниркової недостатності). За її словами, навіть відносно помірне підвищення артеріального тиску крові призводить до скорочення тривалості життя. О.П. Давидович зосередила увагу на рекомендаціях щодо зміни способу життя та дотримання необхідної дієти, головною особливістю якої є обмеження споживання натрію, червоного м’яса, солодощів та цукру, а також збільшення споживання горіхів, цільного зерна, риби, птиці, овочів і фруктів, що допомагає стабілізувати артеріальний тиск. Крім того, доповідачем зазначено важливість споживання продуктів, багатих на калій, магній та кальцій, а також білок. Такі методи можуть стати основним фактором контролю за артеріальним тиском і знизити ризик виникнення серйозних ускладнень для здоров’я, однак для багатьох пацієнтів зміна способу життя виявляється неефективною або недостатньою, у такому випадку необхідним є медикаментозне лікування.
Доповідачем розглянуто три механізми підвищення артеріального тиску, приділено увагу питанням електрокардіографічного дослідження та проблемам вибору препарату при артеріальній гіпертензії.
Також доповідачкою приділено увагу лікуванню артеріальної гіпертензії в поєднанні з такими захворюваннями, як ішемічна хвороба серця, метаболічний синдром/цукровий діабет, хронічні захворювання нирок, а також висвітлені питання, що стосуються добового моніторингу артеріального тиску.
В.о. директора проекту SIAPS в Україні Management Sciences for Health, Inc. Ольга Дужа у частині 3 секції 9 представила доповідь на тему «Складові ефективного і безпечного лікування туберкульозу».
Як зазначила доповідач, покращення доступу до лікарських засобів (ЛЗ) є складовою частиною ефективного лікування хворих на туберкульоз у кожній країні. Характеристиками доступу до ЛЗ є такі моменти: якість, ефективність та безпека, придатність до застосування, реєстрація на території та наявність на ринку, доступність за ціновою категорією та географічною ознакою.
Завжди виникають проблемні питання у сфері забезпечення безпеки та якості ЛЗ:
- непослідовне або невідповідне використання національних стандартних протоколів лікування туберкульозу;
- застосування ЛЗ сумнівної якості або тих, що не відповідають стандартним вимогам;
- незадовільний розподіл та зберігання протитуберкульозних препаратів;
- невідповідні педіатричні лікарські форми;
- неповні історії хвороби пацієнтів або інша документація, яка б дозволила визначити потенційні ризики, такі як взаємодія лікарських засобів або побічні реакції.
У державі обов’язково необхідно розподіляти важливі аспекти управління ЛЗ між різними організаціями, наприклад:
- за вибір ЛЗ, які будуть використовуватись на території протягом певного часу, відповідальність можна покласти на робочі групи або інших технічних спеціалістів, регуляторні установи, пацієнтів або інші громадянські організації й осіб, залучених до закупівель лікарських засобів;
- процес закупівлі можуть контролювати агенції з закупівель, постачальники, виробники, регуляторні установи, митна служба, інспектори продукції, керівники контракту;
- процес розподілу закуплених ЛЗ може контролювати організація, яка керує зберіганням лікарських засобів, пункти проміжного відвантаження, менеджери складського зберігання та персонал управління запасами, менеджери з якості національного та місцевого рівнів, транспортні агентства, менеджери автопарків, водії;
- раціональне використання ЛЗ — медичні працівники, організації або спеціалісти, які здійснюють моніторинг якості медичних послуг, регуляторні установи, групи пацієнтів.
При забезпеченні найкращих практик забезпечення якості та безпеки лікарських засобів досягаються підвищення безпеки пацієнтів та ефективність лікування туберкульозу, оптимізація лікувальних процесів та бажані результати лікування завдяки забезпеченню пацієнтів якісними та безпечними ЛЗ, підвищення довіри суспільства до якості та ефективності ЛЗ та медичних послуг, заощадження коштів завдяки запобіганню невдалому лікуванню.
Серед наскрізних питань покращення доступу до ЛЗ доповідачем були зазначені такі:
- періодично переглядати та оновлювати політику та процедури з метою підвищення ефективності, результативності та дотримання найкращих міжнародних практик;
- продовжувати розбудову кадрового потенціалу шляхом тренінгів, навчання та підтримуючого нагляду з метою розширення кола обов’язків для спеціалістів, які не мають фармацевтичної освіти, визнання необхідності спеціалізованої підтримки за умови швидкого зростання програм протидії туберкульозу та ВІЛ;
- створювати зв’язки між програмами охорони здоров’я з метою інтеграції доступу до лікарських засобів та медичних послуг.
Від колективу авторів з доповіддю «Несприятливі наслідки застосування протитуберкульозних лікарських засобів з боку органів зору» виступила У.М. Тілєкєєва, яка доповіла про результати власних досліджень.
Продовжила засідання С.М. Антоняк, науковий співробітник ДУ « Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України», яка у своїй доповіді висвітлила певні аспекти однієї з найглобальніших проблем людства — епідемії СНІДу.
Наведені в доповіді дані офіційної світової статистики свідчать про масштаби і катастрофічні наслідки епідемії. Так, станом на 2011 р. кількість людей, які живуть на планеті з ВІЛ-інфекцією, становила 34,0 млн, а кількість смертей перевищила 1,7 млн. Незважаючи на колосальні зусилля наукової та медичної спільноти, епідемія СНІДу продовжує зростати в усьому світі. В Україні, як і в інших країнах, продовжується зростання показників захворюваності на СНІД та смертності, пов’язаної зі СНІДом (щорічно реєструється понад 20 000 нових випадків захворювання (45,5 на 100 тисяч населення) і близько 4000 смертей. Серед померлих унаслідок СНІДу діти становлять близько 1 %, проте щорічно втрачається 15–25 дитячих життів!
Особливу увагу доповідач звернула на проблему передачі ВІЛ-інфекції від матері до дитини. В Україні частота передачі ВІЛ від матері до дитини становить 4,9 %. У 2009 році антиретровірусна терапія (АРТ) проведена 95 % ВІЛ-позитивних вагітних, у яких вагітність завершилася пологами, із них у 6,8 % ВІЛ-позитивних жінок проведена АРТ-профілактика тільки в пологах. У 68,2 % ВІЛ-позитивних жінок родорозрішення відбулося через природні родові шляхи, у 26,8 % ВІЛ-позитивних жінок — шляхом елективного кесаревого розтину, у 5,0 % — шляхом екстреного кесаревого розтину (за акушерськими показаннями). 10,2 % матерів з діагнозом III—IV клінічні стадії ВІЛ-інфекції на момент пологів, 5,5 % матерів були активними ПІН під час вагітності. 98,4 % дітей отримали АРТ-профілактику, 99,5 % дітей перебували на штучному вигодовуванні.
Ключова частина доповіді С.М. Антоняк була присвячена питанням АРТ у боротьбі з ВІЛ-інфекцією. За даними доповідача, найбільш значне зниження смертності було досягнуто після впровадження в широку практику інгібіторів протеази (ІП). Антиретровірусні лікарські засоби (АРВ ЛЗ) мають високу активність. Їх використання як третього компонента у схемі АРТ (у поєднанні з двома нуклеазидними інгібіторами зворотної транскриптази (НІЗТ)) різко підвищило ефективність терапії. З уведенням АРТ, що забезпечує відновлення кількості лімфоцитів CD4, значно знизилася захворюваність на опортуністичні інфекції.
У доповіді були також озвучені: основна мета АРТ на сьогодні та етапи боротьби з ВІЛ-інфекцією на державному рівні. Результати боротьби з ВІЛ-інфекцією свідчать про невпинну працю всього світового співтовариства, спрямовану проти цього нещадного і грізного захворювання.
Результатом еволюції АРТ є стандартизація комбінованих схем лікування, що стало основою високої активності терапії (всі сучасні стандартні схеми АРТ високоактивні).
Доповідач також акцентувала увагу на тому, що стандартизація схем АРТ є водночас засобом мінімізації побічних реакцій.
У доповіді наведено результати досліджень щодо ефективності та безпеки АРТ. Так, дослідження ATLIS (AIDS Treatment for Life) показало, що 57,4 % пацієнтів переривали прийом АРВ ЛЗ через побічні реакції, 27,3 % взагалі відмовилися через виникнення ПР.
На ґрунті всього вищенаведеного доповідач підкреслила, що сьогодні під невдачею АРТ розуміють не тільки недостатню відповідь на лікування, а й наявність ПР, що перешкоджають продовженню лікування за схемою АРТ (незалежно від того, наскільки вона ефективна). Саме тому дуже важливо, щоб це положення усвідомили всі медичні працівники, які здійснюють допомогу і лікування людей, що живуть із ВІЛ. Оцінка відповіді на лікування та ПР препаратів є невід’ємною частиною наданої допомоги.
Наводячи основні причини виникнення ПР при проведенні АРТ, з урахуванням всіх її особливостей, доповідач акцентувала увагу слухачів на необхідності здійснення фармаконагляду при АРТ.
Доповідачем також була висвітлена проблема виявлення ризиків, оцінки та запропоновані підходи до управління ризиками.
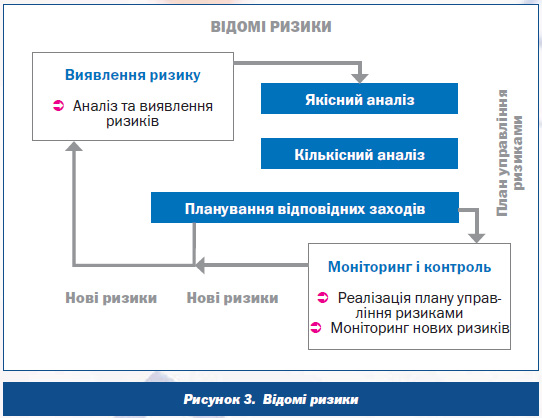
Управління ризиками — це інтерактивний безперервний процес, що включає:
- оцінку співвідношення «користь/ризик ЛЗ»;
- розробку та впровадження методів мінімізації ризику за умови збереження користі;
- оцінку ефективності методів і повторної оцінки співвідношення «користь/ризик»;
- відповідне коректування методів мінімізації ризику для постійного поліпшення співвідношення «користь/ризик».
Комунікація ризику — це інтерактивний процес обміну інформацією про ризики серед медичних працівників, пацієнтів та громадськості.
Управління ризиком, як правило, передбачає не просто внесення змін до інструкції з медичного застосування та заходи регуляторних документів. Це ще й підтримка прийняття рішень медичними працівниками для призначення ЛЗ, проведення моніторингу безпеки.
Фармацевтична допомога, наголосила доповідач, може знизити тягар ПР, що можна попередити, шляхом:
- надання інформаційних послуг про ЛЗ;
- моніторингу та повідомлення про підозрювані ПР;
- проведення оцінки використання ЛЗ;
- терапевтичного моніторингу ЛЗ;
- консультування пацієнта — формування прихильності до лікування;
- оцінки медичних помилок та запобігання їм.
До стратегій мінімізації ризику відносяться: вимоги до інформації в інструкції із застосування ЛЗ, навчання медичних працівників, пацієнтів і команди супроводу, фармацевтична допомога, системи нагадування. При впровадженні стратегій повинні залучатися зацікавлені сторони, підтримуватися доступ до ЛЗ, стратегії повинні перевірятися на предмет їх ефективності. До комунікації ризиків повинні мати відношення як медичні працівники, так і пацієнти та громадськість.
Далі доповідачем були зроблені наступні висновки:
- управління ризиком не означає його викорінення;
- у багатьох випадках не можна отримати користь від застосування ЛЗ без прийнятного ризику;
- ЛЗ вважається безпечним, якщо він має прийнятні ризики, підтверджену користь від застосування й існує альтернативне лікування.
Доповідь д.м.н., професора О.О. Яковлевої, завідувача кафедри клінічної фармації та клінічної фармакології Вінницького національного медичного університету ім. М.І. Пирогова, була присвячена сучасним аспектам діагностики та лікування легеневої артеріальної гіпертензії (ЛАГ).
Доповідачем розглянуто визначення терміна «легенева гіпертензія», а також акцентовано увагу на класифікації та діагностичних критеріях цієї патології.
Доповідачем висвітлені важливі аспекти епідеміології та патогенетичні механізми розвитку ЛАГ, а також клінічні прояви зазначеного захворювання.
Доповідач приділила увагу методам діагностики, гострим лікарським про-бам в оцінці вазореактивності при ЛАГ, а також основним класам лікарських засобів, що застосовуються для лікування ЛАГ:
- антикоагулянти та дезагреганти;
- оксигенуючі засоби;
- антагоністи кальцію;
- простаноїди;
- оксид азоту та інгібітори фосфодіестерази типу 5;
- антагоністи рецепторів ендотеліну;
- серцеві глікозиди, інотропні засоби;
- діуретики.
Доповідачем зосереджено увагу на труднощах своєчасної діагностики ЛАГ та приділено увагу важливим питанням лікування ЛАГ. Особливо висвітлені еволюційні підходи до терапії ЛАГ.
Доповідач не залишила поза увагою і такі поняття, як функціональні класи ЛАГ та важливість їх клінічного визначення у своєчасній діагностиці ЛАГ.
Доповідь В.В. Чоп’як, професора кафедри алергології та імунології Львівського національного медичного університету ім. Данила Галицького, на тему «Міжнародні та вітчизняні підходи до діагностики, лікування та профілактики медикаментозної алергії» висвітлила актуальність проблем алергії та шляхи їх вирішення. Оскільки проблема алергізації населення є нині надзвичайно актуальною, світова медична спільнота, як наголосила доповідач, приділяє вивченню питань діагностики, лікування та профілактики медикаментозної алергії величезну увагу.
У своїй доповіді В.В. Чоп’як дала визначення терміна медикаментозної алергії (МА) як імунозалежної чи імуноопосередкованої реакції організму на введення медикаменту. Також були визначені механізми розвитку МА (імунні й неімунні) і основні фактори ризику розвитку МА, до яких віднесено структуру медикаменту, неконтрольований прийом лікарських засобів (ЛЗ), ускладнений алергологічний анамнез, особливості імунної відповіді пацієнта, генетичні фактори, порушення обміну речовин, вірусні імунотропні та грибкові інфекції, хвороби печінки тощо.
Доповідач звернула увагу слухачів на ті групи ЛЗ, які найчастіше викликають МА. За даними ДП «Державний експертний центр МОЗ України» (ДЕЦ), у 1996–2012 рр. до них належали: антибактеріальні ЛЗ системної дії — 39,2 %, нестероїдні протизапальні ЛЗ — 6 %, вітаміни — 5,8 % та місцеві анестетики — 4,8 %.
Також було відмічено клінічні прояви МА, зареєстровані в ДЕЦ за останні роки. Серед них особливу увагу відведено МА з тяжким клінічним перебігом, у тому числі таким, що стали причиною летальних випадків.
Значну частину своєї доповіді професор приділила аспектам діагностики МА, оскільки своєчасна та якісна діагностика забезпечує ефективність лікування та є запорукою здоров’я пацієнта.
У заключній, четвертій частині 9-ї секції прозвучала доповідь «Аналіз призначень лікарями лікарських засобів рослинного походження за методикою RxTestТМ»1, представлена к.м.н. Світланою Лур’є, директором Medical Data Management (МDМ)2, м. Київ.
З 2012 року компанія МDМ проводить унікальне для України дослідження — «Аудит лікарських призначень RxTestТМ». Дане дослідження проходить у 15 найбільших обласних центрах України серед лікарів 16 спеціальностей як поліклінік, так і стаціонарів. На основі отриманої в дослідженні інформації підготовлена доповідь за темою «Аналіз призначень лікарями лікарських засобів рослинного походження за методикою RxTestТМ».
Всі лікарські препарати, зареєстровані в Україні, умовно можна поділити на 3 категорії:
1. ЛЗ хімічного походження.
2. ЛЗ рослинного походження.
3. Гомеопатичні ЛЗ.
При аналізі структури призначень у рамках дослідження «Аудит лікарських призначень RxTestТМ» було визначено, що частка ЛЗ рослинного походження у призначенні лікарів 16 спеціальностей за січень — червень 2013 року становила 5,1 %. Лідерами у призначенні лікарських засобів рослинного походження за кількістю призначень є терапевти — найбільш численна спеціальність в Україні. Але якщо розглядати більш детально структуру призначення препаратів за кожною спеціальностю окремо, то лідируючу позицію займатимуть лікарі-урологи. Понад 21 % з усіх призначених урологами препаратів становлять ЛЗ рослинного походження. На другому місці за структурою призначень знаходяться гінекологи. Але розрив між першим і другим місцем за даним показником значний (21,6 і 9,3 % відповідно).
При подальшому аналізі та порівнянні 2 категорій (ЛЗ рослинного і хімічного походження) можна зробити висновок, що структура призначень буде значно відрізнятися. Так, ЛЗ рослинного походження в основному призначають при респіраторно-вірусних захворюваннях і хворобах сечо-статевої системи.
Лідерами у призначенні ЛЗ рослинного походження серед лікарів 16 спеціальностей3 у загальній категорії ЛЗ за підсумками першого півріччя 2013 року стали препарати Канефрон® Н і Синупрет®. Якщо розглядати загальний рейтинг призначень препаратів, то вони займають 16-ту і 20-ту позиції.
Для прикладу і більш детального розгляду особливостей призначення препаратулідера групи ЛЗ рослинного походження візьмемо препарат Канефрон® Н. Основним діагнозом, при якому відбувалися призначення даного препарату (наприклад, терапевтами), згідно з класифікацією МКХ-10 2-го рівня, стали N10-N16 тубулоінтерстиціальні хвороби нирок (гострий і хронічний пієлонефрит, дисметаболічна нефропатія тощо). Тривалість призначення при даному діагнозі становить в основному від 5 до 30 днів. Якщо розглядати статево-віковий розподіл пацієнтів, то більшу частку становлять жінки віком від 20 до 50 років.
Таким чином, при аналізі даних про призначення ЛЗ в Україні стає очевидним, що значну частку в призначенні становлять ЛЗ рослинного походження. Незважаючи на деяку скептичну думку великої кількості фахівців, препарати-лідери цієї категорії активно застосовуються в лікуванні таких захворювань, як пієлонефрити, цистити, урогенітальні інфекції, респіраторно-вірусні захворювання та ін.
Частину 1 СЕКЦІЇ 10
«Раціональна фармакотерапія: ризики та управління ними в лікувальному процесі»
вели Олена Миколаївна Новічкова, співробітник кафедри менеджменту охорони здоров’я НМУ імені О.О. Богомольця; Юрій Степанович Рудик, д.м.н., керівник відділу клінічної фармакології та фармакотерапії Національного інституту терапії ім. Л.Т. Малої НАМН України; Ольга Олександрівна Яковлева, професор, зав. кафедри клінічної фармації та клінічної фармакології Вінницького національного медичного університету ім. М.І. Пирогова.
Відкрила секцію Олена Новічкова з доповіддю «Ризики і управління ними в лікувальному закладі». За словами доповідача, ризик — це можливість завдання шкоди, захворювання або пошкодження, а під управлінням ризиками розуміють систематичне виявлення, оцінку, ефективний контроль і моніторинг ризиків, що загрожують пацієнтам, персоналу, власності або репутації організації. Систему ефективної безпеки можна описати як систему чотирьох «К», яка об’єднує комунікацію, компетентність, кооперацію і контроль.
Як зазначила доповідач, серед шести основних характеристик якості в медицині виділяють: орієнтованість на потреби пацієнта, безпеку, ефективність, раціональність, справедливість, своєчасність. Безпека як попередження заподіяння шкоди пацієнту під час надання медичної допомоги є однією з основних характеристик якісної медичної допомоги.
Розпізнати ризики можна, систематично відповідаючи на питання: що може статися? коли і де це може статися? як і чому це може статися? як ми можемо цьому запобігти або мінімізувати? А також використовуючи такі методи визначення ризиків, як мозковий штурм, макетування клінічних маршрутів пацієнта і прохання до співробітників оцінити ризики на кожному етапі, створення checklists ризиків і проведення опитувань.
Доповідач зазначила, що оцінці та аналізу ризику сприяє попереднє виявлення потенційних ризиків і можливої шкоди, а також відповідь на запитання, чи є наявні превентивні заходи достатніми або необхідні додаткові заходи. Слід фіксувати результати і вносити зміни, а також, якщо потрібно, повторювати оцінку та вносити зміни до плану.
Деякі ризики виявити досить легко: неполадки з електропостачанням, погане покриття або пошкоджені спуски і сходи тощо. Але більшість ризиків неочевидні на перший погляд: забруднені бактеріями поверхні, алергічні реакції, помилки персоналу при великих потоках пацієнтів. Тому персонал закладів охорони здоров’я повинен знати, як виявляти і враховувати в документації клінічні ризики, випадки неналежної практики, помилки при часто повторюваних, машинальних процедурах. Якщо потрібно виявити ризик, то слід добре знати рутинну практику, як відбувається власне дія в робочому середовищі. Потрібна вірогідна інформація про несприятливі події, результати аудиту, опитувальники, реєстр скарг тощо.
За словами доповідача, основною причиною неефективного управління ризиками та виникнення нещасних випадків на роботі є людська халатність, недостатня освіченість. Результатом неефективного управління ризиками є людські втрати і страждання, економічні (втрата бізнесу, втрата репутації), юридичні (штрафи та компенсації).
В Україні зроблено перші спроби впровадження стратегії управління ризиками в медичну практику. У 2012 р. МОЗ України було затверджено «Методичні рекомендації клінічного управління ризиками та безпеки медичної допомоги у закладах охорони здоров’я» (№ 74.12/168.12 від 03.08.2012). У рекомендаціях представлена модель покращення якості та взаємодії між принципами, структурою і процесом менеджменту ризиків. Ці методичні рекомендації базуються на міжнародних підходах до управління ризиками.
Завершила свою доповідь Олена Новічкова висловлюванням: «Ризик — це проблема, яка ще не виникла, а проблема — це ризик, який матеріалізувався».
З доповіддю «Фармакогенетичні фактори, що впливають на ефективність і безпеку ліків» виступив Юрій Рудик. Він нагадав, що у 80-ті роки експерти ВООЗ визначили головний фармакотерапевтичний критерій — співвідношення «користь/ризик», який разом із такими вимогами до лікарських засобів, як ефективність, безпека, доступність і прийнятність для пацієнта, став невід’ємною частиною одного з основних напрямків сучасної медицини — раціональної фармакотерапії. Бурхливий розвиток лікарських засобів (ЛЗ) в останні десятиліття і поява великої кількості нових ліків не тільки розширили можливості лікування, а й підвищили ризик нанесення шкоди пацієнту. Саме небезпека розвитку тяжких, часом необоротних ускладнень внаслідок лікарської терапії привертають до проблеми безпеки використання ЛЗ увагу лікарів і пацієнтів.
Доповідач зазначив, що відповідь пацієнтів на лікування ЛЗ відрізняється значною варіабельністю. На сьогодні відсутні будь-які біомаркери, які дозволили б передбачити, у кого із пацієнтів ЛЗ у певній дозі буде ефективний, у кого не буде ефекту, а в кого розвинуться небажані побічні реакції (ПР). Індивідуальний режим прийому та дозування препарату встановлюється лікарем методом проб і помилок, але подібний підхід загрожує небезпекою виникнення серйозних ПР. У зв’язку з цим раціональний підхід до призначення препаратів може бути забезпечений шляхом вивчення ПР і генетичних особливостей конкретного пацієнта. Генетичну залежність дії ЛЗ у науковому аспекті почали вивчати задовго до розкриття геному. Накопичені дані дозволили раціоналізувати застосування багатьох ЛЗ з урахуванням індивідуальної чутливості пацієнта. Чим більше дізнавалися про геном людини, тим більше було зрозуміло, що в основі індивідуальної реакції на лікарські засоби може лежати поліморфізм одного нуклеотиду. Персоналізована медицина, зокрема клінічна фармакогенетика, що вивчає спадкові основи індивідуальної відповіді на лікарські препарати, на сучасному етапі інтенсивно розвивається, і концептуальну основу персоналізованої медицини становлять уявлення про генетичний поліморфізм. На сьогодні генетичні дослідження, багато з яких проводяться в рамках багатоцентрових рандомізованих плацебо-контрольованих проектів, переслідують дві стратегічні мети — глибше розуміння патофізіології процесу з можливістю стратифікації ризику захворювання та його ускладнень і розробка індивідуального підходу до лікування пацієнтів на основі ідентифікації респондерів на специфічне лікування.
Особливу увагу привертає поліморфізм генів, які впливають на сімейство бета-адренорецепторів (b-АР). З’явилися нові можливості для відповіді на питання про те, чи всі пацієнти із серцевою недостатністю для поліпшення свого прогнозу потребують обов’язкового досягнення цільових доз b-АБ. І якщо не вдається досягти цільової дози b-АБ, а лише його максимально переносимої дози, чи означає це, що у таких хворих прогноз менш сприятливий? На сьогодні залишається не до кінця зрозумілим, у яких клінічних ситуаціях краще застосовувати той чи інший b-АБ. Передбачається, що існує популяція, тою чи іншою мірою резистентна до застосування b-АБ, що, очевидно, пов’язано з поліморфізмом генів, що кодують b-АР. У відділі клінічної фармакології та фармакотерапії ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України» впродовж тривалого періоду вивчається проблема оптимізації лікування хворих із серцевою недостатністю з урахуванням їх фармакогенетичного профілю.
За словами Ю. Рудика, накопичені на сьогодні дані фармакогенетичних досліджень із великою часткою оптимізму дозволяють припустити, що індивідуальний підхід до пацієнта, заснований на науковій інтерпретації результатів дослідження генетичного поліморфізму та їх порівнянні з даними клінічних, лабораторних та інструментальних методів дослідження, дозволить не тільки здійснити ранню діагностику генетично детермінованого ризику розвитку захворювання, його прогресування, а й запропонувати максимально ефективну і безпечну схему профілактичних і лікувальних заходів для попередження розвитку патологічного процесу.
Продовжила тему раціональної фармакотерапії Ольга Яковлева з доповіддю «Генетичний поліморфізм ферментів ацетилювання як предиктор кардіотоксичності та фармакотерапії бронхіальної астми». Як зазначила доповідачка, ця проблема дуже актуальна не тільки в Україні, а й в усьому світі. Адже бронхіальна астма (БА) і хронічні обструктивні захворювання легень (ХОЗЛ) — найпоширеніша патологія як в Україні, так і в усьому світі (у світі нараховують 150 млн хворих на БА, та не менше 6,5 млн (13 %) наших співвітчизників страждає від БА або ХОЗЛ). Складною і невирішеною залишається проблема асоціації ураження легень та серця.
Безпека та ефективність базисної фармакотерапії БА, за словами Ольги Яковлевої, залежить, з одного боку, від індивідуального фенотипового поліморфізму метаболізму у пацієнта, з іншого — від особливостей препаратів, що застосовуються для лікування хвороби. Фармакогенетичні особливості біотрансформації ліків є актуальною проблемою, яка недостатньо досліджується в Україні, особливо у хворих на бронхіальну астму.
Для прогнозування ефективності та безпеки фармакотерапії хворих на БА був запропонований комплексний діагностичний підхід, що включає: холтерівське моніторування, визначення фенотипів N-ацетилтрансферази-2 — повільних і швидких ацетиляторів, визначення синдрому ендогенної інтоксикації, визначення біо-хімічних маркерів пошкодження міокарда.
У процесі дослідження виявили, що метаболічні коректори в поєднанні з базисною фармакотерапією БА захищають організм хворих від проявів інтоксикації і зменшують кардіотоксичність. Ефективність цього захисту залежить від фенотипів ацетилювання.
При порівнянні запропонованих схем фармакотерапії встановлено, що застосування кардонату на фоні базисної терапії є ефективнішим у хворих з повільним типом ацетилювання, а призначення мілдронату — у швидких ацетиляторів.
Частина 2 секції 10, яку вели професори Пол Фінглас і Надія Бойко, була спрямована на пошук ефективних підходів до вирішення таких соціальних проблем, як ожиріння, старіння, та пов’язаних із харчуванням хронічних захворювань, що є чи не найважливішими проблемами охорони здоров’я в Європі та й у світі в цілому, саме тому вони знаходяться в центрі уваги багатьох нових наукових проектів та ініціатив.
Доповідь Пола Фінгласа, який працює у Великобританії в Інституті досліджень їжі у Науково-дослідному парку, розташованому в м. Норідж, присвячена висвітленню ролі мережевого електронного ресурсу (EuroFIR — Європейський ресурс індексації їжі) у підтримці здорового харчування і здорового способу життя. Проф. Пол Фінглас одночасно очолює європейську організацію EuroFIR AISBL, яка знаходиться у Брюсселі.
У своїй доповіді він зупинився на важливості правильної, вірогідної, аналітичної комплексної оцінки фактичного харчування та на аналізі складу продуктів як необхідного інструменту для ефективної дієтології в медицині та раціональної політики в галузі охорони здоров’я. Така оцінка можлива за наявності в Україні, як і в більшості країн світу, електронних баз даних споживання продуктів харчування (FCDBs — Food Composition Data Bases), які містять вичерпні відомості про наявні харчові раціони і всі дані про склад харчових компонентів — усіх поживних речовин у їжі і тому можуть бути використані для маркування продуктів харчування, у тому числі тих, які є корисними для здоров’я людини. Такі бази даних, як правило, широко використовуються споживачами, медичними працівниками, міністерством охорони здоров’я, науковцями, приватними підприємствами харчової промисловості тощо.
Електронні бази даних споживання продуктів харчування (FCDBs) традиційно були складені на національному рівні ряду європейських країн, але останнім часом завдяки підтримці Європейської комісії вони були уніфіковані з метою забезпечення можливості їх порівняння, загальної доступності і узгодження наявних даних. Європейський інформаційний ресурс їжі (EuroFIR) — це діюча мережа фахівців із передовим досвідом, а електронні ресурси (зокрема, такі як EuroFIR NEXUS) мають на меті повне узгодження композиційних баз даних (КБД) по всій Європі та за її межами шляхом розробки керівних принципів, методик і процедур контролю якості для професійних працівників, які її заповнюють і підтримують (компіляторів). З іншого боку, EuroFIR є своєрідною платформою продовольчої біржі (див. більш детально на www.eurofir.org), яка дозволяє користувачам отримувати доступ до КБД вже 26 членів ЄС. Такі бази даних є також в Австралії, Канаді та США, вони одночасно забезпечують підтримку використання та інструменти (програмне забезпечення) для користувачів і укладачів. Для прикладу: це такі інструменти, як FoodEXplorer — для пошуку компонентів у КБД, FoodBasket — для розрахунку всіх складових їжі на основі рецепту, FoodTransporter — для експорту даних, а також для управління базами даних — FoodCASE.
Інші загальноєвропейські узгоджені ініціативи, пов’язані з ВМД, включають співпрацю з EFSA (Європейський орган із продовольчої безпеки), ЄС-меню, у якому національні композиційні бази даних будуть переведені в списки харчування за допомогою програмного забезпечення FoodEx2. Використання інноваційних технологій у дослідженнях дієти і здоров’я також поширюється за допомогою нових інформаційних технологій, зокрема, використання персональних портативних пристроїв (наприклад, смартфонів і планшетів) для моніторингу споживання їжі і показників здоров’я людини. Новий дослідницький проект «Якісне життя — нагодуй себе» (проект QuaLiFY) включає в себе основу сучасної доказової дієтології, а саме харчування пацієнтів під керівництвом дієтолога, і клінічні дослідження здорового харчування.
Співвідношення детермінант харчування й фізичної активності (проект DEDIPAC) є частиною спільної ініціативи програмування стратегічних досліджень для забезпечення здорового харчування і здорового способу життя.
Тому необхідним є створення міждисциплінарного навчально-інформаційного центру для об’єднання фахівців, які працюють у галузі харчування і здоров’я, що, безперечно, сприятиме подальшому зміцненню європейської комунікації з Україною, інтенсифікації співпраці і зростанню наукового потенціалу.
Професор Надія Бойко, яка працює директором НДЦ молекулярної мікробіології й імунології слизових оболонок в Ужгородському національному університеті, підтримала створення і функціонування такого електронного ресурсу в Україні і зазначила, що це, безперечно, сприяло б гармонізації національних і європейських стандартів і вимог до здорової чи функціональної харчової продукції, які висуваються органом Європейської безпеки їжі (EFSA), що актуально також і у світлі асоціації України до ЄС. Більше того, в Україні вже розпочато створення національної композиційної бази харчових продуктів, яка містить індексовані характеристики перших п’ятдесяти традиційних українських страв. Це було зроблено в рамках реалізації проекту BaSeFood. Результатом діяльності іншого проекту CAPNUTRA є меморандум про спільний план дій, що передбачає створення єдиної платформи їжі Східного європейського регіону. За участі колег із Донецького національного медичного університету в рамках проекту ODiN українська композиційна база даних буде розширена за рахунок індексації продуктів, багатих на вітамін D. У співпраці з Європейським ресурсом індексації їжі (EuroFIR) в Україні проведено перший тренінг використання програми DARIS з метою індексації їжі для працівників освітніх закладів і представників харчової індустрії, лікарів-дієтологів і маркетологів. Наші спеціалісти оволоділи навиками застосування інших базових програмних інструментів документації харчових продуктів (LanguaL) і рецептури страв (DIET-ASSESS) через представництво у мережах INFOOD та EuroFIR AISBL.
З іншого боку, у своїй доповіді, ґрунтуючись на результатах новітніх досліджень в галузі нутріоміки вітчизняних і закордонних вчених, проф. Надія Бойко запропонувала дотримуватись превентивних і персоніфікованих підходів у медицині шляхом впровадження ряду нових мікробно-імунних біомаркерів для раннього виявлення захворювань людини, пов’язаних із порушеним обміном речовин, і використання специфічних дієт із компонентів їстівних рослин та страв, що характеризуються протизапальною дією, специфічно модулюють локальну імунну відповідь і спрямовано регулюють мікробіоту кишечника. Н. Бойко підкреслила необхідність впровадження дієтичних рекомендацій для попередження захворювань людини, асоційованих із порушеним обміном речовин чи імунною системою, а також рекомендованих раціонів та інноваційних функціональних продуктів для здорового харчування лише на базі даних проведених клінічних досліджень за умови визначення вмісту біологічно активних компонентів їжі.
Частина 1 СЕКЦІЇ 11
«Раціональна фармакотерапія: значення досліджень для забезпечення ефективності і безпеки ліків»
була присвячена сучасним проблемам застосування антимікробних лікарських засобів, резистентності антибіотиків, аналізу споживання антимікробних лікарських засобів в Україні та Європі та стану моніторингу антибіотикорезистентності в Україні.
З доповіддю «Проблеми раціонального застосування антибіотиків» виступила К.А. Посохова, к.м.н., завідувач кафедри фармакології з клінічною фармакологією ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського».
У доповіді йшлося про те, що наростання резистентності збудників інфекційних процесів до всіх існуючих антибактеріальних препаратів супроводжується зростанням рівня смертності від інфекцій, значним погіршенням результатів лікування та збільшенням витрат на нього. Тому особливо важливим є дотримання правил раціонального застосування антибіотиків. Останні 20 років це питання активно порушує ВООЗ. На сьогодні її Європейське бюро у складі WHO/EUROESAC (European Surveillance of Antimicrobial Consumption) збирає інформацію щодо споживання АБ в амбулаторній практиці та в умовах стаціонару (предметом дослідження є антибіотики для системного застосування, протигрибкові, противірусні для системного використання, амантадин як ліки від грипу, антибіотики для лікування туберкульозу, сполуки нітроімідазолу для перорального і ректального застосування, антибіотики, що використовуються як кишкові антисептики). ESAC висвітлює фармакоепідеміологічні питання, прослідковує обсяги продажу антибактеріальних препаратів, з 2011 р. — у країнах Півдня, Східної Європи, країнах пострадянського простору, які на карті резистентності ще залишаються білими плямами, що унеможливлює об’єднання зусиль для вирішення вищезазначених проблем. У багатьох країнах відсутня скоординована мікробіологічна мережа, не проводиться державне фінансування подібних проектів, відсутні національні програми із стримування загрози антибіотикорезистентності; суспільство й уряди недостатньо оцінюють можливі наслідки її неконтрольованого зростання, тому існує нагальна необхідність у використанні уніфікованих методик визначення споживання антимікробних ЛЗ та у формуванні баз даних стійкості патогенів, що є основою для розробки локальних протоколів та рекомендацій щодо антибіотикотерапії. В Україні відсутня співпраця клініцистів з мікробіологами, антимікробна хіміотерапія призначається емпірично. Незважаючи на те, що всі АБ належать до рецептурних засобів, будь-який препарат цієї групи можна вільно придбати в аптеках без рецепта, що є абсолютно неприпустимим і є головною причиною застосування АБ з метою самолікування. Також поширене використання антибактеріальних засобів у тваринництві, птахівництві, побуті тощо.
Очікувані результати діяльності ESAC-групи: зменшення рівня застосування антибіотиків, виявлення недоречного їх призначення; розробка національних регуляторних механізмів; зміцнення нормативних вимог; суворе дотримання вимог GMP при реєстрації АБ; проведення перед- і постмаркетингових GMP-інспекцій; впровадження вимог до біоеквівалентності генериків.
Деякі шляхи вирішення проблеми наростання резистентності до АБ у загальносвітовому масштабі: створення нових препаратів, мікробіологічний моніторинг чутливості мікроорганізмів до АБ (локальний, регіональний), жорсткі гігієнічні заходи, особливо у лікарнях, обмеження застосування АБ лікарями, строго рецептурний відпуск АБ, запобігання самолікуванню ними, освітні програми з питань застосування АБ на етапі післядипломної освіти, обмеження й заборона застосування АБ у сільському господарстві, ветеринарії, харчовій промисловості, побутових продуктах.
З доповіддю «Резистентність антибіотиків та вивчення споживання антимікробних лікарських засобі в Україні та Європі» виступила Л.В. Яковлєва, д.фарм.н., професор. Вона розповіла про результати дослідження споживання антимікробних ЛЗ в Україні, що проводилося в рамках міжнародної мережі ESACNet (European Surveillance of Antimicrobial Consumption). ESAC — це європейська мережа національних систем спостереження та збору даних про споживання антибіотиків у країнах ЄС та ЄЕЗ/ЄАВТ як у госпітальному, так і в роздрібному сегментах.
З доповіддю «Стан моніторингу антибіотикорезистентності в Україні» виступила Т.Г. Глушкевич, головний позаштатний спеціаліст МОЗ України зі спеціальності «бактеріологія», зав. бактеріологічною лабораторією УЦКМЗ МОЗ України, у якій було відмічено стрімкий ріст кількості та поширення полірезистентних штамів мікроорганізмів.
Доповідач зазначила, що в Україні основним документом, який регламентує методи визначення чутливості мікроорганізмів до антибіотиків та організацію епідеміологічного нагляду за антибіотикорезистентністю, є наказ МОЗ України від 05.04.2007 р. № 167 «Про затвердження методичних рекомендацій «Визначення чутливості мікроорганізмів до антибактеріальних препаратів», розроблений з ініціативи та з безпосередньою участю фахівців цього закладу.
Центральна санепідстанція МОЗ України у межах повноважень здійснює конт-роль за виконанням вищезазначеного наказу шляхом аналізу даних, що надходять від територіальних органів Держсанепідслужби та ідентифікації і підтвердження штамів мікроорганізмів, виділених від пацієнтів та з інвентарю й обладнання в закладах охорони здоров’я.
Результати аналізу матеріалів мікробіологічного моніторингу дозволяють зробити висновок, що в країні формується небезпечна ситуація, пов’язана зі значним поширенням мікроорганізмів, стійких до дії антибіотиків.
За словами доповідача, згідно з неповними даними, у 2012 році лабораторіями закладів охорони здоров’я було виконано близько 1,2 млн досліджень матеріалу з ран, крові, сечі та зовнішнього середовища хірургічних, неонатологічних, акушерських, урологічних стаціонарів і відділень реанімації та інтенсивної терапії (ВРІТ). При цьому виділено 93 тис. культур мікроорганізмів, з них 9,8 тис. (10,5 %) ідентифіковано як полірезистентні штами.
Найбільш часто полірезистентні штами виявлялися в хірургічних стаціонарах — 5,5 % від усіх виділених культур, в урологічних — 1,8 %, відділеннях реанімації та інтенсивної терапії — 1,3 %, акушерських стаціонарах — 1 %, неонатологічних стаціонарах — 0,2 %.
Серед полірезистентних штамів переважають стафілококи (відділення реанімації та інтенсивної терапії — 39,1 % від усіх полірезистентних штамів, хірургічні стаціонари — 42,5 %, акушерські — 50,8 %, неонатологічні — 63,4 %). Полірезистентні штами синьогнійної палички становили від 4,9 % в неонатологічних стаціонарах до 15 % в урологічних, полірезистентні штами кишкової палички — від 7,1 % у ВРІТ до 22,9 % в акушерських стаціонарах
У Глобальній стратегії ВООЗ зі стримування стійкості до антимікробних препаратів (2001) наголошено, що ефективний епідеміологічний нагляд за антимікробною резистентністю (АМР) неможливий без наявності розгалуженої й добре оснащеної мережі мікробіологічних лабораторій, і сформульовано основні завдання для лабораторних підрозділів закладів охорони здоров’я ВООЗ, а саме:
-послуги мікробіологічної лабораторії мають бути доступними для лікувального закладу;
- організація роботи мікробіологічної лабораторії має гарантувати вірогідність і якість діагностики та ідентифікації основних патогенів, визначення їх чутливості до антимікробних препаратів і своєчасну видачу результатів досліджень для призначення/корегування антибактеріальної терапії;
- мікробіологічна лабораторія повинна працювати в тісному зв’язку з персоналом лікарні, мати і постійно поповнювати базу даних, поширювати значущі дані спостереження про домінуючі патогени і механізми стійкості до протимікробних препаратів.
Доповідач відмітила низьку доступність клінічних мікробіологічних досліджень у закладах охорони здоров’я (ЗОЗ). Виконання діагностичних досліджень на договірних засадах, в умовах відсутності фінансування призводить до того, що певна частина хворих взагалі залишається не обстеженою або обстеженою неякісно, що негативно впливає на якість медичної допомоги.
Показники укомплектованості лабораторій лікарями, середніми медпрацівниками мають тенденцію до зниження. У цілому ряді лабораторій лікарські посади комплектуються зовнішніми сумісниками, а в деяких за відсутності фахівців із вищою спеціальною освітою мікробіологічні дослідження проводяться фахівцями з середньою освітою.
Система реєстрації медичних виробів (діагностичних препаратів) складна, дорога, тому гальмує впровадження сучасних методів діагностики та лабораторного контролю.
Має місце незацікавленість клініцистів у лабораторних дослідженнях унаслідок тривалості отримання їх результатів.
Повільно впроваджуються сучасні лабораторні технології, зокрема, ті, що дають можливість скоротити термін мікробіологічного дослідження, наприклад готові комерційні тестсистеми для ідентифікації мікроорганізмів, хромогенні середовища тощо. Неефективно використовуються мікробіологічні аналізатори внаслідок недостатнього фінансування на закупівлю витратних матеріалів.
У той самий час скорочення термінів мікробіологічного дослідження дає значний економічний ефект. Наприклад, проф. С.В. Сидоренко наводить такі дані: у дослідженні J. Barenfanger показано, що скорочення середнього часу дослідження від 44,4 до 39,2 години супроводжувалося: зниженням летальності від 9,6 до 7,9 %; скороченням ліжко-дня з 12,6 до 10,7 доби; зниженням середньої вартості лікування пацієнта із 6,677 до 4,927 долара США. У цілому протягом року економія для госпіталю становила приблизно 4 млн доларів США.
У бактеріологічних лабораторіях накопичується величезний об’єм даних про чутливість мікроорганізмів до антибіотиків, але систематично аналізувати їх дуже тяжко. Незадовільна забезпеченість лабораторних підрозділів ЗОЗ оргтехнікою та засобами зв’язку не дозволяє організувати систему оперативного збору, аналізу та обміну необхідною інформацією. Лише 35 % лабораторій забезпечені комп’ютерами. Програма WHONET, рекомендована ВООЗ, впроваджена лише в 209 лабораторіях.
З метою підвищення ефективності й безпеки застосування антимікробних засобів, запобігання появі й селекції резистентних штамів збудників інфекційних захворювань в Україні необхідно:
- розробити національну програму зі стримування стійкості до антимікробних препаратів;
- вжити необхідних заходів, спрямованих на розвиток та зміцнення мережі клінічних мікробіологічних лабораторій.
У частині 2 СЕКЦІЇ 11
«Раціональна фармакотерапія: значення досліджень для забезпечення ефективності і безпеки ліків»
були висвітлені питання застосування ABC- та VEN-аналізу з метою визначення раціонального та безпечного використання лікарських засобів, доступності основних лікарських засобів в Україні, споживання наркотичних аналгетиків: проблеми та шляхи їх вирішення.
З доповіддю «Вплив АВС-VEN-аналізу на раціональне та безпечне використання лікарських засобів на регіональному рівні на прикладі благодійної організації «Лікарняна каса Житомирської області» виступив С.М. Грищук, к.м.н., благодійна організація «Лікарняна каса Житомирської області», м. Житомир, Україна.
У доповіді йшлося про те, що більшість держав світу, у тому числі й розвинених, відчувають брак коштів на систему охорони здоров’я, тому проводиться пошук соціально адаптованих, доступних форм залучення коштів населення. Одним із напрямків, що виник як реакція на обмежені можливості національної системи охорони здоров’я, стала солідарна участь громадян в співоплаті витрат на медичну допомогу у формі лікарняних кас (ЛК). На Житомирщині з 2000 року діє благодійна організація «Лікарняна каса Житомирської області». В ЛК перебуває понад 205 тис. жителів області, що становить 16 % від загальної кількості населення. ЛК стала потужним джерелом позабюджетного фінансування галузі охорони здоров’я Житомирщини. У 2012 р. медичні установи області отримали від ЛК ліків на суму понад 29 млн грн, що дало можливість забезпечити понад 360 тис. звернень за медичною допомогою. Незначний розмір щомісячного внеску (25 грн) при наявності системи управління якістю медичної допомоги дозволяє забезпечити лікування без обмеження розміру витрат та кількості звернень.
У раціональному використанні обмежених ресурсів сходяться економічні інтереси лікарняних кас, держави та особисті інтереси кожного з її громадян. Для лікарняних кас це особливо актуально, оскільки у структурі витрат медикаменти та вироби медичного призначення становлять понад 80 %. Тому вирішувати економічні питання надання населенню медичної допомоги належної якості потрібно шляхом раціонального використання наявних ресурсів. Для підвищення ефективності лікувального процесу та оптимізації фінансових витрат необхідно впровадити стандартизацію медичної допомоги та клініко-економічну оцінку проведеної фармакотерапії. Ці методи використовуються як для ретроспективної оцінки доцільності витрачання ресурсів на фармакотерапію, так і для розрахунку потреби в коштах на її забезпечення.
При медикаментозному забезпеченні членів ЛК використовуються «Лікарський формуляр» (було видано вперше в Україні у 2000 році в Житомирській області, у 2012 році вийшов сьомий випуск) та локальні клінічні протоколи (розроблені на основі наказів МОЗ з 2009 року). Частка дотримання протоколів при лікуванні членів ЛК становить 94,8 %. В ЛК постійно проводяться фармакоекономічні дослідження (АВС/VEN-аналіз, частотний аналіз). З цією метою всі листи призначень пролікованих членів ЛК вносяться в програму, що дає можливість проводити їх автоматизовану обробку.
АВС-аналіз — метод розподілу лікарських засобів за часткою витрат у загальній структурі витрат на лікарську терапію від найбільш витратних до найменш витратних, відповідно до їх фактичного використання за певний період.
Нами проведено аналіз 100 536 випадків лікування членів ЛК за 9 місяців 2013 року в стаціонарних та амбулаторнополіклінічних умовах. На лікарські засоби витрачено 15 млн 251 тис. грн. Середня кількість призначень лікарських засобів на 1 пацієнта — 4,8. Асортимент становив 480 міжнародних непатентованих найменувань (МНН) ЛЗ.
Групу А (80 % витрат) становили 53 МНН (11 % від загальної кількості найменувань), групу В (15 % витрат) — 78 МНН (16 %), групу С (5 % витрат) — 349 найменувань (73 % від усіх МНН). У структурі витрат переважають антибактеріальні засоби та антикоагулянти, що значно відрізняється від існуючої структури видатків населення на закупівлю ЛЗ по Україні, де лідерами є препарати з недоведеною ефективністю та другорядні препарати. Привертає увагу, що лідером серед витрат є натрію хлорид, на який постійно витрачається близько 10–11 % коштів.
АВС-аналіз — це надзвичайно потужний інструмент для оптимізації використання та закупівлі ЛЗ. Він дозволяє отримати точну та об’єктивну картину структури витрат на ЛЗ. На підставі результатів ABC-аналізу керівництвом ЛК приймаються адміністративні та управлінські рішення, визначаються заходи для поліпшення використання ліків, оновлення «Лікарського формуляра» (виключення/включення певних ЛЗ). Аналіз лікарських засобів, що увійшли до групи А, виявляє високозатратні медикаменти, які можна замінити на більш дешеві аналоги. Для зниження витрат на закупівлю ЛП відділом фармацевтичного менеджменту ЛК щомісячно аналізуються пропозиції фармацевтичного ринку (препарати групи А) на наявність більш дешевих лікарських форм, пакувань (за кількістю доз), генериків. У нашому прикладі при плануванні закупівлі проводиться моніторинг 53 МНН ЛЗ (152 ТН), які в структурі видатків становлять 80 %. Будь-яке зниження ціни на ЛП групи А може привести до суттєвої економії коштів.
VEN-аналіз — це розподіл призначених ЛЗ на три категорії за ступенем їх важливості для лікування певного захворювання (V (vital) — життєво необхідні ЛП, E (essential) — важливі ЛП (важливість висока, але не абсолютна), N (non-essential) — другорядні (важливість сумнівна)). VEN-аналіз є елементом клініко-економічного аналізу, який дозволяє оцінити відповідність фармакотерапії хворих з певною патологією чинним стандартам та клінічним протоколам, що надзвичайно важливо в плані раціонального та ефективного використання коштів (лікарняної каси, бюджетних, пацієнта). Основним завданням проведення VEN-аналізу є встановлення пріоритетів між різними лікарськими препаратами при їх призначенні та закупівлі. Якщо переважну частину лікарських призначень становлять препарати категорії V, це свідчить про достатню якість фармакотерапії — відповідність чинним стандартам та протоколам лікування певного захворювання. При надмірному використанні другорядних препаратів (категорія N) необхідно вносити зміни до призначень лікарів у конкретному закладі охорони здоров’я. При закупівлі пріоритет завжди повинен належати важливим (V) і необхідним (Е) ЛЗ.
Розподіл препаратів на категорії V, E та N також допомагає в організації системи постачання, управлінні запасами і визначенні адекватних закупівельних цін для ЛЗ пріоритетної групи. За порівнянними результатами 2007–2013 років у структурі витрат ЛК частка на другорядні лікарські засоби зменшилася на 7 % (близько 2 млн грн).
Частотний аналіз — це вид кількісного аналізу, який відображає частоту призначення певного ЛЗ чи групи ЛЗ, їх частку в загальній кількості призначень. Виявлення препаратів, що призначаються найчастіше, та тих, що використовуються дуже рідко, допомагає регулювати номенклатуру та обсяги закупівлі ЛП (з урахуванням вартості препаратів).
Найчастіше в ЛК використовується комбінація вказаних видів аналізу. За результатами аналізу розробляються пропозиції щодо поліпшення фармакотерапії без додаткового фінансування.
Таким чином, накопичений практичний досвід Житомирської, Полтавської та інших лікарняних кас переконливо свідчить, що оцінка використання ЛЗ за методологією частотного/VEN/АВС-аналізу — дієвий шлях до оптимізації фармакотерапії та моніторингу впровадження клінічних протоколів у лікувальному процесі.
З доповіддю «Доступність основних лікарських засобів в Україні: результати фармакоепідеміологічного дослідження (спільний проект ВООЗ, НАІ та МОЗ України)» виступила Т.М. Думенко, к.м.н., ДП «Державний експертний центр МОЗ України», м. Київ, Україна, Національний медичний університет імені О.О. Богомольця.
Доповідач поінформувала присутніх про те, що з метою отримання об’єктивної інформації щодо доступності лікарських засобів в Україні було проведено дослідження цін на лікарські засоби, їх наявності та економічної доступності з використанням стандартної методології, розробленої Всесвітньою організацією охорони здоров’я та Міжнародними діями в охороні здоров’я (Health Action International, HAI). Дане дослідження було проведене у березні 2012 р. ДП «Державний експертний центр МОЗ України» за підтримки Бюро ВООЗ в Україні та Регіонального бюро ВООЗ у Європі.
У проекті досліджувались 50 основних лікарських засобів, 14 із яких належать до світового переліку ВООЗ/HAI з наперед визначеним дозуванням, формою випуску та рекомендованими розмірами упаковки, та ще 36 лікарських засобів, що відповідають статусу основних в Україні. Дані збиралися у 35 аптеках державного сектора та 35 аптеках приватного сектора у 7 регіонах країни: м. Київ, Вінницька, Дніпропетровська, Житомирська, Львівська, Полтавська та Харківська області.
Ціни та наявність реєструвалися для оригінального лікарського засобу (ОЛЗ), генеричного засобу, що найкраще продається, та генеричного засобу за найнижчою ціною, який визначався в кожній аптеці окремо.
Дослідження визначило, що загальна наявність генеричних лікарських засобів у державних (77 %) та приватних аптеках (81 %) була подібною й оцінена як хороша. Виняток становили лише беклометазон та будесонід в інгаляційній формі, що рідко виявлялись в аптеках обох секторів.
Для лікування багатьох захворювань пацієнти, які отримують найнижчу заробітну плату, потребуватимуть витрачання не більше одноденної заробітної плати для купівлі найдешевших генериків. Однак оригінальні лікарські засоби були менш доступні.
Доступність розраховувалась як кількість днів, необхідних некваліфікованому державному працівнику з найнижчою заробітною платою в Україні для оплати 30-денного курсу лікування гострих станів. Лікування вважається недоступним у випадках, коли для покриття місячного курсу лікування необхідно витрачати більше одноденного заробітку.
За результатами дослідження встановлено, що доступність основних лікарських засобів була однаковою у державних та приватних аптеках. Для лікування багатьох захворювань (діабет, артеріальна гіпертензія, бронхіальна астма, артрит, пептична виразка, гіперхолестеринемія, шизофренія, депресія, інфекційні стани) пацієнти з найнижчою заробітною платою потребують не більше одноденного заробітку для придбання найдешевших генериків. Однак лікарські засоби для багатьох захворювань були менш доступними за умови придбання оригінальних лікарських засобів. Наприклад, необхідно 5 денних зарплат для придбання 30-денного курсу лікування оригінальним диклофенаком (для лікування артриту), але менше половини денної зарплати для придбання його генеричних еквівалентів.
З доповіддю «Споживання наркотичних аналгетиків: проблеми та шляхи їх вирішення» виступила Н.В. Бездітко, д.м.н., професор кафедри фармакоекономіки в Національному фармацевтичному університеті, м. Харків, Україна.
Доповідач повідомила, що за останні сто років статистика за рівнем захворюваності на рак значно змінилася. Смертність від онкологічних захворювань різко зросла і за кількістю випадків поступається тільки хворобам серцево-судинної системи. За темпами поширення раку Україна знаходиться на другому місці серед всіх країн Європи. Щорічно онкологічні захворювання первинно діагностують у 160 тисяч українців, а 90 тисяч громадян нашої країни помирають від них.
Поряд із ранньою діагностикою, розробкою ефективних методів лікування на даному етапі розвитку медицини є проблеми безболісного закінчення життя онкохворих. Згідно з орієнтовними підрахунками фахівців, в Україні знеболювання потребують 428 000 хворих на рак. Всесвітньою організацією охорони здоров’я була розроблена класифікація больових відчуттів в онкологічних хворих — так звані сходи болю. У разі легкого болю доречним є використання нестероїдних протизапальних препаратів. Помірний біль усувається комбінацією слабких опіоїдних лікарських засобів з ненаркотичними аналгетиками, а при сильному болю приймаються сильні наркотичні аналгетики. ВООЗ і Міжнародний комітет із контролю за використанням наркотиків (International Narcotics Control Board — JNCB) активно займаються моніторингом споживання опіоїдів в різних країнах світу з метою досягнення рівноваги між положеннями національної політики використання опіоїдів і потребою тих, кому необхідні ці лікарські засоби. Ця рівновага передбачає, з одного боку, створення ефективного режиму контролю за використанням опіоїдів для недопущення їх витоку в нелегальний обіг, а з іншого — забезпечення адекватної доступності медичного використання опіоїдів. Індикатором дотримання цієї рівноваги в тій чи іншій країні є показники рівня споживання сильних опіоїдів. Для порівняння рівня споживання препаратів у різних країнах ВООЗ рекомендує проводити розрахунки з використанням «встановленої добової дози» (defined daily dose — DDD) і розрахованих на її основі коефіцієнтів «DDD на 1000 жителів», «DDD на 1000 жителів на добу», «DDD на 1 млн жителів на добу».
Для судження про доступність сильних аналгетиків онкохворим проведено порівняння споживання цієї групи препаратів станом на 2007 р. в Україні та ряді європейських країн. Результати подані на рис. 1.
З усіх наркотичних препаратів протягом останнього десятиліття ключовим елементом лікування больового синдрому у випадках раку є пероральний морфін. Він включений в основний перелік лікарських засобів ВООЗ. Це означає, що пероральний морфін є найбільш ефективним, безпечним і доступним із точки зору витрат лікарським засобом. З 2006 р. у більшості країн Європи в онкології почала широко застосовуватися трансдермальна форма фентанілу. Порівняння рівня споживання цих наркотичних аналгетиків в Україні та інших країнах у 2007 р. (рис. 2) переконливо свідчить, що реального дієвого знеболювання наші онкохворі не отримували.
Основними проблемами організації паліативної, у тому числі знеболювальної, терапії на той момент були:
- відсутність системи хоспісної та паліативної допомоги;
- недостатня підготовка кадрів для надання паліативної допомоги;
- відсутність стандартів терапії хронічного больового синдрому;
- складна процедура обліку та контролю наркотичних аналгетиків;
- неможливість призначення опіоїдів лікарями приватної практики;
- неможливість застосування наркотиків в умовах стаціонару на дому;
- відсутність в Україні неінвазивних форм наркотичних аналгетиків;
- відсутність реальної можливості придбання наркотичних аналгетиків;
- максимальна дозволена добова доза морфіну — 50 мг.
За попередній період станом на 2013 рік на шляху забезпечення паліативної допомоги згідно зі стандартами доказової медицини Україна зробила вельми суттєві кроки:
- створено Інститут паліативної та хоспісної медицини МОЗ України (2009 р.);
- у навчальний план підготовки студентів медичних вузів включений курс паліативної допомоги;
- ухвалено наказ МОЗ України № 311 від 25.04.2012 р., що включає в себе уніфікований клінічний протокол надання медичної допомоги при хронічному больовому синдромі;
- зареєстровані трансдермальні терапевтичні системи з фентанілом;
- у лютому 2013 р. в Україні вперше зареєстрований таблетований морфін і налагоджено його вітчизняне виробництво;
- затверджено наказ МОЗ України (№ 333 від 13.05.2013 р.), яким значно спрощені процедури використання лікарями наркотичних лікарських препаратів (збільшено термін дії рецептурного бланка форми № 3 для знеболюючих препаратів з умістом наркотичних речовин з 5 днів до 10, дозволено виписувати дозу препаратів, необхідну на 15 днів, передбачена можливість отримувати знеболюючі препарати з умістом наркотичних речовин в будь-якій аптеці, де є спеціальний дозвіл тощо);
- Державним експертним центром розроблені методичні рекомендації для лікарів, у яких подано докладне роз’яснення сучасних правил виписування, відпуску і використання лікарських препаратів, що містять наркотичні аналгетики.
На жаль, незважаючи на вжиті заходи сьогодні істотної динаміки споживання наркотичних аналгетиків в Україні поки не відмічено (рис. 3).
Щоб реально змінити стан речей у справі забезпечення сильними аналгетиками онкохворих, необхідно об’єднати зусилля не лише керівних органів охорони здоров’я, а й лікарів. Лікарі повинні бути інформовані про всі наявні зміни в законодавстві й поступово позбуватися опіоїдофобії.
КРУГЛИЙ СТІЛ
«Вимоги до здійснення фармако-
нагляду в країнах СНД: проблеми і досягнення»
вели І.І. Лапчинська, С.Б. Сєткіна, Р.С. Кузденбаєва, Ельвіра Істраті.
Право відкриття круглого столу було надано Інні Лапчинській, регіональному менеджеру з фармаконагляду «ГлаксоСмітКляйн», яка виступила з доповіддю «Особливості здійснення фармаконагляду в регіоні СНД».
У своїй доповіді Інна Лапчинська зазначила, що, за визначенням ВООЗ та ЄС, фармаконагляд — це дослідження та дії, спрямовані на виявлення, оцінку, розуміння та попередження побічних реакцій або інших, пов’язаних із застосуванням препаратів проблем.
У ЄС у спостереженні за безпекою застосування лікарських засобів беруть участь Єврокомісія, Європейська агенція з лікарських засобів (ЕМА), власники торгових ліцензій на препарати, що реалізуються в країнах ЄС, спеціалісти охорони здоров’я, пацієнти, організації, які представляють споживачів, пацієнтів та медпрацівників.
Фармаконагляд у ЄС здійснюється відповідно до регуляторних актів: Постанови Європарламенту та Ради Європи 1027/2012 від 14.11.2012 р.; Директиви 2010/84/ЄС; Директивою 2012/26/ЕЄ; Постанови 520/2012 від 19.06.2012; Директиви Європарламенту 2011/62/EU, яка діє з 1 січня 2013 р., а також Належної практики фармаконагляду (GVP), затвердженої ЄMA/541760/2011 від 22.06.2012 р.
Також доповідач відмітила, що в минулому внесок спеціалістів охорони здоров’я у ФН обмежувався спонтанним репортуванням про випадки ПР та отриманням порад щодо мінімізації ризиків ПР через оновлення інструкцій до застосування лікарських засобів та інших інформаційних матеріалів. Із плином часу роль пацієнтів та спеціалістів охорони здоров’я в ЄС значно зросла. В останні роки приймаються повідомлення щодо підозрюваних ПР безпосередньо від пацієнтів.
Згідно з GVP, у сфері ФН має бути налагоджене ефективне співробітництво між заявниками, регуляторними органами, громадськими організаціями охорони здоров’я, пацієнтами, спеціалістами охорони здоров’я, організаціями лікарів та іншими значущими суб’єктами відповідно до вимог законодавства.
Як зазначила доповідач, у регіоні СНД картина є дещо іншою. Населення та лікарі, особливо у віддалених сільських місцевостях, недостатньо інформовані щодо необхідності повідомляти про ПР регуляторні органи або компанію-заявника, також негативно впливає відсутність Інтернету та іноді форми повідомлень про ПР. Цим пояснюється недостатній рівень репортування про випадки ПР. У деяких країнах СНД лікарі бояться репортувати про випадки ПР, боючись (необґрунтовано) санкцій з боку регуляторних органів.
Згідно з вимогами GVP, у здійсненні заходів із ФН має брати участь достатня кількість компетентного, належним чином тренованого кваліфікованого персоналу як компанії-заявника, так і регуляторного органу.
У регіоні СНД у заявників здебільшого має місце кластерна структура ФН, коли особа, відповідальна за ФН (NSC), знаходиться в одній країні, а в інших країнах (на жаль, не в усіх) є локальні відповідальні особи з ФН (LSCs). На жаль, LSCs здебільшого виконують й інші функції — вони є медичними радниками, менеджерами з логістики або регуляторними менеджерами. Особі, яка відповідає за ФН, важко простежити за якістю репортування про випадки ПР у регуляторні органи в кожній країні регіону.
У багатьох країнах регіону відсутнє або дуже слабке локальне законодавство щодо ФН. У багатьох країнах у регуляторних актах відсутні правила інформування спеціалістів охорони здоров’я щодо безпеки ЛЗ. Відсутнє або дуже лаконічне регулювання скарг на якість препаратів, конфіденційності персональної інформації. Недостатньою є увага до ФН з боку органів охорони здоров’я; також є недостатньою обізнаність зацікавлених сторін та ініціативність фармацевтичних компаній у розвитку системи ФН.
Терміни та вимоги до репортування про випадки ПР та періодично оновлюваних звітів із безпеки препаратів (ПОЗБ) у регуляторні органи країн регіону є різними.
Підсумовуючи свою доповідь, Інна Лапчинська звернула увагу слухачів, що успішний ФН має включати відділ ФН або відповідальних за ФН у структурі регуляторних органів країни; своєчасне оновлення регуляторних вимог, які регламентують здійснення ФН у кожній країні регіону; відповідну компетенцію компаній-виробників; діючу систему ФН в академічних та медичних установах; інформованість фармацевтів, лікарів, пацієнтів, організацій пацієнтів, причому всі мають працювати разом.
Наступну доповідь представив Сергій Глаголєв, заступник начальника Управління — начальник відділу моніторингу ефективності та безпеки медичної продукції Управління організації державного контролю якості медичної продукції Росздоровнагляду. Доповідач зазначив, що фармацевтичний ринок країн Митного союзу має низку характерних особливостей. Лікарські засоби, вироблені локальними фармацевтичними компаніями, переважають у кількісному відношенні, але значно поступаються в обсягах продажу зарубіжній фармацевтичній продукції. Переважну частину фармацевтичного ринку країн Митного союзу становлять генерики. Значна частина лікарських засобів розроблялася головними науково-дослідними установами. Внаслідок цього у вітчизняних виробників лікарських засобів сформувався дефіцит експертного потенціалу та досвіду, необхідного для самостійної розробки лікарських засобів, а також оцінки та забезпечення їх безпеки в післяреєстраційному періоді. Багато з препаратів, створених десятки років тому, не вивчалися в широкомасштабних клінічних дослідженнях, що є золотим стандартом доказової медицини. Значна їх частина знаходиться в обігу тільки на внутрішніх ринках. У той же час ринок лікарських засобів країн Митного союзу є частиною глобального фармацевтичного ринку, на якому відбуваються значні зміни. Збільшується асортимент лікарських засобів, зростає частка біотехнологічних препаратів, орфанних лікарських засобів, розвиваються нові технології медичної допомоги (стовбурові клітини та генна терапія). Застосування даних лікарських препаратів і технологій неможливе без безперервного дослідження їх безпеки, а також активних заходів, спрямованих на зниження ризику їх використання. Доповідач нагадав про історію і сучасні системи фармаконагляду (ФН) країн Митного союзу. Сучасні системи ФН ґрунтуються переважно на зборі та аналізі спонтанних повідомлень про небажані реакції. Загальною проблемою є низький рівень надання повідомлень про небажані реакції при застосуванні лікарських засобів, низька якість значної частини повідомлень. Поряд із цим аналіз спонтанних повідомлень не дозволяє повністю оцінити профіль безпеки лікарських засобів. Потрібне створення правових механізмів для ефективного використання всього арсеналу сучасних методів ФН. При розробці єдиних регуляторних документів у галузі ФН необхідно враховувати як міжнародні підходи (насамперед норми посібників ICH та документи ВООЗ), так і особливості національних систем охорони здоров’я та локального фармацевтичного ринку. Пряме запозичення зарубіжних національних регуляторних документів не дозволяє створити систему ФН, здатну однаково ефективно реагувати на глобальні виклики та локальні проблеми безпеки лікарської терапії.
У зв’язку з цим Сергій Глаголєв зазначив, що пріоритетними питаннями, що потребують вирішення під час створення єдиних вимог до ФН, розробка яких проходить під егідою Робочої групи з формування спільних підходів до регулювання обігу лікарських засобів у рамках Митного союзу і Єдиного економічного простору при Колегії Євразійської економічної комісії, є такі:
- розвиток єдиних стандартів експрес-звітності з безпеки лікарських засобів (єдині вимоги до формату повідомлень, включаючи електронні повідомлення, термінів звітності);
- розробка єдиних стандартів періодичної звітності фармацевтичних виробників (у тому числі гармонізація її подання з міжнародною датою народження препаратів);
- розвиток механізмів інформаційного обміну в галузі ФН в середині країн Митного союзу (в галузі експрес-звітності, періодичної звітності та регуляторних рішень);
- активізація участі країн — членів Митного союзу в Програмі Міжнародного моніторингу лікарських засобів ВООЗ;
- формування єдиних вимог до системи ФН у фармацевтичних компаніях;
- розробка єдиних підходів до управління ризиками для лікарських засобів з високою ймовірністю виникнення проблем безпеки в післяреєстраційний період;
- розробка єдиних освітніх програм в галузі ФН для фахівців охорони здоров’я.
Наступну презентацію представила Світлана Сєткіна — головний спеціаліст Республіканської клініко-фармакологічної лабораторії УП «Центр експертиз та випробувань в охороні здоров’я» (далі — Центр). Доповідь було присвячено темі «Підходи до здійснення фармаконагляду в Республіці Білорусь».
Як зазначила доповідач, законодавча база фармаконагляду в Республіці Білорусь включає: Закон Республіки Білорусь від 20.06.2006 р. № 161З «Про лікарські засоби», ст. 11 «Контроль за побічними реакціями на лікарські засоби» в новій редакції (закони № 428-Зі № 27З); Постанову МОЗ РБ від 10.03.2008 р. № 52 «Про затвердження інструкції про порядок подання інформації про виявлені побічні реакції на лікарські засоби та контролю за побічними реакціями на лікарські засоби» (в редакції Постанови від 13.11.2009 р. № 121); Постанову МОЗ РБ від 07.05.2009 р. № 50 «Про затвердження технічного кодексу належної практики «Належна клінічна практика». Основними напрямками діяльності Центру є локальний моніторинг безпеки, моніторинг даних міжнародної системи фармаконагляду (ФН), інформаційна діяльність, організаційно-методична діяльність. Післяреєстраційний моніторинг включає такі етапи: локальні та міжнародні відомості про побічні реакції (ПР), їх аналіз і вивчення, розгляд експертами, прийняття регуляторних рішень, інформування фахівців і виробників. За результатами локального моніторингу в Республіці Білорусь у 2012 р. були прийняті такі заходи: проведений повний контроль якості на відповідність нормативній документації — 14 процедур; були внесені зміни до НД — 3 процедури; призначені додаткові дослідження — 2 процедури; внесені зміни в технологію виробництва/склад — 3 процедури; внесені зміни в рекомендації із застосування — 4 процедури. За періоди 2001–2012 рр. істотно зросла кількість отриманих повідомлень, як вітчизняних, так і закордонних. За поточний період 2013 р. отримано 239 зарубіжних повідомлень і 158 вітчизняних повідомлень, що істотно перевищує кількість повідомлень порівняно з минулими роками: за 2010 р. — 101 зарубіжне повідомлення і 39 вітчизняних; за 2011 р. — відповідно 191 і 122; за 2012 р. — 221 і 176.
З них 14,8 % повідомлень становлять повідомлення на антибактеріальні лікарські засоби, 14,6 % на ацетилсиліцилову кислоту (АСК), 7,8 % на протипухлинні препарати, 7,5 % — нестероїдні протизапальні засоби (НПЗЗ), 7,3 % — гіпоглікемічні лікарські засоби, 4,5 % — антикоагулянти, по 4 % — місцеві анестетики та інгібітори пролактину відповідно, 38,5 % — інші препарати. Також, за словами доповідача, був здійснений перегляд профілю безпеки деяких препаратів: іміноралу (циклоспорин) — змінені показання до застосування (виключення трансплантології, обмеження застосування низькодозовими режимами), реомаксу (клопідогрель) — відкликання з ринку, зупинка дії державної реєстрації, ібупрофену (400) монокомпонентного і комбінованого — зміни в інструкцію із застосування (виключення жарознижуючої дії, зниження дози, тривалості прийому, рецептурний відпуск, моніторинг, взаємодії та ін.), еналаприлу (СП ТОВ «Фармленд») — відклик з ринку серії, зміна НД, кларитроміцину (СП ТОВ «Фармленд») — відклик з ринку серії, зміна НД, ессел форте — внесення змін до складу, бісопрололу (СТОВ «Лекфарм») — внесення змін до складу (виключення ароматичного барвника), омніациду (засоби для дезінфекції на основі глутарового альдегіду) — обмежені сфери застосування, посилені запобіжні заходи при роботі.
Інформаційна діяльність у сфері ФН висвітлюється в таких виданнях Міністерства охорони здоров’я Республіки Білорусь, як журнал «Новини експертизи та реєстрації», Рекомендації з виявлення та подання інформації про побічні реакції на лікарські засоби, а також представлена на офіційному сайті УП «Центр експертиз та випробувань в охороні здоров’я».
Доповідач зазначила, що основними заходами у сфері ФН є: відкликання з ринку/призупинення дії реєстраційного посвідчення (РП); вилучення раніше затверджених показань до застосування; обмеження застосування в певних популяціях; доповнення/зміни розділів «Протипоказання», «Застереження», «Особливості застосування»; доповнення/зміни інших розділів інструкції з медичного застосування (зміни режиму дозування, тривалості застосування та інші); введення/модифікації плану управління та мінімізації ризику, обмеження поширення (зміна порядку відпуску, обмеження розміру упаковки та інші); призначення післяреєстраційних досліджень безпеки; призначення епідеміологічних досліджень з оцінки безпеки; внесення змін до міжнародної непатентованої назви (МНН)/торгової назви для зниження ймовірності медичних помилок.
Світлана Сєткіна зазначила, що вперше на території Республіки Білорусь стартували такі проекти активного моніторингу, як проект когортного моніторингу ВІЛінфікованих пацієнтів за підтримки ВООЗ (у грудні 2012 р. та проект активного моніторингу госпіталізацій за підтримки МОЗ РБ (розпочато у 2013 р.)).
Презентацію «Нормативно-правове поле здійснення фармаконагляду в Казахстані» представила Раїса Кузденбаєва — академік НАН Республіки Казахстан (РК), професор, д.м.н., лауреат Державної премії РК, директор Фармакологічного центру РГП «Національний центр експертизи лікарських засобів, виробів медичного призначення і медтехніки» Міністерства охорони здоров’я Республіки Казахстан.
Раїса Кузденбаєва зупинилась на питаннях гармонізації законодавства у сфері обігу лікарських засобів (ЛЗ) на території Митного союзу (МС) і Єдиного економічного простору (ЄЕП). Угоду про єдині принципи і правила обігу лікарських засобів на території МС і ЄЕП було ухвалено Колегією Євразійської економічної комісії (рішення ЄЕК № 115 від 21 травня 2013 р.).
Доповідач зазначила, що суть даної Угоди полягає у проведенні узгодженої політики у сфері обігу ЛЗ, усунення бар’єрів шляхом взаємного визнання реєстраційних посвідчень на ЛЗ. Ця Угода поширюється на ЛЗ, вироблені на території держав — членів МС і ЄЕП (а саме Російської Федерації, Республіки Білорусь), а також на ЛЗ, що знаходяться в обігу на єдиній митній території МС і ЄЕП.
Суттєвим, вважає доповідач, є також той факт, що ця Угода дозволяє створити оптимальні умови для розвитку фармацевтичної промисловості; підвищити конкурентоспроможність фармацевтичної продукції, виробленої на території держав — членів МС і ЄЕП; усунути необґрунтовані обмеження у взаємній торгівлі; зміцнити здоров’я населення шляхом забезпечення доступу до безпечних, ефективних і якісних лікарських засобів.
У своїй доповіді академік Р. Кузденбаєва особливу увагу приділила питанню процедури взаємного визнання (ПВВ) в ЄС і на території МС і ЄЕП. Процедура взаємного визнання ЄС заснована в 1995 році. Спочатку реєстрація на рівні окремої країни (за повною схемою — 210 днів). ПВВ здійснюється шляхом звернення до інших країн про взаємне визнання (90 днів), експертиза здійснюється за досьє та експертним звітом з оцінки.
Доповідач зауважила, що взаємне визнання реєстраційних посвідчень на території МС і ЄЕП можливе лише після створення єдиних умов та встановлення єдиних вимог, гармонізованих із законодавством ЄС для всіх держав — членів МС. Взаємне визнання реєстраційних посвідчень на лікарські засоби в рамках МС і ЄЕП можливе за наявності єдиних вимог поводження ЛЗ, єдиних умов обігу ЛЗ.
На закінчення доповідачем було представлено перелік нормативних актів, передбачених проектом Угоди про єдині принципи і правила регулювання обігу ЛЗ на території держав — членів МС і ЄЕП, за гармонізацію та впровадження яких відповідає Республіка Казахстан. До даного переліку увійшли:
1) правила належної дистриб’юторської практики;
2) єдині вимоги до інструкції з медичного застосування ЛЗ;
3) концепція гармонізації національних фармакопейних стандартів держав — членів МС і ЄЕП;
4) номенклатура лікарських форм;
5) правила реєстрації та експертизи ЛЗ, у тому числі вимоги до реєстраційного досьє: його структури, форми, формату, єдиної форми заяви про реєстрацію ЛЗ, правила складання та єдину форму експертного звіту про оцінку ЛЗ;
6) єдина форма реєстраційного посвідчення ЛЗ;
7) порядок формування та діяльності Експертного комітету з ЛЗ при Євразійській економічній комісії;
8) правила визначення категорій ЛЗ, що відпускаються за рецептом.
З доповіддю «Система фармаконагляду в Республіці Молдова в контексті гармонізації національного законодавства з європейським законодавством» виступила Ельвіра Істраті — співробітник Агентства з лікарських засобів Республіки Молдова, м. Кишинів (далі — Агентство).
У своїй доповіді вона висвітлила проблеми, завдання, чинні нормативно-правові документи системи фармаконагляду в Республіці Молдова.
Доповідач зазначила, що головна місія Агентства — реалізація державної політики в галузі ліків, фармацевтичної діяльності і медичних виробів з метою захисту здоров’я населення за допомогою якісних, безпечних, ефективних та доступних лікарських засобів та медичних виробів.
Доповідачем були представлені такі нормативно-правові документи, що складають нормативну базу здійснення ФН у Республіці Молдова на сьогодні:
- Закон Республіки Молдова «Про ліки» № 1409-XIII від 17.12.1997 р. Гл. 16. «Фармаконагляд».
- Закон Республіки Молдова «Про фармацевтичну діяльність» № 1456-XII від 25.05.93 р., гл. III, ст. 15, 16, гл. IV, ст. 18.
- Постанова Республіки Молдова № 28 від 11.04.2012 «Дорожня карта Агентства з ліків і медичних виробів на 2012–2014 рр.».
- Постанова Республіки Молдова № 71 від 23.01.2013 р. «Про затвердження Положення про організацію та функціонування, структури та граничної штатної чисельності персоналу Агентства з ліків і медичних виробів».
- Наказ MОЗ РM № 20 від 20.01.2006 р. «Про порядок нагляду за побічними реакціями лікарських засобів та інших фармацевтичних препаратів в Республіці Молдова».
- Наказ MОЗ РM № 739 від 23.07.2012 р. «Про авторизації лікарських засобів і затвердження післяреєстраційних змін».
Крім того, доповідач визначила загальні засади здійснення ФН у Республіці Молдова:
- Установи, уповноважені Міністерством охорони здоров’я, організовують збір, систематизують та аналізують інформацію про побічні дії ЛЗ та особливості їх взаємодії. Ця інформація періодично подається до Міністерства охорони здоров’я і публікується в спеціалізованих виданнях.
- Міністерство охорони здоров’я здійснює обмін інформацією про ПР ЛЗ з відповідними органами інших країн та ВООЗ.
- Медичні заклади та фармацевтичні підприємства зобов’язані повідомляти заклади про всі випадки ПР, виявлені при застосуванні ЛЗ, зареєстрованих в Республіці Молдова. За приховування, неповне подання інформації, а також знехтування проведення необхідних заходів вони несуть відповідальність згідно з чинним законодавством.
- У кожному медичному закладі повинен бути клінічний фармаколог або клінічний фармацевт, відповідальний за ФН.
- Забезпечення реєстрації виявлених ПР ЛЗ та інших фармацевтичних препаратів і повідомлення про них в обов’язковому порядку здійснюється Відділом ФН та раціонального використання ліків Агентства з ліків і медичних виробів.
- Забезпечення контролю за своєчасним наданням інформації про ПР ЛЗ та інші фармацевтичні препарати, що виникли при їх медичному використанні, з включенням даної інформації в річний звіт.
- Лікарі та медичні працівники всіх закладів охорони здоров’я Республіки Молдова незалежно від форм власності зобов’язані надавати відділу ФН інформацію про будь-які ПР ЛЗ, що виявлені на території Республіки Молдова, заповнюючи карту-повідомлення про ПР ЛЗ та інші фармацевтичні препарати.
Доповідачем були зазначені обов’язки відділу ФН у Республіці Молдова, а саме:
- реєстрація, систематизація та аналіз повідомлення про ПР ЛЗ, а також випадки відсутності ефективності ліків, повідомлені співробітниками системи охорони здоров’я та пацієнтами;
- передача в електронному форматі інформації про ПР ЛЗ, зареєстрованих у Республіці Молдова, в базу даних ВООЗ;
- виявлення, формування та підтвердження сигналу;
- затвердження і зберігання періодично оновлюваних звітів з безпеки ЛЗ (PSUR), наданих власниками реєстраційного свідоцтва;
- інформування власника реєстраційного свідоцтва про ПР ЛЗ, що зареєстровані в Республіці Молдова, які він представляє;
- збір та оцінка даних про медичні помилки, нераціональне використання або зловживання ліками;
- розробка документації щодо безпеки ліків, з подальшим інформуванням фахівців у галузі охорони здоров’я;
У своїй доповіді Ельвіра Істраті відзначила основні функції Агентства:
- авторизація (експертиза, затвердження та реєстрація) ЛЗ;
- нагляд за якістю лікарських засобів;
- нагляд і контроль фармацевтичної діяльності;
- застосування процедур нагляду за ринком згідно з положеннями, встановленими законодавством у галузі медичних виробів, у тому числі за допомогою авторизації імпорту медичних виробів;
- моніторинг та координація про-цесу закупівель медикаментів та фармацевтичної допомоги на національному рівні;
- застосування і розвиток системи ФН;
- просування та моніторинг раціонального використання ліків;
- затвердження та контроль за проведенням клінічних випробувань;
- моніторинг процесу постачання та оснащення медичними виробами медико-санітарних установ і реалізація національних програм;
- ведення Державного реєстру ліків, авторизованих в Республіці Молдова;
- створення і ведення Реєстру медичних виробів згідно із Законом про реєстри № 71-XV від 22 березня 2007 р.;
- створення та управління Національним каталогом цін виробників на ліки відповідно до Закону про реєстри № 71-XV від 22 березня 2007 року;
- інформаційне забезпечення системи охорони здоров’я в галузі медичних виробів;
- забезпечення впровадження стандартів якості та захисту;
- моніторинг ринку ліків і медичних виробів, представлених на ринку, включаючи якість останніх;
- сприяння гармонізації законодавства в галузі ліків, фармацевтичної діяльності і медичних виробів із законодавством європейської спільноти;
- надає консультативну допомогу.
На завершення Ельвіра Істраті зазначила, що в результаті плідної роботи Агентства кількість повідомлень щодо побічних реакцій в Республіці Молдова порівняно з попередніми роками збільшилась майже вдвічі.
Резолюція третьої науковопрактичної конференції
«Безпека та нормативноправовий супровід лікарських засобів: від розробки до медичного застосування», присвяченої пам’яті проф., д.м.н. Олексія Павловича Вікторова
Третя науковопрактична конференція «Безпека та нормативноправовий супровід лікарських засобів: від розробки до медичного застосування», присвячена пам’яті проф., д.м.н. Олексія Павловича Вікторова, відбулася 23–24 жовтня 2013 р. у м. Києві і була організована Міністерством охорони здоров’я України, Національною академією медичних наук України, ДП «Державний експертний центр МОЗ України» (далі — ДЕЦ). Її проведення відбулося відповідно до резолюції, прийнятої другою науковопрактичною конференцією «Безпека ліків: від розробки до медичного застосування», та Реєстру з’їздів, конгресів, симпозіумів та науковопрактичних конференцій, які проводитимуться у 2013 році, затвердженого Міністерством охорони здоров’я України та Національною академією медичних наук України.
Проведення цієї конференції було обумовлено істотними змінами у сфері розробки та обігу лікарських засобів, регулювання цих процесів. У світі і в Україні з’явилися нові законодавчі підходи до здійснення фармаконагляду, впроваджуються нові методи отримання інформації з безпеки ліків, вдосконалюються підходи до проведення раціональної фармакотерапії, створюються і впроваджуються медикотехнологічні документи на базі доказової медицини, якості наданої фармакотерапії, фармакоекономіки і фармакоепідеміології, оцінки значущості складових формулярної системи та підходів до її впровадження.
Програма конференції включала пленарні, секційні засідання, круглий стіл, лекції. В рамках конференції відбулися навчальний пресемінар «Система фармаконагляду у заявників: нормативноправове забезпечення та зміни до європейського законодавства» і під егідою ДУ «Інститут фармакології та токсикології НАМН України», Міжвідомчої МОЗ та НАМН України проблемної комісії «Фармакологія», Всеукраїнської громадської організації «Асоціація фармакологів України» — Х Національна школа молодих вченихфармакологів ім. академіка НАМН України О.В. Стефанова.
У роботі конференції взяли участь представники ВООЗ, співробітники регуляторних органів Великобританії, Швеції, Чехії, країн СНД (Російської Федерації, Казахстану, Киргизстану, Вірменії, Молдови, Білорусі, Узбекистану) і України, представники практичної охорони здоров’я, провізори, керівники органів управління охорони здоров’я, провідні вчені науководослідних інститутів, викладачі медичних і фармацевтичних вищих навчальних закладів, представники асоціацій виробників лікарських засобів, представники/виробники лікарських засобів, у тому числі з Польщі, Німеччини, Франції, Росії. Загальна кількість учасників конференції становила близько 500 осіб.
На конференції обговорювалися різні організаційні та методичні питання, пов’язані з нормативноправовим супроводом лікарських засобів від їх розробки до медичного застосування, безпекою ліків, пацієнтів, станом і перспективами розвитку системи фармаконагляду, формулярної системи, проведенням досліджень біоеквівалентності, фармакоепідеміологічних, фармакоекономічних досліджень, висвітленням питань безпеки ліків в освітніх програмах. Був проведений глибокий науковий аналіз особливостей розвитку та перебігу побічних реакцій лікарських засобів, розглядалися методи вивчення, профілактики, лікування побічних реакцій ліків, їх фармакоекономічна оцінка.
Під час конференції обговорювалися питання гармонізації взаємодії регуляторних органів та галузевих об’єднань, аудиту системи фармаконагляду на локальному і державному рівнях, здійснення збору інформації методом моніторингу стаціонарів з питань ефективності та безпеки лікарських засобів, впровадження формулярної системи.
Третя науковопрактична конференція «Безпека та нормативноправовий супровід лікарських засобів: від розробки до медичного застосування», присвячена пам’яті проф., д.м.н. Олексія Павловича Вікторова, констатує, що Міністерством охорони здоров’я України проведена велика робота в здійсненні нагляду за безпекою лікарських засобів на етапах розробки і широкого медичного застосування.
У даний час в Україні освоєна і впроваджена система спонтанних повідомлень, налагоджена активна методична та організаційна діяльність Департаменту післяреєстраційного нагляду та регіональних відділень ДЕЦ МОЗ України з питань фармаконагляду; відомості про побічні реакції лікарських засобів включені в державну медичну статистичну звітність, проводяться дослідження профілю безпеки лікарських засобів в післяреєстраційному періоді; розроблені навчальні плани і програми елективних курсів, перед і післядипломного рівня підготовки лікарів і провізорів з питань нагляду за побічними реакціями лікарських засобів, налагоджені міжнародні зв’язки. Основою здійснення фармаконагляду в Україні стали Директива Європейського парламенту та Ради ЄС від 06.11.2001 р. № 2001/83 ЄС, Постанова Ради ЄС від 22.07.93 р. № 2309/93, том 9А «Фармаконагляд. Правила ЄС щодо фармаконагляду за лікарськими препаратами для людини», Настанова з фармаконагляду в Європейському Союзі.
Незважаючи на наявність досягнень у сфері організації і здійснення фармаконагляду в Україні, залишається ряд питань, що визначені ВООЗ, потребою країни та змінами підходів до здійснення фармаконагляду у світі.
У зв’язку із зазначеним вище третя науковопрактична конференція констатує та пропонує:
1. Вважати за доцільне у 2015 р. проведення четвертої конференції «Безпека та нормативноправовий супровід лікарських засобів: від розробки до медичного застосування», присвяченої пам’яті проф., д.м.н. Олексія Павловича Вікторова, консолідувати зусилля країн СНД у її проведенні.
2. Внести пропозицію про включення до Реєстру з’їздів, конгресів, симпозіумів та науковопрактичних конференцій Міністерства охорони здоров’я України та Національної академії медичних наук України, запланованих на 2015 рік, четвертої науковопрактичної конференції «Безпека та нормативноправовий супровід лікарських засобів: від розробки до медичного застосування», присвяченої пам’яті проф., д.м.н. Олексія Павловича Вікторова.
3. Вважати за доцільне здійснення фармаконагляду в Україні та країнах СНД відповідно до вимог ІСН, стандартів Європейського Союзу, адаптованих до реальних умов країн СНД, за технічної, організаційної та методичної підтримки ВООЗ, ЄС, ЕМА та інших партнерів шляхом:
- проведення круглих столів із питань безпеки лікарських засобів і фармаконагляду в рамках роботи Міждержавної комісії із стандартизації, реєстрації та контролю якості лікарських засобів, виробів медичного призначення і медичної техніки держав — учасниць СНД;
- розвитку єдиних підходів до експресзвітності з безпеки лікарських засобів (єдині вимоги до формату повідомлень, включаючи електронні повідомлення, термінів звітності) в країнах СНД;
- розробки єдиних підходів до періодичної звітності фармацевтичних виробників у країнах СНД;
- розвитку механізмів інформаційного обміну в галузі фармаконагляду у країнах СНД;
- активізації участі країн СНД у Програмі міжнародного моніторингу лікарських засобів Всесвітньої організації охорони здоров’я;
- формування єдиних вимог до системи фармаконагляду у фармацевтичних компаніях у країнах СНД;
- розробки в країнах СНД єдиних підходів до управління ризиками, адекватних ризикам, для лікарських засобів в цілому і для препаратів з високою ймовірністю виникнення проблем безпеки в післяреєстраційному періоді;
- впровадження активних методів збору інформації про несприятливі наслідки застосування лікарських засобів;
- розробки в країнах СНД єдиних освітніх програм в галузі фармаконагляду для фахівців охорони здоров’я та фарміндустрії.
4. МОЗ України, ДЕЦ внести зміни до законодавства України, а саме:
- до нової редакції Закону України «Про лікарські засоби»:
стаття «Державна реєстрація ЛЗ»;
стаття «Фармаконагляд»;
- до підзаконних актів щодо:
акредитації закладів охорони здоров’я;
- атестації лікарів;
- аудиту системи фармаконагляду в системі охорони здоров’я;
- гармонізації підходів до здійснення фармаконагляду лікарських засобів незалежно від їх походження;
- проведення післяреєстраційних досліджень з безпеки.
5. МОЗ України, ДЕЦ за участі усіх зацікавлених країн розробити та затвердити Національне керівництво з належної практики фармаконагляду.
6. МОЗ України створити клінікофармацевтичну службу в системі охорони здоров’я із включенням до її складу служби клінічних провізорів та використання потенціалу цих спеціалістів для закладів охорони здоров’я до здійснення раціональної фармакотерапії та моніторингу за безпекою медичного застосування лікарських засобів.
7. Сприяти комунікації всіх зацікавлених сторін із питань безпеки лікарських засобів шляхом:
- ефективної взаємодії зі ЗМІ та формування об’єктивного бачення ЗМІ з питань безпеки лікарських засобів і використання потенціалу ЗМІ для навчання медичної громадськості та населення з питань безпеки лікарських засобів;
- взаємодії з державними, громадськими та міжнародними організаціями, причетними до питань обігу та безпеки лікарських засобів;
- залучення пацієнтів до процесу інформування про побічні реакції та відсутності ефективності лікарських засобів.
8. Рекомендувати МОЗ України спільно з ДЕЦ сприяти впровадженню активних методів здійснення фармаконагляду.
9. Рекомендувати МОЗ України спільно з ДЕЦ розробити і включити в програми навчання на перед і післядипломних рівнях середньої та вищої медичної та фармацевтичної освіти навчальний курс про безпеку лікарських засобів і фармаконагляд з урахуванням рекомендацій ВООЗ і положень керівництва ВООЗ HAI «Як розпізнавати просування ліків і як до нього ставитися». Сприяти виданню посібників, методичних рекомендацій, нормативних документів, пов’язаних з питаннями безпеки лікарських засобів, для розширення і поглиблення знань та реалізації завдань, що стоять перед учасниками фармаконагляду.
10. Рекомендувати МОЗ України збільшити кількість годин із клінічної фармакології в навчальних програмах вищої медичної освіти для досягнення належного рівня підготовки лікарів.
11. Рекомендувати МОЗ України спільно з ДЕЦ, асоціаціями виробників лікарських засобів, тренінгових центрів сприяти розробці, організації та проведенню навчальних семінарів і шкіл з питань безпеки ліків для лікарів, провізорів, фармацевтів, студентів медичних і фармацевтичних вузів, наукових працівників, виробників лікарських засобів, враховуючи міжнародний і національний досвід у сфері фармаконагляду.
12. МОЗ України сприяти розвитку напрямку управління ризиками як у системі охорони здоров’я, так і в фарміндустрії, включаючи:
- розробку та впровадження національних рекомендацій та протоколу щодо медикаментозної алергії, на підставі яких розробити і впровадити наказ з медикаментозної алергії;
- впровадження в Україні мережі ЕвроFIR з метою зменшення медикаментозної та харчової алергії та її наслідків;
- відображення в клінічних протоколах і рекомендаціях з лікування загальноваріабельного імунодефіциту, саркоїдозу, медикаментозної алергії питань раціонального доказового харчування.
13. Опублікувати резолюцію конференції в журналах «Фармацевтичний журнал», «Український медичний часопис», «Раціональна фармакотерапія», «Провізор», газетах «Аптека», «Новини медицини і фармації», «Здоров’я України», «Ваше здоров’я», а також у спеціалізованих медичних виданнях, розмістити її на офіційному сайті Міністерства охорони здоров’я та ДП «Державний експертний центр МОЗ України».
14. МОЗ України та НАМН України при проведенні щорічних профільних наукових форумів включати в їх програму питання безпеки використання лікарських засобів.
15. МОЗ України спільно з ДЕЦ сприяти донесенню інформації про безпеку лікарських засобів, фармаконагляд, формулярну систему до лікарів та закладів охорони здоров’я у масштабах країни.
Генеральний директор
ДП «Державний експертний центр
МОЗ України» О.О. Нагорна
Директор Департаменту після-
реєстраційного нагляду
ДП «Державний експертний центр
МОЗ України» О.В. Матвєєва