Газета «Новости медицины и фармации» 5 (494) 2014
Вернуться к номеру
Роль сучасних прокінетиків при корекції дисфункцій травного каналу
Авторы: Копча В.С., Копча Ю.В. - Тернопільський державний медичний університет ім. І.Я. Горбачевського
Рубрики: Семейная медицина/Терапия, Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 6-8 (Укр.)
Відомо, що моторно-секреторні розлади реєструються в більше ніж половині випадків патології травної системи, часто визначають особливості її клінічної симптоматики і сприяють прогресуванню й тяжчому перебігу хвороби [1–3].
Сповільнення або прискорення моторної активності травного каналу (ТК) притаманні практично для всіх органічних хвороб органів травлення (гастроезофагеальна рефлюксна, виразкова хвороба, хронічний панкреатит, онкопатологія), кишкових інфекцій, багатьох соматичних недуг (цукровий діабет, патологія щитоподібної залози, міопатія, нейропатія та ін.) та функціональних розладів (функціональна диспепсія — ФД, синдром подразненого кишечника). Важливо, що ФД стосується не тільки патології товстої кишки, це дисфункція всього травного каналу [4–6]. Цим фактом можна пояснити те, що синдром подразненого кишечника та інші функціональні захворювання кишечника часто поєднуються з гастроезофагеальною рефлюксною хворобою та функціональною диспепсією [7, 8].
У механізмі моторної дисфункції системи травлення визначальну роль відіграють два порушення: зміна чутливості та структури рецепторного апарату або біоелектричних властивостей м’язової клітини, а також дисбаланс нейромедіаторів, нейропептидів, гастроінтестинальних гормонів. Так, ацетилхолін, серотонін, гістамін, холецистокінін, ангіотензин, мотилін і гастрин стимулюють моторну функцію, а дофамін, норадреналін, глюкагон, вазоактивний інтестинальний поліпептид і соматостатин пригнічують її.
З урахуванням зазначених властивостей поступово формувалося два напрямки в корекції моторних порушень. Для пригнічення моторики застосовують агоністи симпатичної нервової системи, k-опіатних, пуринергічних рецепторів чи антагоністи парасимпатичної нервової системи, а також регулятори внутрішньоклітинного вмісту кальцію у м’язових клітинах. Активують перистальтику ТК препарати, що безпосередньо чи опосередковано посилюють вплив парасимпатичної нервової системи: стимулятори парасимпатичних і допамінових рецепторів, 5-гідрокситриптамінових рецепторів 4-ї групи (5-НТ4) та антагоністи 5-НТ-рецепторів 3-ї групи (5-НТ3), засоби, що впливають на k- і b-опіатні рецептори [9].
Щоправда при інфекційних диспепсіях засоби, здатні корегувати моторику кишечника (прокінетики, спазмолітики та антидіарейні препарати), потрібно застосовувати з великою обережністю. Адже при усіх кишкових інфекціях блювота і діарея є еволюційно сформованими захисними реакціями організму, покликаними прискорити виведення з нього патогенних мікроорганізмів та їх токсинів. Тому зниження перистальтики кишечника сприяє погіршенню стану хворого, наростанню явищ токсикозу [10].
За останні роки медицина отримала значну кількість фармакологічних препаратів для активації перистальтики травного каналу шляхом стимулювання або блокування серотонінергічних, допамінових рецепторів чи впливу на стан ферменту ацетилхолінестерази. Для деяких медикаментів на певних етапах дослідження (доклінічному, клінічному, постмаркетинговому) виявлено такі ефекти, які унеможливили їх клінічне застосування або подальше використання, частина препаратів втратила клінічне значення внаслідок незначної активності або через появу безпечніших та ефективніших засобів.
На сьогодні активно застосовуються шість прокінетичних препаратів: метоклопрамід, домперидон, мосаприд, тегасерод, цизаприд, ітоприд. Залежно від клінічної ситуації, фармакологічних особливостей препарату та рекомендацій у кожній країні надають перевагу тому чи іншому прокінетику.
Метоклопрамід (церукал, AWD pharma)
Давно відомий препарат, що широко використовували у клінічній практиці. Він має подвійний механізм дії, а також здатний провокувати значну кількість побічних впливів.
Метоклопрамід блокує центральні та периферичні D2-рецептори, стимулює вивільнення ацетилхоліну з постгангліонарних нервових закінчень, а також є агоністом 5-НТ4- і антагоністом 5-НТ3-рецепторів. Завдяки цим механізмам реалізуються прокінетичні ефекти метоклопраміду, переважно на рівні проксимальних відділів ТК. Знижує рухову активність стравоходу, підвищує тонус нижнього стравохідного сфінктера, поліпшує евакуацію їжі зі шлунка за рахунок підвищення тонусу його тіла та зростання фазової активності антрального відділу. Одночасно з цим розслаблюються верхні відділи тонкої кишки, що запобігає розвитку дуоденогастрального рефлюксу та блюванню, прискорюється транзит по тонкій кишці. Після встановлення здатності препарату впливати на гастродуоденальну моторику на нього покладалися великі надії. Однак виявилося, що клінічна ефективність метоклопраміду як прокінетика є недостатньо високою.
Небезпечні побічні ефекти за умови тривалого застосування перевищують позитивні прокінетичні й антиеметичні властивості метоклопраміду та обмежують тривалість його прийому. Так, цей препарат проникає через гематоенцефалічний бар’єр, викликаючи порушення орієнтації, значне погіршення швидкості реакції та здатності до керування автотранспортом або роботи з потенційно небезпечними механізмами, іноді навіть екстрапірамідні розлади. Нині метоклопрамід призначають короткими курсами при вторинних порушеннях моторної функції верхніх відділів ТК, диспепсіях на тлі супутньої патології. З огляду на його низьку ефективність та значну частоту побічних ефектів прийом метоклопраміду, особливо тривалий, визнаний небажаним [9, 11].
Наявність цих значних недоліків зумовила необхідність розробки й вивчення препаратів, що належать до генерації інших речовин — селективних блокаторів допамінових рецепторів.
Домперидон (Брюліум Лінгватабс, Brupharmexport; мотиліум, Janssen)
Прокінетичний препарат другого покоління, селективний антагоніст периферичних D2-рецепторів, що забезпечує прокінетичний вплив на моторику верхніх відділів ТК. Має сублінгвальну форму, що дозволяє швидко усувати прояви еметичного синдрому. Впливаючи на рухову функцію шлунка і дванадцятипалої кишки, домперидон не впливає на показники внутрішньошлункового рН, рівень гастрину [12].
Завдяки блокуванню периферичних D2-рецепторів під час приймання домперидону реалізується прокінетична дія препарату у верхніх відділах ТК. Він збільшує тривалість перистальтичних скорочень антрального відділу шлунка та дванадцятипалої кишки, прискорює спорожнення шлунка, незначно підвищує тонус нижнього стравохідного сфінктера. Антиеметичний ефект домперидону зумовлений поєднанням гастропрокінетичної дії та антагонізмом до рецепторів допаміну в тригерній зоні хеморецепторів, що розташовані поза гематоенцефалічним бар’єром. Домперидон погано проникає через гематоенцефалічний бар’єр і тому практично не зумовлює побічних впливів з боку центральної нервової системи, не має кардіотоксичного ефекту.
Кілька рандомізованих досліджень, проведених у 2000–2002 рр., продемонстрували поліпшення якості життя хворих, які приймали домперидон [13, 14], а також наявність у нього мінімальних побічних ефектів [15, 16]. Межа клінічної безпеки домперидону в десятки разів вища, ніж у метоклопраміду [17].
Домперидон добре зарекомендував себе при лікуванні пацієнтів із функціональною диспепсією, широко застосовується при системній склеродермії, після операцій на шлунку з використанням ваготомії. Опублікований у 2008 р. систематичний аналіз ефективності домперидону при діабетичному гастропарезі за результатами 28 досліджень із 1981 до 2007 р. продемонстрував, що домперидон при цьому захворюванні відповідає рекомендаціям рівня С [18].
Мосаприд (мосид МТ, Torrent Pharmaceuticals Ltd)
Прокінетичний препарат нової генерації з подвійним механізмом дії, який відносно недавно з’явився на фармацевтичному ринку України [19].
Мосаприд є селективним агоністом 5-НТ4- та частковим антагоністом 5-НТ3-рецепторів. Він активізує моторику верхнього відділу ТК: стравоходу, шлунка та дванадцятипалої кишки. Під час досліджень на експериментальних тваринах (конях і морських свинках) продемонстровано стимуляцію перистальтики тонкої та товстої кишок на тлі прийому мосаприду [20, 21]. Щодо використання в людини таких даних не отримано: результати рандомізованого проспективного контрольованого дослідження гастроінтестинального транзиту у 60 пацієнтів за допомогою капсульної ендоскопії продемонстрували прискорення спорожнення шлунка, але тривалість транзиту по товстій та тонкій кишках вірогідно не змінювалася під час прийому мосаприду [22].
Зважаючи на можливість побічних явищ і реакцій (діарея, сухість у роті, загальна слабкість, запаморочення, абдомінальний біль, відчуття серцебиття, шкірні висипання, кропив’янка, збільшення рівня тригліцеридів, печінкових трансаміназ), автори метааналізу рандомізованих досліджень з питань ефективності агоністів серотоніну зауважують, що мосаприд доцільно призначати короткотривалими курсами, а дослідження його тривалого застосування у хворих на ФД потрібно продовжити [23].
Тегасерод (Zelnorm (США)/Zelmac (Європа, Росія), Novartis)
Новий прокінетичний препарат, що потужно стимулює моторну функцію товстої кишки, доступний у країнах Європи, США, Росії, але в Україні на фармацевтичному ринку цього препарату ще немає.
Тегасерод — частковий агоніст 5-НТ4-рецепторів, під впливом якого відбувається викид активуючих нейротрансмітерів з ентеричних холінергічних нейронів, що стимулює перистальтичну активність переважно нижніх відділів ТК, зменшує тривалість транзиту хімусу по тонкій і товстій кишках, збільшує кишкову секрецію рідини та хлоридів з одночасним пригніченням вісцеральної чутливості. Завдяки таким фармакологічним властивостям препарат прискорює перистальтику товстої кишки, збільшує кількість дефекацій, поліпшує консистенцію калових мас (пом’якшення), нівелює абдомінальний біль і відчуття дискомфорту [24].
Початок клінічного застосування тегасероду асоціювався з добрим профілем безпеки препарату, що було підтверджено у кількох рандомізованих дослідженнях [25, 26]. Але у березні 2007 р. фірма-виробник Novartis відкликала тегасерод з фармацевтичного ринку США та Канади на підставі результатів аналізу безпеки, проведеного FDA у 12 дослідженнях, у яких було продемонстровано вірогідне підвищення розвитку інфаркту міокарда, кардіогенного шоку, нестабільної стенокардії під час його прийому. У липні 2007 р. тегасерод знову повернули на фармацевтичний ринок США за умови суворого обмеження показань до застосування, а саме: при синдромі подразненого кишечника з переважанням запору та ідіопатичного гастропарезу в жінок віком понад 55 років [24]. Препарат відкликали з ринку Швейцарії у травні 2007 р. відповідно до розпорядження Швейцарського агентства з лікарських засобів (Swissmedic) у зв’язку з проблемами кардіоваскулярної безпеки [27]. Триває процес вилучення тегасероду із загальної практики в Австралії, розглядається можливість припинення широкого використання цього препарату в Росії.
Цизаприд (координакс, пропульсид, цизап, «Янссен Фармацевтика НВ»)
Непрямий М-холіноміметик (агоніст серотонінових 5-НТ4-рецепторів). Механізм дії пов’язаний із підвищенням звільнення ацетилхоліну із закінчень холінергічних нервів брижових сплетінь і підвищенням чутливості М-холінорецепторів гладкої мускулатури кишечника. Препарат не має допамінергічного ефекту. Він стимулює вироблення мотиліну, підвищує тонус нижнього стравохідного сфінктера, прискорює просування їжі по стравоходу та її евакуацію зі шлунка і дванадцятипалої кишки, посилює скорочення жовчного міхура і кишкову перистальтику. Цизаприд раніше застосовували при гастроезофагальному і дуоденогастральному рефлюксах, гастропарезі, гіпомоториці жовчного міхура, хронічних атонічних запорах. Слід враховувати, що препарати цієї групи мають холінергічні побічні ефекти, тобто можуть спричиняти гіперемію обличчя, пітливість, бронхоспазм, брадикардію, провокують розвиток атріовентрикулярної блокади, подовження інтервалу Q–T, екстрасистолію, шлуночкову тахікардію, мерехтіння і фібриляцію шлуночків, зниження артеріального тиску, болі в серці, підвищення шлункової секреції, діарею, почастішання сечовипускання, іноді спастичні болі в животі, порушення акомодації. Усі ці побічні ефекти стали основою для заборони цизаприду в ряді країн Європи і в США. Слід враховувати можливість розвитку ще одного побічного ефекту цизаприду — скороминущого внутрішньопечінкового холестазу [28, 29].
Ітоприд (Ganaton (США, Європа, Росія), Abbott GmbH&Co; праймер (Україна), Mili Healthcare)
Новітній прокінетичний препарат, який протягом останніх кількох років широко використовують у клінічній практиці різних країн (Японії, США, Європи, Росії, Україні).
Ітоприд має подвійний механізм дії. Він є антагоністом периферичних D2-рецепторів та, крім цього, має антихолінестеразну активність. Блокування D2-рецепторів на тлі приймання ітоприду сприяє збільшенню активності аденілатциклази в гладких м’язах стравоходу, шлунка, дванадцятипалої кишки й рівня цАМФ і підвищенню рухової активності зазначених органів. За рахунок холіноміметичної дії забезпечує збільшення періоду напіврозпаду ендогенного ацетилхоліну, пролонгує його вплив, що супроводжується підвищенням перистальтичної активності тонкої та товстої кишок.
Але нещодавно було опубліковано результати одного дослідження, у якому ефективність ітоприду при ФД поставлена під сумнів. Після закінчення 2-ї фази рандомізованого, мультицентрового, подвійного сліпого, плацебо-контрольованого дослідження вчені помітили, що швидкість і повнота нівелювання скарг у хворих на ФД, які отримували по 150 мг/добу ітоприду, вірогідно не відрізнялася від показників групи пацієнтів, які приймали плацебо. Крім цього, дослідники зазначають, що препарат має високий профіль безпеки, однак наголошують на наявності випадків підвищення рівня пролактину у групі ітоприду (18 випадків із 579 призначень препарату) проти групи плацебо (1 випадок із 591) [30].
Як видно з наведених даних, найбільш безпечним з усіх перелічених засобів є передусім селективний прокінетик домперидон — гастрокінетик II покоління. Він ефективно ліквідує регургітацію вмісту шлунка і сприяє зменшенню частоти рецидивів захворювання. Домперидон підвищує тонус нижнього сфінктера стравоходу, прискорює евакуацію шлункового вмісту, позитивно впливає на стравохідний кліренс, зменшує гастроезофагеальний рефлюкс. Домперидон не впливає на секрецію шлунка і може застосовуватися при різних варіантах кислотності [31].
В Україні зареєстровано декілька торгових назв препаратів, що містять домперидон, серед яких вигідно відрізняється його лінгвальна форма — препарат Брюліум Лінгватабс, що розчиняється і швидко всмоктується у роті без потреби води. Фактично це препарат вибору для лікування неерозивної рефлюксної хвороби, а також при хронічних гастродуоденітах, асоційованих з гелікобактерною інфекцією. Нагадаємо, що всі інші прокінетики активні тільки в умовах кислого вмісту шлунка. Тому їх прийом не повинен поєднуватися з антацидами, антисекреторними та антихолінергічними препаратами. Винятком є Брюліум Лінгватабс. Отже, його можна приймати при значних диспепсіях (нудота, блювання) на тлі застосування антацидів чи антисекреторних засобів [32]. А завдяки здатності підвищувати тонус сфінктерів Брюліум особливо показаний при діареях, пов’язаних із гіпокінезією кишечника, особливо обумовлених токсином S.аureus.
Ми маємо досвід лікування 46 хворих із гострими кишковими інфекціями (ГКІ) середнього ступеня тяжкості, спричиненими умовно-патогенними мікроорганізмами (УПМ). В усіх обстежуваних осіб діагноз підтверджено бактеріологічно шляхом отримання копрокультури умовно-патогенних ентеробактерій у кон-центрації, що перевищує 106 в 1 г випорожнень.
20 пацієнтів отримували тільки традиційну терапію з використанням дієти № 4, фуразолідону та ентеросорбенту ентеросгелю (група контролю), решта — у зв’язку із затяжним гастроентеритним синдромом (дискомфорт, відчуття переповнення, розпирання, здуття, бурчання в животі, нудота, блювання, ознаки гастроезофагального рефлюксу — відрижка, печія та ін.), пов’язаним із гіпокінезією кишечника, — таке ж лікування з включенням препарату Брюліум Лінгватабс у рекомендованій разовій дозі (1 таблетка — 10 мг домперидону — під язик 2–3 рази на добу).
Обидві групи хворих були сформовані методом випадкової ознаки. Відтак пацієнти були порівнянними за статтю, віком, тяжкістю недуги, умовами довкілля, термінами початку лікування від моменту захворювання.
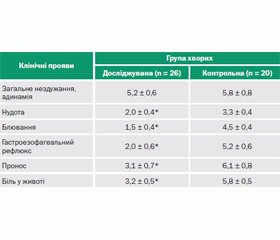
Тривалість основних клінічних проявів у хворих на ГКІ, спричинені УПМ, при різних способах терапії наведена в табл. 1.
Зіставлення термінів зникнення нудоти, блювання, ознак гастроезофагального рефлюксу, проносу, болю в животі показало тенденцію до вкорочення їх у хворих досліджуваної групи (комплексне використання Брюліуму) порівняно з контролем (тільки загальноприйнята терапія без використання Брюліуму, р < 0,05).
При ГКІ, спричинених УПМ, поряд із гастроентеритним синдромом часто реєстрували клінічні ознаки ентериту: на здуття живота, бурчання і розлитий біль у животі; рясні, пінисті випорожнення з грудками неперетравленої їжі скаржились 82,6 % пацієнтів. Лише в окремих випадках копрологічне дослідження давало можливість судити про недостатність травлення у тонкій кишці, що могло розцінюватися як прояви ентериту: жовтий колір випорожнень (у 58,7 % випадків), помірна кількість м’язових волокон, нейтрального жиру, жирних кислот, мил (67,4 %) і багато крохмалю, перетравлюваної клітковини та йодофільної флори (71,7 %). Відтак на підставі клінічних і копрологічних досліджень гастроентеритну клінічну форму хвороби щонайбільше діагностували у 82,6 ± 5,6 % пацієнтів.
Для більш аргументованого підтвердження доцільності виділення ентероколітної форми зазначених кишкових інфекцій усіх хворих було обстежено з використанням специфічного біохімічного маркера ушкодження слизової оболонки тонкої кишки — і-FABP. Його визначали в період розпалу ГКІ (2-га — 3-тя доба недуги) і під час ранньої реконвалесценції — при стиханні клінічних проявів (7-ма — 10-та доба хвороби). Хронічної патології органів травлення в досліджуваних осіб не було.
Установили, що в період розпалу захворювання в усіх 46 (100,0 %) осіб із ГКІ, спричиненими УПМ, рівень і-FABP перевищував пороговий (20 нг/л) і становив 306,0 ± 80,6 нг/л (межі коливань від 51,0 до 800,0 нг/л). Очевидно, це свідчить про практично постійний розвиток ентериту при зазначених ГКІ.
Медіана вмісту і-FABP у сироватці крові під час розпалу недуги становила 282,75 нг/л, причому середнє значення цього показника досягало 274,5 ± 85,3 нг/л.
Після традиційного лікування без використання Брюліуму (7-ма — 10-та доба хвороби) рівень і-FABP у сироватці крові перевищував пороговий у кожного третього реконвалесцента ГКІ, спричиненої УПМ, і тільки в одиничних осіб (11,5 ± 6,3 %), лікованих за допомогою ще й Брюліуму (табл. 2). Тож варто відзначити вірогідне зменшення кількості реконвалесцентів із наявністю біохімічного маркера ентериту після комбінованої терапії із додаванням Брюліуму, ніж без цього прокінетика (р < 0,05).
Таким чином, у всіх хворих із ГКІ, спричиненими УПМ, уражається тонка кишка. Біохімічна ознака ентериту (за рівнем і-FABP у сироватці крові) характеризується вірогідно швидшою позитивною динамікою при комплексному лікуванні із застосуванням Брюліуму, ніж при традиційній терапії без використання цього прокінетика. У жодному випадку не було встановлено побічних реакцій чи побічних явищ препарату.
Відомо, що раціональна корекція функціональних моторно-секреторних розладів травної системи істотно впливає на результати лікування й оцінюється як сучасна патогенетична складова комплексної терапії патології органів гастродуоденальної зони.
Циклічний фазовий характер моторних взаємозв’язків органів травлення порушується при гастродуоденальних захворюваннях, коли ураження одного органа призводить до дискінетичних порушень спочатку на рівні функціональної, а потім органічної поєднаної патології травної системи, реалізується дисфазна дезінтеграція структурно-секреторної взаємодії органів травлення. Доведено, що корекція розладів гастродуоденальної моторики впливає на рухові взаємозв’язки органів травлення і сприяє відновленню їх нормальної фазової структури.
Тому можна припустити, що під впливом препарату Брюліум Лінгватабс (діюча речовина — домперидон) забезпечується не тільки прокінетична активність у верхніх відділах ТК, але й у разі гіпокінезії кишечника активується перистальтична хвиля у його дистальніших відділах. У підсумку це забезпечує не тільки вгамовування клінічних проявів ентериту, але й нормалізацію біохімічного маркера ушкодження слизової оболонки тонкої кишки.
Таким чином, виходячи з результатів досліджень, можна стверджувати, що Брюліум Лінгватабс надійно увійшов до широкої клінічної практики як препарат, що має переваги за ефективністю, безпекою і терапевтичними можливостями перед іншими відомими прокінетиками.
1. Гутнова С.К. Биоэлектрическая активность верхних отделов желудочно-кишечного тракта у больных хроническим панкреатитом / С.К. Гутнова // Гастроэнтерология Юга России. — 2009. — С. 44–45.
2. Ивашкин В.Т. Эволюция представлений о роли нарушений двигательной функции пищевода в патогенезе гастроэзофагеальной рефлюксной болезни / В.Т. Ивашкин, А.С. Трухманов // РЖГГК. — 2010. — Т. 20, № 2. — С. 13–19.
3. Голубь И.В. Нарушение моторики желудка у больных с ГЭРБ, имеющих симптомы диспепсии / [И.В. Голубь, Д.В. Пасечников, Т.Г. Удовиченко и др.] // РЖГГК. — 2010. — Т. 20, № 5. — Прил. 36. — С. 8.
4. Keller J. Intestinal and anorectal motility and functional disorders / J. Keller, P. Layer // Best Pract. Res. Clin. Gastroenterol. — 2009. — Vol. 23 (3). — P. 407–423.
5. Bratten J.R. Small intestinal motility / J.R. Bratten, M.P. Jones // Curr. Opin. Gastroenterol. — 2007. — Vol. 23 (2). — P. 127–33.
6. Serra J. Impaired transit and tolerance of intestinal gas in the irritable bowel syndrome / J. Serra, F. Azpiroz, J.–R. Malageladal // Gut. — 2001. — №. 48. — P. 14–19.
7. Kaji M. Prevalence of overlaps between GERD, FD and IBS and impact on health-related quality of life / [M. Kaji, Y. Fujiwara, M. Shiba et al.] // J. Gastroenterol. Hepatol. — 2010. — Vol. 25 (6). — P. 1151–1156.
8. Чернявський В.В. Оптимізація підходів до лікування синдрому подразненого кишечника із закрепами / В.В. Чернявський, В.О. Козлов // Новости медицины и фармации. — 2011. — № 358. — http://www.mif-ua.com/archive/article/16578
9. Бабак О.Я. Прокінетичні препарати (від метоклопраміду до ітоприду) у клінічній практиці / О.Я. Бабак, Т.Л. Можина // Сучасна гастроентерологія. — 2008. — № 5 (43). — С. 4–11.
10. Козько В.М. Принципи терапії гострих кишкових інфекцій з урахуванням мікробіоценозу кишечнику / В.М. Козько, А.В. Бондаренко, К.В. Юрко // Провизор. — 2010. — № 12. — http://www.provisor.com.ua/archive/2010/N12/gkinf_1210.php
11. Lata P.F. Chronic metoclopramide therapy for diabetic gastroparesis [Електроний ресурс] / P.F. Lata, D.L. Pigarelli // Ann. Pharmacother. — 2003. — № 37 (1). — P. 122–126.
12. Просоленко К.О. Еметичний синдром при захворюваннях травного каналу / К.О. Просоленко // Острые и неотложные состояния в практике врача. — 2011. — № 2 (26). — http://urgent.com.ua/article/376.html
13. Farup C.E. Effect of domperidone on the health-related quality of life of patients with symptoms of diabetic gastroparesis / [C.E. Farup, N.K. Leidy, M. Murray et al.] // Diabetes Care. — 2001. — № 21 (10). — P. 1699–1706.
14. Silvers D. Domperidone in the management of symptoms of diabetic gastroparesis: efficacy, tolerability, and quality-of-life outcomes in a multicenter controlled trial. DOM-USA-5 Study Group / [D. Silvers, M. Kipnes, V. Broadstone et al.] // Clin. Ther. — 2000. — № 20 (3). — P. 438–453.
15. Dimitrascu D. Domperodone versus metoclopramide in the treatment of diabetic gastroparesis / D. Dimitrascu // Am. J. Gastroenterol. — 2000. — Vol. 95, Is. 1. — P. 316.
16. Patterson D. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis [Електронний ресурс] / [D. Patterson, T. Abell, R. Rothstein et al.] // Am. J. Gastroenterol. — 2002. — № 94 (5). — P. 1230–1234.
17. Бабак О.Я. Гастроэзофагеальная рефлюксная болезнь / О.Я. Бабак. — К.: Интерфарма, 2000. — 175 с.
18. Sugumar A. A Systematic Review of the Efficacy of Domperidone for the Treatment of Diabetic Gastroparesis / A. Sugumar, A. Singh, P.J. Pasricha // Clin. Gastroenterol. Hepatol. — 2008. — № 2. — Р. 123–135.
19. Радченко О.М. Підходи до лікування спастичного болю / О.М. Радченко // Рациональная фармакотерапия. — 2012. — № 4. — С. 19–24.
20. Kim H.S. The effect of mosapride citrate on proximal and distal colonic motor function in the guinea-pig in vitro / H.S. Kim, E.J. Choi, H. Park // Neurogastroenterol. Motil. — 2008. — № 20 (2). — Р. 169–176.
21. Sasaki N. Effects of mosapride, a 5–hydroxytryptamine 4 receptor agonist, on electrical activity of the small intestine and cecum in horses / N. Sasaki, K. Okamura, H. Yamada // Am. J. Vet. Res. — 2005. — № 66 (8). — Р. 1321–1323.
22. Wei W. Effect of mosapride on gastrointestinal transit time and diagnostic yield of capsule endoscopy / W. Wei, Z. Z. Ge, H. Luetal // J. Gastroenterol. Hepatol. — 2007. — № 22 (10). — Р. 1605–1608.
23. Hiyama T. Treatment of functional dyspepsia with serotonin agonists: a meta-analysis of randomized controlled trials / [T. Hiyama, M. Yoshihara, K. Matsuo et al.] // J. Gastroenterol. Hepatol. — 2007. — № 22 (10). — Р. 1566–1570.
24. Hammerle C.W. Updates on treatment of irritable bowel syndrome / C.W. Hammerle, C.M. Surawicz // World J. Gastroenterol. — 2008. — № 14 (17). — Р. 2639–2649.
25. Hadley S.K. Treatment of Irritable Bowel Syndrome / K.S. Hadley, S.M. Gaarder // American Family Physician. — 2005. — № 12, Vol. 72. — Р. 2501–2506.
26. Lin San-Ren. A randomized, double-blind, placebo-controlled trial assessing the efficacy and safety of tegaserod in patients from China with chronic constipation / [San-Ren Lin, Mei-Yun Ke, Jin-Yan Luo et al.] // World J. Gastroenterol. — 2007. — № 13 (5). — Р. 732–739.
27. Swissmedic удаляет с рынка тегасерод // Аптека. — 2007. — http://www.apteka.ua/news/archive_day/ 20070601/980/
28. Рациональная фармакотерапия заболеваний органов пищеварения / Под ред. В.Т. Ивашкина. — М.: Литтерра, 2003. — 1046 с.
29. Об изменениях в инструкции по медицинскому применению препарата «Координакс» (цизаприд) (табл. по 0,005 г и 0,010 г) производства фирмы «Янссен Фармацевтика НВ» (Бельгия) — http://www.provisor.com.ua/archive/2000/N14/inf_pob.php
30. Talley N.J. Itopride in functional dyspepsia: results of two phase III multicentre, randomised, double-blind, placebo-controlled trials / [N.J. Talley, J. Tack, T. Ptak et al.] // Gut. — 2008. — № 57. — Р. 740–746.
31. Леженко Г.О. Підходи до терапії гастроезофагеального рефлюксу у дітей, хворих на бронхіальну астму / Г.О. Леженко, О.Є. Пашкова // Современная педиатрия. — 2011. — № 5 (39). — С. 180–182.
32. Бекетова Г.В. Лікування хронічних гастродуоденітів у дітей і підлітків (частина ІІ) / Г.В. Бекетова, К.М.А. Ібрагім // Дитячий лікар. — 2012. — № 8. — С. 13–15.

/7_u/7_u.jpg)