Газета «Новости медицины и фармации» Неврология (497) 2014 (тематический номер)
Вернуться к номеру
Эффективность Глиатилина в улучшении качества жизни пациентов, живущих с болезнью Паркинсона
Авторы: Юров И.В. - к.м.н., Приазовский региональный кабинет по коррекции экстрапирамидных и когнитивных нарушений, г. Мариуполь
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 22-25
Введение
Болезнь Паркинсона (БП) является неуклонно прогрессирующим хроническим заболеванием центральной нервной системы, в основе которого лежит дегенерация дофаминергических нейронов черной субстанции, проявляющаяся сочетанием гипокинезии с ригидностью, тремором покоя и постуральной не-устойчивостью, определенную негативную роль играет дисбаланс ацетилхолина, глутамата, норадреналина и серотонина [1, 3, 5, 14, 16, 22]. Среди факторов, ведущих к дегенерации и апоптозу этих нейронов, важную роль играют нарушение митохондриального дыхания, энергетический дефицит нейрона, усиление свободнорадикального окисления, избыточное накопление свободных ионов кальция и повышение эксайтотоксичности глутамата, вызывающее деполяризацию мембраны нейрона, нарушение ионной проницаемости с массивным входом ионов кальция в клетку (глутамат-кальциевый каскад) [4, 8, 9, 23]. Патоморфологически БП характеризуется избирательной гибелью нейронов черной субстанции, стадийным распространением и накоплением телец Леви (ольфакторная луковица и передние ольфакторные ядра, другие ядра ствола, черная субстанция, кора головного мозга), согласно гипотезе H. Braak [10, 11, 15]. Значимость БП обусловлена влиянием на качество жизни пациентов, трудоспособность, инвалидизацию. Снижение качества жизни пациентов с болезнью Паркинсона происходит преимущественно за счет двигательных нарушений, наличия болевого синдрома. При БП, кроме того, что появляются двигательные нарушения, также страдают эмоциональная и когнитивная сферы личности, и эти расстройства обусловлены преморбидными особенностями и естественным течением патологического процесса, а также влиянием применяемой терапии, ее закономерными побочными действиями. Помимо классических двигательных нарушений для БП характерен широкий спектр немоторных проявлений, включающий психические, вегетативные, сенсорные расстройства, нарушения сна и бодрствования, которые отражают вовлечение других структур центральной нервной системы, а также периферической нервной системы в патологический процесс [12, 13, 18]. Одним из наиболее частых немоторных проявлений БП является боль. В классической физиологии изложено несколько аспектов возникновения боли:
1) популярной теорией боли является теория воротного контроля, разработанная в 1965 году Мелзаком и Уоллом. Согласно ей, в системе афферентного входа в спинном мозге действует механизм контроля за прохождением ноцицептивной импульсации с периферии. Такой контроль осуществляется тормозными нейронами желатинозной субстанции, которые активируются импульсацией с периферии по толстым волокнам, а также нисходящими влияниями со стороны супра-спинальных отделов, в том числе коры головного мозга. Этот контроль представляет собой, образно говоря, «ворота», которые регулируют поток ноцицептивной импульсации;
2) теория генераторных и системных механизмов боли, развитая Г.Н. Крыжановским (1976), согласно которой сильная ноцицептивная стимуляция, поступающая с периферии, вызывает в клетках задних рогов спинного мозга каскад процессов, которые запускаются возбуждающими аминокислотами и пептидами (субстанцией Р);
3) кроме того, болевые синдромы могут возникать вследствие деятельности в системе болевой чувствительности новых патологических интеграций — агрегата гиперактивных нейронов, который является генератором патологически усиленного возбуждения и патологической алгической системы, представляющей собой новую структурно-функциональную организацию, которая состоит из первично и вторично измененных ноцицептивных нейронов, и являющейся патогенетической основой болевого синдрома;
4) нейроматриксная теория боли, обоснованная в 1999 г. R. Melzack: «Болевое ощущение формируется паттерном нервных импульсов в нейрональных цепях ЦНС (функциональные петли между таламусом и корой, корой и лимбической системой), паттерны импульсов запускаются как сенсорным входом, так и центрально, независимо от периферической стимуляции».
Исследователи полагают, что боль у пациентов может быть связана с основными симптомами паркинсонизма, прежде всего мышечной ригидностью, сопутствующей скелетно-мышечной патологией, или может быть самостоятельным симптомом, отражающим нарушение функции ноцицептивной системы при БП [20, 25]. У пациентов с БП боль может также зависеть от нейромедиаторных изменений и возникать на фоне как гиподофаминергического, так и гипердофаминергического состояния [17]. В связи с этим развитию болевого синдрома могут способствовать осложнения длительной терапии леводопой, включая как моторные и немоторные флюктуации, так и дискинезии [21]. Все это предопределяет гетерогенность болевых синдромов при БП. Ряд болезненных ощущений может быть связан с развивающимися при этом заболевании моторными осложнениями, такими как мышечная дистония, дискинезии и др. При этом нужно иметь в виду, что характерный для БП церебральный дофаминергический дефицит изменяет состояние ноцицептивной системы, приводя к снижению порога боли. Все это делает актуальным комплексный клинический анализ хронических болевых синдромов у больных БП, их взаимосвязь с заболеванием и их реакции на дофаминергическую терапию [2, 6, 7]. Особенностью болевых синдромов при БП, с которой соглашаются все исследователи, является высокая частота встречаемости хронической боли различной локализации. Было показано, что возникновение болевых синдромов может опережать развитие других симптомов БП.
Пациенты с БП часто предъявляют жалобы на сжимающие и тянущие ощущения в шее, спине, ногах, жгучие, покалывающие ощущения в различных областях тела, в том числе в полости рта и в области гениталий. Часто пациенты описывают боль как тупую, грызущую и обжигающую. Примерно в 1/3 случаев выявляется связь интенсивности сенсорных ощущений с флюктуациями моторного симптомокомплекса и уменьшением дозы леводопы. Одной из наиболее частых зон локализации боли является область плечевого сустава. Эта боль описывается пациентами как постоянная, плохо локализованная, сжимающая или спазмирующая, иногда жгучая. Обычно после назначения или коррекции дофаминергической терапии происходит уменьшение ощущения дискомфорта и боли в области плечевого сустава. Также часто при БП выявляется боль в пояснице. Ее интенсивность и частота не связаны с длительностью и выраженностью заболевания. В литературных источниках, посвященных этой проблеме, описаны возможные механизмы возникновения боли при БП:
1) первичным является увеличение периферической афферентации, происходящее за счет наличия разнообразных двигательных нарушений, приводящих к изменению взаимоотношения состояния мышц агонистов и антагонистов; это нарушение меняет привычную биомеханику движения, обусловливая микротравматизацию мышц, связочного аппарата, суставных капсул, вызывая в них асептическое воспаление, которое приводит к активации периферических ноцицепторов;
2) в качестве возможной причины возникновения боли при БП обсуждаются нейромедиаторные нарушения, сопровождающие различные стадии этой болезни, которые приводят к снижению болевого порога, при этом имеющиеся двигательные нарушения усиливают афферентный ноцицептивный поток, в результате которого появляется боль;
3) предполагается, что скелетно-мышечные болевые синдромы возникают из-за нарушения нормальной физиологической биомеханики двигательного акта вследствие постуральных и других двигательных нарушений, а также изменений мышечного тонуса, для них характерны ноющие, ломящие боли, судороги; наличие гипокинезии приводит к изменению привычного двигательного стереотипа, нарушению биомеханики движения на разных уровнях, ограничению функционирования защитных и компенсаторных движений; предпосылками к развитию периферической невропатической боли являются дегенеративные заболевания позвоночника; примечательно, что при этом их интенсивность часто снижается на фоне повышения дозы леводопы, однако полностью боли на фоне дофаминергической терапии не регрессируют;
4) точные клинические характеристики и механизмы развития так называемой центральной боли (жгучая боль, сопровождающаяся ощущением покалывания и пощипывания, ползания мурашек) при БП остаются неясными; в основе формирования центрального болевого синдрома при БП предположительно лежит нарушение баланса между ноцицептивной и антиноцицептивной системами, заключающееся в снижении активности последней на фоне нейромедиаторных нарушений при сохранном восходящем ноцицептивном потоке;
5) в формировании болевых синдромов при БП не исключена определенная роль изменения центральных дофаминергических механизмов, принимающих участие в обработке болевой информации.
Целью данной работы явилось изучение влияния препарата Глиатилин (холина альфосцерат) на регресс боли и улучшение когнитивно-мнестического потенциала при БП у пациентов разного возраста и стажа заболевания с учетом применения комплексной терапии.
Материалы и методы исследования
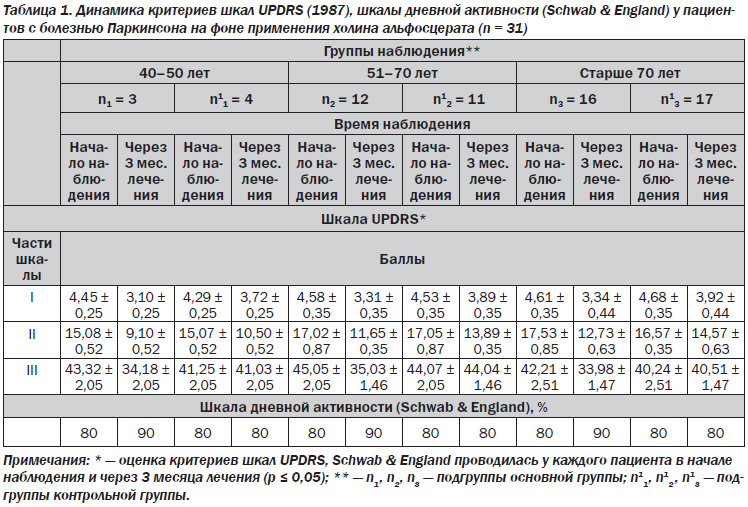
Всем пациентам основной группы (n = 31) до назначения Глиатилина и спустя 3 месяца мы проводили клинико-неврологическое и нейропсихологическое исследование, мониторинг артериального давления, ЭЭГ, МРТ головного мозга. Для обработки полученных результатов применялись расчетные и табличные критерии Фишера — Снедекора для 12 степеней свободы выборок у данных больных, а также интеграл вероятности (функция Лапласа). Моделирование велось в Microsoft Excel с использованием встроенной таблицы квазислучайных чисел.
Результаты и их обсуждение
В 2013 г. из когорты больных, ранее взятых на учет в региональном кабинете (среди 154 пациентов с БП в возрасте от 34 до 80 лет акинетико-ригидный синдром преобладал в 69 % случаев, дрожательно-ригидный — в 31 %, феномен on-off — в 26 %, тремор, резистентный к леводопе, — в 24 %, снижение дневной активности — в 53 %, 94 % пациентов жаловались на тянущую, ноющую боль в верхней половине спины, руках), мы отобрали 31 пациента с БП (основная группа) с жалобой на боль в теле, конечностях для дообследования и уточнения степени функциональных нарушений. При анализе проведенных ЭЭГ в 63 % регистрировалась низкоамплитудная ЭЭГ с дисфункцией стволовых структур. При МРТ головного мозга у 57 % пациентов визуализировалась умеренная внутренняя гидроцефалия, у 73 % больных отмечена субтрофия коры полушарий головного мозга и мозжечка. При оценке неврологического статуса у этих больных мы пользовались клиническими диагностическими критериями Банка мозга Общества болезни Паркинсона Великобритании (1992), критериями шкалы UPDRS (1987), модифицированной шкалой оценки стадии заболевания по Hoehn & Yahr, шкалой MMSE, шкалой дневной активности (Schwab & England). Первая стадия болезни была выявлена у 3 пациентов, вторая — у 12, третья — у 16 пациентов. В нашей работе мы использовали следующие критерии включения: стадию болезни, жалобы на боль (симптом, обусловленный изменением мышечного тонуса — ригидность, дистония; моторные флюктуации и дискинезии; боль центрального типа — локальная акатизия), умеренные когнитивные нарушения, понимание пациентом и его родственниками необходимости медикаментозной коррекции. В ходе нашей работы были проанализированы симптомы цервикоторакалгии, люмбалгии и боли в конечностях у включенных в исследование пациентов с ригидной, тремор-доминантной и ригидно-дрожательной формами БП (ВАШ, шкала Ликерта, NADCS (дельта составила 0,55–1,95 и 0,75–1,05 балла), метод описательных определений боли). В когорту исследуемых пациентов с БП мы не включили больных с разным преморбидным фоном (боль, не исключающая вертеброгенный, дискогенный и миофасциальный генез, дегенерацию суставов конечностей).
Акцент терапии был сделан на применении Глиатилина у пациентов, получавших рутинную схему терапии (леводопа и агонисты дофаминовых рецепторов). Глиатилин, как пресинаптический холинергический препарат, восстанавливает нейрональные связи, оптимизирует нейротрансмиссию (высвобождение холина в головном мозге и увеличение биосинтеза ацетилхолина, что улучшает информационный обмен между нейронами), не связывается с рецепторами ацетилхолина и не влияет на холинэстеразу, нормализует функцию и структуру нейронов, репарацию нейрональных мембран (глицерофосфат улучшает синтез фосфатидилхолина, что ведет к восстановлению пластичности нейрональной мембраны, оптимизации функции рецепторного аппарата), обладает вторичной дофаминергической активностью. Пациенты, получавшие Глиатилин, были в основной группе наблюдения, контрольную группу составили больные, которым проводилась стандартная терапия. Анализ рекомендованной терапии и оценка динамики критериев шкал UPDRS (1987), шкалы дневной активности (Schwab & England) проводились нами с момента начала наблюдения за конкретным пациентом и через три месяца лечения.
Положительный эффект терапии с применением Глиатилина у пациентов с болезнью Паркинсона основной группы наблюдения (табл. 1) проявлялся в виде улучшения процессов мышления, поведения, настроения (первая часть UPDRS), повышения повседневной жизненной активности (вторая часть UPDRS), улучшения показателей дневной активности (шкала Schwab & England); показатели двигательной активности (третья часть UPDRS) изменились в меньшей степени.
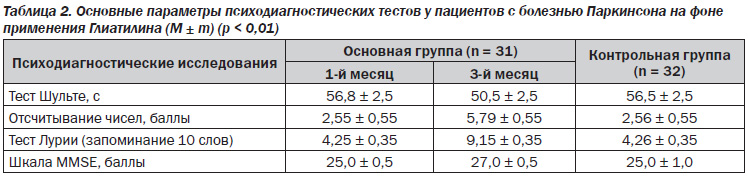
Следует указать, что практически 75 % пациентов основной группы отметили уменьшение интенсивности боли. При проведении психодиагностических тестов нами выявлено достоверное различие между результатами исследования пациентов основной и контрольной группы (р < 0,01) (табл. 2).
При проведении теста Шульте мы оценивали время выполнения задания и количество допущенных ошибок. Поиск чисел у пациентов основной группы до начала приема холина альфосцерата занимал большее время, чем спустя 3 месяца. Тест отсчитывания чисел позволил обнаружить у обследуемых основной группы в начале исследования умеренное снижение концентрации внимания, быструю утомляемость, замедление умственной деятельности. В ходе выполнения теста по методике Лурии у пациентов основной группы до назначения Глиатилина выявлено уменьшение продуктивности запоминания. Оценка шкалы MMSE у пациентов основной и контрольной группы в первые дни исследования свидетельствует о когнитивной дисфункции. Через 3 месяца от начала приема холина альфосцерата когнитивные функции пациентов значительно улучшились: при проведении теста Шульте поиск чисел стал занимать меньшее время, тест отсчитывания чисел выявил увеличение концентрации внимания, тест по методики Лурии выявил увеличение продуктивности запоминания, баллы по шкале ММSE — 27,0 ± 0,5 (p < 0,01).
Вывод
Одно из значимых мест в структуре немоторных симптомов БП занимает болевой синдром (боль как предиктор; симптом, усугубляющийся при прогрессировании болезни; сопутствующий симптом при соматической патологии), который приводит к снижению качества жизни пациентов, отличается сложностью патогенетических механизмов и трудностью в лечении. С учетом того, что клиническими маркерами нейропротекции при БП являются двигательные нарушения, скорость прогрессирования симптомов, эффективность лечения, степень нарушения качества жизни в целом [19, 24], нейромедиаторные свойства Глиатилина, избирательно предотвращающие свободнорадикальные процессы и улучшающие межнейрональную передачу в головном мозге, позволяют рекомендовать холина альфосцерат в комплексной терапии пациентов с болезнью Паркинсона. В ходе нашей работы мы отметили регресс болевого синдрома у обследуемых пациентов с БП, что позволило положительно влиять на их социальную адаптацию и жизненную активность. Назначение Глиатилина пациентам с БП обеспечивало увеличение дневной активности и когнитивного потенциала, снижение чувства зависимости от окружающих, улучшение социальной адаптации и качества жизни. Синергизм знаний и действий невролога, доверия и желания позитива у пациента ведут к улучшению качества жизни человека, живущего с болезнью Паркинсона. Лечить пациента — это высокая профессия, а лечить человека с болезнью Паркинсона — это терпение, сострадание, интуиция, поиск выхода из тупика, искусство доктора.
1. Бархатова В.П. Нейротрансмиттеры и экстрапирамидная патология. — М.: Медицина, 1988. — 175 с.
2. Вейн А.М. Болевые синдромы в неврологической практике / А.М. Вейн, Т.Г. Вознесенская, А.Б. Данилов. — М., 1999. — С. 372 .
3. Голубев В.Л. Особенности клинического течения и фармакотерапии болезни Паркинсона на разных этапах развития заболевания / В.Л. Голубев, Я.И. Левин, А.М. Вейн // Международный медицинский журнал. — 2005. — Т. 11, № 4. — С. 47-51.
4. Карабань Н.В. Комплексная патогенетическая терапия болезни Паркинсона (клинические, диагностические, медико-социальные аспекты): Автореф. дис… д-ра мед. наук. — К., 2007. — 33 с.
5. Крыжановский Г.Н. Болезнь Паркинсона (этиология, патогенез, клиника, диагностика, лечение, профилактика) / Г.Н. Крыжановский, И.Н. Карабань, С.В. Магаева, В.Г. Кучеряну, Н.В. Карабань. — М.: Медицина, 2002. — 335 с.
6. Крыжановский Г.Н. Общая патофизиология нервной системы. — М.: Медицина, 1997. — 352 с.
7. Махнев С.О. Болевые синдромы при болезни Паркинсона: Автореф. дис... канд. мед. наук. — М., 2011. — 32 с.
8. Шток В.Н. Экстрапирамидные расстройства: Руководство по диагностике и лечению / В.Н. Шток, И.А. Иванова-Смоленская, О.С. Левин. — М.: Медпресс, 2002. — 600 с.
9. Arundinc М. Molecular mechanisms of calcium-dependent neurodegeneration in excitotoxicity / М. Arundinc, М. Tymianski // Cell. Calcium. — 2003. — 34. — 325-337.
10. Braak H. Staging of brain pathology related to sporadic Parkinson’s disease / H. Braak, К. Del Tredici, V. Rub // Lancet Neurology. — 2008. — Р. 223-233.
11. Croisier Е. Microglial inflammation in the parkinsonian substantia nigra; relationship to a-synuclein deposition / E. Croisier, L.B. Moran, D.T. Dexter // J. Neuroinflamm. — 2005. — Vol. 2. — P. 14-21.
12. De Lau L.M. Epidemiology of Parkinson’s disease / L.M. De Lau, M.M. Breteler // Lancet Neurol. — 2006. — 5. — P. 525-535.
13. Hartmann A. Pathophysiology of Parkinson’s disease // Parkinson Disorders in Clinical Practice / A. Hartmann, A. Schapira, Y. Agid. —Blackwell Publishing Ltd. — 2009. — P. 1-10.
14. Jenner P. Oxidative stress in Parkinson’s disease / P. Jenner // Ann. Neurol. — 2003. — Vol. 53, Suppl. 3. — P. S26-S36.
15. Jellinger K.A. Lewy body-related alpha-synudeinopathy in the aged human brain / К.А. Jellinger // J. Neurоl. — 2004. — Vol. 111. — P. 1219-1235.
16. Koutsilieri Е. Free radicals in Parkinson’s disease / E. Koutsilieri, C. Scheller, E. Grunblatt // J. Neurol. — 2002. — Vol. 249, Suppl. 2. — P. S1-S5.
17. Langston J.W. The Parkinson’s complex: parkinsonism is just the tip of the iceberg / J.W. Langston // Ann. Neurol. — 2006. — 59. — P. 591-596.
18. Olanow C. An algorithm for the management of Parkinson’s disease (2001): treatment guidelines / C. Olanow, R. Watts, W. Roller // Neurology. — 2001. — V. 56, Suppl. 5. — P. S1-S88.
19. Olanow C.W. Neuroprotection for Parkinson’s disease: prospects and promises / C.W. Olanow, A.H. Schapira, Y. Agid // Ann. Neurol. — 2003. — Vol. 53, Suppl. 3. — P. S1-S2.
20. Olanow C.W. Pathogenesis of cell death in Parkinson’s disease / C.W. Olanow // Mov. Disord. — 2007. — Vol. 22, Suppl.8. — P. S335-S342.
21. Olanow C.W. The Scientific and Clinical Basis for the Treatment of Parkinson’s Disease / C.W. Olanow, M.B. Stem, M.K. Sethi // Neurology. —2009. — Vol. 72, Suppl. 4. — P. S1-S136.
22. Schutz J.B. Glutatione, oxidative stress and neurodegeneration / J.B. Schutz, J. Lindenau, J. Seyfried, J. Dichgans // Eur. J. Biochem. — 2000. — Vol. 267. — P. 4904-4911.
23. Schutz J.B. Neurodegeneration / J.B. Schutz, J. Lindenau // Eur. J. Biochem. — 2001. — Vol. 269. — P. 3902-3910.
24. Schapira A. Neuroprotection in Parkinson’s disease: myths, mysteries and misconceptions / A. Schapira, C.W. Olanow // JAMA. — 2004. — Vol. 29. — P. 358-364.
25. Walter B.L., Vitek J.L. Surgical treatment for Parkinson’s disease / B.L. Walter, J.L. Vitek // Lancet Neurol. — 2004. — Vol. 3. — P. 719-728.