Газета «Новости медицины и фармации» Неврология (497) 2014 (тематический номер)
Вернуться к номеру
Епілепсії
Разделы: Официальная информация
Версия для печати
Статья опубликована на с. 31-66
Адаптована клінічна настанова,
заснована на доказах
2013
Робоча група з адаптації клінічної настанови
Хобзей Микола Кузьмич — Директор Департаменту реформ та розвитку медичної допомоги, Міністерства охорони здоров’я України, д.мед.н., професор (голова)
Міщенко Тамара Сергіївна — Завідувач відділення судинної патології головного мозку Інституту клінічної та експериментальної неврології і психіатрії НАМН України, д.мед.н., професор (заступник голови з клінічних питань), головний позаштатний спеціаліст МОЗ України зі спеціальності «Неврологія» (за згодою);
Морозов Анатолій Миколайович — Заступник генерального директора ДП «Державний експертний центр МОЗ України» (до 01.09.13), д.мед.н., професор (заступник голови координації діяльності мультидисциплінарної робочої групи)
Степаненко Алла Василівна — Консультант ДП «Державний експертний центр МОЗ України», професор кафедри Української військово-медичної академії МЗС України, д.мед.н., професор (заступник голови з методології)
Горачук Вікторія Валентинівна — Доцент кафедри управління охорони здоров’я Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.
Горанський Юрій Іванович — Доцент кафедри неврології та нейрохірургії Одеського державного медичного університету, д.мед.н.
Дубенко Андрій Євгенович — Провідний науковий співробітник Державної установи «Інститут неврології, психіатрії та наркології НАМН України», д.мед.н., професор (за згодою)
Євтушенко Станіслав Костянтинович — Завідувач кафедри дитячої та дорослої неврології Донецького національ–ного медичного університету імені М. Горького, д.мед.н., професор
Коростій Володимир Іванович — Професор кафедри психіатрії, наркології та медичної психології Харківського національного медичного університету, д.мед.н., професор
Літовченко Тетяна Анатоліївна — Завідувач кафедри невропатології Харківської медичної академії післядипломної освіти, д.мед.н., професор
Мартинюк Володимир Юрійович — Директор Державної установи «Український медичний центр реабілітації дітей з органічним ураженням нервової системи», к.м.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «Дитяча неврологія»
Марута Наталія Олександрівна — Заступник директора з наукової роботи Державної установи «Інститут неврології, психіатрії та наркології НАМН України», д.мед.н. професор (за згодою)
Марцинковський Ігор Анатолійович — Керівник сектора медико-соціальної реабілітації дітей та підлітків з психічними та поведінковими розладами Державної установи «Український науково-дослідний інститут соціальної і судової психіатрії та наркології» МОЗ України, д.мед.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «Дитяча психіатрія»
Мар’єнко Лідія Борисівна — Доцент кафедри неврології Львівського національного медичного університету імені Данила Галицького, керівник Львівського обласного протиепілептичного центру, к.м.н.
Мостовенко Раїса Василівна — Завідувач дитячого інфекційного відділення Національної дитячої спеціалізованої лікарні «ОХМАТДИТ», головний позаштатний спеціаліст МОЗ України зі спеціальності «Педіатрія»
Пінчук Ірина Яківна — Головний позаштатний спеціаліст МОЗ України зі спеціальності «Психіатрія», директор Українського науково-дослідного інституту соціальної і судової психіатрії та наркології МОЗ України
Танцура Людмила Миколаївна — Керівник відділу дитячої психоневрології і клінічної нейрогенетики Державної установи «Інститут неврології, психіатрії і наркології Національної академії медичних наук України» (за згодою)
Харчук Сергій Михайлович -—Керівник лікувально-діагностичного центру «Епілепсія» м. Київ, Президент Української протиепілептичної ліги, к.м.н. (за згодою)
Чабан Олег Созонтович — Завідувач відділу пограничних станів та соматичних розладів Українського науково-дослідного інституту соціальної і судової психіатрії та наркології МОЗ України, д.мед.н., професор
Юр’єва Людмила Миколаївна — Завідувач кафедри психіатрії факультету післядипломної освіти Дніпропетровської державної медичної академії МОЗ України, д.мед.н., професор
Малюга Валентина Дмитрівна — Сімейний лікар Калинівської амбулаторії загальної практики — сімейної медицини Васильківського району Київської області
Імерелі Руслан Едуардович — Голова Всеукраїнської громадської організації інвалідів — користувачів психіатричної допомоги «Юзер» (за згодою)
Костюк Костянтин Романович — Завідувач відділення функціональної нейрохірургії ДУ «Інститут нейрохірургії імені акад. А.П. Ромоданова АМН України», к.мед.н., віце-президент Української протиепілептичної ліги
Смоланка Володимир Іванович — Директор обласного клінічного центру нейрохірургії та неврології, Завідувач кафедри неврології, нейрохірургії та психіатрії Ужгородського національного університету, член правління Української асоціації нейрохірургів, голова Закарпатського центру Української асоціації нейрохірургів, д.мед.н., професор
Методичний супровід та інформаційне забезпечення
Ліщишина О.М. — Директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України», к.мед.н.
Горох Є.Л. — Начальник Відділу якості медичної допомоги та інформаційних технологій Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», к.т.н.
Мельник Є.О. — Начальник Відділу доказової медицини Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»
Шилкіна О.О. — Начальник Відділу методичного забезпечення новітніх технологій у сфері охорони здоров’я Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»
Державний експертний центр МОЗ України є членом
Guidelines International Network (Міжнародна мережа настанов)
ADAPTE (Франція)
(Міжнародний проект з адаптації клінічних настанов)
Синтез настанови
За прототип Адаптованої клінічної настанови «Епілепсія» взято Клінічну настанову «NICE CG 137 — The Epilepsies: The diagnosis and management of the epilepsies in adults and children in primary and secondary care» (Епілепсії: діагностика та лікування епілепсій у дорослих та дітей при наданні первинної та вторинної медичної допомоги) 2012
Додаткові докази включені з інших джерел:
1. Epilepsia. 2010 Jun; 51(6): 1069–77. Epub 2009 Nov 3. Definition of drug resistant epilepsy: consensus proposal by the adhoc Task Force of the ILAE Commission on Therapeutic Strategies. Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, Perucca E, Wiebe S, French J. Source.
Передмова робочої групи з адаптації клінічної настанови за темою «Епілепсія»
В останні десятиріччя у всьому світі для забезпечення якості і ефективності медичної допомоги, для створення якісних клінічних протоколів (Clinical Pathway) та/або медичних стандартів (МС) як третинне джерело доказової медицини використовуються клінічні настанови (КН).
Клінічна настанова (Clinical practice guidelines) — це документ, що містить систематизовані положення стосовно медичної та медико-соціальної допомоги, розроблені з використанням методології доказової медицини на основі підтвердження їх надійності та доведеності, і має на меті надання допомоги лікарю і пацієнту в прийнятті раціонального рішення в різних клінічних ситуаціях.
Відповідно до положень наказу МОЗ України від 28.09.2012 р. № 751 «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрованого в Міністерстві юстиції України 29.11.2012 р. за № 2001/22313, створення КН в Україні здійснюється шляхом адаптації вже існуючих клінічних настанов, які розроблені на засадах доказової медицини у відомих світових центрах — NICE (Англія), SIGN (Шотландія), AHRQ (США), HEN WHO (ВООЗ), NZGG (Нова Зеландія) та ін. Клінічні настанови, що розроблені на науковій основі, мають основні ознаки, що відповідають назві, визначенню та змісту клінічних настанов, а саме:
— наявність переліку членів мультидисциплінарної робочої групи;
— наявність зовнішніх рецензентів;
— визначення дати перегляду клінічної настанови;
— наявність шкали рівнів доказів у клінічній настанові;
— список першоджерел літератури (статті за результатами рандомізованих клінічних досліджень, метааналізи, огляди літератури) тощо.
Адаптована клінічна настанова за темою «Епілепсія» створена мультидисциплінарною робочою групою МОЗ України на основі оригінальної Клінічної настанови NICE 137 «The Epilepsies: The diagnosis and management of the epilepsies in adults and children in primary and secondary care», 2012 року, яка була попередньо оцінена групою експертів за допомогою опитувальника AGREE. Результати оцінки задокументовані і зберігаються у робочих матеріалах групи. Механізм адаптації передбачає внесення в оригінальний текст настанови, який залишається незмінним, Коментарів робочої групи, у яких відбивається можливість виконання тих чи інших положень КН в реальних умовах нашої національної системи охорони здоров’я, доступність медичних втручань, наявність зареєстрованих в Україні ліків, що зазначені у КН, відповідність нормативної бази щодо організаційних засад надання медичної допомоги тощо.
Запропонована адаптована клінічна настанова не повинна розцінюватись як стандарт медичного лікування. Дотримання положень КН не гарантує успішного лікування в кожному конкретному випадку, її не можна розглядати як посібник, що включає всі необхідні методи лікування або, навпаки, виключає інші. Остаточне рішення стосовно вибору конкретної клінічної процедури або плану лікування повинен приймати лікар з урахуванням клінічного стану пацієнта та можливостей для проведення заходів діагностики і лікування у медичному закладі. Адаптована клінічна настанова «Епілепсія», відповідно до свого визначення, має на меті надання допомоги лікарю і пацієнту в прийнятті раціонального рішення в різних клінічних ситуаціях, слугує інформаційною підтримкою щодо найкращої клінічної практики на основі доказів ефективності застосування певних медичних технологій, ліків та організаційних засад медичної допомоги.
Клінічна настанова — це рекомендаційний документ з найкращої медичної практики, заснованої на доказах ефективності, в першу чергу для практикуючих лікарів, які надають як первинну, так і вторинну медичну допомогу.
На основі Адаптованої клінічної настанови «Епілепсія» робоча група розробила Уніфікований клінічний протокол медичної допомоги «Епілепсія», у якому використані доказові положення Адаптованої клінічної настанови щодо ефективності медичних втручань, які також слугували основою для визначення індикаторів якості надання медичної допомоги пацієнтам з депресивними розладами.
Представлена адаптована клінічна настанова має бути переглянута не пізніше 2016 р. мультидисциплінарною робочою групою за участю головного позаштатного спеціаліста МОЗ України, практикуючих лікарів, які надають первинну і вторинну медичну допомогу, науковців, організаторів охорони здоров’я, представників громадських організацій, що зацікавлені у підвищенні якості медичної допомоги та ін.
Адаптація системи обґрунтованості доказів, які використовуються
Кожен із відібраних для адаптації КН прототипів використовує власну систему градації первинних даних та оцінки рекомендацій. Втім, різні системи градації рекомендацій хоча і різняться, зокрема, за номенклатурою (абеткова чи числова) та деякими нюансами, але дуже схожі за сутністю визначень. Тому, щоб уникнути непорозумінь та протиріч в характеристиках обґрунтованості рекомендацій в клінічних настановах «Епілепсії: діагностика та лікування епілепсій у дорослих та дітей при наданні первинної та вторинної медичної допомоги» — Клінічна настанова NICE 137, розробники дійшли до згоди щодо використання єдиного підходу до класифікації рівнів обґрунтованості. На наш погляд, така градація є найбільш зрозумілою та практичною.
Потреба в настанові
Епілепсія (Е), як одне з найбільш розповсюджених неврологічних захворювань, є значною медичною і соціальною проблемою. Розповсюдженість Е в світі складає від 5 до 8 на 1000 населення, причому в країнах, що розвиваються, ця цифра вдвічі більша. В Європі на Е страждає 6 млн осіб, з них 40 % не отримує належного лікування, а в країнах з низьким рівнем життя відсоток таких пацієнтів складає 75 %. Європейська комісія Міжнародної протиепілептичної ліги (МПЕЛ) відмітила, що діапазон і характер проблем, пов’язаних з Е, є подібним в усіх європейських країнах, незважаючи на їх економічні, соціальні та інші особливості. Це недостатній розвиток системи адекватної допомоги хворим, в тому числі хірургічного лікування, стигматизація і соціальні проблеми, дорожнеча протиепілептичних препаратів (особливо нових), труднощі фінансування, недостатня кількість фахівців і спеціалізованої допомоги, дефіцит знань щодо Е в суспільстві, недостатня інформація щодо поширеності захворювання.
Компетенції даної клінічної настанови
Коментар робочої групи
Загальні цілі
1. Головною метою цієї настанови є надання допомоги організаторам охорони здоров’я, лікарям сімейної медицини, лікарям неврологам та психіатрам поліклінічної і стаціонарної ланки для оптимізації надання медичної допомоги, пацієнтам з епілепсією. Акцент робиться на організації надання медичної допомоги, діагностиці та сучасних методах лікування, в тому числі хірургічного, ранній вторинній профілактиці.
2. Також розробники КН вважають, що використання доказової бази, яка лежить в основі даної настанови, зменшить необґрунтовану варіабельність клінічної практики при наданні медичної допомоги пацієнтам з епілепсією, особливо призначення першої монотерапії після встановлення діагнозу.
3. Збільшить доступ широкого загалу медичних працівників та інших осіб, що залучені в процес надання медичної допомоги пацієнтам з епілепсією, до сучасної наукової інформації високої якості доказовості.
4. Прискорить втілення в практичну роботи наукових досягнень в питаннях впровадження сучасної протиепілептичної допомоги в Україні.
5. Підвищить якість надання медичної допомоги пацієнтам з епілепсією та дозволить раціонально використовувати ресурси системи охорони здоров’я.
Вступ
Ця настанова Національного інституту здоров’я та досконалості медичної допомоги (NICE) оновлює та замінює клінічну настанову NICE 20. Ця настанова також надає нові дані та оновлює оцінку технології NICE 76 (2004 р.) і оцінку технології NICE 79 (2004 р.).
Нові рекомендації були додані до фармакологічного лікування осіб з епілепсією, включаючи використання кетогенної дієти (для отримання детальної інформації див. про цю настанову NICE).
Епілепсія представляє собою поширений неврологічний розлад, що характеризується нападами, які повторюються. Різні типи епілепсії обумовлені різними причинами. Важко надати точну оцінку захворюваності та поширеності, тому що ідентифікація людей, які можуть страждати від епілепсії, ускладнена. Вважається, що в Англії на епілепсію хворіють від 362 000 до 415 000 осіб. Крім того, у 5–30 %, що дорівнює 124 500 особам, встановлений діагноз епілепсії є помилковим. Захворюваність оцінюється в 50 випадків на 100 000 населення на рік, а поширеність активної форми епілепсії в Об’єднаному Королівстві складатиме 5–10 випадків на 1000. Дві третини хворих з активною формою епілепсії контролюють свій стан задовільним чином за допомогою протиепілептичних препаратів (ПЕП). Інші підходи можуть включати хірургічні операції. Оптимальне лікування покращує загальний стан здоров’я, а також може допомогти мінімізувати інші, часто пагубні, наслідки для соціальної, освітньої та професійної діяльності. Клінічні протоколи NICE 20 — «Епілепсії» стверджують, що щорічна очікувана величина витрат на лікування встановлених епілепсій становила £2 мільярди (прямі та непрямі витрати).
Зараз виписують сучасніші та більш дорогі ПЕП, отже, за умови ймовірного зростання витрат на лікування у найближчі роки дуже важливо визначити ПЕП з доведеною клінічною та економічною ефективністю. Докази, що використовувались для розробки клінічних настанов («Епілепсії» — клінічна настанова NICE 20; «Сучасніші препарати для лікування епілепсії у дорослих» оцінка технології NICE, протокол 76; й «Сучасніші препарати для лікування епілепсії у дітей» оцінка технології NICE, протокол 79) продемонстрували відсутність різниці в ефективності між сучаснішими та попередніми ПЕП або між сучаснішими препаратами (у якості монотерапії) для контролю нападів. Однак велике багатоцентрове випробування (випробування SANAD, 2008 р.), яке оцінювало сучасніші препарати в лікуванні вперше виявленої епілепсії (приймаючи деякі обмеження), висунуло припущення, що натрію вальпроат має стати препаратом вибору при генералізованих та некласифікованих епілепсіях, а ламотриджин — при фокальних епілепсіях. Отже, було прийнято рішення про необхідність розгляду нових доказів стосовно ПЕП в межах оновлення клінічних протоколів NICE 20 (опубліковано в 2004 р.).
Протоколи NICE припускають, що лікарі будуть застосовувати коротку характеристику препарату для інформування про рішення щодо конкретних пацієнтів.
Протоколи NICE рекомендують призначення деяких ПЕП, що не мають реєстраційного посвідчення в Об’єднаному Королівстві на момент публікації, у разі якщо наявні достатні докази, що обґрунтовують їх застосування.
Коментар робочої групи
Епілепсія займає 3-тє місце за розповсюдженістю серед хвороб нервової системи. Смертність при епілепсії в 2–3 рази перевищує таку у популяції, що пов’язанo значною мірою з етіологією захворювання (цереброваскулярні хвороби і пухлини мозку), нещасними випадками під час нападів (травми, утоплення та ін.), а також з випадками так званої SUDEP (sudden unexpected death in epilepsy) — раптової неочікуваної смерті при епілепсії.
В Україні, за останніми даними [2], налічується близько 100 000 хворих на епілепсію, але ця цифра з врахуванням середньостатистичного світового показника поширеності захворювання, швидше всього, занижена. У зв’язку з наданням допомоги хворим на епілепсію неврологами та психіатрами і, відповідно, завдяки подвійному кодуванню і реєстрації клінічної і експертної епідеміології статистичні дані принципово некоректні і потребують нового регламентування [1]. Вже більше 15 років триває всесвітня кампанія Міжнародної протиепілептичної ліги «Епілепсія — з тіні» (Epilepsy out of shadows), яка має на меті привернути увагу до проблем хворих на епілепсію політичних діячів, законодавців, органів охорони здоров’я, медичних і немедичних організацій всіх країн та вивести хворих на епілепсію з «тіні» соціальної стигматизації, а саме захворювання — з «тіні» на «світло» одного з пріоритетних напрямків в системі охорони здоров’я. Протокол, прийнятий в Україні, стане ще одним свідченням участі медичної спільноти нашої держави в цій кампанії і допоможе фахівцям як первинної, так і наступних ланок медичної допомоги забезпечити правильну діагностику та лікування епілепсії, а в подальшому і адекватну статистичну звітність.
Підхід до лікування хворих на епілепсію повинен мати мультидисциплінарний характер. Фахівці, які опікуються таким контингентом хворих, повинні включати неврологів, психіатрів, нейрохірургів, психологів, нейрофізіологів, нейрорадіологів, соціальних працівників, середній медичний персонал.
Переконливі результати нещодавно виконаних високоякісних досліджень дозволили сформулювати в світовій епілептології головні стратегічні напрямки, що будуть впливати на захворюваність, смертність та результати лікування і реабілітації у пацієнтів з епілепсією.
Публікації стандартів та клінічних рекомендацій останніх років, які мають високі рівні доказовості, стали передумовою написання представлених клінічних настанов (КН).
Персоніфіковане лікування
Дані протоколи NICE пропонують поради на підставі найбільш ефективних методів лікування дітей та дорослих різних вікових груп.
Застосовані методи обстеження, лікування та спостереження мають брати до уваги потреби та соціальні особливості пацієнтів. Люди, хворі на епілепсію, повинні мати можливість приймати рішення на підставі всієї наявної інформації щодо їхнього обстеження, лікування та спостереження за участю спеціалістів охорони здоров’я. Якщо людина не в змозі самостійно прийняти рішення, спеціалісти охорони здоров’я мають дотримуватись Порад департаменту охорони здоров’я щодо отримання згоди та зведених правил, що супроводжують закон про дієздатність.
Якщо особі ще не виповнилось 16 років, спеціалісти охорони здоров’я мають дотримуватись вказівок «Отримання згоди: робота с дітьми». Добре налагоджений зв’язок між спеціалістами охорони здоров’я, людьми, хворими на епілепсію (та їхніми сім’ями та особами, що здійснюють догляд за хворим), є обов’язковим. Він має спиратись на доказово обґрунтовану письмову інформацію відповідно до потреб конкретної людини. Лікування та догляд, а також інформація, яку люди отримують стосовно епілепсії, мають бути культурально прийнятними. Вони мають бути доступні людям з додатковими потребами, наприклад з обмеженими фізичними та сенсорними можливостями або нездатністю до навчання, а також людям, які не говорять або не читають англійською.
Якщо особа дає згоду, сім’я та особи, що здійснюють догляд за хворим, повинні мати можливість брати участь у прийнятті рішень щодо лікування. Сім’ям та особам, що здійснюють догляд за хворим, також слід надати повну інформацію, а також підтримку, яка їм необхідна. Догляд за підлітками, які переходять від дитячої до дорослої медичної служби, має плануватись та здійснюватись відповідно до методичних рекомендацій, описаних в рекомендаціях «Перехід лікування: як зробити це правильно для молодих людей». Дорослі та дитячі підрозділи закладів охорони здоров’я мають працювати разом з метою оцінки стану та надання допомоги молодим людям, хворим на епілепсію. Під час здійснення переходу слід переглянути діагностику та лікування й чітко встановити, хто буде провідним фахівцем, з метою забезпечення безперервності лікування.
Настанова NICE визначає у якості першочергових завдань наступні завдання для реалізації
Діагностика
Всі діти, підлітки та дорослі з підозрюваним нападом, що трапився нещодавно, мають бути терміново оглянуті спеціалістом. Це необхідно для забезпечення точної та ранньої діагностики і початку терапії відповідно до потреб клінічної ситуації.
Коментар робочої групи
Початок лікування пацієнтів з епілепсією можливий лише у випадках, коли є впевненість в тому, що напади є епілептичними.
Наявність у пацієнта двох і більше епілептичних нападів вимагає початку лікування протиепілептичними препаратами. Лікування пацієнтів з епілепсією починають з монотерапії препаратом першої лінії вибору, ефективність якого оцінюють протягом періоду не менше 3 місяців після досягнення терапевтичної дози препарату. Оцінка ефективності протягом меншого періоду часу не дозволяє визначити ефективність ПЕП, і призводить до частої їх зміни і розвитку вторинної фармакорезистентності.
При виборі ПЕП першої лінії необхідно пам’ятати про найбільш часті побічні ефекти, які можуть погіршити якість життя хворих більшою мірою, ніж наявність епілептичних нападів. Препарат обирається залежно від статі, віку та соціального функціонування пацієнта.
При ефективності першого призначення ПЕП його рекомендують вживати тривало в терапевтичних дозах протягом мінімум 2–3 років.
Тип нападу є одним з основних критеріїв вибору ПЕП у дорослих, оскільки встановити синдром епілепсії у них часто буває неможливим. ПЕП необхідно призначати в дозах не нижче терапевтичних з адекватною для кожного препарату кратністю прийому. Це дозволить підтримувати стабільну концентрацію препарату в плазмі крові і уникнути піків концентрації, під час яких можлива поява дозозалежних ефектів або падіння концентрації ПЕП, що призводить до різкого зниження їх ефективності та можливості декомпенсації епілепсії.
Ведення пацієнтів
Спеціалісти охорони здоров’я мають дотримуватись консультативного стилю взаємодії, який дозволяє дитині, підлітку або дорослому з епілепсією та їхнім сім’ям та/або особам, що здійснюють догляд за хворим, залежно від ситуації, брати участь в якості партнерів у прийнятті всіх рішень, що стосуються їх обстеження, лікування та спостереження та повною мірою враховувати особливості їхньої раси, культури, а також будь-які особливі потреби. Всі діти, підлітки та дорослі, хворі на епілепсію, повинні мати докладний план обстеження, лікування та спостереження, узгоджений між пацієнтом, його сім’єю та/або особою, що здійснює догляд за хворим, залежно від ситуації, та медичними працівниками різних рівнів надання медичної допомоги. Стратегію лікування із застосуванням ПЕП (протиепілептичного засобу) слід обирати індивідуально відповідно до типу припадків, епілептичного синдрому, форми епілепсії, супутніх ліків та супутніх захворювань, способу життя дитини, підлітка або дорослого та соціальної ситуації пацієнта, його сім’ї та/або особи, що здійснює догляд за хворим, залежно від ситуації.
Жінкам та дівчатам, хворим на епілепсію, та їхнім партнерам залежно від ситуації потрібно надавати точну інформацію і консультації стосовно контрацепції, запліднення, вагітності, догляду за дітьми, годування груддю та менопаузи.
Спостереження та диспансеризація
Всі діти, підлітки та дорослі, хворі на епілепсію, мають проходити регулярний спеціалізований огляд. Для дітей та підлітків цей огляд має проводитися щонайменше раз на рік за участі спеціаліста (але за необхідності діапазон терміну може варіювати між 3 та 12 місяцями). Для дорослих такий огляд має проводитися щонайменше раз на рік за участю як лікаря широкого профілю, так і спеціаліста залежно від того, як добре контролюється епілепсія, та/або при наявності змін способу життя, що можуть вплинути на перебіг захворювання.
Під час проведення огляду діти, підлітки та дорослі повинні мати доступ до: письмової та візуальної інформації; консультативних послуг; інформації про громадські організації, медичні центри, які спеціалізуються в галузі епілепсії; своєчасного і належного проведення досліджень; звернення за третинною медичною допомогою, включаючи за необхідності хірургічні процедури.
Якщо напади неконтрольовані та/або існує діагностична невизначеність або невдача лікування, діти, підлітки та дорослі мають найближчим часом звернутись за третинною допомогою для отримання додаткового обстеження та спеціалізованого лікування.
1. Рекомендації.
Наведені нижче рекомендації NICE базуються на найбільш достовірних доказах. В цих протоколах термін «дорослі» використовують для характеристики осіб віком від 18 років і більше, а «діти» — для осіб віком від 28 діб до 11 років. Термін «підлітки» стосується осіб віком від 12 до 17 років. Термін «люди похилого віку» використовують для характеристики осіб віком від 65 років і більше — цей віковий діапазон базується на доказах, розглянутих групою розробки Протоколів. Тим не менш, визнають, що існує мінливий віковий діапазон (15–19 років), в якому локальні управління охорони здоров’я та організації первинної допомоги переміщують надання лікування між дитячою та дорослою медичною службою.
1.1. Принцип прийняття рішення.
1.1.1. Спеціалісти охорони здоров’я мають дотримуватись консультативного стилю взаємодії, який дозволяє дитині, підлітку або дорослому з епілепсією та їхнім сім’ям та/або особі, що здійснює догляд за хворим, залежно від ситуації, брати участь в якості партнерів у прийнятті всіх рішень, що стосуються охорони їхнього здоров’я та повною мірою враховувати особливості їхньої раси, культури, а також будь-які особливі потреби.
1.2. Загальні положення ведення осіб з епілепсією.
1.2.1. Діти, молоді люди та дорослі, хворі на епілепсію, та їхні сім’ї та/або особи, що здійснюють догляд за хворим, повинні мати можливість якнайкраще слідкувати за своїм станом та контролювати його.
1.2.2. Дорослі мають отримувати належну інформацію та роз’яснення стосовно всіх аспектів епілепсії. Найкращим способом для цього є складання структурованих планів догляду за собою.
1.2.3. Для дітей та підлітків необхідного догляду за собою при епілепсії можна досягти за допомоги активних навчальних моделей та втручань, орієнтованих на дитину.
1.2.4. Спеціалісти охорони здоров’я повинні роз’яснити всі аспекти експертних програми підготовки пацієнтів (www.expertpatients.co.uk [5]) для дітей, підлітків та дорослих, хворих на епілепсію, які бажають більш ефективно управляти своїм станом.
1.3. Інформація.
1.3.1. Діти, підлітки та дорослі, хворі на епілепсію, та їхні сім’ї та/або особи, що здійснюють догляд за хворим, повинні, якщо це потрібно, мати доступ до джерел інформації про:
— епілепсію в цілому;
— діагностику та варіанти лікування;
— препарати та побічні ефекти;
— тип(и) нападів, тригери та контроль нападів;
— самообслуговування;
— управління ризиками;
— першу допомогу, безпеку і профілактику травм вдома та у школі або на роботі;
— психологічні аспекти;
— соціальні виплати та соціальне забезпечення;
— питання страхування;
— освіту та охорону здоров’я в школі;
— роботу та незалежне життя для дорослих;
— важливість розкриття інформації, у разі потреби, про епілепсію на роботі (якщо будуть необхідними подальша інформація чи роз’яснення, слід звертатись до волонтерських організацій);
— безпеку на дорозі та безпечне керування автомобілем;
— прогноз;
— раптову смерть при епілепсії (SUDEP);
— епілептичний статус;
— спосіб життя, вільний час та соціальні проблеми (включаючи легкі наркотики, алкоголь, сексуальну активність та недосипання);
— планування сім’ї та вагітність;
— волонтерські організації, такі як групи підтримки та благодійні організації, та як зв’язатись з ними.
1.3.2. Час, в який потрібно надавати цю інформацію, залежить від визначеності діагнозу та необхідності в підтверджуючих дослідженнях.
1.3.3. Інформацію слід надавати із застосуванням такого формату, мови та способу, який відповідає вимогам дитини, підлітка та дорослого. Особливу увагу слід приділити віковому розвитку, статі, культурі та етапу життя особи.
1.3.4. Якщо діти, підлітки та дорослі, хворі на епілепсію, та їхні сім’ї та/або особи, що здійснюють догляд за хворим, не отримали вичерпної інформації від волонтерських організацій та з інших джерел, спеціалісти охорони здоров’я повинні повідомити їх про різноманітні джерела (із використанням Інтернету за можливості: наприклад, веб-сайт Об’єднаної ради з питань епілепсії Великобританії та Ірландії, www.jointepilepsycouncil.org.uk).
1.3.5. Під час консультації необхідно виділити достатньо часу для надання інформації, до якої слід повернутись під час наступних консультацій.
1.3.6. Для нагадування дітям, підліткам та дорослим, а також спеціалістам охорони здоров’я про інформацію, яку необхідно обговорити під час консультації, слід застосовувати контрольні переліки.
1.3.7. Кожен, хто надає догляд та лікування дітям, підліткам та дорослим, хворим на епілепсію, повинен бути в змозі забезпечити всю необхідну інформацію.
1.3.8. Дитина, підліток або дорослий, хворі на епілепсію, та їхня сім’я та/або особи, що здійснюють догляд за хворим, залежно від ситуації, маю знати, як зв’язатись з конкретною особою у разі потреби в певній інформації. Ця конкретна особа має бути членом команди охорони здоров’я та відповідає за гарантію того, що інформаційні потреби дитини, підлітка або дорослого, та/або їхньої сім’ї, та/або осіб, що здійснюють догляд за хворим, будуть задоволені отриманою інформацією.
1.3.9. Слід обговорити можливість розвитку нападів та надати всю можливу інформацію про них перед їхньою появою дітям (батькам), підліткам та дорослим у групі високого ризику розвитку нападів (наприклад, після тяжкого ушкодження мозку), у осіб з нездатністю до навчання або з наявністю епілепсії в сімейному анамнезі.
1.3.10. Дітям, підліткам та дорослим, хворим на епілепсію, потрібно надати відповідну інформацію перед прийняттям важливих рішень (наприклад, стосовно вагітності або роботи).
Раптова неочікувана смерть при епілепсії (SUDEP)
1.3.11. Інформація про SUDEP має бути включена до літератури, присвяченої питанням епілепсії, для того, щоб показати, наскільки важливе попередження припадків. Спеціальна інформація стосовно відносного ризику SUDEP для пацієнта має бути обов’язковою частиною плану консультаційних прийомів дітей, підлітків та дорослих, хворих на епілепсію, а також обов’язковою інформацією для їхніх сімей та/або осіб, що здійснюють догляд за хворим.
1.3.12. Ризик SUDEP може бути мінімізований шляхом:
— оптимізації контролю нападів;
— інформування про потенційні наслідки нічних нападів.
1.3.13. При проведенні консультацій та обговорень дитина, підліток або дорослий, хворі на епілепсію, їхня сім’я та/або особи, що здійснюють догляд за хворим (залежно від ситуації), та спеціалісти охорони здоров’я повинні взяти до уваги невеликий, але існуючий ризик SUDEP.
1.3.14. У випадку SUDEP спеціалісти охорони здоров’я повинні зв’язатись з сім’ями та/або особами, що здійснюють догляд за хворим, щоб запропонувати свої співчуття, запросити їх для обговорення смерті та запропонувати звернутись за психологічною консультацією до групи підтримки у випадках SUDEP.
1.4. Тактика після першого нападу.
1.4.1. Діти, підлітки та дорослі, які потрапили до відділення екстреної медичної допомоги після підозрілого нападу, спочатку мають пройти систематизацію (скринінг). Це має бути зроблено лікарем-терапевтом або педіатром з подальшим зверненням до спеціаліста у разі підозри на епілептичний напад або у випадку діагностичного сумніву у характері нападу.
1.4.2. Необхідно складати протоколи для лікувально-діагностичних закладів, які надають належний діагностичний та терапевтичний алгоритм в екстрених ситуаціях для дітей, підлітків та дорослих з епілептичним нападом (підозрюваним або підтвердженим).
1.4.3. Інформація, котру необхідно отримати від дорослого та/або сім’ї або особи, що здійснює догляд за хворим, при підозрі на можливий епілептичний напад, міститься в алгоритмі, який наведено нижче (додаток D).
1.4.4. Інформація, котру необхідно отримати від дитини або підлітка та/або когось з батьків або особи, що здійснює догляд за хворим, при підозрі на можливий епілептичний напад, міститься в алгоритмі, який наведено нижче (додаток D).
1.4.5. Рекомендовано якомога скоріше оглянути всіх дорослих після першого нападу (можливо, епілептичного) за участю спеціаліста невролога або психіатра для встановлення точного та своєчасного діагнозу та початку адекватного лікування.
1.4.6. Рекомендовано якомога скоріше оглядати всіх дітей та підлітків, які перенесли перший нефебрильний напад, за участю дитячого невролога для встановлення точного та своєчасного діагнозу та початку адекватного лікування.
1.4.7. При проведенні первинної оцінки нападу з недавнім початком спеціаліст повинен мати доступ до результатів відповідних досліджень.
1.4.8. Дитині, підлітку або дорослому, у яких трапився напад, слід провести ретельній фізикальний огляд. Він має включати в себе дослідження кардіологічного, неврологічного та психічного статусу, та у випадках, коли це необхідно, дослідження має проводитися неодноразово.
1.4.9. Пацієнтам і/або їх родині/особі, що здійснює догляд за хворим, слід надати необхідну інформацію про те, як розпізнати напад, надати першу допомогу, та щодо важливості реєстрації та повідомлення лікаря про наступні напади. Така інформація має бути надана ще до встановлення остаточного діагнозу.
1.5. Встановлення діагнозу.
1.5.1. Діагноз епілепсії у дорослих має бути встановлений лікарем-спеціалістом терапевтичного профілю (неврологом або психіатром), що пройшов підготовку та має досвід в галузі ведення епілепсії.
1.5.2. Діагноз епілепсії у дітей та підлітків має бути встановлений педіатром-спеціалістом (дитячим неврологом), що пройшов підготовку та має досвід в галузі ведення епілепсії.
1.5.3. Дітям, підліткам та дорослим та їхнім сім’ям та/або особам, що здійснюють догляд за хворим, має бути надана можливість обговорити діагноз з відповідним спеціалістом сфери охорони здоров’я.
1.5.4. Від дитини, підлітка або дорослого та/або очевидця нападу за можливості потрібно отримати детальний опис ситуації з метою визначення, чи мав місце епілептичний напад.
1.5.5. Клінічне рішення щодо того, чи мав місце епілептичний напад, має спиратися на поєднання характеру нападу та наявності характерних симптомів. Діагностика не може базуватись на наявності або відсутності окремих ознак.
1.5.6. Не завжди існує можливість лише за клінічними ознаками встановити точний діагноз епілепсії. В цьому випадку слід застосовувати подальші дослідження (див. розділ 1.6) та/або звернення до високоспеціалізованого фахівця в галузі епілепсії [8] (див. рекомендації 1.10.2). У будь-якому випадку слід організовувати подальший нагляд.
1.5.7. У випадку, коли є підозра на неепілептичний напад, слід звернутись до психолога та/або психіатра для подальшого дослідження та лікування.
1.5.8. Проспективна реєстрація пароксизмальних явищ, в тому числі відеозапис та письмові описи, можуть бути корисними у постановці діагнозу.
Коментар робочої групи
З урахуванням відсутності в Україні медичної спеціальності — епілептолог остаточний діагноз «епілепсія» має встановлюватися неврологом та/або психіатром в закладах охорони здоров’я третього рівня. На першому та другому рівнях надання медичної допомоги можливо встановлення імовірного діагнозу епілепсія з обов’язковим подальшим скеруванням хворого до невролога або психіатра третинної ланки, обізнаного в проблемі епілепсії. Пацієнту має бути надана можливість своєчасного комплексного обстеження в амбулаторних або стаціонарних умовах.
1.6. Обстеження.
1.6.1. Дітям, підліткам та дорослим, їх сім’ям та/або особам, що здійснюють догляд за хворим, залежно від ситуації, слід надавати інформацію стосовно причин та необхідності проведення конкретних досліджень, значення їх результатів для діагностики та вибору терапевтичної тактики.
1.6.2. Всі обстеження дітей мають проводитись тільки в спеціалізованому педіатричному медичному закладі.
Електроенцефалографічне обстеження (ЕЕГ)
1.6.3. Діти, підлітки та дорослі, що потребують ЕЕГ, мають пройти дослідження відразу після виникнення необхідності в цьому обстеженні.
1.6.4. ЕЕГ слід проводити тільки для підтвердження діагнозу епілепсії у дорослих, клінічна ситуація у яких дає можливість підозрювати, що напад може бути епілептичним за своєю природою.
1.6.5. ЕЕГ слід проводити тільки для підтвердження діагнозу епілепсії у дітей та підлітків. Якщо проведення ЕЕГ вважається необхідним, це слід робити після другого епілептичного нападу, але за деяких умов, у разі призначення спеціалістом, можна вважати доцільним її проведення і після першого епілептичного нападу.
1.6.6. ЕЕГ недоцільно проводити у випадку ймовірної синкопи через можливість хибнопозитивного результату.
1.6.7. ЕЕГ не можна використовувати для виключення діагнозу епілепсії у дитини, підлітка або дорослого, клінічна картина яких свідчить про наявність того чи іншого неепілептичного стану.
1.6.8. Ізольовані від клінічної картини дані ЕЕГ не можна використовувати для постановки діагнозу епілепсії.
1.6.9. ЕЕГ можна використовувати для визначення типу нападу та епілептичного синдрому у дітей, підлітків та дорослих, в яких встановлено епілепсію. Це може допомогти встановити прогноз захворювання у пацієнта.
1.6.10. Для дітей, підлітків та дорослих з першим неспровокованим нападом недвозначна епілептиформна активність, встановлена на ЕЕГ, може бути використана для оцінки ризику рецидиву нападів.
1.6.11. У дітей, підлітків та дорослих, в яких підозрюють епілепсію, але постановка діагнозу у них ускладнена, данні ЕЕГ має додатково оцінити фахівець.
1.6.12. Повторні стандартні ЕЕГ можуть стати корисними у випадку, коли діагноз епілепсії або синдрому епілепсії є неясним. Однак якщо діагноз був встановлений, повторення ЕЕГ, імовірно, не буде доцільним.
1.6.13. Повторні стандартні ЕЕГ не треба використовувати у якості альтернативи проведенням ЕЕГ під час сну або депривації сну. [2004 p.]
1.6.14. Якщо застосування стандартної ЕЕГ не дозволило встановити діагноз або класифікувати тип нападу або форму епілепсії, доцільно провести ЕЕГ під час сну.
1.6.15. Для дітей та підлітків найбільш інформативною є ЕЕГ сну, проведена після депривації сну або використання мелатоніну.
1.6.16. Тривалу відео- або амбулаторну ЕЕГ можна використовувати в оцінюванні дітей, підлітків та дорослих, постановка діагнозу у яких становить певні труднощі після проведення клінічної оцінки та стандартної ЕЕГ.
1.6.17. Різні провокації за показаннями можуть бути використані при оцінці ЕЕГ показників неепілептичного нападу. Тим не менш, вони мають обмежену роль та можуть призвести у деяких пацієнтів до хибнопозитивних результатів.
1.6.18. Фотостимуляція та гіпервентиляція мають залишатись частиною стандартного ЕЕГ-дослідження. Дитина, підліток або дорослий та сім’я та/або особа, що здійснює догляд за хворим, мають бути повідомлені, що такі процедури активації можуть викликати припадок, і вони мають право відмовитись.
Коментар робочої групи
Для адекватности использования метода ЭЭГ необходимо помнить о требованиях Международной противоэпилептической лиги к проведению ЭЭГ-исследования:
1. Не менее 12 каналов записи одновременно;
2. Расположение электродов по схеме 10–20;
3. Наличие других каналов для мониторирования ЭКГ, дыхания, миограммы, движения глаз;
4. Анализ не менее 20 минут качественной записи фоновой ЭЭГ;
5. Возможность проведения функциональных нагрузок — звуковой стимуляции, фотостимуляции, гипервентиляции.
Только приверженность этим требованиям, которые реально выполнить практически в любой электрофизиологической лаборатории, позволит сделать рутинную ЭЭГ реальным инструментом для дифференциальной диагностики пароксизмальных состояний. При этом необходимо помнить, что интериктальная ЭЭГ не может служить 100% диагностическим критерием диагноза «эпилептический припадок». Но ее данные играют существенную роль в дифференцированной диагностике пароксизмальных состояний. Наличие эпилептиформных феноменов на ЭЭГ делает более вероятным диагноз эпилептического припадка. При оценке интериктальной ЭЭГ необходимо помнить о том, что у больных эпилепсией могут быть нормальные результаты, а у больных с другими пароксизмами могут быть патологические, в том числе эпилептиформные изменения на ЭЭГ.
Данные ЭЭГ должны обязательно сочетаться с данными клинической картины пароксизмов. Если в фоновой ЭЭГ не обнаруживаются патологические феномены, больному должны быть предоставлены физиологические нагрузки, изложенные выше, если сомнения остаются, то возможна запись ЭЭГ после депривации сна, что является более значительным провокатором эпилептической активности, чем фото- и фоностимуляция и гипервентиляция.
Електроенцефалографічний відеомоніторинг (ЕЕГ–відеомоніторинг) — діагностична методика, яка потребує значних коштів, і тривалого часу, і значних затрат праці, заснована вона на безперервному записі ЕЕГ протягом тривалого часу (від кількох годин до тижня) з одночасним відеозаписом клінічних проявів, що й дозволяє зареєструвати ті або інші клінічні події й оцінити біоелектричну активність головного мозку в певний, необхідний для встановлення діагнозу, відрізок часу в кореляції із клінічною подією, методика також дозволяє оцінити динаміку біоелектричної активності головного мозку протягом необхідного для вирішення діагностичних та терапевтичних завдань часу.
Адекватне застосування методики можливо тільки при наявності чітко поставлених діагностичних завдань і плідної співпраці між клініцистом і лікарем функціональним діагностом, який проводить оцінку даних (електрофізіологом). Аналіз отриманих при тривалому ЕЕГ-відеомоніторингу даних проводиться з урахуванням усіх функціональних проб і станів пацієнта під час запису. Крім традиційного аналізу фонової біоелектричної активності головного мозку, а також зміни її при стандартних функціональних навантаженнях, при проведенні даного обстеження з’являється можливість простежити динаміку змін функціональної активності головного мозку протягом доби, при різних видах діяльності.
Можливості ЕЕГ-відеомоніторингу не обмежені лише відеореєстрацією події. Запис ЕЕГ навіть протягом доби значно підвищує можливості підтвердження наявності епілептичної активності та встановлення її характеру, а також підтверджує чи заперечує відповідність морфологічного церебрального вогнища з епілептогенним.
Висновок результатів ЕЕГ-відеомоніторингу має бути уніфікованим, але при цьому містить відповіді на запитання клініциста. До паперового висновку обов’язково має додаватися електронний носій, який містить найбільш показові та значущі для діагностики фрагменти. Електронний носій мусить бути доступним для перегляду.
Оптимізація використання даного методу діагностики в практичній діяльності неврологів, психіатрів, а також лікарів загальної практики дозволить поліпшити якість діагностики як епілепсії, так і неепілептичних пароксизмальних станів, що підвищить ефективність лікування, дозволить оцінити клінічний перебіг та якість ремісії захворювання.
Нейровізуалізація
1.6.19. Нейровізуалізацію слід використовувати для виявлення структурних аномалій, які викликають певні види епілепсії.
1.6.20. Для нейровізуалізації у дітей, молодих людей та дорослих, хворих на епілепсію, методом вибору має бути МРТ.
1.6.21. Використання МРТ є надзвичайно важливим для пацієнтів:
— у пацієнтів з дебютом епілепсії до 2 років або у дорослому віці;
— при наявності в анамнезі, результатах дослідження або ЕЕГ ознак фокального початку (до появи чітких доказів доброякісної фокальної епілепсії);
— у яких напади продовжуються, незважаючи на адекватну терапію першої лінії.
1.6.22. Всі пацієнти, які потребують МРТ, мають пройти дослідження якомога скоріше для уточнення морфологічного діагнозу.
1.6.23. Нейровізуалізацію не можна вважати дослі–дженням першої ліниї вибору для встановлення діагнозу «ідіопатична генералізована епілепсія».
1.6.24. КT слід використовувати для виявлення тільки грубої патології головного мозку у випадку, якщо МРТ неможливо зробити або вона протипоказана, і для дітей або підлітків, яким для проведення МРТ потрібна загальна анестезія чи наркоз.
1.6.25. Тільки в гострій ситуації, при неможливості ургентного проведення МРТ, КT можна використовувати для визначення, чи був напад (симптоматичний напад) спричинений гострим неврологічним ураженням або гострою хворобою головного мозку.
Інші обстеження
1.6.26. Вимірювання пролактину в сироватці вважається недоцільним у діагностиці епілепсії.
1.6.27. У дорослих слід вважати доцільним проведення відповідних біохімічних аналізів крові (наприклад, електроліти плазми, глюкоза, кальцій) для виявлення потенційних причин розвитку нападів та/або визначення будь-яких клінічно важливих коморбідних захворювань.
1.6.28. Для дітей та підлітків інші дослідження, включаючи біохімію крові та сечі, мають бути застосовані на призначення спеціаліста з метою уточнення діагнозу, виключення інших пароксизмальних станів та встановлення етіології епілепсії.
1.6.29. ЕКГ у 12 відведеннях доцільно застосовувати для дорослих з можливою епілепсією для диференційної діагностики.
1.6.30. Для дітей та підлітків у випадках діагностичної невизначеності доцільно використання ЕКГ у 12 відведеннях.
1.6.31. У разі діагностичної невизначеності про характер пароксизмальних станів доцільна можливість звернення до кардіолога для проведення ретельного обстеження та уточнення діагнозу.
Нейропсихологічне оцінювання
1.6.32. Застосування нейропсихологічного оцінювання у дітей, підлітків та дорослих доцільне у випадках, коли необхідно оцінити здатність до навчання та ступінь когнітивної дисфункції, особливо це стосується дослідження мовних можливостей та функцій пам’яті.
1.6.33. Призначення психологічного оцінювання (дослідження) показане в наступних випадках:
— коли дитина, підліток або дорослий, хворі на епілепсію, мають освітні та професійні труднощі;
— коли МРТ виявило аномалії в когнітивно важливих ділянках мозку;
— коли дитина, підліток або дорослий скаржаться на пам’ять або інші когнітивні розлади та/або зниження когнітивних здібностей.
Коментар робочої групи
Також звернення за нейропсихологічним оцінюванням показане:
— при симптоматичних епілепсіях, спричинених органічним ураженням головного мозку;
— коли хворі на епілепсію мають показання до хірургічного лікування епілепсії;
— для уточнення плану психосоціальної реабілітації хворого на епілепсію;
— при лікуванні ПЕП, які можуть спричинювати вплив на когнітивні функції. Нейропсихологічне оцінювання в Україні мають проводити спеціалісти лікар-психолог та/або практичний психолог, компетенцією яких є визначення об’єму та методів обстеження у кожному окремому випадку.
1.7. Класифікація.
1.7.1. Епілептичні припадки та епілептичні синдроми у дітей, підлітків та дорослих мають бути класифіковані з використанням багатоосьової діагностичної схеми. Осі, які обов’язкові при встановленні діагнозу згідно з сучасними класифікаційними підходами: опис нападу (іктальна феноменологія); тип нападу; врахування форми епілепсії та/або епілептичного синдрому та етіології епілепсії.
1.7.2. Тип(и) нападу та епілептичний синдром, етіологія та супутні захворювання мають бути визначені, тому що неправильна класифікація форми епілепсії та епілептичного синдрому, а також інших клінічних феноменів епілепсії може призвести до неадекватного лікування та збереженні нападів, а також розвитку фармакорезистентності епілепсій.
1.7.3. Дітям, підліткам та дорослим, хворим на епілепсію, потрібно надати інформацію про тип(и) нападу, форму епілепсії або різновид епілептичного синдрому, а також імовірний прогноз захворювання.
Коментар робочої групи
На теперішній час загальновживаною є класифікація типу епілептичного нападу, що прийнята в 1981 році.
Міжнародна класифікація епілептичних нападів (ІLAE 1981)
І. Парціальні (фокальні, локальні) епілептичні напади:
A. Прості парціальні напади (свідомість не порушена):
1. З моторними симптомами:
a) фокальні моторні без маршу;
b) фокальні моторні з маршем (джексонівський марш);
c) версивні;
d) постуральні;
e) фонаторні (вокалізація або зупинка мови).
2. Із соматосенсорними або специфічними сенсорними симптомами (прості галюцинації):
a) соматосенсорні;
b) зорові;
c) слухові;
d) нюхові;
e) смакові;
f) запаморочення.
3. З вегетативними симптомами (епігастральні відчуття, блідість, пітливість, почервоніння обличчя, лихоманкоподібне тремтіння, пілоерекція, розширення зіниць).
4. Із психічними симптомами (порушення вищих церебральних функцій). Ці симптоми рідко з’являються без порушення свідомості й частіше супроводжують комплексні (складні) парціальні напади:
a) дисфазичні;
b) дисмнестичні (déjà vu);
c) когнітивні (сновидні стани, порушення відчуття часу);
d) афективні (страх, злість);
e) ілюзії (макро-, мікропсії);
f) структурні галюцинації (музика, сцени).
B. Комплексні (складні) парціальні припадки (з порушенням свідомості, іноді можуть починатися із простих симптомів):
1. Починаються як прості парціальні з наступним порушенням свідомості:
a) початок із простих парціальних припадків (від А1 до А4) з наступним порушенням свідомості;
b) з автоматизмами.
2. З порушенням свідомості на початку:
a) тільки з порушенням свідомості;
b) з автоматизмами.
C. Парціальні напади із вторинною генералізацією (можуть бути генералізовані тоніко-клонічні, тонічні або клонічні судоми) (можлива швидка генералізація):
1. Прості парціальні напади (А) із вторинною генералізацією.
2. Комплексні (складні) парціальні напади (В) із вторинною генералізацією.
3. Прості парціальні напади (А), що переходять у комплексні парціальні (В) з наступною вторинною генералізацією.
ІІ. Генералізовані напади (судомні і безсудомні):
А1. Абсанси:
a) тільки з порушенням свідомості;
b) із клонічним компонентом;
c) з атонічним компонентом;
d) із тонічним компонентом;
e) з автоматизмами;
f) з автономними (вегетативними) симптомами
(b-f можуть бути присутніми ізольовано або в комбінаціях).
А2. Атипові абсанси:
a) зміни тонусу більш значні, ніж при А1;
b) початок і/або закінчення поступові (не раптові).
B. Міоклонічні напади. (Міоклонічні посмикування по–одинокі або множинні.)
C. Клонічні напади.
D. Тонічні напади.
E. Тоніко-клонічні напади.
F. Атонічні (астатичні) напади.
А також
Класифікація епілепсій і епілептичних синдромів (переглянута і доповнена)
Комісія з класифікації і термінології Міжнародної протиепілептичної ліги (1989)
1. Пов’язані з локалізацією (фокальні, локальні, парціальні) епілепсії і синдроми.
1.1. Ідіопатичні (з початком в певному віці).
1.1.1. Доброякісна епілепсія дитячого віку з центротемпоральними спайками.
1.1.2. Епілепсія дитячого віку з потиличними пароксизмами.
1.1.3. Первинна епілепсія читання.
1.2. Симптоматичні.
1.2.1. Хронічна проградієнтна epilepsia partials continua (синдром Кожевнікова) дитячого віку.
1.2.2. Синдроми, що характеризуються специфічними способами викликання.
1.2.3. Різні синдроми, визначення яких ґрунтується переважно на типі нападу і інших клінічних особливостях:
— скроневі епілепсії;
— лобні епілепсії;
— тім’яні епілепсії;
— потиличні епілепсії.
1.2.4. Пов’язані з локалізацією ідіопатичні епілепсії: (лобна нічна спадкова епілепсія).
1.3. Криптогенні.
2. Генералізовані епілепсії і синдроми.
2.1. Ідіопатичні (з початком в певному віці, в порядку віку появи).
2.1.1. Доброякісні сімейні судоми новонароджених.
2.1.2. Доброякісні судоми новонароджених.
2.1.3. Доброякісна дитяча міоклонічна епілепсія.
2.1.4. Епілепсія з пікнолептичними абсансами (пікнолепсія, епілепсія з абсансами) дитячого віку.
2.1.5. Юнацька епілепсія з абсансами.
2.1.6. Юнацька міоклонічна епілепсія (епілепсія з імпульсивними petit mal).
2.1.7. Епілепсія з великими судомними припадками при пробудженні.
2.1.8. Інші генералізовані ідіопатичні епілепсії.
2.1.9. Епілепсія із специфічним способом викликання.
2.2. Криптогенні або симптоматичні (в порядку віку появи).
2.2.1. Епілепсія з блискавичними, кивковими, салаам-нападами (синдром Уеста).
2.2.2. Синдром Леннокса — Гасто.
2.2.3. Епілепсія з міоклоніко-астатичними нападами (синдром Дууз).
2.2.4. Епілепсія з міоклонічними абсансами (синдром Тассінарі).
2.3. Симптоматичні.
2.3.1. Неспецифічної етіології:
— рання міоклонічна енцефалопатія;
— рання епілептична енцефалопатія з паттерном «спалах — пригнічення» на ЕЕГ;
— інші симптоматичні генералізовані епілепсії.
2.3.2. Специфічні синдроми.
Епілептичні напади можуть ускладнювати багато хвороб. Під цим заголовкам зібрані ті захворювання, при яких напади є основним або переважаючим проявом:
— порушення розвитку;
— доведені або передбачувані порушення обміну речовин.
3. Епілепсії і синдроми, не визначені відносно того, чи є вони фокальними, чи генералізованими.
3.1. З генералізованими і фокальними припадками.
3.1.1. Неонатальні напади.
3.1.2. Важка міоклонічна епілепсія дитинства.
3.1.3. Епілепсія з безперервними комплексами «спайк — хвиля» в повільнохвилевому сні.
3.1.4. Синдром епілептичної афазії (Ландау — Клеффнера).
3.1.5. Інші невизначені епілепсії.
3.2. Без однозначних генералізованих або фокальних рис.
Сюди відносяться усі випадки з генералізованими тоніко–клонічними нападами, при яких клінічні і ЕЕГ-дані не дозволяють чітко класифікувати генералізовані або локальні, як, наприклад, припадки grand mal уві сні.
4. Спеціальні синдроми. Ситуаційно-обумовлені припадки.
4.1. Фебрильні напади.
4.2. Ізольований епілептичний напад або ізольований епілептичний статус.
4.3. Напади, які виникають виключно при гострих метаболічних або токсичних порушеннях або під впливом таких чинників, як алкоголь, медикаменти, еклампсія, кататонія, гіперглікемія.
Слід відзначити, що ці класифікації у теперішній час переглядаються, і основні положення новітньої класифікації епілепсій наведені нижче.
1.8. Загальні принципи ведення хворих на епілепсію
1.8.1. Діти, підлітки та дорослі, хворі на епілепсію, повинні мати доступ до відповідних служб та структур системи охорони здоров’я, що надають спеціалізовану медичну допомогу фахівцями-епілептологами.
1.8.2. Всі діти, підлітки та дорослі, хворі на епілепсію, повинні мати комплексний план медичної та соціальної допомоги, узгоджений між пацієнтом, сім’єю та/або особою, що здійснює догляд за хворим, та відповідними фахівцями первинної та вторинної медичної допомоги у всіх можливих випадках. Він має враховувати не тільки медичні питання, а й у тій же мірі аспекти способу та якості життя.
1.8.3. Медичні сестри, які спеціалізуються в галузі епілепсії (ESN), мають стати невід’ємною частиною мережі догляду дітей, підлітків та дорослих, хворих на епілепсію. Ключові обов’язки ESN — надавати допомогу та забезпечувати комунікаційний зв’язок між спеціалістами з епілепсії та лікарями загальної практики, забезпечувати доступ до спільноти, мультидисциплінарних послуг та міжвідомчих послуг та надавати інформацію, що стосується навчання та соціальної підтримки дитини, підлітка або дорослого, а також здійснювати допомогу у медичних та соціальних питаннях сім’ям та/або особам, що здійснюють догляд за хворим, та, у випадку дитини, усім особам, що приймають участь в наданні дитині освіти, опікуються її соціальними та медичними проблемами.
1.8.4. Спеціалісти охорони здоров’я (лікарі, які спостерігають хворих) відповідають за надання знань про епілепсію іншим фахівцям, які мають відношення до хворого, з метою зниження упередженого ставлення (стигматизації). Вони повинні надавати необхідну інформацію про епілепсію людям, які контактують з дітьми, підлітками та дорослими, хворими на епілепсію, в тому числі персоналу школи, працівникам служби соціальної допомоги та іншим.
1.9. Медикаментозне лікування.
Примітка: дивись додаток E для отримання детальної інформації про медикаментозне лікування.
Членам Групи з розробки Протоколів відомо про протипоказання до призначення карбамазепіну деяким людям китайського або тайського походження. Рекомендації у цьому розділі пропонують альтернативи, отже, ніякі конкретні рекомендації для цих етнічних груп не надані.
Членам Групи з розробки Протоколів також відомо про конкретні проблеми, пов’язані з призначенням натрію вальпроату дівчатам та жінкам дітородного віку. Рекомендації в цьому розділі пропонують альтернативні варіанти лікування для цієї групи. Рекомендації 1.9.1.10, 1.9.17.3, 1.9.17.6, 1.9.17.9 та 1.15.1.4 також на–дають додаткову спеціальну інформацію про призначення ПЕП жінкам дітородного віку.
NICE також випустив рекомендації NICE щодо застосування ретигабіну в якості варіанта для допоміжної терапії парціальних (термін «фокальний» був використаний в цих протоколах) нападів з або без вторинної генералізації для дорослих у віці від 18 років та старше, хворих на епілепсію, у рекомендаціях «Ретигабін для допоміжного лікування парціальних припадків при епілепсії» (оцінку технології NICE, протокол 232).
1.9.1. Загальна інформація стосовно фармакологічного лікування.
1.9.1.1. Інформація, надана щодо протиепілептичних препаратів (ПЕП), має відповідати тій, що була представлена виробником, наприклад, показання, побічні ефекти та реєстраційний статус.
1.9.1.2. Стратегію лікування із застосуванням ПЕП слід обирати індивідуально відповідно до типу припадку, епілептичного синдрому, супутніх ліків та супутніх захворювань, способу життя дитини, підлітка або дорослого та інших особливостей та уподобань особи, її сім’ї та/або осіб, що здійснюють догляд за хворим, залежно від ситуації (див. додаток E).
1.9.1.3. Діагноз епілепсії потрібно критично оцінити (поставити під сумнів) у випадку, коли симптоматика продовжує спостерігатися, незважаючи на адекватний вибір та оптимальне дозування ПЕП першої лінії.
1.9.1.4. Рекомендоване постійне постачання препаратів ПЕП одного виробника дитині, підлітку або дорослому, хворим на епілепсію, доки лікар, який призначив лікування та спостерігає пацієнта, порадившись з ним (дитиною, підлітком або дорослим) та їхньою сім’єю та/або особою, що здійснює догляд за хворим, залежно від ситуації, вирішить, що це питання заміни генеріков не становить проблеми. Різні препарати деяких ПЕП, що виготовлені різними виробниками, можуть варіювати в біодоступності та фармакокінетичному профілі, отже, при їх заміні слід бути дуже уважними для запобігання зниження ефекту або появі додаткових побічних ефектів (дозозалежних). Зверніться до короткої характеристики препарату (SPC) та «Британського національного формуляра» (BNF; наявний на сайті http://bnf.org) для отримання інформації щодо біодоступності та фармакокінетичних профілів конкретних ПЕП, однак треба мати на увазі, що вони не надають інформації стосовно порівняння біодоступності різних генеричних препаратів.
Коментар робочої групи
Слід відзначити, що питання призначення або заміни генеричних препаратів при епілепсії є дуже актуальним, воно обговорюється провідними фахівцями на найбільших світових та європейських фахових форумах. Крім NICE, це питання регламентовано у багатьох розвинутих країнах: США/Американська академія неврології (АAN); Німечіна/німецке відділення ILAE; Италія/італійське відділення ILAE; Польща/Польська асоціація епілептології; Шотландія/Skotish Intercollegiate Guidelines Network; Швеція/Шведська агенція медичної продукції; Нідерланди/декілька фахових інституцій; Росія/Експертна рада Російської протиепілептичної ліги; Франція/Ліга Франції проти епілепсії; міжнародне бюро з епілепсії (IBE). Всі ці установи визначають, що ПЕП є особливим класом препаратів, який потребує особливого відношення для використання брендів та генериків; ПЕП є особливим класом лікарських засобів, і це створює особливі проблеми при переводі хворого з бренда на генерик, з генерика на генерик і навіть з генерика на бренд. Зважаючи на вищенаведене, робоча група пропонує доцільним при використанні генеричних препаратів користуватися рекомендаціями, що наведені нижче (обговорені та підтримані Українською протиепілептичною лігою).
Рекомендації Української протиепілептичної ліги щодо застосування оригінальних і відтворених препаратів (генериків) для лікування епілепсії
Необхідність розробки даних рекомендацій визначається високою медико-соціальною значущістю епілепсії, особливістю фармакологічної та фармакоекономічної ситуації в Україні в зв’язку з присутністю на ринку великої кількості відтворених препаратів, в тому числі і з відхиленнями від стандартів якості (відсутність дослідження біоеквівалентності), а також відсутністю механізмів, що забезпечують безперервний доступ хворого до призначеного лікарем препарату.
Основні визначення
Бренд — інноваційний (оригінальний) препарат — нова активна субстанція або вже відомий фармакологічний продукт при новому показанні до його застосування, проходить повний цикл доклінічних і клінічних досліджень, активні інгредієнти брендового препарату захищені патентом на певний термін.
Генерик — відтворений препарат, який є терапевтичним еквівалентом бренду і випускається тільки після закінчення терміну дії патенту на оригінальний препарат. Для генеричних препаратів доказ біоеквівалентності бренду є обов’язковим для реєстрації генерика в більшості країн світу (еквівалентність швидкості і ступеня абсорбції активної речовини). При цьому необхідно зазначити, що просте дослідження на пацієнтах не замінює визначення біоеквівалентності генерика бренду і в жодному разі не є достатнім для реєстрації генерика.
Біоеквівалентність — це визначення швидкості і ступеня всмоктування оригінального (інноваційного) лікарського засобу і генерика при прийомі в однакових дозах і лікарських формах всередину або іншими способами на підставі визначення концентрації в рідинах і тканинах організму (біодоступність). Два лікарських препарати вважаються біоеквівалентними, якщо вони забезпечують однакову біодоступність лікарського засобу.
В Україні на фармацевтичному ринку присутня достатня кількість генериків, що не мають біоеквівалентності оригінальним препаратам і не завжди відповідають вимогам GMP.
Беручи до уваги рекомендації провідних країн Європейського Союзу, США, Канади і Російської Федерації, а також існуючу законодавчу базу та практику застосування в Україні оригінальних і відтворених препаратів, Експертна рада Української протиепілептичної ліги розробила наступні рекомендації.
Загальні положення
Застосування генериків при епілепсії повинно бути більш обґрунтованим, ніж при багатьох інших захворюваннях.
Протиепілептичні препарати (ПЕП) є особливим класом лікарських засобів, і це створює особливі проблеми в переведенні пацієнта з бренду на генерик, з генерика на генерик, а також з генерика на бренд.
Невеликі відмінності в концентрації ПЕП між препаратами можуть викликати токсичні реакції і почастішання нападів.
На відміну від інших захворювань навіть одноразовий рецидив тільки одного симптому — епілептичного нападу — при переведенні з однієї форми на іншу (з одного препарату на інший) може викликати катастрофічні наслідки.
Пріоритет інтересів пацієнта, незалежність лікаря в прийнятті рішення щодо призначення того чи іншого лікарського засобу і вільний доступ хворого до виписаного медикаменту — головні етичні принципи медичної практики.
Українська протиепілептична ліга заперечує проти тих законодавчих актів, розпоряджень і правил загальноукраїнського і підпорядкованих рівнів, які обмежують можливості лікаря у виборі протиепілептичного препарату для пацієнтів з епілепсією. Необхідне забезпечення пацієнтів з епілепсією всім спектром зареєстрованих в Україні протиепілептичних препаратів.
Біоеквівалентність і фармаконагляд
Українська протиепілептична ліга вважає за необхідне привести у відповідність вимоги українських регуляторних органів до проведення досліджень біоеквівалентності відтворених протиепілептичних лікарських засобів і оцінки отриманих результатів до вимог ВООЗ, FDA, EMEA і рекомендує дослідження біоеквівалентості як обов’язкове при реєстрації і/або дозволу до застосування для будь-якого протиепілептичного препарату на території України.
Експертна рада Української протиепілептичної ліги вважає важливим проведення порівняльних досліджень відтворених препаратів, які ініціюються і підтримуються державними регуляторними органами (IV фаза): згідно з єдиним протоколом; з адекватною вибіркою пацієнтів; з валідною тривалістю спостереження, що дозволить достовірно вивчити терапевтичну еквівалентність і взаємозамінюваність оригінальних і зареєстрованих відтворених препаратів.
Українська протиепілептична ліга рекомендує активізувати діяльність фармаконагляду та інших контролюючих інстанцій з моніторування ефективності і безпеки вживаних протиепілептичних брендових і генеричних препаратів окремо по кожному зареєстрованому препарату і інформувати лікарське співтовариство про результати вказаного моніторингу.
Потрібне вдосконалення системи реєстрації небажаних явищ (на основі впровадження реєстраційних форм), що виникають в процесі застосування протиепілептичних препаратів.
Особливості фармакотерапії
На початку лікування слід інформувати пацієнта про наявність оригінальних і відтворених препаратів, їх переваги та недоліки. Потрібне інформування пацієнта про наявність маркетингової і законодавчої інформації з цього питання.
Починати і тривало продовжувати терапію бажано оригінальними препаратами або генериками, виготовленими за стандартами GMP, з доведеною біоеквівалентністю оригінальному препарату. У кожному випадку має бути гарантоване безперервне забезпечення хворого протиепілептичним препаратом, який призначив лікар.
Слід уникати необґрунтованих замін з бренду на генерик, з генерика на генерик і навіть з генерика на бренд у зв’язку з тим, що вони можуть мати істотні фармакокінетичні відмінності.
У хворого в ремісії слід уникати будь-якої заміни препарату (бренду на генерик, генерика на генерик і навіть генерика на бренд). Заміна може спричинити відновлення нападів, небажані явища і соціальні наслідки для хворого.
Особливі групи (діти, вагітні жінки, літні пацієнти, пацієнти з коморбідною патологією) мають більш високий ризик невдачі терапії при заміні протиепілептичного препарату (бренду на генерик, генерика на генерик і навіть генерика на бренд) і вимагають більш обережного і ретельно зваженого підходу з визначенням концентрації препарату в крові.
Працівники аптечної мережі не повинні робити заміну протиепілептичного препарату без узгодження з лікарем. Лікар повинен інформувати пацієнта про можливі наслідки заміни.
При вимушеній заміні протиепілептичного препарату рекомендується моніторування його концентрації в крові.
Потрібне вдосконалення і впровадження освітніх програм для лікарів, пацієнтів, працівників регуляторної сфери охорони здоров’я, що стосуються питань створення і застосування оригінальних і відтворених протиепілептичних препаратів.
1.9.1.5. Рекомендовано, за можливості, лікувати дітей, підлітків та дорослих з використанням одного ПЕП (монотерапії). Якщо початкове лікування є неуспішним, слід спробувати монотерапію з використанням іншого препарату. Протягом періоду зміни лікарського засобу слід бути дуже уважними до стану хворого.
1.9.1.6. Якщо застосування ПЕП виявляється невдалим через небажані ефекти або напади, що продовжують виникати, слід розпочати прийом другого препарату (який може бути альтернативним препаратом першої або другої лінії) та збільшити дозу до терапевтично адекватної чи максимально переносимої, після чого прийом першого препарату потрібно повільно скорочувати з подальшою відміною.
1.9.1.7. Якщо другий препарат не допомагає, перед початком застосування іншого препарату доза першого або другого препарату може бути скорочена або препарат поступово відмінено залежно від відносної ефективності, наявності побічних ефектів та того, наскільки добре перший чи другий препарати переносяться.
1.9.1.8. Рекомендовано розглянути можливість застосування комбінованої терапії (допоміжної чи додаткової терапії), тільки якщо спроби використати ПЕП не призвели до звільнення від нападів. У разі, коли спроба застосувати комбіновану терапію не принесла користі, слід повернутись до схеми лікування (монотерапії чи комбінованої терапії), яка виявилась найбільш прийнятною для дитини, підлітка або дорослого з урахуванням балансу між ефективністю в зниженні частоти нападів та переносимістю препарату внаслідок побічних ефектів.
1.9.1.9. При застосуванні карбамазепіну слід призначати препарати карбамазепіну з контрольованим вивільненням (препарати пролонгованої дії).
1.9.1.10. Призначаючи натрію вальпроат дівчатам та жінкам дітородного віку, необхідно обговорити з ними можливий ризик вад розвитку та порушень нервової системи у дитини, яка може народитися в майбутньому, особливо у разі застосування високих доз вальпроату або у випадку використання його в якості частини політерапії.
1.9.2. Початок медикаментозного лікування.
1.9.2.1. Терапію ПЕП слід починати тільки після підтвердження діагнозу епілепсії, але можуть бути виняткові випадки, які потребують обговорення та узгодження між лікарем, що приймає рішення про початок лікування, спеціалістом-консультантом та дитиною, підлітком або дорослим та їхньою сім’єю та/або особою, що здійснює догляд за хворим, з урахуванням усіх аспектів медичної та соціальної ситуації.
1.9.2.2. У дорослих терапію ПЕП слід починати за рекомендацією спеціаліста-епілептолога.
1.9.2.3. У дітей та підлітків терапію ПЕП має починати дитячий спеціаліст-епілептолог.
1.9.2.4. Рішення почати терапію повинні спільно прийняти дитина, підліток або дорослий, їхня сім’я та/або особи, що здійснюють догляд за хворим (залежно від ситуації), та спеціаліст-епілептолог після ретельного обговорення ризиків та користі лікування. Таке обговорення має брати до уваги подробиці епілептичного синдрому особи, прогноз захворювання, особливості соціального функціонування.
1.9.2.5. Починати терапію ПЕП зазвичай рекомендують після другого епілептичного припадку.
1.9.2.6. Вибір ПЕП слід в першу чергу базувати на основі чітко визначеного клінічно або за допомогою додаткових методів дослідження епілептичного синдрому, якщо це можливо. Якщо епілептичний синдром залишається невизначеним, рішення про обрання того чи іншого ПЕП потрібно приймати, спираючись на тип(и) нападів.
1.9.2.7. Початок терапії ПЕП слід вважати можливим та доцільним, розглядати можливість її застосування та обговорювати з дітьми, підлітками та дорослими та їхньою сім’єю та/або особами, що здійснюють догляд за хворим, після першого неспровокованого припадку в наступних клінічних ситуаціях:
— дитина, підліток або дорослий має актуальні неврологічні розлади;
— ЕЕГ–дослідження демонструє безсумнівну недвозначну епілептичну активність;
— дитина, підліток або дорослий та/або їхня сім’я та/або особи, що здійснюють догляд за хворим, вважають ризик появи наступного нападу неприйнятним;
— сканування головного мозку демонструє структурну аномалію, яка може бути епілептогенною.
1.9.2.8. Слід розуміти, що після ретельного обговорення ризиків та користі деякі діти, підлітки та дорослі (або їхні сім’ї та/або особи, що здійснюють догляд за хворим, у деяких випадках) можуть відмовитись від терапії ПЕП.
Коментар робочої групи
Початок лікування пацієнтів з епілепсією можливий лише у випадках, коли є впевненість в тому, що напади є епілептичними.
Наявність у пацієнта двох і більше епілептичних нападів вимагає початку лікування протиепілептичними препаратами. Лікування пацієнтів з епілепсією починають з монотерапії препаратом першої лінії вибору, ефективність якого оцінюють протягом періоду не менше 3 місяців після досягнення терапевтичної дози препарату. Оцінка ефективності протягом меншого періоду часу не дозволяє визначити ефективність ПЕП і призводить до частої їх зміни і розвитку вторинної фармакорезистентності.
При виборі ПЕП першої лінії необхідно пам’ятати про найбільш часті побічні ефекти, які можуть погіршити якість життя хворих більшою мірою, ніж наявність епілептичних нападів. Препарат обирається залежно від статі, віку та соціального функціонування пацієнта.
При ефективності першого призначення ПЕП його рекомендують вживати тривало в терапевтичних дозах протягом мінімум 2–3 років.
Тип нападу є одним з основних критеріїв вибору ПЕП у дорослих, оскільки встановити синдром епілепсії у них часто буває неможливим. ПЕП необхідно призначати в дозах не нижче терапевтичних з адекватною для кожного препарату кратністю прийому. Це дозволить підтримувати стабільну концентрацію препарату в плазмі крові і уникнути піків концентрації, під час яких можлива поява дозозалежних ефектів або падіння концентрації ПЕП, що призводить до різкого зниження їх ефективності та можливості декомпенсації епілепсії.
Медикаментозне лікування фокальних нападів
Лікування першої лінії для дітей, підлітків та дорослих з вперше виявленими фокальними нападами
1.9.3.1. Карбамазепін чи ламотриджин доцільно використовувати у якості лікування першої лінії дітям, підліткам та дорослим з вперше виявленими фокальними нападами.
1.9.3.2. При підрахунку питомих витрат в червні 2011 р. використання леветирацетаму виявилося економічно необгрунтованим. Доцільне використання леветирацетаму, окскарбазепіну чи натрію вальпроату (за умови, що фактична вартість леветирацетаму впала мінімум на 50 % від вартості в червні 2011 р., задокументованої в реєстрі лікарських засобів Національної служби охорони здоров’я для Англії та Уельсу), якщо застосування карбамазепіну та ламотриджину є недоцільним клінічно або вони погано переносяться хворим. Якщо перший спробуваний ПЕП є неефективним, запропонуйте альтернативу з цих п’яти ПЕП. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
1.9.3.3. Доцільно розглянути можливість застосування додаткової терапії, якщо другий ПЕП, який добре переноситься, є неефективним (див. рекомендації 1.9.3.1 та 1.9.3.2).
Додаткова терапія для дітей, підлітків та дорослих з рефрактерними фокальними нападами
1.9.3.4. Доцільно застосування карбамазепіну, клобазаму, габапентину, ламотриджину, леветирацетаму, окскарбазепіну, натрію вальпроату чи топірамату у якості допоміжної терапії дітям, підліткам та дорослим з фокальними нападами, якщо лікування першої лінії (див. рекомендації 1.9.3.1 та 1.9.3.2) виявилось неефективним або погано переносилось. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
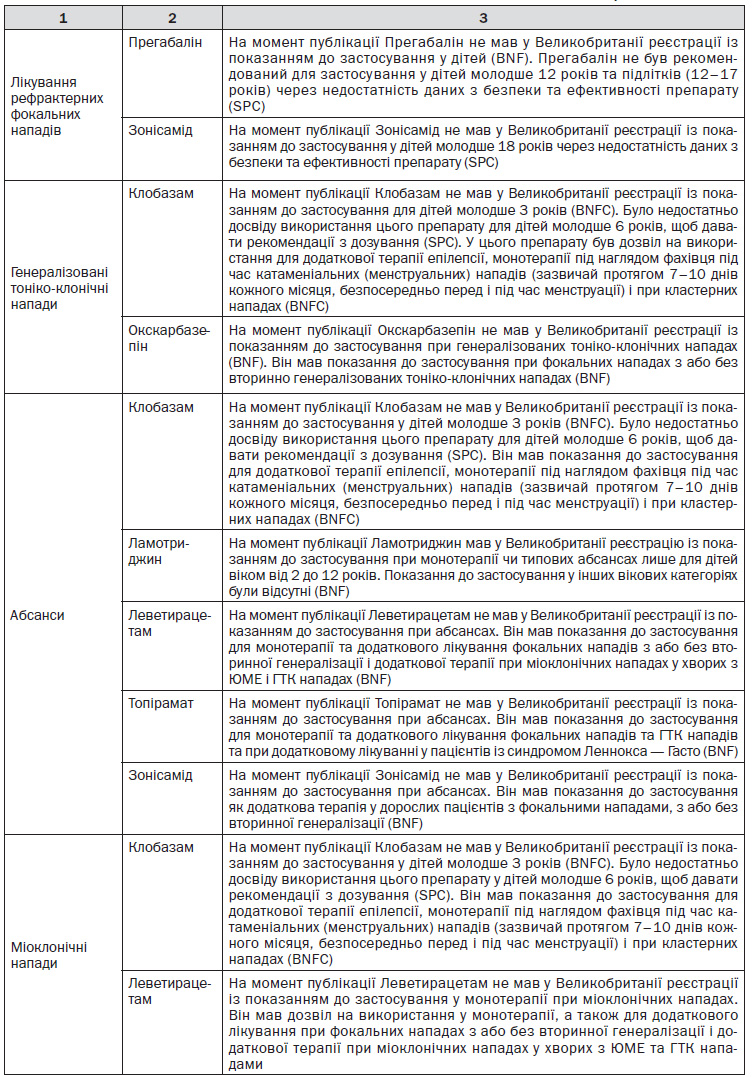
1.9.3.5. Якщо допоміжна терапія (див. рекомендацію 1.9.3.4) є неефективною або погано переноситься, потрібне звернення до високоспеціалізованого експерта в галузі епілепсії. ПЕП, щодо використання яких високоспеціалізований експерт в галузі епілепсії може прийняти рішення про їх призначення, — це еслікарбазепіну ацетат, лакосамід, фенобарбітал, фенітоїн, прегабалін, тіагабин, вігабатрин та зонісамід. При застосуванні вігабатрину треба ретельно розглянути співвідношення «ризик — користь» через ризик незворотного ефекту на поля зору.
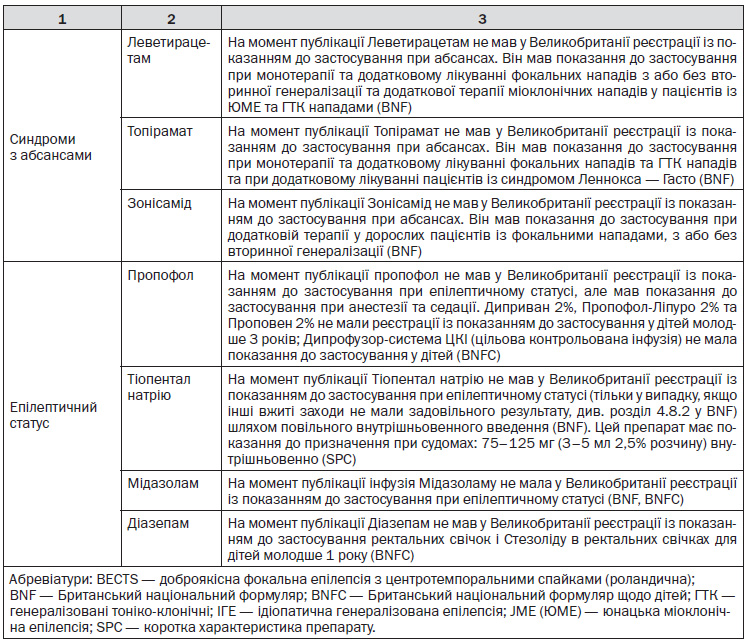
Коментар робочої групи
Масштабне відкрите РКД 2007 року, у якому порівнювалися карбамазепін, габапентин, ламотриджин, окс–карбазепін і топірамат, проведено серед 1721 пацієнта з парціальними нападами (Marson et al., 2007a). Ламотриджин був ефективніше, ніж карбамазепін, габапентин і топірамат — відносно часу неефективності лікування. Карбамазепін був ефективнішим, ніж габапентин, стосовно 12-місячної ремісії. Аналіз популяції «всі пацієнти, які виконали вимоги протоколу» через 2 і 4 роки запропонував не меншу ефективність ламотриджину у порівнянні із карбамазепіном серед частки пацієнтів, що досягла 12-місячної ремісії. Відкрите РКД дослідження вищої ефективності 2005 року порівнювало ламотриджин і карбамазепін у якості 24-тижневої монотерапії серед пацієнтів у віці 12 років і більше з вперше діагностованими парціальними епілептичними нападами (Steinhoff et al., 2005). Рівень відсутності нападів для 88 пацієнтів на ламотриджині був таким самим, як у 88 пацієнтів на карбамазепіні. Подвійне сліпе РКД 2010 року, що порівнює монотерапію топіраматом (n = 132) і фенітоїном (n = 127) серед пацієнтів у віці 12–65 років з вперше діагностованими парціальними нападами (Ramsay et al., 2010). Через 28 днів оцінений рівень відсутності судом, змодельований за допомогою аналізу виживання, склав 81 % для топірамату у порівнянні з 90,3 % для фенітоїну. Прегабалін (n = 330) і ламотриджин (n = 330) порівнювалися в подвійному сліпому дослідженні не меншої ефективності, при цьому первинною кінцевою точкою ефективності була частка пацієнтів, що залишалися без нападів шість або більше місяців без перерви протягом 52–тижневої фази оцінки ефективності. Прегабалін був менш ефективний, ніж ламотриджин, як в аналізі популяції «всі пацієнти, які почали одержувати лікування» (52 % vs. 68 %, оцінена дійсна різниця –0,16 з 95% ДІ від –0,24 до –0,09), так і в аналізі популяції «всі пацієнти, які виконали вимоги протоколу» (різниця –0,16 з 95% ДІ від –0,24 до –0,08) (Kwan et al., 2011). Проте ламотриджин не був визнаний відповідним препаратом порівняння при цьому типі нападів, і дослідження скоріше відноситься до класу III, а не до класу I.
Чотири недавніх метааналізи досліджували ефективність ПЕП у контрольованих і клінічних умовах для дорослих з парціальними нападами. У метааналізах були однакові кінцеві точки: час до скасування лікування, кількість пацієнтів, що досягли відсутності нападів протягом 6 і більше місяців, і час до виникнення першого нападу.
Ефективність карбамазепіну, леветирацетаму, фенітоїну і занісаміду встановлена (рівень A); вальпроат найімовірніше ефективний (рівень B); габапентин, ламотриджин, окскарбазепін, фенобарбітал, топірамат і вігабатрин можливо ефективні (рівень C); у той час як клоназепам і примідон потенційно ефективні (рівень D) у якості початкової монотерапії для дорослих із вперше діагностованими і нелікованими парціальними нападами.
Слід відмітити, що різні національні керівництва з лікування епілепсії та дані доказових досліджень та метааналізів показують майже однаковий рівень доказовості ефективності вальпроєвої кислоти, карбамазепіну, ламотриджину, леветирацетаму, окскарбазепіну та топірамату для терапії парціальних нападів без або з вторинною генералізацією, тому всі вони можуть бути віднесені до препаратів першої лінії лікування дорослих, підлітків і дітей з фокальними нападами, а також використовуватися при рефрактерності епілепсії.
Фармакологічне лікування вперше виявлених генералізованих тоніко-клонічних (ГТК) нападів
Лікування першої лінії для дітей, молодих людей та дорослих з вперше виявленими ГТК припадками
1.9.4.1. Доцільно використання натрію вальпроату у якості лікування першої лінії дітям, підліткам та дорослим з вперше виявленими ГТК припадками. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
1.9.4.2. Якщо натрію вальпроат є неефективним, має побічні дії або його використання недоцільне з інших причин, слід призначити ламотриджин. Якщо в особи в клінічній картині присутні міоклонічні припадки або існує підозра, що у пацієнта — ювенільна міоклонічна епілепсія (ЮМЕ), пам’ятайте, що ламотриджин може агравувати міоклонічні напади.
1.9.4.3. У якості першої лінії вибору можливе застосування карбамазепіну та окскарбазепіну, але слід пам’ятати про ризик агравації міоклонічних нападів чи абсансів.
Додаткова терапія для дітей, підлітків та дорослих з ГТК нападами
1.9.4.4. Доцільно використання клобазаму, ламотриджину, леветирацетаму, натрію вальпроату чи топірамату у якості додаткової терапії дітям, підліткам та дорослим з ГТК нападами, якщо лікування першої лінії (див. рекомендації 1.9.4.1, 1.9.4.2 та 1.9.4.3) є неефективним або погано переноситься. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
1.9.4.5. Якщо в клінічній картині присутні абсанси чи міоклонічні напади або якщо існує підозра на ЮME, не слід використовувати карбамазепін, габапентин, окскарбазепін, фенітоїн, прегабалін, тіагабін чи вігабатрин.
Коментар робочої групи
При виборі першої терапії дорослим пацієнтим з генералізованими тоніко-клонічними нападами обов’язково слід враховувати наявність інших генералізованих нападів в анамнезі (міоклонічних, абсансів та інших). При наявності в анамнезі таких нападів слід помятати про феномен агравації епілептичних нападів. Агравація нападів — парадоксальний фармакодинамічний ефект ПЕП, завдяки якому зростає частота нападів або виникають нові епілептичні напади. Агравація нападів — специфічна реакція, яка виникає при прийомі того чи іншого ПЕП.
Агравація нападів під впливам тих чи інших ПЕП при генералізованих формах епілепсії достатньо добре вивчена.
Барбітурати можуть викликати абсанси або збільшувати їх частоту; цей феномен зазвичай спостерігається при призначенні високих доз препарату; також барбітурати можуть приводити до агравації тонічних генералізованих нападів незалежно від дози. При призначенні карбамазепіну та фенітоїну може збільшитись частота абсансів та міоклонічних нападів; фенітоїн (значно рідше — карбамазепін) можуть агравувати розвиток атонічних нападів; слід відзначити, що в окремих випадках у хворих можуть з’являтися всі три типи нападів. Ламотриджин викликає підвищення частоти міоклоній, яке описано тільки при синдромі Драве. При інших формах генералізованої епілепсії з міоклонічними нападами чітких даних про агравацію міоклоній ламотриджином немає, більше того, показана ефективність препарату при цих формах епілепсії; однак призначення ламотриджину у хворих з міоклонією в анамнезі повинно здійснюватися з обережністю. Окскарбазепін, також як і його попередник — карбамазепін, може викликати агравацію абсансів, міоклонічних та атонічних нападів, і хоча цей феномен зустрічається рідше, ніж при прийомі карбамазепіну, про це слід пам’ятати при лікуванні окскарбазепіном хворих з генералізованими тоніко-клонічними нападами.
Згідно з рекомендаціями МПЕЛ з лікування епілептичних нападів і синдромів, заснованих на доказовому аналізі ефективності протиепілептичних препаратів (Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes // Epilepsia // T. Glauser, E. Ben–Menachem, B. Bourgeois et al. for the ILAE subcommission of AED Guidelines. — 2013. — Epilepsia. — 1–13. — doi: 10.1111/epi.12074), три недавніх метааналізи вивчали ефективність ПЕП у контрольованих і клінічних умовах для дорослих з генералізованими тоніко-клонічними нападами 27 РКД та дослідження SANAD, було зроблено висновки, що:
— для цієї категорії немає відповідних препаратів порівняння;
— карбамазепін, ламотриджин, окскарбазепін, фенобарбітал, фенітоїн, топірамат і вальпроат можливо ефективні (рівень C), а габапентін, леветирацетам і вігабатрин потенційно ефективні (рівень D) у якості початкової монотерапії для дорослих пацієнтів з вперше діагностованими або нелікованими генералізованими тоніко-клонічними нападами.
Доказовість класу IV указує на те, що карбамазепін і фенітоїн можуть провокувати або підсилювати генералізовані тоніко-клонічні напади (Guerrini et al., 1998; Genton, 2000; Somerville, 2009).
1.9.12. Медикаментозне лікування ідіопатичної генералізованої епілепсії (IГE).
Лікування першої лінії для дітей, підлітків та дорослих з IГE
1.9.12.1. Доцільно використання натрію вальпроату у якості лікування першої лінії дітям, підліткам та дорослим з вперше виявленими IГE, особливо на фоні фотопароксизмальної відповіді на ЕЕГ. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.110).
1.9.12.2. Якщо натрію вальпроат є неефективним, має побічні дії або його використання недоцільне з інших причин слід, призначити ламотриджин. Слід пам’ятайти, що ламотриджин може спровокувати або причастити міоклонічні напади. Якщо існує підозра на ЮME, див. рекомендації 1.9.13.1 та 1.9.13.2.
1.9.12.3. Доцільне також використання у якості препарату першої лінії вибору топірамату, але слід пам’ятайти, що він має менш сприятливий профіль побічних ефектів, ніж у натрію вальпроату та ламотриджину.
Додаткова терапія для дітей, молодих людей та дорослих з IГE
1.9.12.4. Доцільне використання ламотриджину, леветирацетаму, натрію вальпроату чи топірамату у якості додаткової терапії дітям, підліткам та дорослим з IГE, якщо лікування першої лінії (див. рекомендації 1.9.12.1, 1.9.12.2 та 1.9.12.3) виявляється неефективним або погано переноситься. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
1.9.12.5. Якщо додаткова терапія (див. рекомендацію 1.9.12.4) є неефективною або погано переноситься, потрібне звернення до високоспеціалізованого експерта в галузі епілепсії. ПЕП, щодо використання яких високоспеціалізований експерт в галузі епілепсії може прийняти рішення про їх призначення, — це клобазам, клоназепам чи зонісамід.
1.9.12.6. Для лікування хворих з IГE не слід використовувати карбамазепін, габапентин, окскарбазепін, фенітоїн, прегабалін, тіагабін чи вігабатрин.
1.9.14. Медикаментозне лікування епілепсії тільки з генералізованими тоніко-клонічними (ГТК) нападами.
Лікування першої лінії для дітей, підлітків та дорослих, хворих на епілепсію тільки з ГТК нападами
1.9.14.1. Доцільне використання ламотриджину чи натрію вальпроату у якості лікування першої лінії дітям, підліткам та дорослим, хворим на епілепсію тільки з ГТК нападами. Якщо існує підозра на міоклонічні припадки або підозра на наявність ЮME, спочатку запропонуйте натрію вальпроат, якщо його використання є клінічно доцільним. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
1.9.14.2. Доцільне також використання у якості препарату першої лінії вибору карбамазепіну та окскарбазепіну, але слід пам’ятати про ризик агравації міоклонічних припадків чи абсансів.
Додаткова терапія для дітей, підлітків та дорослих, хворих на епілепсію тільки з ГТК нападами
1.9.14.3. Доцільне використання клобазаму, ламотриджину, леветирацетаму, натрію вальпроату чи топірамату в якості додаткової терапії дітям, підліткам та дорослим з IГE, якщо лікування першої лінії (див. рекомендації 1.9.14.1 та 1.9.14.2) виявляється неефективним або погано переноситься. Пам’ятайте про тератогенні ризики натрію вальпроату (див. рекомендацію 1.9.1.10).
1.9.17. Довготривале медикаментозне лікування.
1.9.17.1. Слід підтримувати високий рівень пильності лікаря, пацієнта, сім’ї та/або особи, що здійснюють догляд за хворим, щодо розвитку побічних ефектів від препаратів протягом усього періоду лікування (наприклад, вплив на кістки або нейропсихіатричний стан).
1.9.17.2. Продовження та тривалість терапії із застосуванням ПЕП має плануватися спеціалістом. Воно має бути частиною узгодженого плану лікування дитини, підлітка або дорослого, який містить детальну інформацію щодо причин вибору тих чи інших лікарських препаратів, дозування, можливих небажаних явищ та заходів, що мають бути вжиті у разі продовження нападів.
1.9.17.3. Клінічні особливості та потреби дитини, підлітка або дорослого та їх родини та/або осіб, які ними опікуються, необхідно брати до уваги при призначенні довготривалої терапії.
1.9.17.4. У тому випадку, коли діагноз та подальша курація не мають складнощів, довготривале лікування із застосуванням ПЕП може призначатися при первинному етапі медичної допомоги, якщо це дозволяють місцеві обставини та/або ліцензування.
1.9.17.5. Особа, яка призначає лікування, має впевнитись, що дитина, підліток або дорослий та члени їх родини та/або особи, які ними опікуються, повністю проінформовані щодо лікування, в тому числі щодо дій у разі пропуску дози або після шлунково-кишкового розладу.
1.9.17.6. Дотримання лікування може бути оптимізовано через:
— проведення освітньої роботи серед дітей, підлітків або дорослих та їх родин та/або осіб, які ними опікуються, щодо розуміння їх стану та обґрунтування потреби в лікуванні;
— зниження стигматизації щодо даного стану (див. також розділ 1.2);
— застосування простих медикаментозних режимів;
— позитивний взаємозв’язок між медичними працівниками, дитиною, підлітком або дорослим та членами їх родини та/або особами, які ними опікуються.
1.9.17.7. Регулярний моніторинг показників аналізу крові у дорослих не є стандартно рекомендованим та має проводитися виключно за клінічними показаннями.
1.9.17.8. Регулярний моніторинг показників аналізу крові у дітей та підлітків не є стандартно рекомендованим та має проводитися виключно за клінічними показаннями та відповідно до рекомендації спеціаліста.
1.9.17.9. Показання до моніторингу рівнів ПЕП у крові:
— виявлення недотримання призначеного медикаментозного лікування;
— підозра на токсичність;
— коригування дози фенітоїну;
— контроль фармакокінетичної взаємодії (наприклад, зміни у біодоступності, зміни у виведенні та ви–значення можливості супутнього застосування лікарських препаратів, що мають взаємодію);
— специфічні клінічні стани, наприклад епілептичний статус, органна недостатність та певні ситуації при вагітності (див. протокол 1.15.3.19).
1.9.17.10. Показання до проведення аналізу крові включають:
— перед проведенням операції — дослідження згортання крові у тих пацієнтів, які приймають натрію вальпроат;
— розгорнутий аналіз крові, рівень електролітів, печінкові проби, рівень вітаміну D та інші показники кісткового метаболізму (наприклад, рівень кальцію та лужної фосфатази) кожні 2–5 роки у дорослих, які приймають лікарські препарати, що сприяють підвищенню активності ферментів.
1.9.17.11. Безсимптомні незначні відхилення у показниках аналізів не обов’язково є показанням до зміни лікарських препаратів.
1.9.18. Відміна медикаментозного лікування.
1.9.18.1. Рішення щодо продовження або відміни лікарського препарату має прийматися разом дитиною, підлітком або дорослим та членами їх родини та/або особами, що ними опікуються, та спеціалістом-епілептологом після повного обговорення ризиків та переваг такої відміни. Після завершення обговорення діти, підлітки або дорослі та члени їх родини та/або особи, які ними опікуються, мають розуміти ступінь ризику рецидиву нападів за умови продовження лікування та при його відміні. Під час такого обговорення слід брати до уваги специфічність епілептичного синдрому дитини, підлітка або дорослого, можливий прогноз та соціальні особливості.
1.9.18.2. Відміна ПЕП має контролюватися або проводитися під керівництвом спеціаліста у галузі епілепсії.
1.9.18.3. Ризики та переваги продовження або відміни терапії із застосуванням ПЕП необхідно обговорювати з дітьми, підлітками та дорослими, у яких не було нападів щонайменше протягом 2 років, та членами їх родин та/або особами, які ними опікуються.
1.9.18.4. У тому випадку, коли відміну лікування ПЕП проводять дитині, підлітку або дорослому, які нетривалий час не мають нападів, вона має бути повільною (щонайменше протягом 2–3 місяців), необхідно зазначити, що знижуєтся та відміняється тільки один ПЕП, а далі також по одному інші.
1.9.18.5. Особлива обережність потрібна при відміні бензодіазепінів та барбітуратів (має проводитися протягом 6 місяців або довше) у зв’язку з можливістю розвитку симптомів відміни, що пов’язані з тривалим застосуванням цих ПЕП, та/або рецидиву нападів.
1.9.18.6. Має бути надійний план, що узгоджується з дитиною, підлітком та дорослим та членами їх родини та/або особами, які ними опікуються (за необхідності), відповідно до якого у разі рецидиву нападів слід скасувати останнє зниження дози та звернутися за медичною допомогою.
1.10. Курація пацієнтів у складних випадках або при рефрактерній епілепсії.
1.10.1. Всі діти, підлітки та дорослі, які страждають на епілепсію, повинні мати доступ до консультацій всіх необхідних спеціалістів, які повинні забезпечуватися лікарем, який спостерігає хворого, якщо цього вимагає клінічна ситуація.
1.10.2. У тому випадку, коли напади не піддаються контролю та/або існує діагностична невизначеність або невизначеність з вибором методу лікування, діти, підлітки та дорослі мають бути якомога скоріше направлені на спеціалізовану консультацію з метою проведення додаткового оцінювання їх стану. Направлення на спеціалізовану консультацію має бути обов’язковим за умови наявності одного або більше критеріїв, зазначених нижче:
— епілепсія не піддається контролю за допомогою лікарських препаратів протягом 2 років;
— застосування двох препаратів (двох схем прийому ПЕП) не призвело до контролю нападів;
— дитина віком до 2 років;
— у дитини, підлітка або дорослого є неприйнятні побічні ефекти ПЕП або вони мають високий ризик їх розвитку;
— наявність одностороннього структурного ураження головного мозку;
— наявність психологічної та/або психіатричної коморбідності;
— наявність діагностичних сумнівів щодо природи нападів та/або епілептичного синдрому.
1.10.3. У дітей встановлення діагнозу та контроль епілепсії протягом перших років життя можуть бути вкрай проблематичними. У зв’язку з цим дітей з підозрою на епілепсію слід направляти на спеціалізовану консультацію раніше, оскільки напади, що не є контрольованими, мають дуже значний негативний вплив на розвиток, поведінку та психологічний стан дитини.
1.10.4. Регрес розвитку або поява поведінкових розладів, а також неможливість ідентифікувати епілептичний синдром у дитини, підлітка або дорослого має бути приводом для негайного направлення на спеціалізовану консультацію.
1.10.5. Дітей, молодих людей та дорослих, які страждають на специфічні синдроми, такі як синдром Штурге — Вебера, гемісферичні синдроми, енцефаліт Расмуссена та гіпоталамічну гамартому, слід направляти в спеціалізовані епілептичні центри.
1.10.6. Наявність коморбідного психіатричного розладу та/або відсутність патологічних змін при проведенні базових досліджень не має бути підставою для ненаправлення на спеціалізовану консультацію.
1.10.7. Спеціалізована консультація проводиться у спеціалізованому мультидисциплінарному центрі з участю спеціалістів різних профілів, які мають досвід в обстеженні та лікуванні дітей, підлітків та дорослих, що страждають на різні форми епілепсії; мультидисциплінарний центр повинен мати достатній рівень методів дослідження та можливість різних видів лікування, як медикаментозних, так і хірургічних.
1.10.8. Багатопрофільні групи спеціалістів, що надають допомогу хворим з складними випадками епілепсії, мають включати фахівців у сферах психології, психіатрії, соціальної роботи, лікування професійних захворювань, нейрорадіології, сестринської справи, нейропсихології, неврології, нейрохірургії та нейроанестезіології. Група спеціалістів повинна мати у своєму розпорядженні обладнання для проведення МРТ та відеоЕЕ моніторингу.
1.10.9. Нейрохірург у багатопрофільній групі повинен мати спеціальний досвід та/або підготовку у галузі хірургії з приводу епілепсії та мати у своєму розпорядженні обладнання для запису інвазивної ЕЕГ.
1.10.10. Інформацію щодо причин, з яких розглядається можливість проведення хірургічного втручання, слід надати дітям, підліткам та дорослим і членам їх родини та/або особам, які ними опікуються. Переваги та ризики проведення операції необхідно в повній мірі пояснити перед одержанням інформованої згоди.
Коментар робочої групи
Частота випадків фармакорезистентних форм епілепсії коливається від 20 % до 40 % усіх пацієнтів із епілепсією [83, 256, 314]. Шанс на припинення всіх епілептичних нападів після адекватної хірургічної операції в цих випадках повинен становити не менше 70–75 %, з ризиком інвалідизації приблизно 2–3 % і з ризиком смертності нижче 1 %. Тому в даний час більшість авторів вважає, що показання до хірургічного втручання актуальні, коли виявлена фармакорезистентність до двох препаратів. Важливим моментом є своєчасне проведення хірургічного лікування, до прогресування епілептогенезу. А для цього треба вчасно встановити наявність фармакорезистентності пацієнта.
Причини фармакорезистентності все ще значною мірою не зрозумілі, і більшість важливих питань усе ще не вирішено: чи властива фармакорезистентність пацієнтам із епілепсією з самого початку, чи вона генетично детермінована або набута внаслідок тривалої неадекватної терапії. Проблема значно не зменшилася навіть після появи нових ПЕП, які виявилися більш ефективними у багатьох пацієнтів [352]. Проте причиною фармакорезистентності у конкретного хворого може бути не тільки форма епілепсії і тип перебігу захворювання, а й індивідуальна чутливість до призначеного препарату.
Рабочая группа МПЕЛ в 2009 году сформулировала определение фармакорезистентной эпилепсии — это неудача адекватного лечения двумя переносимыми, соответствующе подобранными и использованными схемами противоэпилептических лекарственных средств (в монотерапии или в комбинации) в достижении контроля припадков.
Несмотря на то, что сами авторы допускают возможность изменения данного определения, оно является общепринятым и рекомендовано ILAE как в рутинной клинической практике, так и для проведения клинических исследований.
Успешным лечение считается тогда, когда полностью прекращаются припадки в течение одного года или трехкратного наиболее продолжительного межприступного интервала при декомпенсации эпилепсии. Например, если у пациента припадки были 1 раз в 6 месяцев, то для того чтобы сделать вывод, что пациент свободен от припадков (достигнут контроль припадков), необходимо их отсутствие не менее 18 (6 3) месяцев. Использование «правила 3» обеспечивает 95 % вероятности. Исключением можно считать случаи, когда препарат отменяют, не достигнув клинически эффективной дозы из-за развития побочных эффектов. Причиной отмены препарата явилось не отсутствие эффективности для достижения контроля припадков.
При определении фармакорезистентности эпилепсии необходимо пользоваться новым определением ILAE.
Говорить о фармакорезистентности эпилепсии можно только при верификации эпилепсии и ее предшествующем адекватном лечении.
Неудача первой адекватной монотерапии позволяет предполагать у больного фармакорезистентность эпилепсии и применять адекватную ей диагностическую стратегию.
Комбинацию АЭП необходимо назначать после неудачной второй монотерапии и возможно — после первой. Дуотерапия целесообразна при подозрении на резистентность после первой монотерапии.
Комбинация АЭП может быть столь же безопасной, как монотерапия, при учете фармакокинетического и фармакодинамического взаимодействия АЭП.
Диагностика фармакорезистентности эпилепсии является показанием для консультации нейрохирурга для решения вопроса о проведении хирургического лечения.
Обязательна консультация нейрохирурга при фармакорезистентной эпилепсии.
— Наличие постоянного очага эпилептиформной активности при ЭЭГ-исследовании (даже при рутинной ЭЭГ) у больных с парциальными припадками.
— Склероз гиппокампа.
— Совпадение локализации стабильного морфологического очага и фокальной эпилептиформной активности при ЭЭГ-исследовании.
— Прогрессивное ухудшение клинического течения фокальной эпилепсии.
У прототипі настанови питання психічних розладів у хворих на епілепсію освітлені недостатньо. Психічні та поведінкові розлади в структурі клінічних проявів у хворих на епілепсію можуть розвиватися досить часто і є суттєвою проблемою для вітчизняної клінічної практики. Вважаємо за потрібне освітити особливості лікування психічних та поведінкових розладів у хворих на епілепсію.
Психічні та поведінкові розлади у хворих на епілепсію можуть проявитися у вигляді психотичних розладів, специфічних розладів особистості, когнітивних та мнестичних порушень та епілептичних нападів з порушенням психічних функцій.
Лікування психічних та поведінкових розладів у хворих на епілепсію включає психофармакотерапію, психотерапію та психосоціальні тренінги, які використовуються залежно від форми патології, її перебігу, коморбідних розладів та інших чинників. Лікування слід проводити, не відміняючи ПЕП.
При розвитку депресії та тривоги терапія проводиться згідно з протоколами лікування депресивних та тривожних розладів органічного ґенезу.
Особливостями терапевтичної тактики у хворих на епілепсію є наступне:
— бажане застосування антиконвульсантів з антидепресивною дією;
— при призначенні ПЕП необхідно пам’ятати про їх можливу депресогенну дію;
— антидепресанти бажано призначати тільки при досягненні максимально можливої компенсації епілепсії;
— серед антидепресантів препаратами вибору є інгібітори зворотного захвату серотоніну;
— при призначенні лікування необхідне урахування взаємодії ПЕП та антидепресантів.
Розлади особистості, що формуються на тлі епілепсії, проявляються змінами емоційного контролю, соціальної поведінки та мотивацій. Довготривалий перебіг епілепсії супроводжується формуванням у хворих розладів особистості. Цей розлад характеризується значними змінами преморбідної поведінки. Особливо страждають емоційна сфера, сфера потреб та мотивацій. Розлади особистості проявляються в егоцентричності, сполученні догідливості, утрированої солодкуватості зі спалахами злостивості, жорстокістю, мстивістю, злопам’ятністю і так званою «полярністю характеру». У хворих знижується коло інтересів, вони стають педантичними, причепливими, відзначається схильність до дисфоричних реакцій, що раптово виникають. Для цих хворих характерна афективна в’язкість, формування афективних розрядів у вигляді раптової агресії. У цьому стані хворі становлять небезпеку для оточуючих. Сполучення афективної в’язкості, вибуховості й полярності афектів породжує у хворих на епілепсію тривалі мстиві тенденції, що зберігаються роками й нерідко завершуються агресією, в тому числі іноді надмірно та неадекватно жорстокою.
У хворих з розладом особистості потрібно розглянути можливість проведення психотерапії та переглянути протиепілептичне лікування. При розладах особистості епілептичного ґенезу основою лікування є поєднання психофармакотерапії (АП, АД, анксіолітики, снодійні) та психотерапії (РП, СП, КБП).
Когнітивні розлади, що формуються на тлі епілепсії, мають хронічний, часто прогресуючий характер, проявляються порушенням низки вищих коркових функцій, включаючи пам’ять, мислення, орієнтування, розуміння, рахунок, здатність до навчання, мову, міркування. Свідомість у хворих збережена, порушенню когнітивних функцій передують зміни емоційного контролю, соціальної поведінки та мотивацій. Характер інтелектуального зниження залежить від соціального та культурного оточення, в якому мешкає людина.
Терапія проводиться згідно з протоколами лікування когнітивного розладу органічного ґенезу. Особливостями терапевтичної тактики у хворих на епілепсію є наступне:
— лікування когнітивного розладу бажано призначати тільки при досягненні максимально можливої компенсації епілепсії;
— психотерапія когнітивних функцій (психосоціальний тренінг) призначається при наявності показань;
— необхідно враховувати можливість впливу ПЕП на когнітивні функції хворих на епілепсію;
— при призначенні засобів, які покращують метаболізм мозку, необхідно пам’ятати про їх можливу проепілептичну дію;
— при призначенні лікування необхідне урахування взаємодії препаратів для лікування когнітивних розладів та ПЕП.
Психотичні розлади при епілепсії мають характер гострих, затяжних та хронічних.
Гострі епілептичні психотичні розлади виникають на будь-якій стадії перебігу епілептичного процесу у дорослих як при фокальних, так і при генералізованих формах; хронічні психотичні стани у дорослих найчастіше виникають при наявності в анамнезі окреслених дисфорій, повторних сутінкових станів, а в ряді випадків і явищ епілептичного недоумства. Маячні ідеї одноманітні, уривчасті, стереотипні, конкретні, залежать від змісту галюцинацій. На тлі психотичної сиптоматики відзначаються характерні для хворих на епілепсію афективна напруженість, відчуття страху, туги, а в деяких випадках — стан екстазу. Формування стійкої і в ряді випадків хронічної психотичної симптоматики відбувається при тривалому перебігу епілептичного процесу.
Щодо епілептичних нападів, то епілептичні психози прийнято розділяти на іктальні, постіктальні та інтеріктальні психози.
Епілептичні напади з психотичними розладами у іктальному та постіктальному періодах проявляються у наступних варіантах:
— сутінкове потьмарення свідомості, що супроводжується тривогою, жахом, агресивністю з наступною амнезією; при цьому у хворих можливі зорові, нюхові або слухові галюцинації, маревні ідеї переслідування, загальної загибелі, величі, реформаторства;
— деліріозний стан з яскравими зоровими галюцинаціями й напруженим афектом;
— онейроїдний стан із фантастичним змістом переживань;
— амбулаторний автоматизм у вигляді короткочасних автоматизованих дій за повної відчуженості від оточуючих, з порушенням свідомості й наступною амнезією;
— фуга — стан потьмареної свідомості, коли хворі, усунуті від оточення, прагнуть кудись бігти;
— транс — тривалі розлади свідомості, під час яких хворі автоматично пересуваються, здійснюють невмотивовані поїздки або подорожі, іноді на значні відстані;
— дисфорія, що проявляється пригніченим настроєм, тугою, тривогою, злостивістю, напруженістю, агресивною поведінкою;
— особливі стани у вигляді деперсоналізації і дереалізації з явищами метаморфопсій, які супроводжуються страхом, тугою, тривогою, галюцинаціями.
Гострі психотичні розлади перебігають із потьмаренням свідомості (сутінки, онейроїд, делірій, аменція) і без потьмарення свідомості (гострі афективні й галюцинаторно-параноїдні стани).
Найбільш частою формою гострих психотичних розладів із потьмаренням свідомості є сутінковий стан свідомості, що розвивається після серії судомних нападів і супроводжується збудженням з емоційним напруженням та агресією. Для епілептичного онейроїду характерні яскраві фантастичні галюцинації, що супроводжуються різними емоційними переживаннями.
Найбільш частими затяжними психотичними розладами без потьмарення свідомості є депресивно-дисфоричні стани із тужливо-злісним настроєм, маревними ідеями відношення, переслідування, з підвищеною агресивністю і збудливістю. Рідше виникають депресивні стани із загальмованістю, а також гнівливі та «веселі» манії.
Епілептичні психотичні розлади залежно від провідного синдрому проявляються у вигляді галюцинозу, кататонічного, паранойяльного, галюцинаторно-параноїдного, парафренного та афективного варіантів.
Терапія гострих та затяжних епілептичних психозів проводиться згідно з протоколами лікування психотичних розладів органічного ґенезу відповідно до клінічних проявів. Особливостями терапевтичної тактики при психотичних розладах у хворих на епілепсію є наступне:
— лікування психотичного розладу необхідно проводити у комплексі з протиепілептичним лікуванням з урахуванням можливого патогенетичного зв’язку з епілептичним захворюванням з метою досягнення максимально можливої компенсації епілепсії;
— базовою є психофармакотерапія (переважно антипсихотичними засобами останнього покоління). Допоміжну функцію при наявності показань виконують психотерапія та психосоціальні тренінги;
— при призначенні антипсихотичних препаратів необхідно пам’ятати про їх можливу проепілептичну дію;
— необхідно враховувати можливість впливу деяких ПЕП на виникнення гострих психотичних розладів;
— при призначенні лікування необхідне врахування взаємодії антипсихотичних препаратів та ПЕП.
1.11. Психологічні інтервенції.
1.11.1. Психологічні інтервенції (релаксація, когнітивно-поведінкова терапія, біологічний зворотний зв’язок) можуть бути застосовані у комбінації з терапією із застосуванням ПЕП у дорослих у випадках, коли з точки зору хворого або спеціаліста контролювання нападів не є адекватним при оптимальній терапії із застосуванням ПЕП. Зазначений підхід може сприяти покращенню якості життя у деяких пацієнтів.
1.11.2. Психологічні інтервенції (релаксація, когнітивно-поведінкова терапія) можуть бути застосовані у дітей та підлітків, які страждають на фокальну епілепсію, що є стійкою до лікарських препаратів.
1.11.3. Психологічні інтервенції можуть бути застосовані у якості додаткової терапії. Не доведено, що вони мають вплив на частоту нападів, та вони не є альтернативою фармакологічного лікування.
Коментар робочої групи
Вказані в настанові психологічні інтервенції та наведені нижче психотерапевтичні та психосоціальні заходи у хворих, які страждають на епілепсію, проводяться лікарем медичним психологом та/або лікарем-психотерапевтом.
Питання про вибір варіанта групи чи індивідуальної психотерапії вирішує психотерапевт після консультацій з ведучим лікарем (невролог, психіатр).
При різних формах психічних та поведінкових розладів, що спостерігаються у хворих на епілепсію, диференційовано застосовуються наступні психотерапевтичні та психосоціальні заходи.
Психотерапія в комплексному лікуванні застосовується у формі раціональної психотерапії (РП), когнітивно-біхевіоральної психотерапії (КБТ) та сімейної психотерапії (СП). Всі форми психотерапевтичного впливу призначаються як індивідуально, так і в груповому варіанті.
РП базується на використанні здібностей пацієнта проводити зіставлення, робити висновки та доводити їх обґрунтованість. Зміни дезадаптивних уявлень пацієнта досягаються певними засобами, основою яких є логічна аргументація. РП проводиться індивідуально, 2–5 разів на тиждень в амбулаторних або стаціонарних умовах. Тривалість курсу лікування є індивідуальною.
КБТ сприяє підвищенню самоконтролю та тренінгу реакцій пристосування до складних життєвих ситуацій. Основою технік КБТ є моделювання складних ситуацій. КБТ проводиться як індивідуально, так й в групі, 2–3 рази на тиждень, в амбулаторних або стаціонарних умовах. Тривалість курсу лікування визначається індивідуально.
СП спрямована на корекцію міжособистісних відносин родини та відтворення її емоційного клімату, що сприяє оптимальному виконанню соціальних ролей (з урахуванням захворювання одного з її членів). Техніки СП базуються на діагностиці сімейного конфлікту чи фрустраційних ситуацій, спрямовані на їх усунення та реконструкцію відносин. СП здійснюється як в амбулаторних умовах, так й в умовах стаціонару. Частота сеансів та тривалість курсу терапії визначаються у кожному випадку індивідуально.
Особливою формою психолого-психологічного впливу є психосоціальні тренінги (ПСТ), які належать до компетенції лікаря-психотерапевта, лікаря-психолога та практичного психолога.
Психосоціальні тренінги (ПСТ) спрямовані на формування/відновлення недостатніх/втрачених внаслідок хвороби когнітивних, мотиваційних, емоційних ресурсів особистості, навичок, знань та вмінь взаємодіяти, вирішувати проблеми, використовувати стратегії оволодіння у хворих з порушенням соціальної адаптації, що забезпечує їх інтеграцію у суспільство. Для осіб з психічними та поведінковими розладами при епілепсії найбільшої значущості набувають тренінги проблем міжособистісної взаємодії та когнітивних функцій. Тренінги проводяться 2–3 рази на тиждень в групі в амбулаторних або стаціонарних умовах. Тривалість застосування тренінгів визначається індивідуально.
1.12. Кетогенна дієта.
1.12.1. Слід направляти дітей та молодих людей, які страждають на епілепсію та у яких припадки не піддаються впливу належних ПЕП, на консультацію спеціаліста з лікування епілепсії у дітей з метою розгляду можливості застосування кетогенної дієти. [нова редакція 2012]
1.13. Стимуляція блукаючого нерва (СБН).
1.13.1. Стимуляцію блукаючого нерва призначають в якості додаткової терапії з метою зниження частоти нападів у дорослих, які є несприйнятливими до протиепілептичних лікарських засобів, але які не є кандидатами для проведення резекційного хірургічного втручання. Це стосується дорослих, у яких епілептичні порушення проявляються переважно фокальними нападами (з вторинною генералізацією або без неї) або генералізованими нападами.
1.13.2. Стимуляцію блукаючого нерва призначають в якості додаткової терапії з метою зниження частоти нападів у дітей та підлітків, які є несприйнятливими до протиепілептичних лікарських засобів, але які не є кандидатами для проведення резекційного хірургічного втручання. Це стосується дітей та молодих людей, у яких епілептичні порушення проявляються переважно фокальними нападами (з вторинною генералізацією або без неї) або генералізованими нападами.
1.14. Пролонговані або рецидивуючі напади та конвульсивний епілептичний статус.
1.14.1. Лікування першої лінії у дітей, підлітків та дорослих, які страждають на пролонговані або рецидивуючі генералізовані, конвульсивні (тоніко–клонічні, тонічні або клонічні) напади, на догоспітальному етапі.
1.14.1.1. Слід надавати невідкладну медичну допомогу та лікування дітям, молодим людям та дорослим, які страждають на пролонговані (що тривають 5 хвилин або довше) або рецидивуючі (три або більше за годину) конвульсивні судоми, на догоспітальному етапі.
1.14.1.2. Доцільно призначати лише мідазолам трансбукально або діазепам ректально для застосування на догоспітальному етапі у дітей, підлітків та дорослих, які вже мали раніше епізод пролонгованих або серійних конвульсивних нападів.
1.14.1.3. Доцільне застосовання мідазоламу транс–букально як лікування першої лінії у дітей, підлітків та дорослих, які страждають на пролонговані або рецидивуючі напади, на догоспітальному етапі. Також у якості препарату першої лінії вибору можливе застосовання діазепаму ректально, його також доцільно використовувати, якщо мідазолам трансбукально не є доступним. Якщо є внутрішньовенний доступ та реанімаційне обладнання, доцільне застосовання лоразепаму внутрішньовенно.
1.14.1.4. Лікування має проводитися підготовленим клінічним персоналом, або, якщо є спеціальні інструкції, які було складено спеціалістом, догоспітальна допомога може бути надана членами родини хворого або особами, які ним опікуються, за умови їх належної підготовки.
1.14.1.5. Слід приділити увагу тому, щоб забезпечити прохідність дихальних шляхів дитини, підлітка або дорослого та оцінювати його/її респіраторну та серцеву функцію.
1.14.1.6. Залежно від реакції на лікування, особистої клінічної ситуації пацієнта та при наявності індивідуальних особливостей спостереження конкретного хворого слід викликати швидку медичну допомогу, зокрема якщо:
— напад триває протягом 5 хвилин після застосування препарату невідкладної допомоги;
— в анамнезі хворого наявні часті епізоди серійних нападів, або він/вона має на теперішній час або в анамнезі конвульсивний епілептичний статус, або даний епізод є першим, що вимагає застосування лікарського препарату невідкладної допомоги, або
— є занепокоєння з приводу стану пацієнта, чи складно контролювати прохідність дихальних шляхів людини, дихання, кровообіг або інші життєво важливі функції.
1.14.2. Лікування дітей, підлітків та дорослих з конвульсивним епілептичним статусом в умовах стаціонару.
Конвульсивний епілептичний статус
1.14.2.1. У дітей, підлітків та дорослих з наявними генералізованими тоніко-клонічними нападами (конвульсивний епілептичний статус), які знаходяться у лікарні, слід негайно:
— забезпечити прохідність дихальних шляхів;
— дати кисень у високій концентрації;
— оцінити серцеву та дихальну функції;
— перевірити рівні глюкози у крові та
— забезпечити внутрішньовенний доступ до великої вени. Див. також протоколи, що запропоновано у додатку F.
1.14.2.2. Застосовують лоразепам внутрішньовенно як лікування першої лінії в умовах лікарні у дітей, підлітків та дорослих з наявними генералізованим тоніко-клонічними нападами (конвульсивний епілептичний статус). Застосовують діазепам внутрішньовенно, якщо неможливе внутрішньовенне введення лоразепаму, або мідазолам трансбукально, якщо неможливо забезпечити негайний доступ для внутрішньовенного введення. Застосовують максимум дві дози лікарського препарату першої лінії (із урахуванням амбулаторної допомоги).
Див. також протоколи, що запропоновано у додатку F.
1.14.2.3. У разі, якщо напади тривають, застосовують внутрішньовенно фенобарбітал або фенітоїн як лікування другої лінії в умовах стаціонару у дітей, підлітків та дорослих з наявними генералізованими тоніко-клонічними судомами (конвульсивним епілептичним статусом). Див. також протоколи, що запропоновано у додатку F.
Рефрактерний конвульсивний епілептичний статус
1.14.2.4. Дотримуються протоколів, що запропоновано у додатку F, для лікування рефрактерного конвульсивного епілептичного статусу при наданні вторинної медичної допомоги.
1.14.2.5. Застосовують внутрішньовенно мідазолам, пропофол або тіопентал натрію для лікування дорослих з рефрактерним конвульсивним епілептичним статусом. Адекватний моніторинг, в тому числі рівнів ПЕП у крові, та підтримання систем життєзабезпечення є необхідними. Див. також протоколи, що запропоновано у додатку F.
1.14.2.6. Застосовують внутрішньовенно мідазолам або тіопентал натрію для лікування дітей та підлітків з рефрактерним конвульсивним епілептичним статусом. Адекватний моніторинг, в тому числі рівнів ПЕП у крові, та підтримання систем життєзабезпечення є необхідними. Див. також протоколи, що запропоновано у додатку F.
1.14.2.7. При проведенні подальшого лікування слід залучити до курації хворого анестезіолога/реаніматолога.
1.14.2.8. При необхідності застосування всього протоколу лікування конвульсивного епілептичного статусу та/або необхідності інтенсивної терапії слід одержати спеціалізовану консультацію відповідного фахівця.
1.14.2.9. Регулярний прийом ПЕП слід продовжувати в оптимальних дозах, та необхідно встановити причини епілептичного статусу.
1.14.2.10. Індивідуальне лікування має бути розроблено для дітей, підлітків та дорослих, які мають рецидивуючий конвульсивний епілептичний статус.
1.14.3. Неконвульсивний епілептичний статус.
1.14.3.1. Неконвульсивний епілептичний статус не є розповсюдженим, та його контроль є менш невідкладним. Протоколи, що пропонуються, можна знайти у додатку F.
Коментар робочої групи
Епілептичний статус — це велика медична проблема, з якою часто зіштовхуються у відділеннях швидкої невідкладної допомоги та інтенсивної терапії. В популяційних дослідженнях у США показана частота розвитку епілептичного статусу до 50 чоловік на 100 000 громадян щороку, що означає всього близько 150 000 випадків. Помилки в діагностиці й лікуванні епілептичного статусу приведуть до високої інвалідизації та смертності.
(ILAE, 2007) визначає наступні невирішені питання вибору терапії епілептичного статусу.
Питання вибору терапії епілептичного статусу визначається недоліком рандомізованих контрольованих досліджень. Крім того, у доступному для огляду майбутньому немає підстав сподіватися на проведення рандомізованих контрольованих досліджень у цій області внаслідок малоймовірного їхнього субсидування з боку великих фармацевтичних фірм, а також неможливості одержання згоди на участь у них з боку пацієнта, що перебуває у важкому стані.
Відсутність стандартизованого підходу до застосування тих або інших інфузійних протиепілептичних препаратів, розходження в питаннях їхнього ліцензування в різних країнах Європи, а також безпідставна зміна спеціалізованих протоколів у цілому впливає на успішність лікування ЕС.
Існує кілька визначень епілептичного статусу.
(ILAE, 1989) визначає епілептичний статус (Status epilepticus, SE) як «стійкий епілептичний стан» з повторюваними або безперервними нападами, які тривають більше 30 хвилин, або між якими хворий не може повністю досягти свого нормального психічного й неврологічного стану.
Найбільш адекватним для застосування у клінічній практиці представляється визначення В.А. Карлова: «Епілептичний статус (ЕС) визначається як стан, при якому епілептичні напади настільки часті та/або тривалі, що формується стабільно і якісно інший епілептичний стан. При ЕС кожний наступний напад виникає раніше, ніж хворий повністю вийшов з попереднього нападу, тобто в нього залишаються виражені порушення свідомості, гемодинаміки, подиху або гомеостазу» (Карлов В.А., 2006).
Згідно з МКХ-10, епілептичний статус класифікують у такий спосіб:
G41 Епілептичний статус
G41.0 Епілептичний статус grand mal (судомних нападів) (Виключено: епілепсія парціальна безперервна [Кожевникова] (G40.5))
G41.1 Епілептичний статус petit mal (малих нападів)
G41.2 Складний парціальний епілептичний статус
G41.8 Інший уточнений епілептичний статус
G41.9 Епілептичний статус неуточнений
Використовуючи електроклінічні характеристики, епілептичний статус можна класифікувати просто за наявності судом (судомний епілептичний статус) або їхній відсутності (безсудомний епілептичний статус). Далі їх можна підрозділяти на епілептичний статус із залученням усього тіла (генералізований епілептичний статус) або тільки частини тіла (парціальний епілептичний статус). Таким чином, ЕС може бути генералізований судомний (тоніко-клонічний ЕС), генералізований безсудомний (абсансні, міоклонічні напади), парціальний судомний (прості парціальні рухові напади) або парціальний безсудомний (складні парціальні напади). Точна діагностика типу ЕС необхідна, тому що від цього залежить лікування.
Судомий тоніко-клонічний ЕС. Напади характеризуються втратою свідомості, тоніко-клоничою м’язовою активністю, биттям язика й нетриманням сили. Однак важливо розуміти, що тому що тривалість нападів наростає, судомна активність може ставати менш помітною, наприклад, тільки посмикування повік, незва–жаючи на триваючу електричну судомну активність.
Безсудомний ЕС. До клінічних характеристик належать притуплення свідомості, що може змінюватися, ажитація, ненормальні рухи очей (включаючи відхилення очних яблук і ністагм), афазія й ненормальне положення кінцівок. Недостатня специфічність клінічних симптомів відбита в тому, що не існує загальноприйнятої класифікації безсудомного ЕС.
Статус парціальних нападів. Характеризується повторюваними парціальними припадками простими або комплексними, часто з порушенням свідомості. У міру збільшення тривалості ЕС стирається чітка клінічна картина припадку й наростає загальномозкова симптоматика.
Епілептичний статус — це синдром, що може зустрітися не тільки при епілепсії, а також при різних захворюваннях головного мозку та системних захворювань організму в цілому:
— епілепсія (як правило, до епілептичного статусу веде порушення регулярності прийому антиепілептичних препаратів);
— черепно-мозкова травма;
— пухлина або інше об’ємне утворення мозку;
— запальні захворювання мозку і його оболонок;
— гостре порушення мозкового кровообігу;
— рубцово-спайкові порушення церебральної ліквородинаміки;
— дисметаболічні стани (алкогольна абстиненція, діабет, порфірія, гостра надниркова або тиреоїдна недостатність, уремія, еклампсія, гостра гіпоглікемія й ін.);
— отруєння;
— загальні інфекції, особливо з важкою інтоксикацією і гіпертермією.
Епілептичний статус — це гострий стан, що має потребу у швидкому й інтенсивному лікуванні з метою запобігання нейрональному ушкодженню й системним ускладненням. Помилки в діагностиці й лікуванні епілептичного статусу можуть привести до високої інвалідизації та смертності. Декомпенсація мозкового метаболізму відбувається приблизно через 30 хвилин неконтрольованої судомної активності, і цим строком обмежується терапевтичне вікно. Лікування повинне мати одночасно чотири напрямки: припинення нападів, запобігання повторним нападам, усунення причин статусу, лікування ускладнень.
(ILAE, 2007) пропонує наступні рекомендації для загального лікувального протоколу
1. Необхідне проведення повного комплексу невідкладних заходів. При епілептичному статусі нормальне функціонування серцево–судинної системи найбільш часто ставиться під загрозу і, отже, має потребу в діагностичній і терапевтичній підтримці (особливо при розвитку ускладнень). Паралельно із проведенням специфічної протисудомної терапії повинні в повному обсязі проводитися загальноклінічні рутинні методи дослідження.
2. Дослідження, необхідні для з’ясування причин розвитку ЕС, необхідно проводити без затримки ініціальної терапії.
3. Інфузійну протисудомну терапію доцільно переважно проводити на госпітальному етапі (у зв’язку з наявністю обладнання для реанімаційних заходів) і вкрай небажано на догоспітальному. В останньому випадку використовуються альтернативні форми протисудомних препаратів (інтраназальний або букальний мідазолам, ректальна форма діазепаму).
4. Існують клінічно обґрунтовані свідчення про те, що раннє введення бензодіазепінів (у достатній дозі) є кращим при лікуванні ЕС на ранній стадії (1-ша стадія). Є принаймні одне рандомізоване дослідження та метааналіз, що свідчать, що застосування лоразепаму при ЕС трохи ефективніше діазепаму. При необхідності введення бензодіазепінів проводиться повторно (через 5–10 хвилин).
5. Якщо терапія бензодіазепінами не дає контролю за судомним синдромом, варто зробити висновок про настання 2-ї стадії ЕС, що вимагає негайного проведення інфузійної протисудомної терапії. При цьому найбільш доцільно використовувати фенітоїн або фенобарбітал, однак існують і альтернативні препарати.
6. Якщо лікування в стадії розгорнутого ЕС є неефективним, необхідно констатувати перехід в 3-тю стадію — стадію резистентного ЕС із негайним призначенням внутрішньовенного наркозу. Він не проводиться при альтернативному лікуванні в стадії розгорнутого ЕС і при відсутності необхідних умов і ресурсів. Анестезія нерідко може тривати протягом тривалого періоду (від декількох днів до декількох тижнів). Пацієнтам у стадії резистентного ЕС, яким проводиться внутрішньовенний наркоз, необхідне проведення ЕЕГ-моніторингу.
7. У випадку призначення парентеральної протисудомної терапії пацієнтам у всіх стадіях епілептичного статусу повинен проводитися ретельний контроль кардіореспіраторних функцій.
8. У випадку епілептичного статусу, що розвився внаслідок скасування/скорочення дози протисудомного препарату (у пацієнтів, що страждають на епілепсію), препарат необхідно повторно призначити в інфузивній формі (по можливості).
9. У випадку ЕС, що розвився після нейрохірургічного втручання, повинні бути проведені негайна інтубація та внутрішньовенний наркоз, що дозволить знизити ризик несприятливого результату.
З урахуванням реєстрації препаратів в Україні запропонований (ILAE, 2007) алгоритм терапії епілептичного статусу виконати неможливо, тому робочою групою пропонуєтся наступний:
• Терапії раннього ЕС:
— Діазепам 20 мг (4 мл 0,5% розчину) внутрішньо-венно.
— Можливе застосування осмотичних діуретиків.
• Лікування на стадії розгорнутого ЕС:
— Діазепам до 40 мг (8 мл 0,5% розчину).
— Вальпроєва кислота до 1500 мг внутрішньовенно краплинно (струминно не більше 500 мг).
— Можливе застосування осмотичних діуретиків та інших протинабрякових засобів.
— Можливе застосування нейропротекторів.
— При необхідності — профілактика кардіореспіраторних, автономних, метаболічних і системних ускладнень.
• Лікування на стадії резистентного ЕС:
— Проводиться внутрішньовенний наркоз, бажано з виконанням повторної ЕЕГ або ЕЕГ-відеомоніторингу. Найбільш часто використовуваними препаратами є пропофол або тіопентал, однак порівняльні рандомізовані дослідження, здатні оцінити ефективність даних препаратів, не проводилися. Рідше використовуються засоби для інгаляційного наркозу.
— Діазепам до 60 мг (12 мол 0,5% розчину) у добу.
— Вальпроєва кислота до 4000 мг у добу внутрішньовенно краплинно (струминно не більше 500 мг однократно).
— Застосування осмотичних діуретиків і інших протинабрякових засобів.
— Застосування нейропротекторів.
— Профілактика й лікування кардіореспіраторних, автономних, метаболічних і системних ускладнень.
— Можливе застосування гіпотермії.
Слід відзначити, що найбільш частими причинами неефективності проведеної терапії епілептичного статусу, на думку експертів, є:
— передозування препаратів у стадії розгорнутого ЕС;
— зневажання підтримуючої терапії; тривалість дії препаратів невідкладної терапії (лоразепаму, фенітоїну або фенобарбіталу) становлять близько 12 годин; при відсутності підтримуючої протисудомної терапії ЕС нерідко відновлюється;
— діагностичні помилки, особливо делірій із психогенним неепілептичним статусом, медикаментозно обумовлена або метаболічна енцефалопатія;
— відсутність етіологічного підходу або врахування вторинних ускладнень при терапії ЕС;
— на адекватність вибору протисудомної терапії було визнано вплив таких факторів, як коморбідний фон, вік і варіант епілептичного синдрому, що не завжди враховуєтся.
1.15. Жінки та дівчата, які страждають на епілепсію.
1.15.1. Інформація та поради для жінок та дівчат, які страждають на епілепсію.
1.15.1.1. З метою забезпечення можливості прийняття обґрунтованих рішень, здійснення вибору та зменшення ймовірності виникнення непорозумінь жінки та дівчата, які страждають на епілепсію, та за необхідності їх партнери повинні отримувати точну інформацію та консультацію щодо контрацепції, зачаття, вагітності, догляду за дітьми, годування груддю та менопаузи.
1.15.1.2. Інформацію про контрацепцію, зачаття, вагітність або менопаузу слід надавати жінкам та дівчатам до початку статевого життя, вагітності або менопаузи, окрім того, ця інформація повинна бути пристосована до їх індивідуальних потреб. Зазначену інформацію слід також надавати в разі необхідності людям, які тісно пов’язані з жінками та дівчатами, що страждають на епілепсію. До них можуть відноситись члени їх родини та/або особи, які ними опікуються.
1.15.1.3. Всі медичні працівники, які забезпечують лікування, догляд або підтримку жінок та дівчат, які страждають на епілепсію, повинні володіти відповідною інформацією та бути адекватно підготовані для надання такої консультації.
1.15.1.4. Слід обговорювати з жінками та дівчатами, які є здатними до дітонародження (включаючи молодих дівчат, які ймовірно будуть потребувати лікування в дітородному віці), та їх батьками та/або особами, які ними опікуються, ризик застосування ПЕП, що призводять до виникнення вад розвитку та можливих порушень нервової системи у майбутньої дитини. Потрібно оцінити ризики та користь від лікування за допомогою окремих препаратів. Існують обмежені дані щодо ризиків для майбутньої дитини, які пов’язані із застосуванням нових препаратів. Особливої уваги вимагає обговорення ризиків тривалого застосування натрію вальпроату для майбутньої дитини, враховуючи, що більш високі дози натрію вальпроату (більше ніж 800 мг/день) та політерапія, зокрема, із застосуванням натрію вальпроату, пов’язані з більш високим ризиком.
1.15.1.5. Слід брати до уваги останні данні про ризики для майбутньої дитини, пов’язані з терапією із застосуванням ПЕП, коли призначається лікування жінкам та дівчатам з нинішньою або майбутньою здатністю до дітонародження.
1.15.1.6. Усім жінкам та дівчатам, які приймають ПЕП, повинне бути запропоновано вживання 5 мг фолієвої кислоти на день перед будь-якою можливістю вагітності.
1.15.1.7. Для надання індивідуальних порад щодо взаємодії між ПЕП та засобами гормональної замісної терапії та контрацепції доцільно звертатись до Підсумкової характеристики продукту (Summary of Product Characteristics — SPC) та Британського національного формуляру (British National Formulary — BNF) (що наявні на сайті http://bnf.org).
1.15.2. Контрацепція.
1.15.2.1. З жінками, які здатні до дітонародження, слід обговорювати можливість взаємодії ПЕП з пероральними контрацептивами та оцінити ризик та користь від лікування за допомогою окремих препаратів.
1.15.2.2. З дівчатами, які здатні до дітонародження, у тому числі з молодими дівчатами, які ймовірно потребуватимуть лікування в дітородному віці, та/або особами, які ними опікуються, слід обговорювати можливість взаємодії ПЕП з пероральними контрацептивами та оцінювати ризик та користь від лікування за допомогою окремих препаратів.
1.15.2.3. З жінками та дівчатами, які здатні до дітонародження, слід обговорювати ризик та користь від застосування різних методів контрацепції, у тому числі внутрішньоматкової системи вивільнення гормонів.
1.15.2.4. У разі, якщо жінка або дівчина, яка приймає ПЕП, що індукують ферменти, обирає застосування комбінованих пероральних контрацептивних пігулок, вона повинна отримати рекомендацію щодо дозування згідно з Підсумковою характеристикою продукту (Summary of Product Characteristics — SPC) та поточним виданням Британського національного формуляру (British National Formulary — BNF) (що наявні на сайті http://bnf.org).
1.15.2.5. Пігулки, що містять тільки прогестаген, не рекомендуються до застосування у якості надійного методу контрацепції у жінок та дівчат, які приймають ПЕП, що індукують ферменти.
1.15.2.6. Імплантат з прогестагеном не рекомендується до застосування у жінок та дівчат, які приймають ПЕП, що індукують ферменти.
1.15.2.7. Можливість застосування додаткових бар’єрних методів слід обговорювати з жінками та дівчатами, які приймають ПЕП, що індукують ферменти, і пероральні контрацептиви або яким проводять ін’єкції прогестагену пролонгованої дії.
1.5.2.8. За необхідності проведення екстреної контрацепції жінкам або дівчатам, які приймають ПЕП, що індукують ферменти, тип та дози екстреного контрацептиву повинні узгоджуватись з Підсумковою характеристикою продукту (Summary of Product Characteristics — SPC) та поточним виданням Британського національного формуляру (British National Formulary — BNF) (що наявні на сайті http://bnf.org).
1.15.2.9. Слід доводити до відома жінок та дівчат, які приймають ламотриджин, що одночасне застосування будь-якого контрацептиву на основі естрогену може призвести до значного зниження рівня ламотриджину та спричинити втрату контролю за нападами. У тому випадку, коли жінка або дівчина починає або припиняє застосування цих контрацептивів, може бути потрібне коригування дози ламотриджину.
1.15.3. Вагітність.
1.15.3.1. Жінки та дівчата, які страждають на епілепсію, мають потребу у точній інформації під час вагітності; слід обговорювати можливість епілептичного статусу та раптової несподіваної смерті при епілепсії зі всіма жінками та дівчатами, які планують припинити терапію із застосування ПЕП (див. розділ 1.9.18).
1.15.3.2. Всіх вагітних жінок та дівчат, які страждають на епілепсію, слід заохочувати повідомляти про власну вагітність або дозволити своєму лікарю повідомити про вагітність до Реєстру епілепсії та вагітності Сполученого Королівства (www.epilepsyandpregnancy.co.uk).
1.15.3.3. Лікар повинен обговорювати з жінкою або дівчиною відносну користь та ризик коригування прийому лікарських препаратів (ПЕП) для того, щоб вона мала змогу прийняти обґрунтоване рішення. У разі необхідності спеціаліст, що лікує жінку або дівчину, повинен отримати додаткову консультацію висококваліфікованого фахівця.
1.15.3.4. Жінки або дівчата, які страждають на генералізовані тоніко-клонічні напади, повинні бути проінформовані про те, що плід має відносно вищий відносний ризик ушкоджень під час нападів, хоча абсолютний ризик лишається дуже низьким, та рівень ризику може залежати від частоти розвитку нападів.
1.15.3.5. Жінки та дівчата повинні бути запевнені в тому, що відсутні жодні докази того, що фокальні, абсансні та міоклонічні напади впливають на вагітність або чинять несприятливу дію на плід, окрім випадків падіння та отримання пошкодження.
1.15.3.6. Жінки та дівчата повинні бути запевнені в тому, що підвищення частоти нападів є, як правило, малоймовірним під час вагітності або протягом перших декількох місяців після народження.
1.15.3.7. У більшості випадків жінки та дівчата повинні бути запевнені в тому, що ризик розвитку тоніко-клонічних судом під час пологів та протягом 24 годин після народження є низьким (1–4 %).
1.15.3.8. Жінки та дівчата, що страждають на епілепсію, повинні бути проінформовані про те, що хоча вони, ймовірно, будуть мати здорову вагітність, ризик виникнення ускладнень під час вагітності та пологів є вищим, ніж у жінок та дівчат, які не страждають на епілепсію.
1.15.3.9. Догляд за вагітними жінками та дівчатами має проводитися акушером та спеціалістом з питань епілепсії.
1.15.3.10. Вагітним жінкам та дівчатам, які приймають ПЕП, слід запропонувати проходження ультразвукового дослідження з високою роздільною здатністю для скринінгового виявлення структурних аномалій. Зазначене дослідження повинне проводитися у термін 18–20 тижнів спеціалістом УЗД, який має відповідну підготовку, проте більш раннє дослі–дження може дозволити скоріше виявити основні вади розвитку.
1.15.3.11. Ризик виникнення судом під час пологів є низьким, проте існує достатньо підстав для рекомендації проведення пологів у акушерському відділенні з оснащенням для реанімації матері та новонародженого та лікування судом матері.
1.15.3.12. Всім дітям, народженим від матерів, які приймали ПЕП, що індукують ферменти, слід вводити 1 мг вітаміну K парентерально під час пологів.
1.15.3.13. Слід розглядати можливість генетичного консультування, якщо один із партнерів страждає на епілепсію, зокрема у разі, якщо партнер страждає на ідіопатичну епілепсію та має позитивний сімейний анамнез епілепсії.
1.15.3.14. Хоча існує підвищений ризик нападів у дітей, батьки яких страждають на епілепсію, дітям, підліткам та дорослим слід надавати інформацію про те, що ймовірність ураження дитини є, як правило, низькою. Однак це буде залежати від сімейного анамнезу.
1.15.3.15. Попереднє планування курації таких вагітних, включаючи розробку індивідуальних протоколів медичного догляду, повинне здійснюватись у акушерських відділеннях, що приймають пологи у жінок та дівчат, які страждають на епілепсію.
1.15.3.16. Поєднання епілептологічних та акушерських клінік може бути дотепним рішенням як для вагітних жінок, хворих на епілепсію, так і для медичних працівників, проте існує недостатньо доказових даних про їх клінічну доцільність для того, щоб рекомендувати їх широке впровадження.
1.15.3.17. Однак важливе значення для адекватного регулярного нагляду вагітної, планування пологів має тісний зв’язок між спеціалістом–епілептологом або командою, що спостерігає за хворим на епілепсію, та акушером-гінекологом або медичною сестрою-акушеркою.
1.15.3.18. Потрібно намагатися звільнити пацієнтку від нападів до зачаття і під час вагітності (особливо жінок та дівчат, які страждають на генералізовані тоніко-клонічні судоми), проте враховувати ризик побічних ефектів від застосування ПЕП та використовувати найнижчу ефективну дозу кожного ПЕП, уникаючи застосування політерапії, якщо це можливо.
1.15.3.19. Не слід постійно відстежувати рівень ПЕП під час вагітності. У разі, якщо частота судом збільшується або існує ймовірність її збільшення, спостереження за рівнями ПЕП (зокрема рівнями ламотриджину та фенітоїну, які у першу чергу можуть зазнавати змін під час вагітності) може бути корисним для коригування дози.
1.15.4. Годування груддю.
1.15.4.1. Всіх жінок та дівчат, що страждають на епілепсію, слід заохочувати годувати груддю, за винятком дуже рідкісних обставин. Годування груддю для більшості жінок та дівчат, які приймають ПЕП, є, як правило, безпечним та повинно заохочуватися. Однак кожна мати повинна мати та отримувати повну інформаційну підтримку під час вибору способу годування та вільну можливість вибору годування немовля, що найкраще підходить їй та її родині.
1.15.4.2. Лікарям, які призначають ПЕП жінкам та дівчатам, які годують груддю, слід звернутися за індивідуальною консультацією з приводу застосування ліків до Підсумкової характеристики продукту (Summary of Product Characteristics — SPC) та Британського національного формуляру (British National Formulary — BNF) (що наявні на сайті http://bnf.org). Рішення щодо терапії із застосуванням ПЕП та годування груддю повинно бути узгоджене між жінкою або дівчиною та спеціалістом, що призначає ПЕП, та ґрунтуватися на співвідношенні ризику та користі від годування груддю у зіставленні з потенційними ризиками впливу лікарського препарату на дитину.
1.15.5. Після народження.
1.15.5.1. Батьки новонароджених дітей або дітей молодшого віку повинні бути проінформовані про те, що запровадження низки простих заходів безпеки може значно зменшити ризик небезпеки для дитини у зв’язку з розвитком нападу та мінімізувати занепокоєння батьків перед таким інцидентом. Найбільш доцільно таку інформацію надавати перед пологами, це буде ідеальною можливістю для того, щоб спільно з батьками розробити та обміркувати найкращі та найбільш соціально сприятливі засоби для максимальної безпеки матері та дитини.
1.15.5.2. Всім пацієнтам слід надавати інформацію щодо заходів безпеки, які потрібно запровадити під час догляду та состереження за дитиною (див. додаток D повних рекомендацій).
1.15.5.3. Батьків слід запевнити в тому, що ризик травми немовляти через судоми матері є низьким.
Коментар робочої групи
Актуальність проблеми ведення вагітності та пологів у хворих на епілепсію жінок обумовлена тим, що, з одного боку, напади (особливо судомні) можуть бути симптомом пре- і еклампсії, одного із найнебезпечніших ускладнень вагітності. З іншого боку, такі ускладнення епілепсії, як серія епілептичних нападів, епілептичний статус, синдром раптової смерті, що може зустрічатися як поодинокий випадок, вимагають ургентної терапії й обумовлюють значний відсоток летальності у даній когорті хворих. У вагітних зазначені вище фактори можуть стати також однієї із причин загибелі плода.
Зросла доступність для населення різноманітної інформації, що стосуєтся впровадження нових протиепілептичних препаратів, що істотно поліпшують якість життя хворих, а також забезпеченість сучасним медичним обладнанням, що дозволяє відслідковувати комплекс об’єктивних показників розвитку вагітності та стан плоду, привели до того, що усе більше жінок, хворих на епілепсію, хочуть мати дітей.
Спектр питань, які доводиться вирішувати лікареві під час вагітності у хворих на епілепсію, надзвичайно широкий. Найбільш важливі серед них наступні: яким буде результат взаємовпливу епілепсії й вагітності; особливості ведення пологів; прогноз народження здорової дитини, імовірність розвитку в неї епілепсії. Окрім цих питань ще багато питань і труднощів виникають у лікарів при визначенні тактики ведення вагітності у хворих на епілепсію.
Основна мета консультування перед можливою вагітністю — забезпечення повної поінформованості жінки, що страждає епілепсією й планує дітородіння, про всі фактори ризику, наявні при даному захворюванні як для неї самої, так і для дитини, про переваги, недоліки й можливі ускладнення протиепілептичного лікування, що проводиться, для того, щоб вона змогла самостійно ухвалити рішення щодо можливості або збереження вже наявної вагітності.
Стратегія ведення вагітності ґрунтується на припущенні про те, що напади, особливо судомні, є більш небезпечними для матері та плода, ніж тератогенна дія протиепілептичних препаратів.
Згідно з узагальненими даними, погіршення клінічного перебігу епілепсії або збільшення частоти епілептичних нападів під час вагітності спостерігається приблизно у 8–46 % хворих. Вважають, що це пов’язане з порушенням режиму прийому протиепілептичних препаратів, розвитком токсикозу, неадекватним зниженням дози протиепілептичних препаратів, зниженням концентрацій препарату в плазмі крові під час вагітності (фенітоїну, карбамазепіну, фенобарбіталу, ламотри–джину), недосипанням, соматичною патологією, у тому числі змінами водно–електролітного балансу та цілою низкою інших чинників. У 5 % випадків відбувається зменшення частоти нападів, а в 49–87 % істотної зміни частоти нападів не відзначається.
При наявності ремісії до вагітності рецидив припадків найбільш імовірний у першому й другому триместрах. Тому важливим моментом є предгравідарна підготовка, у період якої необхідно:
— оптимізувати лікування до настання вагітності;
— при необхідності застосування АЕП використовувати монотерапію;
— вибирати найбільш ефективний препарат для даного типу нападів або синдрому епілепсії;
— досягти найбільшого терапевтичного ефекту при найменшій дозі АЕП.
З позицій доказовості основні положення й рекомендації з ведення вагітної, яка страждає на епілепсією, зводяться до наступного:
— не переходити на інший протиепілептичний препарат під час вагітності з єдиною метою — зменшити ризик тератогенної дії протиепілептичного препарату;
— корекція протиепілептичного лікування проводиться за клінічними показниками (залежно від частоти нападів);
— застосування протиепілептичних препаратів (особливо індукторів ензимів) підвищує ризик геморагічної хвороби немовлят. Тому мати протягом останнього місяця вагітності повинна приймати вітамін K у дозі 20 мг у день, а немовляті необхідно ввести 1 мг вітаміну відразу після народження однократно;
— якщо є можливість визначення концентрації протиепілептичних препаратів у крові під час вагітності, необхідно визначати концентрацію не пов’язаного з білком препарату до вагітності, на початку кожного триместру, на останньому місяці вагітності й додатково за клінічними показниками, а також протягом 8 тижнів після пологів.
— призначати фолиєву кислоту в дозі 5 мг у добу до кінця I триместру і далі протягом всієї вагітності по 0,4 мг у день.
Корекція дози препарату виходячи з рівня протиепілептичного препарату в крові:
— показання до збереження колишньої дози препарату: припадки добре контролюються, незважаючи на зниження загального рівня препарату в крові. Виключення становлять випадки, коли рівень вільного препарату знизився більше ніж на 30 %, і в анамнезі відзначаються погано контрольовані припадки [20];
— показання до зміни дози АЕП: зниження загального рівня препарату в крові більше ніж на 60 % (для вальпроату цей показник становить 75 %) або зниження рівня вільного препарату в пацієнтки без припадків на момент обстеження, якщо припадки відзначалися протягом року до настання вагітності.
1.16. Діти, молоді люди та дорослі з обмеженими можливостями до навчання (див. також розділи 1.15 та 1.17).
1.16.1. Діагностика (див. також розділ 1.5).
1.16.1.1. Діагностувати епілепсію у дітей, молодих людей та дорослих з обмеженими можливостями до навчання може бути важко, таким чином, потрібно докласти зусиль для отримання повної історії хвороби. Може бути важко відрізнити стереотипний та інші види поведінки від судомної активності. [2004]
1.16.1.2. Важливо мати свідоцтво очевидців у доповненні з підкріплюючими їх доказами (наприклад, відеозаписом), якщо це є можливим. [2004]
1.16.1.3. Ясне, об’єктивне свідчення має важливе значення. Свідкам може знадобитися навчання для того, щоб правильно описати власні спостереження. [2004]
1.16.1. Обстеження (див. також розділ 1.6).
1.16.1.1. Особи з обмеженими можливостями до навчання можуть потребувати особливого догляду та уваги для того, щоб переносити обстеження. [2004]
1.16.1.2. Повинні бути наявні засоби для проведення діагностичної візуалізації з анестезією у разі необхідності. [2004]
1.16.1.3. У дитини або молодої людини з епілепсією та обмеженими можливостями до навчання, потрібно проводити обстеження з метою визначення першопричини. [2004]
1.16.2. Ведення (див. також розділ 1.8).
1.16.2.1. Потрібно надати можливість дітям, молодим людям та дорослим з обмеженими можливостями до навчання та їх родині та/або особам, які ними опікуються, за необхідності приймати активну участь у розробці персоналізованого плану заходів із догляду з метою лікування їх епілепсії з урахуванням супутніх захворювань. [нова редакція 2012]
1.16.2.2. Потрібно забезпечити наявність достатнього часу для досягнення ефективного лікування епілепсії у дітей, молодих людей та дорослих з обмеженими можливостями до навчання. [нова редакція 2012]
1.16.2.3. При розробці плану заходів із догляду для дитини, молодої людини, або дорослого з обмеженими можливостями до навчання та епілепсією потрібно приділяти особливу увагу можливості виникнення побічних когнітивних та поведінкових ефектів від терапії із застосуванням ПЕП. [2004]
1.16.2.4. Протоколи щодо вибору лікування та важливості регулярного спостереження за ефективністю та переносимістю терапії є однаковими як для осіб з обмеженими можливостями до навчання, так і для загальної популяції. [2004]
1.16.2.5. Не слід проявляти дискримінацію по відношенню до дітей, молоді та дорослих з обмеженими можливостями до навчання та слід пропонувати їм те ж саме обслуговування, обстеження та лікування, як і загальній популяції. [нова редакція 2012]
1.16.2.6. Слід дослідити кожний варіант лікування дітей, молодих людей та дорослих, які страждають на епілепсію, за наявності чи відсутності обмежених можливостей до навчання. [2004]
1.16.2.7. Медичні робітники повинні бути інформовані про більш високі ризики смертності у дітей, молодих людей та дорослих з обмеженими можливостями до навчання та епілепсією та повинні обговорювати це з ними, їх родинами та/або особами, які ними опікуються. [2004]
1.16.2.8. У всіх дітей, молодих людей та дорослих, які страждають від епілепсії та обмежених можливостей до навчання, слід проводити оцінку ризику, до якого відноситься:
— прийняття ванни та душу;
— приготування їжі;
— користування електричними пристроями;
— контролювання тривалих або серійних судом;
— наслідки епілепсії у соціальному середовищі;
— раптова несподівана смерть при епілепсії;
— здатність до самостійного життя, у якому права дитини, молодої людини або дорослого збалансовані з роллю опікуна. [2004]
1.17. Підлітки, які страждають на епілепсію (див. також розділ 1.15).
1.18. Літні люди, які страждають на епілепсію.
1.18.1. Не слід проявляти дискримінацію щодо літніх людей та слід пропонувати їм те ж саме обслуговування, обстеження та лікування, як і загальній популяції. [нова редакція 2012]
1.18.2. Приділяйте особливу увагу питанням фармакокінетики та фармакодинаміки за умов поліпрагмазії та супутніх захворювань у літніх людей, які страждають на епілепсію. Розглядайте можливість застосування більш низьких доз ПЕП та при застосуванні карбамазепіну пропонуйте застосування препаратів карбамазепіну з контрольованим вивільненням. [нова редакція 2012]
1.19. Діти, молоді люди та дорослі з етнічних груп темношкірого населення та національних меншин.
1.19.1. Діти, молоді люди та дорослі з етнічних груп темношкірого населення та національних меншин можуть мати інші культурні та комунікаційні потреби, які повинні враховуватись під час діагностики та лікування. Необхідність перекладу слід враховувати разом з іншими засобами забезпечення того, щоб потреби особи задовольнялись належним чином. [2004]
1.19.2. Перекладач повинен володіти як культурними, так і медичними знаннями. Перекладачі, що належать до родини, як правило, не підходять через такі питання, як конфіденційність, особиста таємниця, особиста гідність та точність перекладу. [2004]
1.19.3. Інформація, у тому числі інформація про трудові права та керування автомобілем, повинна надаватися у належному форматі або за допомогою інших належних засобів дітям, молодим людям та дорослим, які не говорять або не читають англійською. [2004]
Додаток Е. Фармакологічне лікування
Представлені нижче таблиці надають зведену інформацію щодо фармакологічного лікування. Вони були оновлені у 2011 році. Деталі ліцензування наведені під таблицею 3. Препарати розміщені за алфавітом.