Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Особенности формирования токсемии у больных с патологией гепатопанкреатодуоденальной зоны
Авторы: Кагличенко В.В. - Национальный медицинский университет им. А.А. Богомольца, г. Киев; Шейман Б.С. - ГП «Научный центр превентивной токсикологии, пищевой и химической безопасности имени академика Л.И. Медведя МЗ Украины», г. Киев; Национальная детская специализированная больница «Охматдет» МЗ Украины, г. Киев; Осадчая О.И. - Институт гематологии и трансфузиологии НАМН Украины, г. Киев
Рубрики: Медицина неотложных состояний, Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
В работе представлены результаты исследований параметров эндотоксикоза у пациентов с заболеваниями органов гепатопанкреатодуоденальной зоны. Продемонстрированы особенности развития и формирования токсемии, процессы распределения токсинов в кровяном русле, прочность их связи с токсиннесущими фракциями плазмы крови. На основании полученных данных сделаны выводы об особенностях формирования токсемии у больных.
У роботі наведено результати досліджень параметрів ендотоксикозу в пацієнтів із захворюваннями органів гепатопанкреатодуоденальної зони. Продемонстровано особливості розвитку та формування токсемії, процеси розподілу токсинів у кров’яному руслі, міцність їх зв’язку з токсиннесучими фракціями плазми крові. На підставі отриманих даних зроблено висновки про особливості формування токсемії у хворих.
The article presents results of studies of endotoxemia parameters in patients with diseases of the hepatopancreatoduodenal zone. Features of the development and formation of toxemia, processes of toxin distribution in the bloodstream, the strength of their relationship with toxin-containing blood plasma fractions are shown. Based on the data conclusions about the features of the formation of toxemia in patients were made.
болезни органов гепатопанкреатодуоденальной зоны, эндотоксикоз, особенности развития, распределение токсинов в кровяном русле, детоксикационная терапия.
хвороби органів гепатопанкреатодуоденальної зони, ендотоксикоз, особливості розвитку, розподіл токсинів у кров’яному руслі, детоксикаційна терапія.
diseases of hepatopancreatoduodenal zone, endotoxemia, features of development, distribution of toxins in the bloodstream, detoxification therapy.
Статья опубликована на с. 107-116
Введение
Традиционный взгляд на формирование и развитие токсикоза у больных в целом и при заболеваниях гепатопанкреатодуоденальной зоны в частности предполагает образование (синтез) в кровяном русле аутоагрессивных веществ (АВ) эндогенного происхождения, обладающих повреждающим действием на биологические мишени организма. Естественно, что в условиях синтеза АВ происходит их накопление в кровяном русле и распределение на токсиннесущих фракциях — альбуминах, глобулинах, клеточных мембранах и в так называемом свободном (не связанном с белковыми фракциями крови) состоянии. При этом важным является возникновение связи АВ (токсинов) с токсиннесущими фракциями плазмы крови и ее прочность. Ассоциация токсинов с токсиннесущими фракциями белковой природы осуществляется путем возникновения прочных и непрочных связей. От характеристики этой связи во многом зависят основные пути физиологической элиминации токсинов из кровяного русла. Характеристика этой связи имеет также большое значение для выбора метода детоксикационной терапии. В частности, при наличии непрочной связи токсина с белковой токсиннесущей фракцией ряд методов (гемодилюция, квантовая гемотерапия, гемодиафильтрация и др.) позволяют осуществить разрыв этой связи, тем самым снимая нагрузку с систем печени, которые обеспечивают возникновение биотрансформационных реакций, ускоряя элиминацию токсического вещества из кровяного русла. Наличие же прочной связи между токсином и токсиннесущей фракцией делает нерациональным использование этих методов и должно указать клиницисту на целесообразность назначения и выбора других методов (плазмаферез, криоплазмаферез и др.) детоксикационной терапии [1–5, 7].
Следует указать на то, что во многих случаях тяжелого течения заболевания, особенно на фоне возникновения синдрома полиорганной недостаточности, получение информации об эндотоксинах, их токсикокинетике и токсикодинамике, периоде полувыведения, размерах молекул и частиц, местах преимущественного накопления в кровяном русле и других характеристиках составляет значительные сложности. Возникающие вместе с этим ошибки и проблемы при оказании медицинской помощи во многих случаях обусловлены неправильным выбором метода детоксикационной терапии, что отражается на эффективности лечения.
Вполне понятно, что детоксикационная терапия должна быть индивидуализированной с учетом физико-химических свойств АВ, их размеров, мест накопления на токсиннесущих фракциях в кровяном русле (белок-ассоциированные или безбелковые), прочности связи с токсиннесущими фракциями плазмы крови (альбуминами, глобулинами, клеточными мембранами).
Цель работы: изучить процессы распределения аутоагрессивных веществ и их связи с токсиннесущими фракциями в кровяном русле у пациентов с заболеваниями гепатопанкреатодуоденальной зоны для разработки подходов к назначению и выбору методов детоксикационной терапии.
Материалы и методы
Проведены клинико-лабораторные исследования 40 больных с тяжелым течением эндотоксикоза на фоне заболеваний гепатопанкреатодуоденальной зоны. Из них у 12 пациентов эндотоксикоз возник на фоне острого панкреатита, у 28 — на фоне острого гепатита различного генеза. Возраст больных колебался от 11 до 53 лет. Все больные в остром периоде заболевания получали традиционную терапию основного заболевания в отделениях интенсивной терапии, токсикологии и экстракорпоральных методов детоксикации на базе ГКБ № 1 и НДСБ «Охматдет» г. Киева.
Особенности формирования и развития токсикоза (распределение АВ в кровяном русле и их связь с токсиннесущими фракциями плазмы крови) изучали с помощью известных и модифицированных нами методик.
Статистический анализ и расчеты других параметров проведены с помощью программы Statistica 6.0 фирмы StatSoft Inc. (США).
Выделение токсиннесущих фракций из плазмы осуществляли методом высаливания сульфатом аммония 50 и 100% концентрации по общепринятой методике. Выделение фракции, которая содержала токсины с молекулами и частицами размером 10–200 нм и < 10 нм, проводили методом фильтрации через полупроницаемые мембраны с порами диаметром 200 и 10 нм. Исследование прочности связи токсинов с токсиннесущими фракциями (альбуминовой, глобулиновой и клеточными мембранами) осуществляли методом 30% дилюции физиологическим раствором с последующей фильтрацией через фильтры с вышеуказанным диаметром пор.
Для изучения характеристик токсинов, обладающих опосредованным механизмом повреждающего действия на биологические мишени, определяли содержание лимфоцитов, которые образуют розетки с аутологичными эритроцитами (АРОЛ), после их инкубирования с цельной плазмой, токсиннесущими фракциями плазмы и АВ с молекулами различных размеров. Для изучения характеристик токсинов, обладающих прямым механизмом повреждающего действия на биологические мишени, нами был использован метод цитолитической активности лейкоцитов (ЦАЛ). Полученный результат оценивали после инкубирования аутолейкоцитов больного с цельной плазмой, токсиннесущими фракциями плазмы и АВ с молекулами различных размеров [1, 6].
На основании результатов исследований ЦАЛ и АРОЛ делали выводы о повреждающей активности токсинов, которые обладают прямым и опосредованным механизмами повреждающего действия на клетки крови.
Все больные в зависимости от основного механизма повреждения биологической мишени токсинами (прямой — цитолитический или опосредованный — аутоиммунный), обладающими наиболее выраженной повреждающей активностью, были разделены на 2 группы. В 1-ю группу вошли больные, у которых наиболее выраженной повреждающей активностью обладали токсины с прямым механизмом повреждения биологической мишени (ЦАЛ цельной плазмы 51,36 ± 2,07 %); во 2-ю группу — с опосредованным механизмом (АРОЛ цельной плазмы 63,78 ± 5,46 %).
Результаты исследований
1. Средний уровень повреждающей активности накопленных в кровяном русле токсинов с молекулами различных размеров
При исследовании среднего значения повреждающей активности токсинов, обладающих прямым механизмом повреждения биологической мишени, у больных 1-й группы обнаружено, что наиболее высоким уровнем активности обладали токсины с молекулами размером 10–200 нм (39,9 ± 2,07 %) и > 200 нм (34,49 ± 1,83 %). При этом различия между их значениями были недостоверными (p > 0,05). Уровень повреждающей активности токсинов с молекулами размером менее 10 нм был достоверно ниже такового токсинов с молекулами иных размеров и составил 28,10 ± 1,64 %. У больных 2-й группы обнаружено, что наиболее высоким уровнем активности обладали токсины с частицами размером 10–200 нм (42,51 ± 2,35 %). Уровень повреждающей активности токсинов с молекулами размером менее 10 и частицами > 200 нм был достоверно ниже (p < 0,05) такового токсинов с частицами размером 10–200 нм и составил 28,26 ± 2,60 и 27,72 ± 2,06 % соответственно (рис. 1).
/108/108.jpg)
При исследовании среднего значения повреждающей активности токсинов, обладающих опосредованным механизмом повреждения биологической мишени, у больных 1-й группы обнаружено, что наиболее высоким потенциалом обладали токсины с частицами размером > 200 нм (30,86 ± 1,63 %). Уровень повреждающей активности токсинов с частицами размером 10–200 нм и молекулами < 10 нм был достоверно ниже такового токсинов с частицами размером > 200 нм и составил 24,23 ± 1,58 % и 24,40 ± 1,80 % соответственно. У больных 2-й группы обнаружено, что наиболее высоким уровнем повреждающей активности обладали токсины с частицами размером > 200 нм (38,28 ± 3,40 %). Однако их уровень не имел достоверных отличий (p > 0,05) от таковых токсинов с частицами размером 10–200 нм и молекулами < 10 нм (30,61 ± 2,95 % и 28,52 ± 5,26 % соответственно; рис. 2).
/109/109.jpg)
Для уточнения причин, обусловливающих уровень токсичности цельной плазмы крови, проведено исследование корреляционной зависимости между потенциалом повреждающей активности (токсичности) цельной плазмы и таковым токсинов с молекулами и частицами различных размеров, накопленных в кровяном русле. Установлена достоверная корреляционная зависимость (p < 0,05) у больных 1-й группы между уровнем повреждающей активности цельной плазмы и таковым токсинов с частицами размером 10–200 нм и молекул < 10 нм; у пациентов 2-й группы — у токсинов с частицами размером 10–200 нм и > 200 нм, молекулами < 10 нм (рис. 3).
2. Токсичность цельной плазмы и токсиннесущих фракций
При исследовании показателя токсичности цельной плазмы и токсиннесущих фракций, обусловленного повреждающей активностью токсинов, обладающих прямым механизмом повреждения биологической мишени, у больных 1-й группы обнаружено, что уровни повреждающей активности (токсичности) были приблизительно равными у всех токсиннесущих фракций и составили 52,05 ± 1,83 % у глобулиновой, 54,14 ± 2,87 % у альбуминовой и 46,57 ± 3,09 % у свободно циркулирующей фракции (p > 0,05). При этом уровень токсичности цельной плазмы составил 51,36 ± 2,07 % и не имел достоверных отличий (p > 0,05) от такового у токсиннесущих фракций. У больных 2-й группы наиболее высокий уровень повреждающей активности (токсичности) был обнаружен в свободно циркулирующей фракции (51,49 ± 6,01 %), хотя он и не имел достоверных отличий (p > 0,05) от такового у глобулиновой (42,76 ± 4,32 %) и альбуминовой (47,68 ± 5,68 %) фракций. При этом уровень токсичности цельной плазмы составил 45,68 ± 4,85 % и также не имел достоверных отличий (p > 0,05) от такового у токсиннесущих фракций (рис. 4).
При исследовании показателя токсичности цельной плазмы и токсиннесущих фракций, обусловленного повреждающей активностью токсинов, обладающих опосредованным механизмом повреждения биологической мишени, у больных 1-й группы обнаружено, что наибольшие уровни повреждающей активности (токсичности) были у глобулиновой и свободно циркулирующей фракций (37,97 ± 1,85 % и 37,23 ± 3,11 % соответственно). Их уровень достоверно отличался (p < 0,05) от такового у альбуминовой фракции (28,26 ± 2,64 %) и фракции клеточных мембран (23,46 ± 1,98 %). При этом уровень токсичности цельной плазмы составил 32,52 ± 1,85 % и имел достоверные отличия (p < 0,05) от такового у токсиннесущей глобулиновой фракции. У больных 2-й группы наибольшие уровни повреждающей активности (токсичности) были у глобулиновой и свободно циркулирующей фракций (59,11 ± 8,37 % и 50,00 ± 6,12 % соответственно). Их уровень достоверно отличался (p < 0,05) от такового у альбуминовой фракции (17,33 ± 3,80 %) и фракции клеточных мембран (30,44 ± 8,65 %). При этом уровень токсичности цельной плазмы составил 63,78 ± 5,46 % и имел достоверные отличия (p < 0,05) от таковых у токсиннесущей альбуминовой и фракции клеточных мембран и не имел достоверных отличий от таковых у глобулиновой и свободно циркулирующей фракции (рис. 5).
Для уточнения причин, обусловливающих уровень токсичности цельной плазмы крови, проведено исследование корреляционной зависимости между потенциалом повреждающей активности (токсичности) цельной плазмы и таковым у токсиннесущих фракций плазмы крови. Установлена достоверная корреляционная зависимость (p < 0,05) у больных 1-й группы между уровнем повреждающей активности цельной плазмы и таковым у глобулиновой, альбуминовой и свободно циркулирующей фракций; у пациентов 2-й группы — у глобулиновой, свободно циркулирующей и фракции клеточных мембран (рис. 6).
3. Распределение потенциала повреждающей активности токсинов в кровяном русле на токсиннесущих фракциях
При проведении сравнительных исследований у больных 1-й и 2-й групп обнаружены достоверные отличия между показателями повреждающей активности следующих токсинов, обладающих опосредованным механизмом повреждения биологической мишени:
— глобулин-ассоциированных токсинов с частицами размером 10–200 нм и > 200 нм;
— свободно циркулирующих токсинов с молекулами размером < 10 и частицами > 200 нм;
— альбумин-ассоциированных токсинов с частицами размером > 200 нм.
При этом наиболее высокие уровни повреждающей активности были зарегистрированы у больных 1-й группы — у свободно циркулирующих токсинов с частицами размером > 200 нм; у больных 2-й группы — у глобулин-ассоциированных токсинов с частицами размером > 200 нм и у свободно циркулирующих токсинов с частицами размером > 200 и 10–200 нм.
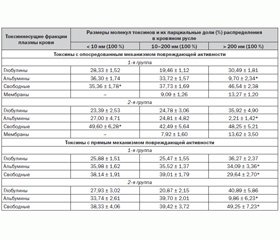
При проведении сравнительных исследований у больных 1-й и 2-й групп обнаружены достоверные отличия между показателями повреждающей активности альбумин-ассоциированных токсинов с частицами размером 10–200 нм и > 200 нм, обладающих прямым механизмом повреждения биологической мишени. При этом наиболее высокие уровни повреждающей активности были зарегистрированы у больных 1-й группы — у альбумин-ассоциированных, глобулин-ассоциированных, свободно циркулирующих токсинов с частицами размером > 200 нм и альбумин-ассоциированных, свободно циркулирующих токсинов с частицами размером 10–200 нм; у больных 2-й группы — у альбумин-ассоциированных, свободно циркулирующих токсинов с частицами размером 10–200 нм и у свободно циркулирующих токсинов с частицами размером > 200 нм (табл. 1).
При проведении сравнительных исследований у больных 1-й и 2-й групп обнаружены достоверные отличия между показателями распределения парциальных долей повреждающей активности следующих токсинов, обладающих опосредованным механизмом повреждения биологической мишени:
— свободно циркулирующих токсинов с молекулами размером менее 10 нм;
— альбумин-ассоциированных токсинов с частицами размером > 200 нм.
При проведении сравнительных исследований у больных 1-й и 2-й групп обнаружены достоверные отличия между показателями распределения парциальных долей повреждающей активности альбумин-ассоциированных и свободно циркулирующих токсинов с частицами размером > 200 нм, обладающих прямым механизмом повреждения биологической мишени (табл. 2).
Для уточнения причин, обусловливающих уровни токсичности токсиннесущих фракций плазмы крови, проведено исследование корреляционной зависимости между потенциалом повреждающей активности (токсичности) токсиннесущих фракций плазмы и таковыми у токсинов с молекулами различных размеров (рис. 7).
У больных 1-й группы установлена достоверная корреляционная зависимость (p < 0,05) между следующими параметрами:
— уровнем повреждающей активности свободно циркулирующей фракции и таковым свободно циркулирующих токсинов с частицами размером 10–200 нм и > 200 нм;
— уровнем повреждающей активности глобулиновой фракции и таковым глобулин-ассоциированных токсинов с молекулами размером < 10 нм и частицами > 200 нм;
— уровнем повреждающей активности альбуминовой фракции и таковым альбумин-ассоциированных токсинов с молекулами размером < 10 нм, частицами 10–200 нм и > 200 нм.
У больных 2-й группы установлена достоверная корреляционная зависимость (p < 0,05) между следующими параметрами:
— уровнем повреждающей активности свободно циркулирующей фракции и таковым свободно циркулирующих токсинов с частицами размером 10–200 нм и > 200 нм;
— уровнем повреждающей активности глобулиновой фракции и таковым глобулин-ассоциированных токсинов с частицами размером > 200 нм и у альбумин-ассоциированных токсинов с молекулами размером < 10 нм.
4. Прочность связи токсинов с токсиннесущими фракциями плазмы крови
Результаты исследования прочности связи токсинов с токсиннесущими фракциями представлены в табл. 3.
Как следует из представленных данных, у больных 1-й и 2-й групп токсины в большинстве случаев имели непрочную связь с белковыми токсиннесущими фракциями плазмы крови. При этом достоверные различия между группами больных в содержании прочно и не прочно связанных с белками токсинов мы наблюдали в отношении аутоагрессивных веществ с прямым механизмом повреждающего действия на биологические мишени.
Обсуждение
Отсутствие эффекта или недостаточная эффективность детоксикационной терапии позволяет нам предположить, что традиционные подходы к назначению и выбору методов детоксикации не учитывают индивидуальных особенностей формирования токсикоза, в частности — параметров распределения аутоагрессивных веществ в кровяном русле, что обусловливает неправильный выбор самого метода лечения. Вполне понятно, что детоксикационная терапия должна быть индивидуализированной, с учетом физико-химических свойств АВ, их размеров, мест накопления на токсиннесущих фракциях в кровяном русле (белок-ассоциированные или безбелковые), прочности связи с токсиннесущими фракциями плазмы крови (альбуминами, глобулинами, клеточными мембранами).
Все пациенты с заболеваниями органов гепатопанкреатодуоденальной зоны были разделены на 2 группы в зависимости от механизма повреждающего действия АВ (прямой или опосредованный). В 1-ю группу вошел 31 больной, у которых был определен наиболее выраженный потенциал АВ, обладающих прямым механизмом повреждающего действия на биологические мишени; во 2-ю группу вошли 9 больных, у которых был определен наиболее выраженный потенциал АВ, обладающих опосредованным механизмом биоповреждения.
Исследование параметров распределения токсинов в кровяном русле и прочность их связи с токсиннесущими фракциями плазмы крови оценивали по результатам расчета среднего уровня повреждающей активности накопленных в кровяном русле токсинов с молекулами различных размеров; расчета распределения парциальных долей повреждающей активности токсинов с молекулами разных размеров; расчета парциальной доли прочно и не прочно связанных с токсиннесущими фракциями токсинов в кровяном русле.
У больных 1-й группы исследования показателей среднего уровня повреждающей активности накопленных в кровяном русле токсинов с молекулами и частицами различных размеров показали, что наиболее высоким уровнем активности обладали токсины с частицами размером 10–200 нм (39,9 ± 2,07 %) и > 200 нм (34,49 ± 1,83 %). При этом установлена достоверная корреляционная зависимость (p < 0,05) между уровнем токсичности цельной плазмы и таковым токсинов с частицами размером 10–200 нм, > 200 нм и молекулами < 10 нм.
При исследовании показателя токсичности цельной плазмы и токсиннесущих фракций, обусловленного повреждающей активностью токсинов, обнаружено, что уровни повреждающей активности (токсичности) были приблизительно равными (p > 0,05) у всех токсиннесущих фракций (глобулиновой, альбуминовой и свободно циркулирующей фракции). При этом уровень токсичности цельной плазмы не имел достоверных отличий (p > 0,05) с таковым токсиннесущих фракций. Установлена достоверная корреляционная зависимость (p < 0,05) между уровнем повреждающей активности цельной плазмы и таковым глобулиновой, альбуминовой и свободно циркулирующей фракции.
При исследовании распределения потенциала повреждающей активности токсинов, накопленных в кровяном русле на токсиннесущих фракциях, установлено, что наиболее высокие уровни повреждающей активности АВ обнаружены у альбумин-ассоциированных, глобулин-ассоциированных, свободно циркулирующих токсинов с частицами размером > 200 нм и у альбумин-ассоциированных, свободно циркулирующих токсинов с частицами размером 10–200 нм. Установлена достоверная корреляционная зависимость (p < 0,05) между уровнем повреждающей активности свободно циркулирующей фракции и таковым свободно циркулирующих токсинов с частицами размером 10–200 нм и > 200 нм; между уровнем повреждающей активности глобулиновой фракции и таковым глобулин-ассоциированных токсинов с молекулами размером менее 10 и частицами > 200 нм; между уровнем повреждающей активности альбуминовой фракции и таковым альбумин-ассоциированных токсинов с молекулами размером менее 10 нм, частицами 10–200 нм и > 200 нм.
Исследования прочности связи токсинов с токсиннесущими белковыми фракциями плазмы крови указали на превалирование в кровяном русле АВ, имеющих непрочные связи с токсиннесущими фракциями.
Таким образом, установлено, что у больных 1-й группы наиболее выраженным потенциалом повреждающей активности обладали токсины с частицами размером 10–200 нм и > 200 нм. Распределение потенциала повреждающей активности токсинов с частицами размером > 200 нм происходило в кровяном русле равномерно на всех токсиннесущих фракциях, а токсинов с частицами размером 10–200 нм — преимущественно на альбумин-ассоциированной и свободно циркулирующей фракциях. При этом токсины с частицами размером > 200 нм имели прочные связи с глобулинами и альбуминами, а с частицами размером 10–200 нм — непрочные связи с альбуминами. Показатель токсичности цельной плазмы является интегративным параметром, отражающим уровни повреждающей активности токсинов с частицами размером 10–200 нм, > 200 нм и молекулами < 10 нм, которые накапливаются в кровяном русле на всех токсиннесущих фракциях. При этом токсичность каждой из токсиннесущих фракций имеет индивидуальные особенности и зависит от преимущественного накопления на фракции токсинов с теми или иными размерами молекул и частиц.
У больных 2-й группы исследования показателей среднего уровня повреждающей активности накопленных в кровяном русле токсинов с молекулами различных размеров обнаружено, что наиболее высоким уровнем активности обладали токсины с частицами размером > 200 нм. Однако их уровень не имел достоверных отличий (p > 0,05) с таковым токсинов с частицами размером 10–200 нм и молекулами < 10 нм. При этом установлена достоверная корреляционная зависимость между уровнем токсичности цельной плазмы и таковым токсинов с частицами размером 10–200 нм, > 200 нм и молекулами < 10 нм.
При исследовании показателя токсичности цельной плазмы и токсиннесущих фракций, обусловленного повреждающей активностью токсинов, обнаружено, что наибольшие уровни повреждающей активности (токсичности) наблюдались у глобулиновой и свободно циркулирующей фракции. При этом уровень токсичности цельной плазмы имел достоверные отличия (p < 0,05) от таковых токсиннесущей альбуминовой и фракции клеточных мембран и не имел достоверных отличий от таковых глобулиновой и свободно циркулирующей фракции. Установлена достоверная корреляционная зависимость (p < 0,05) между уровнем повреждающей активности цельной плазмы и таковым глобулиновой, свободно циркулирующей и фракции клеточных мембран.
При исследовании распределения потенциала повреждающей активности токсинов, накопленных в кровяном русле на токсиннесущих фракциях, установлено, что наиболее высокие уровни повреждающей активности АВ обнаружены у глобулин-ассоциированных токсинов с частицами размером > 200 нм и свободно циркулирующих токсинов с частицами размером 10–200 нм и > 200 нм. Выявлена достоверная корреляционная зависимость (p < 0,05) между уровнем повреждающей активности свободно циркулирующей фракции и таковым свободно циркулирующих токсинов с частицами размером 10–200 нм и > 200 нм; между уровнем повреждающей активности глобулиновой фракции и таковым глобулин-ассоциированных токсинов с молекулами размером < 10 и частицами > 200 нм и у альбумин-ассоциированных токсинов с молекулами размером < 10 нм.
Исследования прочности связи токсинов с токсиннесущими белковыми фракциями плазмы крови показали превалирование в кровяном русле АВ, имеющих непрочные связи с токсиннесущими фракциями.
Таким образом, установлено, что у больных 2-й группы наиболее выраженным потенциалом повреждающей активности обладали токсины с частицами размером > 200 нм. Распределение потенциала повреждающей активности токсинов с частицами размером > 200 нм происходило в кровяном русле преимущественно на глобулин-ассоциированной и свободно циркулирующей фракциях. При этом токсины с частицами размером > 200 нм имели прочные связи с глобулинами. Показатель токсичности цельной плазмы является интегративным параметром, отражающим уровни повреждающей активности токсинов с частицами размером 10–200 нм, > 200 нм и < 10 нм, которые накапливаются в кровяном русле на глобулиновой, свободно циркулирующей и фракции клеточных мембран. При этом токсичность каждой из токсиннесущих фракций имеет индивидуальные особенности и зависит от преимущественного накопления на фракции токсинов с теми или иными размерами молекул и частиц.
Полученные нами данные свидетельствуют о том, что у больных с заболеваниями гепатопанкреатодуоденальной зоны наблюдается токсемия, которая имеет индивидуальные особенности формирования и проявления, обусловленные различиями в механизмах повреждения биологической мишени токсинами, преимущественном накоплении в кровяном русле токсинов с молекулами и частицами различных размеров, распределении токсинов на токсиннесущих фракциях плазмы крови, прочности связи АВ с белковыми фракциями. Обнаруженные особенности формирования и проявления токсемии, несомненно, играют важную роль при назначении и выборе методов детоксикационной терапии и указывают на целесообразность индивидуализированного подхода в решении этих вопросов у больных с патологией гепатопанкреатодуоденальной зоны.
Выводы
1. Комплексные токсикометрические исследования накопленных в кровяном русле АВ позволяют выделить основные звенья развивающейся токсемии и систематизировать их по размерам молекул и частиц, величине повреждающего потенциала, распределению токсинов на токсиннесущих фракциях плазмы крови, прочности связи с белковыми фракциями.
2. У большинства пациентов (77,5 %) с заболеваниями гепатопанкреатодуоденальной зоны наблюдается токсемия тяжелой степени, которая сопровождается накоплением в кровяном русле АВ, обладающих прямым механизмом повреждения биологической мишени, в некоторых случаях (22,5 %) — обладающих опосредованным механизмом.
3. Установлено, что токсемия при заболеваниях гепатопанкреатодуоденальной зоны сопровождается накоплением в кровяном русле АВ с частицами размером 10–200 нм и > 200 нм.
4. Токсины с частицами размером > 200 нм, обладающие опосредованным механизмом повреждения, преимущественно накапливаются на глобулиновой и свободно циркулирующей фракции и имеют прочные связи с белковыми фракциями плазмы крови.
5. Токсины с частицами размером 10–200 нм, обладающие прямым механизмом повреждения, преимущественно накапливаются на альбуминовой и свободно циркулирующей фракции и имеют непрочные связи с белковыми фракциями плазмы крови.
6. Показатель токсичности цельной плазмы является интегративным параметром, отражающим уровни повреждающей активности токсинов с молекулами и частицами различных размеров, которые накапливаются в кровяном русле на различных токсиннесущих фракциях. При этом токсичность каждой из токсиннесущих фракций имеет индивидуальные особенности и зависит от преимущественного накопления на фракции токсинов с различными размерами молекул и частиц.
7. Информация о закономерностях и особенностях развития и формирования токсемии у больных с патологией гепатопанкреатодуоденальной зоны представляется важной для индивидуализации показаний к назначению и выбору методов детоксикационной терапии.
1. Андрейчин М.А., Бех М.Д., Дем’яненко В.В., Ничик А.З., Ничик Н.А. Методи дослідження ендогенної інтоксикації організму // Методичні рекомендації МОЗ України. — К., 1998. — C. 1-31.
2. Аристов М.А. Клиническое значение гемодилюции как метода интенсификации гемодиализа у детей с ОПН: Дис… канд. мед. наук. — К., 1994. — 26 c.
3. Бойко В.В., Криворучко І.А. Патофізіологія та лікування гострого некротичного панкреатиту. — Харків, Ін-т загальної та невідкладної хірургії АМН України, ДМУ, 2000.
4. Зверев Д.В., Долецкий А.С., Музуров А.Л. Активные методы детоксикации у детей раннего возраста // Анестезиология и реаниматология. — 1996. — № 6. — C. 48-51.
5. Козинец Г.П., Цыганков В.П., Боярская А.М. Способы определения токсических свойств сыворотки и экстрактов кожи обожженных. — Киев. — Рацпредложение № 591 от 29.09.1991.
6. Проданчук Н.Г., Шейман Б.С., Осадчая О.И., Волошина Н.А. Спосіб діагностики та лікування ендотоксикозу (заявка на винахід № 2004010546 від 26.01.2004 р.).
7. Шейман Б.С., Осадчая О.И., Козинец К.Г. Дифференциально-диагностические признаки определения схемы детоксикационной терапии у больных с различной патологией // Лабораторная диагностика. — 1999. — № 4. — С. 11-13.

/109/109_2.jpg)
/110/110.jpg)
/110/110_2.jpg)
/111/111.jpg)
/112/112.jpg)
/113/113.jpg)
/114/114.jpg)