Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Клініко-прогностичне значення результатів проби з потік-залежною вазодилатацією у хворих із гострим коронарним синдромом з елевацією сегмента ST
Авторы: Лутай Я.М., Пархоменко О.М., Степура А.О., Іркін О.І., Білий Д.О., Сопко О.О. - Відділ реанімації та інтенсивної терапії, ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска», м. Київ
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Клинические исследования
Версия для печати
У дослідження включений 151 пацієнт із гострим коронарним синдромом (ГКС) з елевацією сегмента ST, які надійшли протягом перших 12 годин від розвитку симптомів захворювання. У всіх пацієнтів проведена проба з потік-залежною вазодилатацією (ППЗВ) при надходженні (у середньому через 13,8 ± 1,5 години від розвитку симптоматики) і на 7-му добу.
Виявлено, що пацієнти з гострим інфарктом міокарда з елевацією сегмента ST характеризуються зниженням приросту діаметра плечової артерії при проведенні ППЗВ на першу добу з наступним збільшенням цього показника на тлі сучасної терапії (6,41 ± 0,53 % на першу добу проти 8,25 ± 0,49 % на 7-му добу, p = 0,014). Результати ППЗВ на першу добу не залежали від основних клініко-анамнестичних характеристик, локалізації ГІМ і вираженості ураження коронарних артерій, але корелювали з вихідним рівнем глюкози (r = –0,29, p = 0,004). Зниження приросту діаметра плечової артерії < 5 % при проведенні ППЗВ асоціювалося з більш рідкісною спонтанною реканалізацією інфаркт-залежної коронарної артерії й більш частим розвитком синдрому no reflow після первинної ангіопластики, що обумовило більшу ймовірність внутрішньогоспітальних ускладнень (розвиток гострої лівошлуночкової недостатності, смерть) у цій групі. Найгірші результати перебігу госпітального періоду відзначені у хворих із парадоксальною реакцією при проведенні ППЗВ (приріст діаметра артерії ≤ 0).
В исследование включен 151 пациент с острым коронарным синдромом (ОКС) с элевацией сегмента ST, поступившие в течение первых 12 часов от развития симптомов заболевания. У всех пациентов проведена проба с поток-зависимой вазодилатацией (ППЗВ) при поступлении (в среднем через 13,8 ± 1,5 часа от развития симптоматики) и на 7-е сутки.
Выявлено, что пациенты с острым инфарктом миокарда с элевацией сегмента ST характеризуются снижением прироста диаметра плечевой артерии при проведении ППЗВ в первые сутки с последующим увеличением этого показателя на фоне современной терапии (6,41 ± 0,53 % в первые сутки против 8,25 ± 0,49 % на 7-е сутки, p = 0,014). Результаты ППЗВ в первые сутки не зависели от основных клинико-анамнестических характеристик, локализации ОИМ и выраженности поражения коронарных артерий, но коррелировали с исходным уровнем глюкозы (r = –0,29, p = 0,004). Снижение прироста диаметра плечевой артерии < 5 % при проведении ППЗВ ассоциировалось с более редкой спонтанной реканализацией инфаркт-зависимой коронарной артерии и более частым развитием синдрома no reflow после первичной ангиопластики, что обусловило большую вероятность внутригоспитальных осложнений (развитие острой левожелудочковой недостаточности, смерть) в этой группе. Наихудшие результаты течения госпитального периода отмечены у больных с парадоксальной реакцией при проведении ППЗВ (прирост диаметра артерии ≤ 0).
The study included 151 patients with acute coronary syndrome (ACS) with elevation of ST, who admitted to hospital within first 12 hours of onset of disease symptoms. All patients underwent a test with a flow-mediated vasodilation (FMVT) at admission (average in 13.8 ± 1.5 hours of symptoms onset) and on the 7th day.
It is found that patients with acute myocardial infarction with ST elevation are characterized by a decrease in growth of the brachial artery diameter during FMVT on the first day, followed by its improvement on the background of modern therapy (6.41 ± 0.53 % on the first day compared to 8.25 ± 0.49 % on 7th day, p = 0.014). FMVT results on the first day did not depend on the main clinical and anamnestic characteristics, localization of AMI and severity of coronary artery lesions, but correlated with the initial level of glucose (r = –0,29, p = 0.004). Reduction in brachial artery diameter growth < 5 % during FMVT was associated with a more rare spontaneous recanalization of the infarct-related coronary artery disease and more frequent development of no reflow syndrome after primary angioplasty, which led to greater likelihood of in-hospital complications (development of acute left ventricular failure, death) in this group. The worst results of hospital period were marked in patients with paradoxical reaction during FMVT (arterial diameter growth ≤ 0).
Статья опубликована на с. 35-44
Ендотелій відіграє важливу роль у підтриманні судинного гомеостазу. Завдяки синтезу ендотелій-залежних факторів констрикції та релаксації відбувається контроль тонусу судинної стінки, тромбоутворення, клітинної проліферації та атерогенезу [1, 2]. Незахищене положення ендотелію, який як одноклітинний внутрішній шар вкриває зсередини стінки судин, робить його чутливим до дії багатьох факторів навколишнього середовища, що є факторами ризику серцево-судинних захворювань. Вже досить добре вивчені особливості порушень вазорегуляторної функції ендотелію в пацієнтів з артеріальною гіпертонією, гіперхолестеринемією, цукровим діабетом, пацієнтів, які палять [2–5]. Результати проспективних досліджень також свідчать, що ендотеліальна дисфункція є фактором ризику смерті від серцево-судинних причин [6–8]. Втім проблема ендотеліальної дисфункції у хворих із гострим коронарним синдромом (ГКС) ще вивчена недостатньо. Лишаються відкритими питання щодо її ролі в розвитку та прогресуванні захворювання, оптимальних методів вивчення, впливу на перебіг захворювання та можливостей корекції.
Матеріали і методи
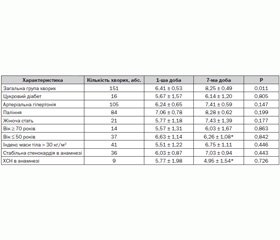
Обстежений 151 хворий на ГКС з елевацією сегмента ST на електрокардіограмі, які були госпіталізовані з листопада 2010 по березень 2013 року у відділення реанімації та інтенсивної терапії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН протягом перших 12 годин від розвитку симптомів захворювання (табл. 1).
Діагноз гострого інфаркту міокарда (ГІМ) встановлювався згідно з рекомендаціями Комітету експертів ВООЗ, Європейського товариства кардіологів та Асоціації кардіологів України [9–10].
Досліджувану групу хворих становили здебільшого чоловіки (86,1 %, n = 130) відносно молодого віку, що в сукупності зі значною кількістю хворих із передньою локалізацією ІМ відображає категорію хворих, яка звичайно госпіталізується в наш реперфузійний центр. Основним методом реваскуляризації було проведення первинної перкутанної транслюмінальної коронарної ангіопластики (ПТКА) (73,5 %, n = 111), стентування коронарних артерій виконано у 67,5 % (n = 102) та ангіопластику — у 9 (5,9 %) хворих. Тромболітична терапія проведена 27 (17,9 %) хворим, з них у 8 пацієнтів із ПТКА було проведено протягом першої доби (фармакоінвазивна стратегія), а ще у 9 хворих — протягом подальшого періоду госпіталізації. Реваскуляризація протягом першої доби не проводилася 21 (13,9 %) хворому, які мали спонтанну реканалізацію інфаркт-залежної коронарної артерії, що клінічно проявлялося відсутністю больового синдрому та позитивною динамікою сегмента ST на електрокардіограмі. Втім майже половині з цих хворих (47,6 %, n = 10) була проведена реваскуляризація протягом подальшого госпітального періоду захворювання.
Всі хворі отримували стандартну терапію згідно з рекомендаціями. У дослідження не включалися хворі з істинним кардіогенним шоком, набряком легенів, клапанними вадами, які потребують хірургічного втручання, та тяжкою супутньою патологією.
Реактивну гіперемію визначали за допомогою проби з потік-залежною вазодилатацією (ППЗВ). Пробу проводили на ультразвуковому сканері IMAGIC Agile (Kontron Medical, Франція) за допомогою судинного датчика LA523K (4–13 MГц/40 мм) на 1-шу та 7-му добу госпітального періоду ГІМ. Високі вимоги пред’являли до методології проведення ППЗВ. Проба проводилася мінімум через 4 години після припинення болів ангінозного характеру, за відсутності явних ознак серцевої недостатності та мінімум через 4 години після припинення внутрішньовенної інфузії нітратів (нітрати тривалої дії відміняли мінімум за 24 години). Проба проводилася в положенні лежачи мінімум через 10 хвилин відпочинку, при кімнатній температурі. Рука пацієнта під час проведення ППЗВ знаходилася у зручному положенні, лікоть фіксований. Вимірювання діаметра плечової артерії проводили лiнiйним методом, який полягає у визначенні діаметра артерії з використанням двох точок, встановлених ультразвуковим курсором: одна — на межі адвентицiя — медiа передньої стінки судини, друга — на межі медiа — адвентицiя задньої стінки. Вираховували середню величину з 4 вимірювань. За діаметр плечової артерії брали розраховану таким чином середню величину, обчислену в трьох серцевих циклах у фазу дiастоли. Після вимірювання вихідного діаметра плечової артерії пацієнту на плече на 2 см вище від місця виміру накладали манжету від манометра та створювали тиск на 50 мм рт.ст. вищий, ніж рівень системного систолічного тиску, який утримували протягом 5 хвилин. Через 80 с після декомпресії проводили повторне вимірювання діаметра артерії у тому ж самому місці та розраховували показник ендотелій-залежної вазодилатації як процент приросту діаметра плечової артерії відносно вихідного розміру. Умовно прийнято вважати нормальною реакцією плечової артерії її дилатацію на фоні реактивної гiперемiї більше ніж на 10 % від початкового діаметра [11–14].
У всіх хворих отримували згоду на проведення досліджень та тривале спостереження.
Статистичний аналіз проводився за допомогою електронних таблиць Microsoft® Excel 2010 та статистичної програми Statistica (компанія StatSoft Inc, версія 7.0.61.0), з використанням непараметричного тесту Уїлкоксона, тесту Фішера, t-критерію Стьюдента, x2-тесту Мантела — Хенсела [15]. Критерієм вірогідності відмінностей вважався р < 0,05.
Результати та обговорення
Визначення реактивної гіперемії за допомогою проби з потік-залежною вазодилатацією на першу добу проводилося в середньому через 13,8 ± 1,5 години від розвитку перших симптомів ГІМ (протягом приблизно 10 годин від госпіталізації в стаціонар). Було виявлено суттєве зниження приросту діаметра плечової артерії у відповідь на ППЗВ протягом першої доби ГІМ зі стійкою елевацією сегмента ST на електрокардіограмі з подальшим збільшенням цього показника в динаміці спостереження (табл. 2).
Структура результатів ППЗВ у хворих із ГІМ зі стійкою елевацією сегмента ST у динаміці протягом госпітального періоду наведена на рис. 1.
Майже половина (43,05 %) хворих із ГІМ з елевацією сегмента ST на 1-шу добу захворювання мали значне порушення результатів проби з реактивною гіперемією (приріст діаметра плечової артерії менший за 5 %). У динаміці госпітального періоду захворювання відмічено суттєве зменшення кількості хворих із парадоксальною реакцією при проведенні проби (16,56 % на першу добу проти 9,27 % на сьому добу відповідно, р = 0,042) та збільшення хворих з адекватною відповіддю на ППЗВ. Приріст діаметра плечової артерії на 10 % та більше спостерігався у 23,84 % хворих на першу добу та 36,44 % на 7-му — 10-ту добу відповідно (р = 0,017). Втім кількість хворих із проміжними значеннями ППЗВ майже не змінювалася.
Приріст діаметра плечової артерії при проведенні ППЗВ у всіх основних клініко-анамнестичних підгрупах суттєво не відрізнявся від такого в загальній групі хворих. Втім хворі молодшого віку (менше ніж 50 років) та пацієнти з анамнезом ХСН мали гірші результати ППЗВ на 7-му добу (табл. 3).
Результати ППЗВ не залежали від локалізації гострого інфаркту міокарда і становили: 6,74 ± 0,77 % — у хворих із переважним ураженням передньої стінки та 6,10 ± 0,77 % — ураженням задньої стінки ЛШ.
Таким чином, хворі на ГІМ з елевацією сегмента ST характеризуються початково низьким приростом діаметра плечової артерії при проведенні ППЗВ, що свідчить про порушення ендотеліальної функції на першу добу з наступним її покращенням на фоні сучасного лікування. Результати ППЗВ на першу добу у хворих із ГІМ не залежали від основних клініко-анамнестичних характеристик та локалізації ІМ. Ці дещо несподівані результати свідчать про те, що причини ендотеліальної дисфункції в момент розвитку ГКС відрізняються від таких у хворих зі стабільними формами ІХС. Подібні результати були отримані і в дослідженні S.M. Chen та співавт. у пацієнтів із ГІМ молодого віку [16].
Для подальшого аналізу всі хворі були поділені на 2 групи залежно від результатів ППЗВ на першу добу ГІМ. Як граничний критерій використовували закруглене значення медіани — 5 % (медіана — 5,47 %). І групу становили 86 хворих зі значеннями приросту діаметра плечової артерії < 5 %, ІІ групу — 65 хворих із приростом < 5 %. Серед пацієнтів ІІ групи була також виділена підгрупа ІІА (24 пацієнти) із парадоксальною реакцією при проведені проби (приріст ≤ 0). Основні клініко-анамнестичні характеристики хворих та характеристики ГІМ наведені в табл. 4. Суттєвої різниці між групами за цими показниками не виявлялося.
Втім на момент госпіталізації ознаки спонтанної реперфузії інфаркт-залежної коронарної артерії (не проводилася реваскуляризація протягом першої доби) мали 18,6 % хворих із першої групи та 7,69 % хворих із другої групи (р = 0,048 при порівнянні результатів між групами). Отримані дані можуть свідчити про кращу активність фібринолітичної системи у хворих зі збереженою функцією ендотелію.
Аналіз лабораторних даних також не виявив суттєвої різниці між групами в рівні маркерів системного запалення, показників ліпідного спектра крові та функції нирок. Однак у хворих другої групи відмічалися значно вищі показники глюкози крові при госпіталізації в стаціонар (7,42 ± 0,26 ммоль/л у першій проти 8,33 ± 0,47 ммоль/л у другій групі відповідно, р = 0,038). Ці дані є дуже цікавими з огляду на те, що групи суттєво не відрізнялися за кількістю хворих із супутнім цукровим діабетом (11,63 % у І групі проти 9,23 % у ІІ групі, р = 0,638). Таке підвищення глюкози найбільш вірогідно є стресовим.
Раніше вже було показано, що стресова гіперглікемія асоціюється розвитком мікроваскулярної обструкції [10]. За даними публікацій, гіперглікемія у пацієнтів із ГІМ з елевацією сегмента ST, у яких рівень глікованого гемоглобіну в межах норми (що свідчить про гострий, або стресовий характер гіперглікемії), пов’язана з більшим розміром некрозу міокарда, погіршенням контрактильної функції лівого шлуночка та несприятливим перебігом госпітального та постгоспітального періодів захворювання [17–20]. У нашому дослідженні виявили обернений кореляційний зв’язок між рівнем глюкози на момент госпіталізації та результатами проби з реактивною гіперемією на першу добу ГІМ (r = –0,29, p = 0,004). Це може свідчити про участь гіперглікемії як причинного фактора в розвитку ендотеліальної дисфункції. В умовах гіперглікемії ендотеліальні клітини зменшують продукцію NO [21]. Одночасно відмічається активація ядерного фактора kB (NF-kB), експресія генів запалення та збільшення адгезії лейкоцитів [22–24]. Минуща гіперглікемія призводить до експресії молекул адгезії VCAM-1 та MCP-1 у NF-kB-залежній манері, що зберігається протягом деякого часу після нормалізації рівня глюкози [25]. Таким чином, як постійна так і минуща гіперглікемія здатні викликати ендотеліальну дисфункцію за механізмами, дуже схожими на ті, що беруть участь у розвитку системного запалення. З іншого боку, порушення мікроциркуляції на фоні погіршення функціонального стану ендотелію можуть викликати розвиток стресової гіперглікемії. Не виключено також, що у хворих із ГКС стресова гіперглікемія та ендотеліальна дисфункція є насідком дії інших факторів та розвиваються паралельно, підтримуючи один одного.
Ми проаналізували перебіг госпітального періоду ГІМ залежно від результатів ППЗВ (табл. 6).
Було виявлено, що за відсутності суттєвих відмінностей між групами за частотою реєстрації гострої лівошлуночкової недостатності (ГЛШН) (Killip 2–3) на момент госпіталізації, починаючи з третьої доби ГІМ, прояви гострої серцевої недостатності значно частіше виявляли в пацієнтів другої групи, що свідчило про більш значимі порушення центральної гемодинаміки в цій групі хворих. Незважаючи на відносно невелику кількість хворих, включених у дослідження, та відносно малий рівень госпітальної летальності у загальній групі (1,99 %, n = 3), всі померлі хворі мали порушення ендотеліальної функції (ППЗВ < 5 %) при першому дослідженні, що стало причиною вірогідних відмінностей між групами за цим показником. Дещо несподіваною стала відсутність суттєвої різниці між групами за частотою розвитку ішемічних подій: ранньої постінфарктної стенокардії та рецидиву ІМ. Це може бути обумовлено більшою кількістю хворих без реваскуляризації на першу добу у першій групі. Найгірші результати перебігу госпітального періоду захворювання відмічені у ІІА підгрупі хворих. Хворі цієї підгрупи характеризувалися значно частішим розвитком ускладнень — гострої серцевої недостатності, блокад серця та смерті (табл. 6).
Первинні перкутанні коронарні втручання були проведені у 111 хворих. Одно-, дво- та трисудинне ураження коронарних артерій, а також ураження стовбура ЛКА однаково часто зустрічалося у хворих обох виділених груп (табл. 7).
Результати оцінки стану епікардіального кровотоку та міокардіальної перфузії на момент аналізу були доступні для 85 пацієнтів (І група — 43 пацієнти та ІІ група – 42 пацієнти, з них 17 пацієнтів з підгрупи ІІА). До проведення первинного ПТКА 5 пацієнтам з першої групи та 3 пацієнтам з другої групи була проведена фібринолітична терапія тенектеплазою (11,6 % першої групи проти 7,14 % другої групи, р = 0,410). При проведенні коронароангіографії не було виявлено суттєвих відмінностей за станом епікардіального кровотоку між групами (табл. 8). Закрита коронарна артерія виявлялася у 67,4 % пацієнтів І групи та 71,4 % пацієнтів ІІ групи відповідно (р = 0,805 порівняно з І групою), а також у 82,4 % пацієнтів з підгрупи ІІA (р = 0,255 порівняно з І групою). Стентування коронарних артерій проведене у 41 (95,3 %) хворого з першої групи, 39 (92,9 %) хворих з другої групи та 16 (94,1 %) хворих із підгрупи ІІА (р > 0,05 при порівнянні між групами). У середньому використовували 1,16 ± 0,05 стента в пацієнтів І групи та 1,09 ± 0,04 стента в пацієнтів ІІ групи. Стан епікардіального кровотоку у хворих двох виділених груп після ПТКА також суттєво не відрізнявся: кровотік TIMI 3 визначався у 88,4 % пацієнтів І групи та 92,9 % пацієнтів ІІ групи, а також 88,2 % у підгрупі ІІА (р > 0,05 при порівнянні між групами).
Ми провели порівняльну оцінку результатів ППЗВ у хворих, які на момент проведення коронароангіографії мали відкриту (TIMI 2–3 — 26 (30,59 %) хворих) та закриту (TIMI 0–1 — 59 (69,41 %) хворих) коронарну артерію. Було виявлено, що пацієнти зі спонтанною реканалізацією інфарктобумовлюючої коронарної артерії мали значно кращі показники ППЗВ на 1-шу добу ГІМ (8,76 ± 1,73 % проти 5,21 ± 0,83 % відповідно, р = 0,045). В нашому дослідженні в І групі було також виявлено значно більше хворих, яким не проводили реваскуляризацію протягом першої доби у зв’язку з неінвазивними ознаками спонтанної реканалізації (18,60 % в І групі проти 7,69 % в ІІ групі відповідно, р = 0,048).
Отримані дані дозволили припустити, що у хворих зі збереженою функцією ендотелію відбувається активація фібринолізу, яка забезпечує більш часту та повну реканалізацію коронарної артерії. Раніше було показано, що внутрішньоартеріальна інфузія ацетилхоліну (агоніст ендотелію) сприяє швидкому вивільненню тканинного активатора плазміногену, втім блокада ендотеліальної NO-синтетази (NG-монометил-L-аргінін) призводить до значного зниження його рівня. Це вказує, що виділення тканинного активатора плазміногену — деякою мірою NO–залежний процес. NO також є активним регулятором процесів тромбоутворення: при агрегації тромбоцитів запускається NO-залежний механізм зворотного зв’язку, обмежуючи цей процес. Першою ланкою цього механізму є вивільнення NO з самих тромбоцитів, що задіяні в процесі тромбоутворення. Друга ланка — це взаємодія тромбоцитів та клітин ендотелію, яка реалізується завдяки вивільненню АДФ з активованих тромбоцитів, що активує ендотеліальну NO-синтетазу (eNOS). Ендотеліальний NO в подальшому запобігає агрегації тромбоцитів та протидіє вазоконстрикторним ефектам тромбоксану А2 і серотоніну. В умовах дефіциту ендотеліального NO цей захисний механізм не працює, що сприяє вазоконстрикції та тромбоутворенню [26–27]. Вважається, що дисфункція ендотелію також призводить до зниження рівня тромбомодуліну — білка, що блокує здатність тромбіну розщеплювати фібриноген та активує протеїн С [27]. Саме ці механізми, ймовірно, лежать в основі взаємодії ендотелію та процесів тромбоутворення/фібринолізу та пояснюють отримані дані. Підтвердженням взаємозв’язку ендотеліальної функції та фібринолізу можуть також служити наші попередні дані щодо зниження ефективності тромболітичної терапії у хворих з поліморфізмом гена eNOS [28]. Подібні дані щодо зв’язку між функцією ендотелію та вірогідністю спонтанного фібринолізу у гострий період інфаркту міокарда були також показані групою російських авторів [29, 30].
Були виявлені суттєві відмінності між групами при оцінці результатів реваскуляризації за методикою MBG (Myocardial blush grade) (табл. 9).
Ця методика дозволяє оцінити міокардіальну перфузію на рівні мікроциркуляції та суттєво доповнює оцінку епікардіального кровотоку за TIMI [31]. У ряді досліджень саме оцінка за шкалою MBG виявилася найбільш чутливим маркером розвитку несприятливих серцево-судинних ускладнень і смерті після проведення ПТКА у хворих із ГІМ незалежно від стану епікардіального кровотоку [32–34]. Методика MBG передбачає бальну (від 0 до 3) оцінку міокардіальної перфузії. При цьому синдром невідновленого кровотоку (no reflow) визначається у хворих з оцінкою в 0–1 балів. 2 бали за MBG характеризують синдром уповільненого кровотоку (slow reflow) та 3 бали — повне відновлення кровопостачання на рівні мікроциркуляції [35–36]. У нашому дослідженні хворі ІІ групи мали тенденцію, що набувала статистичної значимості в підгрупі ІІА, до більш частого розвитку синдрому no reflow. Втім хворі першої групи характеризувалися значно кращим відновленням мікроциркуляторного кровотоку після проведення первинної ПТКА.
Зворотний аналіз виявив, що хворі з оцінкою мікроциркуляторної перфузії MBG 3 мали значно кращі результати ППЗВ, ніж хворі із синдромом уповільненого чи невідновленого мікроциркуляторного кровотоку. Так, приріст діаметра плечової артерії у відповідь на ППЗВ становив 7,15 ± 1,00 % у хворих із MBG 3; 4,00 ± 0,68 % — у хворих із MBG 2 (р = 0,092 порівняно з MBG 3) та 1,31 ± 2,68 % — у хворих із MBG 1 (р = 0,130 порівняно з MBG 3). Відсутність статистичної вірогідності можна пояснити малою кількістю хворих із MBG 0–2 та варіабельністю результатів проби. Втім, якщо об’єднати хворих з уповільненим та невідновленим кровотоком, то результати набувають вірогідності (7,15 ± 1,00 % при MBG 3 проти 3,36 ± 0,96 % при MBG 1–2, р = 0,039).
На сьогодні немає єдиної концепції розвитку синдрому no reflow. Вважається, що цей синдром є мультифакторіальним за своєю природою, але можна виділити 4 основних патогенетичних складових, участь яких визначається як індивідуальними особливостями, так і часом від розвитку гострого коронарного синдрому до проведення реваскуляризації. До цих патогенетичних механізмів зараховують: ішемічне та реперфузійне пошкодження, дистальну емболізацію та чутливість мікроциркуляції до пошкодження, що характеризує генетичну або набуту схильність до розвитку цього синдрому [37–39]. Всі ці патогенетичні механізми описують теорію вторинного (щодо процесів в епікардіальних коронарних артеріях) пошкодження мікроциркуляції міокарда. Але пояснити тільки за допомогою цієї теорії велику різноманітність клінічних проявів (відсутність скарг, стабільні стенокардія, ГКС без елевації та з елевацією сегмента ST) при морфологічно однакових пошкодженнях атеросклеротичних бляшок в епікардіальних артеріях досить складно [40–41]. Не дуже вкладається в цю теорію також значне збільшення ризику повторних коронарних подій протягом перших місяців після ГІМ. На сьогодні багато фактів свідчить про те, що порушення міокардіальної мікроциркуляції можуть передувати дестабілізації атеросклеротичної бляшки й розвитку атеротромбозу та мають суттєву роль у патогенезі гострого коронарного синдрому та розвитку синдрому невідновленого кровотоку.
У ряді досліджень у пацієнтів із ГІМ було показано суттєве зменшення коронарного кровотоку (приблизно на 50 %) в коронарних артеріях, які не обумовлювали розвиток інфаркту [42]. При цьому погіршення кровотоку спостерігалося як до, так і після відновлення магістрального кровотоку в інфаркт-залежній коронарній артерії під час первинної ПТКА, що свідчить швидше на користь глобальних, ніж локальних порушень міокардіальної мікроциркуляції у хворих із ГІМ [43]. У пацієнтів без значимих стенозів коронарних артерій проведення проби з внутрішньокоронарним введенням ацетилхоліну дозволяло виявити групу з високим ризиком серцево-судинних ускладнень (у тому числі ГКС) у майбутньому (знижений коронарний резерв), що свідчить про участь ендотеліальної дисфункції в патогенезі цих ускладнень [44–45]. Такий самий зв’язок між зниженням коронарного резерву та збільшенням кількості перипроцедурних ускладнень та серцево-судинних подій протягом тривалого спостереження було показано і для пацієнтів, яким проводили ПТКА у зв’язку з наявністю значимого ураження коронарних артерій [46–47]. На підтримку ролі ендотеліальної дисфункції в розвитку синдрому no reflow виступають також результати проспективних та ретроспективних досліджень з використанням статинів для попередження його розвитку. В одному з досліджень прийом статинів до розвитку ГІМ передньої локалізації дозволяв на 74 % зменшити вірогідність розвитку синдрому невідновленого кровотоку після проведення первинної ПТКА [48]. Результати регістрів також свідчать, що прийом статинів до розвитку ГІМ чи їх призначення в першу добу ГІМ дозволяє попередити серцево-судинні ускладнення в постінфарктному періоді, тоді як відміна цих препаратів при розвитку ГІМ асоціюється з найгіршими результатами [49–51]. Більше того, призначення великих доз статинів безпосередньо перед проведенням первинної ПТКА дозволяло зменшити розмір інфаркту міокарда та попередити розвиток серцево-судинних ускладнень [52–54]. Збільшення частоти спонтанної реканалізації інфаркт-залежної коронарної артерії та зменшення розмірів інфаркту міокарда було також продемонстровано при застосуванні інгібіторів АПФ (покращують функцію ендотелію) у передінфарктний період [55–56].
Висновки
1. Хворі на ГІМ з елевацією сегмента ST характеризуються низьким приростом діаметра плечової артерії при проведенні проби з потік-залежною вазодилатацією на першу добу, що свідчить про початкові порушення ендотеліальної функції з наступним її покращенням на фоні сучасного лікування.
2. Результати ППЗВ на першу добу у хворих із ГІМ не залежать від основних клініко-анамнестичних характеристик, переважної локалізації ІМ та ступеня ураження коронарних артерій, але корелюють із рівнем глюкози на момент госпіталізації.
3. Ендотеліальна дисфункція на першу добу ГІМ з елевацією сегмента ST асоціюється з рідшою спонтанною реканалізацією інфаркт-залежної коронарної артерії та частішим розвитком синдрому no reflow після проведення первинної ПТКА, що може обумовлювати більший розвиток внутрішньогоспітальних ускладнень.
1. Мoйбенко О.О., Сагач В.Ф., Шаповал Л.М. та ін. Роль ендотелію та біологічно-активних речовин ендотеліального походження в регуляції кровообігу та діяльності серця // Фізіол. журн. — 1997. — 43(1–2). — 3–18.
2. Luscher T.F., Noll G. The pathogenesis of cardiovascular disease: role of the endothelium as a target and mediator // Atherosclerosis. — 1995 Dec. — 118 Suppl. — S81–90.
3. Bartolomucci F., Barone G., Alitto N.D. et al. Carotid artery remodelling and endothelial function in patients with cardiac hypertrophy // J. Hypertens. — 2003.
4. Ghiadoni L., Taddei S., Virdis A. et al. Endothelial function and common carotid artery wall thickening in patients with essential hypertension // Hypertension. — 1998 Jul. — 32(1). — 25–2.
5. Brunner H., Cockcroft J.R., Deanfield J., Donald A., Ferrannini E., Halcox J. et al. Endothelial function and dysfunction. Part II: Association with cardiovascular risk factors and diseases. A statement by the Working Group on Endothelins and Endothelial Factors of the European Society of Hypertension // J. Hypertens. — 2005. — 23. — 233–246.
6. Schächinger V., Britten M.B., Zeiher A.M. Prognostic impact of coronary vasodilator dysfunction on adverse long-term outcome of coronary heart disease // Circulation. — 2000. — 101. — 1899–1906.
7. Heitzer T., Schlinzig T., Krohn K. et al. Endothelial dysfunction, oxidative stress, and risk of cardiovascular events in patients with coronary artery disease // Circulation. — 2001. — 104. — 2673–2678.
8. Perticone F., Ceravolo R., Pujia A. et al. Prognostic significance of endothelial dysfunction in hypertensive patients // Circulation. — 2001. — 104. — 191–196.
9. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC) / Steg P.G., James S.K., Atar D. et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation // Eur. Heart J. — 2012 Oct. — 33(20). — 2569–619.
10. Пархоменко А.Н., Амосова К.М., Дзяк Г.В. та ін. Рекомендації Асоціації кардіологів України щодо ведення пацієнтів з гострим коронарним синдромом з елевацією сегмента ST // УКЖ. — 2013. — Додаток 3.
11. Celermajer D.S., Sorensen K.E., Gooch V.M., Spiegelhalter D.J., Miller O.I., Sullivan I.D., Lloyd J.K., Deanfield J.E. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis // Lancet. — 1992. — 340. — 1111–1115.
12. Charakida M., Masi S., Luscher T.F., Kastelein J.J., Deanfield J.E. Assessment of atherosclerosis: the role of flow-mediated dilatation // European heart journal. — 2010. — 31. — 2854–2861.
13. Harris R.A., Nishiyama S.K., Wray D.W., Richardson R.S. Ultrasound assessment of flow-mediated dilation // Hypertension. — 2010. — 55. — 1075–1085.
14. Thijssen D.H., Black M.A., Pyke K.E., Padilla J., Atkinson G., Harris R.A., Parker B., Widlansky M.E., Tschakovsky M.E., Green D.J. Assessment of flow-mediated dilation in humans: a methodological and physiological guideline // American journal of physiology. — 2011. — 300. — H2–12.
15. StatSoft, Inc. (2004). STATISTICA (data analysis software system), version 7. www.statsoft.com
16. Chen S.M., Tsai T.H., Hang C.L. et al. Endothelial dysfunction in young patients with acute ST-elevation myocardial infarction // Heart Vessels. — 2011 Jan. — 26(1). — 2–9.
17. Jensen C.J., Eberle H.C., Nassenstein K. et al. Impact of hyperglycemia at admission in patients with acute ST-segment elevation myocardial infarction as assessed by contrast-enhanced MRI // Clin. Res. Cardiol. — 2011. — 100(8). — 649–659.
18. Пархоменко О.М., Гур’єва О.С., Іркін О.І. та співавт. Цукровий діабет та глікемія при госпіталізації з приводу ГІМ з елевацією сегмента ST як маркери несприятливого перебігу ІХС за даними тривалого спостереження // Укр. кардіол. журн. — 2008. — 2. — 117–118.
19. Hadjadj S., Coisne D., Mauco G. et al. Prognostic value of admission plasma glucose and HbA in acute myocardial infarction // Diabet. Med. — 2004. — 21(4). — 305–310.
20. Liu Y., Yang Y.M., Zhu J. et al. Haemoglobin A(1c), acute hyperglycaemia and short-term prognosis in patients without diabetes following acute ST-segment elevation myocardial infarction // Diabet. Med. — 2012. — 29(12). — 1493–1500.
21. Du X.L., Edelstein D., Dimmeler S. et al. Hyperglycemia inhibits endothelial nitric oxide synthase activity by posttranslational modification at the Akt site // Journal of Clinical Investigation. — 2001. — Vol. 108, № 9. — pp. 1341–1348.
22. Luppi P., Cifarelli V., Tse H. et al. Human C–peptide antagonises high glucose-induced endothelial dysfunction through the nuclear factor-кB pathway // Diabetologia. — 2008. — Vol. 51, № 8. — P. 1534–1543.
23. Piga R., Naito Y., Kokura S., et al. Short-term high glucose exposure induces monocyte-endothelial cells adhesion and transmigration by increasing VCAM-1 and MCP-1 expression in human aortic endothelial cells // Atherosclerosis. — 2007. — Vol. 193. — № 2. — P. 328–334.
24. Piconi L., Quagliaro L., da Ros R. et al. Intermittent high glucose enhances ICAM-1, VCAM-1, E–selectin and interleukin-6 expression in human umbilical endothelial cells in culture: the role of poly(ADP-ribose) polymerase // Journal of Thrombosis and Haemostasis —2004. — Vol. 2, № 8. — P. 1453–1459.
25. El-Osta A., Brasacchio D., Yao D. et al. Transient high glucose causes persistent epigenetic changes and altered gene expression during subsequent normoglycemia // Journal of Experimental Medicine. — 2008. — Vol. 20, № 10. — P. 2409–2417.
26. Shechter M., Shechter A., Hod H. et al. Brachial artery endothelial function predicts platelet function in control subjects and in patients with acute myocardial infarction // Platelets. — 2012. — 23(3). — 202–10.
27. Gregory Y.H. Effects of hormone-replacement therapy on hemostatic factors, lipid factors and endothelial functions in women undergoing surgical menopause: implications for prevention for atherosclerosis // Am. Heart J. — 1997. — Vol. 134(4). — P. 164–771.
28. Пархоменко А.Н., Лутай Я.М., Иркин О.И., Кожухов С.Н., Скаржевский А.А., Шумаков А.В., Довгань Н.В., Досенко В.Е., Мойбенко А.А. Полиморфизм гена эндотелиальной NO-синтетазы у больных с острыми коронарными синдромами — распространенность, значение для прогноза и выбора тактики лечения // Український кардіологічний журнал. — 2009. — Додаток 1: Матеріали X Національного конгресу кардіологів України (Київ, 23–25 вересня 2009 р.). — С. 15–24.
29. Vasilieva E., Urazovskaya I., Skrypnik D., Shpektor A. Total occlusion of the infarct-related coronary artery correlates with brachial artery flow-mediated dilation in patients with ST-elevation myocardial infarction // Acute Card Care. — 2009. — 11(3). — 155–9.
30. Уразовская И.Л. Эндотелиальная дисфункция у больных с острым инфарктом миокарда с подъемом сегмента ST // Креативная кардиология. — 2010. — № 2. — С. 5–24.
31. Van’t Hof A.W., Liem A., Suryapranata H. et al. Angiographic Assesment of Myocardial Reperfusion in Patients Treated With Prymary Angioplasty for Acute Myacardial infarction Myocardial Blush Grade // Circulation. — 1998. — 97. — 2302–2306.
32. Kampinga M.A., Nijsten M.W., Gu Y.L. et al. Is the myocardial blush grade scored by the operator during primary percutaneous coronary intervention of prognostic value in patients with ST-elevation myocardial infarction in routine clinical practice? // Circ. Cardiovasc. Interv. — 2010 Jun. — 1, 13(3). — 216–23.
33. Brener S.J., Mehran R., Dizon J. et al. Complementary prognostic utility of myocardial blush grade and ST-segment resolution after primary percutaneous coronary intervention: Analysis from the HORIZONS-AMI trial // Journal of the American College of Cardiology. — Vol. 61, Issue 10, Suppl. — P. E1854.
34. Ptaszyńska-Kopczyńska K., Sobolewska D, Kożuch M. et al. Efficacy of invasive treatment and the occurrence of cardiac rupture in acute ST-elevation myocardial infarction // Kardiologia Polska. — 2011. — 69; 8. — 795–800.
35. Stone G.W., Peterson M.A., Lansky A.J. et al. Impact of normalized myocardial perfusion after successful angioplasty in acute myocardial infarction // J. Am. Coll. Cardiol. — 2002. — 39. — 591–597.
36. Prasad S., Meredith I.T. Current Approach to Slow Flow and No-Reflow A preventive approach appears to be the best strategy based on current understanding of this phenomenon // Cardiac Interventions Today. — 2008. — № 1. — P. 43–51.
37. Niccoli G., Burzotta F., Galiuto L., Crea F. Myocardial no-reflow in humans // J. Am. Coll Cardiol. — 2009. — 54. — 281–292.
38. Reffelmann T., Kloner R.A. The no-reflow phenomenon: a basic mechanism of myocardial ischemia and reperfusion // Basic. Res. Cardiol. — 2006. — 101. — 359–372.
39. Zalewski J., Undas A., Godlewski J., Stepien E., Zmudka K. No-reflow phenomenon after acute myocardial infarction is associated with reduced clot permeability and susceptibility to lysis // Arterioscler. Thromb Vasc. Biol. — 2007. — 27. — 2258–2265.
40. Burke A.P., Kolodgie F.D., Farb A., Weber D.K., Malcom G.T., Smialek J., Virmani R. Healed plaque ruptures and sudden coronary death: evidence that subclinical rupture has a role in plaque progression // Circulation. — 2001. — 103. — 934–940.
41. Maehara A., Mintz G.S., Bui A.B., Walter O.R., Castagna M.T., Canos D., Pichard A.D., Satler L.F., Waksman R., Suddath W.O., Laird J.R. Jr, Kent K.M., Weissman N.J. Morphologic and angiographic features of coronary plaque rupture detected by intravascular ultrasound // J. Am. Coll. Cardiol. — 2002. — 40. — 904–910.
42. Gibson C.M., Cannon C.P., Murphy S.A., Ryan K.A., Mesley R., Marble S.J., McCabe C.H., Van De Werf F., Braunwald E. Relationship of TIMI myocardial perfusion grade to mortality after administration of thrombolytic drugs // Circulation. — 2000. — 101. — 125–130.
43. Suwaidi J.A., Hamasaki S., Higano S.T., Nishimura R.A., Holmes D.R. Jr, Lerman A. Long-term follow-up of patients with mild coronary artery disease and endothelial dysfunction // Circulation. — 2000. — 101. — 948–954.
44. Britten M.B., Zeiher A.M., Schachinger V. Microvascular dysfunction in angiographically normal or mildly diseased coronary arteries predicts adverse cardiovascular long-term outcome // Coron. Artery Dis. — 2004. — 15. — 259–264.
45. Marks D.S., Gudapati S., Prisant L.M., Weir B., diDonato–Gonzalez C., Waller J.L., Houghton J.L. Mortality in patients with microvascular disease // J. Clin. Hypertens (Greenwich). — 2004. — 6. — 304–309.
46. Albertal M., Voskuil M., Piek J.J., de Bruyne B., Van Langenhove G., Kay P.I., Costa M.A., Boersma E., Beijsterveldt T., Sousa J.E., Belardi J.A., Serruys P.W. Coronary flow velocity reserve after percutaneous interventions is predictive of periprocedural outcome // Circulation. — 2002. — 105. — 1573–1578.
47. Herrmann J., Haude M., Lerman A., Schulz R., Volbracht L., Ge J., Schmermund A., Wieneke H., von Birgelen C., Eggebrecht H., Baumgart D., Heusch G., Erbel R. Abnormal coronary flow velocity reserve after coronary intervention is associated with cardiac marker elevation // Circulation. — 2001. — 103. — 2339–2345.
48. Iwakura K., Ito H., Kawano S., Okamura A., Kurotobi T., Date M., Inoue K., Fujii K. Chronic pre–treatment of statins is associated with the reduction of the no-reflow phenomenon in the patients with reperfused acute myocardial infarction // Eur. Heart J. — 2006. — 27. — 534–539.
49. Spencer F.A., Allegrone J., Goldberg R.J., Gore J.M., Fox K.A., Granger C.B., Mehta R.H., Brieger D. Association of statin therapy with outcomes of acute coronary syndromes: the GRACE study // Ann. Intern. Med. — 2004. — 140. — 857–866.
50. Lenderink T., Boersma E., Gitt A.K., Zeymer U., Wallentin L., Van de Werf F., Hasdai D., Behar S., Simoons M.L. Patients using statin treatment within 24 h after admission for ST-elevation acute coronary syndromes had lower mortality than non-users: a report from the first Euro Heart Survey on acute coronary syndromes // Eur. Heart J. — 2006 Aug. — 27(15). — 1799–804.
51. Heeschen C., Hamm C.W., Laufs U., Snapinn S., Bohm M., White H.D. Withdrawal of statins increases event rates in patients with acute coronary syndromes // Circulation. — 2002. — 105. — 1446–1452.
52. Patti G., Pasceri V., Colonna G., Miglionico M., Fischetti D., Sardella G., Montinaro A., Di Sciascio G. Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention: results of the ARMYDA-ACS randomized trial // J. Am. Coll Cardiol. — 2007 Mar. — 27; 49(12). — 1272–8.
53. Yun K.H., Jeong M.H., Oh S.K., Rhee S.J., Park E.M., Lee E.M., Yoo N.J., Kim N.H., Ahn Y.K., Jeong J.W. The beneficial effect of high loading dose of rosuvastatin before percutaneous coronary intervention in patients with acute coronary syndrome // Int. J. Cardiol. — 2009 Nov. — 12; 137(3). — 246–51.
54. Yun K.H., Oh S.K., Rhee S.J., Yoo N.J., Kim N.H., Jeong J.W. 12-month follow-up results of high dose rosuvastatin loading before percutaneous coronary intervention in patients with acute coronary syndrome // Int. J. Cardiol. — 2011 Jan. — 7, 146(1). — 68–72.
55. Kennon S., Barakat K., Hitman G.A., Price C.P., Mills P.G., Ranjadayalan K., Cooper J., Clark H., Timmis A.D. Angiotensin-converting enzyme inhibition is associated with reduced troponin release in non-ST-elevation acute coronary syndromes // J. Am. Coll. Cardiol. — 2001. — 38. — 724–728.
56. Robinson C.R., Martin J.L., Zhang L., Canham R.M., Abdullah S.M., Cigarroa J.E., Hillis L.D., Murphy S.A., McGuire D.K., de Lemos J.A., Keeley E.C. Nfarctrelated coronary artery patency and medication use prior to ST-segment elevation myocardial infarction // Am. J. Cardiol. — 2006. — 97. — 7–9.

/36/36.jpg)
/37/37.jpg)
/37/37_2.jpg)
/38/38.jpg)
/39/39.jpg)
/40/40.jpg)
/41/41.jpg)