Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Пропофол в современной поликомпонентной общей анестезии
Авторы: Сорокина Е.Ю. - ГУ «Днепропетровская медицинская академия» МЗ Украины
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
В статье приведены данные, свидетельствующие о том, что использование Пропофола Каби в практике анестезиолога улучшает качество анестезиологического обеспечения и повышает безопасность пациента.
У статті наведено дані, що свідчать про те, що використання Пропофолу Кабі в практиці анестезіолога покращує якість анестезіологічного забезпечення і підвищує безпеку пацієнта.
The paper presents evidence that the use of Propofol Kabi in practice of anesthesiologist improves quality of anesthetic management and increases patient’s safety.
общая анестезия, Пропофол Каби, безопасность.
загальна анестезія, Пропофол Кабі, безпека.
general anesthesia, Propofol Kabi, safety.
Статья опубликована на с. 69-75
Один из главных принципов современной анестезиологии — это обеспечение максимальной безопасности пациента во время и после наркоза. По мере расширения знаний о механизмах боли и обезболивания продолжается развитие и совершенствование методов общей анестезии. Общая анестезия должна обеспечивать быструю и приятную индукцию, предсказуемую потерю сознания, стабильность витальных функций, минимальное количество побочных эффектов, быстрое и плавное восстановление защитных рефлексов и психомоторных функций. В связи с внедрением в практику новых анестетиков с улучшенными свойствами в литературе продолжается дискуссия о выборе гипнотического компонента общей анестезии.
В рамках реализации специальной программы по разработке внутривенных средств для анестезии короткой и ультракороткой длительности действия в 1976 г. английским химическим концерном ICI был синтезирован пропофол, который был введен в клиническую практику и описан B. Kay, G. Rolly (1977) как идеальный внутривенный анестетик [1].
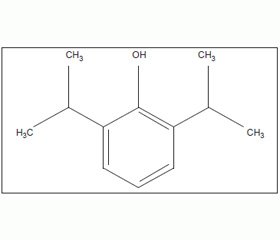
По химической структуре пропофол представляет собой 2,6 диизопропил-фенол (2,6-diisopropylphenol), молекулярная и структурная формулы:
/69/69.jpg)
Пропофол очень слабо растворяется в воде и поэтому выпускается в виде водно-масляной эмульсии белого цвета.
Быстрое наступление эффекта обусловлено высокой липофильностью пропофола и легким прохождением через гематоэнцефалический барьер, в результате чего выключение сознания наступает очень быстро. За последние 30 лет фармакологами были широко изучены эффекты пропофола, направленные на функцию рецепторов гамма-аминомасляной кислоты типа А (ГАМК-А) [2, 3]. Обосновано, что пропофол активирует ГАМК-А-рецепторы нейронов [4]. Это приводит к гиперполяризации нервных клеток и снижению их возбудимости, затруднению передачи нервных импульсов от нейрона к нейрону. С точки зрения фармакологии пропофол является гипнотиком, который обеспечивает выраженный седативный эффект и амнезию.
Одно из главных преимуществ пропофола перед другими анестетиками — способность быстро изменять уровень седации за счет короткого времени полувыведения препарата (t1/2) [5]. Кинетика препарата после внутривенной болюсной инъекции может быть представлена в виде модели из трех частей: быстрая фаза распределения (t1/2 составляет 2–4 минуты), β-фаза, которая характеризуется быстрым выведением из организма (t1/2 — 30–60 минут); далее отмечается более медленная фаза, для которой характерно перераспределение пропофола из слабоперфузируемых тканей (мышцы, жир) в кровь.
Пропофол широко распределяется и быстро выводится из организма (общий клиренс составляет 1,5–2,0 л/мин). Концентрация пропофола в плазме крови возрастает пропорционально увеличению скорости его введения, а стало быть, и дозы. Экспериментальные и клинические исследования подтвердили линейность фармакодинамики пропофола, что обусловливает предсказуемость его клинического действия [6, 7]. T.W. Schnider et al. (1999) описали взаимосвязь между концентрацией пропофола в крови, возрастом и дозой [8].
Основным органом, в котором осуществляется метаболизм препарата, считают печень (60 %), где пропофол метаболизируется в неактивные глюкуронидные и сульфатные конъюгаты, которые экскретируются с мочой (до 88 %). При этом ведущая роль принадлежит не функциональному состоянию этого органа, а скорости печеночного кровотока. Метаболизм пропофола происходит также вне печени — в почках (до 30 %).
F. Servin et al. (1990) сравнивали фармакокинетику пропофола при его инфузии для поддержания общего обезболивания (6 мг/кг/ч) пациентам с циррозом печени и в контрольной группе [9]. Показали, что объем распределения был значительно выше у пациентов с циррозом печени, чем в контрольной группе (в 1,66 раза). Однако эта разница не меняла время полувыведения пропофола. F.J. Carmichael et al. (1993) в экспериментальных исследованиях на крысах продемонстрировали, что поддержание анестезии с использованием инфузионного пропофола привело к увеличению потребления кислорода, что полностью было компенсировано за счет увеличения доставки кислорода к печени [10]. Таким образом, высокий печеночный клиренс и неактивные метаболиты пропофола обусловливают быстрое восстановление психомоторных и когнитивных функций.
Это позволило применять пропофол как индукционное средство для вводного наркоза, а также для поддержания общей анестезии любой продолжительности в любых областях хирургии: абдоминальной, торакальной, сосудистой, сердечной, травматологии, нейрохирургии, офтальмологии, гинекологии. Пропофол успешно используется для обеспечения седативного эффекта во время проведения интенсивной терапии, а также для седации при хирургических или диагностических процедурах [11, 12]. В случае, если пропофол используется в качестве дополнительного средства при применении местной анестезии, могут быть достаточны его более низкие дозы [13].
Особую популярность пропофол приобрел как средство для анестезии в амбулаторной хирургии, когда большое значение имеет быстрое восстановление психомоторных функций пациентов с низкой частотой развития послеоперационной тошноты и рвоты [14–16].
Отсутствие анальгетических свойств у пропофола потребовало использования дополнительных анальгетиков при проведении общей анестезии [17]. Совершенствование знаний о фармакокинетике и фармакодинамике средств общей анестезии, изучение взаимодействия препаратов для внутривенного введения позволило с помощью выбора оптимальных препаратов и их комбинаций обеспечивать амнезию, контролировать уровень анестезии и обезболивания [18–20].
С 1986 г. пропофол широко используется как компонент тотальной внутривенной анестезии (ТВА). При этом выключение сознания, анальгезия, амнезия, стабильность вегетативной нервной системы, миорелаксация обеспечиваются и управляются селективно действующим внутривенным препаратом с короткой продолжительностью действия и периодом полураспада [21].
Из многочисленных публикаций мы знаем, что ТВА позволяет обеспечить высококачественные условия анестезии, избежать продукции флюоридных ионов, связанной с применением некоторых ингаляционных анестетиков, перерастяжения наполненных воздухом пространств тела пациента и создать оптимальные условия для оперирующего хирурга, избежать послеоперационной диффузионной гипоксии, уменьшить частоту послеоперационной рвоты и тошноты, минимизировать риск злокачественной гипертермии, предотвратить токсические эффекты низких концентраций ингаляционных анестетиков на персонал операционной [22].
A.R. Aitkenhead et al. (1989) провели обследование 101 пациента в критическом состоянии, госпитализированных в отделение реанимации и интенсивной терапии, которым в течение 24 ч проводилась анальгоседация (в среднем 20,2 ч) с помощью морфина и непрерывной внутривенной инфузии пропофола (1,77 мг/кг/ч) или мидазолама (в среднем 0,10 мг/кг/ч) для достижения желаемого уровня седации. В обеих группах наблюдения регистрировалось незначительное снижение артериального давления (АД), но не было никаких существенных различий между ними. Пульс был реже у пациентов, получавших пропофол. Анестетики клинически значимо не влияли на лабораторные показатели крови. После прекращения инфузии у пациентов, которые получили пропофол, была меньшая изменчивость при восстановлении сознания и их значительно быстрее отлучали от искусственной вентиляции легких (ИВЛ) по сравнению с группой мидазолама [23].
К специфическим характеристикам пропофола можно отнести урежение частоты сердечных сокращений, которое сопровождает введение препарата в клинически эффективной дозе. В обсуждении возможных механизмов развития брадикардии большинство исследователей сходятся в том, что ее причина в ваготоническом действии пропофола. Так, N.N. Win et al. (2005) показали, что пропофол вызывает значительное уменьшение общей мощности парасимпатического отдела нервной системы при анализе вариабельности сердечного ритма во время анестезии [24], что необходимо учитывать, особенно у пациентов с риском сердечно–сосудистых осложнений.
Пропофол не удлиняет интервал QT в отличие от некоторых других анестетиков. С точки зрения электрофизиологии интервал QT отражает сумму процессов деполяризации (электрическое возбуждение со сменой заряда клеток) и последующей реполяризации (восстановление электрического заряда) миокарда желудочков. Удлинение интервала QT — это изменение электрокардиограммы (ЭКГ), которое может привести к развитию потенциально опасной полиморфной желудочковой тахикардии, известной как трепетание-мерцание (torsade de pointes). S. Paventi et al. (2001), S.D. Whyte et al. (2005), основываясь на данных регистрации двенадцатиканальной ЭКГ в периоперационном периоде у детей в возрасте от 1 до 16 лет (ASA I–III), показали, что севофлюран увеличивает продолжительность реполяризации миокарда у детей в большей степени, чем пропофол, при отсутствии других факторов, удлиняющих QT. Пропофол, в отличие от севофлюрана, не влиял на интервал QTc (интервал QT, скорректированный с помощью формулы Bazett) [25, 26].
Пропофол в обычных дозах для индукции (1,5–2,0 мг/кг) может вызывать снижение АД. Имеется четкая прямо пропорциональная зависимость между степенью снижения АД и возрастом пациентов: у детей — до 10 %, у взрослых (18–65 лет) до 25–30 %, у пожилых (старше 65 лет) — до 35 %. Пропофол подавляет активность симпатической нервной системы [27, 28]. P.F. Wouters et al. (1995) продемонстрировали достоверную зависимость степени снижения уровня общего периферического сосудистого сопротивления от дозы вводимого пропофола [29].
Миорелаксирующий эффект пропофола подтверждается значительным количеством публикаций. Пропофол индуцирует бронходилатацию и уменьшает сопротивление дыхательных путей, поэтому может быть полезным для пациентов с бронхоспазмом. Для гемодинамически стабильных пациентов с бронхиальной астмой, требующей интубации, пропофол может рассматриваться как препарат выбора для индукции анестезии [30, 31]. W.O. Еames et al. (1996) показали, что пропофол ослабляет прессорную реакцию гемодинамики в ответ на интубацию трахеи [32]. F. Trabold et al. (2004) отмечают хорошую способность пропофола подавлять гортаноглоточные рефлексы [33]. Этим обстоятельством объясняется и тот факт, что пропофол считается идеальным средством для введения ларингеальной маски в условиях как самостоятельного дыхания, так и ИВЛ.
Кроме того, обусловливая гиподинамическую реакцию кровообращения, пропофол опосредованно действует на внутричерепное и внутриглазное давление. В некоторой степени это определяет успех применения препарата при анестезии в нейро- и офтальмохирургии [34].
Пропофол, как и тиопентал, снижает внутричерепное давление, поэтому является подходящим препаратом для индукции при нейрохирургических операциях. Внутривенный анестетик вводится с соответствующей дозой опиоида короткого действия и нейромышечным блокатором для обеспечения гладкой индукции и эндотрахеальной интубации, что позволяет избежать гипоксемии и гиперкапнии.
L.A. Steiner (2003) показал, что у здоровых лиц инфузия пропофола сохраняет или даже улучшает ауторегуляцию цереброваскулярного давления. Однако цереброваскулярные эффекты пропофола отличаются у пациентов с черепно-мозговой травмой при инфузии больших доз препарата. Сделан вывод, что для обеспечения ауторегуляции мозгового кровотока целесообразно использование контролируемой инфузии с умеренной (до 2,3 ± 0,4 мкг/мл) целевой плазменной концентрацией пропофола [35].
A. Shah et al. (2011) изучали скорость восстановления когнитивных функций у 50 пациентов (ASA I–II) после лапароскопических операций продолжительностью 1–2 часа [36]. Показано, что у всех пациентов индукция пропофолом (2 мг/кг) не сопровождалась неблагоприятными изменениями гемодинамики, эпизодами кашля или ларингоспазма. Поддержание анальгезии обеспечивалось фентанилом, миоплегия — векуронием. У больных 1-й группы поддержание анестезии осуществлялось за счет инфузии пропофола (75–125 мкг/кг/мин.), во 2-й группе — с помощью севофлюрана до 1,5 об.%. Показано, что использование севофлюрана обеспечило повышение интраоперационной стабильности гемодинамики (отсутствие брадикардии и снижения АД).
Ингаляционные анестетики остаются методом выбора для поддержания анестезии. Одним из представителей нового поколения средств для общей анестезии является севофлюран, который по химической природе представляет собой галогенизированный фторсодержащий эфир. Однако ингаляционные анестетики имеют свои недостатки, которые заключаются в их высокой стоимости, необходимости сложной аппаратуры для мониторинга безопасности анестезии, наличия специфических испарителей, постоянного обслуживания системы очистки выдыхаемого воздуха, возможном загрязнении окружающей среды операционной при использовании лицевой маски. Hsiu-Pin Chen et al. (2013) отметили, что поддержание анестезии пропофолом, по сравнению с севофлюраном, снижает частоту послеоперационной тошноты и рвоты [37]. Проведение ТВА сопровождалось значительным сокращением затрат на проведение общего обезболивания.
Поскольку пропофол не обладает анальгетическими свойствами, традиционным антиноцицептивным компонентом для комбинации с пропофолом является фентанил. Но оба препарата стимулируют парасимпатическую активность, поэтому ваготонические реакции (гипотония, брадикардия) при их сочетанном использовании наиболее выражены [38].
N. Yeganeh et al. (2010) у 60 пациентов в возрасте 18–60 лет (ASA I–II) при проведении мастоидэктомии, когда бескровное поле имеет огромное значение для хирурга, показали преимущества проведения целевой контролируемой инфузии (target-controlled infusion, TCI) пропофола и ремифентанила по сравнению с ручной регулировкой инфузии (manually controlled infusion, MCI). Интраоперационно TCI обеспечивает более стабильные показатели гемодинамики и более комфортные условия для работы хирургов (р ≤ 0,05), а послеоперационно — более быстрое восстановление, уменьшение частоты тошноты и рвоты (р < 0,05) [39].
На сегодня TCI — это стандарт для целевой контролируемой инфузии, когда внутривенные анестетики для индукции и поддержания общей анестезии вводятся при помощи микропроцессор-контролируемых инфузионных насосов [40]. Ритм инфузии препаратов для ТВА рассчитывается на основе многокамерной фармакокинетической модели в соответствии с целевой концентрацией анестетика в плазме крови. Метод позволяет точно титровать анестетики, обеспечивая последовательные уровни концентрации препарата, и контролировать глубину анестезии. Первая коммерческая система TCI для пропофола была создана в 1996 г., что позволило уменьшить количество побочных эффектов препаратов для общей анестезии за счет отсутствия необходимости применения их высоких доз [41].
В рамках Ассоциации обществ анестезиологов создано Научное общество тотальной внутривенной анестезии (Scientific Society of Intravenous Anaesthesia — World SIVA). В 2007 г. проведен первый конгресс World SIVA, который собрал специалистов из 64 стран мира. В 2014 году проводится четвертый конгресс (World Congress of Total Intravenous Anaesthesia and Target Controlled Infusion), что свидетельствует об актуальности разработки более безопасных и контролируемых методов общей анестезии. Так, на сегодня для улучшения качества анестезии и уменьшения расхода анестетиков разработан и внедрен метод непрерывной регистрации электроэнцефалограммы для измерения эффекта общей анестезии. Биспектральный индекс (BIS) отражает меру фармакодинамического воздействия анестезии на центральную нервную систему и коррелирует с прогнозируемой концентрацией пропофола в плазме крови [42, 43].
Пропофол как средство для неингаляционного наркоза привлекает внимание отечественных анестезиологов с 1991 г. Благодаря своим уникальным фармакокинетическим и фармакодинамическим свойствам гипнотика пропофол используется как компонент общего обезболивания в различных областях хирургии и интенсивной терапии (для медикаментозной седации и адаптации пациентов к аппаратам искусственной вентиляции легких).
Отечественными учеными рассмотрены современные вопросы фармакокинетики и фармакодинамики пропофола. Л.В. Усенко и соавт. (2004) освещены особенности анестезии у детей, лиц пожилого возраста и больных с высоким операционно-наркозным риском [44]. Известно, что объемы распределения у людей с возрастом сокращаются, а стало быть, эффекты препарата могут быть достигнуты быстрее и носить более выраженный характер. Этим и продиктованы соображения осторожности при применении сильнодействующих средств в отношении людей пожилого возраста.
В 2013 г. Фармкомитетом МЗ Украины был зарегистрирован и таким образом разрешен к клиническому применению в нашей стране Пропофол Каби (международное название — пропофол). Производитель — компания «Фрезениус Каби Австрия ГмбХ». Пропофол Каби инъекционная эмульсия является стерильной непирогенной эмульсией, содержащей 10 и 20 мг/мл пропофола для внутривенного введения.
Кроме основного вещества (10 или 20 мг/мл) Пропофол Каби содержит в своем составе масло соевое рафинированное, среднецепочечные триглицериды, фосфолипиды яичного желтка, глицерин, кислоту олеиновую, натрия гидроксид и воду для инъекций.
Первая жировая эмульсия (ЖЭ) для внутривенного введения на основе соевого масла была создана в 1961 г., роль эмульгатора в ней выполняли фосфолипиды яичного желтка. Данная ЖЭ содержит длинноцепочечные триглицериды (LCT) из соевого масла с двумя незаменимыми жирными кислотами: α-линоленовой (ω-3) и линолевой (ω-6). Один из возможных недостатков LCT жировой эмульсии связан с относительно высоким содержанием полиненасыщенных жирных кислот (ПНЖК). Следующим этапом развития жировых эмульсий для внутривенного введения стало добавление к LCT среднецепочечных триглицеридов (MCT). Преимуществами композиции LCT/MCT стало не только снижение за счет разведения нежелательных эффектов, но и появление дополнительных положительных свойств, а именно ускорения утилизации мышцами, поступления в митохондрии независимо от карнитина, уровень которого часто снижается у пациентов. Кроме того, добавление оливкового масла (ω-9, олеиновая кислота), богатого мононенасыщенными жирными кислотами, снижает соотношение с ПНЖК. Поэтому современные растворы пропофола демонстрируют улучшенную стабильность [45].
Существует мнение, что поскольку пропофол представляет собой липидную эмульсию, следует применять особые меры предосторожности для пациентов с тяжелыми расстройствами жирового обмена, такими, например, как патологическая гиперлипидемия. S. Gottschling et al. (2005) показали, что у детей, которым при проведении магнитно-резонансной томографии обеспечивалась седация пропофолом, повышались уровни липазы (р = 0,035) и триглицеридов (р = 0,003) сыворотки крови, однако их значения оставались в пределах нормы [46].
Изменение состава жировой эмульсии — носителя Пропофола Каби (замена LCT на LCT/MCT) способствует снижению негативного влияния на липидный обмен у больных с его выраженным исходным нарушением (несмотря на относительно небольшое количество ЖЭ, вводимое в процессе анестезии) [47]. Значение этого фактора увеличивается с возрастанием длительности анестезии.
Пропофол LCT/MCT оказывает меньшее влияние на уровень липидов крови при трансплантации печени и поэтому более удобен при данном виде хирургии (Zhang et al, 2011) по сравнению с пропофолом, растворенным в чистой LСТ-эмульсии.
Жирные кислоты (ЖК) могут оказывать влияние на воспалительные и иммунные процессы [48]. По данным G.J.A. Wanten, P.C. Calder (2007), для уменьшения воздействия ЖЭ на иммунную систему рекомендуется замещение части соевого масла (ω-6) менее биологически активными компонентами, такими как среднецепочечные триглицериды (MCT), мононенасыщенные ЖК (ω-9), полиненасыщенные ЖК типа ω-3 [49].
Замена LCT на LCT/MCT ЖЭ не меняет фармакокинетику и эффективность действия пропофола, но влияет на уменьшение частоты возникновения тромбофлебитов после его введения. Экспериментальное исследование T.E. Morey et al. (2010) показало, что микроэмульсии и макроэмульсии пропофола демонстрировали одинаковую фармакокинетику и не изменяли параметры тромбоэластографии у свиней [50].
Болевые ощущения при инъекции пропофола (до 70 %) являются наиболее распространенной побочной жалобой при его введении [51, 52]. B. Larsen et al. (2001) провели контролируемое рандомизированное двойное слепое исследование при проведении ТВА у 184 пациентов (ASA I–II) для сравнения уровня боли при внутривенной инъекции нового препарата 1% пропофола (пропофол MCT/LCT) со стандартным пропофолом с длинноцепочечными триглицеридами (пропофол LCT) [53]. Показано, что при болюсном введении пропофола MCT/LCT регистрировалось значительно меньшее количество жалоб на боль и ее интенсивность по сравнению со стандартным пропофолом.
Данными H. Ohmizo et al. (2005) и B. Krobbuaban et al. (2008) подтверждено, что изменение состава жировой эмульсии-носителя на LCT/MCT снижает частоту болевых ощущений при инъекции пропофола, способствует улучшению переносимости его пациентами [54, 55].
В последние годы внимание исследователей и клиницистов привлекает влияние пропофола на биологические процессы. H. Arnaoutoglou et al. (2007) изучали эффекты анестезии при использовании пропофола или севофлюрана на производство свободных радикалов кислорода во время тотального эндопротезирования коленного сустава путем измерения уровня малонового диальдегида (МДА). Показано, что в группе пропофола через 30 минут после снятия кровоостанавливающих жгутов значительно снижался уровень МДА (ANOVA, р = 0,007) по сравнению с группой севофлюрана. Обосновано, что пропофол может обладать антиоксидантными свойствами в ортопедической хирургии после жгут-индуцированной ишемии-реперфузии [56, 57].
Е. Engina et al. (2009) выполнили сравнительный анализ у 60 пациентов, которым проводилась интратекальная анестезия с помощью 0,5% бупивакаина [58]. Первая группа — контрольная, во 2–й и 3–й группах дополнительно проводили инфузию пропофола в дозе 2 и 5 мг/кг/ч соответственно. После снятия жгута и через 30 минут концентрация МДА, модифицированного ишемией альбумина и лактата во 2-й и 3-й группах были значительно ниже, чем в контрольной группе. Достоверно отличались показатели газового состава крови и кислотно-основного состояния. Показано, что вне зависимости от дозы пропофол обеспечивал защиту от посттравматической ишемии-реперфузии при артроскопических операциях на колене.
В экспериментальном исследовании O.A. Adaramoye et al. (2013) изучали влияние пропофола на липидный профиль и антиоксидантные показатели у крыс. Первая группа получила кукурузное масло (контроль), в то время как группы 2 и 3 получили пропофол (в дозах 2 и 4 мг/кг массы тела соответственно). Результаты показали, что введение пропофола, по сравнению с контролем, вызвало дозозависимое повышение уровней общего холестерина на 74 и 55 %, триглицеридов — на 97 и 115 %, липопротеинов низкой плотности — на 45 и 73 % соответственно, в то время как уровень липопротеинов высокой плотности сыворотки крови снизился на 41 и 54 % соответственно [59]. Авторы сделали вывод, что незначительное влияние пропофола на уровень АСТ, АЛТ и креатинина сыворотки крови крыс свидетельствует о том, что препарат не оказывал вредного влияния на печень и почки. Данные исследования показали, что пропофол в дозе 2 и 4 мг/кг способствует улучшению антиоксидантного статуса у крыс путем увеличения уровня восстановленного глутатиона (reduced glutathione, GSH) и GSH-зависимых ферментов.
Восстановленный глутатион действует как поглотитель свободных радикалов и регенератор альфа-токоферола, играет важную роль в поддержании белковых сульфгидрильных групп в белках и других ключевых молекулах [60]. Активные формы кислорода и активные формы азота образуются в нормальных гепатоцитах и имеют решающее значение для физиологических процессов, в том числе аэробного дыхания, роста, регенерации, апоптоза и микросомальной защиты. Когда уровни продуктов окисления превышают емкость обычных антиоксидантных систем, развивается окислительный стресс, который сопровождается поражением всех клеток печени, в том числе гепатоцитов, клеток Купфера, звездчатых и эндотелиальных клеток, через индукцию воспаления, ишемии, фиброза, некроза, апоптоза.
Кроме того, GSH может действовать в качестве важного кофактора для ферментов антиоксидантной защиты, особенно глутатионпероксидазы и глутатион-S-трансферазы печени (GST) [61]. Цитозольная, митохондриальная и микросомальная GST участвует в детоксикации электрофильных ксенобиотиков (химические канцерогены), инактивации эндогенных альфа-, бета-ненасыщенных альдегидов, хинонов, гидроперекисей, образующихся вторичных метаболитов окислительного стресса. Эти ферменты также принимают непосредственное участие в биосинтезе простагландинов, лейкотриенов, тестостерона и прогестерона, в деградации тирозина. Регистрируемое повышение уровней печеночной GSH на фоне инфузии пропофола может свидетельствовать об усилении детоксикационной и антиоксидантной функции печени.
Таким образом, следует сделать вывод, что использование Пропофола Каби в повседневной практике анестезиолога улучшает качество анестезиологического обеспечения в целом и повышает безопасность пациентов.
При использовании Пропофола Каби, в котором в качестве растворителя жировой эмульсии содержатся триглицериды со средней длиной цепи (МСТ) и триглицериды с длинной цепью (LCT), снижаются болевые проявления у пациентов, что ценно для проведения комфортной анестезии. Пропофол LCT/MCT оказывает меньшее влияние на уровень липидов крови при трансплантации печени, способствует уменьшению частоты возникновения тромбофлебитов после введения и снижению негативного влияния на липидный обмен у больных с его выраженным исходным нарушением (несмотря на относительно небольшие количества ЖЭ, вводимые в процессе анестезии (рекомендации ESPEN, 2009). Значение этого фактора увеличивается с возрастанием длительности анестезии.
1. Kay B. ICI 35868 a new intravenous induction agent / B. Kay, G. Rolly // Acta Anaes. Belgica. — 1977. — Vol. 28. — P. 303–316.
2. Propofol in anesthesia. Mechanism of action, structure-activity relationships, and drug delivery / Trapani G., Altomare C., Liso G., Sanna E., Biggio G. // Curr. Med. Chem. — 2000. — Vol. 7, № 2. — Р. 249–271.
3. The general anesthetic propofol increases brain N-arachidonylethanolamine (anandamide) content and inhibits fatty acid amide hydrolase / S. Patel, E.R. Wohlfeil, D.J. Rademacher, E.J. Carrier, L.T.J. Perry, A. Kundu, J.R. Falck, K. Nithipatikom, W.B. Campbell, C.J. Hillard // Br. J. Pharmacol. — 2003. — Vol. 139, № 5. — P. 1005–1013.
4. Menthol shares general anesthetic activity and sites of action on the GABA(A) receptor with the intravenous agent, propofol / Watt E.E., Betts B.A., Kotey F.O., Humbert D.J., Griffith T.N., Kelly E.W., Veneskey K.C., Gill N., Rowan K.C., Jenkins A., Hall A.C. // Eur. J. Pharmacol. — 2008. — Vol. 590, № 1–3. — P. 120–126.
5. Strategies to Optimise Propofol-Opioid Anaesthesia / B.J. Lichtenbelt, M. Mertens, J. Vuyk // Clin. Pharmacokinet. — 2004. — Vol. 43, № 9. — P. 577–593.
6. Propofol patient-controlled sedation during hip or knee arthroplasty in elderly patients / Ganapathy S., Herrick I.A., Gelb A.W., Kirkby J. // Can. J. Anaesth. — 1997. — Vol. 44, № 4. — Р. 385–389.
7. The influence of method of administration and covariates on the pharmacokinetics of propofol in adult volunteers / Schnider T.W., Minto C.F., Gambus P.L., Andresen C., Goodale D.B., Shafer S.L., Youngs E.J. // Anesthesiology. — 1998. — Vol. 88, № 5. — Р. 1170–1182.
8. The influence of age on propofol pharmacodynamics / Schnider T.W., Minto C.F., Shafer S.L., Gambus P.L., Andresen C., Goodale D.B., Youngs E.J. // Anesthesiology. — 1999. — Vol. 90, № 6. — P. 1502–1516.
9. Pharmacokinetics of propofol infusions in patients with cirrhosis / Servin F., Cockshott I.D., Farinotti R., Haberer J.P., Winckler C., Desmonts J.M. // Br. J. Anaesth. — 1990. — Vol. 65, № 2. — P. 177–183.
10. Effect of propofol infusion on splanchnic hemodynamics and liver oxygen consumption in the rat. A dose–response study / Carmichael F.J., Crawford M.W., Khayyam N., Saldivia V. // Anesthesiology. — 1993. — Vol. 79, № 5. — Р. 1051–1060.
11. Propofol as an intravenous agent in general anesthesia and conscious sedation / McNeir D.A., Mainous E.G., Trieger N. // Anesth. Prog. — 1988. — Vol. 35, № 4. — P. 147–151.
12. Use of 2% propofol to produce diurnal sedation in critically ill patients / McLeod G., Wallis C., Dick J., Cox C., Patterson A., Colvin J. // Intensive Care Med. — 1997. — Vol. 23, № 4. — Р. 428–434.
13. Effects of propofol, sevoflurane, remifentanil, and (S)-ketamine in subanesthetic concentrations on visceral and somatosensory pain-evoked potentials / Untergehrer G., Jordan D., Eyl S., Schneider G. // Anesthesiology. — 2013. — Vol. 118, № 2. — P. 308–317.
14. The remarkable memory effects of propofol / Veselis R.A. // Br. J. Anaesth. — 2006. — Vol. 96, № 3. — P. 289–291.
15. Total intravenous anaesthesia techniques for ambulatory surgery / H. Eikaas, J. Raeder // Current Opinion in Anaesthesiology. — 2009. — Vol. 22. — P. 725–729.
16. Consensus Guidelines for the Management of Postoperative Nausea and Vomiting / T.J. Gan, P. Diemunsch, A.S. Habib, A. Kovac, P. Kranke, T.A. Meyer, M. Watcha, F. Chung, S. Angus, C.C. Apfel, S.D. Bergese, K.A. Candiotti, M. TV Chan, P.J. Davis, V.D. Hooper, S. Lagoo-Deenadayalan, P. Myles, G. Nezat, B.K. Philip, M.R. Tramèr // Anesth. Analg. — 2014. — Vol. 118. — P. 85–113.
17. Propofol sparing effect of remifentanil using closed-loop anaesthesia / S.E. Milne, G.N.C. Kenny, S. Schraag // Br. J. Anaesth. — 2003. — Vol. 90. — Р. 623–629.
18. Sedation with intravenous infusions of propofol or thiopentone / O.H.G. Wilder-Smith, M. Kolletzki, C.H. Wilder-Smith // Anaesthesia. — 1995. — Vol. 50, № 3. — P. 218–222.
19. Total intravenous anaesthesia / L. Campbell, F.H. Engbers, G.N.C. Kenny // CPD Anaesthesia. — 2001. — Vol. 3, № 3. — P. 109–119.
20. Comparison of two drug combinations in total intravenous anesthesia: Propofol-ketamine and propofol-fentanyl / Sukhminder Jit Singh Bajwa, Sukhwinder Kaur Bajwa, J. Kaur // Saudi J. Anaesth. — 2010. — Vol. 4, № 2. — P. 72–79.
21. Intravenous techniques in ambulatory anesthesia / A. Tesniere, F. Servin // Anesthesiology Clin. N. Am. — 2003. — Vol. 21. — P. 273–288.
22. Sear J.W. Continuous infusions of hypnotic agents for maintenance of anaesthesia // Kay B., ed. Total intravenous anaesthesia. Monographs in Anaesthesiology, Vol. 21. — Amsterdam: Elsevier Science Publishers. — 1991. — Р. 15–55.
23. Comparison of propofol and midazolam for sedation in critically ill patients / Aitkenhead A.R., Pepperman M.L., Willatts S.M., Coates P.D., Park G.R., Bodenham A.R., Collins C.H., Smith M.B., Ledingham I.M., Wallace P.G. // Lancet. — 1989. — Vol. 2 (8665). — P. 704.
24. The different effects of intravenous propofol and midazolam sedation on hemodynamic and heart rate variability / Win N.N., Fukayama H., Kohase H., Umino M. // Anesth. Analg. — 2005. — Vol. 101, № 1. — P. 97.
25. The effects of propofol and sevoflurane on the QT interval and transmural dispersion of repolarization in children / Whyte S.D., Booker P.D., Buckley D.G. // Anesth. Analg. — 2005. — Vol. 100, № 1. — Р. 71.
26. Effects of sevoflurane versus propofol on QT interval / Paventi S., Santevecchi A., Ranieri R. // Minerva Anestesiol. — 2001. — Vol. 67, № 9. — Р. 637.
27. Sympathetic and hemodynamic effects of moderate and deep sedation with propofol in humans / Ebert T.J. // Аnesthesiology. — 2005. — Vol. 103, № 1. — Р. 20.
28. Propofol inhibits volume-sensitive chloride channels in human coronary artery smooth muscle cells / Masuda T., Tomiyama Y., Kitahata H., Kuroda Y., Oshita S. // Anesth. Analg. — 2003. — Vol. 97, № 3. — Р. 657.
29. Hemodynamic changes during induction of anesthesia with eltanolone and propofol in dogs / Wouters P.F., Van de Velde M.A., Marcus M.A., Deruyter H.A., Van Aken H. // Anesth. Analg. — 1995. — Vol. 81, № 1. — P. 125–131.
30. Propofol induces bronchodilation in a patient mechanically ventilated for status asthmaticus / Conti G., Ferretti A., Tellan G., Rocco M., Lappa A. // Intensive Care Med. — 1993. — Vol. 19, № 5. — Р. 305.
31. Wheezing during induction of general anesthesia in patients with and without asthma. A randomized, blinded trial / Pizov R., Brown R.H., Weiss Y.S., Baranov D., Hennes H., Baker S., Hirshman C.A. // Anesthesiology. — 1995. — Vol. 82, № 5. — Р. 1111.
32. Comparison of the effects of etomidate, propofol, and thiopental on respiratory resistance after tracheal intubation / Еames W.O., Rooke G.A., Wu R.S., Bishop M.J. // Anesthesiology. — 1996. — Vol. 84. — Р. 1307.
33. Propofol and remifentanil for intubation without muscle relaxant: the effect of the order of injection / Trabold F., Casetta M., Duranteau J., Albaladejo P., Mazoit J.X., Samii K., Benhamou D., Sitbon P. // Acta Anaesthesiol Scand. — 2004. — Vol. 48, № 1. — P. 35–39.
34. Hemodynamic effects, recovery profiles, and costs of remifentanil-based anesthesia with propofol or desflurane for septorhinoplasty / Gokce B.M., Ozkose Z., Tuncer B., Pampal K., Arslan D. // Saudi Med. J. — 2007. — Vol. 28. — P. 358–363.
35. The effects of large-dose propofol on cerebrovascular pressure autoregulation in head–injured patients / Steiner L.A., Johnston A.J., Chatfield D.A., Czosnyka M., Coleman M.R., Coles J.P., Gupta A.K., Pickard J.D., Menon D.K. // Anesth. Analg. — 2003. — Vol. 97, № 2. — P. 572.
36. Comparison of haemodynamic changes with propofol and sevoflurane anaesthesia during laparoscopic surgery / Shah A., Adaroja R.N. // National Journal оf Medical Research. — 2011. — Vol. 1, № 2. — P. 76–79.
37. Comparison of sevoflurane versus propofol under auditory evoked potential monitoring in female patients undergoing breast surgery / Hsiu-Pin Chen, Ya-Hui Hsu, Kuo-Chun Hua, Chih-Chung Lin, Yung-Feng Lo, Huang-Ping Yu // Biomedical J. — 2013. — Vol. 36, № 3. — P. 125–131.
38. Effects of propofol and thiopentone, and benzodiazepine premedication on heart rate variability measured by spectral analysis / Howell S.J., Wanigasekera V., Young J.D., Gavaghan D., Sear J.W., Garrard C.S. // Br. J. Anaesth. — 1995. — Vol. 74, № 2. — Р. 168–173.
39. Target–controlled infusion anesthesia with propofol and remifentanil compared with manually controlled infusion anesthesia in mastoidectomy surgeries / Yeganeh N., Roshani B., Yari M., Almasi A. // Middle East J. Anesthesiol. — 2010. — Vol. 20, № 6. — Р. 785–793.
40. Новая технология тотальной внутривенной анестезии — инфузия по целевой концентрации / Кобеляцкий Ю.Ю., Машин А.М., Карась Р.К. — Днепропетровск, 2013. — 76 с.
41. Target-controlled infusion anesthesia with propofol and remifentanil compared with manually controlled infusion anesthesia in mastoidectomy surgeries / N. Yeganeh, B. Roshani, M. Yari, A. Almasi // M.E.J. Anesth. — 2010. — Vol. 20, № 6. — P. 785–793.
42. A Bispectral index guided comparison of target–controlled versus manually-controlled infusion of propofol and remifentanil for attenuation of pressor response to laryngoscopy and tracheal intubation in non cardiac surgery / N. Yeganeh, B. Roshani // JRMS. — 2006. — Vol. 11, № 5. — P. 302–308.
43. Relationship between Bispectral Index, electroencephalographic state entropy and effect-site EC50 for propofol at different clinical endpoints / M. Iannuzzi, E. Iannuzzi, F. Rossi, L. Berrino, M. Chiefari // British Journal of Anaesthesia. — 2005. — Vol. 94, № 4. — P. 492–495.
44. Рекофол в современной анестезиологии и интенсивной терапии: Методическое пособие / Л.В. Усенко, Г.В. Панченко, В.И. Слива, С.А. Дудукина; Днепропетр. гос. мед. акад. — К.: Пирамида, 2004. — 99 с.
45. Novel lipid and preservative-free propofol formulation: properties and pharmacodynamics / Ravenelle F., Gori S., Le Garrec D., Lessard D., Luo L., Palusova D., Sneyd J.R., Smith D. // Pharm. Res. — 2008. — Vol. 25, № 2. — P. 313–319.
46. Effects of short-term propofol administration on pancreatic enzymes and triglyceride levels in children / Gottschling S., Meyer S., Krenn T., Kleinschmidt S., Reinhard H., Graf N., Shamdeen G.M. // Anaesthesia. — 2005. — Vol. 60, № 7. — Р. 660.
47. ESPEN Guidelines on Parenteral Nutrition: Intensive care / Singer P., Berger M.M., Van den Berghe G., Biolo G., Calder P., Forbes A., Griffiths R., Kreyman G., Leverve X., Pichard C. // Clinical Nutrition. — 2009. — Vol. 28. — Р. 387–400.
48. Jędrzejczak-Czechowicz M. Effects of parenteral lipid emulsions on immune system response / M. Jędrzejczak-Czechowicz, M.L. Kowalski // Аnaesthesiology Intensive Therapy. — 2011. — Vol. 43, № 4. — P. 207–213.
49. Wanten G.J.A. Immune modulation by parenteral lipid emulsions / G.J.A. Wanten, P.C. Calder // Am. J. Clin. Nutr. — 2007. — Vol. 85. — P. 1171–1184.
50. Thromboelastographic and pharmacokinetic profiles of micro– and macro–emulsions of propofol in swine / Morey T.E., Modell J.H., Garcia J.E., Bewernitz M., Derendorf H., Varshney M., Gravenstein N., Shah D.O., Dennis D.M. // Biopharm Drug Dispos. — 2010. — Vol. 31, № 5–6. — Р. 269–277.
51. Pain on injection: a double-blind comparison of propofol with lidocaine pretreatment versus propofol formulated with long– and medium-chain triglycerides / Schaub E., Kern C., Landau R. // Аnesth. Analg. — 2004. — Vol. 99, № 6. — P. 1699–1702.
52. Pain on injection of propofol: propofol LCT vs propofol MCT/LCT with or without lidocaine pretreatment / Burimsittichai R., Kumwilaisuk K., Charuluxananan S., Tingthanathikul W., Premsamran P., Sathapanawath N. // J. Med. Assoc. Thai. — 2006. — Vol. 89, № 3. — Р. 86–91.
53. Weniger Injektionsschmerz durch Propofol-MCT/LCT? Ein Vergleich mit Propofol-LCT / B. Larsen, U. Beerhalter, A. Biedler, A. Brandt, F. Doege, K. Brün, R. Erdkönig, R. Larsen // Der Anaesthesist. — 2001. — Vol. 50, Issue 11. — Р. 842–845.
54. Mechanism of injection pain with long and long-medium chain triglyceride emulsive propofol / Ohmizo H., Obara S., Iwama H. // Can. J. Anaesth. — 2005 — Vol. 52, № 6. — P. 595–599.
55. Does addition of lidocaine to medium- and long-chain triglyceride propofol emulsions significantly reduce pain on injection? / Krobbuaban B., Siriwan D., Kumkeaw S., Tanomsat M., Jamjamrat G., Thanetses K., Kosittanasan S. // J. Med. Assoc. Thai. — 2008. — Vol. 91, № 3. — P. 383–387.
56. The effects of propofol or sevoflurane on free radical production after tourniquet induced ischaemia-reperfusion injury during knee arthroplasty / Arnaoutoglou H., Vretzakis G., Souliotis D., Cambili M., Galaris D., Papadopoulos G. // Acta Anаеsthesiologica Belgica. — 2007. — Vol. 58, № 1. — P. 3–6.
57. Comparison of the effect of propofol and N-acetyl cysteine in preventing ischaemia–reperfusion injury / Erturk E., Cekic B., Geze S., Kosucu M., Coskun I., Eroglu A., Ulusoy H., Mentese A., Karahan C., Kerimoglu S. // European Journal of Anaesthesiology. — 2009. — Vol. 26, № 4. — Р. 279–284.
58. Comparison of the effect of propofol and N–acetyl cysteine in preventing ischaemia-reperfusion injury / Е. Engina, C. Bahanura, G. Sukrana, K. Mugea, C. Ilkera, E. Ahmeta, U. Hulyaa, M. Ahmetb, K. Canerb, K. Servetc // European Journal of Anaesthesiology. — April 2009. — Vol. 26, № 4. — P. 279–284.
59. Effects of propofol, a sedative-hypnotic drug, on the lipid profile, antioxidant indices, and cardiovascular marker enzymes in wistar rats / Adaramoye O.A., Akinwonmi O., Akanni O. // ISRN Pharmacol. — 2013 Jun 6. — 2013. — Article ID 230261, 6 pages.
60. The contemporary role of antioxidant therapy in attenuating liver ischemia-reperfusion injury: a review / G.K. Glantzounis, H.J. Salacinski, W. Yang, B.R. Davidson, A.M. Seifalian // Liver Transplantation. — 2005. — Vol. 11, № 9. — Р. 1031–1047.
61. Glutathione transferases / J.D. Hayes, J.U. Flanagan, I.R. Jowsey // Annual Review of Pharmacology and Toxicology. — 2005. — Vol. 45, № 1. — Р. 51–88.