Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Гостра серцева недостатність у хворих на інфаркт міокарда зі збереженою систолічною функцією лівого шлуночка: клініко-гемодинамічні, електрофізіологічні особливості та вплив на прогноз
Авторы: Кожухов С.М., Пархоменко О.М., Іркін О.І., Лутай Я.М., Шумаков О.В., Скаржевський О.А. - ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, м. Київ
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Клинические исследования
Версия для печати
Гостра серцева недостатність (ГСН) є одним із найнебезпечніших захворювань у всьому світі. 30–55 % пацієнтів із гострим інфарктом міокарда (ГІМ), у яких відзначаються ознаки ГСН, мають збережену фракцію викиду (ФВ). Наша мета полягала у вивченні виживаності таких хворих при довгостроковому спостереженні.
Серед 606 пацієнтів із ГІМ і елевацією сегмента ST на ЕКГ (вік 54,8 ± 0,4 року, 90,8 % чоловіків) 28,2 % мали СН зі збереженою ФВ (ФВ > 45 %) протягом перших 24 годин. У цих хворих частіше відзначалися шлуночкова тахікардія, фібриляція шлуночків (р > 0,05), аневризма лівого шлуночка (р > 0,05). Крім того, ці пацієнти мали високий рівень глюкози (р > 0,05) і C-реактивного білка (р > 0,05). У хворих зі СН і збереженою ФВ відзначалася ниркова дисфункція: швидкість клубочкової фільтрації (ШКФ) була статистично значно нижчою від моменту надходження й до 10-го дня (обоє р > 0,05). Розмір інфаркту був меншим на 18,5 % порівняно з пацієнтами без ГСН. Під час перебування в лікарні кінцево-діастолічний, кінцево-систолічний об’єми та ФВ у пацієнтів були схожими. Наші дані показали, що у хворих із гострим інфарктом міокарда та фракцією викиду ≥ 45 %, що мають ознаки гострої серцевої недостатності, ризик серцево-судинної смерті протягом п’яти років підвищується у два рази (17,2 % порівняно з 9,3 % у пацієнтів без ГСН, р < 0,034).
Деякі клінічні характеристики у хворих із ГІМ і збереженою ФВ відрізнялися в пацієнтів із ГСН і без такої. У той час як ГСН явно пов’язана з більш низькою ШКФ, високим рівнем системного запалення, розміром інфаркту тощо. Довгостроковий прогноз у таких пацієнтів характеризується зниженням серцево-судинної смерті протягом наступних 5 років.
Острая сердечная недостаточность (ОСН) является одним из самых опасных заболеваний во всем мире. 30–55 % пациентов с острым инфарктом миокарда (ОИМ), у которых отмечаются признаки ОСН, имеют сохраненную фракцию выброса (ФВ). Наша цель заключалась в изучении выживаемости таких больных при долгосрочном наблюдении.
Из 606 пациентов с ОИМ и элевацией сегмента ST на ЭКГ (возраст 54,8 ± 0,4 года, 90,8 % мужчин) 28,2 % имели СН с сохраненной ФВ (ФВ > 45 %) в течение первых 24 часов. У этих больных чаще отмечались желудочковая тахикардия, фибрилляция желудочков (р > 0,05), аневризма левого желудочка (р > 0,05). Кроме того, эти пациенты имели высокий уровень глюкозы (р > 0,05) и C-реактивного белка (р > 0,05). У больных с СН и сохраненной ФВ отмечалась почечная дисфункция: скорость клубочковой фильтрации (СКФ) была статистически значимо ниже с момента поступления и до 10-го дня (оба р > 0,05). Размер инфаркта был меньше на 18,5 % по сравнению с пациентами без ОСН. Во время пребывания в больнице конечно-диастолический, конечно-систолический объемы и ФВ у пациентов были схожими. Наши данные показали, что у больных с острым инфарктом миокарда и фракцией выброса ≥ 45 %, имеющих признаки острой сердечной недостаточности, риск сердечно-сосудистой смерти в течение пяти лет повышается в два раза (17,2 % по сравнению с 9,3 % у пациентов без ОСН, р < 0,034).
Некоторые клинические характеристики у больных с ОИМ и сохраненной ФВ отличались у пациентов с ОСН и без нее. В то время как ОСН явно связана с более низкой СКФ, высоким уровнем системного воспаления, размером инфаркта и т.д. Долгосрочный прогноз у таких пациентов характеризуется снижением сердечно-сосудистой смерти в течение последующих 5 лет.
Acute heart failure (AHF) is a major public health burden worldwide. Of acute myocardial infarction (AMI) patients presenting with AHF, 30–55 % have a preserved ejection fraction (PEF). Our objective was to examine survival in this patient during long term follow-up.
Of 606 AMI patients with ST elevations on ECG and PEF (age 54.8 ± 0.4 years, 90.8 % male), 28.2 % had HFPEF (EF > 45 %) during first 24 hours. Patients with HFPEF had high rate of
VT/VF (p > 0.05), aneurism of left ventricle (p > 0.05). Also these patients had high level of glucose (p > 0.05) and C-reactive protein (p > 0.05). Patients with HFPEF had renal dysfunction: GRF was statistically significant lower on time of admission up to 10 day (both p > 0.05). Infarct size was smaller on 18.5 % compare to patients without AHF.
During hospital stay patients has similar end-diastolic, end-systolic volume and EF. Our data demonstrated that acute myocardial infarction patient with ejection fraction ≥ 45 % complicated sign and symptoms of acute heart failure has two time increase in cardiovascular death during five year (17.2 % compare to 9.3 % patients without AHF, p < 0.034).
Multiple clinical characteristics at the time of initial AMI with PEF presentation differed in participants with AHF vs. no AHF. While AHF was clearly associated with a lower GFR, high level of systemic inflammation, infarct size, etc. Long term prognosis in these patients characterizes decrease of rate of cardiovascular death during follow-up up to 5 years.
гострий інфаркт міокарда, гостра серцева недостатність, клініка, гемодинаміка, прогноз.
острый инфаркт миокарда, острая сердечная недостаточность, клиника, гемодинамика, прогноз.
acute myocardial infarction, congestive heart failure, clinical picture, hemodynamics, prognosis.
Статья опубликована на с. 126-135
Серцева недостатність (СН) є частим ускладненням гострого інфаркту міокарда (ГІМ) з елевацією сегмента ST на електрокардіограмі (ЕКГ) [8, 15, 33, 34]. У цих пацієнтів фракція викиду (ФВ) лівого шлуночка (ЛШ) є одним із найважливіших прогностичних маркерів і незалежним предиктором виживання [3].
За даними ряду регістрів, у великої кількості пацієнтів із симптомами гострої серцевої недостатності (ГСН) діагностується збережена функція міокарда ЛШ [13]. Однак у доступній літературі дуже мало робіт, які б стосувалися хворих із ГІМ.
Збережена систолічна функція міокарда ЛШ при ГІМ є сприятливим фактором прогнозу порівняно з хворими зі зниженою ФВ ЛШ [32]. Збереженню функції ЛШ сприяє застосування ранніх реперфузійних стратегій, використання інгібіторів ангіотензинперетворюючого ферменту (ІАПФ), блокаторів рецепторів альдостерону, статинів, блокаторів бета-адренорецепторів та їх комбінація. Але навіть при збереженій функції ЛШ у гострому періоді ІМ у частини хворих виникають симптоми ГСН [23, 29].
Специфіки лікування хворих зі збереженою ФВ ЛШ у сучасній практиці не існує, тому останнім часом цей синдром все більше привертає увагу вчених, клініцистів. Однак на сьогодні немає однозначних поглядів на перебіг, діагностику та лікування ГСН у хворих зі збереженою функцією ЛШ, також відсутні рішення щодо відповідних терапевтичних підходів.
Ідентифікація пацієнтів із високим ризиком розвитку СН під час госпіталізації є надзвичайно важливою, оскільки шляхом застосування цілеспрямованих терапевтичних стратегій лікування на ранніх етапах розвитку ГІМ можна попередити розвиток СН і покращити прогноз.
Матеріали та методи дослідження
У дослідженні проведено ретроспективно-проспективний аналіз клініко-анамнестичних характеристик та даних інструментальних обстежень 606 хворих на гострий коронарний синдром (ГКС) з елевацією сегмента ST на електрокардіограмі, які були госпіталізовані в період з 1992 по 2007 рік у відділення реанімації та інтенсивної терапії ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України протягом перших 24 годин від розвитку симптомів захворювання та мали, за даними ехокардіографії, збережену систолічну функцію (ФВ понад 45 %). Діагноз ГІМ встановлювали на підставі клінічних, електрокардіографічних та лабораторних критеріїв, згідно з рекомендаціями Європейського товариства кардіологів [35].
Характеристика хворих за демографічними, анамнестичними даними, часом від початку симптомів та показниками інструментальних методів дослідження наведена в табл. 1 та 2. Залежно від наявності ГСН хворих розподілено на дві основні групи: з ГСН (за T. Killip, 2–3-й клас) — I група та без клінічних проявів ГСН — II група [9].
Як видно з табл. 1, досліджувану групу хворих становили здебільшого чоловіки (90,8 %, n = 551). Стабільна стенокардія, нестабільна стенокардія перед ГІМ, тютюнопаління та артеріальна гіпертензія в анамнезі були найбільш поширеними факторами ризику. Значна кількість хворих (23,4 %, n = 137) мала надмірну масу тіла. У хворих із симптомами ГСН вірогідно частіше відмічалася тільки стабільна стенокардія в анамнезі, інші показники зустрічалися з однаковою частотою в обох групах.
Як наведено в табл. 2, хворі з ГСН були вірогідно старші, середній вік хворих становив 54,80 ± 0,40 року. ФВ ЛШ на першу добу ГІМ була вірогідно меншою у хворих із ГСН.
Характеристику проведених лікувальних заходів наведено в табл. 3.
Реперфузійна терапія застосовувалася у 67,66 % хворих (n = 410), із них тромболітична терапія (ТЛТ) становила 47,03 % (n = 285). Всі хворі отримували стандартну терапію, що включала гепарини (90,92 %, n = 551), з них 304 хворих отримували низькомолекулярні гепарини (НМГ), дезагреганти (в тому числі тієнопіридини), бета-адреноблокатори; за наявності симптомів СН, передньої локалізації ІМ та/або артеріальної гіпертензії — інгібітори АПФ або блокатори рецепторів до ангіотензину ІІ першого типу, нітрати. Діуретики та антиаритмічні препарати призначалися за наявності показань.
У дослідження не включалися хворі з істинним кардіогенним шоком, клапанними вадами, які потребують хірургічного втручання, тяжкою формою цукрового діабету, вираженою нирковою і печінковою недостатністю, бронхіальною астмою, порушеннями в системі гемостазу, гострим порушенням мозкового кровообігу, травмою або великим хірургічним втручанням, гострим (або загостренням хронічного) запальним процесом, онкологічними і системними захворюваннями.
Динаміку формування зони некрозу міокарда вивчали на основі серійного визначення активності сироваткової ізоформи креатинфосфокінази (КФК) — МБ-КФК у периферичній венозній крові. Для оцінки динаміки зони некрозу застосовували загальноприйняті критерії: величину піку активності ферменту, час від початку захворювання до його досягнення, тривалість гіперферментемії. Масу некротизованого міокарда визначали у вагових одиницях з урахуванням загальної активності МБ-КФК відповідно до маси тіла хворого за формулою B. Sobel у модифікації R. Norris [38].
Для вивчення зв’язку системного запалення з розвитком ГСН у госпітальному періоді ГІМ визначали в плазмі крові рівні С-реактивного протеїну (СРП).
Кліренс ендогенного креатиніну (ККр) та швидкість клубочкової фільтрації (ШКФ) визначали за допомогою формули Кокрофта — Гаулта (Cockroft — Gault) та формули MDRD (Modification of Diet in Renal Disease Study) [12, 21, 27].
Формула Кокрофта — Гаулта, для жінок результат множиться на 0,85:
/128/128.jpg)
Формула MDRD: для жінок результат множиться на 0,742:
/128/128_2.jpg)
Показники серцевої гемодинаміки оцінювалися за допомогою двовимірної ехокардіографії, яку було проведено 606 хворим із ГІМ протягом перших 10 діб захворювання. Ехокардіографію проводили за допомогою секторального двомірного ехокардіографа Medison, SA 9900, PRIME (Корея) у В-режимі в чотирикамерній позиції із визначенням кінцево-систолічного та кінцево-діастолічного об’ємів і ФВ ЛШ [1, 16]. Вивчення діастолічних властивостей міокарда проводилося на підставі характеристик трансмітрального кровотоку при наповненні ЛШ. Оцінювалися максимальна швидкість хвилі раннього діастолічного наповнення (Е, м/с), максимальна швидкість хвилі пізнього діастолічного наповнення (А, м/с) та їх співвідношення (Е/А), а також час уповільнення ранньодіастолічного трансмітрального кровотоку (DT, мс) і час ізоволюмічного розслаблення ЛШ (IVRT, мс) [1, 24].
Оцінка діастолічної функції (ДФ) ЛШ проведена в перші 24 год від розвитку симптомів ГІМ у 208 пацієнтів зі збереженою фракцією викиду ЛШ. Ця група хворих за своїми клініко-анамнестичними характеристиками суттєво не відрізнялась від загальної групи хворих.
Аналіз інформативності неінвазивних електрофізіологічних показників (усереднена ортогональна ЕКГ високого підсилення (ВП), варіабельність серцевого ритму (ВСР), показники негомогенності реполяризації (ПНР) базуються на обстеженні 474 хворих на ГІМ. Принцип оцінки ЕКГ–сигналу, що використовувався в аналізі ПНР, складається з автоматичного визначення початку і закінчення комплексу QRS, вершини зубця Т, а також закінчення зубця Т за методом Лєпьошкіна в модифікації McLaughlin (метод peak slope intercept, PSI) [5, 17, 22]. Для дослідження електрокардіографічних ПНР у хворих із різними варіантами клінічного перебігу ГІМ на першу добу захворювання була проведена реєстрація усередненої ортогональної ЕКГ та стандартної усередненої ЕКГ. У подальшому проводився аналіз діагностичної значущості електрокардіографічних ПНР для перебігу госпітального періоду захворювання.
Результати тривалого спостереження оцінювалися протягом п’яти років від моменту включення в дослідження. Аналізували кінцеву точку — кардіоваскулярну смерть.
Статистичний аналіз проводився за допомогою SPSS 11.0 з використанням непараметричного тесту Вілкоксона, тесту Стьюдента, тесту Фішера, x2-тесту Мантела — Хенсела, методу Каплана — Мейєра. Критерієм вірогідності відмінностей вважався P < 0,05.
Результати дослідження
Таким чином, із 606 включених у дослідження хворих у 171 (28,21 %) в першу добу захворювання реєструвалася ГСН. Згідно з розподілом хворих на групи, проведено аналіз клініко-анамнестичних даних, перебігу теперішнього ІМ та його ускладнень.
Аналіз анамнестичних даних показав, що переважну більшість хворих становили чоловіки, середній вік — 54,05 ± 0,41 року, причому хворі з ГСН (I група) були вірогідно старші (57,45 ± 0,70 року проти 53,75 ± 0,48 року (p < 0,01)), тобто хворі з ГСН мали довший термін ІХС. Так, стабільна стенокардія в анамнезі зустрічалася в 42,11 % порівняно з 32,41 % у хворих II групи (p < 0,05), статистично частіше зафіксовано післяінфарктний кардіосклероз, відповідно 20,01 та 14,40 % (p < 0,05). Такі фактори, як артеріальна гіпертензія, паління, підвищений індекс маси тіла, ХСН в анамнезі, цукровий діабет, не мали статистичних розбіжностей.
За даними US National Registry of Myocardial Infarction (NRMI), частота ГСН становила близько 20 % під час госпіталізації хворих з ГІМ та ще у 9 % розвивалася протягом госпітального періоду [30]. У дослідженні French study ГСН протягом перших 5 днів ГІМ реєструвався у 38 % хворих [35]. Екстраполюючи ці дані на Україну, де є приблизно 50 000 госпіталізацій кожний рік із приводу ГІМ, можна передбачити близько 15 000 пацієнтів із ГСН. Звичайно, такі симптоми СН є тимчасовими, і дуже важко передбачити, яка частина трансформується в хронічну СН [5]. Найчастіше симптоми ГСН проявляються на першу добу ГІМ із наступним піком на 4-ту добу. Наше дослідження підтверджує, що вагомими факторами появи симптомів ГСН є тривалий анамнез ІХС (як стабільна стенокардія, так і перенесений раніше ІМ). Середній час від розвитку симптомів ГКС з елевацією сегмента ST на ЕКГ до госпіталізації становив 4,09 ± 0,22 години та був однаковим в обох групах. Це давало можливість проведення реперфузійної терапії в хорошому терапевтичному вікні (кількість хворих становила 67,65 %). Тромболітична терапія проведена у 57,89 % хворих І групи та 42,76 % хворих ІІ групи (p < 0,05), перкутанні втручання виконано відповідно в 18,71 та 21,38 %. Слід зазначити, що середній час від розвитку симптомів ГКС до проведення тромболітичної терапії також не відрізнявся і становив 3,02 ± 0,16 години у І групі та 2,98 ± 0,10 години у ІІ групі. Ефективність ТЛТ визначали за даними неінвазивних маркерів реперфузії — зникнення больового синдрому, зниження сегмента ST на ЕКГ [40].
Критерієм ефективності реперфузії при інфарктах нижньої стінки ЛШ було зниження сегмента ST понад 70 % від висхідної величини, при інфарктах передньої локалізації — понад 50 %. Ефективність ТЛТ була вищою у хворих без ознак ГСН і становила 66,67 % порівняно з 49,49 % у хворих ІІ групи (p < 0,05).
Незважаючи на те, що більшість обстежених хворих було госпіталізовано в ранній термін від розвитку симптомів ГІМ, у певному відсотку випадків у хворих спостерігався розвиток ускладнень захворювання, як протягом першої доби захворювання, так і впродовж усього госпітального періоду, про що свідчать дані, наведені в табл. 4 та 5.
Протягом першої доби ГІМ у хворих із ГСН вірогідно частіше відмічалася фібриляція шлуночків (ФШ), стійка шлуночкова тахікардія (ШТ) (p < 0,05) та тенденція до збільшення частоти атріовентрикулярних блокад (АВ-блокад) (p < 0,09).
Шлуночкові порушення ритму серця є досить частим ускладненням ГІМ і можуть спостерігатися у 90 % пацієнтів. У 25 % порушення ритму розвиваються протягом перших 24 годин, але загрозливі для життя аритмії, такі як ФШ, стійка ШТ, частіше розвиваються протягом перших годин [11, 19, 29].
Протягом госпітального періоду у хворих із ГСН та ФВ понад 40 % також вірогідно частіше відмічалася ФШ та стійка ШТ (р < 0,01), ранні аневризми ЛШ (р < 0,01), спостерігалася тенденція до збільшення частоти блокад ніжок пучка Гіса (БНПГ) (р < 0,07).
У хворих I групи вірогідно вищою була частота шлуночкової екстрасистолії (ШЕС) високих градацій (3–4-й клас за В. Lown) на першу (р < 0,001), третю (р < 0,05) та сьому добу ГІМ (р < 0,01).
Серед БНПГ блокада лівої ніжки асоціюється з великим інфарктом та має прогностичне значення стосовно підвищення смертності [42].
Обстежені хворі мали низку лабораторних відмінностей протягом госпітального періоду. Зокрема у хворих І групи був вірогідно нижчий рівень гемоглобіну як на третю (р < 0,05), так і на десяту добу захворювання (р < 0,05), при однакових рівнях на першу добу, що, за даними ряду досліджень, є несприятливим прогностичним маркером. Також слід відмітити у хворих І групи вірогідно вищий (на 6,6 %) рівень глюкози крові на першу добу ГІМ (р < 0,05), що також може негативно вплинути на прогноз захворювання. Так, у дослідженні Glucose Abnormalities in Patients with Myocardial Infarction (GAMI) було показано, що підвищення рівня глюкози при госпіталізації є причиною недіагностованої інсулінорезистентності, чи метаболічного синдрому, так званого предіабету, чи реально існуючого діабету [36]. З іншого боку, на сьогодні доведено, що пацієнти з порушеною толерантністю до вуглеводів чи недіагностованим діабетом мають такий самий ризик смерті, як і пацієнти з установленим діабетом. Так, 28-денна летальність у пацієнтів із рівнем глюкози крові понад 6,67 ммоль/л становить 8,5 %, проти 1,1 % із рівнем глюкози менше 6,67 ммоль/л (p < 0,001), а у пацієнтів із раніше діагностованим діабетом — 12,8 % (p < 0,05). Саме ГСН є одним із найчастіших ускладнень у таких пацієнтів із ГІМ. При довгостроковому спостереженні (50 місяців) частота смерті серед пацієнтів із цукровим діабетом (ЦД) становила 43,1 % порівняно з 28,2 % у хворих без ЦД; на противагу пацієнти без ЦД, але з підвищеним рівнем глюкози, мали рівень летальності 42,6 %. Таким чином, гіперглікемія у хворих із ГІМ повинна виявлятися якомога раніше з метою адекватної патогенетичної корекції як важливий елемент вторинної профілактики.
Також важливою, на нашу думку, є відмінність між досліджуваними групами кліренсу креатиніну як на першу (р < 0,02), так і на 10-ту добу (р < 0,05) захворювання. Це може свідчити про дисфункцію нирoк (ДН), яка, в тому числі, підтверджується кількістю хворих із кліренсом креатиніну нижче 60 мл/хв, число яких становило 12,9 % в І групі порівняно з 7,05 % у ІІ групі (р < 0,05), як результат — це може спричинювати виникнення чи погіршення ГСН. За даними багатьох досліджень, ДН асоціюється з більш високим рівнем летальності, повторного ІМ, інсульту, серйозних геморагічних ускладнень, ГСН, фібриляції передсердь та шлуночків. Навіть помірна ДН є значимим незалежним предиктором ризику госпітальної летальності та геморагічних ускладнень, але чим більш виражене порушення функції нирок, тим вищий ризик ускладнень [2, 31, 39]. Так, дані міжнародного реєстру GRACE (Global Registry of Acute Coronary Events) свідчать про те, що у хворих на ГІМ з елевацією сегмента ST та ШКФ 30–60 мл/хв ризик смерті збільшується в 2,09 раза, при ШКФ менше 30 мл/хв — майже в 4 рази [10, 21].
Госпітальна летальність у хворих на ГІМ з елевацією сегмента ST та НД навіть на фоні інтервенційних втручань є досить високою. Так, у групі з нормальним ККр та ФВ ЛШ понад 40 % вона становила 1 %, в групі зі зниженим ККр та ФВ ЛШ понад 40 % — 3 %, а в групі з нормальним ККр та зниженою ФВ — 15 %. Найбільш високою (30 %) летальність виявилася в групі зі зниженим ККр та ФВ менше 40 %. Таким чином, поєднання ГСН та ДН є тим фактором, що вкупі суттєво впливає на виживання хворих, а визначення функції нирок (ККр, ШКФ) вже на етапі госпіталізації повинне бути тим простим критерієм, на основі якого можна прогнозувати подальший перебіг захворювання, адже застосування реперфузійних стратегій та агресивної медикаментозної терапії може суттєво вплинути на прогноз [23].
Цілком закономірним є більша маса некротизованого міокарда в І групі, що становила 79,52 ± 5,64 г/екв проти 67,13 ± 2,62 г/екв (р < 0,05) у ІI групі.
Багатьма дослідженнями було доведено, що маса некрозу прямо корелює з наявністю проявів ГСН, тому протягом останніх десятиріч, зусилля науковців були спрямовані на пошук кардіопротекторних засобів, які б обмежували зону некрозу. При застосуванні реперфузійних стратегій, навіть при повному відновленні кровотоку, за рахунок реперфузійного пошкодження, феномену no-reflow, активації запального процесу, у 20–30 % маса некрозу така сама, як і у пацієнтів без реперфузійних методів лікування. На сьогодні існує велика кількість експериментальних даних, в яких на моделях тварин доведено обмеження зони некрозу, але, на жаль, у клінічній практиці є досвід лише невеликих пілотних досліджень, тому питання обмеження зони некрозу надалі залишається актуальним, в тому числі у хворих зі збереженою систолічною функцією ЛШ [18].
Серед маркерів запального процесу слід відмітити вірогідне збільшення у хворих І групи СРП на першу добу ГІМ (р < 0,05) та підвищення ШОЕ на 10-ту добу захворювання (р < 0,05). Результати наведено в табл. 6.
Незважаючи на проведення оптимальної терапії ГІМ, прогноз залишається несприятливим у пацієнтів із великим пошкодженням міокарда та тяжкою лівошлуночковою недостатністю. Некроз міокарда внаслідок оклюзії коронарної артерії супроводжується резорбційним синдромом, при якому ряд клітин, зокрема лейкоцитарного паростка, мігрують у пошкоджену зону. Цей процес є дуже важливим з точки зору раннього загоєння пошкодженого міокарда. Однак у подальшому асептичне запалення може відігравати негативну роль, оскільки, з одного боку, процес поширюється на непошкоджений ішемією міокард, а з другого — може сприяти патологічному ремоделюванню міокарда. Теоретично протизапальні підходи можуть бути направлені на профілактику/лікування лівошлуночкової дисфункції у пацієнтів із «великим» розміром ГІМ. Проте особливе значення має час, коли слід впливати на процеси запалення з метою функціонального відновлення міокарда [11]. Все це підкреслює важливість запалення як патогенетичного компонента прогресуючого ушкодження та пролонгації симптомів СН.
Параметри внутрішньосерцевої гемодинаміки у хворих на ГІМ наведено в табл. 7. Як видно з табл. 7, у хворих обох груп частота серцевих скорочень (ЧСС) на першу добу захворювання була однаковою і пропорційно знижувалась на десяту добу ГІМ. Кінцево-діастолічний індекс (КДІ) був незмінним протягом перших десяти днів, тоді як кінцево-систолічний індекс (КСІ) був вірогідно вищим на першу та третю добу ГІМ у хворих І групи. ФВ ЛШ була вірогідно нижчою у хворих із ГСН як на першу добу захворювання, так і на сьому та десяту добу порівняно з хворими ІІ групи.
Функція ЛШ повинна бути визначена у кожного пацієнта з ГІМ із метою діагностики гібернації чи оглушення міокарда. Зворотна ішемія є потенціалом для відновлення скорочувальної здатності ЛШ, зокрема шляхом реваскуляризації міокарда. Пацієнти зі значною систолічною дисфункцією після ГІМ надалі потребують особливого спостереження, тому що мають високий ризик кардіоваскулярних ускладнень, таких як раптова смерть та СН.
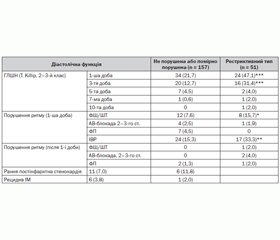
Серед 606 пацієнтів оцінка діастолічної функції ЛШ проведена у 208 хворих. Залежно від часу уповільнення ранньодіастолічного трансмітрального кровотоку на першу добу ГІМ були виділені 157 (75,5 %) хворих із нормальною або помірно порушеною ДФ ЛШ (DT > 130 мс) та 51 пацієнт (24,5 %) з рестриктивним типом ДФ (DT ≤ 130 мс) [7].
Проведений аналіз виявив, що пацієнти з рестриктивним типом порушення розслаблення частіше мали ІМ передньої та бокової стінки ЛШ, характеризувалися більш низькою ФВ ЛШ, проте не відрізнялися від пацієнтів із нормальною або помірно порушеною ДФ за основними клініко-анамнестичними показниками, глибиною ІМ та за частотою проведення різних видів реперфузійної терапії. Перебіг госпітального періоду ГІМ у пацієнтів зі збереженою систолічною функцією ЛШ і рестриктивним типом ДФ характеризувався більш частою реєстрацією порушень серцевого ритму та ГЛШН 2–3-го класу за Killip (табл. 8).
Найбільше значення у розвитку ускладнень госпітального періоду порушення ДФ мали в хворих з ІМ переважно задньої стінки ЛШ. Так, рестриктивний тип ДФ у цих хворих асоціювався зі збільшенням виникнення ШТ та ФШ (23,8 проти 8,9 %, p < 0,1), ідіовентрикулярного ритму (33,3 проти 5,6 %, p < 0,05) та ГЛШН на першу (42,9 проти 14,4 %, p < 0,01) та третю (33,3 проти 4,4 %, p < 0,01) добу спостереження.
Отримані нами дані дозволили вперше оцінити роль діастолічної дисфункції на першу добу ГІМ у розвитку ускладнень госпітального періоду захворювання у пацієнтів з ІМ зі збереженою систолічною функцією ЛШ. У сукупності з даними літератури вони свідчать про необхідність раннього визначення ДФ у хворих на ГІМ та зі збереженою систолічною функцією ЛШ для визначення категорії хворих із високим ризиком внутрішньогоспітальних ускладнень. У той же час методи корекції діастолічної дисфункції та специфічні підходи до лікування цієї категорії хворих на сьогодні ще не визначені [25, 26, 28, 37].
Результати досліджень неінвазивних показників електрофізіологічних властивостей міокарда у хворих на ГІМ зі збереженою (понад 40 %) ФВ ЛШ залежно від наявності проявів ГСН 2–3-го класу за Т. Killip (І група) чи їх відсутності (ІІ група) показали, що на першу добу захворювання в І групі порівняно з ІІ групою відмічалися вищі значення показника LAS — 25,47 ± 1,51 мс проти 21,57 ± 0,84 мс (p < 0,05) та нижчі значення показника RMS — 34,69 ± 2,21 мс проти 46,62 ± 1,90 мс (p < 0,001). На десяту добу захворювання ця закономірність зберігалася: в І групі порівняно з ІІ групою спостерігалися вищі значення показника LAS — 26,46 ± 1,74 мс проти 22,57 ± 0,84 мс (p < 0,05) та нижчі значення показника RMS — 35,72 ± 2,28 мс проти 44,37 ± 1,80 мс (p < 0,01).
Розбіжностей між групами в значеннях показників негомогенності реполяризації на першу добу захворювання виявлено не було (p > 0,1). На десяту добу захворювання в І групі порівняно з ІІ групою спостерігалися вищі значення показника QTcD — 46,36 ± 2,61 мс проти 37,45 ± 1,53 мс (p < 0,01), JTcD — 51,96 ± 2,78 мс проти 41,50 ± 1,72 мс (p < 0,001), JTacD — 52,65 ± 3,41 мс проти 41,87 ± 1,78 мс (p < 0,01). Показники ВСР на першу добу ГІМ між групами не відрізнялися. На десяту добу захворювання відмічалося більш виражене зниження PL до 8,98 ± 1,38 мс проти 11,88 ± 1,24 мс у ІІ групі (p < 0,05), PH — до 1,84 ± 0,37 мс проти 2,85 ± 0,50 мс у ІІ групі (p < 0,05) та PT до 10,84 ± 1,58 мс проти 14,68 ± 1,53 мс у ІІ групі (p < 0,05), а також нижчі значення SD_RRc — 23,30 ± 1,18 мс проти 27,15 ± 1,05 мс (p < 0,05) (табл. 9).
Ці результати можуть свідчити про те, що у хворих на ГІМ зі збереженою систолічною функцією ЛШ клінічні прояви ГСН імовірно асоційовані з більш значним пошкодженням міокарда та прогресуванням дисфункції автономної нервової системи, що проявляється в негативних змінах показників ЕКГ ВП, а також у прогресуючому порушенні показників негомогенності реполяризації та показників ВСР (time-domain та frequency-domain) при аналізі короткотривалої ЕКГ [14].
Результати тривалого спостереження за обстеженими хворими оцінювалися через п’ять років від моменту включення в дослідження. Аналізували кінцеву точку — кардіоваскулярну смерть. Через п’ять років спостереження для оцінки були доступні дані на 122 (71,34 %) хворих I групи та 334 (74,48 %) ІІ групи. За весь період спостереження померло 24 пацієнти (17,21 %) у I групі та 31 пацієнт (9,28 %) у IІ групі (р < 0,034). Отримані дані у вигляді кривої Каплана — Мейєра подано на рис. 1 [4].
/133/133.jpg)
Сучасні дослідження показують, що ГСН залишається найбільш тяжким та частим ускладненням у пацієнтів із ГІМ з елевацією сегмента ST на ЕКГ. Так, кардіогенний шок як найтяжча форма прояву ГСН зустрічається в 5–15 %, інші форми — від 15 до 30 %, асимптоматична дисфункція ЛШ — від 25 до 40 % [28]. Факторами ризику ГСН при ГІМ є: дисфункція ЛШ та СН в анамнезі, вік, трансмуральне пошкодження міокарда, передня локалізація ГІМ, розмір зони некрозу та відсутність реперфузійної терапії [20]. Проте дані про частоту СН, механізми виникнення та вплив на прогноз у хворих зі збереженою ФВ є вкрай обмеженими.
Висновки
Таким чином, факторами розвитку ГСН у хворих на ГІМ зі збереженою систолічною функцією ЛШ є старший вік, тривалий анамнез ІХС, передня локалізація теперішнього ІМ та відносно знижена ФВ ЛШ.
Хворі з гострою серцевою недостатністю зі збереженою систолічною функцією ЛШ мають ускладнений перебіг захворювання як протягом першої доби ІМ, так і протягом усього госпітального періоду.
Серед лабораторних показників у хворих із ГСН мають значення: вихідне порушення функції нирок (зниження кліренсу креатиніну), активація прозапального процесу (підвищення рівня С-реактивного протеїну), зниження вмісту гемоглобіну в динаміці спостереження.
У пацієнтів із ГІМ зі збереженою систолічною функцією ЛШ рестриктивний тип релаксації визначається локалізацією (передня стінка) та поширеністю зони пошкодження, а також ФВ ЛШ, проте не пов’язаний з основними клініко-анамнестичними показниками та глибиною ІМ. Він асоціюється з більшою кількістю ускладнень протягом госпітального періоду захворювання, особливо у пацієнтів із задньобоковою локалізацією ІМ.
Клінічні прояви ГСН у хворих на ГІМ зі збереженою функцією ЛШ асоціюються з більшим розміром пошкодження міокарда та порушенням функції автономної нервової системи. Це проявляється в негативних змінах результатів ЕКГ ВП, а також показників негомогенності реполяризації міокарда та частотно-коригованого часового показника ВСР.
1. American Society of Echocardiography Committee on standards, subcomittee on quantilation of dimensional echocardiograms / Shiller N., Shah P., Grawford M. et al. Recomendations for quantilation of the left ventricle by two-dimensional echocardiography // J. Amer. Soc. Echocardiogr. — 1989. — Vol. 2. — P. 358–367.
2. Amsalem Y., Garty M., Schwartz R. et al. Prevalence and significance of unrecognized renal insufficiency in patients with heart failure // Eur. Heart J. — 2008. — Vol. 29. — P. 1029–1036.
3. Antman E.M., Anbe D.T., Armstrong P.W. et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction; A report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. — 2004. — Vol. 44. — E1–211.
4. Badheka A.O., Rathod A., Bharadwaj A.S. et al. Preserved or slightly depressed ejection fraction and outcomes after myocardial infarction // Postgrad. Med. J. — 2011. — Vol. 87. — P. 400–404.
5. Balanescu S., Corlan A.D., Dorobantu M., Gherasim L. Prognostic value of heart rate variability after acute myocardial infarction // Med. Sci. Monit. — 2004. — Vol. 10. — P. 307–315.
6. Borghi C., Ambrosioni E. Survival of Myocardial Infarction Long–term Evaluation Study Group. Effects of zofenopril on myocardial ischemia in post–myocardial infarction patients with preserved left ventricular function: the Survival of Myocardial Infarction Long-term Evaluation (SMILE)-ISCHEMIA study // Am. Heart J. — 2007 Mar. — Vol. 153(3). — 445.e7–14.
7. Cerisano G., Bolognese L., Buonamici P. et al. Prognostic implications of restrictive left ventricular filling in reperfused anterior acute myocardial infarction // JACC. — 2001. — Vol. 37. — P. 793–799.
8. Cleland J., Torabi A., Khan N. Epidemiology and management of heart failure and left ventricular systolic dysfunction in the aftermath of a myocardial infarction // Heart. — 2005. — Vol. 91 (suppl. 2). — ii7–13.
9. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology // Eur. Heart J. — 2008. — Vol. 10(10). — P. 933–989.
10. Fox K.A., Steg P., Kim A. et al. For the GRACE Investigators Decline in Rates of Death and Heart Failure in Acute Coronary Syndromes, 1999–2006 // JAMA. — 2007. — Vol. 297. — P. 1892–1900.
11. Frants S., Bauersachs F., Ertj G. Post-infarct remodeling. Contribution of wound healing and inflammation // Cardiovasc. Res. — 2008. — Vol. 81(3). — P. 474–481.
12. Froissart M., Rossert J., Jacquot C. et al. Predictive Performance of the Modification of Diet in Renal Disease and Cockcroft-Gault Equations for Estimating Renal Function // Am. Soc. Nephrol. — 2005. — Vol. 16. — P. 763–773.
13. Hellermann J.P., Jacobsen S.J., Reeder G.S. et al. Heart failure after myocardial infarction: prevalence of preserved left ventricular systolic function in the community // Am. Heart J. — 2003. — Vol. 145. — P. 742–748.
14. Karp E., Shiyovich A., Zahger D. et al. Ultra-short-term heart rate variability for early risk stratification following acute ST-elevation myocardial infarction // Cardiology. — 2009. — Vol. 114(4). — P. 275–283.
15. Killip T., Kimball J.T. Treatment of myocardial infarction in a coronary care unit: a two year experience with 250 patients // Am. J. Cardiol. — 1967. — Vol. 20. — P. 457–464.
16. King D.L., Jaffe C., Schmiolt В. Left ventricular volume determination by cross sectional cardiac ultrasonography // Radiology. — 1972. — № 104. — P. 201–209.
17. Lepeschkin E., Surawicz B. The measurement of the QT interval of the electrocardiogram // Circulation. — 1952. — Vol. 6. — P. 378–388.
18. Liem D., Honda H., Zhang J. et al. Past and present course of cardioprotection against ischemia/reperfusion injury // J. Appl. Physiol. — 2007. — Vol. 103. — P. 2129–2136.
19. Lopez de Sa E., Lopez-Sendon J., Anguera I. et al. Prognostic value clinical variables at presentation in pacients with non-ST-segment elevation acute coronary syndromes: results of the PERA study // Medicine. — 2002. — Vol. 81. — S434–442.
20. MacIve D., Townsend M. A novel mechanism of heart failure with normal ejection fraction // Heart. — 2008. — Vol. 94. — P. 446–449.
21. Masoudi F., Plomondon M., Magid D. et al. Renal insufficiency and mortality from acute coronary syndromes // Amer. Heart J. — 2004. — Vol. 147(4). — P. 623–629.
22. McLaughlin N., Campbell R., Murray A. Accuracy of four automatic QT measurement techniques in cardiac patients and healthy subjects // Heart. — 1996. — Vol. 76. — P. 422–426.
23. Mistry N., Bohmer E., Hoffmann P. et al. Left ventricular function in acute myocardial infarction treated with thrombolysis followed by early versus late invasive strategy // Am. Heart J. — 2010. — Vol. 160(1). — P. 73–79.
24. Moller J.E., Pellikka P.A., Hillis G.S. et al. Prognostic importance of diastolic function and filling pressure in patients with acute myocardial infarction // Circulation. — 2006. — Vol. 114. — P. 438–444.
25. Moller J.E., Sondergaard E., Poulsen S.H. et al. Pseudonormal and restrictive filling patterns predict left ventricular dilation and cardiac death after a first myocardial infarction: a serial color M-mode Doppler echocardiographic study // J. Am. Coll. Cardiol. — 2000. — Vol. 36. — P. 1841–1846.
26. Moller J.E., Whalley G.A., Dini F.L. et al. Independent prognostic importance of a restrictive left ventricular filling pattern after myocardial infarction: an individual patient meta-analysis: Meta-Analysis Research Group in Echocardiography acute myocardial infarction // Circulation. — 2008. — Vol. 117. — P. 2591–2598.
27. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification // Am. J. Kidney Dis. — 2002. — Vol. 39 (suppl. 1). — S1–266.
28. Poulsen S.H., Muller J.E., Norager B. et al. Prognostic implications of left ventricular diastolic dysfunction with preserved systolic function following acute myocardial infarction // Cardiology. — 2000. — Vol. 95. — P. 190–197.
29. Pride Y., Appelbaum E., Lord E. et al. TIMI Study Group, Relation Between Myocardial Infarct Size and Ventricular Tachyarrhythmia Among Patients With Preserved Left Ventricular Ejection Fraction Following Fibrinolytic Therapy for ST-Segment Elevation Myocardial Infarction // Am. J. of Cardiol. 2009. — Vol. 104. — I, 4. — P. 475–479.
30. Shamagian L., Gonzalez-Juanatey J., Roman A. The death rate among hospitalized heart failure patients with normal and depressed left ventricular ejection fraction in the year following discharge: evolution over a 10-year period // Eur. Heart J. — 2005. — Vol. 26. — P. 2251–2258.
31. Smith G.L., Masoudi F.A., Shlipak M.G. et al. Renal Impairment Predicts Long-Term Mortality Risk after Acute Myocardial Infarction // J. Am. Soc. Nephrol. — 2008. — Vol. 19(1). — P. 141–150.
32. Solomon S.D., Anavekar N., Skali H. et al. For the Candesartan in Heart Failure Reduction in Mortality (CHARM) Investigators Influence of Ejection Fraction on Cardiovascular Outcomes in a Broad Spectrum of Heart Failure Patients // Circulation. — 2005. — Vol. 112. — P. 3738–3744.
33. Spencer F.A., Meyer T.E., Gore J.M. et al. Heterogeneity in the management and outcomes of patients with acute myocardial infarction complicated by heart failure: the National Registry of Myocardial Infarction // Circulation. — 2002. — Vol. 105. — P. 2605–2610.
34. Steg P., Dabbous O., Feldman L. et al. Determinants and prognostic impact of heart failure complicating acute coronary syndromes: observations from the Global Registry of Acute Coronary Events (GRACE) // Circ. — 2004. — Vol. 109. — P. 494–499.
35. Van de Werf F., Bax J., Betriu A. et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation AMI of the European Society of Cardiology // Eur. Heart J. — 2008. — Vol. 29(23). — P. 2909–2945.
36. Wallander M. Oral glucose tolerance test: a reliable tool for early detection of glucose abnormalities in АМI patients in clinical practice: a report on repeated oral glucose tolerance tests. GAMI study // Diabetes Care. — 2008. — Vol. 31(1). — P. 36–38.
37. Whalley G.A., Gamble G.D., Doughty R.N. Restrictive diastolic filling predicts death after acute myocardial infarction: systematic review and meta-analysis of prospective studies // Heart. — 2006. — Vol. 92. — P. 1588–1594.
38. White H.D., Norris R.M., Cross D.B. et al. Non-invasive diagnosis of arterial patency after thrombolytic treatment and its relations to prognosis // Brit. Heart J. — 1993. — Vol. 69. — P. 485–491.
39. Wright R., Reeder G., Herzog C. et al. Acute myocardial infarction and renal dysfunction: a high–risk combination // Ann. Intern. Med. — 2002. — Vol. 137(7). — P. 563–570.
40. Zeymer U., Bauer T., Gersh B. et al. Beneficial effect of reperfusion therapy beyond the preservation of left ventricular function in patients with acute ST-segment elevation myocardial infarction // Int. J. Cardiol. — 2009. — Vol. 13. — P. 2–4.
41. Zipes D., Camm A., Borggrefe M. et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death // J. Am. Coll. Cardiol. — 2006. — Vol. 48. — P. 247–346.

/127/127.jpg)
/128/128_3.jpg)
/129/129.jpg)
/130/130.jpg)
/131/131.jpg)
/132/132.jpg)
/133/133_2.jpg)