Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Принципы ведения пациентов с субмассивной тромбоэмболией легочной артерии. Клинический случай
Авторы: Пархоменко А.Н., Лутай Я.М., Иркин О.И., Кушнир С.П., Сопко А.А., Федькив С.В. - Отделение реанимации и интенсивной терапии, региональный лечебно-диагностический центр, ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины, г. Киев
Рубрики: Медицина неотложных состояний, Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 148-153
Пациент 55 лет доставлен в отделение реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» каретой скорой медицинской помощи с диагнозом «ИБС: острый коронарный синдром без элевации сегмента ST». На момент поступления жалобы на боль за грудиной давящего характера, умеренную одышку. Возникновение дискомфорта (болей) за грудиной отмечает после физической нагрузки в течение последней недели, боли сопровождались умеренной одышкой. В день поступления после подъема по лестнице почувствовал резкую одышку, позже развилась боль давящего характера, что и послужило причиной обращения за медицинской помощью. У пациента в анамнезе артериальная гипертензия, хронический гастродуоденит, варикозное расширение и тромбофлебит вен нижних конечностей (в 2010 году проводились флебэктомия и удаление тромба из глубоких вен нижних конечностей). Регулярно терапию не принимал.
При поступлении общее состояние средней степени тяжести. Повышенного питания. Кожные покровы телесной окраски, акроцианоз, слизистые оболочки с цианотичным оттенком. АД — 120/80 мм рт.ст., ЧСС — 90 ударов в 1 минуту, насыщение артериальной крови кислородом при пульсоксиметрии (SpO2) — 87 % (93 % на фоне оксигенотерапии). Деятельность сердца ритмичная, тоны приглушены. В легких дыхание жесткое, хрипы не выслушиваются. Живот безболезненный, мягкий. Нижний край печени чувствительный, на 4 см ниже края реберной дуги. Пастозность голеней с обеих сторон. Варикозное расширение вен нижних конечностей.
ЭКГ и данные лабораторных исследований представлены на рис. 1 и в табл. 1.
Таким образом, анамнестические, клинические и лабораторные данные свидетельствовали о необходимости проведения дифференциальной диагностики между тромбоэмболией легочной артерии (ТЭЛА) и острым коронарным синдромом. Клиническая вероятность ТЭЛА была оценена как средняя (4,5 балла по шкале Wells и 6 баллов по шкале Женевского счета) [1, 7]. Пациенту назначена полнодозовая антикоагулянтная терапия низкомолекулярными гепаринами (аспирин и клопидогрель в нагрузочных дозах получил догоспитально), бета–блокаторы, статины, блокаторы протонной помпы. Для проведения дифференциальной диагностики была проведена трансторакальная эхокардиография (ЭхоКГ), которая подтвердила отсутствие нарушений сегментарной сократимости левого желудочка и выявила признаки дилатации и перегрузки правых отделов сердца (рис. 2, ЭхоКГ при поступлении). Систолическое давление в легочной артерии составило 65 мм рт.ст. У пациента отмечен положительный признак Мак-Конелла (выраженное нарушение сократимости свободной стенки ПЖ при сохраненной сократимости верхушки ПЖ), который является высокоспецифичным признаком острой ТЭЛА [7].
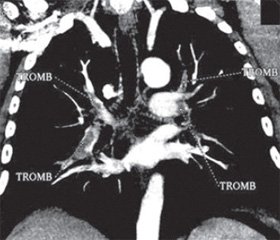
Для окончательной верификации диагноза (так как состояние пациента оставалось гемодинамически стабильным) была проведена мультиспиральная компьютерная томография (МсКТ), которая подтвердила наличие ТЭЛА и выявила множественные тромбы в основных ветвях обеих легочных артерий (рис. 3, МсКТ при поступлении).
С учетом клинической картины заболевания (нормальные параметры центральной гемодинамики), данных инструментальных (признаки дисфункции ПЖ) и лабораторных (повышение уровня тропонина) методов исследования данная ТЭЛА была классифицирована как субмассивная, или промежуточного риска [1, 7]. В то же время наличие одышечного (SpO2 — 87 %) и болевого синдромов, массивность тромботической закупорки основных ветвей легочной артерии, выраженная степень дисфункции ПЖ, а также отсутствие видимых факторов риска развития кровотечений явились основанием для проведения тромболитической терапии (ТЛТ). ТЛТ проводилась альтеплазой в дозе 100 мг в течение 2 часов. Во время проведения ТЛТ отмечалась кровоточивость десен, которую удалось остановить полосканием полости рта раствором аминокапроновой кислоты. Других кровотечений не было. Через 12 часов после окончания ТЛТ состояние пациента существенно улучшилось, боли в грудной клетке и одышка прекратились. Насыщение артериальной крови кислородом при пульсоксиметрии (SpO2) возросло до 96 % (дыхание воздухом), ЧСС снизилась до 70 ударов в 1 минуту. Повторная ЭхоКГ выявила существенное уменьшение размеров и перегрузки ПЖ, снижение степени легочной гипертензии (рис. 2, ЭхоКГ после проведения ТЛТ). Контрольная мультиспиральная КТ, проведенная на 5-е сутки после ТЛТ (рис. 3), выявила значительное улучшение легочного кровотока с наличием единичных тромбов в субсегментарных ветвях легочной артерии. При компрессионной сонографии вен нижних конечностей тромбы в глубоких венах нижних конечностей не выявлены (признаки посттромбофлебитической болезни). Пациент был переведен на длительный прием пероральных антикоагулянтов и выписан в удовлетворительном состоянии. ЭКГ при выписке представлено на рис. 4.
Обсуждение
Терапия больных ТЭЛА определяется клиническим статусом пациента, объемом эмболизации, наличием сопутствующей патологии, уровнем маркеров некроза миокарда (тропонин), а также степенью дисфункции правых отделов сердца. Основополагающим моментом является состояние центральной гемодинамики [1, 7].
Пациентам с явлениями шока или стойкой (более 15 минут) артериальной гипотензией (массивная ТЭЛА) рекомендовано назначение нефракционированного гепарина (болюс 80 Ед/кг с последующей инфузией (18 Ед/кг/ч) и коррекцией скорости в зависимости от АЧТВ). Систолическое АД необходимо поддерживать на уровне выше 90 мм рт.ст. Для этого используется введение катехоламинов (в/в инфузия норадреналина), а быстрая и массивная инфузионная терапия таким больным, напротив, противопоказана. Рекомендуется оксигенотерапия, в то же время искусственная вентиляция должна проводиться по строгим показаниям, так как может усугубить явления правожелудочковой недостаточности. У больных с массивной ТЭЛА тромболитическая терапия является методом выбора, при этом временное «окно» для проведения ТЛТ значительно шире, чем у пациентов с острыми коронарными синдромами. Хирургическая эмболэктомия и/или интервенционные методы лечения используются при противопоказаниях к ТЛТ или при ее неэффективности.
У пациентов со стабильной гемодинамикой (90–95 % пациентов) препаратами выбора являются антикоагулянты (низкомолекулярные гепарины, фондапарин или нефракционированный гепарин). У этой категории больных вопрос о проведении ТЛТ решается только при наличии дополнительных факторов риска — в первую очередь дисфункции правого желудочка и/или повышения уровня тропонина (субмассивная ТЭЛА — 15–20 % больных). В то же время доказательная база, подтверждающая эффективность ТЛТ у пациентов с субмассивной ТЭЛА, до последнего времени практически отсутствовала. В марте этого года на сессии Американского колледжа кардиологов были доложены результаты многоцентрового рандомизированного плацебо-контролируемого исследования PEITHO, посвященного этому вопросу [2]. В исследование включено 1006 пациентов (медиана возраста — 70 лет) с субмассивной ТЭЛА, которые рандомизировались для приема гепарина/плацебо или гепарина/тенектеплазы. У всех больных диагноз ТЭЛА подтверждался при помощи методов визуализации (в 95 % случаев МсКТ), а также была выявлена дисфункция ПЖ (ЭхоКГ или МсКТ) и повышение уровня тропонинов. Развитие смерти и/или гемодинамического коллапса в течение 7 дней наблюдения было выбрано в качестве первичной конечной точки. Проведение ТЛТ позволило снизить вероятность развития событий первичной конечной точки на 56 % (2,6 % в группе тенектеплазы по сравнению с 5,6 % в группе плацебо, p = 0,015). В то же время не было выявлено достоверного влияния анализируемой терапии на вероятность смерти от всех причин как через 7 (1,2 % в группе ТЛТ по сравнению с 1,8 % в группе контроля, р = 0,43), так и через 30 дней наблюдения (2,4 по сравнению 3,2 % соответственно, p = 0,42). В группе ТЛТ отмечалась тенденция к более редкому рецидивированию ТЭЛА (0,2 по сравнению с 1,0 %, р = 0,12), а также реже требовалось проведение интубации/искусственной вентиляции легких (1,6 по сравнению 3,0 %, р = 0,13) и повторного введения тромболитических агентов (0,8 по сравнению с 4,6 %, р < 0,001). Однако ТЛТ тенектеплазой приводила к достоверному повышению количества больших кровотечний (6,3 против 1,5 % в группе плацебо (p < 0,001) и геморрагических инсультов (10 против 1 в группе плацебо). Таким образом, результаты самого большого на сегодняшний день исследования оказались неоднозначными: предотвращение жизнеопасных гемодинамических осложнений при проведении ТЛТ у пациентов с субмассивной ТЭЛА было получено за счет увеличения геморрагических осложнений. В этом случае улучшения результатов ТЛТ возможно добиться либо путем выделения подгрупп пациентов с минимальным риском кровотечений, либо путем изменения режима ТЛТ. К сожалению, в настоящее время отсутствует общепринятая шкала для определения риска кровотечений у пациентов с ТЭЛА. Однако в 2010 году на основе анализа данных более 24 000 пациентов с ТЭЛА, включенных в регистр RIETE, была предложена шкала риска развития фатальных кровотечений (рис. 5).
/153/153.jpg)
Она не является специфичной для пациентов, которым планируется проведение ТЛТ, однако позволяет среди всех больных с ТЭЛА выделить небольшую (2,2 %) категорию с очень высоким риском фатальных геморрагических осложнений и, соответственно, высоким риском осложнений при проведении системной ТЛТ. Предпосылками для снижения дозы тромболитического препарата у больных с ТЭЛА могут быть особенности кровоснабжения легких (единственный орган, через который проходит весь объем циркулирующей крови и, соответственно, вся доза фибринолитика, введенная системно), а также высокая активность собственной фибринолитической системы в легочной ткани [6]. Такой подход также тестировался в ряде небольших исследований. В проспективном рандомизированном многоцентровом исследовании C. Wang и соавт. [8] в ходе обследования 118 пациентов с массивной и субмассивной ТЭЛА не было выявлено существенных отличий между двумя режимами введения альтеплазы в дозах 50 мг или 100 мг (инфузия в течение 2 часов) по основным показателям эффективности — функции ПЖ и динамики систолического давления в легочной артерии по данным ЭхоКГ; степени обструкции легочных артерий по данным МсКТ; количеству дефектов наполнения по данным вентиляционно-перфузионной сцинтиграфии. Оба режима ТЛТ также существенно не отличались по влиянию на летальность и вероятность развития повторных венозных тромбоэмболий (ВТЭ). В то же время использование низкодозового режима имело тенденцию к более редкому развитию больших кровотечений (3 % по сравнению с 10 % соответственно, р = 0,288), особенно у пациентов с массой тела менее 65 кг (14,8 по сравнению с 41,2 % соответственно, р = 0,049). В многоцентровом рандомизированном исследовании MOPETT у 121 больного с субмассивной ТЭЛА тестировалось введение безопасной дозы альтеплазы (50 мг у пациентов c массой тела < 50 кг или 0,5 мг/кг при массе тела < 50 кг) на фоне безопасного режима антикоагулянтной терапии (по сравнению со стандартными дозами антикоагулянтов) [5]. Проведение ТЛТ привело к достоверному снижению вероятности развития первичной конечной точки (повторная ТЭЛА + легочная гипертензия) через 28 месяцев наблюдения (р < 0,001). В группе ТЛТ также достоверно реже наблюдалось развитие смерти и повторных ВТЭ (1,6 по сравнению с 10 %, р = 0,049), а также существенно сокращались сроки пребывания пациента в стационаре (p < 0,001). В иследовании MOPETT большие кровотечения не были зарегистрированы ни в одной из групп.
Существенное снижение дозы тромболитического агента возможно также при использовании катетерного (направленного) тромболизиса. Этот метод уже используется у пациентов с массивной ТЭЛА [4] и дополнительно позволяет напрямую контролировать давление в системе легочной артерии и в онлайн-режиме оценивать эффективность терапии, однако является инвазивным и связан с дополнительным перипроцедурным риском (в т.ч. кровотечений). В марте 2013 года были доложены результаты исследования ULTIMA, в котором у больных с субмассивной ТЭЛА эндоваскулярное введение тромболитического препарата проводили специальным катетером EkoSonic с возможностью усиления эффекта терапии при помощи ультразвука. Это позволило свести применяемые дозы тромболитических препаратов к минимуму и полностью избежать развития кровотечений [3].
В дальнейшем всем больным с ТЭЛА для профилактики повторных эмболий назначают пероральные антикоагулянты (в случае применения антагонистов витамина К отмена гепаринов только после достижения МНО от 2 до 3). Длительность профилактической терапии обусловлена степенью риска повторной эмболизации. Постановка венозных кава-фильтров применяется в основном у пациентов с противопоказаниями или неэффективностью антикоагулянтной терапии.
Показания к постановке венозных кава-фильтров:
— противопоказания к антикоагулянтной терапии (класс I, уровень С);
— повторная ТЭЛА, несмотря на антикоагулянтную терапию (класс IIa, уровень С);
— плохой кардиопульмональный резерв (класс IIb, уровень С);
— рутинная установка не рекомендована (класс III, уровень С).
Мы представили вашему вниманию случай успешной ТЛТ у пациента с субмассивной ТЭЛА. В то же время вопрос применения тромболитиков у данной категории пациентов остается открытым и требует дальнейшего изучения. В рекомендациях Американской ассоциации сердца 2011 года указано, что ТЛТ может быть проведена пациентам с субмассивной ТЭЛА при отсутствии противопоказаний и наличии клинических признаков плохого прогноза. При этом класс рекомендаций (IIb) и уровень доказательной базы (С) — очень низкие.
Дополнительные факторы риска у пациентов с субмассивной ТЭЛА:
1. Гемодинамическая/респираторная недостаточность:
— эпизод гипотензии;
— шоковый индекс > 1;
— дыхательная недостаточность (SpO2 < 95 + Borg > 8, психические нарушения).
2. Умеренная/выраженная дисфункция ПЖ:
— гипокинез ПЖ/сист. давление в ПЖ > 40 мм рт.ст.;
— BNР > 100 пг/мл;
— proBNР > 900 пг/мл;
— диагностическое повышение уровня тропонина.
Данные последних клинических исследований (PEITHO, MOPETT и др.), на наш взгляд, свидетельствуют в пользу проведения ТЛТ у этой категории больных, что, помимо уменьшения количества осложнений в острый период заболевания, позволит избежать развития хронической легочной гипертензии, легочного сердца и сердечно-легочной недостаточности. Что, безусловно, существенным образом повысит качество жизни пациента. Однако ТЛТ должна проводиться только после тщательного анализа факторов риска развития осложнений (в первую очередь кровотечений), а у некоторых категорий пациентов (низкая масса тела, высокий риск кровотечений) возможно использование низкодозовых режимов ТЛТ.
1. Jaff M.R., McMurtry M.S., Archer S.L. et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association // Circulation. — 2011. — 123. — 1788e–1830.
2. Konstantinides S. Late-breaking clinical trials V: Heart failure. Presented at: American College of Cardiology Scientific Sessions; March 9–11, 2013; San Francisco.
3. Kucher N. et al. Presented at: American College of Cardiology Scientific Sessions; March 9–11, 2013; San Francisco.
4. Kuo W.T., Gould M.K., Louie J.D. et al. Catheter–directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques // J. Vasc. Interv. Radiol. — 2009. — 20. — 1431e–1440.
5. Sharifi M., Bay C., Skrocki L., Rahimi F., Mehdipour M. MOPETT Investigators. Moderate pulmonary embolism treated with thrombolysis (from the MOPETT Trial) // Am. J. Cardiol. — 2013 Jan 15. — 111 (2). — 273–7.
6. Shetty S. et al. The fibrinolytic system and the regulation of lung epithelial cell proteolysis, signaling, and cellular viability // Am. J. Physiol. Lung. Cell. Mol. Physiol. — 2008. — 295 (6). — 967–975.
7. Torbicki A., Perrier A., Konstantinides S. et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) // Eur. Heart J. — 2008. — 29 (18). — 2276–2315.
8. Wang C., Zhai Z., Yang Y. et al. Efficacy and safety of low dose recombinant tissue–type plasminogen activator for the treatment of acute pulmonary thromboembolism: a randomized, multicenter, controlled trial // Chest. — 2010 Feb. — 137 (2). — 254–62.

/149/149.jpg)
/149/149_2.jpg)
/150/150.jpg)
/151/151.jpg)
/152/152.jpg)