Газета «Новости медицины и фармации» 13-14 (507-508) 2014
Вернуться к номеру
Тамсулозин — препарат выбора для лечения симптомов со стороны нижних мочевыводящих путей при доброкачественной гиперплазии предстательной железы
Авторы: Савустьяненко А.В. - кафедра фармакологии Донецкого национального медицинского университета им. М. Горького; Сагалевич А.И. - кафедра урологии Донецкого национального медицинского университета им. М. Горького
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 10-11 (Мир)
Доброкачественная гиперплазия предстательной железы является одной из основных медицинских проблем, с которой приходится сталкиваться мужчинам преклонного возраста. В связи с этим становится актуальной проблема выбора адекватного лекарственного средства, которое должно эффективно устранять симптомы заболевания и не вызывать побочных эффектов, чтобы не снижать качество жизни пациентов. К препаратам первого выбора для лечения упомянутой патологии относят α1-адреноблокаторы. Результаты выполненных исследований свидетельствуют о том, что все α–адреноблокаторы — теразозин, доксазозин, альфузозин, тамсулозин и силодозин — проявляют одинаковый эффективный лечебный эффект, однако профиль безопасности продолжает быть более высоким у тамсулозина. Это делает его предпочтительным лекарственным средством для лечения симптомов со стороны нижних мочевыводящих путей, связанных с доброкачественной гиперплазией предстательной железы.
Патогенетическое обоснование выбора препарата
Доброкачественная гиперплазия предстательной железы (ДГПЖ) встречается у 50 % мужчин в возрасте > 50 лет и приводит к развитию обструкции выходного отверстия мочевого пузыря, появлению симптомов со стороны нижних мочевыводящих путей (СНМП) и снижению качества жизни [1]. Высокая распространенность ДГПЖ среди мужчин пожилого возраста и демографическая тенденция к постарению населения определяют актуальность вопросов диагностики и лечения этого заболевания. К препаратам первого выбора при лечении СНМП вследствие ДГПЖ относят α1-адреноблокаторы, воздействующие на разные подтипы α1-адренорецепторов. Современные данные позволяют определиться с тем, назначение какого препарата является наиболее патогенетически обоснованным, если учесть представленность тех или иных α1-адренорецепторов в мочевыводящей системе и ряде других систем организма.
Первоначально считалось, что если устранить обструкцию мочеточника, вызванную разрастанием ткани предстательной железы, за счет расслабления ее гладкомышечных клеток (α1а-эффект), то это приведет к исчезновению всех симптомов со стороны нижних мочевыводящих путей. Однако на практике было показано, что устранение обструкции приводило к улучшению мочеиспускания, но не влияло на другие СНМП (например, на симптомы раздражения мочевого пузыря) [1, 2].
Таким образом, был сделан вывод о том, что для эффективного лечения СНМП вследствие ДГПЖ необходимо проявление двойного эффекта. Блокада α1а-адренорецепторов приводит к расслаблению гладкомышечных клеток стромы предстательной железы, что приводит к уменьшению симптомов обструкции. Блокада α1d-адренорецепторов приводит к расслаблению гладкой мускулатуры мочевого пузыря и/или устранению спинномозговых рефлексов, связанных с мочевым пузырем, что приводит к устранению симптомов раздражения мочевого пузыря. Следствием обоих эффектов будет также нивелирование симптомов, возникающих сразу после опорожнения мочевого пузыря [1].
Побочные эффекты, вызываемые α1-адреноблокаторами, также связаны с влиянием на разные подтипы α1-адренорецепторов. Так, α1b-адренорецепторы расположены в сосудах, поэтому их блокада приводит к расширению сосудов и возникновению головокружения, гипотензии, обморока. Кроме того, могут возникать и другие побочные эффекты, потенциально связанные с влиянием на сосуды, — слабость, утомляемость, головная боль. Избыточная блокада α1а-адренорецепторов приводит к уменьшению или полному отсутствию эякуляции. Это связано с тем, что данный подтип рецепторов расположен в семенных пузырьках и семявыводящих протоках и при их блокаде не происходит сокращение гладкой мускулатуры перечисленных структур [1, 5].
К сегодняшнему дню в распоряжении врача находится несколько α1-адреноблокаторов. Они различаются по степени селективности (избирательности) к разным подтипам α1-адренорецепторов (табл. 1), поэтому, учитывая вышеизложенную информацию, можно определить, какой же препарат патогенетически наиболее целесообразен.
Теразозин, доксазозин и альфузозин относятся к неизбирательным α1-адреноблокаторам и в равной степени блокируют все α1-адренорецепторы. Недостатком этих средств является высокая частота развития сосудистых осложнений в связи с блокадой α1b-адренорецепторов. Тамсулозин блокирует α1a- и α1d-адренорецепторы, что позволяет ему эффективно бороться со всеми СНМП, при этом сосудистые осложнения возникают редко, в связи с малым влиянием на α1b-адренорецепторы. Недостатком силодозина является высокая избирательность в отношении α1a-адренорецепторов, что ведет к высокой частоте развития эякуляторных расстройств, и несколько меньшее сродство к α1d-адренорецепторам (хотя на эффективности лечения это не сказывается и не определяет клинические преимущества силодозина). Так, систематический обзор и метаанализ рандомизированных контролируемых исследований, оценивающих силодозин в лечении ненейрогенных СНМП при ДГПЖ, показал, что силодозин был более эффективен, чем плацебо и тамсулозин в дозе 0,2 мг, и так же эффективен, как тамсулозин в дозе 0,4 мг. Что касается побочных эффектов, то нарушений эякуляции было больше при применении силодозина [14]. В другом исследовании, проведенном в 9 медицинских центрах с участием 209 пациентов, принимавших 4 мг силодозина 2 раза в день и 0,2 мг тамсулозина в день в течение 12 недель, показано, что 4 мг силодозина 2 раза в день не хуже, чем 0,2 мг тамсулозина в день для пациентов с симптомами ДГПЖ [15]. Более масштабное мультицентровое двойное слепое плацебо-контролируемое исследование с участием 1228 пациентов из 72 городов в 11 европейских странах показало, что общая эффективность силодозина не ниже и не выше, чем эффективность тамсулозина [7].
Таким образом, с патогенетической точки зрения наиболее целесообразным средством для лечения СНМП при ДГПЖ следует признать тамсулозин. Данный препарат в равной степени блокирует α1a- и α1d-адренорецепторы, что позволяет одинаково эффективно бороться со всеми симптомами болезни. При этом он достаточно мало влияет на α1b-адренорецепторы, чтобы практически не вызывать сосудистых осложнений, и не столь сильно блокирует α1a-адренорецепторы, чтобы слишком часто вызывать эякуляторные расстройства.
Эффективность терапии
В Руководстве Европейской ассоциации урологов (2014) по лечению симптомов со стороны нижних мочевыводящих путей ненейрогенной этиологии у мужчин, включая доброкачественную обструкцию предстательной железы (Guidelines on the Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO)), сообщается о том, что все α1-адреноблокаторы одинаково эффективны в отношении СНМП, если они назначены в адекватных дозах [2].
Об эффективности препаратов обычно судят по изменению значений Международной шкалы оценки простатических симптомов (International Prostate Symptom Score (IPSS)) и параметров уродинамики, в частности величины Qmax (максимальной объемной скорости потока мочи). Все α1-адреноблокаторы уменьшают IPSS примерно на 30–40 % и увеличивают Qmax приблизительно на 20–25 %. Однако значительные улучшения показателей также происходят в соответствующих группах пациентов, получающих плацебо. В открытых исследованиях выявлено улучшение IPSS до 50 % и повышение Qmax до 40 %.
Как указывается в рекомендациях ЕАУ 2014, эффективность альфа-блокаторов оказалась одинаковой в различных возрастных группах и не зависела от размера ПЖ в исследованиях длительностью менее года. Но в продолжительных исследованиях было показано, что α1-адреноблокаторы более эффективны у пациентов с малой железой ( < 40 мл), чем с большой. В длительных исследованиях выявлено, что α1-блокаторы не уменьшают размер ПЖ и не предотвращают риск развития острой задержки мочеиспускания, поэтому с течением времени некоторым пациентам приходится проводить хирургическое лечение. Несмотря на это, очевидно, что снижение IPSS и увеличение Qmax сохраняются при лечении α1-блокаторами как минимум в течение 4 лет [2].
Таким образом, с учетом одинаковой эффективности при выборе α1-адреноблокатора для лечения СНМП вследствие ДГПЖ решающее значение имеют только параметры безопасности.
Сосудистые осложнения
В 2008 г. был выполнен крупнейший на сегодняшний день метаанализ сосудистых побочных эффектов α1-адреноблокаторов, применяемых для лечения СНМП вследствие ДГПЖ [6]. При его подготовке был осуществлен поиск двойных слепых проспективных плацебо-контролируемых исследований в базах данных MEDLINE, Cochrane Database и Food and Drug Administration Web site, опубликованных до 2006 г. В общей сложности из 2389 доступных публикаций в метаанализ было включено 25 работ. Среди оцениваемых препаратов были теразозин, доксазозин, альфузозин и тамсулозин. Длительность большинства исследований составила от 4 до 24 недель.
Главная цель исследования сводилась к оценке вероятности развития сосудистых осложнений (головокружение, гипотензия, обморок) при назначении различных α1-адреноблокаторов. Кроме того, была оценена вероятность развития других побочных эффектов, которые потенциально могли быть связаны с влиянием на сосуды, — слабости, утомляемости, головной боли.
В результате было выяснено, что только тамсулозин не приводил к достоверному росту вероятности развития сосудистых осложнений (головокружение, гипотензия, обморок) по сравнению с плацебо, хотя уровень достоверности имел пограничное значение (0,053). Применение всех остальных препаратов было высокодостоверно связано с развитием перечисленных побочных эффектов (табл. 2).
В дополнение к этому альфузозин, тамсулозин и доксазозин ГИТС (форма выпуска: гастроинтестинальная терапевтическая система) приводили к развитию слабости, утомляемости и головной боли.
Таким образом, в ходе цитируемого метаанализа тамсулозин был единственным препаратом, который не приводил к достоверному увеличению вероятности развития основных и дополнительных сосудистых побочных эффектов. При этом важным преимуществом препарата является то, что тамсулозин не требует титрации и корректировки рекомендуемой дозы для пациентов пожилого возраста с сердечно–сосудистыми заболеваниями, для больных с нарушениями функции почек и печени. А ведь 80 % больных, обращающихся к врачу по поводу ДГПЖ, имеют сопутствующую патологию. Наряду с этим проведенное исследование применения α-адреноблокаторов у неврологических пациентов показало, что для пациентов с ДГПЖ, перенесших мозговой инсульт, препаратом выбора является Флосин® (тамсулозин производства Берлин-Хеми/А. Менарини Украина ГмбХ), который обеспечивает быстрое и стойкое избавление от симптомов ДГПЖ при минимальных кардиоваскулярных побочных эффектах [13].
Более новый препарат из группы α1-адреноблокаторов — силодозин не был включен в метаанализ. Однако результаты одного из последних двойных слепых проспективных плацебо-контролируемых исследований свидетельствуют о том, что силодозин не вызывает сосудистых осложнений [7].
Влияние на эякуляцию
В литературе сообщается о том, что теразозин, доксазозин и альфузозин не вызывают эякуляторных расстройств [1]. Тамсулозин может вызывать эякуляторные расстройства (уменьшение/отсутствие эякуляции), но с очень малой частотой. Так, в работе K. Kawabe и соавт. приводится цифра на уровне 1,6 %, в работе C.R. Chapple и соавт. — на уровне 2 % [7, 8].
Вместе с тем эякуляторные расстройства являются основным побочным эффектом силодозина. Те же исследователи сообщают о частоте встречаемости данного осложнения на уровне 22,3 и 14 % соответственно (что в десятки раз превышает частоту нарушений эякуляции при приеме тамсулозина). T. Yokoyama и соавт. приводят цифру 24,4 % [9].
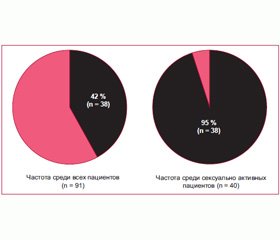
Еще одна группа японских исследователей указала на общий недостаток процитированных работ: оценка эякуляторной дисфункции производилась без учета того, ведут ли пациенты сексуально активную жизнь (половые контакты, мастурбация). Чтобы исправить этот недочет, они провели собственное открытое исследование [5], в которое был включен 91 пациент с СНМП вследствие ДГПЖ, из которых 40 вели сексуально активную жизнь на фоне приема силодозина. В исследовании не было плацебо-группы или других групп сравнения.
В ходе исследования было установлено, что эякуляторные расстройства наблюдались у 38 пациентов, что составило 42 % от общей популяции (91 пациент). Когда же частоту эякуляторных расстройств подсчитали только среди тех пациентов, которые вели сексуально активную жизнь, то частота эякуляторных расстройств составила 95 % (рис. 1).
Иными словами, практически все пациенты, ведущие сексуально активную жизнь (половые контакты, мастурбация), переживали эякуляторные расстройства на фоне приема силодозина.
Далее авторы исследования выяснили, каждый ли раз возникали эякуляторные расстройства у тех пациентов, у которых они наблюдались (n = 38). Оказалось, что у 34 пациентов (89 %) эякуляторные расстройства возникали при каждом акте сексуальной активности, у 3 пациентов (8 %) — в 2 из 3 актов и у 1 пациента (3 %) — в 1 из 2 актов. При этом полное отсутствие семенной жидкости наблюдалось у 33 пациентов (87 %), уменьшение объема семенной жидкости — у 5 пациентов (13 %).
Таким образом, результаты выполненного исследования свидетельствуют о том, что силодозин вызывает эякуляторные расстройства практически у всех пациентов (95 %), ведущих сексуально активную жизнь. При этом 76 % из этих пациентов обеспокоены имеющимся побочным эффектом, что ведет к снижению качества жизни, особенно у пациентов более молодого возраста.
Напротив, как показали результаты рандомизированного слепого исследования 2013 года [11], применение тамсулозина приводит к значительному улучшению эректильной функции и качества полового акта, что статистически достоверно подтверждается увеличением показателей — международного индекса эректильной функции (МИЭФ (IIEF)) наряду с улучшением показателей IPSS. Подобные результаты положительного влияния тамсулозина (препарата Флосин®) докладывались и на 61-м конгрессе Немецкой ассоциации урологов. Исследование половой функции мужчин в динамике при монотерапии препаратом Флосин показало улучшение эректильной функции у 76,4 % пациентов, улучшение качества оргастических ощущений и исчезновение посторгастической боли у 83,3 % больных, а также увеличение времени полового акта у 63,6 % пациентов [12].
Заключение
Анализ результатов лечения больных с СНМП в Украине свидетельствует о значительном расширении показаний к медикаментозному лечению заболеваний предстательной железы [16]. Кроме основного показания — ДГПЖ, α1-адреноблокаторы применяются в урологии:
1) при оперативных вмешательствах на предстательной железе, то есть после трансуретральной резекции предстательной железы и трансуретральной микроволновой терапии;
2) нарушениях мочеиспускания после лучевого лечения рака предстательной железы;
3) хроническом простатите;
4) послеоперационной острой задержке мочеиспускания (профилактика и лечение);
5) у женщин с нарушениями мочеиспускания [16].
В соответствии с Руководством Европейской ассоциации урологов (2014) по лечению СНМП ненейрогенной этиологии у мужчин, включая доброкачественную обструкцию предстательной железы, «препаратами первого выбора для лечения СНМП являются α1-адреноблокаторы из-за их быстрого начала действия, хорошей эффективности и низкой частоты и тяжести побочных эффектов. Альфа-блокаторы назначают мужчинам при СНМП умеренной и сильной выраженности».
Рекомендации ЕАУ 2014 констатируют, что все α1-блокаторы имеют сходную эффективность в сопоставимых дозах. Вместе с тем только у тамсулозина отмечен достаточный профиль безопасности: он практически не вызывает сосудистых осложнений (характерных для теразозина, доксазозина и альфузозина) и эякуляторных расстройств (характерных для силодозина), что делает его предпочтительным средством для лечения СНМП при ДГПЖ.
1. Schwinn D.A., Roehrborn C.G. α1-Adrenoceptor subtypes and lower urinary tract symptoms // Int. J. Urol. — 2008. — V. 15, № 3. — P. 193–199.
2. Guidelines on the Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO) / Gravas S., Bachmann A., Descazeaud A. et al. // European Association of Urology. — Update April 2014.
3. Djavan B. Симптомы нижних мочевых путей: оптимальный контроль качества жизни пациента // Здоров’я України. — 2007. — № 3. — С. 48–49.
4. Симптомы нижних мочевых путей // http://krivoborodov.ru
5. Sakata K., Morita T. Investigation of ejaculatory disorder by silodosin in the treatment of prostatic hyperplasia // BMC Urology. — 2012. — doi:10.1186/1471–2490–12–29.
6. Nickel J.C., Sander S., Moon T.D. A meta-analysis of the vascular-related safety profile and efficacy of alpha-adrenergic blockers for symptoms related to benign prostatic hyperplasia // Int. J. Clin. Pract. — 2008. — V. 62, № 10. — P. 1547–1559.
7. Silodosin therapy for lower urinary tract symptoms in men with suspected benign prostatic hyperplasia: results of an international, randomized, double-blind, placebo- and active-controlled clinical trial performed in Europe / Chapple C.R., Montorsi F., Tammela T.L. et al. // Eur. Urol. — 2011. — V. 59, № 3. — P. 342–352.
8. Kawabe K., Yoshida M., Homma Y. Silodosin, a new α1A-adrenoceptorselective antagonist for treating benign prostatic hyperplasia: results of a phase III randomized, placebo-controlled, double-blind study in Japanese men // BJU Int. — 2006. — V. 98. — P. 1019–1024.
9. Effects of three types of alpha-1-adrenoceptor blocker on lower urinary tract symptoms and sexual function in males with benign prostatic hyperplasia / Yokoyama T., Hara R., Fukumoto K. et al. // Int. J. Urol. — 2011. — V. 18, № 3. — P. 225–230.
10. American Urological Association Guideline: Management of Benign Prostatic Hyperplasia (BPH) / McVary K.T., Roehrborn C.G., Avins A.L. et al. — Revised 2010.
11. Shelbaia A., Elsaied W.M. et al. Effect of selective alpha-blocker tamsulosin on erectile function in patients with lower urinary tract symptoms due to benign prostatic hyperplasia // Urology. — 2013 Jul. — 82 (1). — 130–5.
12. Гурженко Ю.Н. 61-й конгресс Немецкой ассоциации урологов // Здоровье мужчины. — 2010. — № 2. — С. 59–61.
13. Спиридоненко В.В. Особенности применения α-адреноблокаторов у неврологических пациентов с ДГПЖ // НМиФ. — 2010. — № 18 (341). — С. 3–4.
14. Novara G., Tubaro A. et al. Systematic review and meta-analysis of randomized controlled trials evaluating silodosin in the treatment of non-neurogenic male lower urinary tract symptoms suggestive of benign prostatic enlargement // World J. Urol. — 2013 Aug. — 31 (4). — 997–1008.
15. Yu H.J., Lin A.T. et al. Non-inferiority of silodosin to tamsulosin in treating patients with lower urinary tract symptoms (LUTS) associated with benign prostatic hyperplasia (BPH) // BJU Int. — 2011 Dec. — 108 (11). — 1843–8.
16. Серняк П.С. Роль Флосина (тамсулозина) в комплексном лечении симптомов нижних мочевых путей // НМиФ. — 2009. — 19 (293). — С. 3–4.

/10_m/10_m.jpg)
/11_m/11_m2.jpg)
/11_m/11_m.jpg)