Международный неврологический журнал 5 (67) 2014
Вернуться к номеру
Особенности изменений ЭЭГ у детей с фармакорезистентными формами эпилепсий
Авторы: Воронова А.В. - Республиканская детская клиническая больница, г. Симферополь; Донецкий национальный медицинский университет им. М. Горького
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Выполнен корреляционный анализ ЭЭГ у 64 детей с фармакорезистентными эпилепсиями и 26 детей курабельными формами эпилепсий. Проведена программная и визуальная оценка ЭЭГ-паттернов, а также количественная оценка неспецифических изменений биоэлектрической активности мозга, среднего интервала между эпилептическими разрядами, количества эпилептических очагов в зависимости от наличия фармакорезистентности и диагностированной эпилептической энцефалопатии.
Показано, что по данным только визуального анализа ЭЭГ невозможно различить пациентов с резистентными и курабельными формами эпилепсии. Исключение составляют только нозологические специфичные паттерны — вспышка-подавление, гипсаритмия, генерализованные комплексы острая-медленная волна, CSWS-синдром. Выявлена связь фармакорезистентности и развития эпилептической энцефалопатии с интенсивностью неспецифических изменений и количеством эпилептических очагов. Развитие эпилептической энцефалопатии коррелирует с высокой частотой пароксизмальных разрядов на ЭЭГ.
Виконано кореляційний аналіз ЕЕГ у 64 дітей із фармакорезистентними епілепсіями й 26 дітей із курабельними формами епілепсій. Проводилася програмна і візуальна оцінка ЕЕГ-патернів, кількісна оцінка неспецифічних змін біоелектричної активності мозку, середнього інтервалу між епілептичними розрядами, кількості епілептичних вогнищ залежно від наявності фармакорезистентності та діагностованої епілептичної енцефалопатії.
Показано, що за даними тільки візуального аналізу ЕЕГ неможливо розрізняти пацієнтів із резистентними й курабельними епілепсіями. Винятком є нозологічно специфічні патерни — спалах-пригнічення, гіпсаритмія, генералізовані комплекси гостра-повільна хвиля, CSWS-синдром. Виявлений зв’язок фармакорезистентності та розвитку епілептичної енцефалопатії зі ступенем неспецифічних змін і кількістю епілептичних вогнищ. Розвиток епілептичної енцефалопатії корелює з високою частотою пароксизмальних розрядів на ЕЕГ.
Comparative analysis of EEG in 64 children with drug-resistant epilepsy and in 26 children with remediable forms of epilepsy was performed. A visual assessment of EEG patterns, as well as quantitative assessment of non-specific changes in brain activity, the average interval between epileptic discharges, the number of epileptic foci were conducted depending on drug-resistant or epileptic encephalopathy being diagnosed.
It was shown that according to the only visual analysis of the EEG was shown to be not remarkable for differentiating drug-resistant and remediable forms of epilepsy. The exceptions were specific nosological patterns: burst suppression ones, hypsarrhythmia, generalized complexes sharp — slow wave. There was found a correlation between drug-resistance and epileptic encephalopathy development with non-specific changes in intensity and the epileptic foci number. Development of epileptic encephalopathy iis associated with increased frequency of paroxysmal discharges in EEG.
фармакорезистентные формы эпилепсии у детей, ЭЭГ-паттерны.
фармакорезистентні форми епілепсії в дітей, ЕЕГ-патерни.
drug-resistant forms of epilepsy in children, EEG patterns.
Статья опубликована на с. 72-76
/72/72.jpg)
Распространенность эпилепсий у детей в Автономной Республике Крым достигает 3,1 на 1000 детей [1]. До трети случаев представлены резистентными формами эпилепсии, которые приводят к формированию эпилептических энцефалопатий (ЭЭ) со значительным снижением когнитивных функций, поведенческими расстройствами [2–4]. Как благоприятное, так и злокачественное течение эпилепсии может встречаться при любых вариантах этиологии [5]. Преодоление фармакорезистентности представляет собой трудную задачу и требует понимания причин ее возникновения. Факторы, определяющие наличие фармакорезистентности, разнообразны и изучены недостаточно [6, 7]. Так как эпилепсия, по сути, является проявлением нарушения церебрального электрогенеза, то форма и степень выраженности изменений ЭЭГ могут коррелировать с течением заболевания [8–10].
Задачей исследования было изучение особенностей ЭЭГ-паттернов у детей с резистентными формами эпилепсий в сравнении с пациентами, которые имели положительный ответ на проводимую противоэпилептическую терапию.
К фармакорезистентным мы относили случаи, когда ребенок не имел должного эффекта от 2 курсов моно- или политерапии антиэпилептическими препаратами продолжительностью от 3 до 6 месяцев. Кроме того, в группу наблюдения включены пациенты, у которых устанавливался диагноз определенного фамильного эпилептического синдрома, известного своей фармакорезистентностью, например синдромов Веста, Драве, Леннокса — Гасто, Ландау — Клеффнера и т.п.
Диагноз эпилепсии устанавливался в соответствии с действующей классификацией Международной противоэпилептической лиги на основании характерных черт заболевания: вида приступов (фокальные, мультифокальные, миоклонические с падением и без, спазмы), возраста дебюта и изменений биоэлектрической активности мозга. Всем пациентам проводили тщательное обследование соматического и неврологического статуса, нейровизуализацию и запись ЭЭГ (рутинная запись бодрствования и сна или, при необходимости, ЭЭГ-мониторинг).
В исследование были включены 64 пациента с резистентными формами эпилепсии, находившиеся на лечении в неврологических отделениях КРУ ДКБ г. Симферополя (24 чел.) и ОДКБ г. Донецка (40 чел.) в 2010–2013 гг. Девочек было 28, мальчиков — 36. Возраст варьировал от 2 месяцев до 10 лет, в среднем составляя 43 ± 33 мес. Длительность заболевания на момент включения в исследование была от 3 месяцев до 6 лет.
В группу сравнения вошли 26 детей с вариабельными фокальными и генерализованными эпилепсиями, у которых на протяжении 3 лет был достигнут достаточный контроль приступов с применением антиэпилептических препаратов. Мальчиков было 14, девочек — 12. Возраст — от 3 мес. до 10 лет.
По полу и возрасту группы детей с резистентными и курабельными формами эпилепсии были значимо идентичными. Всем больным обеих групп было проведено тщательное соматическое обследование, ЭКГ, ЭхоЭКГ, ЭЭГ, МРТ, консультация генетика и окулиста.
Нозологический состав сравниваемых групп представлен в табл. 1.
По этиологическому фактору эпилепсии у детей с фармакорезистентностью распределились следующим образом: идиопатические — 19 чел. (29,7 %); криптогенные — 17 (26,6 %); симптоматические — 28 чел. (43,8 %). Случаи с уточненной этиологией были представлены церебральными мальформациями — 12 детей (42,9 %), перинатальным поражением головного мозга — 7 (25,0 %); туберозным склерозом — 5 (17,9 %), герпетическим энцефалитом — 2 (7,1 %), энцефалитом неуточненной этиологии — 1 (3,6 %) и спонтанным кровоизлиянием в мозг — 1 ребенок (3,6 %).
В группе сравнения у 4 детей (15,4 %) диагностированы варианты идиопатической генерализованной эпилепсии, у 10 детей (38,5 %) — идиопатические фокальные эпилепсии, у 9 (34,6 %) — криптогенные фокальные эпилепсии и у 3 детей (11,5 %) с фокальными приступами нейровизуализация выявила церебральные мальформации (фокальная корковая дисплазия, микрогирия, полимикрогирия, агенезия мозолистого тела).
Симптомы эпилептической энцефалопатии (задержка или регресс развития, поведенческие и речевые нарушения) были выявлены у 42 детей основной группы (65,6 %) и у 10 детей группы сравнения (38,5 %); у 2 детей диагностирован эпилептиформный регрессивный аутикоподобный синдром. Разница в частоте встречаемости эпилептической энцефалопатии была достоверной (р < 0,01).
Для каждого ребенка индивидуально рассчитывалась средняя частота приступов в месяц (СЧП) на основании данных анамнеза за предыдущие 2 месяца до включения в исследование. У детей с кластерными приступами каждый кластер расценивался как один приступ. В целом у детей с резистентными формами эпилепсий СЧП колебалась от 2 до 210,5 в месяц, в среднем 46,1 ± 49,5 приступа в месяц. У детей группы сравнения СЧП варьировала от 1,5 до 76,0 в месяц, в среднем 10,8 ± 15,0 приступа в месяц. Так как в группе сравнения не было детей с синдромами Веста, Отохара, Драве, Дузе, мы отдельно сравнили СЧП у детей с фокальными эпилепсиями. В основной группе у детей с фокальными эпилепсиями СЧП составила 20,3 ± 35,7 приступа в месяц, в группе сравнения — 7,8 ± 7,3 приступа в месяц (р = 0,056). СЧП у детей с ЭЭ была выше как в группе с резистентными, так и в группе с контролируемыми приступами. У детей с фармакорезистентностью и ЭЭ показатель СЧП составил 59,2 ± 53,7 приступа в месяц, тогда как в отсутствие ЭЭ — 21,3 ± 26,1 приступа в месяц (р = 0,0004). У детей с курабельными эпилепсиями показатель СЧП значимо не отличался в зависимости от наличия или отсутствия симптомов энцефалопатии.
Электроэнцефалография была неоднократно выполнена всем пациентам. Исследования проводились на программно-аппаратных комплексах DXNT-32 Professional и Tredex Expert 16 (Украина). Использовалась запись с наложением электродов в соответствии со схемой «10–20». Схема обследования включала в себя запись в состоянии бодрствования (открытые и закрытые глаза, фотостимуляция, гипервентиляция) и в состоянии сна.
Проводился визуальный анализ ЭЭГ, и для статистического анализа использовались следующие параметры биоэлектрической активности мозга (БЭА): средний интервал между разрядами (СИР), количество эпилептических очагов (КЭО) у больных с фокальными эпилепсиями, выраженность неспецифических изменений (НИ) БЭА. Оценка количества эпилептических очагов была возможна только среди детей с фокальными формами эпилепсии.
Для анализа выраженности неспецифических изменений биоэлектрической активности мозга нами была применена 4-балльная шкала оценки, аналогичная шкале выраженности парезов или спастичности.
0 баллов — отсутствие неспецифических изменений БЭА.
1 балл — незначительные неспецифические изменения БЭА.
2 балла — умеренные неспецифические изменения БЭА.
3 балла — выраженные неспецифические изменения БЭА.
Как незначительные НИ расценивались увеличение доли медленных волн по сравнению с привычной нормой при сохранении базового ритма или его постоянное или преходящее замедление до верхних границ тета-диапазона.
Умеренные НИ БЭА представлены сочетанным увеличением доли медленных волн и замедлением базового ритма либо преобладанием патологической активности над физиологическими ритмами.
Выраженные НИ мы трактовали как замещение физиологических ритмов патологической медленной или быстрой активностью постоянного или преходящего характера, включая общее угнетение активности мозга.
Средний интервал между разрядами исчислялся во время бодрствования для эпохи анализа 5 минут. У детей с генерализованными формами эпилепсий учитывался интервал между разрядами, отделенными фоновой активностью, без учета общей длительности разряда. У детей с фокальными формами эпилепсии в разрядах со множественными пиками каждый пик учитывался отдельно, если он был отделен от последующего хотя бы одной медленной волной. Разряды множественных пиков учитывались как один разряд.
Согласно данным визуального анализа ЭЭГ были выделены несколько вариантов ЭЭГ-паттернов: нормальная БЭА, неспецифические диффузные изменения БЭА, первично генерализованные комплексы пик-волна или полипик-волна, фокальные эпилептические разряды, множественные независимые очаги пиков, гипсаритмия, паттерн вспышка-угнетение.
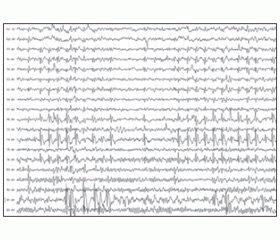
В группе резистентных эпилепсий мы не зарегистрировали ни одной нормальной ЭЭГ. У всех 14 детей с синдромом Веста имела место гипсаритмия, и только в 3 случаях она была типичной (рис. 1).
В остальных случаях гипсаритмия была атипичной: у 5 детей имелись отчетливые очаговые разряды; у 2 детей доминировала медленная активность; у 3 детей имела место тенденция к синхронизации (рис. 2), и в 1 случае имела место регионарная гипсаритмия (рис. 3). У детей с синдромом Отахара был зарегистрирован паттерн вспышка-подавление, который в дальнейшем трансформировался в мультифокальные пики. Пациенты с синдромом Леннокса — Гасто демонстрировали характерный для этого состояния ЭЭГ-паттерн в виде комплексов острая-медленная волна с максимальной выраженностью над лобными отделами (рис. 4). У детей с синдромами Дузе и Драве имели место вариабельные разряды генерализованных комплексов пик-волна и/или полипик-волна в сочетании с неспецифическими изменениями и в части случаев — с фокальными эпилептическими разрядами. У детей с фокальными формами эпилепсий в основной группе регистрировались моно- и мультифокальные разряды в сочетании с неспецифическими изменениями различной степени выраженности (рис. 5).
У детей группы сравнения с точки зрения визуального анализа ЭЭГ регистрировались различные варианты генерализованных, фокальных и мультифокальных разрядов, мало отличающиеся от таковых при резистентных формах эпилепсий (рис. 7). У 2 больных этой группы была зарегистрирована нормальная БЭА мозга в интериктальном периоде.
Виды ЭЭГ представлены на рис. 1–7.
/76/76.jpg)
Анализ количественных данных ЭЭГ продемонстрировал определенные отличия биоэлектрической активности у детей с резистентными и курабельными формами эпилепсий. Оценка неспецифических изменений БЭА показала, что НИ достоверно чаще встречаются у детей с резистентными эпилепсиями, чем у детей с курабельными формами эпилепсий — 76,6 и 50,0 % соответственно (р < 0,05). Также и степень выраженности НИ была большей в основной группе, чем в группе сравнения. У детей с резистентными эпилепсиями средняя балльная оценка НИ составила 1,6 ± 1,2 балла, а у детей с курабельными эпилепсиями — 0,7 ± 0,8 балла (р = 0,0002). Наличие и степень выраженности НИ коррелировали с наличием эпилептической энцефалопатии. В группе резистентных эпилепсий НИ встречались достоверно чаще у детей с ЭЭ, чем у детей без нее — 88,1 и 54,5 % соответственно (р < 0,01). У детей с контролируемыми приступами НИ также встречались достоверно чаще при наличии ЭЭ, чем без нее — 90,0 против 33,3 % (р < 0,01). У детей основной группы при наличии энцефалопатии средний показатель НИ составил 2,3 ± 0,9 балла, тогда как у детей без энцефалопатии — 1,3 ± 0,5 балла (р < 0,001). Эта же тенденция показателя НИ имела место и в группе сравнения — 1,6 ± 0,5 балла и 1,3 ± 2,0 балла соответственно (р = 0,355).
Количество эпилептических очагов у детей с резистентными фокальными эпилепсиями варьировало от 1 до 5, в среднем составляя 2,5 ± 0,9. У детей с курабельными фокальными эпилепсиями показатель КЭО колебался от 1 до 3, в среднем — 2,0 ± 0,7. Разница среднего показателя КЭО была статистически достоверной (р = 0,027). Кроме того, и в основной группе, и в группе сравнения КЭО было выше у детей с эпилептической энцефалопатией, чем у детей без нее, но различия не достигали степени статистической достоверности (р > 0,05).
Показатель СИР у детей обеих групп был почти одинаковым и составил 7,0 ± 6,7 секунды у детей с фармакорезистентными эпилепсиями и 7,8 ± 6,5 секунды у детей с контролем приступов (р = 0,655). Однако в основной группе СИР колебался в зависимости от наличия ЭЭ. Так, у детей с ЭЭ СИР составил 4,4 ± 2,9 секунды, а у детей без ЭЭ — 9,4 ± 8,2 секунды (р = 0,027). При курабельных формах эпилепсий связи между наличием ЭЭ и СИР не было.
У 15 пациентов (42,9 %) из 35 детей с резистентными фокальными эпилепсиями зарегистрирован электрический эпилептический статус сна (ЭЭСС) (рис. 6). В группе детей с курабельными фокальными эпилепсиями электрический эпилептический статус сна был выявлен у 5 (22,7 %) из 22 пациентов. Однако разница в частоте выявления ЭЭСС между основной группой и группой сравнения не достигала степени достоверной (р > 0,05).
Полученные данные позволяют утверждать, что фармакорезистентные и курабельные формы эпилепсий недостоверно отличаются друг от друга с позиций визуального анализа ЭЭГ. Формальное описание ЭЭГ пациента с резистентной эпилепсией и пациента с достигнутой ремиссией может быть идентичным. Исключением являются особые фамильные разрушительные формы эпилепсий (синдромы Веста, Отохара, Леннокса — Гасто), которые демонстрируют нозологически специфические изменения БЭА — паттерн вспышка-подавление, гипсаритмию, комплексы острая-медленная волна и др. Регистрация таких паттернов с высокой вероятностью говорит о возможных вариантах приступов и неблагоприятном течении заболевания. Эти же синдромы имеют достаточно определенные клинические границы. При фокальных эпилепсиях вне зависимости от этиологии и ответа на антиконвульсанты визуальный анализ собственно эпилептических феноменов ЭЭГ не позволяет достоверно утверждать, к какой из групп эпилепсий может принадлежать данный пациент.
Большую специфичность в отношении фармакорезистентности демонстрируют неспецифические изменения БЭА: чем больше степень этих изменений, тем более вероятно, что у данного пациента не будет положительного ответа на антиконвульсантную терапию. Также более вероятным становится и развитие эпилептической энцефалопатии при грубых НИ.
Среднее количество эпилептических очагов на ЭЭГ у пациентов с резистентными эпилепсиями значимо больше, чем у пациентов с курабельными эпилепсиями. Четкой связи между количеством эпилептических очагов и наличием эпилептической энцефалопатии у наших пациентов мы не обнаружили.
Частота появления разрядов на ЭЭГ и частота выявления феномена ЭЭСС значимо не отличалась у резистентных и курабельных больных в нашем исследовании. Однако у детей с фармакорезистентностью высокая плотность разрядов на ЭЭГ была ассоциирована с эпилептической энцефалопатией.
Таким образом, мы можем констатировать, что электрографическими биомаркерами фармакорезистентности могут служить неспецифические изменения БЭА, количество эпилептических очагов и частота разрядов, которые отражают объем и степень расстройств кортикального электрогенеза при эпилепсии. Однако специфичность этих показателей ЭЭГ остается недостаточной для уверенного прогнозирования течения эпилепсии и подбора терапии. Это подтверждается данными о том, что эпилептический процесс не ограничивается только нарушением электрической стабильности групп нейронов, а имеет и другие, не связанные с электрогенезом аспекты, которые требуют дальнейшего изучения и исследования, разработки новых подходов к курации больных с разрушительными формами эпилепсии.
Автор благодарит доц. Омельяненко А.А., руководителя электроэнцефалографической лаборатории при областном противоэпилептическом центре на базе ОДКБ (г. Донецк), за постоянную помощь в трактовке полученных при обcледовании пациентов данных.
1. Бунчук М.М., Номеровская А.А., Воронова А.В. Динамика заболеваемости эпилепсией и эпилептическими синдромами у младенцев и детей в АРК за 5 лет (2007–2011 гг.) // Международный неврологический журнал. — 2012. — № 6 (52). — С. 27–30.
2. Евтушенко С.К., Омельяненко А.А. Клиническая электроэнцефалография у детей. — Донецк, 2005. — 880 с.
3. Евтушенко С.К., Омельяненко А.А., Шестова Е.П., Морозова Т.М. Прогрессирующие формы эпилептических энцефалопатий у младенцев и детей (трудности диагностики и терапии) // Український вісник психоневрологiї. — 2013. — Т. 21, № 3 (76). — С. 123–127.
4. Мухин К.Ю., Петрухин А.С., Холин А.А. Эпилептические энцефалопатии и схожие синдромы у детей. — М.: АртСервис Лтд, 2011. — 680 с.
5. Filippini M., Boni A., Giannotta M., Gobbi G. Neuropsychological development in children belonging to BECTS spectrum: long-term effect of epileptiform activity // Epilepsy Behav. — 2013. — V. 28 (3). — P. 504–511.
6. Holmes G. EEG abnormalities as a biomarker for cognitive comorbidities in pharmacoresistant epilepsy // Epilepsia. — 2013. — V. 54 (Suppl. 2). — P. 60–62.
7. Lado F., Rubboli G., Capovilla P., Avanzini G., Moshй S. Pathophysiology of epileptic encephalopathies // Epilepsia. — 2013. — V. 54 (Suppl. 8). — P. 6–13.
8. Noachtar S., Remi J. The role of EEG in epilepsy: A critical review // Epilepsy & Behavior. — 2009. — V. 15. — P. 22–33.
9. Pitkдnen A., Lukasiuk K. Mechanisms of epileptogenesis and potential treatment targets // Lancet Neurol. — 2011. — V. 10. — P. 173–186.
10. Steinhoff B., Scholly J., Dentel C., Staack A. Is routine electroencephalography (EEG) a useful biomarker for pharmacoresistant epilepsy? // Epilepsia. — 2013. — V. 54 (Suppl. 2). — P. 63–66

/73/73.jpg)
/75/75.jpg)
/75/75_2.jpg)