Международный неврологический журнал 6 (68) 2014
Вернуться к номеру
Оптимізація лікувальної тактики у пацієнтів з інсомнією на тлі початкових проявів недостатності мозкового кровообігу
Авторы: Тріщинська М.А. - Національна медична академія післядипломної освіти імені П.Л. Шупика,
кафедра неврології № 1, м. Київ
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Цереброваскулярна патологія є однією з основних причин смертності та основною причиною інвалідизації населення в усьому світі. Особливо актуальним питанням є пошук нових мішеней для патогенетичного лікування початкових стадій цереброваскулярних захворювань. Одним із ранніх симптомів цереброваскулярних захворювань (початкових проявів недостатності мозкового кровообігу) є розлади сну (інсомнія), що тісно пов’язані з порушенням функції автономної нервової системи. Відновлення сну та його характеристик має важливе значення не тільки для загального самопочуття пацієнтів, але й для реалізації адаптаційних та компенсаторних можливостей головного мозку в умовах впливу судинних факторів ризику. Нами було проведене дослідження, присвячене оцінці впливу цілеспрямованого відновлення якості сну на стан пацієнтів із початковими проявами недостатності мозкового кровообігу.
Метою дослідження була оцінка клінічної ефективності, переносимості та безпечності тразодону (50 мг на ніч) у пацієнтів із початковими проявами недостатності мозкового кровообігу на тлі традиційного лікування.
Матеріал та методи. У дослідженні взяли участь 45 пацієнтів із початковими проявами недостатності мозкового кровообігу та інсомнією. Основну групу становили 34 хворі віком від 30 до 58 років, серед яких було 26 жінок та 8 чоловіків (з артеріальною гіпертензією 1–2-го ступеня І стадії, дисліпідемією, нестенозуючим атеросклерозом церебральних судин). Групу контролю становили 11 пацієнтів (7 жінок і 4 чоловіки), середній вік яких був 47,7 ± 6,7 року. Всім хворим проводили загальноклінічне, клініко-неврологічне, клініко-психологічне та клініко-інструментальне обстеження. Пацієнти основної групи отримували додатково до стандартної терапії 50 мг тразодону на ніч протягом спостереження (4 тижні) на відміну від пацієнтів контрольної групи, які отримували лише стандартну терапію.
Результати та їх обговорення. В основній групі самопочуття пацієнтів статистично значимо покращилося порівняно з попереднім станом. Хворі відмічали зменшення інтенсивності або зникнення таких скарг, як головний біль, запаморочення, схвильованість, ком у горлі, відчуття серцебиття, покращилися здатність до концентрації уваги та якість сну. В контрольній групі стан пацієнтів мав тенденцію до поліпшення, але менш динамічно. В основній групі протягом 4 тижнів статистично значимо зменшилися прояви вегетативної дисфункції (з 35,35 ± 9,75 бала до 30,22 ± 11,1 бала за опитувальником для виявлення ознак вегетативних порушень) та реактивної тривожності (з 41,82 ± 11,02 бала до 36,62 ± 10,5 бала за шкалою Спілбергера). В контрольній групі показники мали тенденцію до позитивної динаміки.
Висновки. З метою більш суттєвого та безпечного впливу на симптоми початкових проявів недостатності мозкового кровообігу, зокрема проявів інсомнії, в схему лікування доцільно включати тразадон (Триттіко) у дозах, близьких до 50 мг, на ніч.
Цереброваскулярная патология является одной из основных причин смертности и основной причиной инвалидизации населения во всем мире. Особенно актуальным вопросом является поиск новых мишеней для патогенетического влияния на начальных стадиях цереброваскулярных заболеваний. Одним из ранних проявлений цереброваскулярных заболеваний (начальных проявлений недостаточности мозгового кровообращения) являются расстройства сна (инсомния), которые тесно связаны с нарушениями функции автономной нервной системы. Восстановление сна и его характеристик имеет важное значение не только для общего самочувствия пациентов, но и для реализации адаптационных и компенсаторных механизмов головного мозга в условиях влияния сосудистых факторов риска. Нами было проведено исследование, посвященное оценке влияния целенаправленного восстановления качества сна на состояние пациентов с начальными проявлениями недостаточности мозгового кровообращения.
Целью исследования была оценка клинической эффективности, переносимости и безопасности тразодона (50 мг на ночь) у пациентов с начальными проявлениями недостаточности мозгового кровообращения на фоне традиционного лечения.
Материал и методы. В исследовании приняли участие 45 пациентов с начальными проявлениями недостаточности мозгового кровообращения и инсомнией. Основную группу составили 34 больных в возрасте от 30 до 58 лет, среди которых было 26 женщин и 8 мужчин (с артериальной гипертензией 1–2-й степени, I стадии, дислипидемией, нестенозирующим атеросклерозом церебральных сосудов). Группу контроля составили 11 пациентов (7 женщин и 4 мужчины), средний возраст которых был 47,7 ± 6,7 года. Всем пациентам проводилось общеклиническое, клинико-неврологическое, клинико-психологическое и клинико-инструментальное обследование. Пациенты основной группы получали дополнительно к стандартной терапии 50 мг тразодона на ночь в течение периода наблюдения (4 недели) в отличие от пациентов контрольной группы, которые получали только стандартную терапию.
Результаты и их обсуждение. В основной группе самочувствие пациентов статистически значимо улучшилось в сравнении с предыдущим состоянием. Больные отмечали уменьшение интенсивности или исчезновение таких жалоб, как головная боль, головокружение, взволнованность, ком в горле, учащенное сердцебиение, улучшились способность к концентрации внимания и качество сна. В контрольной группе состояние пациентов имело тенденцию к улучшению, но менее динамично. В основной группе в течение 4 недель достоверно уменьшились проявления вегетативной дисфункции (с 35,35 ± 9,75 балла до 30,22 ± 11,10 балла по опроснику для выявления признаков вегетативных нарушений) и реактивной тревожности (с 41,82 ± 11,02 балла до 36,62 ± 10,50 балла по шкале Спилбергера). В контрольной группе показатели имели тенденцию к позитивной динамике.
Выводы. С целью более существенного и безопасного влияния на симптомы начальных проявлений недостаточности мозгового кровообращения, в частности явлений инсомнии, в схему лечения целесообразно включать тразодон (Триттико) в дозах, близких к 50 мг, на ночь.
Cerebrovascular pathology is one of the main causes of mortality and a major cause of disability of the population worldwide. The search of new targets for pathogenetic treatment on the initial stages of cerebrovascular diseases is particularly topical. One of the early symptoms of cerebrovascular diseases (the initial manifestations of cerebrovascular insufficiency) are sleep disorders (insomnia), closely associated with dysfunctions of the autonomic nervous system. Restoration of sleep and its characteristics is important not only for the general well-being of the patient, but also for the implementation of adaptive and compensatory mechanisms of the central nervous system under the influence of vascular risk factors. We have carried out a study on assessing the impact of task-oriented sleep recovery on the state of patients with initial manifestations of cerebrovascular insufficiency.
The aim of the study was to evaluate the clinical efficacy, tolerability and safety of trazodone (50 mg nocte) in patients with early manifestations of cerebrovascular insufficiency on the background of traditional treatment.
Material and Methods. The study involved 45 patients with initial manifestations of cerebrovascular insufficiency and insomnia. A study group comprised 34 patients aged 30 to 58 years, among whom were 26 women and 8 men (with hypertension of degree 1–2, I stage, dyslipidemia, nonstenotic atherosclerosis of cerebral vessels). The control group consisted of 11 patients (7 women and 4 men), average age 47.7 ± 6.7 years. All patients underwent general clinical, clinical neurological, clinical psychological, clinical and instrumental examination. Patients of the study group received 50 mg of trazodone nocte during the observation period (4 weeks) in addition to the standard therapy in contrast to patients in the control group who received only standard therapy.
Results and Discussion. In the study group patients’ well-being significantly improved compared to the previous state. Patients reported a decrease in severity or disappearance of such complaints as headache, dizziness, anxiety, and «lump» in the throat, palpitation; ability to concentrate and sleep quality improved. In the control group, the condition of patients tended to improve, but less rapidly. In the study group manifestations of autonomic dysfunction (from 35.35 ± 9.75 to 30.22 ± 11.10 points by questionnaire for detecting signs of autonomic disorders) and reactive anxiety (from 41.82 ± 11.02 to 36.62 ± 10.50 points by Spielberger scale) significantly decreased for 4 weeks. In the control group, dynamics of indicators had a trend to be positive.
Conclusions. For a more substantial and safe impact on the symptoms of initial manifestations of cerebrovascular insufficiency, and insomnia signs in particular, it’s appropriate to include trazodone (Trittico) in a doses close to 50 mg nocte in the treatment regimen.
початкові прояви недостатності мозкового кровообігу, інсомнія, тразодон.
начальные проявления недостаточности мозгового кровообращения, инсомния, тразодон.
initial manifestations of cerebrovascular insufficiency, insomnia, trazodone.
Статья опубликована на с. 29-37
Цереброваскулярна патологія є однією з основних причин смертності та інвалідизації населення у всьому світі. Враховуючи той факт, що клінічно і соціально значимі прояви зазначеної патології (інсульт і/або деменція) припадають на другу половину життя, хоча останніми роками частішають випадки інсульту у молодому віці, логічно припустити, що ураження церебральних судин починається в більш молодому віці. У 60–70-х роках минулого століття, коли створювалася класифікація судинних захворювань головного та спинного мозку, було запропоновано спри–ймати вегетативнії (вегетосудинні) дистонії, що, як відомо, переважно зустрічаються у молодому віці, як вірогідний предиктор розвитку цереброваскулярної патології у майбутньому. Слід зазначити, що ряд симптомів, що в молодому віці свідчать про дисфункцію автономної нервової системи (АНС) як прояв вегетосудинної дистонії, у середньому і похилому віці входять до симптомокомплексу, який свідчить про вогнищеве ураження ЦНС на тлі судинної патології. Зважаючи на таку стійкість симптомів дисфункції АНС, можна говорити про стадійність процесу — функціональну та органічну стадії [8, 9].
Вегетативна (вегетосудинна) дисфункція, або дистонія (ВСД), перш за все діагностична категорія, а не нозологічна одиниця, зазвичай вторинна відносно психічних або соматичних захворювань. Виявлення ознак ВСД, що проявляється полісистемними вегетативними порушеннями, перш за все повинно сприяти пошуку причини зазначеного стану: психогенні захворювання (психофізіологічні реакції на стрес, порушення адаптації, психосоматичні захворювання, посттравматичне стресорне порушення, тривожно-депресивні розлади); органічне ураження ЦНС, соматичні захворювання, періоди фізіологічної перебудови гормонального статусу в організмі тощо [2].
Клінічна картина ВСД складається з соматичних скарг, що спонукають до ретельного обстеження органа чи системи, з боку якої ці скарги найбільш виражені, з метою виключення органічної або невідкладної соматичної патології та симптомів психічного дискомфорту (відчуття неспокою, стурбованості, пригніченості, роздратованості, плаксивості), що можуть розцінюватися пацієнтами як реакція на соматичний стан. Тому для встановлення діагнозу перш за все слід виключити органну патологію, а саме функціональну (судинні фактори ризику, субклінічне ураження головного мозку, початкові прояви недостатності мозкового кровообігу) [2, 3].
Клінічні прояви вегетативної дисфункції мають зазвичай полісистемний характер, але часто є так звані провідні скарги, що визначають вразливі, найменш здатні до адаптації органи чи системи. Частіше за все спостерігаються ознаки активації симпатичного відділу АНС, що імітують ураження серцево-судинної системи: тахікардія, екстрасистолія, неприємні відчуття у грудях, кардіалгії, артеріальна гіпер- або гіпотензія, дистальний акроціаноз, напади жару або холоду. Прояви вегетативної дисфункції з боку дихальної системи часто є вирішальними у зверненні до лікаря: утруднене дихання, ком у горлі, гіпервентиляційний синдром (відчуття нестачі повітря, задишка, відчуття задухи, відчуття втрати автоматизму дихання, сухість у роті, аєрофагія та інші) та гіпервентиляційні еквіваленти (кашель, позіхання, зітхання). Дихальні розлади часто супроводжуються іншими патологічними симптомами, такими як м’язово-тонічні чи моторні розлади (болісне напруження м’язів, м’язові спазми, судомні м’язово-тонічні феномени); парестезії у кінцівках (відчуття оніміння, поколювання, «повзання мурах», свербіння, печіння) і/або носогубного трикутника; феномени порушення свідомості (запаморочення, відчуття «порожньої» голови, головокружіння, нечіткість зору, туман перед очима, дзвін у вухах). Потребують особливої уваги та ретельної диференціальної діагностики вегетативні розлади з боку шлунково-кишкового тракту (нудота, блювота, відрижка, метеоризм, урчання, запори, проноси, біль у животі) [2, 3].
Вегетативні розлади часто превалюють над психічними симптомами, тип та ступінь вираженості яких варіюють, але виявлення цих психопатологічних симптомів (тривога, депресія, змішанні тривожно–депресивні розлади, фобії, істерія, іпохондрія) має велике значення для адекватної терапії. Найбільш поширеним психопатологічним симптомом, що асоціюється з вегетативною дисфункцією, є тривога [2].
Тривожні патологічні стани характеризуються загальними тривожними симптомами та специфічними проявами. Вегетативні симптоми (головокружіння, тахікардія, епігастральний дискомфорт, сухість в роті, пітливість тощо) є неспецифічними та спостерігаються при будь-якій тривозі. Крім того, до неспецифічних симптомів тривоги відносяться погані передчуття (стурбованість щодо майбутнього, передчуття неприємностей, труднощі при концентруванні уваги), моторне напруження (рухове збудження, метушливість, неможливість розслабитися, головні болі напруження, тремтіння). Зміст тривожних думок зазвичай стосується власного здоров’я або здоров’я близьких. Підвищення уваги до свого здоров’я поступово формує іпохондричний стиль життя [10].
Специфічні ознаки тривоги, які стосуються типу її формування та перебігу, визначають характер тривожного розладу. Тривожні розлади відрізняються факторами, що їх викликають, та швидкістю і послідовністю виникнення симптомів. Серед найбільш поширених форм тривожних розладів виділяють генералізовані тривожні розлади, панічні атаки та розлади адаптації [3].
Вегетативні розлади часто супроводжуються порушеннями сну, а саме труднощами при засинанні, неглибоким сном, частими нічними пробудженнями, астенічним симптомокомплексом, роздратованістю відносно звичайних життєвих ситуацій, нейроендокринними порушеннями, пов’язаними з недосипанням [2, 3].
Вважається, що основною функцією сну, а саме повільної фази, є відновлення сил організму, в тому числі це стосується відновлення гомеостазу мозкової тканини. На користь цього свідчить те, що саме на цей період припадає пік секреції соматотропного гормону, відновлюється кількість клітинних білків, рибонуклеїнових кислот та фосфорорганічних зв’язків. Останні дані свідчать, що у фазу повільного сну продовжується переробка інформації мозком, але тієї її частини, яка заснована на інтероцептивній імпульсації. Іншими словами, відбувається оптимізація управління внутрішніми органами [6]. Вважається, що у фазу швидкого сну відбувається переробка інформації і утворення програми дії та поведінки на майбутнє. У цю фазу клітини мозку надзвичайно активні, але результат цієї активності до м’язів не доходить. Ймовірно, проводиться обробка інформації, отриманої під час неспання, та зберігається у пам’яті [3]. Слід зазначити, що функції сну реалізуються на адекватному рівні не тільки за рахунок його загальної тривалості, але й завдяки збалансованості різних його циклів (фаз).
Іншими словами, сон є надзвичайно важливою складовою частиною функціонування ЦНС — як для підтримання хімічного гомеостазу, так і для збалансованості процесів гальмування та активності у головному мозку. Cон є активним процесом, під час якого підтримується висока активність нейронів, незважаючи на те, що вони мають інший просторовий характер порівняно із фазою неспання. Щодо функції АНС під час сну можна виділити декілька аспектів: 1) вегетативне забезпечення діяльності мозку під час сну; 2) активність вегетативних рефлексогенних зон під час сну; 3) динаміка вегетативних показників за стадіями та фазами сну. Так, під час більшої частини сну (ІІ ст. фази повільного сну, дельта-сон, тонічний швидкий сон) активність симпатичного відділу АНС знижена, а тонус парасимпатичного відділу АНС підвищений. У фазі швидкого сну тонус симпатичного відділу АНС підвищується, а тонус парасимпатичного відділу є варіабельним [3]. Порушення сну негативно впливає на функцію ЦНС, тому корекція цього стану має надзвичайно важливе значення для ефективності патогенетичного та симптоматичного лікування цереброваскулярної патології як на функціональній, так і на органічній стадії розвитку процесу.
Порушення сну (інсомнія) — стан, що визначається (DSM-IV) як дефіцит якості і кількості сну, які необхідні для нормальної життєдіяльності. В МКХ-10 інсомнія — це первинний психогенний стан з емоційно обумовленим порушенням кількості, тривалості і ритму сну. Розрізняють декілька видів порушення сну [7]. Пресомнічні порушення — труднощі на початку сну, тобто процес засинання триває не 3–10 хвилин, як у здорової людини, — при патології цей період може тривати до 2 годин; інтрасомнічні розлади проявляються переважно поверхневим сном, частими нічними пробудженнями та поганим засинанням після них. Післясомнічні порушення — складне пробудження, яке не приносить відчуття бадьорості, виникнення відчуття розбитості, сонливості. Діагноз інсомнії встановлюється при наявності 3 і більше постійних (більше місяця) або періодичних (протягом 3 і більше місяців) наступних ознак: 1) засинання триває більше 30 хв; 2) сон бентежить хворого (всю ніч в голову лізуть думки); 3) страх перед неможливістю заснути; 4) часті пробудження протягом ночі; 5) ранні пробудження з неможливістю потім заснути; 6) знижений настрій; 7) немотивовані страх, тривога [1].
У фізіологічних випадках інсомнія може виникати внаслідок зміни часового поясу, зміни режиму роботи (нічні зміни з вживанням тонізуючих напоїв, таких як чай, кава тощо), пізнього засинання (насамперед стосується молодих людей, які віддають перевагу нічним дискотекам, комп’ютерним іграм, телевізору тощо) і, навпаки, раннього сну із занадто раннім пробудженням, сильних психоемоційних відчуттів. Слід зазначити, що передчасне засинання може бути проявом цереброваскулярної патології з супутнім астенодепресивним синдромом [20].
Існує дуже тісний зв’язок між АНС та функцією сну — анатомічно, фізіологічно та нейробіохімічно обумовлений. Багато робіт виявили в активності АНС зміни, які асоціювалися з порушеннями сну, що переважно відображалося на функціонуванні серцево-судинної системи. Порушення функціонування АНС при розладах сну може виражатися широким різноманіттям симптомів та синдромів, що може створити серйозні діагностичні труднощі внаслідок схожості при різних захворюваннях. Найбільш поширеними порушеннями функціонування АНС в осіб з розладами сну, що проявляються з боку різних органів та систем, є: ортостатична гіпотензія, гіпер-, ангідроз, запор, діарея, імпотенція, ніктурія, часте сечовипускання, нетримання, затримка сечі, анізокорія, синдром Горнера, інспіраторна задишка, епізоди апное, стридор [13].
Сон — це найбільш значиме джерело коливань артеріального тиску (АТ). Під час сну у здорових осіб АТ знижується на 10–20 % порівняно з періодом неспання. У жінок під час сну АТ знижується більш виражено, ніж у чоловіків. Окрім глибокого нічного зниження АТ протягом доби спостерігається менш значиме фізіологічне зниження АТ приблизно о 9-й та о 19-й годинах і зовсім незначне — о 15-й годині. Слід зауважити, що під час сну спостерігається зниження частоти серцевих скорочень, але підвищується варіабельність (особливо у фазі швидкого сну). При розладах сну ці періоди фізіологічного зниження тиску та частоти серцевих скорочень відсутні або змінені, що негативно позначається на стані серцево-судинної системи [3]. Так, у дослідженні PIUMA було показано, що зменшення ступеня нічного зниження систолічного АТ є незалежним предиктором підвищення серцево-судинної захворюваності при будь-якому рівні супутніх факторів ризику. Особливо це стосується жінок-нондиперів з артеріальною гіпертензією. Отримані докази зв’язку між зменшенням ступеня нічного зниження АТ та цереброваскулярною захворюваністю. Частота мозкових і серцевих ускладнень та ступінь ураження органів-мішеней найвищі серед нондиперів та осіб із значним зниженням АТ під час сну — овердиперів. Вважається, що це обумовлено розвитком гіпоперфузії органів і тканин, а саме ішемії головного мозку, серця, нирок, та розвитком їх функціональної недостатності [3, 11].
Вивчення хронобіологічних аспектів мозкових інсультів показало, що від 18 до 61 % випадків інсульту розвивалися у ранкові години після сну. Доведено, що саме в цей час підвищуються АТ, ЧСС, рівень норадреналіну і реніну у крові, агрегаційні властивості тромбоцитів. Нічні інсульти, за даними літератури, спостерігаються у 12–44 % хворих і пов’язуються із зниженням АТ, ЧСС, змінами реологічних властивостей крові, що сприяє погіршенню кровопостачання мозку. Є дані, які свідчать про те, що ранкові та нічні інсульти виникають не тільки внаслідок тромбоутворення чи тромбоемболії з поверхні атеросклеротичних бляшок під час різкого підйому АТ, але й в результаті порушення авторегуляторних механізмів кровопостачання на тлі багатогодинного обмеження доступу аферентних імпульсів. Ця думка сприяє розумінню особливостей нічного сну у людей похилого віку (часті пробудження, скорочення тривалості глибокого сну, раннє пробудження) та адаптивного характеру таких змін [3, 19].
За даними О.С. Кадикова і співавт. (2006), серед хворих із ранніми формами цереброваскулярної патології найчастіше спостерігаються поверхневий сон, труднощі при засинанні, нічні пробудження (що також можуть бути пов’язані з частим сечовипусканням). Найчастіше порушення сну спостерігаються у хворих із цереброваскулярною патологією та депресією, тривожністю, синдромом апное уві сні та порушеннями сечовипускання [4].
Дослідники Університету Warwickу (Велика Британія) проаналізували дані 3968 чоловіків та 4821 жінки, які взяли участь у дослідженні ELSA, та виявили зв’язок між якістю і тривалістю сну та функцією мозку, що змінюється з віком. Серед учасників віком від 50 до 64 років із коротким (менше ніж 6 годин вночі) та занадто довгим (більше ніж 8 годин) сном спостерігалися більш низькі бали за шкалами оцінки функції мозку. У досліджуваних більш старшого віку (68–89 років) на функцію мозку впливала лише надмірна тривалість сну [21].
Отже вважається, що для оптимальної функції головного мозку в осіб молодого віку сон повинен тривати від 6 до 8 годин. Крім того, така тривалість сну виявилася оптимальною для загального стану здоров’я, включаючи зниження ризику розвитку ожиріння, артеріальної гіпертензії, цукрового діабету, серцевих захворювань та інсульту. Слід зазначити, що у дослідних віком до 65 років якість сну не впливала на функцію мозку на відміну від осіб, старших за 65 років, у яких була виявлена вірогідна кореляція між зазначеними показниками. Було зроблено припущення, що підтримка оптимальної тривалості сну може зменшити ризик розвитку з віком когнітивних порушень або відтягнути чи попередити зміни, які призводять до деменції. Іншими словами, якщо поганий, короткий сон призводить до когнітивних порушень, слід активно моніторувати та корегувати порушення сну з метою профілактики порушень функцій мозку [19, 20].
При симптомах вегетативної дисфункції найбільший дискомфорт в пацієнта вікликають саме психоемоційні симптоми, що можуть тривати навіть після встановлення контролю над соматичними проявами. Тому в терапії ВСД активно застосовується психофармакологічне лікування. Спектр протитривожних засобів дуже широкий: транквілізатори (бензодіазепінові і небензодіазепінові), антигістамінні препарати, малі нейролептики, седативні рослинні збори, антидепресанти. З 60–х років ХХ ст. для лікування ВСД переважно використовуються антидепресанти у зв’язку з високою ефективністю при тривожних станах [7, 20].
Основні принципи лікування інсомній включають: 1) лікування причин, що викликають порушення сну (тривожність, депресія, синдром апное уві сні, порушення сечовипускання); 2) лікування самого синдрому інсомнії, що включає дотримання гігієни сну, медикаментозну терапію, фототерапію. Основні правила гігієни сну складаються з дотримання того ж самого часу засинання та пробудження, сон у тихій, темній, прохолодній кімнаті; по можливості слід виключити денний сон, вживання чаю, кави тощо за декілька годин до сну; слід зменшити фізичне та розумове навантаження за 2–3 години до сну та виключити перегляд хвилюючих телепередач перед сном; перед сном можна приймати прохолодний душ або здійснювати прогулянку на свіжому повітрі [4, 7].
Медикаментозне лікування повинно відповідати таким вимогам: швидке настання сну, підтримка достатньо глибокого сну, відсутність постсомнотичних розладів. Можуть застосовуватися снодійні засоби (короткої, середньої та тривалої дії), бензодіазепіни (діазепам, лоразепам, нітразепам), антидепресанти. При застосуванні препаратів, що впливають на сон (снодійних засобів), слід обмежити вживання алкоголю та управління автотранспортом [7, 8].
Антидепресанти як клас препаратів були створені з метою впливу насамперед на симптоми депресії, але завдяки різним додатковим ефектам використовуються для лікування тривоги, больового синдрому, безсоння тощо. Ці ефекти у різних представників класу виражені по–різному, що й обумовлює вибір того чи іншого препарату залежно від переважання тієї чи іншої симптоматики у конкретного пацієнта. Наприклад, вплив на симптоми безсоння у різних представників класу варіює від відсутності впливу на якість сну, обтяження симптомів існуючого безсоння та здатності його викликати до вираженого снодійного впливу із здатністю нормалізувати формулу сну і, таким чином, підвищувати схильність до лікування, оскільки цей ефект настає раніше за інші (насамперед антидепресивний) [18]. Яскравим прикладом таких препаратів є тразодон.
Тразодону гідрохлорид — похідне тріазолпіридину, єдиний представник антидепресантів класу SARI (Serotonin (5HT2) Antagonist and Reuptake Inhibitor) в Україні, за своїми фармакологічними показниками відноситься до групи антагоністів серотонінових рецепторів (5HT) і селективних інгібіторів зворотного захвату серотоніну. Крім антагонізму до 5-HT2A- і 5-HT2C-рецепторів, тразодон є агоністом 5-HT1-рецепторів та інгібує постсинаптичні a1- і пресинаптичні a2-адренергічні рецептори [15]. Ступінь впливу тразодону на рецептори визначається дозою препарату: доза, близька до 50 мг (25–100 мг), повністю насичує 5HT2A-рецептори, значною мірою блокує a1-адренорецептори і зв’язує лише половину гістамінових рецепторів першого типу і ділянок зворотного захвату серотоніну. Цього достатньо саме для виникнення седативного і снодійного ефекту. У таких дозах вплив на рецептори виражений сильніше за інгібування зворотного захвату серотоніну. Для отримання антидепресивного ефекту добова доза тразодону повинна становити щонайменше 150–300 мг, що дозволяє створити повне насичення переносників серотоніну [14].
Є спостереження, що застосування препарату саме на ніч, перед сном, має більший гіпнотичний ефект: сон настає швидше, зменшується кількість пробуджень, покращуються якість сну та самопочуття при пробудженні [23]. Застосування тразодону сприяє збільшенню загальної тривалості сну завдяки зменшенню кількості пробуджень вночі і скороченню тривалості швидкого сну. За рахунок цього частково пом’якшується вплив фази швидкого сну на психічний стан людини, послаблюючи таким чином фактор, який часто є причиною виникнення депресії. На відміну від трициклічних антидепресантів тразодон не вкорочує спокійну четверту фазу сну. Ефективність тразодону щодо порушень сну вивчалася також у пацієнтів із неорганічним безсонням, пов’язаним з депресивним епізодом або рекурентним депресивним розладом, із використанням полісомнографії. Прийом тразодону у дозі 100 мг на добу був пов’язаний з нормалізацією повільнохвильової і REM-фази сну, приводив до поліпшення суб’єктивної оцінки якості сну, емоційної сфери і числової пам’яті порівняно з групою плацебо. Завдяки своїм седативним і снодійним ефектам препарат може використовуватися також при лікуванні станів з підвищеною тривожністю, які часто супроводжуються безсонням. Є дані щодо ефективного застосування тразодону при безсонні недепресивного походження, в тому числі у хворих з алкогольною, наркотичною і бензодіазепіновою залежністю. Препарат також можна застосовувати для лікування порушень сну у посттравматичному періоді. Слід зазначити, що тразодон є ефективним для зменшення тривоги і загального збудження у хворих з деменцією (в дозі 50–150 мг).
Оцінка ранкового та вечірнього АТ і частоти серцевих скорочень показала тільки зниження ранкового діастолічного АТ. Були повідомлення, що тразодон у дозі 100 мг не впливає на частоту серцевих скорочень, систолічний та діастолічний АТ у положенні стоячи або лежачи у людей похилого віку, але тривалий прийом препарату призводив до значимого зниження частоти пульсу й АТ [12]. У зв’язку з a1-адреноблокуючим ефектом тразодон може викликати поступальну гіпотензію, що необхідно мати на увазі при призначенні препарату пацієнтам із коливаннями АТ і ЧСС [20].
Завдяки тому, що тразодон (Триттіко) — це антидепресант, який є антагоністом рецепторів серотоніну та інгібує зворотний захват серотоніну синаптосомами головного мозку, його відносять до поліфункціональних психофармокалогічних засобів. Так, тразодон перш за все показаний при депресії (переважно уніполярній), однак є велика доказова база відносно ефективності тразодону при використанні його як замінника бензодіазепінів або снодійних засобів за рахунок вираженого анксіолітичного та снодійного ефектів. Дані, отримані з офіційних джерел, підтверджують його ефективність в лікуванні генералізованного тривожного розладу, хронічного больового синдрому, а також як анксіолітика у випадах алкогольної чи бензодіазепінової залежності [14, 15].
Нами були проведене дослідження, у якому брали участь пацієнти з початковими проявами недостатності мозкового кровообігу, клінічна картина яких включала інсомнію. Метою спостереження були оцінка клінічної ефективності, переносимості та безпечності тразодону в пацієнтів із початковими проявами недостатності мозкового кровообігу на тлі традиційного лікування.
Матеріал та методи
У дослідженні взяли участь 45 пацієнтів з початковими проявами недостатності мозкового кровообігу та інсомнією. Основну групу становили 34 хворі віком від 30 до 58 років (середній вік 46,5 ± 7,5 року), серед яких було 26 жінок та 8 чоловіків. Групу контролю становили 11 пацієнтів (7 жінок і 4 чоловіки), середній вік яких був 47,7 ± 6,7 року. Серед супутньої патології у пацієнтів обох груп виявлялися артеріальна гіпертензія (АГ) 1–2-го ступеня, І стадії, дисліпідемія, нестенозуючий атеросклероз церебральних судин. Діагноз артеріальної гіпертензії та її ступінь (у дослідженні брали участь пацієнти з І стадією хвороби) встановлювався за рекомендаціями ESH/ESC 2013 року [16]. Дисліпідемія як фактор ризику визначалася відповідно до рекомендацій ESC/EAS (Guidelines for the management of dyslipidaemias) [17]. Діагноз початкових проявів недостатності мозкового кровообігу встановлювався за умови наявності у хворого факторів ризику судинного захворювання (АГ, цукровий діабет, паління, дисліпідемія тощо) та не менше двох із зазначених нижче скарг: головний біль, головокружіння, шум у голові, порушення запам’ятовування, зниження працездатності, порушення сну, що спостерігалися пацієнтом не менше одного разу на тиждень протягом трьох останніх місяців. Враховувалися відсутність в анамнезі черепно-мозкових травм, минущих порушень мозкового кровообігу, інфекційних захворювань ЦНС. В дослідженні не брали участь пацієнти, які перенесли гостре порушення мозкового кровообігу, інфаркт міокарда, а також з тяжкою соматичною патологією. Всім хворим проводилася магнітно-резонансна томографія головного мозку, включаючи режими дифузійно-зваженого зображення та Т2-зважене зображення, з метою виявлення дрібних ішемічних та геморагічних вогнищ відповідно, розмір і наявність яких визначали діагноз пацієнта. Умовою встановлення діагнозу була відсутність органічного великовогнищевого ураження головного мозку, тобто розмір вогнищ не повинен був перевищувати 3 мм у діаметрі [19].
Всім хворим проводилося загальноклінічне та клініко-неврологічне дослідження. Клініко-лабораторне дослідження включало загальний аналіз крові та сечі, біохімічний аналіз крові, аналіз крові на глюкозу, ліпідограму. Клініко-інструментальні методи дослідження крім МРТ включали ЕКГ, вимірювання артеріального тиску та частоти серцевих скорочень (ЧСС), дуплексне сканування екстра- та інтракраніальних судин головного мозку, за допомогою якого виявлялися стенози та деформації судин голови та шиї, їх гемодинамічну значимість, товщину та однорідність комплексу інтима-медіа, наявність атеросклеротичних явищ. Клініко-психологічне дослідження включало оцінку стану пацієнтів за шкалою Спілбергера (для оцінки тривожних розладів), шкалою оцінки астенії MFI–20 (The Multidimensional Fatigue Inventory), шкалою Бека (для оцінки депресії). Об’єктивізація функціонального стану вегетативної нервової системи проводилася за допомогою опитувальника для виявлення ознак вегетативних змін.
Шкала Спілбергера (тест Спілбергера — Ханіна, розроблений Ч.Д. Спілбергером (США) і адаптований Ю.Л. Ханіним (Росія)) дозволяє оцінити окремо реактивну й особисту тривожність. Певний рівень тривожності — природна й обов’язкова особливість активної діяльності особистості. У кожної людини існує оптимальний (бажаний) рівень тривожності — так звана корисна тривожність. При аналізі результатів треба мати на увазі, що кінцевий показник за кожною із підшкал може знаходитись в діапазоні від 20 до 80 балів. Реактивною (ситуаційною) вважається тривожність, що відповідає стану пацієнта на момент проведення тестування. Висока реактивна тривожність може порушувати рівень уваги, здатність до концентрації, збільшувати відволікальність від діяльності і гальмувати швидкість реакції, тобто змінювати дані нейропсихологічного тестування. 30 балів і менше за шкалою вказують на низький рівень реактивної тривожності, 31–44 — на середній, більше ніж 45 балів свідчать про високий рівень реактивної тривожності. Особиста тривожність відображає готовність пацієнта до тривожних реакцій, властивих його особистості. 30 балів і менше за шкалою вказують на низький рівень особистої тривожності, 31–44 — на середній рівень тривожності, більше ніж 45 балів свідчать про високий рівень особистої тривожності. Дуже висока тривожність (> 46 балів) може бути пов’язана з невротичним конфліктом, емоційним зривом і психосоматичним захворюванням. Низька тривожність (< 12 балів), навпаки, вказує на вірогідність депресивного, неактивного стану з низьким рівнем мотивації [5].
Шкала оцінки астенії MF-20 дозволяє отримати суб’єктивну кількісну оцінку як загальної тяжкості астенії, так і її різних проявів. Шкала не дозволяє оцінити генез астенічного синдрому, але дає можливість оцінити його вираженість та структуру. Шкала складається з 20 пунктів, що відображають різні складові астенії: загальну астенізацію, фізичну астенію, знижену активність, зниження мотивації і психічну астенію. Оцінка за шкалою — сума балів її окремих пунктів. Найвищій бал відображає найвищу тяжкість астенії. Оцінка за кожною субшкалою — сума балів її окремих пунктів, що може коливатись в інтервалі 4–20 балів. Клінічно вираженою астенія вважається при перевищенні 12 балів за будь-якою субшкалою, а також при загальному балі більше ніж 60 [5].
Для оцінки депресії ми застосували шкалу самооцінки депресії Бека, що може використовуватися в осіб віком від 18 до 86 років. Шкала дозволяє виявити депресивні розлади різного ступеня, від мінімальних до сильно виражених. Тест складається з 21 групи тверджень, у кожній із яких можна вибрати найбільш відповідне для себе твердження з чотирьох наведених варіантів, що оцінюються в балах від 0 до 3. Пункти шкали Бека оцінюють такі симптоми депресії: нудьга, песимізм, минулі невдачі, втрата задоволення, відчуття провини, відчуття заслуженого покарання, невдоволення собою, самокритика, суїцидальні думки чи дії, плаксивість, роздратованість, втрата інтересу до людей, нерішучість, невдоволеність змінами своєї зовнішності, втрата працездатності, зміни сну, втома/стомлюваність, зміни апетиту, втрата ваги, занепокоєність здоров’ям, втрата інтересу до сексуального життя. При рівні сумарного балу від 0 до 9 депресія відсутня, 10–13 — мінімально виражена, 14–19 — легка депресія, 20–28 — середній ступінь депресії, 29–63 бали — тяжка депресія. Встановлювати діагноз депресії тільки на підставі даних шкали Бека не рекомендується, оскільки це самооціночна шкала і питання можуть довільно або недовільно спотворюватися пацієнтом. Але, на думку ряду авторів, якщо кількість балів за шкалою Бека дорівнює 19 і більше, діагноз можна вважати встановленим. У пацієнтів з когнітивними розладами і соматичними захворюваннями інтерпретувати данні шкали Бека слід з обережністю [5].
Опитувальник для виявлення ознак вегетативних змін складений так, що дослідний підкреслює відповіді «так» або «ні». Для кількісної оцінки виявлених ознак була проведена експертна оцінка вегетативних симптомів шляхом надання певної кількості балів кожній ознаці відповідно до її питомої ваги серед різних симптомів ВСД. З огляду на це кожному симптому в разі позитивної відповіді на відповідне питання був наданий бал від 1 до 10. Загальна сума балів, отримана при вивчені ознак за опитувальником, не повинна перевищувати 15, у випадку перевищення можна говорити про наявність ВСД [2, 3].
Пацієнти під час спостереження приймали відповідно ретельно підібрану антигіпертензивну і ліпідознижуючу терапію. Враховуючи симптоми захворювання, пацієнти обох груп отримували симптоматичну терапію, направлену на досягнення балансу у функціонуванні АНС (транквілізатори або анксіолітики), препарати для покращення венозного відтоку та метаболізму у мозковій тканині (антигіпоксанти). Пацієнти основної групи протягом 4 тижнів отримували тразодон в дозі 50 мг на ніч.
Статистична обробка отриманих результатів проводилася за допомогою програми Statistica 6.0 з використанням параметричних (для обчислення кількісних показників) та непараметричних (для обчислення якісних показників) методів статистики. При порівнянні груп за дослідними показниками відмінність вважалася вірогідною при p < 0,05.
Результати та їх обговорення
Серед пацієнтів основної групи (n = 34) АГ 1-го ступеня була виявлена в 11 (32,35 %) осіб, АГ 2-го ступеня — у 3 хворих (8,82 %), артеріальна гіпотензія (АТ 100/60 мм рт.ст.) — у 6 пацієнтів (17,65 %). У пацієнтів контрольної групи (n = 11) АГ 1-го ступеня була виявлена у 36,36 % (n = 4) хворих, АГ 2-го ступеня — в 5 пацієнтів (45,46 %). Ознаки нестенозуючого атеросклерозу на початкових стадіях і/або зміни у ліпідограмі були виявлені у всіх дослідних пацієнтів.
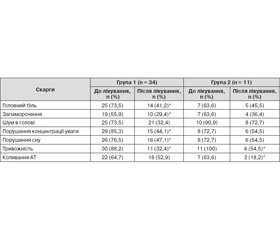
Пацієнти основної і контрольної груп на початку лікування мали подібні скарги, серед яких найбільш поширеними були головний біль, запаморочення чи хиткість, шум у голові/вухах, порушення концентрації уваги, зниження пам’яті, порушення сну, тривожність (комок у горлі, відчуття нестачі повітря, серцебиття, схвильованість, коливання артеріального тиску (систолічний АТ протягом доби відрізнявся більше ніж на 20 мм рт.ст.)). Порушення сну (інсомнія) проявлялися в усіх дослідних пацієнтів у поверхневому нетривалому сні, частих нічних пробудженнях, після яких складно було засинати, нав’язливих хвилюючих думках і, відповідно, у сонливості вдень.
Якщо звернути увагу на дані нейропсихологічної оцінки пацієнтів обох груп (за допомогою шкал та опитувальника), можна зробити висновок, що у дослідних пацієнтів обох груп не було виявлено ознак депресії (згідно з самооціночною шкалою депресії Бека — не більше ніж 9 балів) та вираженої загальної астенії (за шкалою оцінки астенії MFI-20 — не більше ніж 60 балів). Згідно з бальною оцінкою за шкалою Спілбергера, у пацієнтів обох груп спостерігається як реактивна, так і особиста тривожність середнього рівня (30–44 бали) з тенденцією до високого (45 і більше балів) ступеня тривожності. Оцінка за допомогою опитувальника для виявлення ознак вегетативних змін вказує на наявність (більше ніж 15 балів) в обстежених пацієнтів основної і контрольної груп ВСД.
В табл. 1 надана порівняльна характеристика скарг пацієнтів основної та контрольної груп до лікування та через 4 тижні.
Як ми бачимо з табл. 1, в основній групі стан пацієнтів статистично значимо покращився порівняно з попереднім станом (вірогідно зменшились кількість скарг, їх інтенсивність). Пацієнти відмічали зменшення інтенсивності або зникнення таких скарг, як головний біль, запаморочення, здатність до концентрації уваги, схвильованість, ком у горлі, відчуття серцебиття. Основні зміни, які пацієнти відмічали вже на 7-му — 10-ту добу, виражалися в покращенні якості сну: зменшувалась кількість нічних пробуджень, збільшувалася тривалість сну, сон ставав більш спокійним, менше хвилювали набридливі думки при засинанні. В контрольній групі стан пацієнтів мав тенденцію до поліпшення, але менш динамічного. Спостерігалося клінічно значиме покращення контролю АТ, зменшилися симптоми тривоги. Судячи з динаміки бальної оцінки стану пацієнтів за шкалою Спілбергера (для оцінки тривожних розладів), шкалою оцінки астенії MFI-20, шкалою Бека (для оцінки депресії) та опитувальником для виявлення ознак вегетативних порушень, в основній групі протягом 4 тижнів статистично значимо зменшилися прояви вегетативної дисфункції та реактивної тривожності. В контрольній групі показники мали позитивну динаміку, але вона не досягнула статистичної значимості (табл. 2).
Висновки
Включення у стандартну схему лікування пацієнтів з симптомами інсомнії на тлі початкових проявів недостатності мозкового кровообігу тразодону (50 мг на ніч) дозволило більш ефективно вплинути на симптоми вегетативної дисфункції та тривоги, що входять до синдромокомплексу цереброваскулярної хвороби. Так, вірогідне зменшення реактивної (ситуаційної) тривожності свідчить про зменшення готовності пацієнта до тривожної реакції на момент дослідження. Спостерігалася тенденція до зменшення підвищеної особистої тривожності, але динаміка не набула статистичної значимості, ймовірно, через більшу стійкість симптомів, обумовлену конституційними факторами, та нетривалий час спостереження. Порівняно з контрольною групою значиме покращення загального стану пацієнтів із початковими проявами недостатності мозкового кровообігу, а саме зменшення кількості та інтенсивності скарг, скоріше за все, пов’язане саме із зменшенням явищ інсомнії. Слід зазначити, що небажані явища при прийомі тразодону (Триттіко) в дозі 50 мг на ніч не спостерігалися, в результаті чого був 100% комплайєнс.
Таким чином, можна говорити про доцільність включення в схему лікування пацієнтів з початковими проявами недостатності мозкового кровообігу і симптомами інсомнії тразодону (Триттіко) в дозах, близьких до 50–100 мг, на ніч, з метою більш суттєвого та безпечного впливу на симптоми захворювання та відповідне покращення стану пацієнтів із мінімальним ризиком виникнення побічних ефектів, що сприяє прихильності до лікування.
1. Артюхова М.Г., Шанаева И.А. Структура и особенности лечения нарушений сна у больных с сердечно–сосудистыми заболеваниями // РМЖ. — 2010. — Т. 18, № 26. — С. 1573–1577.
2. Вегетативные расстройства (клиника, диагностика, лечение) / Под ред. А.М. Вейна. — М.: Медицинское информационное агентство, 1998. — 752 с.
3. Вегетативные расстройства: клиника, лечение, диагностика: Руководство для врачей / Под ред. В.Л. Голубева. — М.: ООО Медицинское информационное агентство, 2010. — С. 608–633.
4. Кадыков А.С., Манвелов Л.С., Шахпаронова Н. В. Хронические сосудистые заболевания головного мозга (дисциркуляторная энцефалопатия). — М.: ГЭОТАР-Медиа, 2006.
5. Нервно–психические нарушения: диагностические тесты / В.В. Захаров, Т.Г. Вознесенская. — М.: МЕДпресс-информ, 2013. — 320 с.
6. Пигарев И.Н. Висцеральная теория сна // Журнал высшей нервной деятельности. — 2013. — Т. 63, № 1. — С. 86–104.
7. Ранние клинические формы сосудистых заболеваний головного мозга: Руководство для врачей / Под ред. Л.С. Манвелова, А.С. Кадыкова. — М.: ГЭОТАР-Медиа, 2014. — 344 с.
8. Семенова Е.П., Пантелеева Р.А., Логинова Н.Н. Актуальные вопросы диагностики начальных форм сосудистых заболеваний головного мозга // Начальные формы сосудистой патологии нервной системы / Под ред. проф. Е.П. Семеновой. — Горький, 1975. — С. 5–10.
9. Трошин В.Д. О систематизации начальных форм сосудистых заболеваний мозга / Под ред. проф. Е.П. Семеновой. — Горький,1975. — С. 11–18.
10. Blazer D.G., Hughes D., George L.K. et al. Generalized anxiety disorder. Psychiatric Disorders in America: The Epidemiologic Catchment Area Study / Robins L.N., Regier D.A. eds. — NY: The Free Press, 1991. — Р. 180–203.
11. Bradley T.D., Floras J.S. Sleep apnea and heart failure: part I: obstructive sleep apnea // Circulation. — 2003. — 107. — 1671–1678.
12. Branconnier R., Cole J. Effect of acute administration of trazodone and amitriptyline on cognitive, cardiovascular functions and salivation in normal geriatric subjects // J. Clin. Psychopharmacol. — 1981. — 1(6). — P. 82s–88s.
13. Cortelli P., Calandra-Buonaura G., Culebras A. Autonomic dysfunction in sleep disorders // Originally released July 21, 2003; last updated October 5, 2013.
14. Ede Frecska. Trazodone. Its multifunctional mechanism of action and clinical use // Neuropsychopharmacol. Hung. — 2010. — 12(4). — Р. 477–482.
15. Frazer A. Pharmacology of antidepressants // J. Clin. Psychopharmacol. — 1997. — №17(2). — P. 2–18.
16. Guidelines for the management of arterial hypertension / 2013 ESH/ESC // Journal of Hypertension. — 2013. — 31. — 1281–1357.
17. Guidelines for the management of dyslipidaemias: Addenda / ESC/EAS // European Heart Journal. — doi:10.1093/eurheartj/ehr169.
18. Obemdorfer S. et. al. Effects of selectiveserotonin inhibitors on objective and subjective sleep // Neuropsychobiology. — 2000. — 42. — P. 69–81.
19. Pantoni L. // The Lancet Neurology. — July 2010. — Vol. 9, Issue 7. — P. 689–701.
20. SaJetu-Zyhlan G.M. et al. // Progress in Neuro-Psychpharmacology & Biological Psychiatry. — 2002. — 26. — 249–260.
21. Sleep Problems Linked To Decline in Brain Function With Age / By Janice Wood Associate News Editor Reviewed by John M. — Grohol, Psy.D., June 28, 2014.
22. Ware J.C. et al. Inaeased deep sleep after trazadone use: a double-blind placebo-controlled study in healthy young adults // J. Clin. Psychiatry. — 51(Suppl. 9). — P. 18–22.
23. Wheatley D. Trazodone: alternative dose regimen and sieep // Pharmatherapeutica. — 1984. — № 9(3). — P. 607–612.

/35/35.jpg)