Газета «Новости медицины и фармации» Аллергология и пульмонология (520) 2014 (тематический номер)
Вернуться к номеру
Саркоїдоз Адаптована клінічна настанова, заснована на доказах 2014
Разделы: Официальная информация
Версия для печати
Статья опубликована на с. 31-55
Державний експертний центр Міністерства охорони
здоров’я України
Українське товариство спеціалістів з імунології, алер-
гології та імунореабілітації
Асоціація фтизіатрів та пульмонології України
Саркоїдоз
Адаптована клінічна настанова,
заснована на доказах
2014
мультидисциплінарної робочої групи з опрацювання медико-технологічних документів зі стандартизації медичної допомоги на засадах доказової медицини хворим на саркоїдоз
|
Чоп’як Валентина Володимирівна |
Завідувач кафедри клінічної імунології та алергології Львівського національного медичного університету імені Данила Галицького, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Алергологія. Імунологія. Клінічна імунологія. Лабораторна імунологія» |
|
Морозов Анатолій Миколайович |
Професор кафедри нейрохірургії Національного медичного університету імені О.О. Богомольця, д.мед.н., професор |
|
Степаненко Алла Василівна |
Радник Міністра охорони здоров’я, д.мед.н., професор |
|
Гаврисюк Володимир Костянтинович |
Завідувач клініко-функціонального відділення Національного інституту фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України, професор кафедри фтизіатрії і пульмонології Національної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор |
|
Гуменюк Галина Львівна |
Доцент кафедри фтизіатрії і пульмонології Національної медичної академії післядипломної освіти імені П.Л. Шупика, старший науковий співробітник Національного інституту фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України., к.мед.н. |
|
Левченко Олена Михайлівна |
Заступник головного лікаря Комунальної установи «Одеська обласна клінічна лікарня», доцент кафедри внутрішньої медицини № 10 з курсом серцево-судинної патології Одеського національного медичного університету, к.мед.н. |
|
Літус Олександр Іванович |
Професор кафедри дерматовенерології Національної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Дерматовенерологія» відповідно до наказу № 526-к від 10.12.2012 |
|
Процик Любомир Миронович |
Старший науковий співробітник Державної установи «Національний інститут фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України», к.мед.н. |
|
Риков Сергій Олександрович |
Головний лікар Київської міської лікарні «Центр мікрохірургії ока», завідувач кафедри офтальмології Національної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Офтальмологія» відповідно до наказу № 526-к від 10.12.2012 |
|
Рекалова Олена Михайлівна |
Завідуюча лабораторією клінічної імунології Державної установи «Національний інститут фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України», д.мед.н. |
|
Толох Ольга Степанівна |
Завідувач 2-го діагностичного відділення Львівського регіонального фтизіопульмонологічного клінічного лікувально-діагностичного центру, асистент кафедри клінічної імунології та алергології Львівського національного медичного університету імені Данила Галицького, к.мед.н. |
|
Харченко Наталія В’ячеславівна |
Завідувач кафедри гастроентерології, дієтології, декан терапевтичного факультету Національної академії післядипломної освіти імені П.Л. Шупика, член-кореспондент Національної академії медичних наук України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Гастроентерологія» відповідно до наказу № 526-к від 10.12.2012 |
|
Яременко Олег Борисович |
Завідувач кафедри внутрішніх хвороб стоматологічного факультету Національного медичного університету імені О.О. Богомольця, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Ревматологія» |
|
Селюк Мар’яна Миколаївна |
Професор кафедри терапії Української військово-медичної академії, к.мед.н., доцент |
|
Гиріна Ольга Миколаївна |
Завідувач кафедри загальної практики (сімейної медицини) Національного медичного університету імені О.О. Богомольця, д.мед.н., професор |
|
Білоглазов Володимир Олексійович |
Завідувач кафедри внутрішньої медицини № 2 Кримського державного медичного університету ім. С.І. Георгієвського, професор, д.мед.н. |
|
Господарський Ігор Ярославович |
Завідувач кафедри клінічної імунології, алергології та загального догляду за хворими Тернопільського медичного університету, д.мед.н., професор |
|
Гречанська Лариса Василівна |
Асистент кафедри дерматовенерології Національної медичної академії післядипломної освіти імені П.Л. Шупика |
|
Назаренко Олександр Павлович |
Генеральний директор та головний лікар клініки імунології і алергології «Форпост» та Лабораторії Форпост, асистент кафедри алергології та імунології Національної медичної академії післядипломної освіти імені П.Л. Шупика |
|
Мальцев Дмитро Валерійович |
Заступник директора Інституту імунології та алергології Національного медичного університету імені О.О. Богомольця, к.мед.н. |
Методичний супровід та інформаційне забезпечення
|
Ліщишина О.М. |
Директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України», к.мед.н, ст.н.с. |
|
Горох Є.Л. |
Начальник Відділу якості медичної допомоги та інформаційних технологій Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», к.т.н. |
|
Мельник Є.О. |
Начальник Відділу доказової медицини Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» |
|
Шилкіна О.О. |
Начальник Відділу методичного забезпечення новітніх технологій у сфері охорони здоров’я Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» |
Державний експертний центр МОЗ України є членом
Guidelines International Network (Міжнародна мережа настанов)
ADAPTE (Франція) (Міжнародний проект з адаптації клінічних настанов)
Рецензенти адаптованої клінічної настанови, заснованої на доказах, «Саркоїдоз»
|
Кайдашев Ігор Петрович |
Завідувач кафедри внутрішньої медицини № 3 ВДНЗ України «Українська медична стоматологічна академія», президент Українського товариства спеціалістів з імунології, алергології та імунореабілітації, д.мед.н., професор |
|
Моногарова Надія Єгорівна |
Професор кафедри внутрішньої медицини ім. О.Я. Губергріца Донецького національного медичного університету ім. М. Горького, д.мед.н., професор |
|
Наконечна Алла Анатоліївна |
К.мед.н., лікар алерголог-імунолог Клініки імунології та алергології Університету Халла та Йорка, Великобританія |
Перелік скорочень
ATS Американське торакальне товариство
GM-CSF Гранулоцитарно-макрофагальний колонієстимулуюючий фактор
Dlco Дифузна здатність легенів по монооксиду вуглецю
ERS Європейське респіраторне товариство
ICF-l Інсуліноподібний фактор росту 1
IGRA Тест на вивільнення інтерферону-гамма
IL-2 Інтерлейкін-2
HLA Людський лейкоцитарний антиген
MIP-la Макрофагальний білок запалення 1-альфа
MHC Головний комплекс гістосумісності/важкий ланцюг міозину
MTX Метотрексат
PDGF Тромбоцитарний фактор росту
RANTES Регуляція активації нормальної Т-клітинної експресії і секреції
TCR Рецептор Т-клітин
TGF-β Фактор росту бета
Thl Т-хелпери типу 1
TNF Фактор некрозу пухлини
VTLB Відеоторакоскопічна біопсія
WASOG Всесвітня асоціація саркоїдозу та інших гранулематозних розладів
АКТГ Адренокортикотропний гормон
АЛТ Аланінамінотрансфераза
АЛФ Алкалінлужна фосфатаза
АМ Альвеолярні макрофаги
АСТ Аспартатамінотрансфераза
АПФ Ангіотензин-перетворюючий фермент
БАЗ Бронхоальвеолярний змив
БАЛ Бронхоальвеолярний лаваж
ВІЛ Вірус імунодефіциту людини
ВООЗ Всесвітня організація охорони здоров’я
ГКС Глюкокортикостероїди
ДНК Дезоксирибонуклеїнова кислота
ЖЄЛ Життєва ємність легенів
ШКТ Шлунково-кишковий тракт
ЗАК Загальний аналіз крові
ІФН-γ Інтерферон-гамма
КН Клінічна настанова
КТ Комп’ютерна томографія
КТВРЗ Комп’ютерна томографія високої роздільної здатності
НСПЗЗ Нестероїдні протизапальні засоби
ПЛР Полімеразна ланцюгова реакція
РНК Рибонуклеїнова кислота
РГ Рентгенограма
СМР Спинномозкова рідина
ТБЛ Трансбронхіальна біопсія легенів
ФЗД Функції зовнішнього дихання
ЦНС Центральна нервова система
ЛФ Лужна фосфатаза
ЕКГ Електрокардіограма
ЕхоКГ Ехокардіограма
ЯМР Ядерний магнітний резонанс
Синтез настанови
За прототип Адаптованої клінічної настанови «Саркоїдоз» взято Консенсусний документ Американського торакального товариства (ATS), Європейського респіраторного товариства (ERS) та Всесвітньої асоціації саркоїдозу та інших гранулематозних розладів (WASOG) «Statement on Sarcoidosis» (1999).
Додаткові докази, включені з інших джерел:
1. Cremers J.P. Multinational evidence-based World Association of Sarcoidosis and Other Granulomatous Disorders recommendations for the use of methotrexate in sarcoidosis: integrating systematic literature research and expert opinion of sarcoidologists worldwide — 2013.
2. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society / A.U. Wells et al. — 2008.
3. Sarcoidosis — European Respiratory Society Monograph — 2005.
4. Current and emerging pharmacological treatments for sarcoidosis: a review / S.H. Beegle — 2013.
Передмова робочої групи з адаптації клінічної настанови за темою «Саркоїдоз»
Упродовж останніх десятиріч у всьому світі для забезпечення якості і ефективності медичної допомоги, для створення якісних клінічних протоколів (Clinical Pathway) та/або медичних стандартів (МС) як третинне джерело доказової медицини використовуються клінічні настанови (КН).
Клінічна настанова (Clinical practice guidelines) — це документ, що містить систематизовані положення стосовно медичної та медико–соціальної допомоги, розроблені з використанням методології доказової медицини на основі підтвердження їх надійності та доведеності, і має на меті надання допомоги лікарю і пацієнту в прийнятті раціонального рішення в різних клінічних ситуаціях.
Клінічна настанова — це рекомендаційний документ з найкращої медичної практики, заснований на доказах ефективності, в першу чергу для практикуючих лікарів, які надають як первинну, так і вторинну медичну допомогу.
Відповідно до положень наказу МОЗ України від 28.09.2012 р. № 751 «Про створення та впровадження медико–технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрованого в Міністерстві юстиції України 29.11.2012 р. за № 2001/22313, створення КН в Україні здійснюється шляхом адаптації вже існуючих клінічних настанов, які розроблені на засадах доказової медицини у відомих світових центрах — NICE (Англія), SIGN (Шотландія), AHRQ (США), HEN WHO (ВООЗ), NZGG (Нова Зеландія) та ін. Клінічні настанови, що розроблені на науковій основі, мають основні ознаки, що відповідають назві, визначенню та змісту клінічних настанов, а саме:
— наявність переліку членів мультидисциплінарної робочої групи;
— наявність зовнішніх рецензентів;
— визначення дати перегляду клінічної настанови;
— наявність шкали рівнів доказів у клінічній настанові;
— список першоджерел літератури (статті за результатами рандомізованих клінічних досліджень, метааналізи, огляди літератури) тощо.
Вибір клінічної настанови або кількох настанов для подальшої адаптації з метою використання в інших країнах в рамках національної системи охорони здоров’я — велика відповідальність, зокрема і для робочої групи, затвердженої наказом МОЗ України від 15.04.2012 р. № 303. Важливість питання полягає у тому, що на основі обраного прототипу(ів) буде розроблена адаптована настанова для системи охорони здоров’я України, а на її основі — Уніфікований клінічний протокол надання медичної допомоги пацієнтам, які хворіють на саркоїдоз. Для забезпечення правильності вибору прототипу(ів) застосовується інструмент, що оцінює якість КН, методичний та науковий рівень її розробки — шкала Appraisal of Guidelines for Research and Evaluation (AGREE), а науковий рівень публікацій здійснюється за допомогою оціночних листів Scottish Intercollegiate Guidelines Network (SIGN).
Робоча група з адаптації має відзначити, що, на жаль, літератури з доказової медицини стосовно діагностики та лікування саркоїдозу на сьогоднішній день обмежена кількість, і це додавало труднощів для робочої групи. Всі первинні матеріали знайдених джерел літератури та їхньої оцінки, всі етапи діяльності робочої групи, напрацьовані матеріали зберігаються у Департаменті стандартизації медичних послуг ДЕЦ МОЗ України.
Адаптована клінічна настанова «Саркоїдоз» відповідно до свого визначення має на меті допомогти лікарю і пацієнту в прийнятті раціонального рішення щодо тактики лікування, вибору сучасних методів та способів діагностики та лікування цієї патології, слугує інформаційною підтримкою щодо найкращої клінічної практики на основі доказів ефективності застосування певних медичних технологій, ліків та організаційних засад при наданні медичної допомоги.
Запропонована адаптована клінічна настанова не повинна розцінюватись як стандарт медичного лікування. Дотримання положень КН не гарантує успішного лікування в кожному конкретному випадку, її не можна розглядати як посібник, що включає всі необхідні методи лікування або, навпаки, виключає інші. Остаточне рішення стосовно вибору конкретної клінічної процедури або плану лікування повинен приймати лікар з урахуванням клінічного стану пацієнта та можливостей для проведення заходів діагностики і лікування у медичному закладі та з урахуванням положень Уніфікованого клінічного протоколу медичної допомоги (УКПМД) при лікуванні саркоїдозу, який буде розроблений цією ж мультидисциплінарною робочою групою, затверджений наказом МОЗ України та впроваджений у систему охорони здоров’я України.
На основі УКПМД заклади охорони здоров’я будуть розробляти локальні протоколи медичної допомоги.
Представлена адаптована клінічна настанова має бути переглянута не пізніше 2017 р. мультидисциплінарною робочою групою за участю головного позаштатного спеціаліста МОЗ України, практикуючих лікарів, які надають первинну і вторинну медичну допомогу, науковців, організаторів охорони здоров’я, представників громадських організацій, які зацікавлені у підвищенні якості медичної допомоги та ін.
Мультидисциплінарна робоча група рекомендує професійній асоціації поширювати цю Адаптовану клінічну настанову та рекомендувати її для ознайомлення широкому колу лікарів, які надають медичну допомогу із саркоїдозу.
Саркоїдоз — системне гранулематозне захворювання, яке первинно вражає легені і лімфатичну систему людини. Діагноз цієї патології зазвичай вимагає виявлення типових змін більш ніж в одній системі органів і виключення іншої патології, яка характеризується гранулематозом. З тих пір, як саркоїдоз був вперше описаний в 1877 році, він продовжує залишатися випробуванням як для клініцистів, так і для вчених. Значний прогрес досягнуто в розумінні різнобічних клінічних та імунологічних порушень, а також у патоморфологічних ознаках захворювання. Набагато менше відомо про епідеміологію та генетичні фактори, які сприяють розвитку і прояву захворювання. Ставлення до лікування цього захворювання поки не цілком визначене. Найбільш важливим є те, що причина хвороби залишається невідомою.
Мета
Первинним стимулом для розробки цієї настанови, що відображає консенсус ATS, ERS і WASOG, було довести до відома клініцистів і вчених нові досягнення та підходи в області лікування саркоїдозу. Настанова допоможе поліпшити лікування хворих на саркоїдоз і буде сприяти створенню нових досліджень, спрямованих на виявлення причин і патогенезу цього захворювання.
Доказова база
До переліку авторів документа увійшли експерти з лікування саркоїдозу. Їх можна розділити на групи, відповідальні за написання окремих розділів настанови. Рівень доказовості для рекомендацій, наведених у настанові, значною мірою заснований на думці експертів та їх взаємній згоді. На жаль, є небагато доведених фактів, заснованих на добре проведених рандомізованих дослідженнях.
Автори дійшли до наступної згоди щодо розуміння патогенезу, діагностики та лікування саркоїдозу:

Визначення
Саркоїдоз — мультисистемна патологія невідомої етіології (1). Зазвичай він вражає людей молодого та середнього віку і часто проявляється у двосторонній лімфаденопатії коренів легенів, легеневій інфільтрації, ураженні очей і шкіри. Печінка, селезінка, лімфатичні вузли, слинні залози, серце, нервова система, м’язи, кістки та інші органи можуть також бути уражені.
Діагноз ставиться на тлі клініко-рентгенологічних даних, підтверджених гістологічною картиною неказеозної епітеліоїдно-клітинної гранульоми. Слід зауважити, що гранульоми відомої етіології і локальні саркоїдні реакції не є саркоїдозом.
Імунологічними ознаками, що часто спостерігаються, є пригнічення шкірної гіперчутливості уповільненого типу і посилення імунної відповіді, опосередкованої Т-хелперами (Th1), в місці прояву захворювання. Може також відбуватися посилення активності В-клітин і збільшення кількості циркулюючих імунних комплексів.
Перебіг і прогноз можуть корелювати з різними початковими проявами і тривалістю захворювання. Гострий початок із вузлуватою еритемою або безсимптомна двостороння лімфаденопатія коренів легенів зазвичай вказують на високу ймовірність самостійного вилікування, тоді як поступовий початок із множинним позалегеневим ураженням може супроводжуватися тривалим прогресуючим фіброзом легенів та інших органів.
Історія
Історія вчення про саркоїдоз має наступну хронологію відкриттів (детально ці факти були раніше опубліковані) (2, 3). Початковий опис саркоїдозу належить англійському лікарю Джонатану Хатчинсону (Jonathan Hutchinson), який в 1877 році описав пацієнта, в якого руки і ноги були покриті множинними збільшеними пурпуровими плямами, які розвинулися протягом років (4). Хатчинсон пов’язував появу цих плям із проявами подагри. У наступних публікаціях (5) він описав нові випадки і припустив, що зустрівся з «формою захворювання шкіри, яка... до теперішнього часу перебуває за межами спеціального розпізнавання». У подальших публікаціях про яскраві гістопатологічні і клінічні ознаки саркоїдозу були описані дерматологічні прояви або локальні прояви (очі, привушна залоза, кістки), при цьому системна природа захворювання до уваги не бралася. Карл Бек (Carl Boeck), норвезький дерматолог, зробив замальовки уражень шкіри руки норвезького моряка. Ці ілюстрації бачив Хатчинсон, але вони не були опубліковані (3). Його племінник, Цезар Бек (Caesar Boeck), описав випадок ураження шкіри в 1899 році, схожий на той, про який повідомляв Хатчинсон, і назвав його «множинним доброякісним саркоїдом шкіри»; при гістологічному дослідженні він виявив епітеліоїдні і гігантські клітини (7). Він використовував термін «саркоїд», оскільки вважав їх схожими на саркому, тоді як вони були доброякісними. Термін «саркоїдоз» походить від цієї публікації. Цезар Бек згодом опублікував опис 24 випадків «вузловатого розсіяного саркоїду», який вражав легені, кістки, лімфатичні вузли, селезінку, слизову оболонку носа або кон’юнктиву, вказуючи на системний характер хвороби (2). Француз Бенье (Besnier) першим описав lupus pernio (озноблений вовчак) в 1889 році (8). Гістологічні ознаки lupus pernio були встановлені через 3 роки (9).
У 1904 році Крайбіх (Kreibich), професор дерматології в Празі, описав саркоїдні кісти кісток у хворого з lupus pernio (10). Саркоїдне ураження кісток часто пов’язували з туберкульозом або іншими специфічними хворобами (11). У 1909 році датський офтальмолог Хеерфордт (Heerfordt) описав увеопаротидну лихоманку у трьох хворих (вона характеризувалася хронічним фебрильним перебігом, збільшенням привушних залоз і увеїтом; у двох випадках був односторонній параліч лицьового нерва) (12). У той час синдром був приписаний «свинці».
Ураження внутрішніх органів отримало належну оцінку в роботах Кузніцкого і Бітторфа (Kuznitsky, Bittorf), які описали 27-річного солдата з множинними шкірними та підшкірними вузлами, які гістологічно відповідали саркоїду Бека, зі збільшеними вузлами в коренях легенів і легеневою інфільтрацією на рентгенограмі органів грудної клітини (13). Шведський дерматолог Жаргон Шауманн (Jargon Schaumann) описав хворих із множинним ураженням органів, включаючи легені, кістки, мигдалики, ясна, селезінку і печінку (14). У статті 1919 року (опублікованій у 1934) Шауманн висловив думку про те, що ознаки, що раніше зараховувалися до різних захворювань, є однією системною патологією, яку він назвав «доброякісний лімфогранулематоз» (15). Він і багато інших дослідників вважали, що саркоїдоз являє собою варіант туберкульозу (3).
Зв’язок між саркоїдозом і гіперкальціємією або гіперкальціурією був вперше виявлений у 1939 році (16). У 1941 році норвезький дерматолог Ансгар Квейма (Ansgar Kveim) виявив, що внутрішньошкірне введення тканини лімфатичного вузла, ураженого саркоїдозом, призводить до утворення папули у 12 з 13 хворих на саркоїдоз (17). Він зробив висновок про те, що утворення папули викликане невідомим агентом, відмінним від туберкульозу. У США ця реакція була відзначена дещо раніше, проте була проігнорована (18). Луї Зільцбах (Louis Siltzbach) допрацював цей тест, використовуючи суспензію селезінки, підтвердив специфічність проби й організував міжнародне дослідження (19). Тест був названий пробою Квейма — Зільцбаха, вказуючи на вклад цих вчених. Свен Лефгрен (Sven Lofgren) зробив великий внесок у нове розуміння клінічних ознак саркоїдозу й описав синдром, що часто зустрічається на початку перебігу саркоїдозу в білошкірих людей, який характеризувався вузлуватою еритемою, двосторонньою лімфаденопатією коренів легенів, лихоманкою і поліартритом (20). Це поєднання ознак з тих пір називають синдромом Лефгрена. Патологоанатомічні (некроскопічні) дослідження (21) і велика група клінічних спостережень (22, 30) згодом внесли деяку ясність у клінічні прояви та природний перебіг саркоїдозу.
У 1951 році вперше для лікування саркоїдозу були використані кортикостероїди (31, 32). Численні неконтрольовані дослідження підтвердили ефективність цього лікування (23, 25, 32–37). Інтерпретація ефективності гормональної терапії залишалася незрозумілою через високу частоту спонтанних ремісій, особливо на ранніх стадіях захворювання, при синдромі Лефгрена або ізольованій лімфаденопатії коренів легенів на рентгенограмах (22, 23, 25–27). У 1958 році Вурм (Wurm) і співавт. запропонували систему рентгенологічних стадій саркоїдозу (38), яка була прийнята клініцистами для прогнозування процесу (23, 25, 28, 29) і залишається широко використовуваною і по сьогодні. У наступні три десятиліття рандомізовані дослідження ролі кортикостероїдів у лікуванні легеневого саркоїдозу були засновані на цій рентгенологічній схемі розподілу пацієнтів на групи (39–46). У той час, як ці різноманітні дослідження не могли визначити роль і значення кортикостероїдів у зміні перебігу саркоїдозу, вони підтвердили неоднорідність клінічного перебігу захворювання та проявів його симптомів. У середині 1970-х років завдяки фібробронхоскопії стало можливим підтвердження діагнозу саркоїдозу при мінімальних ускладненнях і високій чутливості (47–49). Більш того, пошук імунних ефекторних клітин в рідині бронхоальвеолярного лаважу (БАЛ) під час бронхоскопії вельми сприяє розумінню патогенезу саркоїдозу та інших запальних змін в легенях (50–53).
До кінця 1960-х років науково-дослідні розробки та міжнародна увага до саркоїдозу були обмежені. Перша міжнародна зустріч із саркоїдозу була організована Джеймсом (Geraint James) в Лондоні в 1958 році, де зібралися всього 22 учасники (тільки запрошені) (2). Після першого обміну думками міжнародні зустрічі стали відбуватися кожні 3 роки (2). У 1963 році був створений Міжнародний комітет із саркоїдозу, аби створити більш широку основу для розвитку наукових та епідеміологічних досліджень (3). Різко збільшилася кількість досліджень і публікацій. На Сьомій міжнародній конференції в Нью-Йорку в 1975 році були визначені імунологічні аберації, властиві саркоїдозу (52), і рівень ангіотензин-перетворюючого ферменту (АПФ) в сироватці крові був вперше оцінений як можливий біохімічний маркер активного саркоїдозу (53). Наприкінці 1970-х і початку 80-х років розпочалося чимало досліджень, спрямованих на розуміння імунологічних, біохімічних і патогенетичних механізмів саркоїдозу (54, 55). Були встановлені такі факти, як особливості імунної відповіді, участь хелперів Т-лімфоцитів і активованих імунних ефекторних клітин у місці прояву активності хвороби (50, 51, 54, 55). Були проведені додаткові дослідження, спрямовані на виявлення «стадій» хвороби, такі як сканування з цитратом галію-67 (54, 56), дослідження рідини БАЛ (50, 51), проте клінічне значення цих досліджень залишилося суперечливим. За останні три десятиліття сотні наукових досліджень були присвячені імунологічним, патогенетичним і епідеміологічним аспектам саркоїдозу. На момент написання настанови був проведений пошук в MEDLINE, у якій із 1965 року налічувалося 6500 публікацій. Зросло і число наукових форумів, присвячених саркоїдозу. У 1984 році в Мілані Джіанфранко Різзато (Gianfranco Rizzato) створив журнал «Sarcoidosis» (2). У 1987 році на Конгресі із саркоїдозу в Мілані була утворена Всесвітня асоціація саркоїдозу та інших гранулематозних розладів (WASOG), замість існуючого раніше Міжнародного комітету (2). Ці досягнення забезпечили можливості для проведення спільних досліджень цього загадкового захворювання.
Епідеміологія
Саркоїдоз зустрічається у всьому світі, вражає представників обох статей незалежно від раси і віку. Епідеміологія саркоїдозу залишається проблематичною з низки міркувань: відсутність точного визначення хвороби, різноманітність методів виявлення, неоднорідність клінічних проявів, відсутність чутливих і специфічних діагностичних тестів, недоліки в системних епідеміологічних дослідженнях причин саркоїдозу (57). Хвороба схильна виникати у дорослих у віці до сорока років із піком захворюваності в 20–29 років (58). У Скандинавських країнах і в Японії існує другий пік захворюваності у жінок після 50 років (59–61). Більшість досліджень вказують на невелике переважання захворювання серед жінок. У єдиному популяційному дослідженні саркоїдозу в США захворюваність серед чоловіків становила 5,9 на 100 000 чоловік і 6,3 — серед жінок (62). На підставі оцінки кумулятивної захворюваності ризик захворіти на саркоїдоз протягом життя в США склав 0,85 % для білих і 2,4 % для афроамериканців (63). Поширеність саркоїдозу коливається від 1 до 40 випадків на 100 000. При вирівнюванні за віком захворюваність на саркоїдоз в США становить 35,5 на 100 000 на рік для афроамериканців і 10,9 на 100 000 для білих (62–64). Найбільша поширеність саркоїдозу у світі відзначена у Швеції, Данії і серед темношкірих мешканців США (65). Водночас саркоїдоз рідко зустрічається в Іспанії, Португалії, Індії, Саудівської Аравії та Південній Америці (65, 66), можливо, внаслідок відсутності програм масового виявлення та поширеності інших, більш часто розпізнаваних гранулематозних захворювань (туберкульоз, лепра, грибкові інфекції), що перешкоджає виявленню саркоїдозу.
Серед різних етнічних і расових груп відзначене значне розмаїття проявів хвороби та її тяжкості. Ряд робіт вказує на те, що серед чорношкірих саркоїдоз протікає важче, тоді як у білих частіше зустрічається безсимптомний перебіг (22, 25, 63, 67–70). Позалегеневі прояви більш типові для конкретних популяцій, такі як хронічний увеїт в афроамериканців, lupus pernio у пуерториканців і erythema nodosum у європейців. Вузлувата еритема при саркоїдозі не зустрічається у темношкірих і японців (71). Ураження серця й очей при саркоїдозі більш часто виявляють в Японії, де найбільш частою причиною смерті хворих на саркоїдоз є залучення в процес міокарда (60, 72, 73). В інших місцях хворі на саркоїдоз найчастіше помирають від дихальної недостатності (67, 74). Загальна смертність від саркоїдозу становить від 1 до 5 %.
Інтригуючим аспектом цього захворювання є питання про можливу передачу від однієї людини іншій або ж про загальні фактори впливу навколишнього середовища. У 1987 році було опубліковане дослідження випадок–контроль жителів острова Мен, в якому 40 % хворих на саркоїдоз відзначали контакт з іншими хворими на саркоїдоз, тоді як в контрольній групі таких було лише 2 % (75, 76). Серед контактних 14 пар мали спільне домашнє господарство і тільки 9 були кровними родичами. 9 пар перебували в контакті на робочому місці, 2 — були сусідами і 14 були друзями, які ніколи разом не жили. Інші описи випадків саркоїдозу в одружених парах припускають загальний екологічний або інфекційний вплив. Деякі дослідники виявили сезонність випадків саркоїдозу взимку і на початку весни (77, 78). Описано також географічні та просторові кластери захворювання, хоча помилки в класифікації і дизайні досліджень ускладнюють інтерпретацію цих даних. Раніше опубліковані дані про збільшення поширеності хвороби у сільській місцевості у південно-східній та центрально-атлантичній частинах США призвели до запровадження досліджень потенційної етіологічної ролі метеорологічних факторів, ґрунту, рослин, сосни, пилку, близькості до лісових масивів, водопостачання, використання дров, близькості лісозаготовчих і деревопереробних підприємств, впливу фермерських і домашніх тварин (79–87). Ні експерименти на тваринах, ні спостереження за людиною не довели правильності цих гіпотез.
Кілька робіт присвячені дослідженню професійних факторів ризику при саркоїдозі. У 1940-ві роки випадки «саркоїдозу» у жінок, зайнятих на виробництві флуоресцентних світильників у Салемі (Массачусетс), призвели до виявлення в цьому процесі ролі берилію як причини так званого «Салемського саркоїду». Пил інших металів, випари, дим, органічні антигени можуть викликати легеневий гранулематоз, який клінічно важко відрізнити від саркоїдозу. Це вказує на значимість ретельного професійного та екологічного анамнезу (88–90). У дослідженні острова Мен (91) було встановлено, що в 18,8 % випадків саркоїдозу хворі були працівниками сфери охорони здоров’я (частіше медичними сестрами), тоді як у контрольній групі таких було тільки 4,2 %. Це було відмічено в деяких інших роботах (92, 93). Можливо, це пов’язано з більш частими рентгенологічними обстеженнями медпрацівників. Опис трьох випадків саркоїдозу серед групи з 57 пожежників, які навчалися разом, вказує на значущість впливу оточуючих факторів (94). Достовірний зв’язок був встановлений між зростанням ризику розвитку саркоїдозу та службою у військово-морських силах США. Але, на думку вчених, це відображає лише більш часте профілактичне рентгенологічне дослідження органів грудної клітини (95). Саркоїдоз частіше зустрічається у некурців, ніж у курців (96–98). Ступінь впливу екологічних та професійних факторів на розвиток саркоїдозу повинні оцінити майбутні дослідження.
Є безліч повідомлень про сімейну кластеризацію саркоїдозу, яка у США набагато частіше зустрічається серед чорношкірих (з частотою не менш 19 % у сім’ях із чорношкірим подружжям), ніж серед білих (частота 5 %) (99). У Республіці Ірландія існує значна національна поширеність саркоїдозу, а також висока частота саркоїдозу (2,4 %) серед братів і сестер (100). Підвищена поширеність саркоїдозу відзначена в районі Фурано на півночі Японії з явною сімейною кластеризацією (101). HLA-аналіз в уражених сім’ях показав, що модель спадкування ризику розвитку саркоїдозу, ймовірно, полігенна, з найбільшою частотою генотипу класу I HLA-A1 і -B8 і класу II HLA-DR3 (102–104). Досить імовірно, що дія антигена, що є тригером посилення клітинної імунної відповіді, призводить до розвитку гранульом у генетично схильної людини.
Коментар робочої групи
Численні епідеміологічні дослідження показують, що саркоїдоз поширений у всьому світі, причому переважно в географічних зонах із помірним і холодним кліматом. У країнах Африки, Азії, Центральної та Південної Америки показники поширеності саркоїдозу найнижчі, в Скандинавських країнах — найвищі (Ількович М.М. Саркоїдоз органів дихання [Текст] / М.М. Ількович // Інтерстиціальні захворювання легенів. Керівництво для лікарів. під. ред. М.М. Ільковича, А.Н. Кокосова. — Санкт-Петербург: Нордмедиздат, 2005. — С. 288–289).
Разом з тим відомості літератури про вплив географічного чинника на рівень захворюваності на саркоїдоз до теперішнього часу не мали статистичних доказів. У зв’язку з цим у Національному інституті фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України було проведено дослідження залежності захворюваності на саркоїдоз в різних країнах Євроазіатського регіону від географічної широти на основі застосування кореляційно–регресійного аналізу. В результаті було отримано значення коефіцієнта кореляції r = 0,827. Коефіцієнт статистично значущий: p = 6,295 х 10–6; межі 95% довірчого інтервалу: 0,636–0,923. (Гаврисюк В.К. Заболеваемость саркоидозом органов дыхания: частота новых случаев в зависимости от географической широты [Текст] / В.К. Гаврисюк, Е.А. Меренкова, О.В. Шадрина, Е.А. Беренда, В.В. Куц // Укр. пульмонол. журнал. — 2013. — № 2(80). — С. 36–40).
Враховуючи отримані статистичні докази залежності захворюваності на саркоїдоз в різних країнах від їх географічної широти, було проведено порівняльне дослідження захворюваності та поширеності саркоїдозу органів дихання у південному (АР Крим) і північному (Житомирська область) регіонах України за даними звернень і результатами профілактичного рентгенологічного обстеження у 2011 році.
В АР Крим показник захворюваності склав 1,08 на 100 000 дорослого населення, показник поширеності — 4,59 на 100 000. У Житомирській області показник захворюваності (2,62 на 100 000) перевищував аналогічний в АР Крим у 2,4 раза, поширеність (7,86 на 100 000) була вище в 1,7 раза.
У зв’язку з тим, що кліматичний фактор є одним з тих, що визначають епідеміологію саркоїдозу, показники захворюваності та поширеності в південному і північному регіонах із великою часткою ймовірності можна вважати крайніми для областей України. Це дає підставу зробити висновок, що в цілому по Україні захворюваність на саркоїдоз органів дихання становить в середньому від 1,1 до 2,6 на 100 000 дорослого населення, а поширеність — від 4,6 до 7,9 на 100 000, що відповідає рівню південноєвропейських країн. Якщо враховувати, що доросле населення країни становить близько 38 млн осіб, то можна припустити, що щорічно в Україні реєструється близько 700 нових випадків саркоїдозу, а загальна кількість хворих з активним саркоїдозом становить близько 2500 тис. (Гаврисюк В.К. Заболеваемость саркоидозом органов дыхания в южном и северном регионах Украины в 2011 году [Текст] / В.К. Гаврисюк, Е.А. Меренкова, О.В. Шадрина, Е.А. Беренда // Укр. пульмонол. журнал. — 2013. — № 3(80). — С. 41–45).
Етіологія і патогенез саркоїдозу
Незважаючи на те, що причини розвитку саркоїдозу залишаються невідомими, є три найбільш ймовірних напрямки доказу значущості впливу фактора навколишнього середовища на генетично схильний організм: 1) вищезгадані епідеміологічні дослідження (75–93, 105), 2) запальна реакція при саркоїдозі, яка характеризується великою кількістю активованих макрофагів і T-лімфоцитів, що мають фенотип CD4-хелперів (50, 106), з властивістю виробляти цитокіни в легенях, що найближче до T-клітинної імунної відповіді, викликаної впливом антигена (107–111); 3) проведення досліджень, що стосуються рецепторів Т-клітин (TCR) у хворих на саркоїдоз (112–118).
Роль генетичних факторів
Той факт, що расова ознака є важливим фактором ризику розвитку саркоїдозу, очевидно вказує на генетичну схильність до розвитку саркоїдозу (63). Однак найбільш важливим аргументом генетичного механізму набуття цієї схильності є сімейні випадки захворювання (85). Загалом генетичні відмінності у генах-кандидатах, які можуть призвести до розвитку саркоїдозу, можуть розташовуватися в локусах, відповідальних за функцію Т-клітин, регулювання, розпізнавання й обробку антигенів або ж за регуляцію відкладення матриксу (матриці депонування), що призводить до утворення гранульом і прогресивного фіброзу (119). Однак також ймовірно, що генетичні фактори можуть бути важливими у визначенні ознак захворювання і його прогресування, так само як і прогнозу в цілому. Це проілюстровано дослідженнями взаємозв’язку між саркоїдозом і HLA фенотипом у двох різних країнах Європи — Чеській Республіці та Італії (120). Для обох країн був типовим прояв певних ознак саркоїдозу при наявності HLA-A1, -B8 і -DR3; тоді як негативний зв’язок був встановлений для фенотипів HLA-B12 і -DR4. Дані, які були обмежені однією країною, свідчили про системну дисемінацію захворювання при фенотипі HLA-B22 серед італійців і зв’язок інших специфічних проявів хвороби з HLA-B13 фенотипом серед неіталійців. У дослідженні з використанням геномічного типування в скандинавській популяції сприятливий прогноз був пов’язаний з DRI7 гаплотипом (119), тоді як DRI5 (112) і DRI6 (120) вказували на більш тривалий перебіг хвороби (121). DRI7 (119), який широко представлений у скандинавських хворих на саркоїдоз, також пов’язаний із хорошим результатом хвороби (103, 120). У цілком етнічно різнорідній популяції в Японії оцінка поліморфізму довжини фрагмента показала декілька обмежених фрагментів DR-бета гена лише у DRw52-позитивних хворих (122), у яких хвороба носила обмежений характер без ураження органа зору. На противагу цьому DR5J-позитивні японські хворі часто мали захворювання з низькою ймовірністю вилікування (123). Аналіз специфічності HLA дозволив здійснити етнічні порівняння і вивчити взаємозв’язок між HLA фенотипом і клінічним результатом.
Роль факторів навколишнього середовища
Оскільки причини саркоїдозу залишаються невідомими, список можливих причинних агентів продовжує розширюватися з того моменту, коли було висловлено припущення про роль вдихання пилку сосни. Деякі передбачувані чинники перераховані в таблиці 1.
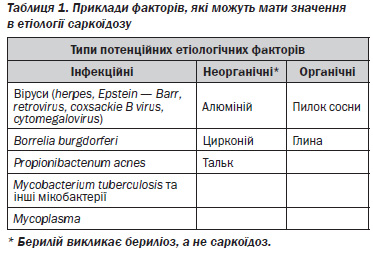
Вже в 1969 році Mitchell і Roes (124) припустили заразний агент в етіології саркоїдозу. З тих пір зустрічаються повідомлення, що підтверджують цю думку, включаючи дані про розвиток саркоїдозу у реципієнтів, яким була проведена трансплантація від хворого на саркоїдоз (105).
Деякі інфекційні агенти включені в список потенційних причин саркоїдозу, такі як віруси, Borrelia burgdorferi і Propionibacterium acnes (див. табл. 1). Водночас неінфекційні фактори навколишнього середовища можуть викликати гранулематозну реакцію з безліччю ознак, схожих на саркоїдоз, як, наприклад, берилій, алюміній і цирконій (89, 90, 125). Тому точність діагностики саркоїдозу залежить від ретельного опитування щодо потенційного контакту хворого з органічними і неорганічними антигенами. Зрештою, сам організм людини може бути потенційним джерелом антигенів, що індукують появу гранульом. Однак можливість того, що саркоїдоз є аутоімунним захворюванням, зараз вважається менш імовірною.
Оскільки гранулематозне запалення є гістологічною ознакою саркоїдозу, дослідники продовжують удосконалювати і застосовувати сучасні діагностичні засоби пошуку інфекційних чинників, таких як мікобактерії, можливість яких призводити до утворення гранульом добре відома (126). Дослідження в цьому напрямку проводяться десятиліттями, хоча їх техніка останнім часом набагато ускладнилася. Використовуючи різні методи та різні групи хворих, дослідники виявляли антитіла до мікобактерій в сироватці крові пацієнтів у 50–80 % випадків (127, 128), тоді як мало хто в контрольній групі мав позитивний результат. При відсутності специфічної сукупності ознак важко інтерпретувати цю інформацію, оскільки у хворих на саркоїдоз може відбуватися генералізований поліклональний синтез імуноглобулінів, що пояснює підвищення щодо норми титрів антитіл до багатьох типових антигенів. Неможливість виявити антимікобактеріальні антитіла або ріст культури мікобактерій при посіві не виключає цих збудників з патогенезу саркоїдозу, але це вимагає пошуку збудника безпосередньо в ураженій тканині. Виявлення туберкулостеаронової кислоти (129) і мурамілдипептиду (130) — компонентів клітинної стінки мікобактерії — в саркоїдних вузликах трактується як непряма ознака присутності мікобактерій, і кислототривкі L-форми (мікобактерій без клітинної стінки) були отримані з крові хворих на саркоїдоз (131). Але це все не є доказом інфекційної етіології саркоїдозу.
Пошук доказової бази стосовно інфекційного етіологічного фактора, особливо мікобактерій, стає все більш поширеним. Однак навіть при роботі на рівні молекулярних технологій, таких як високочутлива полімеразна ланцюгова реакція (ПЛР), суперечки не можуть бути остаточно вирішені. Переваги й недоліки цих методів ретельно описані Mangiapan і Hance (126). Вони вказали на необхідність обережності в інтерпретації як позитивних, так і негативних даних. Неможливість виявити мікобактерію може бути пов’язана з нечутливістю методів, тоді як позитивні результати можуть бути наслідком забруднення матеріалу. Подальші спостереження показали необхідність ретельного контролю зразків для оцінки частоти помилково-позитивних результатів. Нещодавні знахідки мікобактеріальної ДНК або рибосомальної РНК в зразках тканин або клітин рідини БАЛ, взятих від хворих на саркоїдоз, повинні бути інтерпретовані в цьому контексті (132, 133). У сукупності ці дані підтверджують наявність мікобактеріальної ДНК в більшості саркоїдних тканин, кількість мікобактерій при цьому невелика. З іншого боку, деякі хворі, яким поставлений діагноз саркоїдоз, можуть мати патологію, викликану мікобактеріальною інфекцією (126), так само як і в інших хворих на саркоїдоз можуть бути інші антигенні тригери хвороби.
Рецептори Т-клітин
Більшість Т-лімфоцитів використовують a/b TCR для розпізнавання антигенних пептидів у контексті молекул MHC, і різні ділянки TCR створені з декількох несуміжних ділянок гена. Було висловлено припущення, що дослідження рецепторів Т-клітин може вказати на існування Т-клітин з обмеженим використанням TCR, припускаючи, що специфічний антиген грає роль тригера у розвитку саркоїдозу (105, 113–118). Крім того, в експерименті на тваринах було показано, що Т-клітини зі значним обмеженням використання TCR V (змінного сегмента) гена можуть забезпечити експериментальну модель аутоімунного захворювання, і модуляція цих клітин може впливати на хворобу.
У цій стратегії ідентифікації саркоїдозного антигену потенційною проблемою є те, що тривалість захворювання може впливати на використання TCR, приводячи до більш гетерогенної Т-клітинної відповіді на пізніх етапах хвороби. Згодом, оскільки початок захворювання при саркоїдозі досить підступний, важко оцінити можливий вплив тривалості хвороби на гетерогенність Т-клітинної відповіді. Крім того, варіації використання TCR V гена, які відзначені у різних групах, можуть бути пов’язані з відмінностями етнічної природи тих популяцій, які входили у групи дослідження. Хоча багато даних в цій області звучать обнадійливо, залишається неясним, наскільки вони корисні у визначенні етіології саркоїдозу.
Імунологія
Рання саркоїдна реакція характеризується скупченням активованих Т-клітин і макрофагів у місці розвитку запалення, найчастіше в легенях (50, 106) (табл. 2). Вивчення саркоїдних Т-лімфоцитів в уражених ділянках показали, що у більшості хворих клітини відносяться до Т-хелперів з CD4 фенотипом; в рідкісних випадках переважають CD8-лімфоцити (134). Ці клітини спонтанно виділяють інтерферон-гамма (ІFN-γ) та інтерлейкінγ2 (ILγ2), а також інші цитокіни (107, 108). Надалі саркоїдні альвеолярні макрофаги (АМ) поводять себе як універсальні секреторні клітини, що виділяють велику кількість різних цитокінів, включаючи фактор некрозу пухлини альфа (TNF-α), IL-12, IL-15 і фактор росту (109–111, 135).
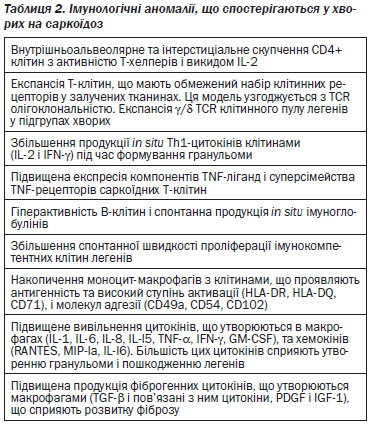
Скупчення імунокомпетентних клітин відображає найбільш ранній етап у серії подій, які ведуть до утворення гранульоми. Цей процес активують CD45RO+ Th1-типу T-лімфоцити як центральні клітини в розвитку даного феномена. З патогенетичної точки зору слід розглядати два механізми збільшення кількості клітин в тканині, залученій у запальний саркоїдний процес: перерозподіл клітин з периферичної крові в легені і проліферація in situ (136–138). Реалізація першого механізму опосередкована цитокінами хемоатрактантами (включаючи IL-8, IL-15, IL-16 і RANTES регуляцію активації, експресію нормальних Т-клітин і секрецію), які взаємодіють для розширення внутрішньоальвеолярного пулу CD4+ клітин пам’яті в середині області запалення (111, 139–141). Другий механізм, відповідальний за накопичення CD4+ Т-хелперів в місці утворення гранульоми, полягає у IL-2-опосередкованій проліферації in situ. Велика кількість GAL-лімфоцитів у хворих на саркоїдоз є CD4+/HLA-DR+ T-клітинами, що спонтанно виділяють IL-2 і викликають експресію функціональної IL-2 рецепторної системи (111, 142, 143). Різні дослідження показують, що IL-2 діє як локальний чинник зростання для Т-–лімфоцитів, які інфільтрують паренхіму легені та інші уражені саркоїдозом тканини (144, 145). В Т-клітинах, отриманих від хворих на активний саркоїдоз, також виявлено підвищення рівня mРНК і рівня білка ІФН-γ, проліферацію активованих Т-клітин і залучення в диференціацію клітин Th0 в клітини Th1 (110). Таким чином, клітинна відповідь Thl-клітин (секреція IL-2, IL-12, ІFN-γ і TNF-β) найбільш ймовірно сприяє гранулематозній відповіді в місці активності хвороби.
Жодне дослідження не дало відповіді на питання, чому в одних пацієнтів хвороба зберігається, а в інших ні. Більше того, жодна робота не показала, як персистуюча хвороба призводить до ураження легенів і фіброзу. Однак імунологічні ознаки клітин саркоїдного інфільтрату вказують на те, що:
1) саркоїдна гранульома утворюється у відповідь на антигенний стимул, що зберігається і, ймовірно, мало деградує, і який індукує локальну Th1-типу опосередковану Т-клітину імунну відповідь з олігоклональними ознаками; дійсно, ці клітини мають схильність (113–116) до експресії генів α- і β-ланцюгів різних ділянок рецепторів Т-клітин (TCR);
2) внаслідок їх хронічної стимуляції макрофаги викидають медіатори запалення локально, що призводить до скупчення Th1-клітин в місці розвитку запалення і сприяє розвитку структури гранульоми.
Експериментальні дані на підставі моделі Schistosoma mansoni вказують на можливість існування механізму, який призводить до утворення фіброзу при персистуючій хворобі, тобто відбувається зміщення цитокінової моделі з Th1 до Th2 фенотипу із секрецією IL-4, IL-5, IL-6, IL-9 і IL-10. У моделі це призводило до фібропроліферативної відповіді зі значним позаклітинним депонуванням матриксу і подальшим розвитком до легеневого фіброзу (146). При саркоїдозі постійна Th1-відповідь може асоціюватися з фіброзом. Дослідження Th1/Th2 секреторної моделі у людини в різні фази саркоїдозного запального процесу потребують уточнення імунного механізму, який управляє змінами матриксу при цьому захворюванні.
Для розуміння патогенезу саркоїдозу необхідно досягнення й іншої мети імунологічних досліджень, що включає в себе ідентифікацію дискретних маркерів (поверхневих антигенів, продукції цитокінів і т.д.), що може бути корисно для лікування хворих не тільки в плані прогнозу, але також і для точного виділення різних фаз захворювання.
Коментар робочої групи
Для саркоїдозу є притаманним так званий «імунний парадокс», який характеризується, з одного боку, інтенсивною Th1-відповіддю (Т-хелперною відповіддю за 1-м типом) у місті запалення, а з іншого — станом анергії при відповіді на загальні антигени [8, 9].
Перше супроводжується активацією та проліферацією CD4+ Th1-лімфоцитів та мононуклеарних фагоцитів, призводить до формування неказеозних гранульом [10] і проявляється, зокрема, зростанням відношення CD4+ дo CD8+ T-клітин у місцях запалення від 3,5 : 1 дo 15 : 1 майже у 50 % випадків (у здорових — 2 : 1) [11, 12].
Друге виражається пригніченням реакцій гіперчутливості уповільненого типу, що пояснюють розширенням підгрупи CD25brіght FOXP3+ регуляторних T-клітин (мають антипроліферативну спроможність) при активному саркоїдозі [8, 15] і, зокрема, приводить до пригнічення системних імунних реакцій, наприклад, при проведенні вакцинації (зниження ефективності), а також імунологічних та шкірних тестів, у тому числі туберкульозних [13–16].
Передбачається, що вихід гранулематозного процесу до розсмоктування або фіброзування залежить від переваги відповідно Th1- або Th2-Т-клітинні відповіді [12, 17].
На формування Th1- або Th2-відповіді при саркоїдозі впливає також активність Th17 лімфоцитів, які асоціюються з аутоімунними процесами і формуванням гранульом [18].
При активному саркоїдозі визначається зростання рівня IL-17 and IL-23R у периферичній крові, бронхоальвеолярному змиві (БАЗ), а також в легенях та лімфатичних вузлах, що може обумовлювати прогресування захворювання [12, 19].
Встановлено, що розвиток пневмофіброзу пов’язаний з виразною активністю TGF-, IGF-1, MMPs (matrix metalloproteinases із дендритних клітин) [20, 21], а також альвеолярних макрофагів з М2 фенотипом, які підвищують експресію CCL-18 [22].
Саркоїдоз характеризується також поліклональною гіпергаммаглобулінемією та зростанням рівня циркулюючих імунних комплексів в крові, що спостерігається в 20–80 % випадків і може бути результатом неспецифічної активації В-клітин активованими Т-хелперами [23].
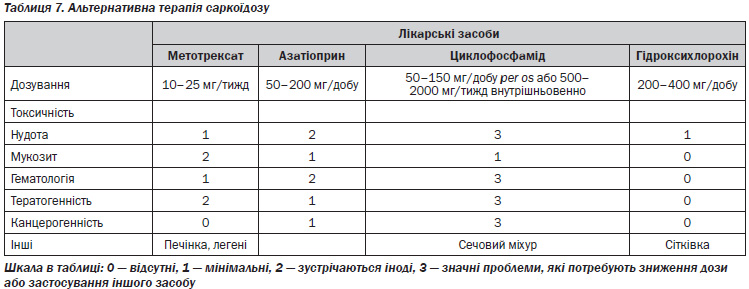
У якості імунологічних маркерів активності хвороби можуть розглядатися наступні показники:
— у бронхоальвеолярному змиві (БАЗ) при активному саркоїдозі спостерігається підвищення співвідношення CD4+/CD8+ клітин > 3,5 (у здорових — 2 : 1) (чутливість 53 %, специфічність 94 %, а при більш високому коефіцієнті досягає 100 %) [12, 24];
— розчинний сироватковий IL-2 receptor (sIL-2R) (Т-клітинний рецептор для IL-2), який можливо використовувати як маркер погіршення перебігу хвороби [25, 26];
— неоптерин (метаболіт гуанозинтрифосфату, який виділяють активовані макрофаги у відповідь на IFN-γ), який визначають в крові або сечі хворих (для моніторингу хвороби) [11];
— лізоцим (його джерелом є макрофаги та епітеліоїдні гігантськи клітини, які беруть участь у формуванні гранульом), який корелює з активністю патологічного процесу і продукцією ангіотензинперетворюючого фактора (АПФ); його рівень в крові підвищується у 30–60 % хворих; може використовуватись для моніторингу хвороби [11, 27, 28];
— плазмова хітотріозидаза (член групи ферментів, які беруть участь у руйнуванні хітину); характеризує стан хронічного гіперзапалення та може бути маркером тяжкості гранулематозного запалення з ризиком фіброзування легеневої тканини [29, 30] та інші показники.
Аналіз конденсату повітря, що видихається, є дуже перспективним способом для застосування в практиці, оскільки (при наявності відповідного обладнання) є простим неінвазивним способом для одержання багатьох імунологічних, біохімічних показників, які можуть допомогти в постановці діагнозу та моніторингу саркоїдозу [12].
Патологія
Саркоїдна гранульома
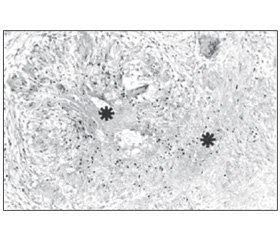
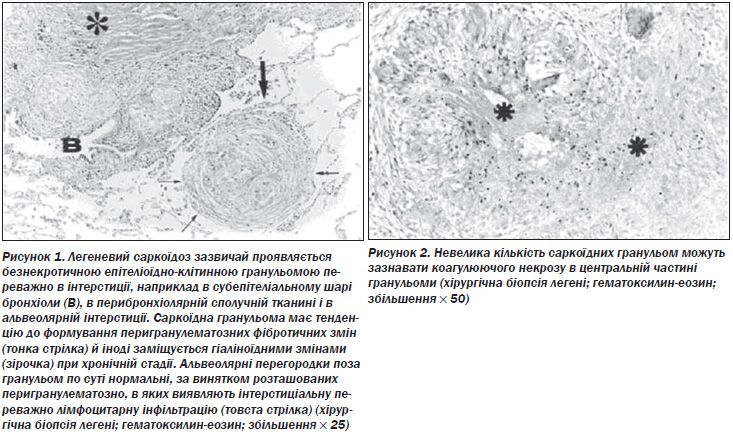
Морфологія і компоненти. Характерною патологічною ознакою саркоїдозу є дискретна, компактна, неказеозна епітеліоїдно-клітинна гранульома, що складається з високодиференційованих мононуклеарних (одноядерних) фагоцитів (епітеліоїдних і гігантських клітин) і лімфоцитів. Гігантські клітини можуть містити цитоплазматичні включення, такі як астероїдні тільця і тільця Шаумана (21, 147–50). Центральна частина гранульоми складається переважно з CD4+ лімфоцитів, тоді як CD8+ лімфоцити представлені в периферійній зоні (148, 150). Саркоїдна гранульома може зазнавати фібротичних змін, які зазвичай починаються з периферії і просуваються до центру, завершуючись повним фіброзом і/або гіалінізацією (рис. 1). Іноді в гранульомі виникає фокальний коагуляційний некроз (148) (рис. 2). Це свідчить про те, що некротизуючий саркоїдний гранулематоз може бути варіантом саркоїдозу (150, 151). При електронній мікроскопії в добре розвинених епітеліоїдних клітинах можна виявити численні ендоплазматичні вирости з частим переплетінням. Морфологічно підтверджується секреторна функція (148, 149).
Локалізація і розподіл. Лімфатичні вузли (особливо внутрішньогрудні), легені, печінка, селезінка є типовими місцями локалізації саркоїдних гранульом, які мають подібну природу в будь-якому з цих органів (21, 72, 148–150, 152). У легенях приблизно 75 % гранульом тісно прилягають або знаходяться в середині сполучної тканини навколо бронхіол, або субплеврально, або в перилобулярних просторах (лімфангітичний розподіл) (147, 150, 153). Ураження судин спостерігається більш ніж у половини хворих при відкритій біопсії легенів або аутопсії (147, 148, 150, 154).
Зміна гранульом у часі. Саркоїдні гранульоми або розсмоктуються, або зазнають фіброзних змін. Кінцева стадія саркоїдозу супроводжується фіброзом паренхіми і «сотовою конструкцією» легенів. Фактори, що впливають на розвиток фіброзу, поки що не цілком зрозумілі (148, 150).
Гістологічна діагностика саркоїдозу
Зважаючи на відсутність знань про етіологію саркоїдозу, цей діагноз ставиться при наявності клініко-рентгенологічних даних, підтверджених гістологічним виявленням гранульом. Зважаючи на важливість диференціальної діагностики з інфекційними захворюваннями, необхідні мікробіологічні дослідження та дослідження культур, особливо якщо у хворого лихоманка або в біоптатах є некротичні зміни. Спеціальне фарбування для виявлення кислототривких бацил і грибків. Для діагностики інформативним є фарбування матеріалу для виявлення кислототривких бацил і грибків, особливо за наявності таких атипових ознак саркоїдозу, як некроз або домінування повітряних просторів над гранульомами (147–150) (табл. 3).
Діагностика саркоїдозу легенів. Морфологічний діагноз саркоїдозу легенів заснований на трьох головних ознаках: наявності добре сформованих гранульом та обідка лімфоцитів і фібробластів по зовнішньому її краю; перилімфатичному інтерстиціальному розподілі гранульом (що дозволяє проведення трансбронхіальної біопсії як чутливого діагностичного методу) і виключенні інших причин утворення гранульом (147, 155, 156).
Діагностика позалегеневого саркоїдозу. Диференціальна діагностика саркоїдних гранульом проводиться на підставі даних біопсії з різних уражених ділянок, наприклад лімфатичних вузлів, шкіри, печінки, кісткового мозку і селезінки (l57–166).
Саркоїдні реакції, пов’язані з пухлинами. При карциномах в регіональних лімфатичних вузлах можуть спостерігатися епітеліоїдноклітинні гранульоми неказеоного вигляду (саркоїдні реакції) в середньому з частотою 4,4 % (167, 168). Біоптати печінки і селезінки, отримані при лапаротомії у хворих з хворобою Ходжкіна (Hodgkin) і неходжкінською лімфомою, виявляють епітеліоїдноклітинні гранульоми в середньому в 13,8 і 7,3 % випадків відповідно (167, 168). У 3–7 % хворих з карциномами гранульоми виявляють у первинній пухлині (167), як при семіномах і дисгерміномах (169, 170).
Гранулематозне порушення невідомого значення (Granulomatous lesions of unknown significance, GLUS-синдром). 15–20 % біоптатів містять гранульоми невизначеної етіології. У пацієнтів такий процес хвороби називають GLUS-синдромом (171). Імуногістологічно гранульоми з GLUS-синдромом є позитивними відносно B-клітин, так само як і саркоїдні реакції, пов’язані з пухлиною і токсоплазмоз. При саркоїдозі та мікобактеріальних інфекціях гранульоми не містять B-клітин (172).
Клінічні прояви та ураження органів
Саркоїдоз є мультиорганною патологією. Через розмаїття його проявів хворі на саркоїдоз можуть звертатися до різних спеціалістів. Клінічна картина захворювання залежить від етнічної приналежності, тривалості процесу, локалізації і поширеності на органи, а також активності (60, 173–175).
Неспецифічні загальні прояви
Неспецифічні конституціональні симптоми, такі як лихоманка, слабкість, нездужання і втрата маси тіла, можуть зустрічатися приблизно у третини хворих на саркоїдоз. Найчастіше лихоманка невисока, але зустрічаються випадки підвищення температури до 39–40 °C. Втрата ваги зазвичай складає 2–6 кг протягом 10–12 тижнів перед виявленням. Втома може бути дуже вираженою, аж до нездатності працювати. Іноді відзначається нічна пітливість. Конституціональні симптоми частіше відзначалися у афроамериканців і азійських індійців, ніж серед білих і інших представників Азії. Саркоїдоз є важливою частою нерозпізнаною причиною лихоманки неясного генезу (FUO) (176). GLUS-синдром також має деякі ознаки саркоїдозу, такі як лихоманка і гепатоспленомегалія (171).
Ознаки, пов’язані з ураженням певних органів
Легені. Ураження легенів зустрічається більш ніж у 90 % випадків саркоїдозу. Задишка, сухий кашель і біль у грудях характерні для третини і навіть для половини хворих. Хоча ретростернальна локалізація болю в грудях може бути лише наслідком неоднорідності грудної клітки (нерівномірної напруги), цей симптом може бути важким і не відрізнятись від серцевого болю (177). Легеневі кровотечі зустрічаються рідко. Потовщення кінцевих фаланг пальців зустрічається рідко, а потріскування в легенях відзначено менш ніж у 20 % хворих.
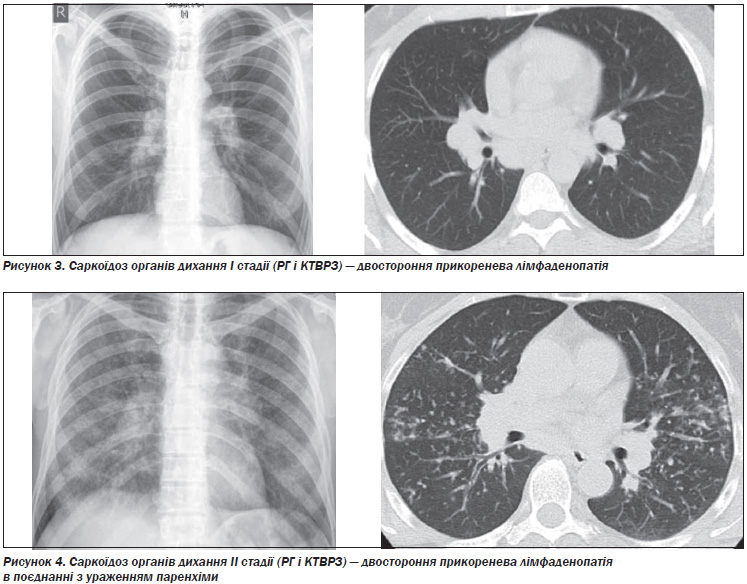
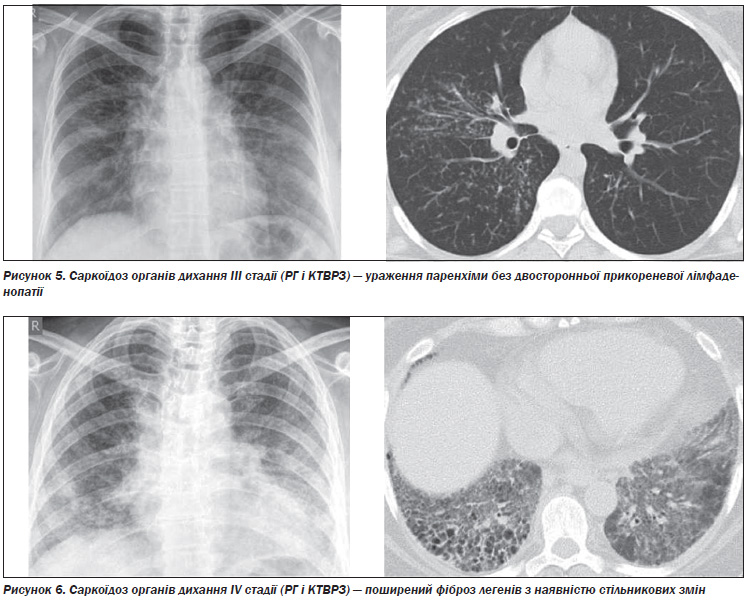
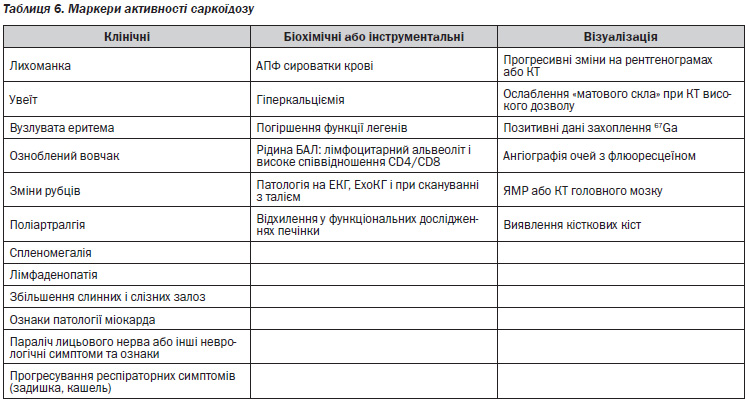
Виділяють п’ять рентгенологічних стадій внутрішньогрудних змін при саркоїдозі (табл. 4). При стадії 0 видимих змін на рентгенограмі органів грудної клітки немає. Стадія I — двостороння лімфаденопатія коренів легенів, яка може супроводжуватися паратрахеальною лімфаденопатією. Хоча поля легенів не містять інфільтратів, при біопсії легені можна виявити гранульоми в паренхімі. Стадія II — двостороння лімфаденопатія коренів легенів, ускладнена інфільтрацією паренхіми легені. Стадія III — інфільтрація паренхіми легені без аденопатії. Стадія IV представлена поширеним фіброзом з наявністю стільникових змін, підтягнення коренів, булл, кіст і емфіземи.

Хоча захворювання паренхіми легенів частіші, можуть бути уражені і дихальні шляхи (гортань, трахея і бронхи), призводячи до обструкції і бронхоектазії. Гіперреактивність дихальних шляхів відзначена більш ніж у 20 % хворих (178). Інші нетипові прояви включають плевральний випіт, хілоторакс, пневмоторакс, потовщення і кальцифікацію плеври, кальцинацію лімфатичних вузлів і утворення порожнин (179).
Класифікація заснована тільки на даних прямої оглядової рентгенограми органів грудної клітки. Іноді дані КТ і сканування легенів з 67Ga дають інформацію, яка вказує на відмінності в приналежності до тієї чи іншої стадії. Стадійність процесу залишається відкритим питанням, але поки немає причин змінювати підхід, оскільки КТ і сканування з галієм показані не всім хворим.
Коментар робочої групи
На рис. 3–6 представлені характерні зміни на рентгенограмах органів дихання (РГ) та комп’ютерних томограмах високої роздільної здатності (КТВРЗ) у хворих з різними стадіями саркоїдозу органів дихання (Гаврисюк, В.К. Саркоїдоз органів дихання [Текст] / В.К. Гаврисюк // Здоров’я України: Медична газета: Пульмонологія. Алергологія. Риноларингологія. — 2010. — № 2. — С. 29–31).
Лімфаденопатія характеризується збільшенням лімфатичних вузлів, розташованих у воротах легенів, в препаратрахеальних і правому паратрахеальному середостінні, в аорто-легеневому вікні, субкаринально і, менш часто, в передньому і задньому середостінні. Проте на РГ легенів можна виявити тільки паратрахеальні і внутрішньогрудні лімфатичні вузли, розташовані в аорто–легеневому вікні. Для виявлення ураження інших лімфатичних вузлів зазвичай необхідна КТ (Verschakelen J.A. Chapter 18. Sarcoidosis: imaging features [Text] / J.A. Verschakelen // European Respiratory Society Monograph. 2005; 32 (Sarcoidosis): 265–283).
Найбільш характерними на РГ ураженнями паренхіми легенів при саркоїдозі є ретикулярні, ретикуловузлові або фокальні тіні. Менш звичайні зливні області та множинні, добре сформовані вузли. Зразки «матового скла» спостерігаються рідко. В термінальній стадії можуть спостерігатися широкі септальні смуги зі спотворенням архітектури, ретракією, втратою об’єму верхньої частини і, нарешті, стільникові легені з великими буллами.
Особливості паренхіматозного ураження при саркоїдозі на КТ залежать від стадії хвороби і від того, якою мірою хвороба є хронічною. Вузли розміром від 2 мм до 1 см — найбільш часте ураження паренхіми. Ці вузли є сукупністю гранульом з або без перибронхіального фіброзу. Вони зазвичай добре сформовані, мають нерівні краї і зазвичай розташовуються уздовж великих і малих бронховаскулярних пучків, меншою мірою субплеврально, в міждолькових перегородках і центролобулярних (Verschakelen J.A. Chapter 18. Sarcoidosis: imaging features [Text] / J.A. Verschakelen // European Respiratory Society Monograph. 2005; 32 (Sarcoidosis): 265–283).
Лімфатична система. Приблизно у третини хворих на саркоїдоз можна пропальпувати периферичні лімфатичні вузли. Найчастіше це шийні, аксилярні, епітрохлеарні та пахові лімфатичні вузли. На шиї частіше уражаються лімфатичні вузли заднього трикутника, ніж переднього. Збільшені вузли дискретні, рухливі, безболісні. Вони не призводять до виразок і не утворюють дренуючих каверн. Збільшення селезінки зазвичай мінімальне або безсимптомне,
Серце. Клінічні прояви ураження міокарда можна зустріти приблизно у 5 % хворих на саркоїдоз (60). Проте при розтині їх виявляють частіше. Перебіг цієї патології неоднорідний і варіює від доброякісної аритмії або серцевих блокад різного ступеня до раптової смерті. Звичайна ЕКГ може залишатися нормальною, тоді як моніторування холтером виявляє шлуночкову тахікардію, блокаду серця або ектопічні шлуночкові скорочення. Допплерівська ехокардіографія дозволяє виявити діастолічну дисфункцію, проте сканування з талієм-201 більш інформативне для виявлення сегментарних порушень скоротливості (181). Зображення міокарда, отримане за допомогою талію-201, виявляє сегментарну дисфункцію, викликану як гранулематозним ураженням, так і фіброзним рубцем. Клінічна значущість виявленої таким способом патології у безсимптомних пацієнтів поки невідома. Тривале спостереження показує, що ризик порушення функції серця або раптової смерті у них невеликий (182). Коронарографія показана для виключення ураження вінцевих артерій у випадках, коли сканування з талієм-201 виявило ураження серця. Виявлення гранульом при ендоміокардіальній біопсії дозволяє підтвердити діагноз саркоїдозу серця, але діагностична цінність процедури низька, зважаючи на негомогенний розподіл гранульом у міокарді. Тому хворих з саркоїдозом і порушенням функції серця, ЕКГ-відхиленням або дефектами при скануванні з талієм-201 слід відносити до хворих з саркоїдозом серця навіть за відсутності гранульом у біоптатах ендоміокарда.
Печінка. Хоча гранульоми можна виявити в 50–80 % біоптатів печінки, пальпація печінки можлива менш ніж у 20 % пацієнтів (22, 183–185). Ураження печінки рідко призводить до портальної гіпертензії, печінкової недостатності та збільшення смертності, пов’язаної з дисфункцією печінки. У той же час досить типові відхилення в функціональних пробах печінки (175, 186). Безсимптомні хворі з ізольованим саркоїдозом печінки і помірним порушенням функцій печінки лікування не потребують. Кортикостероїди можуть покращити тяжкі порушення функції печінки (183, 187, 188).
Шкіра. Ураження шкіри зустрічається приблизно у 25 % пацієнтів (189). Відомі два клінічно важливих ураження шкіри, які легко розпізнаються: вузлувата еритема й озноблений вовчак (lupus pernio). Вузлувата еритема — ознака гострого саркоїдозу — зазвичай зустрічається у європейців, пуерторіканців і мексиканців, особливо у жінок дітородного віку. Вузлувата еритема рідкісна серед японців і афроамериканців. Ураження представляє собою піднятих червоних щільних шишок або вузлів на передніх поверхнях ніг. Наявність гранульом у біоптатах для цих уражень не характерна. Прилеглі суглоби зазвичай запалені і болючі. Вузлувата еритема зазвичай полегшується протягом 6–8 тижнів. Епізоди рецидивів вузлуватої еритеми зустрічаються нечасто (190). Синдром Лефгрена представлений лихоманкою, двосторонньою лімфаденопатією, вузлуватою еритемою і артралгією (20). Озноблений вовчак супроводжує хронічний саркоїдоз і представляє індуративні бляшки із зміною кольору на носі, щоках, губах і вухах. Ці зміни більш типові для афроамериканських жінок. Часто уражається слизова носа. Озноблений вовчак часто буває одночасно з кістами кісток і фіброзом легенів. Перебіг саркоїдозу з ознобленим вовчаком тривалий; спонтанні ремісії рідкісні. Інші шкірні зміни при саркоїдозі включають атеросклеротичні ураження тканин, макуло-папулярні висипання, підшкірні вузли, зміни в області старих рубців, алопецію, гіпер- або гіпопігментацію окремих ділянок шкіри. Як правило, хронічні саркоїдозні зміни шкіри не супроводжуються болем або свербінням і не призводять до виразок.
Порушення зору. Ураження очей зустрічається у 11–83 % хворих на саркоїдоз (175). Може бути уражена будь-яка частина ока або очниці; найчастішим ураженням при саркоїдозі є увеїт. Гострий передній увеїт проходить спонтанно або після місцевого застосування кортикостероїдів (очні краплі); хронічний увеїт може призводити до злипання райдужної оболонки і кришталика, приводячи до глаукоми, катаракти і сліпоти. Флюоресцентна ангіографія є чутливим методом виявлення ураження мікросудин і повинна бути проведена при підозрі на задній увеїт (191). Іншими патологічними змінами можуть бути фолікули кон’юнктиви, збільшення слізних залоз, сухий кератокон’юнктивіт, дакріо-цистит і ретинальний васкуліт сітківки.
Нейросаркоїдоз. Ураження нервової системи, яке можна клінічно розпізнати, зустрічається менш ніж у 10 % хворих на саркоїдоз (192, 193). Хвороба має схильність уражати основу мозку. Характерне ураження нервів черепа, особливо параліч лицьового нерва, ураження гіпоталамуса і гіпофіза. Ці ураження можуть з’являтися на ранніх стадіях і добре піддаються лікуванню (194). Маси, які займають великий простір, периферична невропатія та нервово–м’язові розлади виникають пізніше і вказують на хронічний перебіг. Рівні сироваткового ангіотензин-перетворюючого ферменту мають невелике значення. Як КТ, так і ЯМР можуть бути використані для підтвердження діагнозу нейросаркоїдозу. Слід віддати перевагу ЯМР з гадолінієм для дослідження паренхіми мозку, мозкових оболонок і спинного мозку. Проте прояви на ЯМР неспецифічні (195). При можливості необхідно всі зусилля спрямувати на гістологічне підтвердження діагнозу. У спинномозковій рідині (СМР) виявляють лімфоцитоз і підвищення білка приблизно у 80 % пацієнтів з нейросаркоїдозом. Інші ознаки нейросаркоїдозу в СМР включають підвищений рівень АПФ (приблизно у половини хворих), лізоцим і бета-2-макроглобулін, а також підвищення співвідношення CD4/CD8 (175). Дослідження СМР також важливе для виключення туберкульозу та грибкових інфекцій.
Опорно-рухова система. Якщо біль у суглобах зустрічається в 25–39 % випадків саркоїдозу, то деформуючий артрит зустрічається рідко (179). Найчастіше уражаються колінні суглоби, щиколотки, лікті, зап’ястя, дрібні суглоби рук і ніг. Ураження суглобів можуть бути гострими і минущими або хронічними і постійними. Симптоматичні ураження м’язів рідкісні. Хронічна міопатія виникає частіше у жінок і може бути єдиним проявом захворювання. Слід пам’ятати про міопатію, яку викликає лікування кортикостероїдами, особливо такий прояв, як слабкість проксимальних м’язів. Біопсія синовіальної оболонки або м’язів в місці ураження може виявити неказеозні гранульоми (196). Кістозні зміни кісток бувають тільки в поєднанні з ураженнями шкіри (189).
Шлунково-кишковий тракт (ШКТ). Частота ураження ШКТ складає менш ніж 1 %. Найбільш часто уражається шлунок. Менш часто саркоїдоз зачіпає стравохід, апендикс, пряму кишку і підшлункову залозу. Саркоїдоз ШКТ може нагадувати хворобу Крона, туберкульоз, грибкові ураження і новоутворення підшлункової залози.
Гематологічна патологія. Гематологічні відхилення, особливо червоної та білої крові, зустрічаються часто, але не патогномонічні. Анемія (гемоглобін менше 110 г/л) зустрічається у 3–20 % хворих на саркоїдоз. Гемолітична анемія рідкісна. Лейкопенія відзначена у 40 % хворих, але вона рідко буває важкою (186). За відсутності спленомегалії лейкопенія може відображати залучення в процес кісткового мозку, хоча основною причиною лейкопенії вважають перерозподіл Т-клітин периферичної крові в місці хвороби (22, 51, 199). Лейкемоїдна реакція, еозинофілія та тромбоцитопенія зустрічаються рідко.
Привушні залози. Поєднання лихоманки, збільшення привушних залоз, передній увеїт і параліч лицьового нерва називають синдромом Хеерфордта (Heerfordt). Менш ніж у 6 % хворих зустрічається односторонній або двосторонній паротит, що виявляється набряком і хворобливістю залоз. Приблизно в 40 % випадків паротит зникає спонтанно.
Прояви з боку ендокринної системи. Гіперкальціємія виникає у 2–10 % хворих на саркоїдоз, гіперкальціурія зустрічається приблизно в 3 рази частіше (200, 201). Ця патологія є наслідком порушення регуляції продукції 1,25-(OH)2-D3 (кальцитріол) активованими макрофагами і клітинами гранульоми (200, 201). Нерозпізнана постійна гіперкальціємія і гіперкальціурія можуть призвести до нефрокальцинозу, каміння в нирках і ниркової недостатності (202). Внаслідок ураження гіпофіза і гіпоталамуса може розвинутися нецукровий діабет. Рідко зустрічаються гіпо- та гіпертиреоїдизм, гіпотермія, пригнічення функції кори надниркових залоз і залучення передньої долі гіпофіза (203).
Репродуктивні органи. Безсимптомні гранульоми можуть виникати в будь-якій ділянці жіночої репродуктивної системи, включаючи молочну залозу. Найбільш часто буває вражена матка. Чоловічі статеві органи уражаються рідко. Проте при підозрі на злоякісні ураження сім’яників третина хворих з цим типом ураження можуть бути піддані непотрібній орхіектомії (204).
Нирки. У рідкісних випадках гранулематозний процес може безпосередньо вражати нирки і викликати інтерстиціальний нефрит. Набагато частіше ниркова недостатність розвивається внаслідок гіперкальціємії і нефрокальцинозу. Саркоїдоз нирок може нагадувати пухлину (205, 206).
Специфічні ситуації
Саркоїдоз у дітей. Kendig проаналізував 104 випадки у пацієнтів віком 15 років і молодше і показав, що ураження органів у дітей аналогічне таким у дорослих (207). Діагноз саркоїдозу слід розглядати у дітей будь-якого віку з шкірними висипаннями, увеїтом, лімфаденопатією і ураженням легенів. Прогноз у дітей більш оптимістичний, ніж у дорослих (208).
Саркоїдоз і вагітність. Саркоїдоз не впливає несприятливо на вагітність, але може загострюватися після пологів, тому протягом 6 місяців після пологів необхідно провести контрольну рентгенограму. Частота спонтанних абортів, невиношування і вроджених аномалій плода у хворих на саркоїдоз не відрізняється від таких у жінок без саркоїдозу (184, 209).
Саркоїдоз у літніх людей. Хоча багато хворих на саркоїдоз доживають до похилого віку, лише у небагатьох з тих, кому за 65 років, саркоїдоз виявляється вперше. При спостереженні таких пацієнтів важливо мати на увазі, що злоякісні новоутворення легенів, шлунка, кишечника і навіть матки призводять до почастішання гранулематозних реакцій у дренуючих лімфатичних вузлах. Ця локальна саркоїдна реакція повинна бути диференційована від мультисистемного саркоїдозу.
Діагностичні підходи
Діагноз саркоїдозу вимагає порівнянної клінічної картини, гістологічних доказів наявності неказеозних гранульом і виключення інших захворювань, здатних продукувати подібну клінічну або гістологічну картину. Наявність неказеозних гранульом тільки в одному такому органі, як шкіра, не дозволяє ставити діагноз. Діагностичний процес при саркоїдозі передбачає досягнення чотирьох цілей: 1) забезпечити гістологічне підтвердження наявності захворювання, 2) визначити поширеність і тяжкість захворювання; 3) оцінити перебіг захворювання — стабільний або прогресуючий; 4) оцінити доцільність проведення лікування.
Біопсія
При наявності відповідної клінічної картини першим кроком є визначення місця для проведення біопсії. У більшості випадків рекомендується трансбронхіальна біопсія легені (ТБЛ). Діагностичні результати методу залежать від досвіду оператора і коливаються від 40 до 90 %, якщо береться 4–5 біоптатів (212). Ризик процедури в досвідчених руках низький.
Ретельне обстеження хворого може виявити інші можливі місця для взяття біоптатів, наприклад шкіру, губи або поверхнево розташовані лімфатичні вузли. Дуже інформативним місцем для взяття біоптату є грануляція рубця (свіжа гранулематознозна реакція в місцях старих рубців). Біопсія ділянок вузлуватої еритеми марна, оскільки в ній немає гранульом. Біопсія печінки показана рідко, тільки коли є клінічні або біохімічні ознаки її ураження. В даний час більше не рекомендується прискалена біопсія. У деяких випадках місце взяття біоптату може бути встановлено при скануванні з 67Ga (213, 214).
У випадках, коли бронхіальна або трансбронхіальная біопсія неінформативна і не вдається визначити інші відповідні місця для біопсії, показана хірургічна біопсія легені після того, як за рентгенограмою або КТ буде визначено місце ураження. Виявлення медіастинальної аденопатії при проведенні стандартної КТ є показанням до біопсії при медіастиноскопії, перед тим як проводити відеоторакоскопічну біопсію (VTLB) або відкриту біопсію легенів (215, 216). Діагностична цінність всіх цих процедур становить 90 % і більше. Частота ускладнень і необхідності залишитися в стаціонарі після медіастиноскопії набагато нижча, ніж після хірургічної біопсії легенів. Перевагою VTLB є можливість взяття біоптату як з легені, так і з лімфатичних вузлів.
Хворі без гістології
Деякі хворі відмовляються від біопсії, у інших ураження легенів дуже важкі для проведення маніпуляцій. Клінічні та/або рентгенологічні ознаки самі по собі є діагностичними у хворих з I стадією (достовірність 98 %) або II стадією саркоїдозу (89 %), проте менш точні у хворих з III стадією (52 %) або ж стадією 0 (23 %) цього захворювання (217). Хворі з класичним синдромом Лефгрена, який включає лихоманку, вузлувату еритему, артарлгії і двосторонню лімфаденопатію коренів легенів, можуть не потребувати проведення біопсії, якщо процес проходить спонтанно. У деяких випадках допомагає бронхоальвеолярний лаваж (БАЛ) і дослідження субпопуляцій лімфоцитів. Згідно з даними Costabel, співвдношення CD4/CD8 більше ніж 3,5 має чутливість 53 %, а специфічність 94 %, прогностична цінність позитивного результату складає 76 %, а негативна прогностична цінність — 85 % (218). Іншими словами, співвідношення CD4/CD8 > 3,5 дозволяє діагностувати саркоїдоз з імовірністю 94 %, навіть якщо трансторакальна біопсія була неінформативною. Схожі результати отримали Winterbauer і співавтори (219). Біопсія слизової оболонки бронхів може бути проведена під час тієї ж процедури; вона позитивна щодо неказеозних гранульом у 41–57 % хворих на саркоїдоз (220–222). Комбінація з панда–патерну в поєднанні з лямбда-патерном при скануванні з 67Ga всього тіла може підтверджувати діагноз саркоїдозу і усувати необхідність у інвазивних діагностичних процедурах (223). Проте дані цього дослідження представлені в невеликій кількості спостережень (213). У деяких медичних центрах доступний антиген Квейма — Зільцбаха, з ним проводиться тест, який допомагає діагностувати саркоїдоз (224). Показання до нього зберігаються при нормальних рентгенограмах і КТ, у випадках увеїтів невідомої природи, гіперкальціурії, гранулематозі печінки, передбачуваному нейросаркоїдозі, рецидивуючій вузлуватій еритемі (225). При цій процедурі можливе внесення інфекційного агента, якщо антиген погано приготований чи погано проконтрольований. Легке підвищення рівня АПФ сироватки крові не має діагностичного значення, оскільки зустрічається при багатьох хворобах (226). Збільшення цього показника більш ніж у 2 рази від норми менш характерне для інших захворювань, хоча може зустрічатися при інших гранулематозах, таких як туберкульоз, хвороба Гоше (Gaucher), і гіпертиреоїдизмі.
European Respiratory Society Monograph — 2005
Єдиного тесту, що дозволяє діагностувати саркоїдоз, не існує. Найбільш достовірним критерієм постановки діагнозу є наявність неказеозних гранульом в ураженому органі. Гістологічне підтвердження може бути необов’язковим у безсимптомних пацієнтів, які мають симетричну лімфаденопатію коренів легенів. Проте коли внутрішньогрудна лімфаденопатія асиметрична, дуже серйозна або пов’язана зі збільшенням паратрахеальних вузлів, проведення біопсії настійно рекомендується. У пацієнтів з класичним синдромом Лефгрена біопсія зазвичай не є обов’язковою. У проведенні біопсії вузлуватої еритеми немає необхідності, оскільки її гістопатологія демонструє неспецифічне запалення і васкуліт, але не гранульоми. Важливо мати можливість оцінювати попередні рентгенограми легенів. Якщо вони доступні і демонструють мінорну лімфаденопатію коренів легенів, яка, можливо, була пропущена, а більш пізні рентгенограми демонструють розвиток II стадії хвороби, такі характерні зміни можуть бути достатні для постановки діагнозу саркоїдозу без гістологічного підтвердження.
Коментар робочої групи
Положення «Statement on Sarcoidosis» передбачає обов’язкову верифікацію саркоїдозу органів дихання за допомогою трансбронхіальної або хірургічної біопсії легені. Положення було прийнято в 1999 році, коли можливості комп’ютерної томографії були дуже обмежені. В даний час багатозрізова комп’ютерна томографія за своїми можливостями в морфологічній діагностиці патологічних змін у легенях наближається до патогістологічних методів. У зв’язку з цим, значно звужені і показання для проведення біопсії легені і медіастинальних лімфовузлів при інтерстиціальних захворюваннях легенів. Зокрема, в новому Положенні ведення ідіопатичного фіброзу легенів (2011) застосування хірургічної біопсії легені не передбачено у більшості хворих.
З точки зору експертів робочої групи, трансбронхіальна або хірургічна біопсія легені або медіастинальних лімфатичних вузлів при підозрі на саркоїдоз органів дихання повинна проводитися в наступних випадках:
1. Наявність вагомих підстав, за даними КТВРЗ під час першого візиту, для проведення диференційної діагностики з лімфопроліферативними захворюваннями (асиметричне збільшення медіастинальних лімфатичних вузлів, ознак здавлення верхньої порожнистої вени, зміщення стравоходу, трахеї, бронхів і ін.).
2. Прогресування або відсутність ознак регресії патологічних змін у легенях після 6 місяців терапії глюкокортикоїдами.
3. Екстрапульмональні ураження з локалізацією в шкірі і периферичних лімфатичних вузлах вимагають безумовного проведення біопсії.
На сьогоднішній час немає специфічних лабораторних біомаркерів саркоїдозу, але разом з клініко-рентгенологічними даними лабораторні дослідження можуть бути корисними при постановці діагнозу та оцінці тяжкості захворювання.
При саркоїдозі можуть виявлятись:
— помірна лімфопенія у периферічній крові (у зв’язку з акумуляцією активованих Т-лімфоцитів у вогнищі гранулематозного запалення [32];
— незрозуміла анемія, лейкопенія, тромбоцитопенія (нечасто) як прояви ураження кісткового мозку або селезінки [33, 34];
— зростання в крові вмісту лужної фосфатази і помірне — амінотрансфераз (при саркоїдозному ураженні печінки — у 10–20 % хворих) [17, 35, 36];
— зростання вмісту в крові креатиніну і сечовини (у зв’язку з ураженням нирок через хронічну гіперкальціємію, гіперкальціурію, нефролітіаз, нефрокальциноз, а також гранулематозний інтерстиціальний нефрит) [37, 38];
— підвищення рівня креатинфосфокінази/альдолази як прояви ураження м’язів [33];
— зростання вмісту кальцію в крові (у 5–10 % хворих) та сечі (у 40 % хворих) (у зв’язку з хронічною гіперкальціємією, гіперкальціурією через підвищення рівня сироваткового 1,25–дигідроксивітаміну D3 — кальцитріолу — біологічно активної форми вітаміну D3, який надлишково продукується макрофагами в гранульомах) [38, 39] через підвищену експресію мРНК гена 25-hydroxyvitamin D3-1a-hydroxylase (в нормі це відбувається тільки в нирках) [40], з пригніченням секреції гормону паращитовидних залоз, зниженням ниркової реабсорбції кальцію, підвищенням кишкової абсорбції кальцію, а також резорбції кістки остеокластами [17, 38, 41].
Аналогічні зміни можуть спостерігатись також при інших захворюваннях, зокрема при інфекційних гранулематозах, захворюваннях паращитовидних залоз, гематологічних та онкологічних захворюваннях [42, 43];
— збільшення активності ангіотензинперетворюючого ферменту (АПФ) в крові [44].
АПФ — глікопротеїд, який є одним з ключових регуляторів балансу між факторами вазоконстрикції і вазодилатації і реалізує перетворення ангіотензину I в ангіотензин II (вазоконстриктор), з іншого боку, інактивує брадикінін — один з стимуляторів виділення ендотелієм NO (ендотеліального фактора релаксації). У хворих на саркоїдоз надлишково продукується в гранульомах епітеліоїдними та гігантськими клітинами макрофагальної лінії [45].
Його активність збільшується приблизно у 60 % хворих, на що впливають: стадія та активність хвороби (загальна кількість гранульом), наявність загострення, позалегеневих проявів захворювання, глюкокортикоїдна терапія, прийом інгібіторів АПФ, вік (у молодих хворих частіше), генетичні фактори та ін. [17, 46].
Використовується для діагностики та прогнозу перебігу захворювання. Чутливість тесту при саркоїдозі — 77 % (41–100 %), специфічність — 93 % (83–99 %) [47]; нормальні рівні не виключають наявність саркоїдозу; хибнопозитивні результати не характерні. Помірне підвищення активності АПФ у сироватці крові виявляється також при гістоплазмозі, цукровому діабеті, гіперфункції щитовидної залози, міліарному туберкульозі, лепрі, професійних пневмоконіозах, хронічному бериліозі та ін. [48].
При гіпертонічній хворобі — частіше в межах нормальних значень.
— збільшення активності АПФ в бронхоальвеолярному змиві дає більш точну інформацію, ніж його сироваткові значення [49], а збільшення АПФ в цереброспінальній рідині > 8 nmol/mL/min має специфічність 94 % і чутливість 55 % при постановці діагнозу нейросаркоїдозу [50].
Подальші дослідження
У всіх хворих, у яких встановлені характерні клінічні та рентгенологічні ознаки, рекомендується дообстеження (табл. 5). Дослідження функції легені є важливим для оцінки початкового ураження легені і визначення точки відліку для подальшої оцінки поліпшення і погіршення в перебігу ураження легені. Тому, як і анамнез, фізикальне обстеження і рентгенограма органів грудної клітки показані всім пацієнтам. Відхилення у функції легенів виявляють тільки у 20 % з I стадією саркоїдозу, тоді як при II, III або IV стадіях ці порушення складають 40–70 %. Найбільш інформативними параметрами вважаються зниження дифузійної здатності легенів і ЖЄЛ (227–229). Зустрічаються як обструктивні, так і рестриктивні порушення функції легенів. Рекомендований обсяг первинного дослідження хворого на саркоїдоз наведено в таблиці 5.
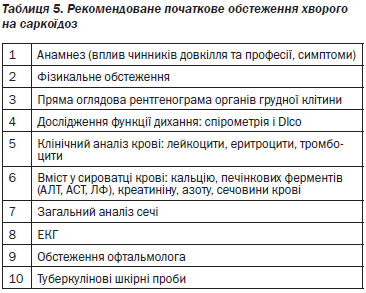
Деяким хворим показано проведення КТ. Показаннями для цього є: (1) атипова клінічна та/або рентгенологічна картина, (2) виявлення таких ускладнень захворювання легенів, як бронхоектаз, аспергілома, легеневий фіброз, тракційна емфізема або підозра інфекції або злоякісного новоутворення і (3) нормальна рентгенографічна картина при клінічній підозрі на хворобу. У більшості хворих класичними проявами саркоїдозу на КТ є (230): (1) поширення дрібних вузлів, розташованих бронховаскулярно і субплеврально; (2) потовщення міждолькових перегородок, (3) порушення архітектури легені і (4) конгломератні маси. Рідше зустрічаються: (1) стільникові легені, (2) утворення кіст і бронхоектазів і (3) ознаки консолідації альвеол.
При екстралегеневому саркоїдозі при необхідності повинні проводиться дослідження, наведені в таблиці 6. Наприклад, залучення в процес міокарда може бути розпізнане при холтерівському моніторуванні, ехокардіографії і скануванні з талієм, а ураження ЦНС — при дослідженнях ЯМР і КТ.
Клінічну активність визначають на підставі початку, небезпеки і сталості симптомів або ознак, безпосередньо пов’язаних з саркоїдозом. Довгий список маркерів активності відносять до потенційних діагностичних засобів або показників активації (231, 232). Деякі з цих маркерів вказують на прогресування хвороби в одному органі, але не дозволяють виявити прогресування в іншому. Таблиця 6 описує найбільш часто використовувані маркери.
Природний перебіг
Клінічні ознаки, природний плин і прогноз саркоїдозу варіюють досить широко, з тенденціями до загострень і ремісії або спонтанно, або у відповідь на лікування (22, 179, 233). Спонтанна ремісія характерна приблизно для 2/3 хворих, тоді як хронічний перебіг і прогресування — для 10–30 % (23, 25, 28–30, 62, 179, 234). Серйозні позалегеневі ураження (наприклад, серця, ЦНС, печінки) зустрічаються в 4–7 % випадків саркоїдозу з клінічним проявами з боку цих органів і систем, частота зростає з прогресуванням хвороби (22, 23, 25, 28, 175, 229, 235). Розуміння природного перебігу хвороби утруднене через часте призначення кортикостероїдів хворим з вираженими або прогресуючими симптомами з боку легенів або при позалегеневих ураженнях (229, 233, 236). В абсолютній більшості опублікованих робіт від 1/3 до 1/2 хворих на саркоїдоз отримували кортикостероїди (22, 23, 25, 28, 45, 229, 235). У більшості хворих відзначено поліпшення або стабілізацію процесу при лікуванні, проте при зниженні дози або відміні гормонів загострення відзначені у 16–74 % пацієнтів (22, 23, 25, 28, 36, 74, 229, 235, 237). Оцінка захворюваності та смертності від саркоїдозу досить важка. Проте не менш 10–20 % хворих на саркоїдоз страждають від його ускладнень і наслідків (легеневих або позалегеневих).
Смерть від саркоїдозу наступає у 1–5 % хворих, звичайно внаслідок прогресуючої респіраторної недостатності або ураження ЦНС або серця (29, 30, 36, 42, 74,152, 233, 235, 238–241). Відмінності в смертності відображають неоднорідність тяжкості захворювання, точок зору фахівців, а також різні генетичні та епідеміологічні чинники. За даними неспеціалізованих установ США та Скандинавії, в яких переважали білошкірі пацієнти, у багатьох хворих саркоїдоз був безсимптомним (29, 30, 62, 234). У такому контексті смертність не перевищувала 1 %, а серйозні клінічні прояви зустрічали не часто. На відміну від цього, в публікаціях із центрів, куди спеціально направляли хворих, кількість хворих з важким і прогресуючим перебігом непропорційна, що призводить до високої частоти клінічних проявів і летальних результатів (22, 23, 25, 28, 36, 237, 242). Клінічні прояви і причини смерті варіюють у різних географічних регіонах (що може відображати генетичні фактори і стан навколишнього середовища). У Японії 77 % летальних випадків через саркоїдоз пов’язували з ураженням серця (60). У США більшість хворих помирають від ускладнень з боку легенів: 13–50 % смертей відносять за рахунок ураження міокарда (74,152, 241).
Вплив етнічних і генетичних факторів на прогноз
На клінічний перебіг та прогноз саркоїдозу впливають етнічні й генетичні фактори (237, 242, 243). У афроамериканців частіше зустрічаються позалегеневі прояви саркоїдозу, хронічний увеїт, озноблений вовчак, кістозні зміни кісток, хронічне прогресування захворювання, загрозливий прогноз перебігу хвороби і висока частота рецидивів і загострень (28, 36, 237, 242, 244). Деякі дослідження вказують на те, що маркери людського лейкоцитарного антигену (HLA) відображають прогноз і локалізацію ураженого органу (102, 104, 120, 121, 123, 243, 245–248). Ці дослідження не остаточні, і потрібне подальше дослідження ролі HLA-маркерів у прогнозі і клінічних проявів саркоїдозу.
Клінічні фактори, які мають прогностичне значення
Вузлувата еритема і прояви активного запалення (наприклад, лихоманка, поліартрит) більш типові для певних расових груп і HLA-типів і вказують на прекрасний прогноз (25, 120, 121, 190, 237, 244, 245). Ці ознаки супроводжуються високою частотою (> 80 %) спонтанних ремісій (20, 26, 78, 121, 196, 249–251). Синдром Лефгрена зустрічається у 20–30 % білих пацієнтів (25, 78, 121, 250) і у 4 % хворих азіатського походження (25). Вузлувата еритема і лихоманка зазвичай дають спонтанну ремісію протягом 6 тижнів; лімфаденопатія може тривати до 1 року і більше (179, 190). У цих випадках рідко потрібно призначення кортикостероїдів.
Низка клінічних ознак пов’язана з хронічним і прогресуючим перебігом саркоїдозу. Поганими прогностичними факторами є озноблений вовчак (28,190), хронічний увеїт (28, 190, 202), початок захворювання у віці старше 40 років (29), хронічна гіперкальціємія (28, 29, 252), нефрокальциноз (28, 202, 253), чорна раса (25, 28, 237, 242), прогресування саркоїдозу легенів (26, 78,184,196, 249, 254), ураження слизової носа (28), кістозні зміни кісток (28, 255, 256), нейросаркоїдоз (193, 257, 258), ураження міокарда (175) і хронічна дихальна недостатність (241).
Значення рентгенологічної стадії (на рентгенограмі органів грудної клітини)
У багатьох дослідженнях рентгенографічна стадія саркоїдозу розглядається як прогностичний фактор (23, 25, 28–30, 62, 233, 234). При стадії I рентгенограма зазвичай поліпшується спонтанно або картина залишається стабільною. Виявлення аденопатії коренів легенів не свідчить про активність хвороби або необхідності починати лікування; важка клінічна картина або пізні ускладнення рідкісні для саркоїдозу I стадії. На відміну від цього клінічні прояви і смертність значні серед хворих з хронічними паренхіматозними інфільтративним змінами в легенях (рентгенологічні стадії II, III і IV). Спонтанна ремісія зустрічається у 55–90 % хворих при I стадії саркоїдозу; 40–70 % при стадії II; 10–20 % при стадії III і ніколи на стадії IV (23, 25, 28–30, 45, 62, 233, 234).
Як довго слід спостерігати хворого для того, щоб дізнатися, чи відбудеться спонтанна ремісія? У проспективних дослідженнях спонтанна ремісія відзначалася у 16–39 % пацієнтів протягом 6–12 місяців з моменту виявлення перших симптомів (45, 229, 236). Більше 85 % спонтанних ремісій відзначено протягом 2 років (29). Серед хворих зі спонтанною ремісією пізні рецидиви відзначені тільки в 2–8 % випадків (29, 45, 229, 237). Відсутність спонтанної регресії протягом 24 місяців вказує на хронічний або персистуючий перебіг саркоїдозу (29). У різних роботах (23, 25, 28–30, 45, 62, 229, 233, 234, 237) пізні ускладнення або прогресування хвороби були рідкісні серед хворих (на початковій стадії спостереження) з нормальною рентгенограмою або рентгенологічною стадією I зі стабільною лімфаденопатією коренів легенів. Прогноз при стадіях I і II неоднорідний. У деяких хворих з легеневою інфільтрацією бувають симптоми, значна дисфункція легень, тоді як інші залишаються безсимптомними. Рентгенограма органів грудної клітини не дозволяє надійно розрізнити активне запалення від фіброзу. Клінічне значення «стабільності» залежить від початкових симптомів і ступеня погіршення функції.
Проспективні клінічні випробування
Зрозуміти природній перебіг саркоїдозу можна з проспективних досліджень, в яких пацієнтів рандомізували на отримання кортикостероїдів і не отримання ніякого лікування (39, 44). Проте хворі з важким або прогресуючим перебігом саркоїдозу були виключені з таких випробувань. Включені пацієнти або були безсимптомними, або мали мінімальні симптоми, які пов’язують з хорошим прогнозом. Враховуючи це початкове істотне обмеження, ці дослідження не змогли визначити відмінності в двох групах дослідження (39, 44). Недавно опубліковане проспективне, але не рандомізоване випробування здійснювало моніторинг 91 раніше нелікованого хворого на саркоїдоз (229). Спочатку кортикостероїди були призначені 36 хворим (40 %) у зв’язку з прогресивним погіршенням функції легенів або серйозними позалегеневими захворюваннями (229). Решта 55 хворих (60 %) спостерігалися без лікування, і тільки 8 з них (16 %) потребували пізніше призначити кортикостероїди. При подальшому спостереженні стан 61 % хворих (які лікувались і які не отримували лікування) залишався стабільним; у 31 % пацієнтів спостерігалося поліпшення; тільки у 8 % пацієнтів було погіршення стану. В подальшому призначення лікування поліпшило їх стан. Істотний вплив на результат міг чинити той факт, що 85 % хворих були білими (229). Британське торакальне товариство проводило проспективне спостереження 149 хворих на саркоїдоз на II або III стадіях (45). Кортикостероїди були призначені 33 хворим за наявності симптомів на момент виявлення. Решта 116 хворих спостерігалися без лікування протягом 6 місяців. У 58 з них за цей час відбулося поліпшення, а у решти 58 стан був стабільним. Важливо, що тільки у 1 хворого зі спонтанною ремісією розвинувся пізній рецидив, який потребував призначення кортикостероїдів.
Спостереження за хворими
Спостереження за хворими на саркоїдоз повинно бути найбільш інтенсивним протягом перших двох років після виявлення для того, щоб визначити прогноз і визначити потреби (якщо є такі) в лікуванні. Для стадії I досить спостерігати кожні 6 місяців. Для стадій II, III, IV це слід робити частіше (кожні 3 місяці). Лікувальні втручання слід розглядати у хворих з важкою, активною або прогресуючою хворобою. Всіх хворих (незалежно від рентгенологічної стадії) слід спостерігати мінімум протягом 3 років після припинення лікування. Пізніше спостереження не потрібне доти, поки не виникнуть нові або не посиляться старі симптоми або виникнуть позалегеневі прояви захворювання. Стійка стабільна безсимптомна стадія I не вимагає призначення лікування, але передбачає тривале спостереження (не рідше 1 разу на рік). Хворі з персистуючим перебігом на стадіях II, III і VI незалежно від того, призначене лікування чи ні, також вимагають тривалого спостереження (як мінімум щорічного). Як ми вже підкреслювали, більшої уваги потребують пацієнти, у яких ремісія була викликана призначенням кортикостероїдів через високу частоту рецидивів серед них (45, 237). На відміну від них, прогресування хвороби або рецидиви рідкісні у хворих зі спонтанною ремісією (45, 229, 237). Хворі з серйозними позалегеневими проявами вимагають тривалого спостереження незалежно від рентгенологічної стадії процесу.
Протягом періоду спостереження всім хворим показаний контроль симптомів, повтор фізикального обстеження, рентгенографія органів грудної клітки і спірометрія. Подальші дослідження залежать від первинного органу ураження або нових симптомів або даних обстеження. Наприклад, хворому з задишкою або зниженням функції легенів слід провести пробу з навантаженням або КТ.
Лікування саркоїдозу
Симптоми і/або ознаки, які вимагають призначення кортикостероїдів, залишаються суперечливими. У хворих з помірним захворюванням, наприклад з ураженням шкіри, переднім увеїтом або кашлем, застосовуються кортикостероїди місцевої дії. У пацієнтів з системним захворюванням часто застосовуються пероральні кортикостероїди. Системна гормональна терапія необхідна у пацієнтів з ураженням серця, неврологічним захворюванням, ураженням очей, які не відповідають на місцеву терапію, а також при гіперкальціємії. Застосування системного лікування при легеневих та інших позалегеневих захворюваннях поки викликають дискусію, але більшість лікарів вважає, що прогресування симптомів є показанням до лікування (229, 233, 259). Хворі зі стійкими інфільтратами в легенях або при прогресуючому погіршенні параметрів дихання навіть при відсутності симптомів потребують лікування (45). У хворих, які вимагають постійного лікування кортикостероїдами, можна розглянути лікування протималярійними засобами та цитостатиками (260). У деяких рефрактерних випадках і розвитку важкої дихальної недостатності виконана трансплантація.
Коментар робочої групи
На думку експертів робочої групи, показання до призначення глюкокортикостероїдних (ГКС) препаратів необхідно конкретизувати стосовно до стадій і характеру перебігу захворювання.
ГКС не показані в наступних випадках:
— При первинному обстеженні у хворого встановлено діагноз саркоїдозу I або II стадії при відсутності клінічних проявів і екстраторакальних уражень. Хворому призначається візит через 3 міс., при поліпшенні або відсутності рентгенологічної динаміки рекомендується контрольне обстеження ще через 3 міс. Частота спонтанної ремісії у хворих на саркоїдоз I стадії складає від 55 до 90 %, у хворих на саркоїдоз II стадії — від 40 до 70 % (Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society [ Text ] / Thorax. — 2008. — Vol. 63. — v1–v58. doi: 10.1136/thx.2008.101691).
— При прогресуванні (збільшення лімфовузлів, перехід в II стадію, збільшення ділянок паренхіматозного ураження) призначається ГКС–терапія.
— При гострому перебігу хвороби за типом синдрому Лефгрена призначаються симптоматичні засоби (нестероїдні протизапальні препарати).
— При відсутності регресу таких проявів синдрому Лефгрена, як вузлувата еритема та артрит, протягом 2 тижнів лікування нестероїдними протизапальними препаратами призначаються ГКС в середніх дозах (зазвичай 20 мг на добу в перерахунку на преднізолон перорально) на 1 місяць з подальшим поступовим зниженням дози аж до відміни.
ГКС– терапія призначається:
— При всіх стадіях саркоїдозу з екстраторакальними проявами — ураженнями серця, ЦНС, очей, а також з гіперкальціємією.
— При ІІ стадії саркоїдозу з клінічними проявами (кашель, задишка, біль у грудях, зниження фізичної активності) та/або з помірно вираженими порушеннями функції зовнішнього дихання.
— При III стадії захворювання, оскільки у цієї категорії хворих спонтанні ремісії спостерігаються відносно рідко (10–20 % випадків). Крім того, у більшості хворих на саркоїдоз III стадії відзначаються виражені клінічні прояви (задишка, кашель), порушення вентиляційної та дифузійної здатності легенів.
У хворих на саркоїдоз IV стадії основними проявами є легенева недостатність і хронічне легеневе серце, що потребують відповідної специфічної терапії.
Кортикостероїди
Раніше проведені дослідження показали, що короткі курси лікування адренокортикотропним гормоном (АКТГ) або кортизоном можуть сприятливо впливати на інфільтративні зміни, які виявляються на рентгенограмах, а тривале лікування кортизоном призводить до розсмоктування гранульом, що було доведено при проведенні повторних біопсій (32). Застосування кортикостероїдів per os зазвичай призводить до полегшення респіраторних симптомів, поліпшення у рентгенографічній картині і функції легенів (34, 35, 40, 41, 43, 45, 229, 261–263). Проте відновлення симптомів і інфільтратів на рентгенограмах відбуваються досить часто після припинення лікування, в деяких групах рецидиви відзначені більш ніж у 1/3 хворих протягом 2 років після закінчення терапії (35, 261).
Оптимальна доза та тривалість застосування кортикостероїдів не досліджувалися в рандомізованих проспективних випробуваннях. Доза і тривалість лікування часто повинні бути індивідуалізовані. При саркоїдозі легенів початкова доза найчастіше 20–40 мг на добу або її еквівалент через день (259). Більш високі дози потрібні при ураженні серця або ЦНС. Через 1–3 місяці слід оцінити відповідь на проведене лікування. Якщо через 3 місяці лікування ефект не отриманий, то малоймовірно, що подальше лікування кортикостероїдами принесе успіх. З цього моменту слід почати пошук причин відсутності ефекту лікування, таких як наявность необоротних фіброзних змін, погана співпраця хворого, неадекватність дозування або резистентність до кортикостероїдів. Серед тих, хто відповів на стероїди, дозу знижують до 5–10 мг на добу або через день. Лікування слід продовжувати не менше 12 місяців. Іноді хворі з недавно виявленим захворюванням і незначними проявами дають ремісію на 3–6-й місяць. Хворі з синдромом Лефгрена не потребуються кортикостероїдів, крім випадків, коли неефективні НПЗЗ. Хворі на саркоїдоз потребують спостереження після зниження дози або припинення лікування, щоб не пропустити рецидив. У деяких пацієнтів з повторюваними рецидивами слід проводити тривале лікування малими дозами (35, 261).
Місцеве застосування кортикостероїдів показано хворим з ураженням шкіри, іритом/увеїтом, поліпами носа і патологією дихальних шляхів (264–269). Сильні стероїди не слід застосовувати при лікуванні шкіри обличчя. Хоча рандомізовані дослідження не проводилися, очевидно, що місцеве лікування із застосуванням кремів, крапель, спреїв і ін’єкцій спрощує лікування. Інгаляційні стероїди застосовуються в лікуванні саркоїдозу легенів. Низка робіт свідчить про їх ефективність (264–268, 270, 271), але не всі дослідження показали їх клінічну ефективність (269).
Коментар робочої групи
У Положенні початкова доза препарату становить 20–40 мг на добу. Слід зазначити, що доза 20 мг відповідає категорії середніх доз, а 40 мг відноситься до розряду високих, застосування яких пов’язане з частим розвитком серйозних небажаних явищ. Крім того, у Положенні відсутня рекомендація співвідносити дозу препарату з масою тіла хворого, що в сучасних посібниках і положеннях є обов’язковою умовою. Оцінку відповіді на ГКС-терапію пропонується проводити через 1–3 місяці після початку лікування. Такий широкий діапазон строків безсумнівно знижує об’єктивність оцінки ефективності ГКС-терапії.
З точки зору експертів робочої групи, необхідна уніфікована схема ГКС-терапії хворих на саркоїдоз, заснована на застосуванні середніх доз препаратів у розрахунку на 1 кг маси тіла хворого з подальшою оцінкою ефективності в більш конкретні терміни.
Найбільш придатною є схема лікування, яка передбачає призначення препарату в дозі 0,5 мг/кг маси тіла у розрахунку на преднізолон протягом 4 тижнів (для хворого масою 60 кг доза препарату складе 30 мг на добу). Потім дозу знижують протягом 8 тижнів такими темпами, щоб до кінця третього місяця вона склала 0,25 мг/кг. Через 3 місяці від початку лікування проводиться оцінка його ефективності. При позитивній динаміці клінічних та рентгенологічних даних дозу препарату поступово знижують до 0,125 мг/кг до кінця 6-го місяця, протягом наступних 6 місяців дозу зберігають незмінною. [American Thoracic Society, European Respiratory Society. Idiopathic pulmonary fibrosis: diagnosis and treatment. International consensus statement [Text] //Am. J. Respir. Crit. Care Med. — 2000. — Vol. 161. — P. 646–664].
При відсутності ознак регресії через 3 місяці лікування необхідний аналіз можливих причин відсутності ефекту з прийняттям рішення в залежності від його результату.
Найкращим препаратом з групи глюкокортикоїдів є метилпреднізолон, що має значно меншу, порівняно з преднізолоном, мінералокортикоїдну активність. Початкова доза метилпреднізолону становить 0,4 мг/кг маси тіла, до кінця 3-го місяця — 0,2 мг/кг, до кінця 6-го місяця — 0,1 мг/кг.[Рациональная фармакотерапия заболеваний органов дыхания: Рук. для практикующих врачей [Текст] / Под общ. ред. А.Г. Чучалина. — Москва: Литтера, 2004. — С. 70–97].
Цитотоксичні засоби
При лікуванні саркоїдозу застосовували різні цитостатики. Незважаючи на те, що в окремих хворих ці препарати були ефективні, немає досліджень, на підставі яких можна було б визначити показання до їх призначення. На основі безпеки та ефективності метотрексат і азатіопрін є кращими (260). Циклофосфамід має бути зарезервований для рефрактерних випадків.
Метотрексат. Оригінальні спостереження лікування метотрексатом обмежені випадками, в яких описана його ефективність при рефрактерному саркоїдозі (272–275). Один центр опублікував результати застосування метотрексату при хронічному саркоїдозі. У 33 з 50 хворих метотрексат був ефективний у монотерапії, ще у 9 хворих ефект був досягнутий при поєднанні з низькими дозами преднізону (276, 277). У двох інших повідомленнях подібний ефект був досягнутий при лікуванні саркоїдозу шкіри (278, 279). Рецидиви по закінченню лікування метотрексатом часті, але в 26 з 27 випадків повторне застосування метотрексату було ефективним (277). Все вказує на те, що метотрексат пригнічує, але не виліковує хворобу.
Коментар робочої групи
Нижче представлені опубліковані в 2013 році рекомендації експертів WASOG щодо застосування метотрексату у хворих на саркоїдоз (Cremers J.P. Multinational evidence — based World Association of Sarcoidosis and Other Granulomatous Disorders recommendations for the use of methotrexate in sarcoidosis: integrating systematic literature research and expert opinion of sarcoidologists worldwide [Text] / J.P. Cremers, M. Drent, A. Bast et al. // Curr. Opin. Pulm. Med. — 2013. — Vol. 19. — P. 545–561).
1. MTX при саркоїдозі показаний в якості терапії другої лінії у випадках резистентності до стероїдів при наявності несприятливих ефектів, пов’язаних зі стероїдами, або на додачу до стероїдів для потенціювання їх ефекту, а також у виняткових випадках в якості варіанту терапії першої лінії у вигляді комбінованої терапії з кортикостероїдами або у вигляді монотерапії.
2. Рекомендована початкова доза перорального MTX складає 5–15 мг щотижня.
3. Рекомендується додаткове призначення фолієвої кислоти з терапією MTX принаймні 5 мг на тиждень або 1 мг на день.
4. Перед лікуванням MTX необхідно обстежити пацієнта на аспартатамінотрансферазу (АСТ), аланінамінотрансферазу (АЛТ), алкалінлужну фосфатазу (АЛФ), білірубін, загальний аналіз крові (ЗАК), креатинін і при наявності показань, серологію на ВІЛ, гепатит В/С і тест на вивільнення інтерферону-гамма (IGRA) для виявлення інфекції M.tuberculosis.
5. Перед призначенням MTX повинні бути розглянуті деякі протипоказання: виражена ниркова недостатність, значна печінкова хвороба, крім саркоїдозу печінки, пригнічення функції кісткового мозку і гостра або хронічна інфекція.
6. Після початку застосування MTX або збільшення дози MTX необхідно проводити моніторинг AЛT (з або без AСТ), концентрації креатиніну та ЗАК кожні 3–6 тижнів до досягнення стабільної дози і кожні 1–3 місяці після цього. Після стабілізації інтервал моніторингу може бути розширений до кожних 6 місяців
7. У разі MTX-індукованих шлунково-кишкових побічних ефектів, у тому числі запалення слизової оболонки, слід розглянути можливість розділення пероральної дози на декілька прийомів за умови, що загальна доза МТХ потрапляє протягом 12 годин. У разі стійкої нетерпимості слід розглянути можливість парентерального введення або заміни його на альтернативний імуносупресант.
8. Необхідно прийняти всі запобіжні заходи у випадку підтвердженого збільшення активності АЛТ/АСТ. Якщо немає інших причин, воно повинно призвести або до зниження дози MTX, або до відміни, біопсії печінки, щоб оцінити токсичність MTX, або додавання фолієвої кислоти; розглянути альтернативний імуносупресивний препарат після нормалізації рівня ферментів.
9. Ґрунтуючись на прийнятному профілі безпеки, MTX може призначатися для довготривалого застосування.
10. MTX не повинен застосовуватися чоловіками або жінками принаймні за 3 місяці до запланованої вагітності і не повинен застосовуватися під час вагітності або годування груддю (абсолютне протипоказання)
Азатіоприн. Обмежена кількість публікацій вказує на ефективність лікування азатіоприном (258, 280, 281). Дві серії спостережень показали хороший ефект застосування цього цитостатика з одночасним застосуванням преднізону і без нього (282, 283). У цих роботах азатіоприн призначали хворим на хронічний саркоїдоз. Його ефективність була подібною до ефективності метотрексату. Досвід лікування азатіоприном хворих після пересадки органів, а також хворих на ревматоїдний артрит свідчить про відносну безпеку і ефективність цього препарату.
Current and emerging pharmacological treatments for sarcoidosis: a review / S.H Beegle // Drug Design, Development and Therapy. — 2013. — Vol. 7. — P. 325–338
Лефлуномід. Лефлуномід був спочатку розроблений як аналог метотрексату з меншою токсичністю. Було висловлено припущення, щоб він корисний при саркоїдозі в декількох серіях випадків. Активний метаболіт лефлуноміду (A77 1726) має протизапальну дію шляхом інгібування циклооксигенази-2 (ЦОГ-2) і призводить до імуномодуляції через його інгібування дигідрооротатдегідрогенази — ферменту, відповідального за синтез піримідинів з нуля.44 У кінцевому рахунку препарат запобігає розширенню активованих лімфоцитів через втручання в прогресію клітинного циклу. Лефлуномід також пригнічує сигналізацію TNF-α. Обмежені клінічні дані свідчать про те, що лефлуномід може бути настільки ж ефективним, як і метотрексат у пацієнтів з хронічним саркоїдозом, але з меншою токсичністю.45 Препарат можна розглядати при саркоїдозі як захисний агент кортикостероїдів, коли кортикостероїди неповністю можуть контролювати захворювання та/або викликають значні побічні ефекти. Ми вважаємо, що це було б особливо корисно для пацієнта із саркоїдозом, який мав позитивну відповідь на метотрексат, але розвинув побічні ефекти від цього препарату. Початкова доза лефлуноміду становить, як правило, 20 мг на день. Доза може бути знижена до 10 мг/день у пацієнтів, у яких розвивається токсичність. Деякі лікарі рекомендують введення навантажувальної дози 100 мг на день протягом 3 днів, оскільки препарат має тривалий період напіврозпаду (як правило, 14–15 днів) і потребує багато часу для досягнення стабільного стану.46 Однак навантажувальна доза часто опускається у зв’язку з більшою частотою побічних ефектів, особливо у пацієнтів, які приймають препарат через попередню гепатотоксичність або гематологічну токсичність від використання метотрексату.47
Інші цитостатики. Хлорамбуцил у комбінації з низькими дозами преднізолону застосовувався у невеликої кількості хворих. Відповідь була подібна відповіді при лікуванні метотрексатом або азатіоприном (284, 285). Ризик розвитку злоякісних процесів при лікуванні хлорамбуцилом значно вищий, ніж при використанні метотрексату і азатіоприну. У зв’язку з цим більшість лікарів відмовилися від цього препарату. Циклофосфамід також застосовувався у невеликої кількості пацієнтів (258, 286–288). Висока токсичність обмежує його застосування у важкохворих, рефрактерних до інших препаратів. У невеликих групах хворих з неврологічними змінами без успіху лікувалися іншими препаратами, деяким пацієнтам допомагав циклофосфамід (289).
Токсичність
Таблиця 7 узагальнює токсичні ефекти цитостатиків, що застосовувалися при лікуванні саркоїдозу. Для них характерні такі загальні прояви, як гематологічні та шлунково–кишкові реакції, тератогенність і канцерогенність. Хворих слід регулярно спостерігати, оцінюючи токсичність препаратів на кістковий мозок. Нудота і блювання зустрічаються при застосуванні будь-яких цитостатиків, але найчастіше вони залежать від дози (290–292). Всі цитостатики тератогенні для чоловіків і жінок, слід оберігатися від зачаття в період лікування (293, 294). Менш тератогенний азатіоприн. Циклофосфамід призводить до ранньої менопаузи і аспермії, хоча й інші препарати можуть призводити до цього. Тератогенний ефект може виявлятися протягом 6 місяців після прийому останньої дози метотрексату. Описано багато випадків народження нормальних дітей від осіб, які отримували цитостатики, але ризик розвитку вад плода великий.
Застосування цитостатиків супроводжується підвищеним ризиком розвитку лімфопроліферативних порушень і карцином. Метотрексат має мінімальну канцерогенність або ніякої (295–297). Ці препарати асоціюються з гіперчутливим пневмонітом і гепатотоксичністю (289, 298–300). При пересадці органів застосування азатіоприну супроводжувалося підвищенням ризику злоякісних новоутворень (301–303), тоді як при ревматоїдному артриті це не відзначалося (304). Хлорамбуцил збільшує ризик лімфопроліферативних захворювань. Загальний ризик канцерогенності із застосуванням циклофосфаміду, в тому числі лімфопроліферативних пухлин і карциноми, викликає занепокоєння. Крім того, є ризик розвитку раку сечового міхура і гематурії (305–307). Гематурія є вагомим показанням для припинення лікування цим препаратом.
Токсичність метотрексату може бути знижена застосуванням фолієвої або фолінієвої кислоти (308). Деякі автори рекомендують біопсію печінки для моніторування гепатотоксичності після кожної кумулятивної дози в 1–1,5 м. Метотрексат виводиться нирками, і тому його застосування не рекомендується при значній нирковій недостатності. Активні метаболіти азатіоприну метаболізуються метилтрансферазою. У невеликої частини популяції відсутній фенотип цього ензиму, що призводить до надлишкових рівнів 6-меркаптопурину і пролонгації ефекту препарату (309, 310). Геморагічний цистит, що викликається циклофосфамідом, може бути зменшений підвищеним споживанням рідини. Проте слід регулярно повторювати аналізи сечі для контролю цього токсичного прояву і пов’язаного з ним раку сечового міхура (306).
Коментар робочої групи
Метотрексат може мати пневмотоксичний ефект. При тривалому лікуванні метотрексатом хворих на ревматоїдний артрит частота метотрексат-індукованих інтерстиціальних пневмонітів становить близько 7 % (Marder W. Advances in Immunosuppressive Therapy [Text] / W. Marder, J.W. McCune // Semin. Respir. Crit. Care Med. — 2007. — Vol. 28(4). — P. 398–417).
У зв’язку з цим поява нових інфільтратів в легенях або ділянок «матового скла» на фоні лікування метотрексатом можуть бути помилково розцінені як загострення природного перебігу саркоїдозу.
Інші засоби
Найбільш часто використовуваними протималярійними засобами лікування саркоїдозу є хлорохін і гідроксихлорохін. Siltzbach і Teirstein лікували 43 хворих з інтраторакальними або шкірними ураженнями і відзначили поліпшення більш ніж у половини пацієнтів. Імовірність успіху лікування у хворих з більш вираженими рентгенологічними змінами була нижчою (311). Хлорохін був особливо ефективний при ознобленому вовчаку і гіперкальціємії (312). У рандомізованому подвійному сліпому дослідженні при застосуванні хлорохіну і плацебо протягом 4 місяців, очищення рентгенограми було відзначено при лікуванні хлорохіном. Проте через 8 місяців після припинення лікування відмінностей не було (313). Проте тривале застосування хлорохіну може призводити до необоротної ретинопатії і сліпоти; ретельне обстеження в офтальмолога необхідно проводити кожні 3–6 місяців. Зважаючи на високий ризик ретинопатії, лікування хлорохіном найкраще обмежувати 6 місяцями (314). Гідроксихлорохін застосовувався протягом тривалого часу без ураження сітківки (314). Гідроксихлорохін викликає руйнування інсуліну в печінці, пригнічення глюконеогенезу і підсилює використання глюкози периферійними тканинами (315). Його можна застосовувати у хворих на цукровий діабет при лікуванні легкої або середньої тяжкості саркоїдозу.
Гідроксихлорохіну слід віддати перевагу, зважаючи на нижчий ризик токсичності на очі. Була доведена ефективність нестероїдних засобів у лікуванні саркоїдозу, особливо при проявах хвороби з боку опорно-рухового апарату і вузлуватої еритеми (46). Протигрибковий засіб кетоконазол, відомий інгібітор стероїдної оксидази цитохрому Р-450, знижує рівень циркулюючого 1,25-гідроксивітаміну D3 і кальцію в сироватці крові у хворих із гіперкальціємією внаслідок саркоїдозу (316, 317).
При рефрактерному саркоїдозі пропонується застосування деяких інших агентів. Циклоспорин був мало ефективний (318) або неефективний (319, 320) при лікуванні саркоїдозу легенів. Його застосування обмежене високою токсичністю. Він може допомогти деяким хворим з рефрактерним нейросаркоїдозом, коли лікування кортикостероїдами й імунодепресантами виявилося неефективним (258, 321). У деяких випадках застосовувалася променева терапія, і в деяких випадках був відзначений ефект (322). Мелатонін, талідомід і пентоксифілін також були корисні в деяких випадках (323–325).
European Respiratory Society Monograph 2005
Chapter 20. Therapy for sarcoidosis
Кілька досліджень показали, що альвеолярні макрофаги пацієнтів з активним саркоїдозом виробляють підвищені рівні TNF, який відіграє значну роль в утворенні гранульом і прогресуванні саркоїдозу [88–90]. Нещодавні дослідження продемонстрували, що у пацієнтів з активною хворобою, незважаючи на кортикостероїдну терапію, все ще може вироблятися надмірно велика кількість TNF [91]. Це призвело до використання засобів з анти-TNF активністю [92].
Пентоксифілін пригнічує виробництво цитокінів альвеолярними макрофагами [93], причому при активному саркоїдозі більш ефективно пригнічується виробництво TNF, ніж інших цитокінів [94]. Пентоксифілін успішно застосовується при лікуванні гострого саркоїдозу [95]. Цей препарат слід розглядати як засіб лікування активного саркоїдозу легенів разом з гормонами і самостійно.
Дозування — 200–400 мг до 3 разів на день (або 25 мг/кг на день протягом 6 місяців). Для блокування TNF може бути необхідне високе дозування.
Current and emerging pharmacological treatments for sarcoidosis: a review / S.H. Beegle // Drug Design, Development and Therapy, 2013
Антагоністи фактору некрозу пухлини альфа
За останні кілька років різноманітні серії випадків і клінічні випробування повідомляли про ефективність антагоністів TNF-α при лікуванні саркоїдозу.31, 59–62 Для цієї терапії є слушні обґрунтування, тому що TNF-α секретується макрофагами у пацієнтів з активним саркоїдозом,63 і TNF-α, як вважають, безпосередню бере участь у розвитку саркоїдної64 гранульоми.
У рандомізованому подвійному сліпому клінічному дослідженні було показано, що інфліксимаб є ефективним при легеневому31 та позалегеневому саркоїдозі.65 Він може бути особливо ефективним при ознобленому вовчаку66 (спотворючий обличчя саркоїдоз) і при нейросаркоїдозі56. На відміну від майже всіх інших агентів другого ряду для саркоїдозу, які, як правило, вимагають кілька місяців, аби досягти максимальної ефективності, інфліксимаб часто показує терапевтичну відповідь протягом декількох тижнів.31
Незважаючи на багатообіцяючі результати інфліксимабу для лікування саркоїдозу, його вартість і той факт, що він вимагає регулярних внутрішньовенних інфузії, запобігає тому, щоб препарат був препаратом вибору для більшості форм саркоїдозу. Ми б позиціонували інфліксимаб як препарат третьої лінії після того, як кортикостероїди плюс захисні агенти кортикостероїдів не зможуть забезпечити адекватну реакцію на лікування. Як свідчать обмежені дані, препарат є дуже ефективним при саркоїдозі і він може розглядатися у випадках тяжкого саркоїдозу в якості препарату другої лінії або призначатися на початку в цій ситуації разом з кортикостероїдами. Як уже згадувалося, інфліксимаб можна розглядати як препарат другої лінії для лікування ознобленого вовчака або нейросаркоїдозу, оскільки обмежені дані свідчать про те, що він може бути особливо ефективним для цих форм саркоїдозу.
Типове дозування інфліксимабу при саркоїдозі становить 3–5 мг/кг із навантажувальною дозою на 0, 2, 6 тижні, а потім кожні 6 тижнів після цього. Інтервал дозування може бути скоригований відповідно до реакції пацієнта. Оскільки більшість пацієнтів, які отримують інфліксимаб, мають історію хронічної, невиліковної важкої хвороби, більшість пацієнтів матимуть рецидив, якщо препарат припинити вживати. Таким чином, терапія інфліксимабом зазвичай має бути продовжена, якщо тільки пацієнт не перейшов в інший протисаркоїдозний препарат.
Інші біологічні антагоністи TNF-α використовувалися для лікування саркоїдозу зі змішаними результатами. Є дані, що адалімумаб може бути корисним при лікуванні саркоїдозу. Він має переваги перед інфліксимабом у тому, що він є повністю гуманізованим антитілом і алергічні реакції можуть бути менш частими. Крім того, оскільки адалімумаб вводиться підшкірно, а не внутрішньовенно, він менш складний у використанні. Хоча медичні дані обмежені, адалімумаб часто вимагає відносно високих доз (наприклад, 40 мг підшкірно щотижня)72 і відносно тривалого періоду часу порівняно з інфліксимабом, щоб досягти максимальної ефективності. Етанерцепт, як свідчать дані, не особливо корисний для лікування саркоїдозу.73, 74 Пероральні антагоністи TNF-α, такі як талідомід і апреміласт, можуть мати деяку активність при саркоїдозі, хоча вони, здається, не дуже ефективні в цих умовах.59, 79, 80
Коментар робочої групи
Застосування анти-TNF блокуючих агентів у хворих на саркоїдоз набуває все більше доказів їх ефективності, незважаючи на те, що при лікуванні ними інших захворювань в 0,04 % випадків виникають саркоїд–подібні гранулематози або гострий саркоїдоз [54, 55, 56].
У подвійному сліпому плацебо-контрольованому дослідженні у 138 хворих на хронічний саркоїдоз підтверджена ефективність антагоніста TNF, а також в інших дослідженнях — його позитивна дія при різних формах захворювання [57,58] на відміну від розчинної форми рецепторів до TNF, ефект від застосування яких у більшості хворих на саркоїдоз не був позитивним [59, 60].
Інфліксимаб — химерні мишачо-людські моноклональні антитіла IgG1, є антагоністом до TNF-α.
Адалімумаб — рекомбінантне моноклональне антитіло, яке ідентичне IgG1 людини, антагоніст TNF-α.
Етанерцепт — рекомбинантний людинний димерний білок, який містить ланцюг розчинного людського рецептора до TNF-α, що з’єднаний з Fc-компонентом людського IgG1 та імітує дію розчинних рецепторів TNF–a, будучи конкурентним інгібітором зв’язування TNF-α з його рецепторами на поверхні клітини. Є антагоністом TNF-α, утворює стійкий комплекс як з розчинною, так з мембрано-асоцийованою формами людськго TNF-α, але на відміну від антитіл проти TNF-α етанерцепт не блокує молекул TNFa, які вже зв’язані з рецепторами, а також не зв’язує комплемент і не спроможний до лізису клітин.
Талідомід — снодійний та заспокійливий лікарський засіб із встановленою тератогенною активністю. Має протизапальну, імуномодулюючу та антиангіогенну дію, проте ії механізм остаточно не встановлений. Імунологічні ефекти талідоміду можуть істотно варіювати в різних умовах, і, можливо, пов’язані з супресією надмірного вироблення TNF-α, що дозволяє застосовувати його для лікування хворих на червоний вовчак, множинну мієлому.
Апреміласт — інгібірує фосфодіестеразу-4, а також спонтанну продукцію TNF-α. FDA (США) дозволило його застосування у пацієнтів з активним псоріатичним артритом.
Апреміласт не зареєстрований в Україні станом на 01.05.2014 р.
Лікування супутніх станів і ускладнень
У хворих із фіброзним захворюванням частим ускладненням є бронхоектази. У цих випадках може знадобитися лікування антибіотиками. При саркоїдозі заслуговує на увагу таке ускладнення бронхоектазів, як формування аспергілеми. У багатьох випадках це призводило до фатальної легеневої кровотечі. Відоме застосування протигрибкового засобу ітраконазолу, але немає контрольованих випробувань, які доводять його ефективність. У деяких випадках ефективними були хірургічна резекція і емболізація бронхіальних артерій.
Найбільш частим ускладненням є остеопороз. Глюкокортикоїди збільшують ризик остеопорозу. Проте після припинення кортикостероїдної терапії остеопороз може бути оборотним, особливо в осіб у віці до 50 років (326). При лікуванні саркоїдозу дефлазакортом (deflazacort), новим, зберігаючим кістки кортикостероїдом, відзначений клінічний ефект і мінімальні прояви остеопорозу (326, 327). Серед засобів попередження розвитку остеопорозу запропоновані вітамін D або додаткове застосування кальцію, назальний кальцитонін і біфосфонати. Особливої обережності слід дотримуватися при застосуванні вітаміну D і кальційвмісних препаратів і добавок при саркоїдозі, оскільки саме захворювання викликає гіперкальціємію і гіперкальціурію внаслідок підвищення ендогенного вітаміну D. Хоча гіперкальціємія й гіперкальціурія можуть зникати під час лікування саркоїдозу, при проведенні кальцій-замісної терапії потрібен ретельний контроль рівня кальцію в крові та сечі. Зустрічаються роботи, в яких при призначенні кальцитоніну й біфосфонатів показана оборотність остеопорозу, викликаного терапією саркоїдозу стероїдами (328).
Хворі на саркоїдоз повинні ретельно обстежуватися щодо таких системних симптомів, як міалгія і втома. Цим хворим та пацієнтам із вираженою дихальною недостатністю може допомогти легенева реабілітація. Гіпоксемія в спокої або при навантаженні може потребувати додаткової оксигенотерапії.
Відомо, що в термінальних стадіях саркоїдозу успішно проводилися трансплантація легенів та інших органів (329). На жаль, в донорській легені описано розвитку саркоїдозу (330). Проте схоже, що посттрансплантаційна імуносупресивна терапія дозволяє утримати саркоїдоз під контролем (331).
Коментар робочої групи
Є нечисельні дані про позитивну терапевтичну дію імідазольних антифунгальних засобів (кетоконазолу, ітраконазолу) у хворих при саркоїдозній гіперкальціурії. Супресія ними рівня сироваткового фермент-Р450-залежного 1,25-дигідрокси-вітаміну D супроводжується зниженням вмісту кальцію в крові та зменшенням легеневої інфільтрації в рефрактерних до терапії хворих [61, 62, 63].
Дефлазакорт не зареєстрований в Україні станом на 01.05.2014 р.
Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. A. U. Wells et al., 2008
Трансплантація легенів при саркоїдозі
Респіраторне захворювання кінцевої стадії з фіброзом легенів і IV стадією рентгенологічних змін трапляється в невеликої кількості пацієнтів. Загальна смертність від саркоїдозу становить 1–5 % через ураження легенів, інфаркт або ураження ЦНС. Трансплантація легенів використовується у пацієнтів з саркоїдозом, і такі пацієнти представляють 2,8 % від усіх реципієнтів легенів у США.620 Короткостроковий результат показав більш високий ступінь відторгнення трансплантата з 83% виживанням при саркоїдозі порівняно з 91 % виживання при трансплантації з інших причин, при чому інфекція значно важливіша в інших трансплантатів.620 Оцінка виживаності з досліджень з невеликою кількістю пацієнтів виявила 1-річну виживаність на рівні 62–72 % і 4–5-річну виживаність на рівні 46–56 %.621–623 Короткострокова виживаність залежить від раси, будучи нижчою у донора або реципієнта афроамериканця.620 Результати свідчать про те, що виникнення облітеруючого бронхіоліту подібне до трансплантації при інших запальних захворюваннях.622 Немає єдиної думки з приводу того, чи слід виконувати трансплантацію одного або обох легенів. Саркоїдоз є найбільш поширеним основним захворюванням, що повторно виникає в пересадженій легені в 35–62,5 % випадків,622, 624 однак повторне виникнення зазвичай протікає безсимптомно і часто виліковується протягом періоду спостереження.
Список використаних літературних джерел в редакції