Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Ассоциативные связи между микоплазмой и компонентами иммунного ответа у женщин с аутоиммунным тиреоидитом
Авторы: Гончарова О.А. — Харьковская медицинская академия последипломного образования
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Исследованы иммуноглобулины G к микоплазме в сыворотке крови женщин с аутоиммунным тиреоидитом репродуктивного и постменопаузального возрастных периодов. Контрольную группу составили женщины аналогичных возрастных периодов без тиреопатологии. Установлено, что наличие аутоиммунного тиреоидита не повышает частоту выявленных иммуноглобулинов G к микоплазме у женщин, а возрастной фактор не влияет на этот показатель. В то же время активность микоплазменной инфекции в постменопаузальном периоде повышается и на фоне аутоиммунного тиреоидита, и в контрольной группе, причем у женщин без тиреопатологии — достоверно в большей степени (в 4,4 раза по сравнению с репродуктивным периодом, а на фоне аутоиммунного тиреоидита — на 13,5 %). У женщин с аутоиммунным тиреоидитом достоверных ассоциативных связей между иммуноглобулинами G к микоплазме и показателями клеточного иммунитета CD3, CD4, CD8, CD16 не установлено. В то же время в репродуктивном периоде имеет место достоверная прямая корреляция с CD20 и обратная — с CD95 (маркером Fas-опосредованного апоптоза), а в постменопаузе — прямая с показателем гуморального звена иммунитета — антителами к тиреоглобулину.
Досліджено імуноглобуліни G до мікоплазми у сироватці крові жінок, хворих на автоімунний тиреоїдит, репродуктивного та постменопаузального вікових періодів. Контрольну групу становили жінки відповідних вікових періодів без тиреопатології. Встановлено, що наявність автоімунного тиреоїдиту не підвищує частоту виявлених імуноглобулінів G до мікоплазми у жінок, а віковий фактор не впливає на цей показник. У той же час активність мікоплазмової інфекції у постменопаузальному періоді підвищується і на тлі автоімунного тиреоїдиту, і в контрольній групі, причому в жінок без тиреопатології — вірогідно більшою мірою (у 4,4 раза порівняно з репродуктивним періодом, а на тлі автоімунного тиреоїдиту — на 13,5 %). У жінок з автоімунним тиреоїдитом вірогідних асоціативних зв’язків між імуноглобулінами G до мікоплазми та показниками CD3, CD4, CD8, CD16 не виявлено. Водночас в репродуктивному періоді має місце вірогідна пряма кореляція з CD20 та обернена — з CD95 (маркером Fas-опосередкованого апоптозу), а в постменопаузі — пряма з показником гуморальної ланки імунітету — антитілами до тиреоглобуліну.
There was investigated immunoglobulin G (IgG) to the mycoplasma (Mp) in the blood serum of women with autoimmune thyroiditis (AIT) of reproductive age and in postmenopausal periods. A control group consisted of women of similar periods without thyroid pathology. The presence of AIT was found not to be associated with increased IgG level to Mp and age factor in women. At the same time, the activity of mycoplasma infection in postmenopausal women increases both in women with AIT, and in the control group, but in women without thyroid pathology it occurs significantly more intensive (4.4-fold compared with women in reproductive period, and in AIT women — on 13.5 %). In women with AIT reliable associative links between IgG to MP and CD3, CD4, CD8, CD16 levels were not revealed. At the same time in a reproductive period there is a significant positive correlation with CD20 and negative one with CD95 (marker of Fas-mediated apoptosis), and in postmenopausal women — with a direct indicator of humoral immunity — antibodies to TG.
микоплазма, иммуноглобулин G, аутоиммунный тиреоидит, постменопаузальный и репродуктивный периоды.
мікоплазма, імуноглобулін G, автоімунний тиреоїдит, постменопаузальний та репродуктивний періоди.
mycoplasma, immunoglobulin G, autoimmune thyroiditis, postmenopausal and reproductive periods.
Статья опубликована на с. 18-22
Микоплазменную инфекцию животных и человека относят к латентным или хроническим процессам, которые обычно сопровождаются симптомами иммунодефицита [1].
Микоплазмы (Мп) — группа разнообразных микроорганизмов размером 150–200 нм. Хотя по размеру Мп очень близки к вирусам, они, как и бактерии, содержат обе нуклеиновые кислоты — РНК и ДНК, способны размножаться в условиях искусственных питательных сред [1, 2].
Доказано, что все Мп вызывают очень большие изменения в метаболизме клеток организма хозяина: нарушают обмен аминокислот, синтез белков, нуклеиновых кислот, привносят новую генетическую информацию [3].
Считают, что доминирующим фактором, определяющим патогенность Мп, является их способность тесно связываться с мембраной клетки, вступать с ней в межмембранное взаимодействие, при котором возможен обмен отдельными мембранными компонентами. В результате этого нарушается процесс распознавания антигенов и начинается выработка антител (АТ) против собственных тканей и клеток, т.е. происходит развитие аутоиммунного процесса. Аутоиммунные антитела, характерные для аутоиммунных процессов, часто обнаруживаются при микоплазменных инфекциях, в том числе при микоплазменных пневмониях, идиопатической тромбоцитопенической пурпуре, гемолитической анемии, волчаночном нефрите, ревматоидном артрите и т.д. [4, 5].
Сходство микоплазменных мембран с мембранами клеток хозяина обусловливает их слабую иммуногенность и длительную персистенцию в организме. Наличие же общих антигенных структур у Мп и клеток организма является причиной развития аутоиммунных процессов, приводящих к тяжелым осложнениям, которые требуют специфической терапии [6].
Большинство Мп, подобно вирусам, являются клеточными паразитами. Но в отличие от них преимущественно населяют не ядро или цитоплазму, а клеточные мембраны, располагаясь на их поверхностях, углубляясь в них или даже «сливаясь» с ними. В человеческом организме объектами паразитирования для микоплазм являются клетки эпителия, нервных волокон, паренхиматозных органов, мышц, суставов, желез, а также клетки крови и других микроорганизмов, нормально или патологически населяющих органы человека [7, 8].
Мп обладают способностью воспроизводить на своих мембранах молекулярные комплексы, серологически малоотличимые от «хозяйских». Антигенная мимикрия, наряду с эндоцитарным (эпицитарным) паразитированием, делает микоплазмы малозаметными и малоуязвимыми для иммунной системы. Если же организму все-таки удается распознать их чужеродность, под его иммунный удар неизбежно попадают собственные, контаминированные Мп клетки, что для макроорганизма означает аутоиммунное расстройство [9, 10].
Свое место пребывания в организме хозяина микоплазмы не ограничивают статичными тканевыми образованиями. Они имеют тропность и к форменным элементам крови, особенно к лейкоцитам. Внедрившись в мембрану лейкоцита, Мп могут попадать с ним в ткани различных органов.
Причастность Мп к иммунодефицитам и аутоиммунным расстройствам впервые была установлена еще в 1970 году при обследовании пациентов с первичной гипогаммаглобулинемией, что и послужило первым сигналом для радикального пересмотра места и роли этих микроорганизмов в патогенезе. В настоящее время некоторые исследователи считают Мп главными виновниками клинических проявлений ВИЧ-инфекции, а некоторые вообще считают, что возбудителем СПИДа является не вирус, а Мп [10, 11].
В литературе имеются сообщения о заболеваниях поджелудочной железы и других эндокринных органов микоплазменной этиологии [2, 4]. В.Н. Прилепская и соавт. [2, 12] выявили Мп во всех случаях аутоиммунного тиреоидита (АИТ) и в процессе его лечения противомикоплазменными препаратами (М122) отмечали положительную динамику.
Возможные механизмы развития аутоиммунных реакций при микоплазменных инфекциях представляются следующим образом (по Пфейфер, 1998, с изменениями и дополнениями) [9]:
— внутри клетки микоплазмы могут связываться с молекулами главного комплекса гистосовместимости (ГКГС) 1-го класса, и этот комплекс распознается цитотоксическими Т-лимфоцитами; «своя» клетка, несущая чужеродные антигены, может быть уничтожена вместе с ними;
— перекрестно реагирующие антигены, т.е. общие антигенные детерминанты Мп и хозяина, могут стимулировать Т-хелперы для «молчащих» аутореактивных В-клеток; при наличии аутореактивных В-лимфоцитов, когда клональная элиминация оказалась недостаточной для элиминации всех аутореактивных В-клеток, инвазивные микроорганизмы, имеющие общие с хозяином антигенные детерминанты, способны вызвать выработку аутоантител к «своим» антигенам;
— установлено существование при микоплазмозе аутоантител, не реагирующих с организмом, что объясняют существованием идиотипспецифических Т-хелперов и общего идиотипа у АТ разной специфичности;
— поздно появившиеся или секвестрированные АТ впервые контактируют с лимфоцитами только после поражения содержащего их органа (в результате повреждения ткани и воспаления вследствие инфекции) и воспринимаются как «чужие»;
— если в результате микоплазменной инфекции на поверхности нормальных клеток появляются молекулы ГКГС 2-го класса, пусковым фактором экспрессии этих молекул может быть гамма-интерферон;
— как результат аутотоксического воздействия активных метаболитов кислорода (АМК), повышенный уровень АМК индуцирует повреждение белков, липидов и нуклеиновых кислот; модификация белков вызывает появление у них антигенных свойств;
— образующиеся иммунные комплексы, в свою очередь, стимулируют продукцию АМК фагоцитами; окисление липидов приводит к появлению хемоаттрактантов, усиливающих миграцию фагоцитов; эти реакции, образуя порочный круг, приводят к хронической патологии и могут лежать в основе аутоиммунных реакций человека при персистенции Мп.
Следует иметь в виду, что результат взаимодействия инфекционных агентов с организмом хозяина зависит в значительной степени от состояния его иммунного гомеостаза. В этом плане представляют интерес особенности взаимодействия Мп с компонентами иммунной системы женщин репродуктивного и постменопаузального периодов, так как известно, что постменопауза сопровождается инволютивными изменениями центрального органа иммунной системы — тимуса.
Установление указанных особенностей у женщин с аутоиммунным тиреоидитом явилось целью данного исследования.
Материалы и методы
У 55 женщин с АИТ в возрасте от 26 до 62 лет (29 в возрасте 31,4 ± 0,8 года и 26 — 51,4 ± 0,4 года) и 25 женщин без тиреоидной патологии в возрасте от 25 до 59 лет — контрольная группа (12 в возрасте 31,8 ± 0,9 года и 13 — 50,9 ± 0,8 года) иммуноферментным методом исследованы в сыворотке крови иммуноглобулины G (IgG) к Мп. У всех женщин исследованы также уровни антител к тиреоглобулину (АТ к ТГ) и тиреопероксидазе (АТ к ТПО) иммуноферментным методом и показатель Fas-опосредованного апоптоза по уровню CD95 — иммунопероксидазным методом. У женщин с АИТ, кроме того, исследован иммунофенотип лимфоцитов с использованием стабильных диагностикумов на основе моноклональных АТ к CD3+, CD4+, CD8+, CD16+, CD20+.
Статистическая обработка данных выполнена с помощью программы Biostatistics, Version 6.0. Статистический анализ предусматривал оценку нормальности распределения изучаемых переменных с помощью теста Колмогорова — Смирнова, расчет основных статистических параметров (среднее значение и его ошибка). Для изучения связи между показателями использовали метод корреляционного анализа с определением коэффициента корреляции (r) и установлением его значимости по t-критерию с 95% уровнем надежности (р < 0,05).
Результаты и их обсуждение
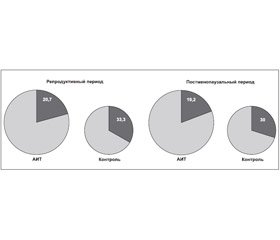
При анализе частоты выявления IgG к Мп (рис. 1) установлено, что среди женщин без тиреопатологии и в репродуктивном, и в постменопаузальном возрастном периоде носителями АТ были около трети обследованных (33,3 и 30,0 % соответственно).
На фоне АИТ доля таких женщин была меньшей — примерно пятая часть и в репродуктивном (20,7 %), и в постменопаузальном периоде (19,2 %). Это позволяет сделать вывод, что наличие АИТ не ассоциируется с учащением микоплазмоза.
Что касается уровней IgG к Мп, то, в соответствии с полученными данными, в репродуктивном периоде на фоне АИТ этот показатель вырос на 52,9 % (0,260 ± 0,090 г/л против 0,169 ± 0,050 г/л). В постменопаузальном периоде по сравнению с репродуктивным уровни IgG к Мп выросли в обеих группах, но если на фоне АИТ это увеличение было небольшим (на 13,5 %), то в группе без тиреопатологии — в 4,4 раза (р < 0,05). В результате в постменопаузе уровень IgG к Мп стал достоверно (р < 0,05) выше в контрольной группе по сравнению с больными АИТ (табл. 1). Эти результаты позволяют предположить, что в постменопаузальном периоде создаются условия для активации микоплазмоза, причем на фоне АИТ — в меньшей степени.
Исследование ассоциативных связей между IgG к Мп и изученными компонентами клеточного и гуморального иммунитета (табл. 2) показало, что у женщин с АИТ в репродуктивном периоде имела место только достоверная прямая корреляция с В-клетками (СD20): r = 0,474, р < 0,05, и обратная — с маркером Fas-опосредованного апоптоза (СD95): r = 0,456, р < 0,05.
С Т-хелперами (СD4) и Т-супрессорами (СD8), а также с натуральными киллерами (СD16) достоверной корреляции показателя IgG к МП не определялось.
В группе женщин с АИТ постменопаузального периода определялась сильная прямая корреляция между IgG к Мп и АТ к ТГ: r = 0,867, р < 0,01. Можно сделать вывод, что при микоплазмозе у женщин с АИТ в большей степени в аутоиммунном процессе играет роль гуморальное звено иммунитета, а в репродуктивном периоде в аутоиммунный процесс, связанный с АИТ, включены процессы Fas-опосредованного апоптоза.
Выводы
1. Возрастной фактор у женщин не влияет на частоту выявляемых иммуноглобулинов G к микоплазмам, но наличие аутоиммунного тиреоидита не увеличивает этот показатель.
2. Активность микоплазменной инфекции в постменопаузальном периоде растет по сравнению с репродуктивным, но при этом у женщин без тиреопатологии — в значительно большей степени.
3. У женщин с аутоиммунным тиреоидитом механизмы развития аутоиммунного процесса реализуются главным образом через гуморальное звено иммунитета (В-лимфоциты в репродуктивном периоде и антитела к тиреоглобулину — в постменопаузе), а также через изменение активности Fas-опосредованного апоптоза — в репродуктивном периоде.
1. Борхсениус С.Н. Взаимодействие микоплазм с иммунной системой животных и человека [Текст] / С.Н. Борхсениус, О.А. Чернова, В.М. Чернов // Цитология. — 2001. — Т. 43, № 3. — С. 219–242.
2. Инфекции, передающиеся половым путем [Текст]: клинические лекции / под ред. В.Н. Прилепской. — М.: ГЭОТАР-Медиа, 2014. — 157 с.
3. Nonaka T. Triskelion structure of the Gli521 protein, involved in the gliding mechanism of Mycoplasma mobile [Text] / T. Nonaka, J. Adan-Kubo, M. Miyata // J. Bacteriol. — 2010. — Vol. 192(3). — P. 636–642.
4. Kawahito Y. Mycoplasma fermentans glycolipid-antigen as a pathogen of rheumatoid arthritis [Text] / Y. Kawahito, S. Ichinose, H. Sano, Y. Tsubouchi et al. // Bichem. Biophys. Res. Commun. — 2008. — Vol. 369. — P. 561–566.
5. Fabisiak J.P., Mycoplasma fermentans and TNF-beta interact to amplify immune-modulating cytokines in human lung fibroblasts. [Text] / J.P. Fabisiak, F. Gao, R.G. Thomson et al. // Amer. J. Physiol-Lung Cell Mol. Physiol. — 2006. — Vol. 291. — L781–L793.
6. Liu C.L. A family associated outbreak of Mycoplasma pneumoniae infection in a hospital ward [Text] / C.L. Liu, G.S. Tian, Y. He et al. // Zhonghua Liu Xing Bing Xue Za Zhi. — 2011. — Vol. 32(11). — P. 1110–1113.
7. Goldenberg R.L. The Alabama Preterm Birth Study: umbilical cord blood Ureaplasmaurealyticum and Mycoplasma hominis cultures in very preterm newborn infants [Text] / R.L. Goldenberg, W.W. Andrews, A.R. Goepfert, O. Faye-Petersen, S.P. Cliver, W.A. Carlo, J.C. Hauth // Am. J. Obstet. Gynecol. — 2008. — Vol. 198, № 1. — Р. 43.e 1–5.
8. Прокопюк В.Ю. Микоплазмоз в практике акушера-гинеколога [Текст] / В.Ю. Прокопюк // Медицинские аспекты здоровья женщины. — 2008. — № 5(14). — С. 61–65.
9. Плейфер Дж. Наглядная иммунология [Текст] / Дж. Плейфер. — М.: ГЭОТАР-Медицина, 1998. — 95 с.
10. Борхсениус С.Н. Микоплазмы. Молекулярная и клеточная биология, взаимодействие с иммунной системой млекопитающих, патогенность, диагностика [Текст] / С.Н. Борхсениус, О.А. Чернова, В.М. Чернов и др. — СПб.: Наука, 2002. — 256 с.
11. Фофанова И.Ю. Современные представления об урогенитальной микоплазменной инфекции [Текст] / И.Ю. Фофанова, В.Н. Прилепская // Гинекология. — 2014. — № 2. — С. 4–8.
12. Прилепская В.Н. К вопросу о роли микоплазм в урогенитальной патологии [Текст] / В.Н. Прилепская, В.И. Кисина, Е.В. Соколовский, А.М. Савичева, М.А. Гомберг, А.Е. Гущин, К.И. Забиров, Е.В. Ширшова // Гинекология. — 2007. — Т. 9, № 1. — С. 31–38.

/20/20.jpg)
/20/20_2.jpg)
/21/21.jpg)