Журнал «Медицина неотложных состояний» 7 (62) 2014
Вернуться к номеру
Динаміка добової екскреції катехоламінів у хворих на персистуючу форму фібриляції передсердь на фоні ІХС у поєднанні з гіпертонічною хворобою під впливом комбінованої терапії
Авторы: Сідь Є.В. — ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», кафедра медицини невідкладних станів
Рубрики: Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 171-173
Фібриляція передсердь (ФП) залишається серйозною й невирішеною проблемою, поширення її становить 1–2 % у популяції і залежить від віку. При наявності у хворого ФП ризик розвитку інсульту підвищується в 5 разів, а смертність — приблизно в 2 рази порівняно з людьми з синусовим ритмом. Симпатоадреналова система є найважливішою нейроендокринною системою організму, що забезпечує підтримання циркуляторного гомеостазу. Це дає підставу припускати безпосередню участь даної системи регуляції і в механізмі виникнення та підтримки такої форми аритмії, як фібриляція передсердь. Гіперактивація симпатоадреналової системи справляє негативний вплив на стан серцево-судинної системи — викликаючи надмірну констрикцію вен і артеріол, надлишок катехоламінів значно підвищує потребу міокарда в кисні, створюючи кардіотоксичний ефект.
Мета дослідження: вивчити динаміку добової екскреції катехоламінів у хворих із персистуючою формою фібриляції передсердь на фоні ІХС у поєднанні з гіпертонічною хворобою (ГХ) під впливом комбінованої терапії з включенням бета-адреноблокатора (метопрололу тартрату) і статину (аторвастатину).
Матеріали і методи
Результати дослідження ґрунтуються на даних комплексного обстеження та динамічного спостереження за 62 хворими з персистуючою формою фібриляції передсердь на фоні ІХС у поєднанні з гіпертонічною хворобою віком від 45 до 65 років (середній вік становив 58,7 ± 0,5). Хворим було призначено комбіновану терапію: інгібітор АПФ (еналаприл) у середній добовій дозі 10 мг + бета-блокатор (метопрололу сукцинат у добовій дозі 50–100 мг). Антиагрегант (аспірин) або антикоагулянт непрямої дії (варфарин) призначався згідно з рекомендаціями Європейського кардіологічного товариства після розрахування ризику за шкалами CHA2DS2-VASc та HAS-BLED. Програму дослідження повністю виконало 62 пацієнти, з яких 31 хворий приймав статин (аторвастатин) у середній добовій дозі 20 мг — вони становили першу підгрупу. Другу підгрупу становив 31 пацієнт з негативним досвідом застосування статинів в анамнезі, або негативним ставленням до цього класу препаратів, або з протипоказаннями до прийому інгібіторів HMG-CoA-редуктази. Оцінка результатів дослідження проводилася через 18 тижнів від початку проведення лікування. Динаміка показників оцінювалась за допомогою Delta check method. Статистична обробка отриманих результатів проводилася з використанням методів параметричної та непараметричної статистики із застосуванням пакету прикладних програм Microsoft Excel 2003 і Statistica 6.0.
Результати
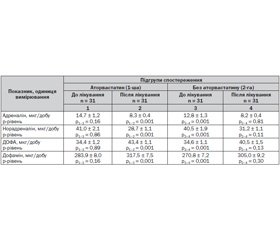
Аналіз отриманих у нашому дослідженні даних показав, що протягом 18 тижнів спостереження в обох групах пацієнтів було досягнуто статистично значущого зниження добової екскреції катехоламінів із сечею (табл. 1). Показники рівнів добової екскреції катехоламінів суттєво не відрізнялися в обох групах на початку лікування (p > 0,05). Як у пацієнтів підгрупи аторвастатину, так і в підгрупі без аторвастатину спостерігалася вірогідно позитивна динаміка біохімічних показників.
Як видно з табл. 1, рівень добової екскреції адреналіну у хворих із персистуючою формою ФП на фоні ІХС у поєднанні з ГХ вірогідно (p < 0,05) знизився при комбінованій терапії як із включенням аторвастатину, так і без аторвастатину, відповідно з 14,20 ± 1,27 мкг/добу до 8,3 ± 0,4 мкг/добу та з 12,8 ± 1,3 мкг/добу до 8,2 ± 0,4 мкг/добу. Також вірогідно (p < 0,05) знизився і рівень норадреналіну у підгрупі аторвастатину з 41,0 ± 2,1 мкг/добу до 28,7 ± 1,1 мкг/добу, а в підгрупі хворих, які не приймали аторвастатин, — з 40,5 ± 1,9 мкг/добу до 31,2 ± 1,1 мкг/добу.
У хворих із персистуючою формою на фоні ІХС у поєднанні з ГХ через 18 тижнів комбінованої терапії як з включенням аторвастатину, так і без аторвастатину відбулося вірогідне (p < 0,05) підвищення добової екскреції ДОФА відповідно з 34,1 ± 0,8 мкг/добу до 43,4 ± 1,1 мкг/добу та з 34,6 ± 1,1 мкг/добу до 40,5 ± 1,5 мкг/добу. Добова екскреція дофаміну на початку лікування у підгрупі аторвастатину становила 283,9 ± 8,0 мкг/добу та вірогідно (p < 0,05) збільшилась під впливом терапії до 317,5 ± 7,5 мкг/добу, у підгрупі комбінованої терапії без аторвастатину також вірогідно (p < 0,05) збільшилась добова екскреція дофаміну з сечею з 270,8 ± 7,2 мкг/добу до 305,0 ± 9,2 мкг/добу. Динаміка катехоламінів у сечі у хворих на персистуючу форму ФП на фоні ІХС у поєднанні з ГХ через 18 тижнів лікування наведена в табл. 2.
Як свідчать отримані дані, за період спостереження дві стратегії лікування виявляли досить порівнянний вплив на реверсію добової екскреції катехоламінів. Слід зазначити, що хоча і не було статистично значимих відмінностей між підгрупами за відсотком зниження норадреналіну, у хворих, які отримували аторвастатин, цей показник знизився більше (–31,9 % проти –20,3 % у підгрупі хворих, які не отримували статин). Існують роботи (T. Matsuda et al., 2008; A. Schmechel et al., 2009), у яких показано зниження синтезу та екскреції катехоламінів під впливом інгібіторів 3-гідрокси-3-метил-глутарил-КоА-редуктази, але можливо, період спостереження у нашому дослідженні виявився недостатнім для реалізації ефекту аторвастатину або недостатньою була доза препарату.
Таким чином, тривала підтримуюча терапія хворих на персистуючу форму фібриляції передсердь на фоні ІХС у поєднанні з гіпертонічною хворобою з включенням аторвастатину може мати позитивний вплив на серцево-судинну систему шляхом зниження негативної дії катехоламінів.

/172/172.jpg)