Газета «Новости медицины и фармации» 21-22 (523-524) 2014
Вернуться к номеру
Плейотропні ефекти метформіну в сучасному менеджменті цукрового діабету 2-го типу: акцент на онкопротекцію
Авторы: Паньків І.В. — Буковинський державний медичний університет, м. Чернівці
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 3-6 (Мир)
Проблема управління цукровим діабетом (ЦД) 2-го типу із призначенням пероральних цукрознижувальних препаратів (ПЦЗП) стосується багатьох людей, оскільки зростання поширеності цієї недуги свідчить про її глобальну епідемію. Гіперглікемія розглядається не лише як невід’ємна метаболічна ознака ЦД 2-го типу, вона залишається провідним порушенням, на усунення якого слід скерувати лікування, розпочинаючи вже з дебюту захворювання. Стратегічна мета лікування людини з ЦД 2-го типу полягає в досягненні максимального зниження сумарного ризику розвитку діабетичних ускладнень за рахунок досягнення та підтримання цільового рівня визначених показників та модифікації факторів ризику, ефективного лікування супутніх клінічних станів. На сьогодні ефективне управління ЦД скероване на запобігання виснаженню бета-клітин підшлункової залози, профілактику і/або уповільнення прогресування розвитку як мікро-, так і макросудинних ускладнень захворювання, що призводять до інвалідності пацієнтів і ранньої смертності. Забезпечення тривалого контролю цільового рівня глюкози в крові за допомогою дотримання здорового способу життя досягається далеко не у всіх людей із ЦД 2-го типу. Лише медикаментозні методи лікування на доповнення до немедикаментозних допомагають досягти цільового рівня глюкози в крові. Згідно з чинними настановами, на сьогодні ЦД 2-го типу без призначення медикаментозної терапії для контролю глікемії не лікується.
На вибір лікарського засобу при ЦД 2-го типу впливають зручність використання, передбачуваний ступінь прихильності пацієнта до лікування, вартість препарату. При цьому пріоритет має належати засобам із мінімальним ризиком гіпоглікемії, з особливою увагою до групи осіб високого ризику (пацієнти з тривалістю ЦД 2-го типу понад 10 років, з вираженою макросудинною патологією, відсутністю розпізнавання гіпоглікемії, серйозними супутніми захворюваннями).
Метформін залишається основним препаратом першої лінії в лікуванні ЦД 2-го типу, найбільш вивченим із точки зору ефективності та безпечності лікарським засобом при монотерапії. Початкова доза метформіну становить 500 мг один раз на добу (зі сніданком), з подальшим збільшенням на 500 мг з інтервалом 1–2 тижні залежно від переносимості й ефективності. Максимальна добова доза метформіну становить 3 г (у декілька прийомів), хоча на практиці добові дози понад 2,5 г використовуються нечасто. Слід уникати або припинити лікування метформіном у пацієнтів із підозрою на гіпоксію тканин (наприклад, гостра серцева або дихальна недостатність, сепсис, тяжка печінкова недостатність, алкоголізм із підвищенням рівня печінкових ферментів у 2,5 раза й більше від норми). Не слід призначати метформін пацієнтам із ЦД 2-го типу та вираженою серцевою недостатністю із зниженням фракції викиду (< 40 %).
Лікування метформіном розпочинають безпосередньо від моменту встановлення діагнозу одночасно із заходами стосовно зміни способу життя.
Клінічні ефекти метформіну, крім його антигіперглікемічних властивостей, досить добре вивчені. Вперше вони були опубліковані після завершення багаторічного дослідження UKPDS (United Kingdom Prospective Diabetes Study) у 1998 р., яке засвідчило, що терапія метформіном знижує:
— ризик розвитку судинних ускладнень — на 32 %;
— смертність від ЦД — на 42 %;
— загальну смертність — на 36 %;
— ризик розвитку інфаркту міокарда — на 39 %.
Якщо проаналізувати основні висновки досліджень за останнє десятиріччя, то можна констатувати, що метформін має унікальні безпосередні ангіопротекторні властивості, які не залежать від цукрознижувального ефекту препарату. Подвійна дія метформіну дає змогу пояснити результати стосовно зниження смертності.
Ще одним важливим і дуже перспективним напрямом у вивченні властивостей метформіну є його антионкогенний ефект.
За даними епідеміологічних досліджень, пацієнти з ЦД схильні до розвитку злоякісних пухлин певних локалізацій, серед яких найчастіше трапляються рак печінки і підшлункової залози, колоректальний рак і рак тіла матки, дещо менше — рак молочної залози у жінок у постменопаузальному періоді. Величина відносного ризику (ВР) стосовно раку молочної залози в період менопаузи становить 1,15–1,20, у випадках раку підшлункової залози досягає 3,0–4,5 (Vigneri P. et al., 2009).
На сьогодні відсутні однозначні відомості стосовно інших новоутворень при ЦД. Так, не встановлено вірогідних зв’язків між ЦД і ризиком розвитку раку молочної залози в жінок репродуктивного віку (La Vecchia C. et al., 2011), а ризик виникнення раку передміхурової залози у хворих на ЦД навіть дещо знижений (Wotton C.J. et al., 2011). Незважаючи на неоднорідний характер зв’язків між ЦД і онкологічною захворюваністю, в онкологічних хворих на тлі ЦД ризик смерті за інших однакових умов вищий, ніж у хворих без ЦД (Richardson L.C. et al., 2005), що підтвердив і метааналіз публікацій із цієї проблеми (Barone B.B. et al., 2008).
Інші не менш важливі обставини вказують на відмінності між ЦД 1-го і 2-го типів стосовно як ризику виникнення злоякісних пухлин (із деякою перевагою при ЦД 1-го типу), так і структури онкологічної захворюваності (Shu X. et al., 2010). Безумовно, гетерогенність природи ЦД й ожиріння, особливості впливу цих патологічних процесів на тканини-мішені визначають і підсумковий результат, тобто популяційний рівень поширеності онкологічних захворювань (Бернштейн Л.М., 2012).
При цьому ожиріння більш істотно порівняно з ЦД підвищує ризик розвитку злоякісних пухлин, і цей ефект проявляється відносно більшим числом їх локалізацій (Calle E.E. et al., 2004).
Вплив терапії метформіном на виникнення онкологічної патології при ЦД
При аналізі бази даних 11 876 мешканців району Тейсайд у Шотландії, хворих на ЦД 2-го типу (середній вік — 73 роки, тривалість ЦД — 8,4 року), за період з 1993 до 2001 року було встановлено, що згодом (не менше одного року після виявлення хвороби) 923 особи були госпіталізовані з приводу раку (Evans J.M.M. et al., 2005). Дослідники звернули увагу на той факт, що прийом метформіну хворими на ЦД може поєднуватися в них зі зниженням ризику розвитку злоякісних новоутворень. У хворих, які отримували метформін, ВР розвитку злоякісних новоутворень порівняно з хворими, які не отримували цей препарат, становив 0,77, тобто знижувався на 23 %. При збільшенні тривалості прийому метформіну ВР досягав значень 0,56–0,57 (зниження на 43,5 %). У дослідженні не вказувалася локалізація пухлин.
В інше дослідження, проведене в Канаді (Bowker S.L. et al., 2006), було залучено 10 309 хворих на ЦД 2-го типу (середній вік — 63,4 року, тривалість спостереження — 5,4 року). 6969 осіб лікувалися метформіном, 3340 — препаратами сульфонілсечовини (ПСС). У 82,4 % випадків (5740 осіб) на тлі прийому метформіну з часом було призначено ПСС, а у 16,3 % випадків — інсулін; у групі, яка отримувала ПСС, інсулін періодично використовувався в 9,2 % спостережень. При перерахунку на 1000 людино-років спостереження з’ясувалося, що асоційована з раком смертність становила 6,3 в групі метформіну, 9,7 — у групі ПСС (р < 0,001) і 9,9 — у групі осіб, які отримували інсулін (порівняно з 6,8 у групі, яка не лікувалася інсуліном, р < 0,01). Дані про локалізацію пухлин у дослідженні не наводилися.
У роботі, опублікованій у 2010 р. (Landman G.W.D. et al., 2010), відзначалося, що в 1353 хворих на ЦД, за якими спостерігали в середньому впродовж 9,5 року, смертність від злоякісних новоутворень (n = 122) була вірогідно нижча при прийомі метформіну, ніж у випадках, коли цей препарат не використовувався (ВР = 0,43). Зазначалося, що ефективність препарату в цьому відношенні була тим вищою, чим більшою була його добова доза.
У подальших дослідженнях аналіз онкологічної захворюваності ґрунтувався вже на реєстрації локалізації новоутворень. У ретроспективному когортному дослідженні, проведеному в США із залученням 191 233 хворих на ЦД (середній вік — 56 років, тривалість спостереження в середньому 3,9 року), було виявлено 813 випадків раку. Хоча здебільшого це дослідження оцінювало динаміку онкологічної захворюваності на тлі прийому тіазолідиндіонів, серед залучених хворих була виділена група пацієнтів, яка отримувала монотерапію метформіном. При монотерапії метформіном (порівняно з хворими, які не отримували цей препарат) спостерігалися відсутність впливу на ризик виникнення раку сечового міхура (ВР = 0,99), тенденція до підвищення ризику виникнення раку підшлункової залози (ВР = 1,26) і до зниження ризику розвитку колоректального раку (ВР = 0,67) і раку печінки (ВР = 0,73) (Oliveria S.A. et al., 2008).
У двох відносно нечисленних за кількістю пацієнтів дослідженнях, проведених на госпітальному рівні в США і Італії, навпаки, при прийомі метформіну хворими на ЦД було встановлено не підвищення, а зниження ризику виникнення раку підшлункової залози (ВР = 0,38; р = 0,001) і підтверджено зниження ризику розвитку гепатобластоми (ВР = 0,33; р = 0,006) здебільшого за рахунок хворих чоловічої статі (Donadon V. et al., 2009).
У більшому дослідженні (Currie C.J. et al., 2009) проаналізовано відомості про 62 809 хворих на ЦД (віком понад 40 років), які були розподілені на 4 групи (монотерапія метформіном — 31 429 осіб, монотерапія ПСС — 7439 осіб, комбінація метформіну і ПСС — 13 882 осіб, інсулінотерапія — 10 067 осіб). Середній вік обстежених становив відповідно 58,6; 70,0; 64,4 і 63,7 року, частка жінок — від 42,1 до 48,9 %. Результати роботи оцінювали за ризиком прогресування до розвитку будь-якого новоутворення або пухлин молочної залози, товстої кишки, підшлункової і передміхурової залози. Загальна тривалість спостереження становила 152 065 людино-років, що в перерахунку на число хворих із ЦД становило в середньому 2,4 року. З поправкою на вік і стать встановлено хоча і незначні в кількісному відношенні, але статистично вірогідні відмінності в ефекті метформіну (до 5-го року, ВР = 0,96), з одного боку, і ПСС або інсуліну (ВР = 0,94) — з іншого, а поєднання метформіну з ПСС нівелювало несприятливий ефект останніх, насамперед при раку підшлункової залози, а також раку товстої кишки (р = 0,02), при якому позитивний ефект самого метформіну був найбільш виражений. При іншому способі підрахунку (порівняно з групою хворих на ЦД, які не отримували жодного лікування) ВР стосовно ризику виникнення будь-яких злоякісних новоутворень становив: для метформіну — 0,90; ПСС — 1,23; комбінації метформіну і ПСС — 0,97; інсулінотерапії — 1,28.
Ще в одному метааналізі (Soranna D. et al., 2012) узагальнені результати 17 досліджень, що містять дані про 37 632 випадки раку. Встановлено, що застосування метформіну вірогідно асоціюється зі зменшенням ВР усіх випадків раку (ВР = 0,61, 95% довірчий інтервал (ДІ) 0,54–0,70), колоректального раку (ВР = 0,64, 95% ДІ 0,54–0,76) і раку підшлункової залози (ВР = 0,38, 95% ДІ 0,14–0,91). Автори підкреслюють, що застосування саме метформіну, а не ПСС сприяє зменшенню ризику розвитку онкопатології.
H. Zhang і співавт. (2012 р.) повідомляють про зменшення ризику розвитку гепатоцелюлярної карциноми у хворих на ЦД на тлі лікування метформіном.
Певна варіабельність результатів стосовно окремих локалізацій раку була підтверджена в дослідженні J.L. Wright і J.L. Stanford (2009 р.), у якому на відміну від роботи C.J. Currie і співавт. (2009 р.) при прийомі метформіну хворими на ЦД виявилося зниження ризику виникнення раку передміхурової залози, щоправда, тільки у європеоїдів, але не в афроамериканців.
У проведених дослідженнях у хворих на ЦД на тлі лікування метформіном не встановлено істотного впливу на ризик виникнення раку молочної залози (Oliveria S.A. et al., 2008), чого можна було очікувати на підставі деяких доклінічних випробувань і що можна пояснити різними причинами (Phoenix K.N. et al., 2010). У той же час у роботі G. Libby і співавт. (2009 р.) застосування метформіну великою групою осіб із ЦД (понад 4000) при 10-річному спостереженні призвело до зменшення на 37 % ризику розвитку не лише всіх новоутворень, але й також пухлин легень, товстої кишки і молочної залози, що дає підстави додатково замислитися про причини і медіаторні механізми цього ефекту.
За даними значної кількості сучасних досліджень, інсулінорезистентність, компенсаторна гіперінсулінемія і ЦД асоційовані з більш високим ризиком розвитку онкопатології різної локалізації. Крім того, застосування цукрознижувальних препаратів має різний вплив на число випадків розвитку онкозахворювань.
У зв’язку з цим у серпні 2013 року був виданий спільний Консенсус ААСЕ/АСЕ (Американської асоціації клінічних ендокринологів/Американської колегії ендокринологів) із ЦД і онкопатології.
У цьому документі проаналізовано взаємозв’язок між індексом маси тіла (ІМТ), гіперінсулінемією, високим рівнем С-пептиду, підвищеним рівнем інсуліноподібного фактора росту (ІФР), ЦД і розвитком онкопатології, а також смертністю від онкопатології. Цей взаємозв’язок був досить чітко продемонстрований у багатьох дослідженнях.
У табл. 1 наведені результати досліджень, які встановлюють взаємозв’язок між збільшенням ІМТ (понад 25 кг/м2) та ризиком розвитку злоякісних новоутворень.
До факторів, що сприяють підвищенню онкологічного ризику при ЦД 2-го типу, зараховують надмірну масу тіла, центральний тип ожиріння, інсулінорезистентність/гіперінсулінемію (включаючи зміни рівня С-пептиду і проінсуліну, інсуліноподібних факторів росту). Окремі експерти висловлюють точку зору про більшу небезпеку стану порушеної толерантності до глюкози (ПТГ) порівняно з ЦД. Закономірність появи злоякісних новоутворень схематично можна описати такою послідовністю: ПТГ ≥ ЦД 2-го типу ≥ гестаційний діабет ≥ ЦД 1-го типу (Берштейн Л.М. і співавт., 2006). Певну роль у збільшенні частоти злоякісних новоутворень на тлі ЦД відіграє генетичний фактор.
ІФР-1 — один із трьох представників ІФР, що здійснюють ендокринну, автокринну й паракринну регуляцію процесів росту, розвитку й диференціювання клітин і тканин організму. ІФР-1 виробляється гепатоцитами печінки у відповідь на стимуляцію їх соматотропних рецепторів. Саме ІФР-1 забезпечує практично всі фізіологічні ефекти соматотропного гормона в периферичних тканинах. Його наслідки були названі «некерованою інсуліноподібною діяльністю».
ІФР-1 повинен зв’язуватися зі специфічним рецептором, який за умов хронічної гіперінсулінемії виявляється конкурентно заблокованим інсуліном, що призводить до циркуляції великої кількості незв’язаного ІФР-1.
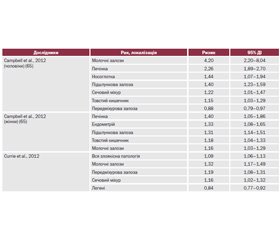
Циркулюючий ІФР-1 може зв’язуватися специфічним білком — IGFBP-3, і в природних умовах таким чином зв’язується до 90 % циркулюючого ІФР. У разі хронічної гіперінсулінемії відбувається виснаження запасів цього білка, що призводить до збільшення вільного (незв’язаного, циркулюючого) ІФР-1, для якого доведений прямий взаємозв’язок із розвитком онкопатології. Відповідно в пацієнтів із маніфестним ЦД онкозахворюваність вища (табл. 2, 3). Вищою стає не лише захворюваність, але й смертність від онкопатології (табл. 4, 5).
Ожиріння й асоційована з ним гіперінсулінемія можуть впливати на ризик розвитку раку за допомогою зв’язування ліганда з рецептором інсуліну і/або за рахунок підвищення рівня циркулюючого ІФР-1. За умов тривалої гіперінсулінемії збільшуються концентрації вільних ІФР-1 і ІФР-2. Підтверджений прямий зв’язок між ІМТ, гіперінсулінемією і рівнем вільного ІФР-1.
У метааналізі за участю більше ніж 900 тисяч пацієнтів, який покладено в основу Консенсусу ААСЕ/АСЕ, було показано, що в разі показника ІМТ > 25 кг/м2 (навіть за відсутності інсулінорезистентності та ЦД) підвищується вірогідність виникнення раку ендометрію, молочної залози, товстого кишечника, щитоподібної залози, тобто пухлин різних локалізацій (за винятком раку підшлункової залози, стравоходу і легень). Аналіз взаємозв’язку підвищеного рівня інсуліну в плазмі, С-пептиду та ІФР-1 показав почастішання випадків онкологічних захворювань різних локалізацій (раку молочної залози, товстого кишечника та ін.).
Ще в дослідженні UKPDS було показано зменшення смертності від онкозахворювань серед хворих, які отримували метформін. Автори консенсусу досить детально проаналізували взаємозв’язок різних схем терапії з розвитком онкопатології. Встановлено, що застосування метформіну асоційоване зі зниженням онкозахворюваності і смертності від онкозахворювань, а для препаратів із групи тіазолідиндіонів цей ризик вищий.
На сьогодні розиглітазон не рекомендований до застосування (тривають дискусії щодо можливості й раціональності його використання у деяких категорій хворих), а прийом піоглітазону асоціюється з підвищенням рівня онкологічної захворюваності і смертності. Факторами ризику визнані тривалість застосування піоглітазону понад 24 місяці і кумулятивна доза понад 28 000 мг (Azoulay et al., 2012).
Згідно з даними Консенсусу ААСЕ/АСЕ (2013 р.), препарати, що впливають на екскрецію глюкози, не мають достатньої доказової бази щодо впливу на частоту виникнення онкологічних захворювань; неможливо зробити чіткий висновок про вплив на вказаний параметр інкретинів (інгібіторів дипептидилпептидази-4 і агоністів глюкагоноподібного пептиду-1); інсулін може провокувати підвищення ризику розвитку раку при застосуванні в дуже високих дозах. Ефекти препаратів сульфонілсечовини в метааналізі не оцінювалися.
В одній із недавніх робіт, що виконана американськими ученими B. Thakkar і співавт. (Metabolism. — 2013. — Vol. 62), порівнювалася дія метформіну і препаратів сульфонілсечовини на частоту виникнення онкопатології у хворих на ЦД 2-го типу. За даною темою метааналіз містив 2077 статей із бази даних PubMed за участю понад 600 тис. пацієнтів. Відібрано 23 статті з метформіну і 17 статей стосовно ПСС згідно з критеріями включення. Результати більше ніж переконливі: терапія метформіном у 355 420 учасників забезпечувала зниження частоти розвитку онкопатології на 30 % (ВР = 0,70 [95% ДI = 0,67–0,73]), що можна порівняти з даними Консенсусу ААСЕ/АСЕ 2013 р.
У той же час монотерапія препаратами сульфонілсечовини 296 904 хворих асоціювалася зі збільшенням частоти всіх видів раку в середньому на 55 % (ВР = 1,55 [95% ДI = 1,48–1,63]). Експерти пов’язують таку значну різницю впливу на ризик онкозахворюваності з тим фактором, що при монотерапії ПСС інсулінорезистентність не зникає. При такому лікуванні контроль глікемії досягається за рахунок більш вираженої гіперінсулінемії, з усіма супутніми факторами ризику. Початок терапії з метформіну дозволяє зменшити інсулінорезистентність, що призводить до зменшення рівня гіперінсулінемії зі зменшенням усіх несприятливих аспектів цього стану.
У хворих, які розпочинають лікування з монотерапії ПСС, досягнення контролю глікемії пов’язане з подальшим більш значущим посиленням гіперінсулінемії, тобто долається поріг інсулінорезистентності й забезпечується адекватний цукрознижувальний ефект, але при цьому кількість інсуліну та ІФР-1 збільшується, що реалізується у вигляді збільшення частоти онкологічної патології.
Механізми дії та ефекти метформіну
Розпочинаючи з 2001 р., коли була опублікована робота G. Zhou і співавт., все більш популярною стає точка зору, що метформін належить до активаторів аденозинмонофосфаткінази (AMФК), що відіграє основну роль в енергетичному балансі клітини. Цей фермент входить до числа основних регуляторів клітинного метаболізму і є мішенню гена-супресора LKB1, втрата або мутація якого пов’язана з розвитком синдрому Peutz-Jeghers (гастроінтестинальні поліпи, пігментація шкіри і слизових оболонок), а також має відношення до виникнення раку молочної залози і деяких інших пухлин (Shackelford D.B. et al., 2009). АМФК активується при зменшенні енергетичних запасів клітини або фізичному навантаженні. Активація АМФК пов’язана з пригніченням клітинної проліферації, синтезу білка і гліколізу (клітинної енергетики) (Cazzaniga M. et al., 2009), що може пояснювати гальмівний ефект метформіну на ріст пухлини. Її активація можлива також за допомогою фосфорилювання треонінового залишку в a-субодиниці ензиму, за що відповідає супресор пухлинного росту LKB-1. Втрата функції сприяє формуванню доброякісних пухлин гамартом і деяких типів раку, зокрема раку легень і товстої кишки. Ймовірно, метформін впливає на LKB-залежний туморогенез (Shackelford D.B. et al., 2009).
Увага дослідників також привернута до вивчення взаємодій із комплексом mTOR, оскільки він інтегрує різні сигнали ростових факторів, енергетичний статус і регулює синтез протеїнів і клітинний ріст.
Для більшості подібних пухлин характерні високі рівні нерегульованої активності білка mTOR. Інший антионкогенний механізм, як вважають, ґрунтується на виявлених у дослідженні Т-лімфоцитах, позбавлених фактора VI, що асоціюється з рецептором фактора некрозу пухлин (TRAF6), і не здатних генерувати Т-клітини пам’яті. Недостатність пов’язана з дефектом окислення жирних кислот. При використанні метформіну відновлювався як метаболічний дефект, так і генерація Т-клітин пам’яті (Дедов И.И. и соавт., 2011).
Крім інгібуючого впливу, виявленого на деяких моделях експериментального канцерогенезу in vivo, зокрема при раку молочної залози (Bojkova B. et al., 2009), метформін зменшував і число пухлинних клітин при їх культивації in vitro (Dowling R.J. et al., 2007), що може свідчити як про гальмування клітинного розмноження, так і про стимуляцію апоптозу під впливом цієї сполуки залежно від об’єкту й умов дії (Liu B. et al., 2009).
Процес активації AMФK залучений у реалізацію нормалізуючого впливу метформіну на інсулінорезистентність (Shackelford D.B. et al., 2009) — ключовий фактор схильності до багатьох неінфекційних захворювань, включаючи новоутворення гормонозалежних тканин. Крім того, здатність метформіну пригнічувати активність ароматази — кінцевої ланки в біосинтезі естрогену, роль якого у формуванні схильності до розвитку низки пухлин не потребує додаткових характеристик, також може опосередкувати АМФК, у тому числі в стромальних клітинах молочної залози (Brown K.A. et al., 2009).
Зазначені механізми дозволяють зрозуміти потенційну користь використання метформіну в клінічній онкології.
Результати інших досліджень також можуть призвести до розширення показань до клінічного використання метформіну. Так, у 37-річної пацієнтки, яка хворіла на резистентну до прогестинів атипову гіперплазію ендометрія (облігатний передрак тіла матки), призначення метформіну в дозі 1,5 г/добу, не орієнтоване на будь-які ендокринні порушення, вже через місяць після початку лікування призвело до нормалізації стану внутрішньоматкового епітелію (Session D.R. et al., 2003). Успіх використання доопераційної хіміотерапії при раку молочної залози у хворих на ЦД, які отримували метформін (Jiralerspong S. еt al., 2009), викликав додатковий інтерес до подібного підходу і у хворих без ЦД.
Одну з точок прикладання метформіну вбачають, зокрема, у ситуаціях, що характеризуються резистентністю до гормоно-, хіміо- і біотерапії раку (Martin-Castillo B. et al., 2010). Так, мeтформін інгібує ріст клітин тиреоїдної карциноми, супресує самооновлення ракових стовбурових клітин і потенціює ефект хіміотерапевтичних засобів (Chen G. et al., 2012). Автори досліджували ефект метформіну на ріст диференційованих клітин щитоподібної залози людини, анапластичних клітин тиреоїдної карциноми, клітин і стовбурових клітин раку щитоподібної залози.
J. Rezzоnico і співавт. (2011 р.) вивчали вплив терапії метформіном на невеликі (до 2 см у діаметрі) вузли в щитоподібній залозі у 66 жінок з інсулінорезистентністю. Пацієнтки були розподілені на групи: група I (n = 14) — пацієнтки, які отримують метформін; група II (n = 18) — пацієнтки, які отримують метформін і левотироксин; група III (n = 19) — лікування левотироксином; група IV (n = 15) — пацієнтки, які не отримують медикаментозне лікування. Впродовж 6-місячного спостереження в пацієнток груп II і III зменшився рівень тиреотропного гормона, а в групах I і II нормалізувався індекс інсулінорезистентності HOMA. Середній розмір тиреоїдних вузлів становив 0,84 см у діаметрі. Після лікування у пацієнтів груп I і II спостерігалося вірогідне зменшення розмірів вузлів (медіана зменшення становила 30 і 55 % відповідно). У пацієнтів груп III і IV не встановлено вірогідних змін розмірів вузлів у щитоподібній залозі. Автори дійшли висновку, що метформін вірогідно зменшує розміри вузлів у щитоподібній залозі у пацієнток з інсулінорезистентністю і тиреоїдними вузлами невеликих розмірів, однак кращий результат встановлений при комбінованому лікуванні метформіном і левотироксином.
Як бачимо, ця проблема настільки велика, що в разі позитивних результатів ставлення до застосування метформіну як потенційного засобу профілактики й лікування в онкології підніметься на новий більш значущий щабель.
Отримані на сьогодні результати свідчать про можливості застосування метформіну як потенційного засобу зниження ризику деяких злоякісних новоутворень у хворих на ЦД 2-го типу й позитивно сприймаються експертами. Свідченням такого ставлення є, зокрема, той факт, що лише за період 2009–2010 рр. під егідою Національного інституту здоров’я і Національного інституту раку (США) розпочато близько 10 клінічних випробувань, пов’язаних з оцінкою біологічних ефектів і результатів використання метформіну при раку молочної залози, передміхурової залози, нирки тощо на різних етапах перебігу і лікування цих захворювань. Враховуючи можливість ширшого застосування метформіну в онкологічній практиці, слід здійснювати пошук системних і тканинних (включаючи саму пухлинну тканину) маркерів чутливості і резистентності до цього препарату, чому вже приділяється певна увага (Rezzónico J. et al., 2011).
Отже, доступна на сьогодні наукова інформація підтверджує плейотропні ефекти метформіну, у тому числі протекторний вплив стосовно ризику розвитку онкологічних захворювань у хворих на ЦД. Метформін залишається єдиною протидіабетичною молекулою, для якої чітко доведені зменшення рівня онкологічної смертності на 15 % і зниження вірогідності виникнення всіх видів новоутворень на 33 %.
На українському фармацевтичному ринку представлений метформін виробництва компанії «Берлін-Хемі» — препарат Сіофор®. Ефективність і безпека лікарського засобу багаторазово підтверджена в рамках клінічних досліджень. Сіофор® користується заслуженим авторитетом у клініцистів як надійний інструмент управління ЦД 2-го типу.
1. Бернштейн Л.М. Диабет, ожирение и онкологическая заболеваемость: риски и антириски / Л.М. Бернштейн // Сахарный диабет. — 2012. — № 4. — С. 81–88.
2. Дедов И.И. Потенциальные возможности метформина в профилактике и лечении онкологических заболеваний у больных сахарным диабетом 2 типа / И.И. Дедов, С.А. Бутрова, М.А. Берковская // Ожирение и метаболизм. — 2011. — № 1. — С. 40–49.
3. Кондратьева Л.В. Бигуаниды в терапии сахарного диабета / Под ред. А.С. Аметова. — М.: Планида, 2012. — 48 с.
4. Barone B.B. Long-term all-cause mortality in cancer patients with preexisting diabetes mellitus: a systematic review and meta-analysis / B.B. Barone, H.C. Ueh, C.F. Snyder [et al.] // JAMA. — 2008. — Vol. 300, № 23. — P. 2754–2764.
5. Bojkova B. Metformin in chemically-induced mammary carcinogenesis in rats / B. Bojkova, P. Orendas, M. Garajova [et al.] // Neoplasma. — 2009. — Vol. 56, № 3. — Р. 269–274.
6. Bowker S.L. Increased cancer-related mortality for patients with type 2 diabetes who use sulfonylureas or insulin / S.L. Bowker, S.R. Majumdar, P. Veugelers, J.A. Johnson // Diabetes Care. — 2006. — Vol. 29, № 2. — P. 254–258.
7. Brown K.A. Metformin inhibits aromatase expression in primary human breast adipose stromal cells / K.A. Brown, E.R. Simpson // Cancer. Res. — 2009. — Vol. 69 (Suppl.). — 690 s.
8. Calle E.E. Overweight, obesity and cancer: epidemiological evidence and proposed mechanisms / E.E. Calle, R. Kaaks // Nat. Rev. Cancer. — 2004. — Vol. 4, № 8. — P. 579–591.
9. Cazzaniga M. Is it time to test metformin in breast clinical trials? / M. Cazzaniga, B. Bonanni, A. Guerrieri-Gonzaga, A. Decensi // Cancer Epidemiol. Biomarkers Prev. — 2009. — Vol. 18, № 3. — Р. 701–705.
10. Chen G. Metformin inhibits growth of thyroid carcinoma cells, suppresses self-renewal of derived cancer stem cells, and potentiates the effect of chemotherapeutic agents / G. Chen, S. Xu, K. Renko, M. Derwahl // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97, № 4. — P. 510–520.
11. Colagiuri S. Diabesity: thyrapeutic options / S. Colagiuri // Diabetes Obes. Metab. — 2010. — Vol. 12, № 6. — P. 463–473.
12. Currie C.J. The influence of glucose-lowering therapies on cancer risk in type 2 diabetes / C.J. Currie, C.D. Poole, E.A. Gale // Diabetologia. — 2009. — Vol. 52, № 9. — Р. 1766–1777.
13. Donadon V. Antidiabetic therapy and increased risk of hepatocellular carcinoma in chronic liver disease / V. Donadon, M. Balbi, M. Ghersetti [et al.] // World J. Gastroenterol. — 2009. — Vol. 15, № 20. — Р. 2506–2511.
14. Dowling R.J. Metformin inhibits mammalian target of rapamycin-dependent translation initiation in breast cancer cells / R.J. Dowling, M. Zakikhani, I.G. Fantus [et al.] // Cancer Res. — 2007. — Vol. 67. — P. 10804–10812.
15. Evans J.M.M. Metformin and reduced risk of cancer in diabetic patients / J.M.M. Evans, L.A. Donnelly, A.M. Emslie-Smith [et al.] // BMJ. — 2005. — Vol. 330, № 7503. — P. 1304–1305.
16. Hjartåker A. Obesity and diabetes epidemics: cancer repercussions / A. Hjartåker, H. Langseth, E. Weiderpass // Adv. Exp. Med. Biol. — 2008. — Vol. 630. — P. 72–93.
17. Jiralerspong S. Metformin and pathologic complete responses to neoadjuvant chemotherapy in diabetic patients with breast cancer / S. Jiralerspong, S.L. Palla, S.H. Giordano [et al.] // J. Clin. Oncol. — 2009. — Vol. 27. — Р. 3297–3302.
18. La Vecchia C. Overweight, obesity, diabetes, and risk of breast cancer: interlocking pieces of the puzzle / C. La Vecchia, S.H. Giordano, G.N. Hortobagyi, B. Chabner // Oncologist. — 2011. — Vol. 16, № 6. — P. 726–729.
19. Landman G.W.D. Metformin associated with lower cancer mortality in type 2 diabetes / G.W.D. Landman, N. Kleefstra, K.J.J. van Hateren [et al.] // Diabetes Care. — 2010. — Vol. 33, № 2. — P. 322–326.
20. Libby G. New users of metformin are at low risk of incident cancer: a cohort study among people with type 2 diabetes / G. Libby, L.A. Donnely, P.T. Donnan [et al.] // Diabetes Care. — 2009. — Vol. 32. — P. 1620–1625.
21. Liu B. Metformin induces unique biological and molecular responses in triple negative breast cancer cells / B. Liu, Z. Fan, S.M. Edgerton [et al.] // Cell Cycle. — 2009. — Vol. 8. — P. 2031–2040.
22. Martin-Castillo B. Incorporating the antidiabetic drug metformin in HER2-positive breast cancer treated with neoadjuvant chemotherapy and trastuzumab: an ongoing clinicaltranslational research experience at the Catalan Institute of Oncology / B. Martin-Castillo, J. Dorca, A. Vazquez-Martin [et al.] // Ann. Oncol. — 2010. — Vol. 21, № 1. — Р. 187–189.
23. Oliveria S.A. Cancer incidence among patients treated with antidiabetic pharmacotherapy / S.A. Oliveria, C.E. Koro, M.U. Yood, M. Sowell // Diabetes. Metabol. Syndrome: Clin. Res. Reviews. — 2008. — Vol. 2. — Р. 47–57.
24. Phoenix K.N. Dietary energy availability affects primary and metastatic breast cancer and metformin efficacy / K.N. Phoenix, F. Vumbaca, M.M. Fox [et al.] // Breast Cancer Res. Treat. — 2010. — Vol. 123, № 2. — P. 333–344.
25. Rezzónico J. Metformin treatment for small benign thyroid nodules in patients with insulin resistance / J. Rezzónico, M. Rezzónico, E. Pusiol [et al.] // Metab. Syndr. Relat. Disord. — 2011. — Vol. 9, № 1. — P. 69–75.
26. Richardson L.C. Therapy insight: influence of type 2 diabetes on the development, treatment and outcomes of cancer / L.C. Richardson, L.A. Pollack // Nat. Clin. Pract. Oncol. — 2005. — Vol. 2, № 1. — P. 48–53.
27. Session D.R. Treatment of atypical endometrial hyperplasia with an insulin-sensitizing agent / D.R. Session, K.R. Kalli, I.S. Tummon [et al.] // Gynecol. Oncol. — 2003. — Vol. 17. — P. 405–407.
28. Shackelford D.B. The LKB1-AMPK pathway: metabolism and growth control in tumour suppression / D.B. Shackelford, R.J. Shaw // Nat. Rev. Cancer. — 2009. — Vol. 9, № 8. — P. 563–575.
29. Shu X. Cancer risk among patients hospitalized for Type 1 diabetes mellitus: a population-based cohort study in Sweden / X. Shu, J. Ji, X. Li [et al.] // Diabet. Med. — 2010. — Vol. 27, № 7. — P. 791–797.
30. Smith U. Does diabetes therapy influence the risk of cancer? / U. Smith, E.A. Gale // Diabetologia. — 2009. — Vol. 52, № 9. — Р. 1699–1708.
31. Soranna D. Cancer risk associated with use of metformin and sulfonylurea in type 2 diabetes: a meta-analysis / D. Soranna, L. Scotti, A. Zambon [et al.] // Oncologist. — 2012. — Vol. 17, № 6. — P. 813–822.
32. Thakkar B., Aronis K.N., Vamvini M.T. et al. Metformin and sulfonylureas in relation to cancer risk in type 2 diabetes patients: A meta-analysis using primary data of published studies // Metabolism. — 2013. — Vol. 62. — P. 922–934.
33. Vigneri P. Diabetes and cancer / P. Vigneri, F. Frasca, L. Sciacca [et al.] // Endocr. Relat. Cancer. — 2009. — Vol. 16, № 4. — P. 1103–1123.
34. Wotton C.J. Cancer in patients admitted to hospital with diabetes mellitus aged 30 years and over: record linkage studies / C.J. Wotton, D.G. Yeates, M.J. Goldacre // Diabetologia. — 2011. — Vol. 54, № 3. — P. 527–534.
35. Wright J.L. Metformin use and prostate cancer in Caucasian men: results from a population-based case-control study / J.L. Wright, J.L. Stanford // Cancer Causes Control. — 2009. — Vol. 20, № 9. — P. 1617–1622.
36. Zhang H. Metformin and reduced risk of hepatocellular carcinoma in diabetic patients: a meta-analysis / H. Zhang, C. Gao, L. Fang [et al.] // Scand. J. Gastroenterol. — 2012. — № 11.
37. Zhou G. Role of AMP-activated protein kinase in mechanism of metformin action / G. Zhou, R. Myers, Y. Li [et al.] // J. Clin. Invest. — 2001. — Vol. 108, № 8. — Р. 1167–1174.

/4_m/4_m.jpg)
/5_m/5_m.jpg)