Газета «Новости медицины и фармации» 1 (525) 2015
Вернуться к номеру
Патогенетичні аспекти застосування екстракту S.repens і тамсулозину з метою зменшення ускладнень після трансуретральної резекції простати з приводу доброякісної гіперплазії передміхурової залози
Авторы: Горпинченко І.І., Гурженко Ю.М., Спиридоненко В.В. - ДУ «НДІ урології НАМН України», м. Київ
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 16-18 (Укр.)
Вступ
Різке зростання реєстрації патології простати є реалією сучасної медичної науки, особливо серед чоловіків віком понад 50 років. Хронічний простатит (ХП) і доброякісна гіперплазія передміхурової залози (ДГПЗ) по праву вважаються найбільш поширеною патологією в чоловіків зазначеного віку [1, 2].
Тісна залежність проліферації простатичних клітин від рівня активного метаболіту тестостерону — дигідротестостерону ґрунтується на регуляції роботи ферменту 5α-редуктази (Oesterling J. та співавт., 1991; Paubert-Braquet М. та співавт., 1997). Розвиток дискоординації у метаболізмі останнього виникає в осіб віком понад 35 років, але перебігає приховано, а дебют клініко-морфологічних проявів припадає на вік після 40 років. ДГПЗ, як і більшість процесів у простаті, є прогресуючим захворюванням, із гіперпластичним ростом і прогресуванням клінічних ускладнень, погіршенням якості життя.
Гістологічні дослідження в пацієнтів із ДГПЗ, за даними [34], вказують на наявність ознак запалення в більше ніж 40 % випадків. Високий рівень асоціації ДГПЗ і запалення є давно визнаним фактом [25], за деякими даними, із 3942 гістологічних випадків ДГПЗ запальний компонент встановлений в 43 % [15].
Є наукові роботи, що пропонують класифікацію рівня запального компонента в тканинах простати, зі спробою гіпотетичної градації гістологічної агресивності гіперпластичних процесів [24]. Такий підхід заснований на відомій моделі кореляції рівнів простатспецифічного антигену (ПСА) в сироватці крові з неопластичною агресією [21]. Можна з упевненістю стверджувати, що формування запального процесу в простатичній тканині в більшості випадків відбувається з мінімальними клінічними проявами, а верифікація часто не відображає дійсного стану проблеми. Відомий феномен рефлюксу бактеріальних агентів в інтерстицій простати з ацинусів може відігравати певну роль у генезі хронічного запалення і канцерогенезі [18].
Дані досліджень вказують, що хронічне запалення здатне викликати проліферативні зміни і посттрансляційні модифікації ДНК у тканині передміхурової залози в результаті оксидативного стресу. Окислювальні процеси, викликані уропатогенами (E.coli), і подальший розвиток запалення здатні викликати порушення гладком’язових скорочень, реактивну дисплазію.
Підвищена продукція арахідонової кислоти, простагландинів і циклооксигеназ (ЦОГ) у результаті вільнорадикального руйнування біомембран так само активно сприяє клітинній проліферації в простатичній тканині [8]. Факторами захисту при цьому виступають представники антиоксидантної системи (супероксиддисмутаза, каталаза, глутатіон-S-трансферази) [9]. Роль оксиду азоту (NO) як універсального пошкоджуючого фактора полягає в тісному зв’язку високого рівня NO і ризику гіперплазії простати, клітини якої, залучені в процес запалення, індукують активну NO-синтетазу (iNOS) як основний фактор їх пошкодження [4].
У даний час відомо, що запалення є складним явищем, яке включає різні гуморальні (цитокіни) і клітинні (лейкоцити) чинники. Запалення пошкоджує простатичну тканину через надлишок прозапальних факторів (синтез вільних радикалів, ЦОГ-активність та ін.), і цей процес є безперервно прогресуючим [12]. Зазначені фактори змінюють структуру і функції білків, викликають зміни генів, посттрансляційні генні модифікації, порушують процеси репарації ДНК та апоптозу, а також провокують клітинну проліферацію [3].
Висока активність ЦОГ-2 була виявлена в усіх запальних клітинах епітелію та інтерстиціальних просторах простати, із збільшенням проліферативних запальних уражень, що генерують прозапальні простагландини [30, 32]. Цікавою є наукова робота, що вказує на роль дієти з фітоестрогенами як регуляторами зниження активності ЦОГ-2 ізоформ, зменшення оксидативного стресу і запальних реакцій [9]. Альтернативою поодиноким роботам щодо фітоестрогенів є сучасні метааналізи, присвячені ефектам Serenoa repens, із досить чітко викладеним механізмом дії і високою верифікацією клінічної ефективності [7].
Альтернативою нестероїдним протизапальним засобам, антибактеріальній терапії і ряду інших засобів у сучасній урології є рослинні інгібітори 5α-редуктази, із яких найбільш вивченим є екстракт Serenoa repens. Останній, за даними наукових публікацій, має одну з найбільш вірогідних доказових баз, створених на основі багаторічних досліджень лікарів Європи, Азії та Північної Америки [19, 20, 26].
До відомих ефектів Serenoa repens відносять антиандрогенний, протизапальний [14], протинабряковий, пролактин-модулюючий і антипроліферативний [6], що реалізуються за рахунок інгібування вищевказаних чинників індукції росту простати.
Застосування Serenoa repens у післяопераційний період сприяє значному поліпшенню об’єктивних даних, препарат має сприятливий профіль безпеки, поліпшує еректильну функцію і зменшує ускладнення після трансуретральної резекції (ТУР) простати, особливо кровотечі.
При вивченні механізмів апоптозу в простаті були встановлені більш високі рівні індексу апоптозу (відношення Bax до Bcl-2) і каспаз-3 в інтраопераційному матеріалі осіб, які приймали 320 мг Serenoa repens протягом 3 місяців. Нормативне відношення Bax до Bcl-2, що використовується як індекс апоптозу, у тканині простати пацієнтів, які отримують лікування, є значно збільшеним. На фоні прийому Serenoa repens було встановлено зниження рівня регулятора апоптозу 116 kDa poly(adenosine diphosphate-ribose) polymerase, що передбачало підвищену активність каспаз-3 у тканинах простати [36].
Як базову терапію ми вважаємо перспективним застосування екстракту Serenoa repens (Простамол® уно) і α1-адреноблокатора тамсулозину (Флосін®), клінічна ефективність яких у хворих із ДГПЗ і ХП була продемонстрована раніше в низці клінічних досліджень [1–3].
Простамол® уно є фітостероловим екстрактом плодів Serenoa repens. Як найбільш імовірні фармакологічні механізми впливу фітостеролів розглядаються інгібування ізоформ 1-го і 2-го типів 5α-редуктази й інгібування зв’язування дигідротестостерону з цитозолевими рецепторами андрогена в клітинах простати (Di Silverio F. та співавт., 1998; Plosker G.L., Brogdan Р.Н., 1996), що надзвичайно важливо з огляду на андрогенозалежний характер росту передміхурової залози (Jenster G., 1999).
До можливих додаткових механізмів впливу екстрактів S.repens можна віднести: інгібування росту простати за допомогою зв’язування пролактину з рецепторами в залозі, антиестрогенний ефект (Plosker G.L., Brogdan Р.Н., 1996), пригнічення проліферації епітеліальних клітин простати (показано зниження рівня епідермального фактора росту в природних умовах у чоловіків із ДГПЗ після 3 місяців лікування (Di Silverio et al., 1998)), пригнічення базального фактора росту (Paubert-Braquet М., 1997). Протизапальна і протинабрякова дії реалізуються шляхом інгібіції синтезу простагландинів (Paubert-Braquet М., 1997), метаболітів 5-оксигенази й арахідонової кислоти в передміхуровій залозі, активних кислотних радикалів у нейтрофілах людини [11].
Тамсулозин є селективним α1-адреноблокатором, ефективність якого як при ДГПЗ, так і при ХП неодноразово розглянута в сучасній літературі з позиції доказової медицини. Специфічні α-адренорецептори в значній кількості зосереджені в ділянці шийки сечового міхура і передміхурової залози, і їх активність визначає тонус гладких м’язів у цій ділянці (Donker P.J. et al., 1972). Установлено здатність альфа-адреноблокаторів пригнічувати динамічний гладком’язовий компонент у роботі автономної нервової системи сечового міхура зі зниженням опору уретри і збільшенням об’ємних показників потоку сечовипускання [1].
Важливо, що на відміну від синтетичних інгібіторів 5α-редуктази екстракти Serenoa repens та альфа-адреноблокатори не впливають на концентрацію сироваткового ПСА [3, 33], що дозволяє контролювати ПСА на тлі комбінованої терапії цими препаратами.
Проведення ТУР аденоми простати, як правило, ускладнюється поглибленням місцевого запалення, наслідком якого є склероз, і цей процес складно контролювати. Термічний і механічний вплив на тканину простати створює умови для активації каскаду арахідонової кислоти та інших продуктів запалення, що надходять у кровотік і призводять до ряду негативних ефектів. До таких належать венозний стаз, артеріальний спазм, розвиток інтерстиціального набряку тканин, поширення запальних фокусів у периферичні зони простати, що супроводжується виникненням симптомів нижніх сечових шляхів (СНСШ) із погіршенням якості життя пацієнта. Є наукові дані, які доводять позитивний ефект від застосування простатоселективних препаратів, що впливають на прозапальні місцеві фактори (Djavan B. et al., 2002, 2006).
Роль S.repens у профілактиці та лікуванні ДГПЗ відома, однак застосування даного засобу з метою корекції стану в ранньому післяопераційному періоді в літературі описане недостатньо й потребує подальших досліджень. Патогенетичним обґрунтуванням застосування S.repens після ТУР є її тропність до тканин простати і парапростатичних структур. Привабливі перспективи обумовлені рядом переваг Serenoa repens:
- відсутністю впливу рослинного препарату на рівні ПСА;
- високим профілем безпеки і легкістю застосування;
- вірогідним ефектом інгібування 5α-редуктази;
- високою клінічною ефективністю.
Патогенетична дія даного компонента в післяопераційній комбінованій терапії заснована на розвитку ряду ефектів: протинабрякового, протизапального й антипроліферативного.
Мета дослідження — оцінити клінічну ефективність екстракту S.repens в комбінації з тамсулозином в осіб із ДГПЗ II ст., оперованих із приводу ДГПЗ методом ТУР простати.
Матеріали і методи дослідження
В ДУ «НДІ урології НАМН України» спостерігали 152 хворих із ДГПЗ II ступеня, які були поділені на 3 групи. У I групу ввійшли пацієнти (n = 81), які отримували комбінацію екстракту Serenoa repens (Простамол® уно) і тамсулозину (Флосін®) виробництва «Берлін-Хемі» («Менаріні Груп», Німеччина); у другу — пацієнти (n = 39), які одержували стандартну терапію із включенням тамсулозину 0,4 мг/добу; у III (n = 32) — особи, які одержували стандартне лікування згідно з протоколами МОЗ України без включення зазначених препаратів. Групу контролю становили 30 практично здорових чоловіків. Простамол® уно призначався в дозі 1 табл/добу після їжі протягом 24 тижнів, тамсулозин (Флосін®) — у дозі 0,4 мг/добу одноразово вранці після їжі протягом 24 тижнів. Лікування проводилося в терміни 8,2 ± 1,3 тижня до операції і протягом 24,2 ± 0,5 тижня після операції. Методикою оперативного втручання була обрана трансуретральна резекція тканин простати з попереднім проведенням обстеження пацієнта за стандартом, із визначенням показань до цієї методики.
Вік пацієнтів коливався від 59 до 74,5 року, у середньому — 67,0 ± 2,4 року. Тривалість захворювання — від 3,5 до 8 років (у середньому 5,5 ± 0,8 року).
Усім пацієнтам до терапії і в її процесі проводили обстеження, що включали збір скарг та анамнезу, клініко-біохімічні тести крові й сечі, оцінку симптомів за міжнародною шкалою IPSS з визначенням індексу якості життя (QoL), пальцеве ректальне обстеження, трансректальне і трансабдомінальне ультразвукове сканування з установленням об’єму простати і залишкової сечі, визначення ПСА. Так само досліджена частота розвитку побічних ефектів цієї терапії.
Висновок щодо ефективності та переносимості комбінації Простамол® уно — Флосін® робили на підставі результатів порівняння з монотерапією тамсулозином, традиційною терапією в післяопераційному періоді і здоровим контролем. Контрольне дослідження показників проводили до лікування, на 14-й день і через 24 тижні від початку терапії.
Обробка результатів досліджень відбувалася з використанням загальноприйнятих методів на комп’ютері Samsung SM 753df із пакетами QPRO і Stargraf із застосуванням традиційних статистичних величин, критерію Стьюдента — Фішера.
Результати та їх обговорення
Пацієнти з перших трьох груп при зверненні мали аналогічні симптоми ДГПЗ за період 1 міс. до операції і лікування з цього приводу не отримували. Досліджувані показники до лікування в основних групах були однаковими і в середньому становили: IPSS — 18,1 ± 1,0 бала; QoL — 5,1 ± 0,2 бала; U простати — 52,5 ± 5,6 г; кількість залишкової сечі — 67,5 ± 10,8 мл; ПСА — 3,00 ± 0,92 нг/мл; середня швидкість сечовипускання — 10,50 ± 1,02 мл/с. Середні дані в групі контролю становили: IPSS — 6,1 ± 0,4 бала; QoL — 1,1 ± 0,2 бала; U простати — 17,5 ± 2,6 г; кількість залишкової сечі — 5,0 ± 2,0 мл; ПСА — 0,10 ± 0,02 нг/мл; середня швидкість сечовипускання — 19,5 ± 2,3 мл/с.
Під час дослідження вивчався стан загальної гемодинаміки методом щоденного вимірювання пульсу, частоти серцевих скорочень та артеріального тиску. У контрольних дослідженнях клінічного аналізу крові, сечі, традиційних біохімічних тестів плазми крові, що проводяться раз на місяць, зміни мали традиційний характер.
Показники вмісту сечовини і креатиніну в плазмі до лікування в основних групах були невірогідно підвищеними — у середньому 8,02 ± 1,40 ммоль/л і 0,112 ± 0,010 ммоль/л відповідно (р < 0,05).
Цитологія сечі відповідала стану нижніх сечових шляхів, а виявлені лейкоцитурія (67,2 ± 4,8 %) і бактеріурія (72,5 ± 3,9 %) були тривіальними, корегувалися стандартною антибіотикотерапією в післяопераційному періоді в середньому впродовж 20,2 ± 2,3 дня.
Дані, отримані в І групі в термін 14 діб, свідчили про високу ефективність зазначеної комбінації в ліквідації симптомів нижніх сечових шляхів, що визначалося в основному aадреноблокуючим ефектом тамсулозину. Оцінити короткостроковий ефект Простамолу® уно не було можливості в силу короткого терміну застосування, сумації фармакологічних (прийом препаратів, що регулюють роботу сечових шляхів), клінічних (тривалий ортостаз, катетеризація сечових шляхів, набряк в зоні операції тощо) та інших чинників.
Отже, порівняння результатів І та ІІ груп, враховуючи прийом тамсулозину, не вказувало на вірогідний результат в період 2 тижнів після проведення ТУР. У III групі вираженість СНСШ значно відрізнялася від I і II груп — відзначався великий відсоток ускладнень у ранньому післяопераційному періоді. Типовий комплекс ускладнень після ТУР розвивався внаслідок нанесення операційної травми з реалізацією ряду нижчезазначених чинників, а саме:
- збільшення патологічної α-адренорецепторної активності структур нижніх сечових шляхів;
- високий рівень активності прозапальних агентів в умовах порушення цілісності тканин, як місцевих, так і загальних;
- різке порушення тканинного гомеостазу в простаті на тлі патологічних змін при ДГПЗ, посилених термічним впливом;
- наявність супутніх захворювань в осіб віком понад 60 років (серцево-судинні ризики, метаболічний синдром тощо).
Очікувані ефекти вимагали патогенетичної спрямованості на зниження вираженості місцевих і загальних факторів. До перших відносили 5α-редуктазну активність Serenoa repens, а також α-адренолітичний ефект тамсулозину, спрямований на гіпоактивацію селективних α-адренорецепторів шийки сечового міхура і pars prostatica uretrae. Зниження вираженості післяопераційних ускладнень як мультифакторіального комплексу після проведення ТУР простати було опосередкованим і залежало від повноти корекції місцевого вогнища. Можливість стратифікації отриманих даних була сумнівною, як і коректність їх порівняння на ранніх етапах спостереження.
Прояв α1-адреноблокуючого ефекту в перші дні після операції полягав у зменшенні вираженості СНСШ: в осіб І групи — на 23,5 %, ІІ групи — на 21,8 % порівняно з ІІІ групою досліджуваних, у якій СНСШ були яскраво вираженими. Показники шкали ІPSS свідчили про те, що частота розвитку СНСШ без терапії селективними α-адреноблокаторами зберігалася високою протягом перших 7–9 тижнів з подальшим зменшенням її вираженості і стабілізацією до 13–15-го тижня. На відміну від таких результатів дані в І групі вказували на вірогідну редукцію вираженості СНСШ у середньому до 4,5 ± 0,2 тижня, а в II групі — до 6,2 ± 0,4 тижня після ТУР аденоми. Відповідні дані були отримані під час аналізу показників QoL — при порівнянні балів за IPSS відзначався позитивний кореляційний зв’язок поліпшення цих показників із прийомом зазначеної комбінації (р < 0,05).
Потрібного ефекту не було відзначено або він був статистично невірогідним в осіб III групи, і до 12-го тижня зазначалася наявність СНСШ у половини досліджуваних. Обидва препарати мали добру переносимість, клінічно значущі побічні ефекті були відсутні.
Результатом терапії в І групі протягом 12 тижнів була більш ефективна ліквідація іритативної й обструктивної симптоматики й залишкового об’єму сечі після мікції в 92,0 % випадків. До 12-го тижня монотерапії Флосіном® (з урахуванням проведення ТУР аденоми) порівняно з І групою менш значним було поліпшення за показниками IPSS і QoL, хоча динаміка й була вірогідно кращою порівняно з ІІІ групою (табл. 1).
При порівнянні кінцевих результатів 24-тижневого курсу терапії після ТУР у двох перших групах відзначався вірогідний позитивний ефект у вигляді ліквідації залишкової сечі та поліпшення швидкісних показників сечовипускання, з прискоренням післяопераційної реабілітації за рахунок зменшення впливу прозапальних чинників (табл. 2). Показники за шкалою IPSS в І групі вказували на зменшення вираженості СНСШ у середньому на 18,6 % до 24-го тижня порівняно з результатами у групі тримісячної комбінованої терапії.
Показник за шкалою QoL покращився в І групі в середньому на 15,2 ± 1,2 %, у ІІ — на 14,5 ± 1,6 % порівняно з ІІІ групою (р < 0,05). В осіб, які отримують терапію в післяопераційному періоді після ТУР аденоми простати, як правило, відзначається швидка позитивна динаміка у вигляді поліпшення показників якості життя за рахунок зменшення вираженості СНСШ. У дослідженні ефективності монотерапії тамсулозином після швидкого початкового ефекту протягом 30 діб відзначено уповільнення динаміки відновлення показників за шкалами IPSS та QoL, що відрізняється від комбінації Serenoa repens — тамсулозин.
Традиційне лікування без використання зазначених груп препаратів не сприяє прискоренню процесів реабілітації через слабкий вплив на патогенетичні ланки ДГПЗ. Як видно з табл. 2, результати терапії в групі контролю через 24 тижні свідчать про потенційні можливості довгострокової комбінованої терапії.
Ризик виникнення небажаних побічних явищ при довгостроковій терапії завжди актуальний, тому, враховуючи важливий соціальний аспект — співвідношення «ціна/якість», хворі були опитані на предмет комплайєнтності терапії.
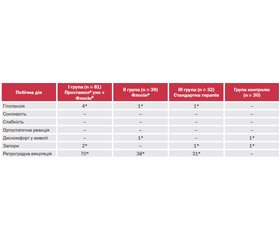
Реєстрація небажаних явищ, пов’язаних із можливим проявом побічної дії препаратів, проводилась в період 4–24 тижні від оперативного лікування. До 4-го тижня із 152 хворих у 14 (9,2 %) були ортостатичні реакції (різке зниження артеріального тиску, запаморочення), у 23 (15,1 %) — порушення випорожнення у вигляді запорів, сексуальна функція не оцінювалася. Було встановлено, що на 24–му тижні рівень зазначених ускладнень знизився у 2,7 раза. Так, у 6 пацієнтів (3,9 %) були ортостатичні реакції, у 3 (1,9 %) — порушення випорожнення у вигляді запорів, лібідо й еректильна дисфункція не оцінювалися. У контрольній групі була виявлена наявність запорів в одного пацієнта, інші симптоми були відсутні. При контрольних оглядах через 4 і 24 тижні від початку терапії проводився аналіз побічних ефектів (табл. 3 і 4). Оцінку ретроградної еякуляції на 4-му тижні не проводили, а на 24-й тиждень рівень ретроградної еякуляції становив 149 (98 %) випадків.
Поліпшення лібідо й еректильної функції, що відмічалося до 24-го тижня, було статистично невірогідним, тому попередня оцінка цих показників до 4-го тижня була неможлива. Отримані дані потребували подальшої оцінки протягом терапії, її продовження протягом більше одного року узгоджувалося з рекомендаціями ВООЗ.
Зниження рівня небажаних явищ до 24-го тижня порівняно з даними 4-го тижня вказувало на мінімальний ризик їх розвитку і високу комплайєнтність даної комбінації (табл. 5).
За результатами проведеного дослідження можна зробити висновок, що комбінація Простамол® уно — Флосін® є високоефективною в лікуванні станів після ТУР із приводу ДГПЗ, на що вказує оцінка як пацієнта, так і лікаря (97,6 %). Це корелює з даними об’єктивного обстеження: вірогідно поліпшилися показники IPSS і QoL у I і II групах порівняно з III групою, у якій нормалізація акту сечовипускання була менш ефективною, а якість життя відновлювалася повільніше (р < 0,05).
Необхідність тривалої фармакологічної курації, спрямованої на максимальне охоплення патогенетичних ланок цього процесу, обумовлена наявністю обтяжливих факторів, соматичної патології, ризику розвитку раку передміхурової залози в подальшому й іншими причинами. Наявність побічних дій і негативні ефекти від взаємодії препаратів часто є визначальними у виборі на користь терапії фітопрепаратом Простамол® уно. Так само слід враховувати необхідність титрування дози, ризик розвитку сексуальних порушень при використанні неселективних антагоністів α1-адренорецепторів тощо.
Оперативне лікування з приводу ДГПЗ найчастіше не є радикальним методом, що визначає необхідність подальшої раціональної, часто довгострокової терапії.
За результатами дослідження можна зробити висновок, що фармакологічна комбінація препаратів S.repens (Простамол® уно) і тамсулозину (Флосін®) високоефективна, є надійною альтернативою традиційній терапії в осіб із ДГПЗ після ТУР аденоми, а ефективність її прямо залежить від ступеня процесу та тривалості терапії.
Висновки
З результатів проведених обстежень в осіб із ДГПЗ, які отримували консервативну терапію, випливає, що:
1) проведення малоінвазивного оперативного втручання при ДГПЗ (трансуретральна резекція аденоми простати) в післяопераційному періоді вимагає застосування патогенетичних засобів, до яких відносять α-адреноблокатори (Флосін®) і рослинні інгібітори 5α-редуктази (Простамол® уно);
2) комбінація препаратів Простамол® уно і Флосін®, що призначається пацієнтам у післяопераційному періоді після ТУР аденоми простати, була більш ефективною, ніж традиційна терапія;
3) комбінація препаратів Простамол уно® і Флосін® сприяє більш швидкому відновленню показників уродинаміки, IPSS і QoL в осіб із ДГПЗ у післяопераційному періоді порівняно з традиційною терапією.
1. Аляев Ю.Г., Аполихин О.И., Мазо Е.Б. и др. Результаты трехлетнего клинического исследования по изучению эффективности и безопасности препарата Простамол Уно® у больных с начальными проявлениями аденомы предстательной железы и риском прогрессирования // Урология. — 2010. — № 6. — С. 3–10.
2. Мазо Е.Б., Дмитриев Д.Г., Зиканов В.В. Комбинированное лечение больных доброкачественной гиперплазией предстательной железы в сочетании с хроническим простатитом при подозрении на рак предстательной железы // РМЖ. — 2005. — № 13(9). — С. 615–618.
3. Aliaev I.G., Vinarov A.Z., Demidko I.L., Spivak L.G. The results of the 10-year study of efficacy and safety of Serenoa repens extract in patients at risk of progression of benign prostatic hyperplasia // Urologiia. — 2013 Jul-Aug. — 4. — Р. 32–6.
4. Baltaci S., Orhan D., Cogus C., Turkolmez K. et al. Inducible nitric oxide synthase expression in BPH, low and high grade PIN and prostate carcinoma // BJU Int. — 2001. — V. 88. — P. 100–103.
5. Basler J.W., Piazza G.A. Nonsteroidal anti–inflammatory drugs and cyclooxy-genase-2 selective inhibitors for prostate cancer chemoprevention // J. Urol. — 2004. — V. 171. — P. 59–S63.
6. Berges R.R., Pientka L., Hufner K. et al. Male lower urinary tract symptoms and related health care seeking in Germany // Eur. Urology. — 2001. — Vol. 39. — P. 682.
7. Bostanci Y., Kazzazi A., Momtahen S., Laze J., Djavan В. Correlation between benign prostatic hyperplasia and inflammation // Benign Prostatic Hyperplasia. — 2013. — Vol. 23(1). — Р. 5–10.
8. Chua T., Eise N.T., Simpson J.S., Ventura S. Pharmacological characterization and chemical fractionation of a liposterolic extract of saw palmetto (Serenoa repens): effects on rat prostate contractility // J. Ethnopharmacol. — 2014 Mar. 14. — V. 152(2). — P. 283–91.
9. Coffey D.S. Similarities of prostate and breast cancer: evolution, diet and estrogens // Urology. — 2001. — V. 57. — P. 31–38.
10. De Marzo A.M., Platz E.A., Sutcliffe S. et al. Inflammation in prostate carcino-genesis // Nat Rev. — 2007. — V. 7. — P. 256–269.
11. De Marzo A.M. Pathological and molecular mechanisms of prostate carcinogenesis: implications for diagnosis, prevention and treatment // J. Cell. Biochem. — 2004. — V. 91. — P. 459–477.
12. De Marzo A.M., Marchi V.L., Epstein J.I., Nelson W.G. Proliferative inflammatory atrophy of the prostate // Am. J. Pathol. — 1999. — V. 155. — P. 1985–1992.
13. Dennis L., Lynch C.F., Tornes J.C. Epidemiologic association between prostatitis and prostate cancer // Urology. — 2002. — V. 60. — P. 78–83.
14. Di Silverio F., Bosman C., Salvatori M. et al. Combination therapy with rofecoxib and finasteride in the treatment of men with lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH) // Eur. Urol. — 2005. — V. 47 — P. 72–79.
15. Di Silverio F., Gentile V., De Matteis A. et al. Distribution of inflammation, premalignant lesions, incidental carcinoma in histologically confirmed benign prostatic hyperplasia: a retrospective analysis // Eur. Urol. — 2003. — V. 43. — P. 164–175.
16. Djavan B. Lower urinary tract symptoms benign prostatic hyperplasia: fast control of the patient’s quality of life // Urology. — 2003 Sep. — 62 (3 Suppl. 1). — P. 6–14.
17. Drachenberg C.B., Papadimitriou J.C. Prostatic corpora amylacea and crystalloids: similarities and differences on ultrastructural and histochemical studies // J. Submicroscop. Cytol. Pathol. — 1996. — V. 28. — P. 141–150.
18. Elkahwaji J.E., Zhong W., Bushman W. Chronic bacterial infection and inflammation incite reactive hyperplasia in a mouse model of chronic prostatitis // Prostate. — 2007. — V. 67. — P. 14–21.
19. Ficarra V., Rossanese M., Zazzara M. et al. The role of inflammation in lower urinary tract symptoms (LUTS) due to benign prostatic hyperplasia (BPH) and its potential impact on medical therapy // Curr. Urol. Rep. — 2014. — Dec. 15(12). — P. 463.
20. Forray C., Bard J.A., Wetzel J.M. et al. The α1-adrenergic receptor that mediates smooth muscle contraction in human prostate has the pharmacological properties of the cloned human a1с subtype // Mol. Pharmacol. — 1994. — 45(4). — 703–708.
21. Goldstraw M.A., Fitzpatrick J.M., Kirby R.S. What is the role of inflammation in the pathogenesis of prostate cancer // BJU Int. — 2007. — V. 15. — P. 1–2.
22. Gradini R., Realacci M., Petrangeli E., Di Silverio F., Russo M. Nitric oxide synthases in normal and benign hyperplastic human prostate: immunohistochemistry and molecular biology // J. Pathol. — 1999. — V. 189. — P. 224–229.
23. Irani J., Levillian P., Gouion J.M., Bon D. et al. Inflammation in benign prostatic hyperplasia: correlation with prostate specific antigen value // J. Urol. — 1997. — V. 157. — P. 1301–1303.
24. Karakiewicz P.I., Benayoun S., Begin L.R. et al. Chronic inflammation is negatively associated with prostate cancer and high grade prostatic intraepithelial neoplasia on needle biopsy // Int. J. Clin. Pract. — 2007. — V. 71. — P. 425–430.
25. Kramer G., Mitteregger D., Marberger M. Is benign prostatic hyperplasia (BPH) an immune inflammatory disease? // Eur. Urol. — 2007. — V. 51. — P. 1202–1216.
26. Lowe F., Fagelman E. Phytotherapy in the treatment of benign prostatic hyperplasia // Curr. Opin. Urol. — 2002. — Vol. 12. — P. 15.
27. Martinon F., Petrilli V., Mayor A., Tardivel A., Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome // Nature. — 2006. — V. 440. — P. 237–241.
28. Naber K., Weidner W. Chronic prostatitis: an infectious disease? // J. Antimicrob. Chemother. — 2000. — V. 46. — P. 157–161.
29. Nelson W.G., De Marzo A.M., Isaacs W.B. Prostate cancer // N. Engl. J. Med. — 2003. — V. 349. — P. 366–381.
30. Palapattu G.S., Sutcliffe S., Bastain P.J., Platz E.A. Prostate carcinogenesis and inflammation: emerging insights // Carcinogenesis. — 2004. — V. 26. — P. 1170–1181.
31. Platz E.A., De Marzo A.M. Epidemiology of inflammation and prostate cancer // J. Urol. — 2004. — V. 171. — P. 536–540.
32. Sugar L.M. Inflammation and prostate cancer // Can. J. Urol. — 2006. — V. 13(1). — P. 46–47.
33. Tomas D., Krušlin B., Rogatsch H. et al. Different types of atrophy in the prostate with and without adenocarcinoma // Eur. Urol. — 2007. — V. 51. — P. 98–104.
34. Nickel J.C. Prostatic inflammation in BPH: the third component? // Can. J. Urol. — 1994. — V. 1 — P. 1–4.
35. Zhou T., Yang Y., Zhang H. et al. Serenoa Repens Induces Growth Arrest, Apoptosis and Inactivation of STAT3 Signaling in Human Glioma Cells // Technol. Cancer. Res. Treat. — 2014 Jun. — V. 16. — P. 12–16.
36. Vela-Navarrete R., Escribano-Burgos M., Farré A.L et al. Serenoa repens treatment modifies bax/bcl-2 index expression and caspase-3 activity in prostatic tissue from patients with benign prostatic hyperplasia // J. Urol. — 2005 Feb. — V. 173(2). — P. 507–10.

/17_u/17_u.jpg)
/18_u/18_u.jpg)