Газета «Новости медицины и фармации» Кардиология (516) 2014 (тематический номер)
Вернуться к номеру
Руководство по ведению пациентов с мерцательной аритмией: доклад Американского колледжа кардиологии, рабочей группы Американской ассоциации сердца по практическим рекомендациям и Общества ритма сердца (в сокращении)
Авторы: Craig T. January, L. Samuel Wann, Joseph S. Alpert, Hugh Calkins, Joseph C. Cleveland Jr, Joaquin T.E. Cigarroa, Jamie B. Conti, Patrick T. Ellinor, Michael D. Ezekowitz, Michael E. Field, Katherine Murray, Ralph L. Sacco, William G. Stevenson, Patrick J. Tchou, Cynthia M. Tracy and Clyde W. Yancy
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 32-48
AHA/ACC/HRS (Американская ассоциация по изучению сердца/
Американская коллегия кардиологов/Общество ритма сердца),
2014 г.
Список сокращений
АВ — атриовентрикулярный
АПФ — ангиотензинпревращающий фермент
БАТ — блокатор ангиотензиновых рецепторов
ГКМ — гипертрофическая кардиомиопатия
ОКС — острый коронарный синдром
МА — мерцательная аритмия
ИБС — ишемическая болезнь сердца
КК — клиренс креатинина
ЛЖ — левый желудочек
ЛП — левое предсердие
МНО — международное нормализованное отно–шение
НМГ — низкомолекулярный гепарин
НФГ — нефракционированный гепарин
ПЖ — правый желудочек
ПИА — преходящая ишемическая атака
ПТД — период в терапевтическом диапазоне
РКТ — рандомизированное контролируемое исследование
РРМТ — рекомендованная руководствами медикаментозная терапия
СН — сердечная недостаточность
СНсФВ — сердечная недостаточность с сохраненной фракцией выброса
УЛП — ушко левого предсердия
ФВ — фракция выброса
ФВЛЖ — фракция выброса левого желудочка
ХБП — хроническая болезнь почек
ЧПЭхоКГ — чреспищеводная электрокардиография
ЭКГ — электрокардиография
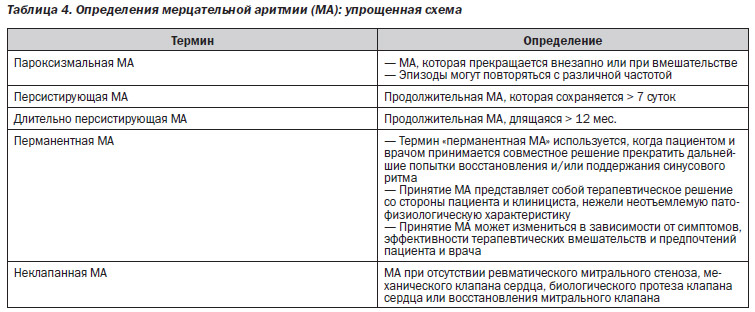
2.1. Определения мерцательной аритмии (см. табл. 4, схема 1, схема 2)
3. Клиническая оценка: рекомендации
Класс I
1. Для установления диагноза МА рекомендуется электрокардиографическое подтверждение (уровень доказательности: С).
Диагноз МА у пациентов ставится на основании истории болезни и физикального осмотра и подтверждается мониторированием ритма в амбулаторных условиях с использованием ЭКГ (напр., телеметрия, холтеровское мониторирование, регистраторы события), имплантированных петлевых регистраторов, водителей ритма, дефибрилляторов или, в редких случаях, с помощью электрофизиологического исследования. Клинические обследования, включая дополнительные исследования, которые могут потребоваться, приведены в приложении 4.
4. Предотвращение тромбоэмболии
4.1. Антитромботическая терапия, основанная на оценке риска: рекомендации
Класс I
1. У пациентов с МА антитромботическую терапию необходимо подбирать индивидуально на основании совместного принятия решения после обсуждения абсолютного и относительного риска инсульта или кровотечения и с учетом предпочтения пациента (уровень доказательности: С).
2. Выбор антитромботической терапии должен основываться на оценке риска развития тромбоэмболии в зависимости от вида МА: пароксизмальная, персистирующая или перманентная (уровень доказательности: B).
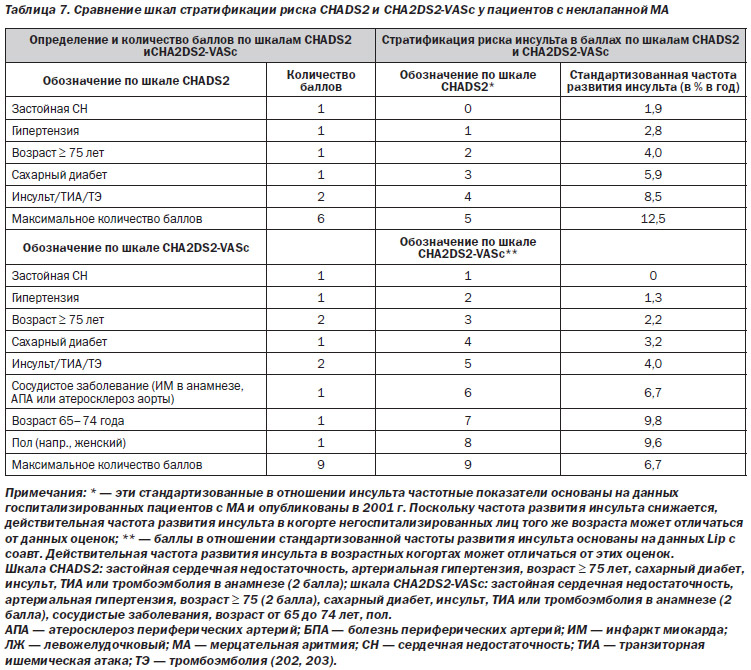
3. У пациентов с неклапанной МА для оценки риска развития инсульта рекомендуется учитывать количество баллов по шкале CHA2DS2-VASc (уровень доказательности: B)
4. Для пациентов с МА, у которых установлены механические клапаны сердца, рекомендуется варфарин, а целевой уровень международного нормализованного отношения (МНО) (от 2,0 до 3,0 или от 2,5 до 3,5) должен определяться по типу протеза и его локализации (уровень доказательности: B)
5. Для пациентов с неклапанной МА с инсультом, преходящей ишемической атакой (ПИА) в анамнезе или количеством баллов по шкале CHA2DS2-VASc 2 и более рекомендуется пероральный прием антикоагулянтов. Доступны следующие варианты: варфарин (МНО от 2,0 до 3,0) (уровень доказательности: A), дабигатран (уровень доказательности: B), ривароксабан (уровень доказательности: B) или апиксабан (уровень доказательности: B)
6. Среди пациентов, получавших лечение варфарином, МНО должно определяться не менее одного раза в неделю в начале антитромботической терапии и не менее одного раза в месяц, когда антикоагуляция (МНО в соответствующем диапазоне) стабильна (уровень доказательности: A).
7. Для пациентов с неклапанной МА, неспособных поддерживать терапевтический уровень МНО при применении варфарина, рекомендуется использование прямых ингибиторов тромбина или фактора Ха (дабигатран, ривароксабан или апиксабан) (уровень доказательности: С).
8. Для повторной оценки рисков развития инсульта или кровотечения рекомендуется периодическая повторная оценка необходимости антитромботической терапии и ее выбор (уровень доказательности: С).
9. Переходная терапия нефракционированным гепарином (НФГ) или низкомолекулярным гепарином (НМГ) рекомендуется для пациентов с МА и механическим клапаном сердца, подвергающихся процедурам, которые требуют прерывания приема варфарина. Решения относительно переходной терапии должны приниматься с учетом рисков развития инсульта и кровотечения (уровень доказательности: С).
10. Для пациентов с МА без механических клапанов сердца, которым требуется прерывание приема варфарина или современных антикоагулянтов для проведения процедур, решения о переходной терапии (НМГ или НФГ) должны основываться на оценке риска развития инсульта или кровотечения и продолжительности времени, на протяжении которого пациент не будет принимать антикоагулянты (уровень доказательности: С).
11. До начала приема прямых ингибиторов тромбина или фактора Ха необходимо провести исследование функции почек, а также повторное исследование при наличии клинических показаний и не менее одного раза в год (уровень доказательности: B).
12. Для пациентов с трепетанием предсердий антитромботическое лечение рекомендуется назначать согласно аналогичному профилю риска, который используется в отношении МА (уровень доказательности: С).
Класс IIa
1. Для пациентов с неклапанной МА и количеством баллов по шкале CHA2DS2-VASc, равным 0, целесообразно исключить антитромботическую терапию (уровень доказательности: B).
2. Для пациентов с неклапанной МА с количеством баллов по шкале CHA2DS2-VASс, равным 2 и более, с ХБП конечной стадии (клиренс креатинина (КК) < 15 мл/мин) или находящихся на гемодиализе, в качестве пероральной антикоагулянтной терапии целесообразно назначить варфарин (МНО от 2,0 до 3,0) (уровень доказательности: B).
Класс IIb
1. Для пациентов с неклапанной МА и количеством баллов по шкале CHA2DS2-VASc, равным 1, назначение антитромботической терапии или лечения пероральным антикоагулянтом или аспирином не рекомендуется (уровень доказательности: С).
2. Для пациентов с неклапанной МА и ХБП от умеренной до тяжелой степени с количеством баллов по шкале CHA2DS2-VASc 2 и более можно рассмотреть возможность лечения сниженными дозами прямых ингибиторов тромбина или фактора Ха (напр., дабигатран, ривароксабан или апиксабан), но безопасность и эффективность при этом не установлены (уровень доказательности: С).
3. У пациентов с МА, подвергающихся чрескожному коронарному вмешательству*, для уменьшения требуемой продолжительности двойной антитромботической терапии может рассматриваться возможность применения непокрытых металлических стентов. Антикоагулянтная терапия может быть прервана во время проведения процедуры для снижения риска развития кровотечения в месте пункции периферической артерии (уровень доказательности: С).
4. После реваскуляризации коронарных артерий (чрескожной или хирургической) у пациентов с МА и количеством баллов по шкале CHA2DS2-VASc 2 и более может быть целесообразно использование клопидогреля (75 мг ежедневно один раз в сутки) одновременно с пероральными антикоагулянтами, но без аспирина (уровень доказательности: B).
Класс III: отсутствие пользы
1. Не рекомендуется назначение прямого ингибитора тромбина, дабигатрана, ингибитора фактора Ха, ривароксабана пациентам с МА и конечной стадией ХБП, или находящихся на гемодиализе ввиду недостаточности доказательств, полученных в клинических исследованиях, относительно соотношения риска и пользы (уровень доказательности: С).
Класс III: вред
1. Прямой ингибитор тромбина дабигатран не следует назначать пациентам с МА и механическим клапаном сердца (уровень доказательности: B).
4.1.1.1. Шкалы стратификации риска (CHADS2, CHA2DS2-VASc и HAS-BLED)
В одном метаанализе стратифицирован риск ишемического инсульта среди пациентов с неклапанной МА благодаря исследователям МА. Шкала CHADS2: застойная сердечная недостаточность, артериальная гипертензия, возраст ≥ 75 лет, сахарный диабет, инсульт или транзиторная ишемическая атака в анамнезе (два балла), или шкала CHA2DS2-VASc: застойная сердечная недостаточность, артериальная гипертензия, возраст ≥ 75 лет (два балла), сахарный диабет, инсульт или транзиторная ишемическая атака в анамнезе (два балла), сосудистые заболевания, возраст 65–74, пол (табл. 7).
4.4.2. Хирургическое вмешательство на сердце — окклюзия/иссечение УЛП. Рекомендации
Класс IIb
1. Хирургическое иссечение УЛП может рассматриваться у пациентов, подвергающихся хирургическому вмешательству на сердце (уровень доказательности: С).
5. Контроль ЧСС: рекомендации
Класс I
1. Контроль частоты желудочковых сокращений с помощью бета-блокаторов или недигидропиридиновых блокаторов кальциевых каналов рекомендуется у пациентов с пароксизмальной, персистирующей или перманентной МА (уровень доказательности: B).
2. Внутривенное введение бета-блокаторов или недигидропиридиновых блокаторов кальциевых каналов рекомендуется для замедления частоты желудочковых сокращений при экстренном назначении у пациентов с преждевременным возбуждением желудочков. Гемодинамически нестабильным пациентам показана электрическая кардиоверсия (уровень доказательности: B).
3. У пациентов, у которых наблюдаются симптомы, обусловленные МА, при повседневной деятельности, необходимо оценивать адекватность контроля ЧСС при физической нагрузке, подбирая, при необходимости, фармакологическое лечение, чтобы поддерживать частоту сокращения желудочков в физиологических пределах (уровень доказательности: С).
Класс IIa
1. Стратегия контроля частоты сердечных сокращений (частота сердечных сокращений в покое < 80 уд/мин) целесообразна для симптоматического лечения МА (уровень доказательности: B).
2. Внутривенное введение амиодарона может быть целесообразно для контроля ЧСС у тяжелобольных пациентов с преждевременным возбуждением желудочков (уровень доказательности: B).
3. Абляция АВ узла с постоянной желудочковой стимуляцией целесообразна для контроля частоты сердечных сокращений, когда фармакологическое лечение неэффективно и невозможно достигнуть контроля ритма (уровень доказательности: B).
Класс IIb
1. Гибкая стратегия контроля ЧСС (< 110 уд/мин) может быть целесообразна, пока у пациентов отсутствуют симптомы и сохраняется систолическая функция ЛЖ (уровень доказательности: B).
2. Пероральное введение амиодарона может быть целесообразным для контроля частоты желудочковых сокращений, когда другие меры неэффективны или противопоказаны (уровень доказательности: С).
Класс III: вред
1. Абляция АВ узла с постоянной желудочковой стимуляцией не должна проводиться в целях улучшения контроля частоты сокращений без предварительных попыток достичь контроля частоты с помощью медикаментозного лечения (уровень доказательности: С).
2. Недигидропиридиновые блокаторы кальциевых каналов не должны использоваться у пациентов с декомпенсированной СН, поскольку это может привести к дальнейшему ухудшению гемодинамики (уровень доказательности: С).
3. Пациентам с преждевременным возбуждением и МА не должны назначаться дигоксин, недигидропиридиновые блокаторы кальциевых каналов или внутривенный амиодарон, поскольку они могут усилить желудочковый ответ и привести к фибрилляции желудочков (уровень доказательности: B).
4. Дронедарон не следует использовать для контроля частоты желудочковых сокращений у пациентов с перманентной МА, поскольку это увеличит риск появления сочетанной конечной точки (исхода): инсульта, ИМ, системной эмболии или смерти по причине сердечно–сосудистой патологии (уровень доказательности: B).
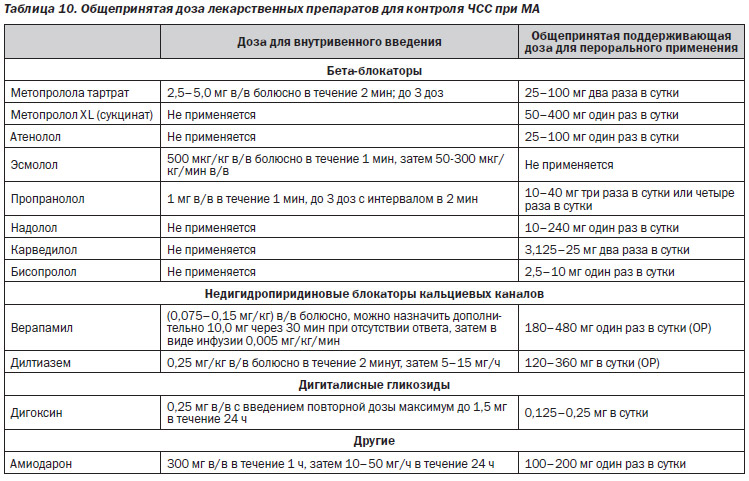
Контроль ЧСС при МА является важной стратегией. Он оказывает влияние на качество жизни, снижает заболеваемость и потенциальный риск развития кардиомиопатии, индуцированной тахикардией. Проводилась оценка многочисленных препаратов, включая бета-блокаторы, недигидропиридиновые блокаторы кальциевых каналов, дигоксин и некоторые антиаритмические препараты, в том числе амиодарон и соталол, в отношении их эффективности в достижении контроля ЧСС. Данная информация представлена в табл. 10. При решении вопроса о том, какой(ие) препарат(ы) использовать, клиницисты должны учитывать тяжесть симптомов пациента, гемодинамический статус, наличие или отсутствие СН и потенциальные факторы развития МА. При оценке доказательства в поддержку различных препаратов клиницисты должны осознавать, что большинство клинических исследований было выполнено в 1980–90-х гг.; эти исследования имеют ограничения в отношении дизайна исследования, которые включают разные конечные точки, маленький размер выборок; исследования одноцентровые и обсервационные. К вопросам, которые следует рассматривать, относятся срочность достижения контроля ЧСС, препарат(ы), который(е) нужно вводить, и требуемая степень контроля ЧСС. За последние 40 лет обострились некоторые вопросы. В целом бета-блокаторы являются наиболее распространенными препаратами, используемыми для контроля ЧСС, с последующим введением недигидропиридиновых блокаторов кальциевых каналов, дигоксина и амиодарона. Необходимо учитывать сопутствующие заболевания пациента, чтобы избежать введения лекарственных средств, которые могут привести к развитию нежелательных явлений, в частности к декомпенсации СН, обострению хронической обструктивной болезни легких или ускорению проведения имульсов у пациентов с преждевременным возбуждением.
Если при МА требуется срочный контроль частоты желудочковых сокращений, можно использовать внутривенное введение лекарственных препаратов или электрическую кардиоверсию. Электрическая кардиоверсия является предпочтительной у пациентов с декомпенсированной СН, продолжающейся ишемией миокарда или гипотонией, хотя она может обусловить повышенный риск развития тромбоэмболии у пациентов, которые получали ненадлежащее антитромботическое лечение или у которых МА неопределенной продолжительности. Гемодинамически стабильным пациентам с быстрым желудочковым ответом можно вводить лекарственные препараты перорально (табл. 10)
5.1. Специфические фармакологические препараты для контроля ЧСС
5.1.1. Блокаторы бета-адренергических рецепторов
Благодаря блокированию симпатического тонуса бета-блокаторы используются для контроля частоты желудочковых сокращений у пациентов с МА. Бета-блокаторы, включая эсмолол, пропранолол и метопролол, эффективны при внутривенном введении при тяжелой форме МА. Бета-блокаторы, введенные перорально, включая атенолол, метопролол, надолол, пропранолол и соталол, эффективно используются для регулярного контроля частоты желудочковых сокращений у пациентов с хронической МА. Существует небольшое количество опубликованной литературы по контролю ЧСС при МА с помощью дополнительного введения бета-блокаторов. В исследовании AFFIRM (Atrial Fibrillation Follow-Up Investigation of Rhythm Management — Повторное исследование тактики управления ритмом при фибрилляции предсердий) бета-блокаторы были наиболее эффективным и часто используемым классом лекарственных препаратов для контроля ЧСС (70 % лиц, принимавших бета-блокаторы, против 54 % лиц, принимавших блокаторы кальциевых каналов). У пациентов с СН карведилол продемонстрировал эффективность в отношении контроля ЧСС и в комбинации с дигоксином привел к улучшению функции ЛЖ. Комбинированная терапия бета-блокаторами и другими препаратами, включая дигоксин, эффективна при контроле частоты желудочковых сокращений, однако во избежание чрезмерной брадикардии необходимо осуществлять подбор дозы лекарственных препаратов.
5.1.2. Недигидропиридиновые блокаторы кальциевых каналов
Дилтиазем и верапамил оказывают прямое воздействие на АВ-узел, блокируя кальциевые каналы L-типа, и используются для контроля желудочкового ответа как при острой, так и при хронической МА. При острой МА внутривенное введение дилтиазема было безопасным и эффективным при назначении для контроля желудочкового ответа у 83 % пациентов. Внутривенное введение верапамила также эффективно для быстрого достижения контроля частоты желудочковых сокращений. Когда не требуется немедленное регулирование ЧСС или когда недоступен парентеральный путь введения, целесообразно пероральное введение. Как верапамил, так и дилтиазем уменьшают частоту сердечных сокращений в покое и при физической нагрузке и могут улучшить переносимость последней. Эти недигидропиридиновые блокаторы кальциевых каналов не следует назначать пациентам с систолической дисфункцией ЛЖ и декомпенсированной СН из-за негативных инотропных эффектов, но их можно использовать у пациентов с СН при сохраненной систолической функции ЛЖ. Кроме того, эти препараты не следует назначать пациентам с преждевременным возбуждением и МА ввиду потенциального риска укорочения рефрактерности дополнительного проводящего пути, что может ускорить частоту желудочковых сокращений вплоть до развития гипотензии или фибрилляции желудочков (раздел 7.8).
5.1.3. Дигоксин
Обычно не является препаратом первой линии для контроля частоты желудочковых сокращений у пациентов с МА, несмотря на его широкое применение. Хотя дигоксин при внутривенном введении замедляет желудочковый ответ, до начала действия требуется > 1 часа, и эффект не достигает пика в течение до 6 часов после первичного введения. Следовательно, он не является оптимальным препаратом, если необходим быстрый контроль ЧСС. При длительном пероральном приеме дигоксин снижает частоту сердечных сокращений в покое, но он неэффективен при регулировании желудочкового ответа во время физической нагрузки. Дигоксин можно комбинировать с бета-блокаторами или недигидропиридиновыми блокаторами кальциевых каналов, чтобы улучшить контроль частоты желудочковых сокращений при физической нагрузке; он также используется при СН в качестве одного из немногих препаратов для контроля ЧСС, который не обладает отрицательным инотропным эффектом. Побочные эффекты дигоксина включают АВ-блокаду, желудочковые аритмии и, редко, обострение дисфункции синусового узла. Пациентам с дисфункцией почек, пожилым пациентам, а также при приеме препаратов, которые уменьшают выведение дигоксина, в частности амиодарона, пропафенона или недигидропиридиновых блокаторов кальциевых каналов, требуется подбор дозы. Следовательно, требуется периодическая оценка его концентрации в сыворотке у многих пациентов. Исследования, обнаружившие связь между лечением дигоксином и смертностью, подняли дальнейший вопрос относительно его использования, в частности в течение длительного времени. В исследовании AFFIRM прием дигоксина был связан с повышением уровня смертности, который при последующем анализе не зависел от пола или наличия СН. Дозозависимые аритмии являются потенциальной причиной смертности; в исследовании DIG (Digitalis Investigation Group — Исследование применения дигиталисных препаратов) концентрации в сыворотке > 0,9 нг/мл были связаны с повышенным уровнем смертности. Несмотря на это, в другой подгруппе в исследовании AFFIRM при анализе склонности соответствия при пароксизмальной и персистирующей МА не наблюдалось повышения уровня смертности или частоты госпитализации у лиц, принимавших дигоксин в качестве базовой терапии первой линии. Поскольку дигоксин может привести к уменьшению потенциала действия сердечной мышцы, его не следует назначать в качестве монотерапии пациентам с преждевременным возбуждением.
5.1.4. Другие фармакологические препараты для контроля ЧСС
Амиодарон проявляет симпатолитические свойства, а также свойства антагониста кальция, которые могут снижать проведение в АВ–узле. Хотя амиодарон, вводимый внутривенно, может использоваться у тяжелобольных пациентов с отсутствием преждевременного возбуждения для контроля частоты сокращений желудочков, он менее эффективен, чем недигидропиридиновые блокаторы кальциевых каналов, и требует более длительного времени для достижения контроля ЧСС (7 часов против 3 часов для дилтиазема). Имеются ограниченные данные по эффективности длительной пероральной терапии амиодароном в отношении контроля ЧСС при персистирующей МА, но в одном небольшом исследовании он продемонстрировал эффективность, аналогичную дигоксину. Амиодарон является исключительно жирорастворимым. Начало его действия можно ускорить при агрессивном нагрузочном режиме приема, но в этом случае существует потенциальный риск ухудшения гемодинамики у пациентов с декомпенсированной СН или гипотонией. Амиодарон при внутривенном введении не оказывает тех же электрофизиологических эффектов, что при пероральном введении. Амиодарон при внутривенном введении обладает потенциальным риском ускорения желудочкового ответа и может спровоцировать развитие смертельных аритмий у пациентов с МА и преждевременным возбуждением. Амиодарон характеризуется многочисленными токсическими эффектами и лекарственными взаимодействиями, которые ограничивают его продолжительное использование для регулирования частоты желудочковых сокращений. Дронедарон, который, в отличие от амиодарона, не содержит молекул йода, демонстрирует частоту сокращений при МА в покое в среднем 12 уд/мин и также улучшает контроль частоты сердечных сокращений при физической нагрузке; однако его не следует использовать для контроля ЧСС при перманентной МА, поскольку обнаружено, что он повышает частоту развития СН, инсульта, смерти от сердечно-сосудистой патологии и внеплановой госпитализации. Более того, дронедарон не следует использовать для контроля ЧСС у пациентов с СН и систолической дисфункцией ЛЖ, поскольку он увеличивает вероятность комбинированной конечной точки (исхода): инсульта, ИМ, системной эмболии или смерти от сердечно-сосудистой патологии.
5.2. Абляция АВ-узла
Абляция АВ-узла с имплантацией постоянного водителя ритма эффективно контролирует и регулирует частоту желудочковых сокращений и у части пациентов уменьшает симптомы. Пациенты с большей степенью вероятности чувствуют улучшение, включая пациентов с кардиомиопатией, индуцированной тахикардией с рефрактерностью контроля частоты желудочковых сокращений к медикаментозному лечению. Абляцию АВ-узла обычно применяют у пожилых пациентов, поскольку она ведет к зависимости от водителя ритма. У пациентов с признаками рефрактерности к медикаментозной терапии, которым проводится абляция АВ-узла и имплантация постоянного водителя ритма, наблюдаются уменьшение кардиальных симптомов, улучшение качества жизни и снижение частоты обращений за медицинской помощью. При данном подходе отсутствует необходимость в приеме лекарственных препаратов для контроля ЧСС, но требуется прием антикоагулянтов для предотвращения тромбоэмболии в связи с наличием риска развития инсульта у пациентов согласно оценке по шкале CHA2DS2-VASc. С учетом данного подхода пациент должен получить консультацию, чтобы осознать, что это необратимая мера, которая приводит к зависимости продолжительности работы водителя ритма от его потенциальных осложнений. Во временном диапазоне имплантация водителя ритма может быть выполнена за 4–6 недель до абляции АВ-узла, чтобы удостовериться в надлежащем функционировании пейсмекера, поскольку нарушение работы вследствие дислокации электрода может иметь катастрофические последствия. Внезапная смерть, вторичная по отношению к двунаправленной желудочковой тахикардии или фибрилляции желудочков, наблюдалась после абляции АВ-соединения. Данный исход, возможно, связан с повышенной дисперсией рефрактерности желудочков, обусловленной внезапным замедлением частоты сердечных сокращений и желудочковой стимуляции. После абляции частота сокращений при желудочковой стимуляции устанавливается в диапазоне от 90 до 100 уд/мин и затем постепенно снижается в течение нескольких месяцев. Апикальная стимуляция ЛЖ также создает последовательность желудочковой активации, что может привести к сниженной функции желудочков. У пациентов с фракцией выброса левого желудочка (ФВЛЖ) < 35 % и симптомами СН рекомендуется имплантация бивентрикулярной стимулирующей системы. Данную процедуру также следует рассматривать у пациентов с менее тяжелой вентрикулярной дисфункцией. В исследовании BLOCK HF (Biventricular Versus Right Ventricular Pacing in Heart Failure Patients With Atrioventricular Block — Бивентрикулярная стимуляция против правожелудочковой стимуляции у пациентов с сердечной недостаточностью и атриовентрикулярной блокадой) у пациентов с АВ-блокадой высокой степени и с ФВЛЖ < 50 % наблюдалось улучшение клинических исходов при лечении с помощью бивентрикулярного водителя ритма по сравнению с апикальной стимуляцией ПЖ. Установку бивентрикулярной стимулирующей системы следует рассматривать у пациентов, которые подверглись абляции АВ-узла, совместно с системой стимуляции ПЖ, у которых развилась умеренная или тяжелая систолическая дисфункция ЛЖ.
6. Регулирование ритма
Длительное лечение МА может быть направлено на восстановление и поддержание синусового ритма, что обычно называется стратегией контроля ритма, с использованием сочетания подходов, включая кардиоверсию, антиаритмические лекарственные препараты и радиочастотную катетерную абляцию, на фоне надлежащей антикоагулянтной терапии и контроля ЧСС. РКТ, в которых сравнивались исходы стратегии контроля ритма с применением антиаритмических лекарственных препаратов с исходами стратегии контроля ЧСС у пациентов с МА, не выявили превосходства контроля ритма над стратегией контроля ЧСС по показателю смертности.
Более того, при применении у пациентов, которые являются кандидатами для обеих стратегий лечения (контроль ритма или ЧСС), стратегия контроля ритма привела к большему числу госпитализаций. Следовательно, рутинное использование стратегии контроля ритма не показано для некоторых пациентов. Катетерная абляция в данном контексте не изучалась.
Хотя начальная стратегия контроля ЧСС является целесообразной для многих пациентов, некоторые факторы свидетельствуют в пользу стратегии контроля ритма. Успешное поддержание синусового ритма связано с уменьшением симптомов и улучшением качества жизни для некоторых пациентов. Персистирующие симптомы, связанные с МА, остаются основным показанием для стратегии контроля ритма. Другие факторы, которые могут свидетельствовать в пользу попыток контроля ритма, включают затруднения в достижении адекватного контроля частоты, детский возраст, кардиомиопатию, индуцированную тахикардией, первый эпизод МА, МА, которая спровоцирована острым заболеванием, и предпочтения пациента. МА прогрессирует от пароксизмальной до персистирующей у многих пациентов и впоследствии приводит к электрическому и структурному ремоделированию, которое становится необратимым с течением времени. По этой причине принятие МА как перманентной у пациента может сделать будущую терапию, направленную на контроль ритма, менее эффективной. Это может быть более характерно для молодых лиц, которые желают остаться кандидатом для будущих разработок в терапии по контролю ритма. Может быть целесообразным раннее вмешательство со стратегией контроля ритма для предотвращения прогрессирования МА.
6.1. Электрическая и фармакологическая кардиоверсия МА или фибрилляции предсердий
6.1.1. Предотвращение тромбоэмболии: рекомендации
Класс I
1. Для пациентов с МА или фибрилляцией предсердий продолжительностью 48 часов и более либо с МА с неизвестной продолжительностью рекомендуется антикоагулянтная терапия варфарином (МНО от 2,0 до 3,0) в течение не менее 3 недель до и 4 недель после кардиоверсии, независимо от количества баллов по шкале CHA2DS2-VASc и метода (электрическая или фармакологическая), используемого для восстановления синусового ритма (уровень доказательности: B).
2. Для пациентов с МА или фибрилляцией предсердий более 48 часов либо с неизвестной продолжительностью, которая требует немедленной кардиоверсии вследствие гемодинамической нестабильности, антикоагулянтную терапию следует начинать как можно скорее и продолжать в течение не менее 4 недель после кардиоверсии при отсутствии противопоказаний (уровень доказательности: С).
3. Пациентам с МА или фибрилляцией предсердий продолжительностью менее 48 часов и с высоким риском развития инсульта рекомендуется немедленное введение гепарина или НМГ внутривенно либо введение ингибитора фактора Ха или прямого ингибитора тромбина до или сразу после кардиоверсии с последующей долгосрочной антикоагулянтной терапией (уровень доказательности: С).
4. После кардиоверсии при МА любой длительности решение в отношении длительной антикоагулянтной терапии должно основываться на профиле риска развития тромбоэмболии (раздел 4) (уровень доказательности: С).
Класс IIa
1. Для пациентов с МА или фибрилляцией предсердий продолжительностью 48 часов и более или с неизвестной продолжительностью, которым не проводилась антикоагулянтная терапия в течение предшествующих 3 недель, целесообразно выполнить ЧПЭхоКГ перед кардиоверсией и продолжить с кардиоверсией, если не было выявлено тромба ЛП, включая УЛП, что свидетельствует о достижении антикоагулянтного эффекта до ЧПЭхоКГ и сохранении его после кардиоверсии в течение не менее 4 недель (уровень доказательности: B).
2. У пациентов с МА или фибрилляцией предсердий продолжительностью 48 часов и более или при неизвестной продолжительности МА целесообразно проведение антикоагулянтной терапии дабигатраном, ривароксабаном или апиксабаном в течение не менее 3 недель до и 4 недель после кардиоверсии (уровень доказательности: С).
3. У пациентов с МА или фибрилляцией предсердий продолжительностью менее 48 часов, с низким риском развития тромбоэмболии для проведения кардиоверсии может рассматриваться применение антикоагулянтной терапии (гепарин, НМГ внутривенно или современный пероральный антикоагулянт) или отсутствие антитромботической терапии без необходимости применения пероральной антикоагулянтной терапии после кардиоверсии (уровень доказательности: С).
6.2.1. Кардиоверсия прямым током: рекомендации
Класс I
1. При выборе стратегии контроля ритма кардиоверсия рекомендуется пациентам с МА или фибрилляцией предсердий в качестве метода восстановления синусового ритма. Если кардиоверсия оказалась безуспешной, повторные попытки кардиоверсии прямым током могут быть предприняты после корректировки расположения электродов, или применения давления на электроды, или последующего введения антиаритмических препаратов (уровень доказательности: B).
2. Кардиоверсия рекомендуется, когда быстрый желудочковый ответ на МА (фибрилляцию предсердий) не отвечает должным образом на фармакологическую терапию и способствует дальнейшему развитию ишемии миокарда, гипотонии или СН (уровень доказательности: С).
3. Кардиоверсия рекомендуется пациентам с МА (фибрилляцией предсердий) и преждевременным возбуждением, если тахикардия связана с гемодинамической нестабильностью (уровень доказательности: С).
Класс IIa
1. Целесообразно выполнить повторную кардиоверсию у пациентов с персистирующей МА, обеспечивающую поддержание синусового ритма в течение клинически значимого периода между процедурами кардиоверсии. Тяжесть симптомов МА и предпочтение пациента должны учитываться при начале осуществления стратегии, требующей серии процедур кардиоверсии (уровень доказательности: С).
6.3.1. Фармакологическая кардиоверсия: рекомендации
Класс I
1. Флекаинид, дофетилид, пропафенон и внутривенный ибутилид применяются для фармакологической кардиоверсии МА в случае отсутствия противопоказаний к выбранным лекарственным препаратам (уровень доказательности: A).
Класс IIa
1. Введение амиодарона перорально является целесообразным выбором для фармакологической кардиоверсии при МА (уровень доказательности: A).
2. Пропафенон или флекаинид (принцип «таблетка в кармане») в дополнение к бета-блокаторам или недигидропиридиновым блокаторам кальциевых каналов целесообразно назначать для купирования МА вне больничных условий, поскольку сообщалось о безопасности данного лечения у выбранных пациентов в контролируемых условиях (уровень доказательности: B).
Класс III: вред
1. Не следует начинать терапию дофетилидом вне больничных условий вследствие риска удлинения интервала QT, что может привести к развитию двунаправленной веретенообразной желудочковой тахикардии (уровень доказательности: B).
6.2. Фармакологические препараты для предотвращения МА и поддержания синусового ритма
6.2.1. Антиаритмические препараты для поддержания синусового ритма: рекомендации
Класс I
1. Перед началом антиаритмической терапии рекомендуется лечение провоцирующих или потенциально обратимых факторов развития МА (уровень доказательности: С).
2. Для поддержания синусового ритма пациентам с МА рекомендуется назначение следующих антиаритмических препаратов, в зависимости от основного заболевания сердца и сопутствующей патологии (уровень доказательности: А):
а) амиодарона;
b) дофетилида;
c) дронедарона;
d) флекаинида;
e) пропафенона;
f) соталола.
3. Риски при назначении антиаритмических препаратов, включая проаритмию, следует учитывать до начала лечения каждым из препаратов (уровень доказательности: С).
4. Вследствие наличия потенциальных токсических эффектов амиодарон следует применять только после учета рисков и в случае, когда другие препараты не оказывают должного действия или противопоказаны (уровень доказательности: С).
Класс IIa
1. Стратегия контроля ритма с помощью фармакологической терапии может использоваться у пациентов с МА для лечения кардиомиопатии, обусловленной тахикардией (уровень доказательности: С).
Класс IIb
1. Продолжение терапии текущим антиаритмическим препаратом может быть целесообразно в условиях нечастых, хорошо переносимых рецидивов МА, если лекарственный препарат снижал частоту симптомов МА (уровень доказательности: С).
Класс III: вред
1. Не следует продолжать прием антиаритмических препаратов для контроля ритма, если МА переходит в перманентную форму (уровень доказательности: С), включая дронедарон (уровень доказательности: B).
2. Дронедарон не следует использовать для лечения МА у пациентов с СН III и IV функционального класса, согласно классификации Нью-Йоркской ассоциации сердца (NYHA), или у пациентов, у которых наблюдался эпизод декомпенсированной СН в последние 4 недели (уровень доказательности: B).
6.2.2. «Опережающая» терапия (upsteam therapy, терапия «против течения»): рекомендации
Класс IIa
1. Ингибиторы АПФ или блокаторы ангиотензиновых рецепторов (БАР) целесообразно назначать для первичного предотвращения вновь возникшей МА у пациентов с СН со сниженной ФВЛЖ (уровень доказательности: B).
Класс IIb
1. Лечение ингибиторами АПФ или БАР можно рассматривать для первичного предотвращения вновь возникшей МА в условиях гипертензии (уровень доказательности: B).
2. Лечение статинами может быть целесообразно для первичного предотвращения вновь возникшей МА после хирургического вмешательства на коронарных артериях (уровень доказательности: A).
Класс III: отсутствие пользы
1. Лечение ингибиторами АПФ, БАР или статинами нецелесообразно для первичного предотвращения МА у пациентов с сердечно-сосудистым заболеванием (уровень доказательности: B)
6.3. Катетерная абляция при МА для поддержания синусового ритма: рекомендации
Класс I
1. Катетерная абляция при МА используется для лечения симптоматической пароксизмальной МА, устойчивой или чувствительной к антиаритмическим препаратам по крайней мере I и III класса, при выборе стратегии контроля ритма (уровень доказательности: A).
2. До рассмотрения катетерной абляции МА рекомендуется провести оценку риска процедуры и исходов в отношении конкретного пациента (уровень доказательности: С).
Класс IIa
1. Катетерная абляция при МА целесообразна для выбранных пациентов с симптоматической персистентной МА, устойчивой или чувствительной к антиаритмическим препаратам по крайней мере I и III класса (уровень доказательности: A).
2. У пациентов с рецидивирующей симптоматической пароксизмальной МА катетерная абляция является целесообразной начальной стратегией контроля ритма до попытки назначения лечения антиаритмическим препаратом после взвешивания рисков и исходов при проведении лекарственной терапии и абляции (уровень доказательности: B).
Класс IIb
1. Катетерная абляция МА может рассматриваться при симптоматической продолжительной (> 12 месяцев) персистентной МА, устойчивой или чувствительной к антиаритмическим препаратам по крайней мере I и III класса, когда предпочтительной является стратегия контроля ритма (уровень доказательности: B).
2. Возможность проведения катетерной абляции при МА может рассматриваться до начала лечения антиаритмическим препаратом класса I или III при симптоматической персистентной МА, когда предпочтительной является стратегия контроля ритма (уровень доказательности: С).
Класс III: вред
1. Катетерную абляцию МА следует выполнять пациентам, которым нельзя назначать антикоагулянтную терапию во время и после процедуры (уровень доказательности: С).
2. Катетерную абляцию при МА для восстановления синусового ритма следует выполнять с целью устранения потребности в антикоагулянтной терапии (уровень доказательности: С).
6.3.1. Отбор пациентов
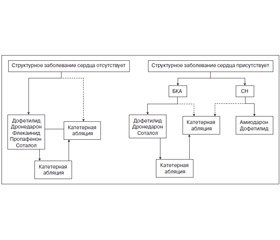
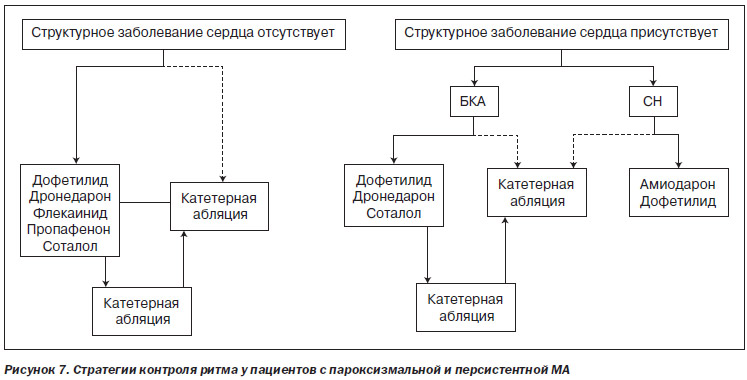
Решение о проведении катетерной абляции зависит от многих факторов, включая тип МА (пароксизмальная/персистентная/продолжительная персистентная), тяжесть симптомов, наличие структурного заболевания сердца, кандидатуры на альтернативные варианты, такие как контроль ЧСС или лечение антиаритмическими препаратами, вероятность развития осложнений и предпочтения пациента. Важно осознавать, что большинство пациентов, включенных в исследования катетерной абляции при МА, были в целом молодыми, здоровыми лицами с симптоматической пароксизмальной МА, устойчивой к ≥ 1 антиаритмическому препарату. Безопасность и эффективность катетерной абляции менее хорошо изучены в других популяциях пациентов, особенно у пациентов с продолжительной персистентной МА, пожилых пациентов и пациентов с тяжелой СН, включая кардиомиопатию, индуцированную тахикардией (раздел 6.3). На рис. 7 изображен подход к интеграции антиаритмических препаратов и катетерной абляции при МА у пациентов с наличием и отсутствием структурного заболевания сердца.
6.4. Водители ритма и имплантируемые кардиовертер-дефибрилляторы для предотвращения МА
Главная роль водителей ритма при лечении пациентов с МА заключается в лечении симптоматической брадикардии, которая часто связана с лежащим в основе заболевания синдромом слабости синусового узла. Антиаритмическая терапия может усугубить синдром слабости синусового узла и потребовать имплантации водителя ритма. У пациентов с синдромом слабости синусового узла, которые нуждаются в стимуляции, предсердная или двухкамерная стимуляция значительно снижают частоту развития последующей МА по сравнению со стимуляцией ПЖ. Попытки предотвратить эпизоды МА с помощью запатентованных алгоритмов усиленной стимуляции предсердий, которые реагируют на преждевременный предсердный комплекс, являются несостоятельными. Следовательно, постоянная электростимуляция не показана для предотвращения МА у пациентов при отсутствии других показаний для имплантации водителя ритма. Предсердные дефибрилляторы для автоматической кардиоверсии МА не имеют клинического значения; большинство пациентов находят энергию разряда > 1 Дж неудобной, и часто наблюдается раннее возвращение МА с последующим шоком. Имплантированные дефибрилляторы не показаны для регулирования ритма при МА.
6.5. Хирургическое вмешательство на сердце по типу «лабиринт»: рекомендации
Класс IIa
1. Процедура хирургической абляции при МА является целесообразной для отдельных пациентов с МА, подвергающихся хирургическому вмешательству на сердце по другим показаниям (уровень доказательности: С).
Класс IIb
1. У отдельных пациентов с многосимптомной формой МА, плохо управляемой с помощью других подходов, может быть целесообразно проведение обособленной процедуры хирургической абляции (уровень доказательности: B).
7. Особые группы пациентов и МА
7.1. Спортсмены
Пароксизмальная или персистентная МА часто встречается среди спортсменов и может быть автономно спровоцирована другими наджелудочковыми тахикардиями. Сопутствующие состояния, такие как гипертензия и БКА, должны учитываться, особенно у пожилых спортсменов; трансторакальная эхокардиография поможет выявить наличие структурного заболевания сердца. Необходимо проведение оценки частоты ответа желудочков во время эпизода МА, для чего может потребоваться ЭКГ-мониторирование в амбулаторных условиях и/или нагрузочная проба с уровнем нагрузки, аналогичным таковому при предполагаемом виде спорта. Другие подходы к лечению, в частности радиочастотная катетерная абляция или «таблетка в кармане», могут рассматриваться применительно к спортсменам. Особенности других видов лечения рассматриваются в разделе 6.1.3.
7.2. Пожилые люди
Распространенность МА увеличивается с возрастом, и приблизительно 35 % пациентов с МА находятся в возрасте ≥ 80 лет. Пожилые люди представляют собой гетерогенную группу с потенциальной возможностью развития множественных осложнений. Чрезвычайно важно рассматривать роль каждого осложнения, чтобы убедиться, что конечные цели лечения учитываются в принятии управленческих решений. У пожилых пациентов с МА симптомы могут быть незначительными и в некоторой степени атипичными. У пожилых пациентов повышается риск развития инсульта. По этой причине в шкале оценки риска CHA2DS2-VASc указан возраст от 65 до 74 лет как менее значительный фактор риска развития инсульта и ≥ 75 лет как более значительный фактор риска.
Поскольку МА часто ассоциируется с наличием минимальных симптомов или полным их отсутствием в данной популяции, клиренс антиаритмических препаратов снижается, чувствительность к проаритмическому воздействию, включая брадиаритмии, часто повышается. Следовательно, предпочтение зачастую отдается стратегии контроля ЧСС, а кардиоверсия прямым током используется менее часто. Обычно контроль ЧСС можно достигнуть бета-блокаторами или недигидропиридиновыми блокаторами кальциевых каналов. За такими пациентами должно быть установлено медицинское наблюдение, поскольку они часто более подвержены ортостатической гипотензии или брадиаритмиям, а также в случаях, когда МА носит пароксизмальный характер, более часто встречается дисфункция синусового узла. Также необходимо учитывать сопутствующие заболевания. Дигоксин можно применять для контроля ЧСС у относительно стабильных лиц, но необходимо помнить о возможных рисках вследствие его применения (раздел 5.1.3).
7.3. Гипертоническая кардиомиопатия: рекомендации
Класс I
1. Антикоагулянтная терапия показана пациентам с ГКМ с МА независимо от количества баллов по шкале CHA2DS2-VASc (уровень доказательности: B).
Класс IIa
1. Антиаритмические препараты можно использовать для предотвращения рецидивов МА у пациентов с ГКМ.
Применение амиодарона или дизопирамида в комбинации с бета-блокатором или недигидропиридиновым блокатором кальциевых каналов является целесообразным методом лечения (уровень доказательности: С).
2. Катетерная абляция при МА может быть показана пациентам с ГКМ, у которых предпочтение отдается стратегии контроля ритма, если антиаритмические препараты неэффективны или плохо переносятся (уровень доказательности: B).
Класс IIb
1. Соталол, дофетилид и дронедарон могут рассматриваться для стратегии регулирования ритма у пациентов с ГКМ (уровень доказательности: С).
Пациенты с ГКМ рассматриваются отдельно, поскольку их уникальная патология служит для отличия их от других пациентов с гипертрофией ЛЖ. ГКМ определяется на основании стандартного критерия, в частности электрокардиографического определения гипертрофированного, недилатированного ЛЖ при отсутствии другого сердечного или системного заболевания, способного продуцировать амплитуду, указывающую на гипертрофию. МА относительно часто встречается при ГКМ, распространенность ее увеличивается с возрастом, и она часто симптоматически плохо переносится. Частота встречаемости МА составляет 2 % в год у пациентов с ГКМ, и приблизительно две трети пациентов с ГКМ и МА имеют пароксизмальную форму. МА ассоциирована с повышенной смертностью у пациентов с ГКМ (3 % — у пациентов с МА и 1 % — при синусовом ритме в год) и в основном вследствие СН. Риск развития СН, ассоциированный с МА у пациентов с ГКМ, увеличивается при сужении выхода и у тех, у кого МА развивается до 50 лет.
Существует значительный риск развития инсульта и системной эмболии у пациентов с ГКМ и МА. При обследовании 480 пациентов с ГКМ риск развития инсульта у пациентов с МА составил 17,7 %. Хотя информация о рандомизированных контролируемых исследованиях антикоагулянтной терапии отсутствует, частота развития тромбоэмболии у пациентов с ГКМ и МА высокая, антикоагулянты показаны для данных пациентов, независимо от количества баллов по шкале CHA2DS2-VASc (или CHADS2). Антикоагулянтная терапия прямыми ингибиторами тромбина или ингибиторами фактора Ха может являться еще одним вариантом для снижения риска тромбоэмболических событий, однако данные для пациентов с ГКМ отсутствуют.
Принимая во внимание плохую переносимость МА пациентами с ГКМ, предпочтительной является стратегия контроля ритма. Однако для тех пациентов, для которых выбрана стратегия контроля ЧСС, предпочтительным вариантом выбора является недигидропиридиновый блокатор кальциевых каналов, бета-блокатор или их комбинация. Дигоксин, обладающий положительным инотропным эффектом, может повышать градиент оттока у пациентов с ГКМ, поэтому следует избегать его назначения. Не проводились систематические исследования лечения МА у пациентов с ГКМ, но применялись различные антиаритмические препараты, включая дизопирамид, пропафенон, амиодарон, соталол, дофетилид и дронедарон. Имплантируемый кардиовертер-дефибриллятор может обеспечить дополнительную безопасность при применении лекарственных препаратов, увеличивающих интервал QT. Обычно предпочтение отдают амиодарону или дизопирамиду в комбинации с препаратами, регулирующими частоту желудочковых сокращений.
Частота достижения успеха и развития осложнений при применении катетерной абляции при МА аналогична таковой при ГКМ и других формах заболевания сердца, но исходы, вероятно, подвержены влиянию систематической ошибки, связанной с отбором пациентов. Хирургическое вмешательство типа «лабиринт» при МА демонстрирует некоторый положительный эффект, однако роль хирургического вмешательства типа «лабиринт» у пациентов, подвергающихся другим хирургическим вмешательствам на открытой грудной клетке (например, септальная миэктомия), остается нерешенной.
7.4. МА, осложненная ОКС: рекомендации
Класс I
1. Экстренная кардиоверсия вновь возникшей МА прямым током при наличии ОКС рекомендуется пациентам с гемодинамическими нарушениями, продолжающейся ишемией или неадекватным контролем ЧСС (уровень доказательности: С).
2. Внутривенное введение бета-блокаторов рекомендуется для замедления быстрого желудочкового ответа на МА у пациентов с ОКС с отсутствием признаков СН, гемодинамической нестабильности или бронхоспазмом (уровень доказательности: С).
3. Пациентам с ОКС и МА с количеством баллов по шкале CHA2DS2-VASc 2 и более рекомендуется антикоагулянтная терапия варфарином при отсутствии противопоказаний (уровень доказательности: С).
Класс IIb
1. Введение амиодарона или дигоксина может рассматриваться для замедления быстрого желудочкового ответа у пациентов с ОКС и МА, ассоциированной с тяжелой дисфункцией ЛЖ и СН или гемодинамической нестабильностью (уровень доказательности: С).
2. Введение недигидропиридиновых блокаторов кальциевых каналов может рассматриваться для замедления быстрого ответа желудочков у пациентов с ОКН и МА только при отсутствии тяжелой СН или гемодинамической нестабильности (уровень доказательности: С).
7.5. Гипертиреоидизм: рекомендации
Класс I
1. Бета–блокаторы рекомендуются для контроля частоты желудочковых сокращений у пациентов с МА, осложненной тиреотоксикозом, при отсутствии противопоказаний (уровень доказательности: С).
2. В ситуации, при которой нельзя назначить бета-блокатор, рекомендуется применение недигидропиридинового блокатора кальциевых каналов для контроля частоты желудочковых сокращений (уровень доказательности: С).
МА является наиболее частым видом аритмии у пациентов с гипертиреоидизмом (от 5 до 15 % пациентов) и наиболее часто встречается среди этих пациентов в возрасте > 60 лет. Осложнения МА при гипертиреоидизме включают СН и тромбоэмболию, хотя корреляция с тромбоэмболическим заболеванием спорна.
Лечение направлено главным образом на восстановление состояния эутиреоза, которое обычно ассоциировано со спонтанным переходом МА к синусовому ритму. Антиаритмические препараты и кардиоверсия часто неэффективны для достижения стабильного синусового ритма, поскольку присутствует тиреотоксикоз; следовательно, усилия, направленные на восстановление синусового ритма могут быть отсрочены до тех пор, пока у пациента не будет достигнут эутиреоз. В данной ситуации бета-блокаторы эффективны для контроля частоты желудочковых сокращений, и лечение бета-блокаторами особенно важно в случаях тиреотоксического криза; недигидропиридиновые блокаторы кальциевых каналов рекомендуются для контроля ЧСС. Хотя в некоторых исследованиях сообщалось о наличии тромбоэмболии у пациентов с тиреотоксикозом и МА, факты свидетельствуют, что риск развития эмболии не обязательно был повышен вне зависимости от других факторов риска инсульта. Назначение антикоагулянтной терапии пациентам с тиреотоксикозом должно быть основано на факторах риска по шкале CHA2DS2-VASc.
Гипертиреоидизм и тиреотоксикоз иногда могут развиваться на фоне длительного приема амиодарона. В случае развития ятрогенного тиреоидизма при лечении амиодароном следует прекратить прием лекарственного препарата. Риски и преимущества лечения амиодароном пациентов с МА с установленным диагнозом заболевания щитовидной железы в анамнезе следует тщательно взвешивать до начала лечения, и пациенты должны находиться под пристальным наблюдением врача.
7.6. Острое некардиальное заболевание
Ряд острых некардиальных состояний связан с МА (например, гипертензия, состояние после операции, легочная эмболия, вирусная инфекция). Лечение сопутствующих заболеваний и коррекция сопутствующих факторов в виде терапии первой линии являются общими для всех подобных случаев, и у многих пациентов происходит спонтанная ремиссия при коррекции сопутствующего заболевания. Однако при остром заболевании пациентам может потребоваться контроль частоты сокращений с помощью кардиоверсии, блокаторов АВ-узла и/или антиаритмических препаратов, если МА плохо переносится или невозможно достичь контроля ЧСС. Выбор специфического(их) препарата(ов) по регулированию частоты или ритма будет зависеть от основного медицинского состояния. Следует учитывать, что повышенный уровень катехоламинов характерен для многих из этих клинических состояний и при отсутствии противопоказаний бета-блокаторы являются предпочитаемыми препаратами для начальной терапии. Роль антикоагулянтной терапии менее ясна и, вероятно, зависит от конкретного заболевания, а также должна рассматриваться на основании профиля риска и продолжительности МА.
7.7. Болезнь легких: рекомендации
Класс I
1. Недигидропиридиновый блокатор кальциевых каналов рекомендуется для регулирования частоты желудочковых сокращений у пациентов с МА и хронической обструктивной болезнью легких (уровень доказательности: С).
2. Кардиоверсию прямым током следует рассматривать у пациентов с легочным заболеванием, которые находятся в состоянии гемодинамической нестабильности вследствие нового приступа МА (уровень доказательности: С).
Наджелудочковые аритмии, включая МА, распространены у пациентов с хронической обструктивной болезнью легких. МА следует отличать от многоочаговой предсердной тахикардии, которая плохо отвечает на электрическую кардиоверсию, но часто будет замедляться при лечении сопутствующего заболевания и в ответ на недигидропиридиновые блокаторы кальциевых каналов. Лечение сопутствующего легочного заболевания и коррекция гипоксии и кислотно-основного равновесия являются наиболее важными в данной ситуации и представляют собой терапию первой линии.
Антиаритмическая терапия и кардиоверсия могут быть неэффективны при МА до тех пор, пока не будет скорректирована респираторная декомпенсация. Теофиллин и агонисты бета-адренергических рецепторов могут спровоцировать МА и затруднить контроль частоты желудочковых сокращений. Не-бета-1-селективные блокаторы, соталол, пропафенон и аденозин противопоказаны пациентам с бронхоспазмом. Однако назначение бета-блокаторов, соталола или пропафенона может рассматриваться у пациентов с обструктивной болезнью легких и МА при отсутствии бронхоспазма. Контроль ЧСС обычно безопасно достигается при назначении недигидропиридиновых блокаторов кальциевых каналов или, вероятно, амиодарона. Дигоксин можно использовать с блокаторами кальциевых каналов, в частности, у пациентов с сохраненной ФВЛЖ. У пациентов, устойчивых к лекарственной терапии, для контроля частоты желудочковых сокращений может потребоваться абляция АВ-узла и желудочковая стимуляция.
7.8. Синдром WPW и синдром преждевременного возбуждения: рекомендации
Класс I
1. Экстренная кардиоверсия прямым током рекомендуется пациентам с МА, WPW и быстрым желудочковым ответом, у которых наблюдаются гемодинамические нарушения (уровень доказательности: С).
2. Внутривенное введение прокаинамида или ибутилида для восстановления синусового ритма или замедления частоты желудочковых сокращений рекомендуется пациентам с МА с преждевременным возбуждением и быстрым жедудочковым ответом, у которых отсутствуют гемодинамические нарушения (уровень доказательности: С).
3. Катетерная абляция добавочного пути рекомендуется у пациентов при наличии симптомов с МА с преждевременным возбуждением, особенно если добавочный путь имеет короткий рефрактерный период, который обусловливает возникновение быстрого антеградного проведения (уровень доказательности: С).
Класс III: вред
1. Внутривенное введение амиодарона, аденозина, дигоксина (перорально или внутривенно) или недигидропиридиновых блокаторов кальциевых каналов (перорально или внутривенно) у пациентов с синдромом WPW при наличии МА с преждевременным возбуждением является потенциально опасным, поскольку оно ускоряет частоту желудочковых сокращений (уровень доказательности: B).
МА является предметом беспокойства у пациентов с синдромом WPW ввиду потенциального риска развития дистрофии на фоне фибрилляции желудочков, связанной с быстро проводящими антеградными добавочными путями. Риск развития МА в течение 10 лет у пациентов с WPW оценивается в 15 %, хотя механизм повышенного риска МА изучен плохо. Приблизительно 25 % пациентов с синдромом WPW имеют добавочные пути с короткими рефрактерными периодами (< 250 мс), которые связаны с риском развития ускоренной частоты желудочковых сокращений и фибрилляции желудочков. Пациенты с множественными добавочными путями также подвержены более высокому риску развития фибрилляции желудочков. Установлены безопасность и эффективность катетерной абляции добавочного пути, однако абляция добавочного пути не всегда предотвращает развитие МА, особенно у пожилых пациентов, и требуется дополнительная фармакологическая или абляционная терапия. После элиминации добавочного пути процесс выбора фармакологической терапии аналогичен таковому у пациентов с преждевременным возбуждением.
Особенности антиаритмической терапии описаны в разделе 6. При МА частота желудочковых сокращений определяется конкурирующим проведением по АВ-узлу и добавочному(ным) пути(ям). Как и при нестабильной аритмии, кардиоверсия рекомендуется при гемодинамической нестабильности. Препараты, которые замедляют проведение по АВ-узлу, не увеличивая рефрактерность добавочного пути, могут ускорять частоту желудочковых сокращений и провоцировать развитие гемодинамического коллапса и фибрилляции желудочков у пациентов группы высокого риска. Внутривенное введение ибутилида или прокаинамида может замедлять скорость проведения по добавочному пути, частоту желудочковых сокращений или может перевести МА в синусовый ритм; оно рекомендуется для гемодинамически стабильных пациентов с МА с проведением добавочного пути. Верапамил, дилтиазем, аденозин, дигоксин (перорально или внутривенно) и амиодарон внутривенно могут спровоцировать фибрилляцию предсердий и поэтому не должны использоваться. Таким образом, считается потенциально опасным использование лидокаина при МА с преждевременным возбуждением. Амиодарон при пероральном введении может замедлить или заблокировать проведение по добавочному пути при длительной пероральной терапии. Хотя бета-блокаторы теоретически обладают аналогичным потенциальным риском, имеются некоторые данные относительно введения этих препаратов при быстрой МА у пациентов c синдромом WPW; тем не менее их следует применять с осторожностью.
7.9. Сердечная недостаточность: рекомендации
Класс I
1. Рекомендуется контроль частоты сердечных сокращений в покое с использованием бета-блокаторов либо недигидропиридиновых блокаторов кальциевых каналов при персистирующей или перманентной МА и компенсированной СН с сохраненной ФВ (СНсФВ) (уровень доказательности: B).
2. При отсутствии преждевременного возбуждения рекомендуется внутривенное введение бета-блокаторов (или недигидропиридиновых блокаторов кальциевых каналов у пациентов с СНсФВ) для замедления желудочкового ответа на МА в острых условиях с осторожностью, необходимой у пациентов с явными застойными явлениями, гипотензией или СН со сниженной ФВЛЖ (уровень доказательности: B).
3. При отсутствии преждевременного возбуждения для экстренного контроля частоты сердечных сокращений у пациентов с СН рекомендуется внутривенное введение дигоксина или амиодарона (уровень доказательности: B).
4. Оценка контроля частоты сердечных сокращений во время физической нагрузки и подбор фармакологического лечения в целях сохранения частоты в физиологическом диапазоне применяются у пациентов с наличием симптомов во время повседневной деятельности (уровень доказательности: С).
5. Дигоксин эффективен для регулирования частоты сердечных сокращений в покое у пациентов с СН со сниженной ФВ (уровень доказательности: С).
Класс IIa
1. Комбинация дигоксина и бета-блокатора (или недигидропиридинового антагониста кальциевых каналов у пациентов с СНсФВ) целесообразна для контроля частоты сердечных сокращений в покое и при физической нагрузке у пациентов с МА (уровень доказательности: B).
2. Для контроля частоты сердечных сокращений при неэффективности или непереносимости фармакологической терапии целесообразно проводить абляцию АВ-узла со стимуляцией желудочков (уровень доказательности: B).
3. Внутривенное введение амиодарона может использоваться для регулирования частоты сердечных сокращений у пациентов с МА, когда другие меры неэффективны или противопоказаны (уровень доказательности: С).
4. У пациентов с МА и быстрым желудочковым ответом, вызывающим или предположительно вызывающим кардиомиопатию, индуцированную тахикардией, целесообразно достичь контроль частоты сокращений либо с помощью блокады АВ-узла, либо с помощью стратегии контроля ритма (уровень доказательности: B).
5. У пациента с хронической СН при отсутствии симптомов МА помимо стратегии контроля частоты сокращений целесообразно использовать стратегию контроля ритма (уровень доказательности: С).
Класс IIb
1. Амиодарон при пероральном введении можно назначать, когда частота сердечных сокращений в покое и при физической нагрузке не может контролироваться адекватно с помощью бета-блокаторов (или недигидропиридиновых блокаторов кальциевых каналов у пациентов с СНсВФ) или дигоксина в виде монотерапии или комбинации (уровень доказательности: С).
2. Применение абляции АВ-узла может рассматриваться, когда нельзя контролировать частоту сокращений и предполагается кардиомиопатия, индуцированная тахикардией (уровень доказательности: С).
Класс III: вред
1. Абляцию АВ-узла не следует выполнять, не попытавшись достичь контроля частоты желудочковых сокращений с помощью фармакологической терапии (уровень доказательности: С).
2. Для контроля ЧСС не следует вводить внутривенно недигидропиридиновые блокаторы кальциевых каналов, бета-блокаторы и дронедарон пациентам с декомпенсированной СН (уровень доказательности: С).
У пациентов с СН вероятность развития МА выше, чем в общей популяции; существует прямая взаимосвязь между классом по NYHA и распространенностью МА у пациентов с СН, варьируя от 4 % у лиц с СН класса I по NYHA до 40 % у лиц с классом IV. МА также является сильным независимым фактором для последующего развития СН. Кроме того, среди лиц с СН и сниженной ФВ пациенты с СН вследствие диастолической дисфункции при СНсФВ также находятся в группе повышенного риска развития МА. СН и МА могут взаимодействовать, поддерживая и обостряя друг друга посредством таких механизмов, как зависимое от частоты ухудшение сердечной функции, фиброз и активация нейрогуморальных вазоконстрикторов. МА может приводить к ухудшению симптомов у пациентов с СН, и, наоборот, ухудшение МА может способствовать ускорению ответа желудочков при МА.
Как и у других пациентов в популяции, основными целями терапии для лиц с МА и СН являются предотвращение развития тромбоэмболии и регулирование симптомов. Предполагается, что большинство пациентов с СН и МА являются кандидатами для системной антикоагулянтной терапии при отсутствии противопоказаний (раздел 4). Общие принципы лечения включают коррекцию основных причин МА и СН, а также оптимизацию лечения СН. Как и в других популяциях пациентов, изучается вопрос контроля ЧСС в сравнении с контролем ритма. У пациентов, у которых в результате МА развилась СН, следует применять стратегию контроля ритма. Важно осознавать, что МА с ускоренным ответом желудочков является одной из потенциально менее обратимых причин СН. Следовательно, у пациентов, у которых обнаружена впервые развившаяся СН при наличии МА с ускоренным желудочковым ответом, следует рассматривать наличие кардиомиопатии, индуцированной тахикардией, если не доказано иное. В данной ситуации можно рассматривать 2 стратегии. Одна из них — применить контроль ЧСС у пациента с МА и посмотреть, уменьшились ли симптомы СН и МА. Другая стратегия — попытаться восстановить и поддержать синусовый ритм. В данной ситуации лечение обычно начинается с амиодарона, после чего через месяц показана кардиоверсия. Преимущество амиодарона в том, что он является как эффективным лекарственным средством для контроля ЧСС, так и самым эффективным антиаритмическим препаратом с низким риском развития проаритмии.
У пациентов с СН, у которых развивается МА, стратегия контроля ритма не стоит выше стратегии контроля ЧСС. Если выбрана стратегия контроля ритма, катетерная абляция при МА у пациентов с СН может привести к улучшению функции ЛЖ и качеству жизни, но маловероятно, что она будет эффективнее, чем у пациентов с нормальной сердечной функцией. Вследствие благоприятного влияния бета-блокаторов на показатели заболеваемости и смертности у пациентов с систолической СН они являются препаратами выбора для достижения контроля ЧСС при отсутствии противопоказаний. Дигоксин может быть эффективным добавлением к бета-блокаторам. Недигидропиридиновые блокаторы кальциевых каналов, такой как дилтиазем, следует применять с осторожностью у лиц со сниженной ФВ вследствие их отрицательного инотропного эффекта. У пациентов с СН и сохраненной ФВ для достижения контроля ЧСС могут быть эффективны антагонисты кальция, но их эффект может быть усилен в комбинации с дигоксином. У тех пациентов, у которых выбрана стратегия контроля частоты сокращений, абляция АВ-узла и установление устройства ресинхронизирующей сердечной терапии могут использоваться, если нельзя достичь контроля частоты вследствие либо неэффективности, либо непереносимости лекарственного препарата.
7.10. Семейная (наследственная) МА: рекомендации
Класс IIb
1. Пациенты с МА и наличием МА у нескольких поколений в семье могут быть направлены в специализированный центр для генетического консультирования и обследования (уровень доказательности: С).
7.11. Постоперационное хирургическое вмешательство на сердце и грудной клетке: рекомендации
Класс I
1. Пациентам, у которых развилась МА после хирургического вмешательства на сердце, рекомендуется лечение бета-блокаторами при отсутствии противопоказаний (уровень доказательности: A).
2. Недигидропиридиновый блокатор кальциевых каналов рекомендуется, если лечение бета-блокатором неэффективно для достижения контроля ЧСС у пациентов с постоперационной МА (уровень доказательности: B).
Класс IIa
1. Введение амиодарона в предоперационном периоде снижает инцидентность МА у пациентов, подлежащих хирургическому вмешательству на сердце, и целесообразно в качество профилактического лечения для пациентов с высоким риском развития послеоперационной МА (уровень доказательности: A).
2. Целесообразно восстанавливать синусовый ритм с помощью фармакологического лечения ибутилидом или кардиоверсии прямым током у пациентов, у которых развилась послеоперационная МА, а также у неоперабельных пациентов (уровень доказательности: B).
3. Целесообразно вводить антиаритмические препараты в качестве попытки поддержать синусовый ритм у пациентов с рекуррентной или рефрактерной постоперационной МА, как и у других пациентов, у которых развилась МА (уровень доказательности: B).
4. Целесообразно вводить антитромботические препараты пациентам, у которых развилась постоперационная МА, а также неоперабельным пациентам (уровень доказательности: B).
5. Целесообразно лечить хорошо переносимую, вновь возникшую постоперационную МА согласно стратегии контроля ЧСС и антикоагулянтной терапии с кардиоверсией, если МА не восстанавливается спонтанно до синусового ритма при последующем наблюдении (уровень доказательности: С).
Класс IIb
1. Профилактическое введение соталола может рассматриваться у пациентов с риском развития МА после хирургического вмешательства (уровень доказательности: B).
2. Введение колхицина может рассматриваться у пациентов после операции для уменьшения симптомов МА после хирургического вмешательства на сердце (уровень доказательности: B).
Перевод с англ. Романенко В.
Опубликовано онлайн 28 марта 2014 г.
в журнале Circulation