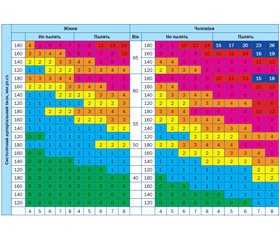
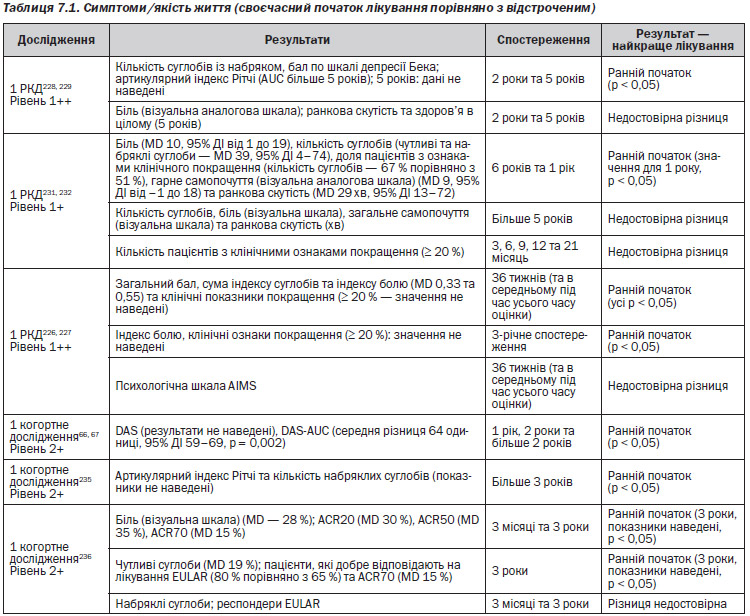
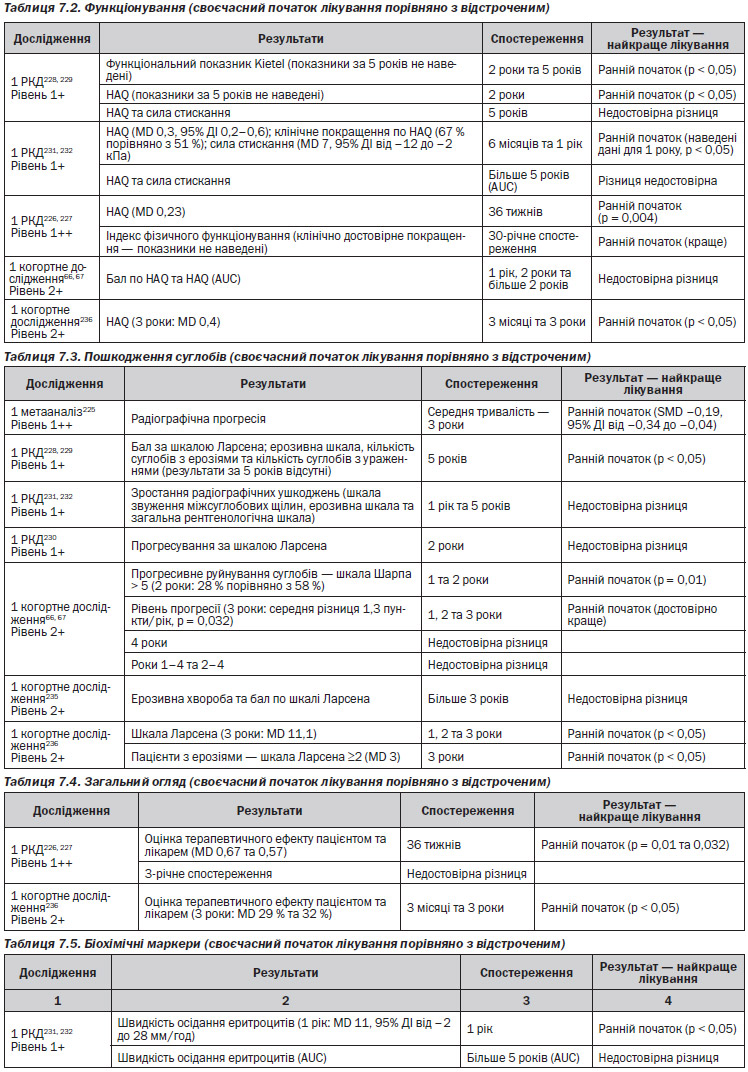
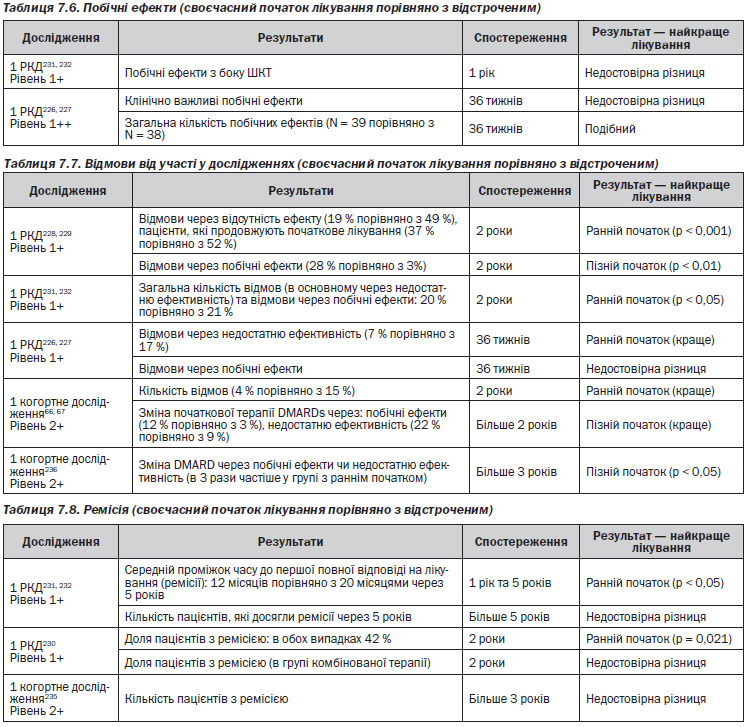
Газета «Новости медицины и фармации» Кардиология (516) 2014 (тематический номер)
Вернуться к номеру
Ревматоїдний артрит Адаптована клінічна настанова, заснована на доказах 2014 (скорочено)
Разделы: Официальная информация
Версия для печати
Статья опубликована на с. 53-117
Рекомендовано
Наказ Міністерства охорони здоров’я України
від 11.04.2014 року № 263
Закінчення. Початок у номері 512
7. Фармакологічний контроль
7.1. Антиревматичні препарати, що модифікують перебіг захворювання (DMARDs)
7.1.А Загальна інформація про антиревматичні препарати, що модифікують перебіг захворювання
7.1.1. Клінічні дані (DMARDs)
Протягом останніх десятиріч показаннями для прийому DMARDs були відповідність пацієнтів критеріям AРА для РА2, а також радіологічні ерозії. Сьогодні вважаться, що критерії AРА не дозволяють виявити ранню стадію РА (див. розділ 4), крім того, персистуючий синовіт потребує відповідної терапії модифікуючими препаратами незалежно від розподілу вражених суглобів та результатів дослідження. Відповідно, для будь-якого персистуючого ідіопатичного синовіту рекомендується ранній прийом DMARDs. Це рішення не завжди є однозначним через діагностичні та прогностичні труднощі, а також токсичність даних препаратів. Існують також практичні труднощі, пов’язані з затримкою між першим проявом симптомів та зверненням до сімейного лікаря або поліклінічного закладу, час такої затримки у Великобританії складає в середньому 9 місяців. Незалежно від цих діагностичних, прогностичних та практичних ускладнень, в літературі, присвяченій РА, з’явилась концепція «терапевтичного вікна», яке означає: чим раніше починається введення DMARDs, тим кращими є довготривалі наслідки. Чи існують факти, які підтверджують цю концепцію?
Прийнявши рішення про початок прийому DMARDs, ревматолог повинен далі вирішити питання про тип препарату, а також обрати між монотерапією чи комбінацією різних DMARDs. Забезпечені відповідною інформацією, хворі на РА можуть обирати той чи інший препарат залежно від режиму чи частоти прийому, способу життя, можливих побічних ефектів та інших факторів (супутні захворювання, вагітність). Приймаючи ці рішення, клініцист керується власним досвідом, базуючись на інтерпретації існуючих даних та особистого досвіду щодо ефективності та токсичності різних схем прийому препаратів. У деяких випадках рішення визначається профілем токсичності DMARDs та супутніми захворюваннями у пацієнта. Була опублікована велика кількість досліджень монотерапій та комбінованих терапій. Накопичених даних має бути достатньо для визначення більш ефективних лікувальних терапій, які краще переносяться, при виборі схеми лікування пацієнтів з ранньої стадією РА. Для визначення пріоритетності стратегій лікування необхідні дані аналізу витрати-ефективність. Послідовне використання адалімумабу, етанерцепту та інфліксимабу при лікуванні РА не було включене до даного керівництва, оскільки ці препарати оцінюються NICE (Національний Інститут здоров’я та клінічного удосконалення) (дата публікації наразі вирішується). З подробицями можна ознайомитися на сайті NICE, www.nice.org.uk.
7.1.2. Клінічні методи
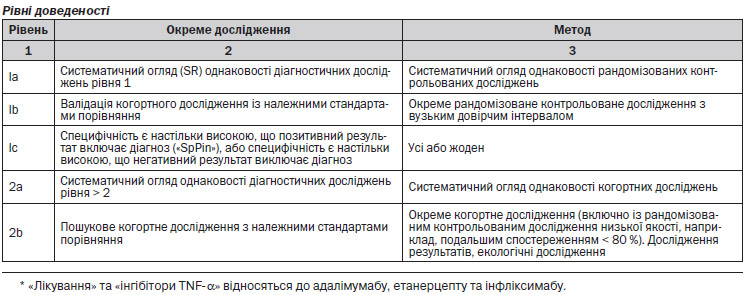
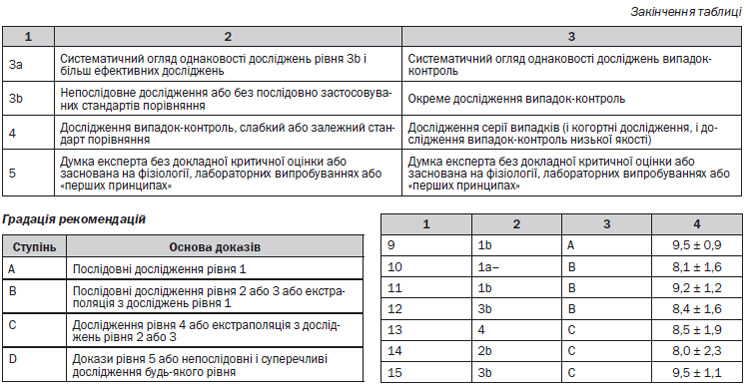
Нами були вивчені роботи, в яких досліджували ефективність та безпечність раннього прийому DMARDs щодо симптомів, ушкодження суглобів, функціонування та якості життя пацієнтів з ранньою стадією РА. Через велику кількість досліджень обиралися лише дослідження рівня 1 та 2 (метааналізи, РКД, когортні та дослідження серії випадків), в яких приймали участь пацієнти з Великобританії.
Було знайдено 10 досліджень, які відповідали критеріям включення. Серед них 1 метааналіз225, 6 РКД226–234 та 3 когортні дослідження66, 67, 235, 236. Три з РКД (1 РКД228, 229, 1 РКД226, 227, 1 РКД231, 232) та одне когортне дослідження66, 67 були опубліковані у вигляді 2 окремих робіт, в яких наводилися різні результати чи використовувалися різні періоди спостереження, тому ці дослідження враховувалися як одне, однак посилання відбувається на обидві частини досліджень. Два з РКД233, 234 були виключені через методичні обмеження (1 РКД не було сліпим, та в ньому не проводився ІТТ аналіз, в іншому був високий рівень відмов від участі, 79 %). В РКД, що залишилися, були наступні методологічні обмеження: ті, що отримали ступінь 1+, чи були подвійними сліпими, але ІТТ аналіз не був проведений (1 РКД), чи не були сліпими, але в їх межах був проведений ІТТ аналіз (2 РКД). Дослідження, які мають ступінь 1++, були подвійними сліпими, та в них був проведений ІТТ аналіз.
Системні огляди/метааналізи
В системному огляді/метааналізі225 був проведений аналіз 12 досліджень (6 періодів спостереження в ме–жах РКД та 6 когортних досліджень), в яких проводилося порівняння DMARDs у пацієнтів з ранньою стадією РА (< 2 років). Метааналіз був виконаний на належному рівні, однак РКД, які він включав, були різної якості. Дослідження, включені до аналізу, відрізнялися у наступному:
— розмір (від N = 23 до N = 189);
— якість дослідження (максимальна оцінка 6) (6 досліджень низької чи помірної якості — оцінка 2 чи 3 (1– чи 1+); 6 досліджень якісні з оцінкою 4 чи 5 (1++));
— затримка у початку прийому DMARDs (різниця в місяцях середньої тривалості хвороби на початок прийому DMARDs між двома групами) — від 6 до 14 місяців;
— тривалість дослідження — тривалість спостереження (від 1 до 5,6 років).
РКД
Усі 4 включені РКД [1 РКД231, 232; 1 РКД228, 229; 1 РКД226, 227, 1РКД230] мали різні критерії включення та відрізнялися за наступним:
— розмір вибірки (від N = 120 до N = 238);
— засліплення (2 РКД були подвійними сліпими, 2 РКД одинарними сліпими/не були сліпими);
— тривалість дослідження та спостереження (від 36 тижнів до 5 років);
— лікування — тип використаних DMARDs (в 1 РКД HCQ, в 1 РКД ауранофін, в 1 РКД SAARD, в 1 РКД 3 DMARDs — сульфасалазин + метотрексат + гідроксіхлорохін + глюкокортикоїди порівняно з 1 DMARD ССЗ ± ГК)*;
— схема лікування — один препарат чи комбінація;
— схема лікування — доза.
Когортні дослідження
В перше когортне дослідження66, 67 були включені N = 206 пацієнтів, які мали ранню стадію РА, які: а) вчасно отримали лікування DMARDs та НППЗ чи б) отримали таке лікування із затримкою. Середня затримка у лікуванні становила близько 4 місяців у пацієнтів відповідної групи, період спостереження становив 4 роки. В другому когортному дослідженні235 приймали учать 149 пацієнтів з ранньою стадією РА, які почали терапію DMARDs, коли стадія РА: а) була дуже ранньою (в середньому 3,1 місяця) чи б) ранньою (середня тривалість 9,2 місяця). Період спостереження становив 3 роки. В третьому когортному дослідженні236 приймали участь 40 пацієнтів з ранньою стадією РА, які: а) вчасно почали терапію DMARDs; б) мали затримку в початку лікування DMARDs. Середня затримка у початку лікування в цій групі становила приблизно 9 місяців, період спостереження становив 3 роки.
7.1.3. Вступ до методології медичної економіки (DMARDs)
Було знайдено 7 робіт і чотири були виключені через відсутність аналізу витрати-ефективність237–239 або в них приймали участь пацієнти не з ранньою стадією РА240. Останні три дослідження241–243 відповідали критеріям включення і були проаналізовані.
7.1.4. Результати клінічних досліджень (стосовно DMARDs)
Рання стадія РА
7.1.5. Визначення співвідношення витрати-ефективність (DMARDs)
Єдине дослідження, об’єктом якого були пацієнти з Великобританії, це робота Grigor et al.242; дослідження Verhoeven et al.241 та Korthals et al.243 були проведені у Нідерландах та Бельгії відповідно, тому їх значення для пацієнтів Великобританії є обмеженим. Grigor et al. мали високі критерії включення для ранньої стадії РА (< 5 років), хоча середня тривалість хвороби під час дослідження становила 19 місяців. Grigor et al. визначили, що інтенсивна стратегія поступового підвищення дози TICORA домінує над загальноприйнятою стратегією (монотерапія сульфасалазином та додавання DMARD у разі неефективності). Verhoeven et al. та Korthals et al. базувалися на дослідженні COBRA, вони з’ясували, що комбінована терапія преднізолону, метотрексату та сульфасалазину з поступовим зниженням дози домінує над монотерпією сульфасалазином.
7.1.6. Підсумки (DMARDs)
— З точки зору симптомів, ушкодження суглобів, функції та якості життя затримка в прийомі DMARD є гіршою за своєчасну терапію66, 67, 225–229, 231, 232, 235,236.
— Своєчасний прийом DMARD дозволяє отримати переваги у наступні 5 років після прийому порівняно з відстроченим228, 229.
— Ранній прийом препаратів також означає менше число побічних ефектів та відмов від прийому препаратів66, 67, 226–229, 231, 232, 236.
— Існують дані, відповідно до яких комбінована терапія може підвищити ефективність DMARD порівняно з монотерапією230.
— Найкраще починати терапію DMARD настільки рано, наскільки це можливо.
7.1.В Оптимальна послідовність призначення базисних препаратів (DMARDs)
7.1.7. Клінічні методи (оптимальна послідовність DMARD)
Нами було здійснено пошук досліджень, в яких вивчали ефективність та безпечність різних послідовностей DMARD за такими показниками, як симптоми, ушкодження суглобів, виконання функції, якість життя пацієнтів з ранньою стадією РА. Через велику кількість досліджень обиралися лише дослідження рівня 1 та 2 (метааналізи, РКД, когортні та дослідження серії випадків), в яких приймали участь пацієнти з Великобританії з розміром вибірки N ≥ 100.
Було знайдено 12 досліджень, які відповідали критеріям включення. Серед них 2 метааналізи244, 245, 9 РКД242, 246–262 та 1 когортне дослідження (проспективне)263. Два РКД (1 РКД — CIMESTRA246, 247; 1 РКД — COBRA253, 254) були опубліковані у вигляді 2 окремих робіт. Результатии 2 РКД (1 РКД — the FINRACO study248–251; 1 РКД — the BeSt study256–259) були опубліковані в 4 окремих доповідях. В них наводилися різні результати чи використовувалися різні періоди спостереження, тому ці дослідження враховувалися як одне, однак посилання відбувається на обидві частини досліджень. 1 метааналіз245 та 1 РКД252 були виключені через методичні обмеження (метааналіз мав недоліки у методах пошуку, автори не провели оцінку якості чи тести на гетерогенність. РКД було відкритим та в ньому не проводився ІТТ аналіз). В РКД, що залишилися, були наступні методологічні обмеження: ті, що отримали ступінь 1+, чи були подвійними сліпими, але ІТТ аналіз не був проведений (1 РКД), чи не були сліпими, але в їх межах був проведений ІТТ аналіз (2 РКД). РКД, які мають ступінь 1++, були подвійними сліпими та в них був проведений ІТТ аналіз (5 РКД), в метааналізі, який має ступінь 1++, було перевірена гетерогенність та оцінена якість включених досліджень.
Щоб полегшити аналіз та порівняння, включені дослідження були розділені на дві окремі групи: 1) агресивна послідовність DMARD порівняно з неагресивною, 2) звичайна послідовність DMARD.
Зауваження. В багатьох дослідженнях послідовність DMARD могла відрізнятися у різних пацієнтів навіть в межах однієї групи. Це пояснювалося необхідністю індивідуальних змін дозування та типу препаратів в залежності від розвитку побічних ефектів чи клінічної ефективності. Це було зроблено, щоб відобразити клінічну практику.
Агресивна послідовність DMARD порівняно з неагресивною.
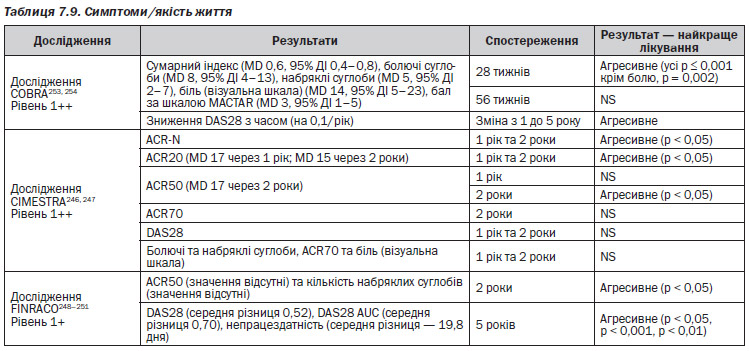
Агресивна та неагресивна терапії DMARD порівнювалися у трьох РКД (1 РКД — COBRA253, 254; 1 РКД — CIMESTRA246, 247; 1 РКД — FINRACO248–251).
В першому РКД — COBRA253, 254 — порівнювалися 2 різні групи лікування. Група 1 (агресивна): пацієнти отримували сульфасалазин, потім додавалися глюкокортикоїди та метотрексат. Ці препарати потім були відмінені. Група 2 (неагресивна): пацієнтам давали сульфасалазин і потім продовжували прийом цього препарату. В другому РКД — CIMESTRA246, 247 — приймали участь 163 пацієнти с ранньою стадією РА. Вони були розділені на 2 групи, які отримували 1) агресивне лікування (сульфасалазин, потім метотрексат + преднізолон) чи 2) неагресивне лікування DMARD (сульфасалазин спочатку та потім) протягом 2 років. В третьому РКД — FINRACO248–251 приймали участь 199 пацієнтів з ранньою стадією РА. Пацієнти були розділені на 2 групи, які отримували 1) агресивне лікування DMARD (3 DMARD + преднізолон) чи 2) неагресивне лікування (1 DMARD ± преднізолон) протягом 5 років.
Загальні послідовності DMARD
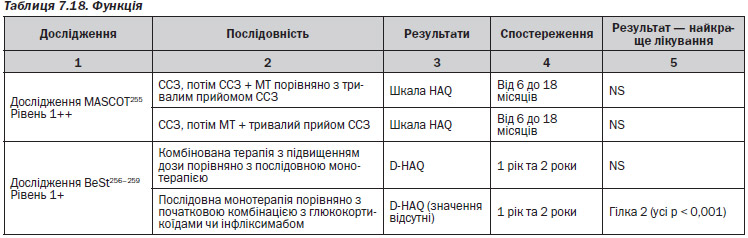
В одному метааналізі244, 6 РКД (1 РКД — BeSt256–259; 1 РКД — MASCOT255; 1 РКД — Feraccioli et al.260; 1 РКД — TICORA242; 2 інші РКД — Choy et al. та Braun et al.261, 262) та одному проспективному когортному дослідженні (Hider et al.)263 досліджувалися послідовності DMARD.
В метааналізі244 розглядалися РКД та квазірандомізовані РКД, в яких порівнювалися монотерапія DMARD та комбінована терапія DMARD у пацієнтів як з ранньою стадією РА (< 3 років), так і з розгорнутою стадією РА (> 3 років). Метааналіз був виконаний на належному рівні та був ретельно методологічно якісним. Однак 36 РКД, які в ньому аналізувалися, були різної якості. Дослідження, включені до аналізу, були подібними у наступному:
— дизайн дослідження (усі рандомізовані або хибно-рандомізовані контрольовані дослідження);
— втручання (DMARD);
— група порівняння (комбінована терапія з 2 або більше DMARD чи 1 DMARD + 1 біологічний агент);
— засліплення (переважно подвійні сліпі дослідження);
— прихований розподіл;
— був проведений ІТТ аналіз;
— розмір дослідження (усі відносно невеликі, N < 100).
Дослідження відрізнялися за наступними параметрами:
— розмір дослідження (від N = 11 до N = 89);
— якість дослідження — максимальний бал по шкалі Jadad — 5 (30 досліджень доброї якості, 6 — неякісні);
— тривалість дослідження — відрізнялася (точна тривалість не вказувалася).
Зауваження. Оскільки в метааналіз були включені дослідження, в яких приймали участь одночасно пацієнти і з ранньою, і з розгорнутою стадіями РА, було прийнято рішення, що дублюючі роботи (знайдені під час пошуку, які входили до метааналізу) також будуть включатися в розділ, який стосується ранньої стадії РА, з метою вивчення будь-яких ефектів в межах цих субпопуляцій.
В 6 включених РКД242, 255–262 була проведена оцінка послідовностей DMARD, але використовувалися різні критерії включення. Дослідження відрізнялися за наступними параметрами:
— розмір вибірки (від N = 111 до N = 508);
— засліплення (1 РКД — потрійне сліпе, 2 РКД подвійні сліпі, 2 РКД однобічно засліплені, 1 РКД не сліпе);
— тривалість дослідження (1 РКД — 6 місяців, 3 РКД — 18 місяців, 2 РКД — 2 роки);
— лікування — тип і послідовність DMARD, які використовувалися та порівнювалися;
— схема лікування — дози DMARD.
Типи лікування
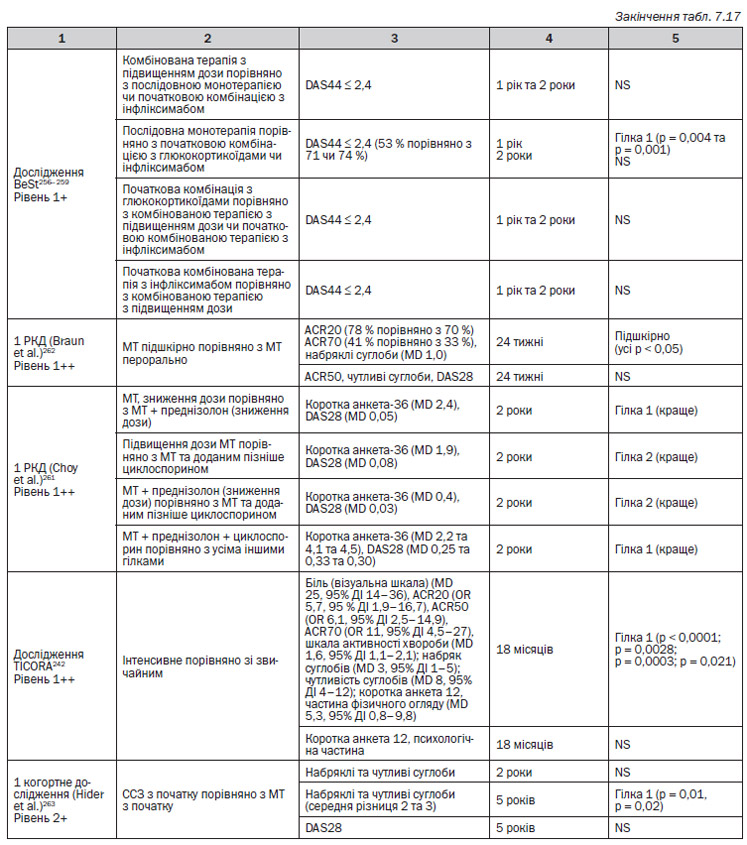
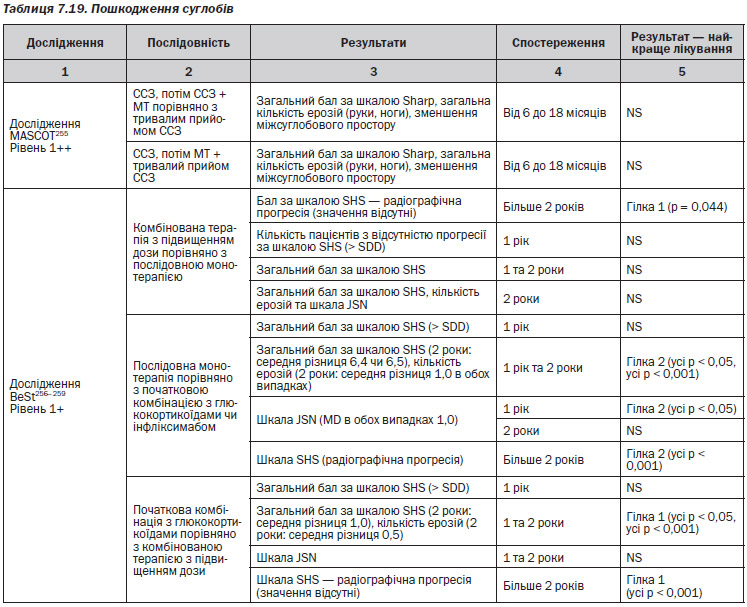
1. В першому РКД — BeSt256–259 — порівнювали 4 різні гілки лікування. Група 1: послідовна моноторапія; група 2: комбінована терапія step-up; група 3: початкова комбінована терапія + глюкокортикоїди; група 4: початкова комбінована терапія та інфліксимаб. Терапію змінювали залежно від балу DAS.
2. У другому РКД — MASCOT255 — порівнювали 3 різні групи лікування. Група 1: пацієнти приймали сульфасалазин, а потім сульфасалазин та метотрексат; група 2: приймали сульфасалазин на початку та продовжували його приймати; група 3: спочатку сульфасалазин, потім метотрексат.
3. В третьому РКД (Feraccioli et al.)260 порівнювали 3 гілки лікування. Група 1: пацієнти приймали DMARD, потім метотрексат; група 2: пацієнти приймали DMARD, потім циклоспорин А; група 3: пацієнти приймали DMARD, потім сульфасалазин.
4. В четвертому РКД — TICORA242 порівнювали 2 гілки дослідження. Група 1 (інтенсивна): спочатку монотерапія сульфасалазином (доза підвищується), потім потрійна терапія; група 2 (звичайна): початкова монотерапія сульфасалазином, а потім монотерапія або комбінована терапія. Терапію змінювали залежно від балу DAS.
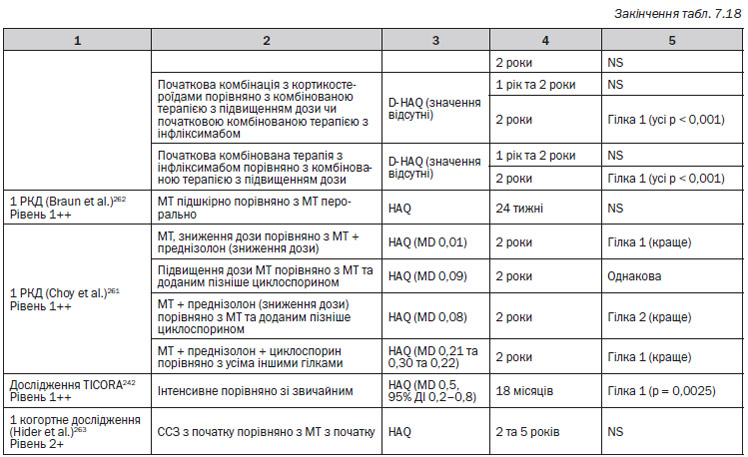
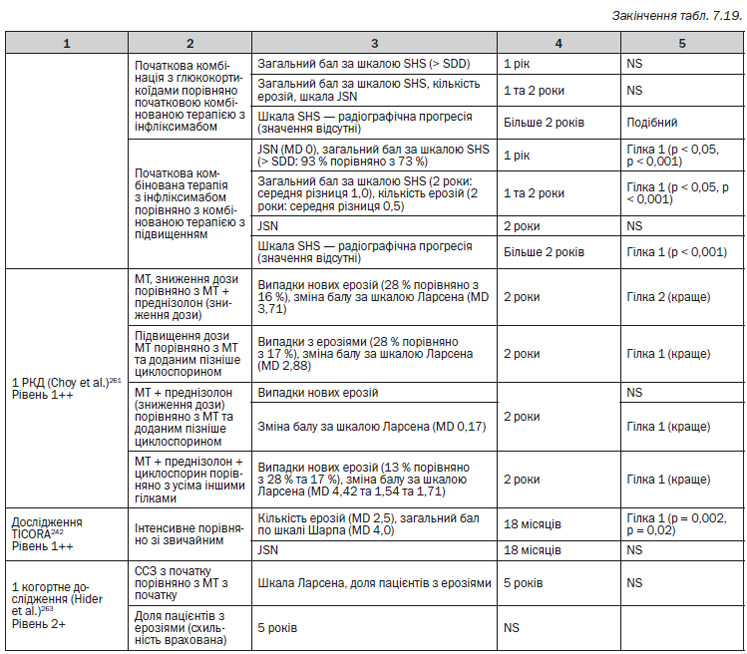
5. В п’ятому РКД (Braun et al.)262 порівнювали 2 різні гілки у пацієнтів, які раніше не отримували DMARD. Група 1: метотрексат підшкірно; група 2: метотрексат перорально.
6. В шостому РКД (Choy et al.)261 порівнювали 4 гілки лікування. Група 1: метотрексат (починаючи від 7,5 мг/тиждень і підвищуючи до 15 мг/тиждень); група 2: терапія преднізолоном зі зниженням дози після метотрексату (60 мг/день на початку, потім знижений до 7,5 мг на 6 тижні, 7,5 мг/день з 6 до 8 тижня і припинення прийому через 34 тижні); група 3: циклоспорин після 3 місяців прийому метотрексату (початкова доза 100 мг/день, яка поступово підвищується до 3 мг/кг щоденно); група 4: усі типи лікування.
В проспективному когортному дослідженні (Hider et al.)263 приймали участь N = 439 пацієнтів, які були обрані з NOAR (Реєстру пацієнтів з Норфолку, хворих на артрит), яким давали метотрексат або сульфасалазин як першочергову терапію та за якими велося спостереження протягом 2 років.
7.1.8. Визначення співвідношення витрати–ефективність (оптимальна послідовність DMARD та біопрепаратів)
Був здійснений пошук одночасно на DMARD та біопрепарати, щоб оцінити співвідношення витрати–ефективність оптимальної послідовності біопрепаратів та традиційних DMARD при лікуванні ранньої стадії РА. Дані щодо біопрепаратів були отримані з огляду Chen et al.237. Жодне з досліджень не стосувалося ранньої стадії РА, крім моделі BРАM, яка була частиною самого звіту НТА. Було також знайдене ще одне дослідження239.
7.1.9. Клінічні дані (оптимальна послідовність DMARD)
Рання стадія РА
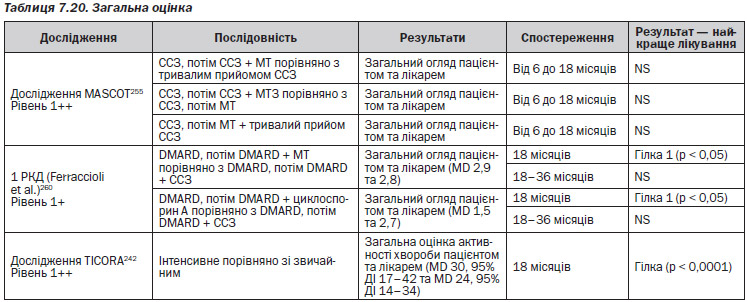
Агресивне лікування порівняно з неагресивною терапією (табл. 7.9–7–16)
В одному РКД, FINRACO248–251, було продемонстровано, що стійка ремісія протягом 2 років захищає від радіографічного ушкодження суглобів порівняно з пацієнтами, у яких ремісія тривала 6 місяців та закінчилася пізніше (MD 3 пункти, р < 0,001). Рівень 1+
Загальні послідовності (табл. 7.17–7.19)
В одному РКД — BeSt256–259 — було з’ясовано, що у пацієнтів, у яких не досягається та не підтримується DAS ≤ 2,4 на метотрексаті, незалежно від успішності наступного лікування розвиваються достовірно більше ушкоджень суглобів порівняно з пацієнтами, які мають DAS ≤ 2,4 на метотрексаті (MD 6 балів загальної шкали Шарпа, р = 0,007). Після неуспішного лікування метотрексатом прийом наступного DMARD не дозволяє досягти DAS ≤ 2,4, і ушкодження суглобів прогресує. Рівень 1+
7.1.10. Визначення співвідношення витрати–ефективність: документальні докази (оптимальна послідовність DMARD та біопрепаратів)
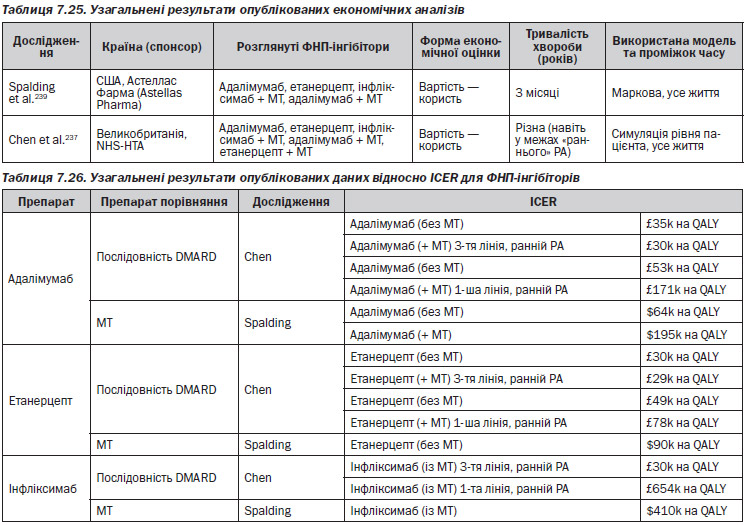
Було виявлено лише два дослідження, з яких тільки одне мало відношення до Великобританії (Chen et al.).237 Інше виконувалося на базі Сполучених Штатів (Spalding et al.)239 і, внаслідок цього, має сумнівну значимість, представляючи інші ціни на лікарські препарати та системи охорони здоров’я.
Було змодельовано та проаналізовано модель лікування адалімумаб, етанерцепт, інфліксимаб + МТ, адалімумаб + МТ, етанерцепт + МТ порівняно з послідовністю DMARD. Spalding із співавторами розроблено модель Маркова при розгляді адалімумаб, етанерцепт, інфліксимаб + МТ, адалімумаб + МТ порівняно з МТ.
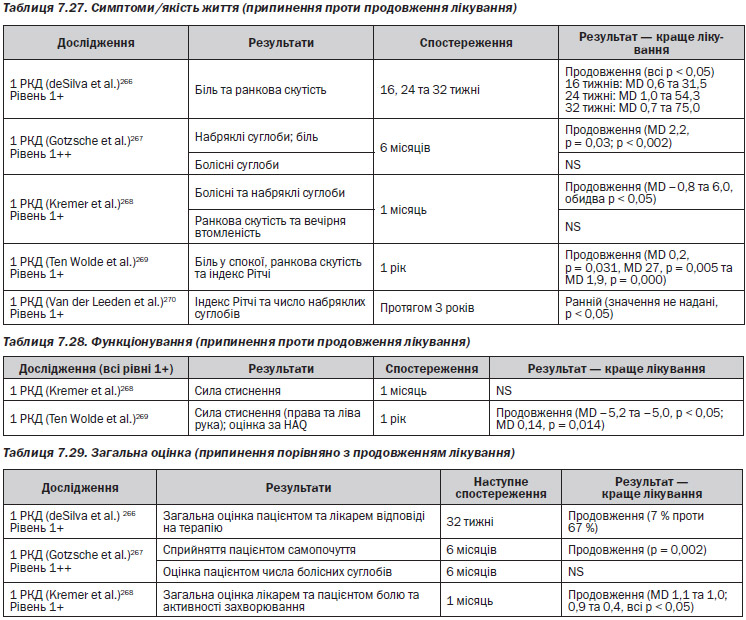
Для біопрепаратів першої лінії, з МТ або без нього, Chen із співавторами237 оцінюють ICER значно вище звичайного порогу NICE. В обох дослідженнях використання інфліксимабу як препарату першої лінії пов’язане із надзвичайно високими ICER. Адалімумаб та етанерцепт без МТ в обох дослідженнях давали нижчі ICER, але це так само малоймовірно може бути визнане рентабельним. Як відображено у сучасній настанові NICE,130 визнається рентабельним використання кожного із трьох ФНП–інгібіторів як препарату третьої лінії (табл. 7.25—7.26).
В Англії та Уельсі звичайний покроковий поріг рентабельності вважається у межах від £20 000 до £30 000 на отриманий QALY для NICE. Припустимий рівень ICER, який зазвичай наводиться у Сполучених Штатах, складає $50 000 на отриманий QALY, хоча переводити це чи значення у доларах слід з обережністю.
7.1.11. Узагальнені результати відносно документальних доказів (оптимальна послідовність DMARD)
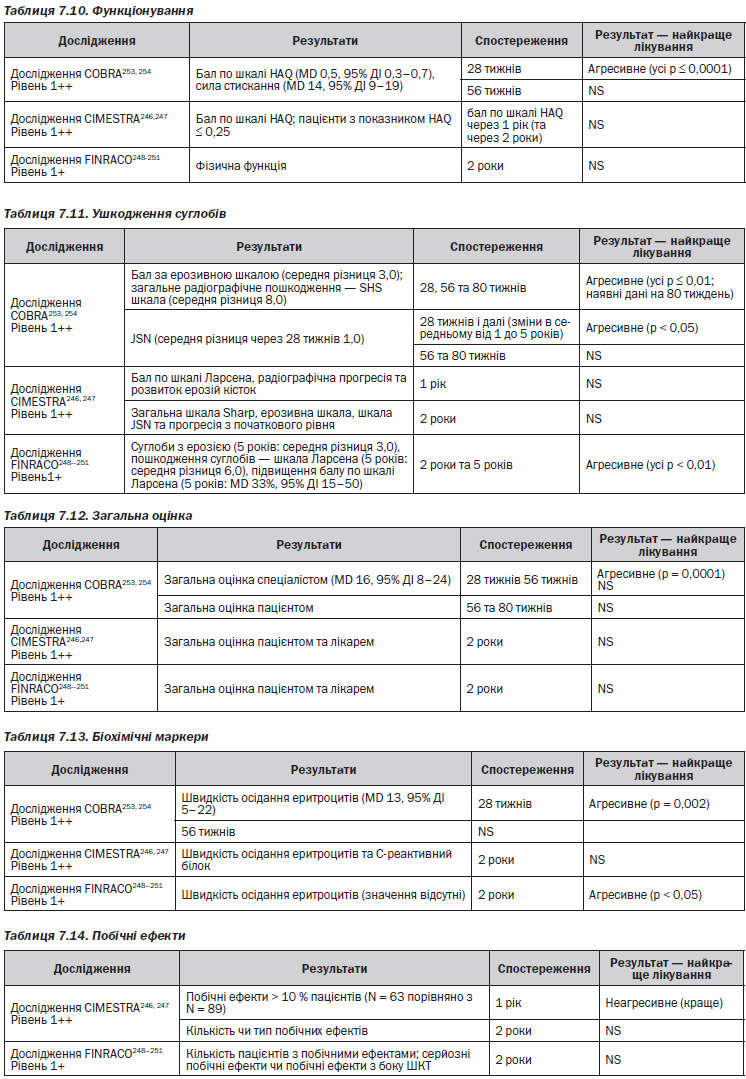
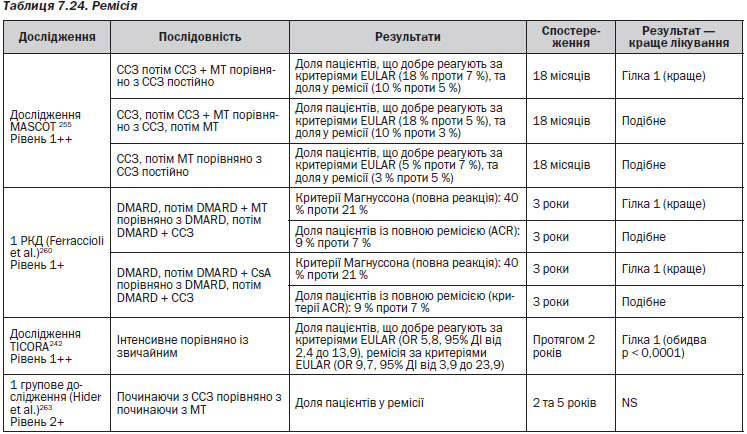
Для більшості пацієнтів монотерапія, наприклад, метотрексатом працює добре256–259. Послідовні монотерапії порівнюють метотрексат та сульфазалазин, не показують аніяких явних відмінностей між препаратами255, 263, хоча інші дослідження, що порівнюють сульфазалазин із метотрексатом та циклоспорином у комбінованій терапії, наводять на думку, що останні два є кращими за окремими результатами порівняно з першим260. Якщо у пацієнта монотерапія із використанням метотрексату була невдалою, шанси, що він матиме гарну відповідь на інший загальноприйнятий DMARD, є малими259. Відносно симптомів, якості життя, можливості досягти ремісії та сповільнити пошкодження суглобів різні комбіновані терапії здаються кращими, ніж монотерапія244 ,246–251, 253–259, 264.
Відносно інших результатів, таких як функціонування, ознак відмінності є мало246–251, 253–258,259.
За переносимістю між монотерапією та комбінованою терапією відмінностей немає244, 246–251, 253, 254, 256–259, 264.
Одне дослідження порівнювало пероральне та підшкірне застосування метотрексату, однак не виявило аніякої значної різниці між ними і не було включене до аналізу економіки охорони здоров’я308.
Окремі дослідження показують конвергенцію результатів із часом між групами дослідження246, 247, 253, 254.
Більшість досліджень показала подібне покращення при застосуванні різних видів монотерапії та комбінованої терапії, і наводило на думку, що тип і комбінація використаних препаратів були менш важливими, ніж швидкість та інтенсивність введення DMARD244, 246–251, 253–259, 264. Під інтенсивністю мається на увазі швидке збільшення терапевтичних доз DMARD.
7.1.12. Від доказів до рекомендацій (раннє застосування та оптимальна послідовність DMARD)
ГРН відмітила, що існує вирішальний доказ на підтримку стратегії раннього застосування DMARD. Однак ГРН враховувала, що всі випробування проводилися на пацієнтах із активним запальним ураженням суглобів, і на даний час немає доказу на підтримку підходу, який має бути застосований при легкому синовіті чи паліндромному артриті, при яких активність хвороби наростає та спадає в періоди наявності чи відсутності активності. Тому вирішили, що раннє застосування DMARD при РА потребує встановлення відношення зокрема до активного РА, а при лікуванні легкої хвороби його слід розглядати як експериментальну рекомендацію.
Ключовою сферою, яка повинна була бути узгодженою для моделювання економіки охорони здоров’я (див. розділ 2.8), була оцінка рентабельності різних стратегій із застосуванням DMARD у пацієнтів із раннім РА, у тому числі початкової терапії із застосуванням комбінацій засобів, що модифікують перебіг захворювання. Результати цього аналізу (див. Додаток C) продемонстрували явні переваги комбінованої стратегії порівняно з монотерапією та показали, що комбінації DMARD із поступовим зменшенням дози ймовірно є дуже рентабельними чи навіть економними, і інші комбінації DMARD є імовірно вельми рентабельними. ГРН вирішила, що, за винятком особливих протипоказань, такий підхід повинен бути використаний в якості терапії першої лінії.
Існує доказ, що метотрексат є принаймні таким саме ефективним, як інші варіанти монотерапії із використанням DMARD, а в окремих дослідженнях і більше. За допомогою швидкого збільшення дози препарату можна досягти відмінної відповіді у більшості пацієнтів. NICE відносно ФНП-інгібіторів рекомендує, аби перед терапією інгібіторами ФНП-а був випробуваний метотрексат130. ГРН також пам’ятала про появу доказу на підтримку того, що, якщо у пацієнта терапія метотрексатом була невдалою, малоймовірно, що він відповість на інші загальновживані DMARD, і слід розглянути призначення терапії інгібіторами ФНП-а, якщо використання принаймні двох загальновживаних DMARD (включно із метотрексатом) було невдалим. ГРН також усвідомлювала збільшення доказів того, що метотрексат, який вводиться підшкірно, може мати більшу біодоступність, ніж при введенні пероральним шляхом, однак не бачила достатнього доказу, аби зробити рекомендацію на даному етапі, особливо з огляду на те, що аналіз екоміки охорони здоров’я був недоступний.
Беручи до уваги всі ці міркування, ГРН вирішила, що метотрексат повинен бути включений в якості терапії DMARD першої лінії, або як монотерапія, або як частина комбінованої терапії. Крім того, найбільш успішні та економічно вигідні режими із покроковим зниженням дози та комбінованої терапії всі у тій чи іншій формі (або перорально із поступовим зниженням дози, інтраартикулярно, внутрішньом’язово або шляхом комбінації цих варіантів) використовували глюкокортикоїди, і тому здається, що глюкокортикоїди повинні бути особливо відмічені при комбінованих режимах. Хоча базовий аналіз визначив, що стратегія монотерапії плюс глюкокортикоїди є більш дорогою та менш ефективною, ніж монотерапія із використанням DMARD (по причині того, що різниця у витратах не покривалася значним збільшенням частоти відповіді за критеріями ACR; будь ласка, для отримання більшої інформації див. Додаток C), ГРН вирішила важливим відмітити, що терапія як із покроковим збільшенням дози, так і з покроковим зменшенням — всі включають до режиму глюкокортикоїди, отже, немає комбінованого режиму, який був би ефективний без глюкокортикоїдів у якій-небудь формі (пероральній, внутрішньом’язовій або інтраартикулярній). До того як дослідження продемонстрували, що комбіновані режими можуть бути ефективно використані за відсутності стероїдів, ГРН вирішила, що вони повинні бути включені до рекомендації.
Було вирішено, що не слід встановлювати нижню межу часу, який повинен пройти до початку застосування DMARD при ранньому РА; фактично така терапія повинна бути розпочата якомога швидше. Хоча немає достатнього доказу на підтримку концепції верхньої межі часу, протягом якого повинна бути розпочата терапія із використанням DMARD, аби досягти довготривалого впливу на наслідки захворювання («терапевтичне вікно», згадане у клінічному впровадженні), ГРН вирішила, що початок терапії із використанням DMARD у межах 3 місяців з моменту появи стійких симптомів спирається на докази і тому повинен бути рекомендований в якості ідеального завдання.
У відповідності до цього початкового агресивного лікування хвороби було відмічено, що є необхідність намагатися знижувати дози препаратів, тільки-но буде досягнутий задовільний контроль захворювання та що це, у свою чергу, може потребувати належного моніторингу (див. рекомендації в розділі 8.1). ГРН вирішила, що ідеальний рівень контролю хвороби прямує до ремісії, але це не завжди є досяжним у клінічній практиці. Тому пацієнтом та спеціалістом шляхом обговорення повинна бути визначена позиція стосовно того, що вважати задовільною відповіддю.
Необхідність у ранньому початку терапії можуть також підтримати рекомендації відносно необхідності термінового звернення по допомогу до спеціаліста хворих із персистуючим ідіопатичним синовітом, навіть за відсутності результатів тестів, що відхиляються від норми, та особливо якщо симптоми вже присутні більше 3 місяців (див. рекомендації у розділі 8.2).
Хоча метотрексат здається препаратом вибору для використання у комбінованій терапії у пацієнтів із симптомами раннього ревматоїдного артриту, було визнано, що можливі обставини (такі як супутні захворювання та протипоказання до метотрексату), за яких слід обрати інші препарати та, можливо, використати їх в якості монотерапії. Монотерапія із використанням інших DMARD та комбінована терапія, яка виключає метотрексат, можуть працювати дуже успішно. Тому було вирішено, що у тих випадках, коли комбінована терапія не показана, тип обраного препарату є менш важливим, ніж своєчасність початку DMARD терапії, швидке збільшення дози та її підтримання на рівні терапевтичної дози. ГРН вирішила, що слід дати рекомендацію, яка включає ці концепції.
Рекомендації
R16 У хворих із вперше діагностованим активним РА в якості терапії першої лінії якомога швидше, ідеально — в межах 3 місяців з моменту появи стійких симптомів запропонуйте комбінацію DMARD (у тому числі метотрексату та принаймні ще одного іншого DMARD, плюс на короткий час глюкокортикоїди).
R17 У хворих із раннім РА, які отримують комбіновану терапію із використанням DMARD та у яких був досягнутий стійкий та задовільний рівень контролю захворювання, обережно спробуйте знизити дози препаратів до рівнів, які продовжують підтримувати конт–роль захворювання.
R18 У хворих із вперше діагностованим РА, для яких комбінована терапія із використанням DMARD не підходить (наприклад, при супутній патології чи під час вагітності, коли певні препарати протипоказані), розпочніть монотерапію із використанням DMARD, віддаючи перевагу швидкому збільшенню до клінічно ефективної дози, ніж вибору DMARD.
Будь ласка, див. розділ 10 для отримання відповідних пов’язаних рекомендацій.
7.1.С. Базисні та біологічні препарати: коли їх відміняти
7.1.14. Клінічне впровадження (припинення приймання DMARD)
Існують різні причини для відміни або зменшення дози засобів, що модифікують перебіг захворювання. Приймання окремих препаратів може потребувати припинення перед тим, як пацієнт або його партнер завагітніє (наприклад, метотрексат та лефлуномід), та під час вагітності та годування груддю. Приймання препарату може бути припинене чи знижена його доза внаслідок побічних ефектів або під час інтеркурентного захворювання. Вони можуть бути відмінені внаслідок первинної чи вторинної втрати ефективності.
Наступні категорії пацієнтів ставлять запитання відносно найбільш підходящого підходу. Це пацієнти із РА з хронічним перебігом із мінімальною чи відсутньою активністю захворювання. Спостереження, що їхнє захворювання знаходиться під контролем, може бути результатом його природного перебігу або приймання засобів, що модифікують перебіг захворювання. Якщо підозрюється перше, належною клінічною практикою є спроба відмінити лікарський засіб. Якщо причиною є останнє — така спроба може призвести до підвищення активності захворювання. Крім того, є окремі дані, які наводять на думку, що навіть у пацієнтів у ремісії магнітно-резонансна томографія може продовжувати показувати активність хвороби та прогресування пошкодження, які можуть посилитися, якщо відмінити засіб, який модифікує перебіг захворювання. Однак значущість цього спостереження на даний час невідома.
Було доведено, що РА з хронічним перебігом ніколи повністю не виліковується. Якщо дані говорять про те, що для більшості пацієнтів повна відміна засобів, які модифікують перебіг захворювання, не є доцільною, чи є який-небудь доказ на підтримку звичайного клінічного підходу, що полягає у досягненні найменшої дози препаратів, які здатні утримувати хворобу під контролем?
7.1.15. Клінічне методологічне впровадження (припинення приймання DMARD)
Ми шукали дослідження, які вивчали вплив припинення приймання чи титрування дози DMARD або біопрепаратів з урахуванням симптомів, пошкодження суглоба, функціонування та якості життя у пацієнтів із встановленим РА. Через нечисельність досліджень у цій області всі типи досліджень були включені як докази.
Десять досліджень265–274 були визнані як такі, що задовольняють критеріям. Вони що містили 7 РКД265–270, 274 та 3 дослідження серії випадків.271–273 Одне РКД265, 274 було виключене у зв’язку із методологічними обмеженнями (не сліпе та не зроблений ІТТ-аналіз). Досліджень, які б оцінювали біопрепарати, знайдено не було.
РКД
6 включених РКД265, 265–270 оцінювали пацієнтів із РА, які раніше вже лікувалися за допомогою DMARD і були рандомізовані або продовжувати лікування, або відмінити його (давалося плацебо) чи приймати знижену дозу DMARD. Після цього за пацієнтами велося спостереження протягом певного відрізку часу, і потім були оцінені результати. РКД265 відрізнялися у відношенні наступного:
— об’єм вибірки (діапазон від N = 10 до N = 285);
— сліпий метод (5 подвійних сліпих РКД265 і 1 одинарне сліпе РКД265);
— тривалість випробування (діапазон від 6 місяців до 2 років);
— лікування (1 РКД265 лікування DMARD другої лінії проти плацебо, 1 РКД265 МТ, пеніциламін або препарати золота проти плацебо, 1 РКД265 МТ проти плацебо, 1 РКД265 золото внутрішньом’язово проти плацебо, 1 РКД265 азатіоприн проти плацебо, 1 РКД265 D-пеніциламін в одній тій самій дозі проти D-пеніциламіну у титрованій дозі);
— режим лікування — режим дозування та відміни/титрування.
Хоча РКД265 були фактично якісними методологічно, є сенс відмітити, що більшість їх були маленькими дослідженнями (об’єм вибірки < 40) та одинарними чи подвійними сліпими дослідженнями, і не здійснювався ІТТ-аналіз (5 РКД265). Одне випробування було класифіковане як 1++, оскільки було одночасно подвійним сліпим і мало ІТТ-аналіз. Різні режими дозування та титрування та різні популяції у дослідженнях могли також обмежувати пряме порівняння між дослідженнями.
Серії випадків
3 серії випадків271–273 оцінювали ефекти титрування дози у пацієнтів, які вже отримують DMARD або глюкокортикоїди. Перша серія випадків (Fleischmann et al.)273 оцінювала пацієнтів, які вже приймають МТ, лікували їх за допомогою інфліксимабу, якщо на 22-й тиждень спостерігалося клінічне покращення, доза МТ поступово зменшувалася та за пацієнтами здійснювався нагляд, і результати оцінювались через рік. Друга серія випадків (Tishler et al.)272 оцінювала пацієнтів, які вже приймають постійну дозу МТ, прийом МТ потім зменшувався з одного разу/тиждень до одного разу/два тижні. Потім за пацієнтами велося спостереження та через 1 рік оцінювалися результати. Третя серія випадків (Bacon et al.)271 оцінювала пацієнтів, які вже приймають глюкокортикоїди (преднізолон) у постійній дозі. Доза кортикостероїдів поступово зменшувалася, за пацієнтами велося спостереження, а через 1 рік оцінювалися результати.
7.1.16 Визначення співвідношення витрати-ефективність (припинення приймання DMARD)
З цього питання не було знайдено документів.
7.1.17. Клінічні документальні докази (припинення приймання DMARD)
РА з хронічним перебігом (табл. 7.27)
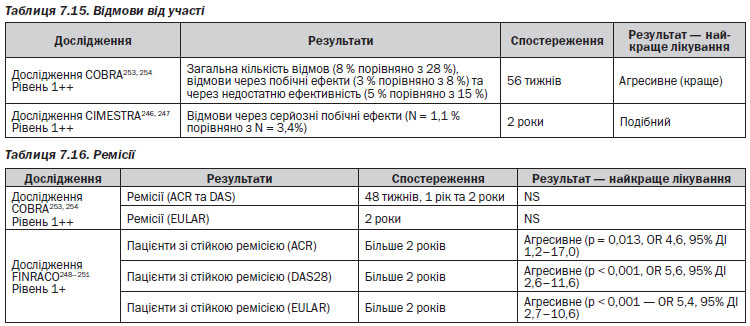
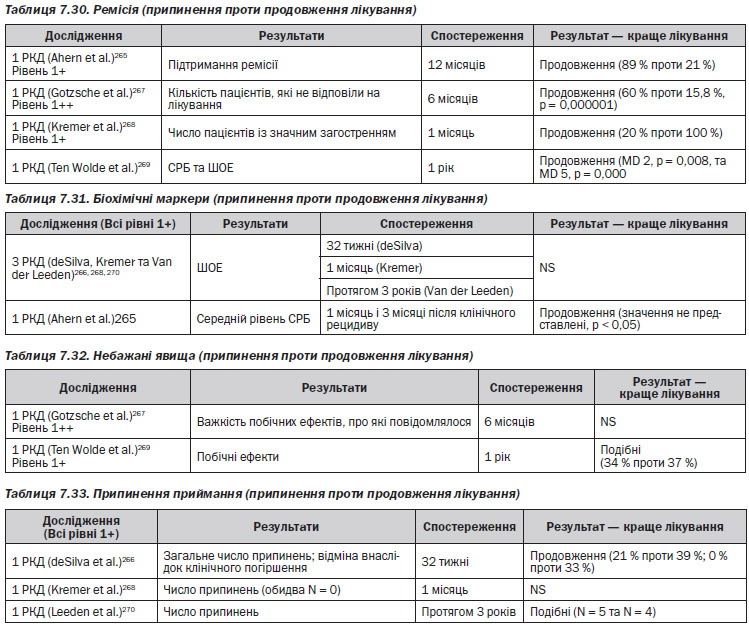
— 1 дослідження серії випадків272 виявило, що коли у пацієнтів із клінічною ремісією частота приймання МТ знижувалася, погіршення у ранковій скутості та суглобовому індексі Рітчі не було. Рівень 3
— 1 дослідження серії випадків273 виявило, що у пацієнтів, у яких інфліксимаб додавали до наявного лікування МТ і які показали ≥ 40% клінічне покращення артриту, а потім доза МТ поступово зменшувалася, спостерігалося значне покращення порівняно з вихідним рівнем за показниками болісних та набряклих суглобів (середнє покращення 73 %, p < 0,001). Рівень 3 (табл. 7.28)
— 1 серія випадків272 виявила, що коли у пацієнтів із клінічною ремісією частота приймання МТ була зменшена, у силі схоплювання погіршення не було. Рівень 3
— 1 серія випадків273 виявила, що у пацієнтів, яким до їхнього наявного лікування МТ додавали інфліксимаб і які одночасно мали ≥ 40% клінічне покращення артриту, коли дозу МТ поступово зменшували, спостерігалося значне покращення оцінки за HAQ порівняно з вихідним рівнем (середнє покращення 40 %, p < 0,001). Рівень 3
Пошкодження суглоба (припинення порівняно з продовженням лікування)
— 1 РКД270 виявило, що за рентгенологічною оцінкою між групою, яка припиняла лікування за допомогою золота, та групою, яка його продовжувала, відмінність була незначимою. Рівень 1+ (табл. 7.29)
— 1 серія випадків272 виявила, що коли у пацієнтів із клінічною ремісією частота приймання МТ була знижена, в загальній оцінці лікарем та пацієнтом болю та активності захворювання погіршення не було. Рівень 3 (табл. 7.30)
— 1 серія випадків271 виявила, що у 26 % пацієнтів, які довготривало приймали глюкокортикоїди і досягли ремісії артриту, припинення лікування кортикостероїдами було успішним (без повторної активації артриту), однак 61 % пацієнтів мали відновити лікування глюкокортикоїдами внаслідок повернення активного артриту. Рівень 3
— 1 серія випадків272 виявила, що у 87 % пацієнтів, які отримували лікування МТ і досягли ремісії артриту, зменшення частоти приймання було успішним (артрит не прогресував), однак 13 % мали загострення артриту. Рівень 3 (табл. 7.31)
— 1 серія випадків272 виявила, що коли у пацієнтів із клінічною ремісією частота приймання МТ була знижена, погіршення у рівнях ШОЕ чи СРБ не було. Рівень 3
— 1 серія випадків273 виявила, що у пацієнтів, яким до їхнього наявного лікування МТ додавали інфліксимаб і які показували ≥ 40% клінічне покращення артриту, при поступовому зменшенні дози МТ спостерігалося значне покращення за рівнями ШОЕ та СРБ (середнє покращення 23 та 50 %, обидва p ≤ 0,001). Рівень 3 (табл.7.32)
— 1 серія випадків273 виявила, що у пацієнтів, яким до лікування МТ додавали інфліксимаб і у яких було ≥ 40 % клінічного покращення артриту, при поступовому зниженні дози МТ частота виникнення НП склала 80 %. Специфічні НП не спостерігались, але включали інфекцію та реакції на інфузію. Рівень 3 (табл. 7.33)
Вплив повторного призначення відмінених DMARD
— 1 РКД265 виявило, що коли D-пеніциламін був повторно призначений у попередній дозі пацієнтам, які зазнали загострення після зменшення дози препарату, 87 % протягом 4 місяців знову досягли клінічної ремісії. Інші 13 % досягли ремісії після призначення більш високої дози. Рівень 1+
— 1 РКД268 виявило, що коли МТ знову призначався пацієнтам, які зазнали загострення після відміни препарату, всі пацієнти знову досягли покращення у показниках болю, ранкової скутості та оцінці пацієнтом загальної активності захворювання. Рівень 1+
— 1 серія випадків272 виявила, що коли МТ призначався повторно зі звичайною частотою пацієнтам, які зазнали загострення після зниження частоти прийому препарату, всі пацієнти досягали контролю активності захворювання. Рівень 3
7.1.18. Узагальнені результати відносно документальних доказів (припинення приймання DMARD)
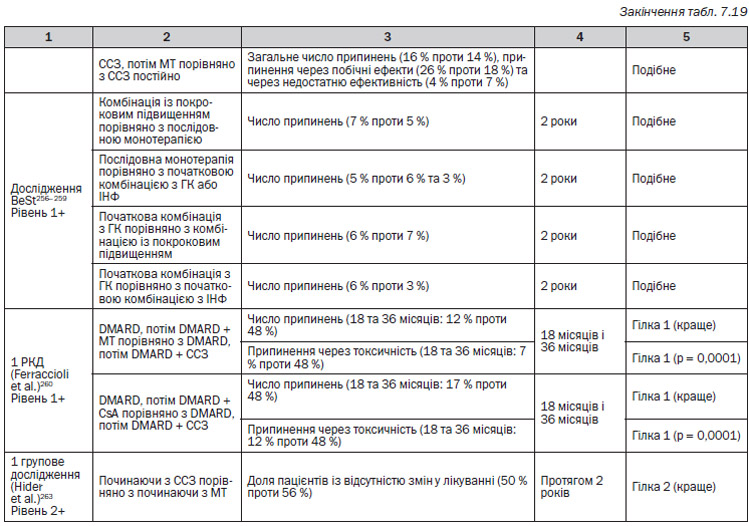
— Дослідження використовували різні методи відміни різних DMARD. В окремих дослідженнях пацієнти мали успішний контроль захворювання до відміни активного DMARD265, 266, 269, 271, 272, а в інших — мали безперервне активне захворювання267, 268, 270, 273.
— В окремих випробуваннях доза активного DMARD поступово зменшувалася271–273, але у більшості — різко замінювалася на плацебо265–270.
— Який метод не був би використаний, більшість досліджень показала, що пацієнти, які приймають плацебо чи менші дози DMARD, симптоматично, функціонально та за якістю життя не почуваються так само добре265–269, 271. Відносно будь-якого впливу на пошкодження суглобів існує недостатня кількість даних.
— Одне дослідження, в якому доза метотрексату могла бути успішно знижена, проводилося у пацієнтів, які добре відповідали на інфліксимаб273. Одне дослідження також підтвердило, що повернення пацієнта на вихідну дозу препарату може приводити до відновлення покращення захворювання265.
7.1.19. Від доказів до рекомендацій (припинення приймання DMARD)
На основі доступних даних ГРН вирішила, що при зниженні дози засобів, які модифікують перебіг захворювання, було б доцільно дати пораду, що це слід завжди робити із обережністю та що слід визначити заходи для негайної повторної оцінки аби при перших ознаках загострення швидко повернутися до дози препаратів, яка контролює захворювання. Навчання пацієнтів, коли та як відшукати швидкий доступ до лікаря та отримати допомогу у випадку загострення захворювання з метою досягнення контролю захворювання, вказано у рекомендації R36. Тим не менше, ГРН вирішила, для таких особливих пацієнтів, у яких було прийняте рішення знизити дозу (чи припинити приймання) засобу, що модифікує перебіг захворювання, показана додаткова рекомендація щодо доступності невідкладного огляду (наприклад, шляхом швидкого доступу до призначеного члену MDT, див. розділ 6.1).
Було також вирішено екстраполювати на основі доступного доказу більш загальну рекомендацію, згідно з якою при додаванні до режиму лікування додаткових препаратів завжди повинна бути вивчена можливість спробувати знизити дозу чи відмінити теперішній препарат.
Рекомендації
R19 У хворих із вперше діагностованим РА, для яких комбінована терапія із використанням DMARD не підходить (наприклад, при супутній патології чи під час вагітності, коли певні препарати протипоказані), розпочніть монотерапію із використанням DMARD, віддаючи перевагу швидкому збільшенню до клінічно ефективної дози, ніж вибору DMARD.
R20 При введенні нових препаратів для покращення контролю захворювання у режим лікування осіб із встановленим РА розгляньте зниження дози чи припинення приймання вже призначених ревматологічних препаратів, тільки-но хвороба стане контрольованою.
R21 У будь–яких осіб із встановленим ревматоїдним артритом, у яких дози засобів, які модифікують перебіг захворювання, чи біопрепаратів зменшені чи приймання припинене, повинні бути встановлені заходи для швидкої перевірки.
7.2. Глюкокортикоїди
7.2.1. Клінічне впровадження
Глюкокортикоїди при РА з недавнім початком та встановленому РА
Глюкокортикоїди використовувалися при лікуванні РА протягом більше ніж 50 років. Після першого введення ентузіазм відносно ефективності цих препаратів зменшився у зв’язку із важкими побічними ефектами великих доз, які були використані. Лікарі та пацієнти продовжують звертатися до цих препаратів з обережністю. Однак окремі аспекти використання стероїдів є стандартною клінічною практикою:
— Інтраартикулярні ін’єкції мають обмежену доказову базу, але їх користувачі та одержувачі можуть підтвердити, що вони є виключно практичними при загостренні в одному чи більше суглобах.
— При поліартикулярних загостреннях або при першому прояві захворювання внутрішьом’язовий/інтраартикулярний чи короткий пероральний курс стероїдів може зменшити симптоми хвороби у той час, коли очікується ефект інших повільно діючих препаратів.
— При тяжких позасуглобових проявах внутрішньовенне введення глюкокортикоїдів може зберегти критичні органи (наприклад, очі при склериті) або навіть, в окремих випадках, запобігти ускладненням, які загрожують життю (наприклад, важкому серозиту чи васкуліту), хоча вони повинні використовуватися з імуносупресорами, такими як циклофосфамід.
Питаннями, поставленими ГРН, були:
— Чи повинні пацієнти із раннім РА лікуватися за допомогою будь-якої форми стероїдів (перорально чи внутрішньом’язово)?
— Чи переважує користь стероїдів недоліки?
— Чи мають глюкокортикоїди довготривалий вплив на симптоми, функціонування суглобів та якість життя?
— Чи слід класифікувати глюкокортикоїди як засоби, які модифікують перебіг захворювання?
7.2.2. Клінічне методологічне впровадження
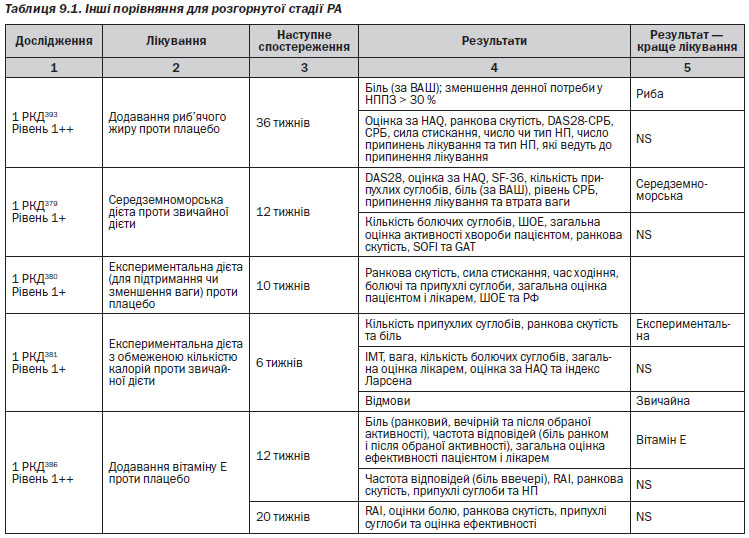
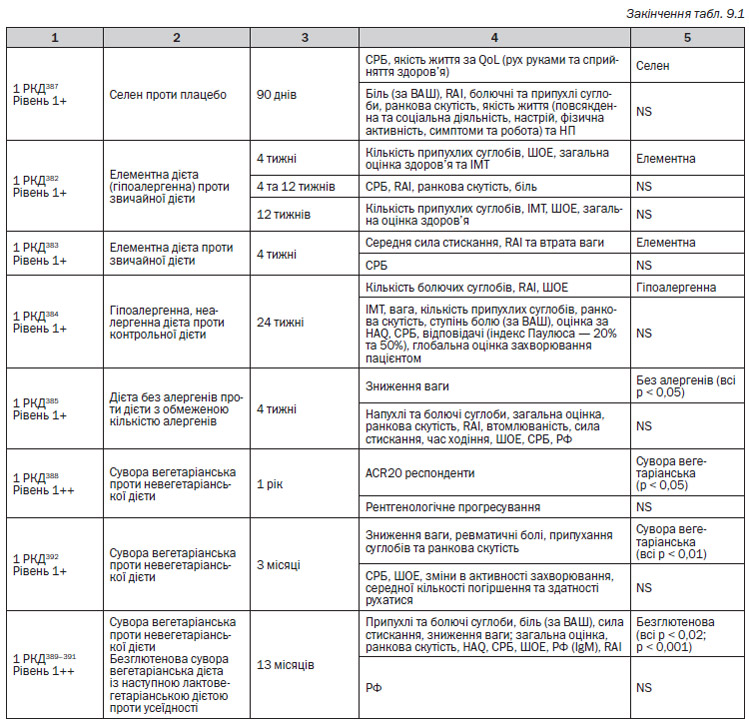
Ми шукали дослідження, які вивчали ефективність та безпечність кортикостероїдів щодо симптомів, пошкодження суглоба, функціонування та якості життя у пацієнтів із раннім чи пізнім РА. У зв’язку із великим об’ємом матеріалів були відібрані лише РКД із об’ємом вибірки N > 50 та які порівнювали монотерапію глюкокортикоїдами із плацебо чи комбінації глюкокортикоїдів та DMARD із терапією DMARD. Аби зробити спробу відокремити вплив стероїдів у чистому вигляді, були включені лише дослідження, які порівнювали глюкокортикоїди із плацебо чи глюкокортикоїди плюс DMARD із DMARD. Однак слід відмітити, що глюкокортикоїди із плацебо за відсутності інших DMARD порівнювало одне дослідження282, 283, а інші дослідження порівнювали глюкокортикоїди плюс DMARD із терапією лише DMARD. В окремих із цих досліджень DMARD були встановлені протоколом, а в інших супутні DMARD залишалися на вибір лікаря. Критерії включення активності захворювання варіювали в залежності від дослідження. Окремі дослідження включали пацієнтів із тривалістю РА до 1 року, а інші — до 2 років. Тому, у зв’язку із цими відмінностями, об’єднані результати потребують обережної обробки.
Аби бути включеним у дослідження встановленого захворювання, пацієнти повинні були мати активне захворювання, але в різних випробуваннях це мало різні визначення. Було відмічено, що одне випробування275 використовувало в обох групах пеніциламін, а інше276 використовувало ін’єкції золота. Жоден із цих DMARD на даний час не є дуже популярним з причини токсичності. Немає достатньо доказів для більш популярних DMARD, таких як метотрексат або сульфазалазин. Матеріали, які оцінювали глюкокортикоїди, що були опубліковані у 1950-ті роки, не були включені в оцінку, оскільки пошук по базі даних здійснювався лише починаючи із публікацій з 1966 року та пізніше.
Ранній РА
Шість РКД277–284 були визнані як такі, що задовольняють критеріям. Два із цих РКД (1 РКД282–283, 1 РКД 279–280) були опубліковані у вигляді двох окремих документів, в яких повідомлялися різні результати, і тому кожне випробування могло бути підраховане лише один раз, однак тут представлені та включені до списку літератури результати з обох документів. Методичні обмеження РКД полягали у наступному: ті, що були класифіковані як 1+, були або подвійними сліпими та не мали ІТТ-аналізу (2 РКД), або були не сліпими та мали ІТТ-аналіз (1 РКД). Випробування, класифіковане як 1++, було сліпим, і ІТТ-аналіз був здійснений.
Всі шість випробувань були паралельно-груповими дослідженнями, в яких використовувався пероральний кортикостероїд преднізолон, але вони відрізнялися відносно наступного:
— об’єм вибірки (діапазон: від N = 81 до N = 259);
— сліпий метод (5 подвійних сліпих РКД, 1 несліпе РКД);
— тривалість випробування (5 РКД 2 роки, 1 РКД 12 тижнів; наступне спостереження у діапазоні від безпосередньо після лікування до 1 року після лікування);
— лікування (1 РКД глюкокортикоїд проти плацебо, 5 РКД глюкокортикоїд + DMARD проти DMARD);
— Режим лікування — доза.
РА з хронічним перебігом
П’ять РКД275, 276, 285–287 були визнані як такі, що задовольняють критеріям. Методичні обмеження РКД полягали у наступному: ті, що були класифіковані як 1+, були або подвійними сліпими та не мали ІТТ-аналізу (2 РКД), або несліпими та мали ІТТ-аналіз (1 РКД), або одинарними сліпими та мали ІТТ-аналіз, але мали високу частоту виключень (1 РКД). Випробування, класифіковане як 1++, було сліпим, і ІТТ-аналіз був здійснений.
Всі п’ять випробувань були паралельно-груповими дослідженнями, в яких використовувався кортикостероїд, але вони дуже різнилися за дизайном і мали різні критерії включення. Випробування відрізнялися відносно наступного:
— об’єм вибірки (діапазон: від N = 59 до N = 137);
— сліпий метод (3 подвійних сліпих РКД, 1 одинарне сліпе РКД, 1 несліпе РКД);
— тривалість випробування (діапазон: від одного введення до 1 року; наступне спостереження у діапазоні від безпосередньо після лікування до 7 місяців після лікування);
— лікування (1 РКД глюкокортикоїд проти плацебо, 3 РКД глюкокортикоїд + DMARD проти DMARD);
— використаний кортикостероїд (2 РКД — метилпреднізолон, 1 РКД — преднізолон, 1 РКД — депомедрол, 1 РКД — римексолон);
— шлях введення кортикостероїду (2 РКД — внутрішньом’язово, 1 РКД — інтраартикулярно, 1 РКД — внутрішньовенно, 1 РКД — перорально);
— режим лікування — доза.
7.2.3. Економіка охорони здоров’я: методологічне впровадження
Було знайдено та оцінено два дослідження. Дослідження Bae et al.288 виконувалося у Сполучених Штатах і є аналізом вартості — користі низьких доз глюкокортикоїдів порівняно з інгібіторами ЦОГ-2 та неселективними НППЗ. Дослідження Verhoeven et al.241 виконувалося у Голландії та є аналізом вартості — користі введення преднізолону з поступовим зменшенням дози, сульфазалазину та метотрексату порівняно з сульфазалазином.
7.2.4. Клінічні документальні докази
Ранній РА
Симптоми та якість життя
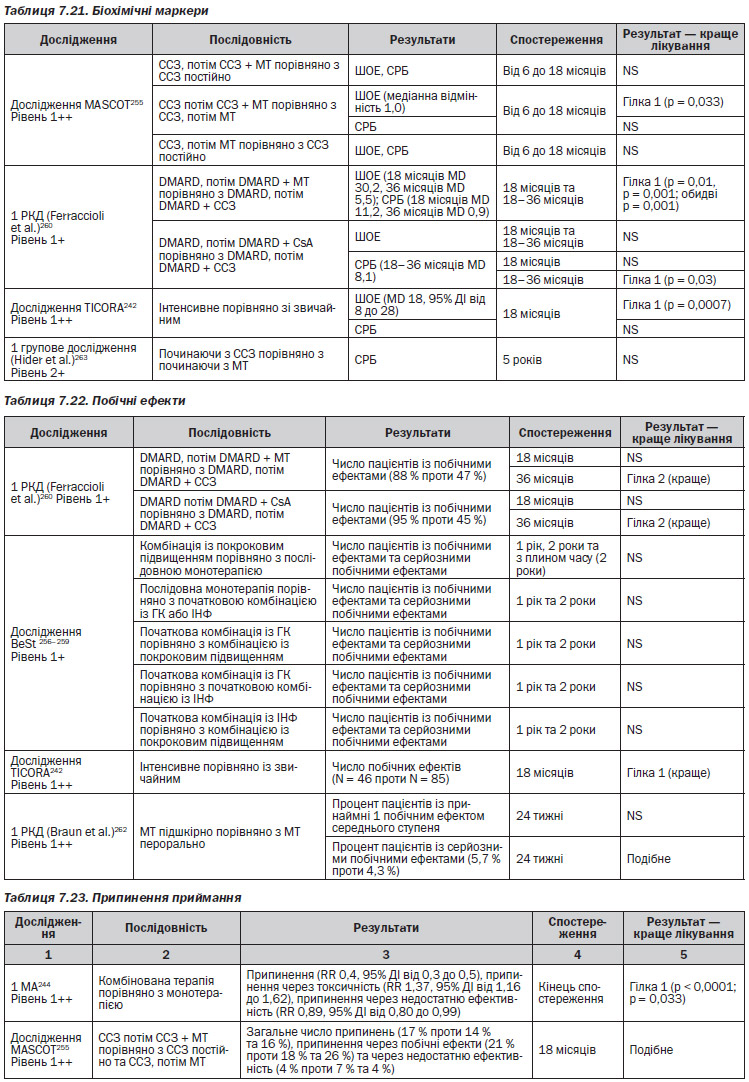
— Три РКД (1 РКД279, 280 рівень 1+281; 1 РКД277 рівень 1++) показали відсутність покращення за показником болю у 1-й або 2-й рік при використанні преднізолону перорально (та у 3-й рік для випробування Hickling та Kirwan279, 280 рівень 1+).
— Одне РКД281 показало стійке зменшення активності захворювання (DAS28) на 6-й, 12-й та 24-й місяці у групі преднізолону та більшу долю пацієнтів у ремісії за DAS28 наприкінці 2-го року, але не наприкінці 1-го року. Рівень 1+
— Три РКД (1 РКД279, 280 рівень 1+; 1 РКД282, 283 рівень 1++; 1 РКД284 рівень 1+) продемонстрували, що клінічні та лабораторні показники запалення суглобів, за винятком болісності суглобів, у дослідженні Van Everidgen282, 283 не мали покращення у 1-й або 2-й рік. При цьому дослідження Wassenberg284 показало відсутність загального покращення у пацієнтів чи значних змін у показниках якості життя.
— Три РКД були спрямовані на вивчення небажаних явищ та припинення приймання протягом 2-річного періоду (1 РКД284 рівень 1+; 1 РКД277 рівень 1++; 1 РКД281 рівень 1++) та виявили подібні результати для преднізолону порівняно з плацебо, хоча Cappell277 виявив більше випадків відміни препарату внаслідок небажаних явищ у групі стероїдів, а Wassenberg284 більше випадків відміни внаслідок неефективності препарату у стероїдній групі.
— Два РКД (1 РКД282, 283 рівень 1++; 1 РКД281 рівень 1+) показали, що у групах преднізолону доза супутнього медикаменту могла бути знижена. Пацієнти у дослідженні Van Everidgen282, 283 та Svensson281 у групах преднізолону були здатні зменшувати кількість інтраартикулярних стероїдів, а у випробуванні Svensson були здатні зменшувати кількість НППЗ.
Пошкодження суглобів
— Чотири РКД (1 РКД279, 280 рівень 1+; 1 РКД281 рівень 1+; 1 РКД282, 283 рівень 1++; 1 РКД284 рівень 1+) показали знижене пошкодження при рентгенологічній оцінці (доля ерозій, прогресування пошкодження на рентгенограмі) у групі, яка приймала преднізолон перорально, порівняно з плацебо протягом 2 років. Однак лише у випробуваннях Wassenberg284 та Svensson281 це явне розходження було в 1-й рік. За показником звуження суглобової щілини у групах преднізолону досліджень Wassenberg284 та Svensson281 покращення не було, але інші компоненти інтегральних індексів пошкодження покращувалися. У Kirwan279, 280 відмінність за показником ерозії у руці при рентгенівському дослідженні залишалася значною через 3 роки (через 1 рік після припинення приймання стероїдів), але показник прогресування пошкодження при рентгенівському дослідженні не відрізнявся.
— Одне РКД277 показало відсутність покращення у показнику пошкодження, виявленому рентенологічно у групі преднізолону через 1 чи 2 роки. Рівень 1++
Функціонування
— Три РКД (1 РКД282, 283 рівень 1++; 1 РКД277 рівень 1++; 1 РКД284 рівень 1+) показали, що функціональні показники у групі преднізолону у 1-й та 2-й рік не відрізнялися. Van Everidgen282, 283 показав покращення показника сили стискання у 1-й рік при застосуванні преднізолону, але ця відмінність була втрачена у 2-й рік.
— Одне РКД279, 280 показало відсутність функціонального покращення за HAQ для будесоніду (3 мг або 9 мг) на 3-й місяць порівняно з плацебо. Преднізолон (7,5 мг) показав покращення за HAQ на 3-й місяць, але воно не зберігалося у 1-й чи 2-й рік. Рівень 1+
— Одне РКД281 показало значне покращення у групі преднізолону за HAQ та індексом SOFI (Signals of Functional Impairment — ознаки функціонального порушення) на 6-й, 12-й та 24-й місяць. Рівень 1+
РА з хронічним перебігом
Симптоми та якість життя
— Одне РКД285 порівнювало депомедрол раз на місяць із плацебо на додаток до звичайного DMARD і виявило зниження DAS та зменшення набрякання суглобів на 6-й місяць, однак загальні оцінки пацієнтом та лікарем не відрізнялися. Більшість пацієнтів припиняли приймання плацебо через недостатню ефективність. Симптоматична користь у 1-й чи 2-й рік не зберігалася. Зменшення ШОЕ не відбувалося. Хоча група глюкокортикоїдів мала більше небажаних явищ, більше припинень лікування із цієї причини не було. Рівень 1++
— Одне РКД276 оцінювало вплив метилпреднізолону внутрішньом’язово на 0-й, 4-й та 8-й тиждень від початку внутрішньом’язового введення золота порівняно з плацебо. Показники болю та рахунок суглобів покращувалися на 12-й тиждень (4 тижні після останньої ін’єкції), але не на 24-й тиждень. Суглобовий рахунок покращувався на 12-й тиждень, але не на 24-й. Показник ШОЕ у групі глюкокортикоїдів знижувався на 4-й тиждень, але пізніше не зберігався. Індекс активності захворювання покращувався до 12-го тижня, але не до 24-го. Ін’єкції добре переносилися при відсутності більшої кількості відміни препарату у глюкокортикоїдній групі. Рівень 1+
— Одне РКД275 оцінювало різні дози перорального преднізолону, який давався у режимі зменшення дози починаючи із 30 мг і до дози між 2,5 мг і 15 мг (визначалася пацієнтом) для контролю захворювання. Хоча більше число пацієнтів на 3-й місяць мало більше ніж 20% та 50% клінічне покращення, цей показник не зберігався на 6-й або 12-й місяці. Покращення у показниках ШОЕ або СРБ не відбувалося. Рівень 1+
— Одне РКД278 порівнювало 6 внутрішньовенних ін’єкцій метилпреднізолону (15 мг/кг) протягом 20 тижнів із плацебо та виявило відсутність відмінностей за різними симптомами через 20 тижнів або через 1 рік (7 місяців після останньої ін’єкції). Рівень 1+
— Одне РКД286 виявило, що показники кількості болісних та набряклих суглобів значно покращувалися на 4-й тиждень при використанні будесоніду перорально (3 мг та 9 мг) та перорального преднізолону (7,5 мг) після додавання до звичайного лікування порівняно з плацебо та звичайним лікуванням (всі р < 0,05). На 12-й тиждень, поряд з іншими показниками активності захворювання та якості життя (загальні оцінки пацієнтом та лікарем, ACR20, SF-36 фізичного та психічного стану), це зберігалося лише для будесоніду (9 мг) та преднізолону (7,5 мг) (р < 0,05). Показники болю та ранкової скутості на 12-й тиждень при використанні будеcоніду (3 мг та 9 мг) не покращувалися. При використанні преднізолону у дозі 7,5 мг показник болю зменшувався на 12-й тиждень (р < 0,001), але ранкова скутість — ні. Показники СРБ та ШОЕ знижувалися лише на 12-й тиждень при використанні преднізолону (обидва р < 0,001). У той же час число пацієнтів із небажаними явищами було подібним із плацебо, всі три стероїдні групи мали більше число небажаних явищ, ніж група плацебо, але без більшого числа припинень лікування. Рівень 1++
— Одне РКД287 перевіряло вплив інтраартикулярного введення різних доз римексолону у коліна хворих на РА, і для більш високих доз була виявлена симптоматична користь порівняно з плацебо аж до 84-го дня. Ін’єкція добре переносилася. Рівень 1+
Пошкодження суглобів
— Одне РКД285 порівнювало депо-медрол щомісячно із плацебо додатково до звичайного DMARD та виявило знижений показник пошкодження (за рентгенограмою) на 2-й рік у групі стероїдів (аналіз використовував % зміни відносно вихідного рівня внаслідок вихідних відмінностей — однак, коли аналіз здійснювався за зміною у фактичних кількісних показниках, між групами значних відмінностей не було). Рівень 1+
— Одне РКД276 перевіряло метилпреднізолон внутрішньом’язово на 0-й, 4-й та 8-й тижні після початку внутрішньом’язового введення золота порівняно з плацебо, і виявило відсутність відмінностей між групами на 24-й тиждень за показником пошкодження (на основі рентгенограми). Рівень 1+
— Одне РКД275 перевіряло різні дози перорального преднізолону, який давався у режимі зменшення дози починаючи із 30 мг і до дози між 2,5 мг і 15 мг (визначалася пацієнтом) для контролю захворювання. Стероїдна група показала менше пошкодження суглобів (оцінка дельта Ларсен — delta Larsen score) у 1-й рік, але однакове число пацієнтів із пошкодженням суглобів та прогресуванням ерозії. Рівень 1+
Функціонування
— Одне РКД287 оцінювало вплив різних доз римексолону інтраартикулярно у коліна у хворих на РА і для більш високих доз виявило стійкі функціональні переваги (здатність ходити пішки, амплітуда рухів) порівняно з плацебо аж до 84 днів. Рівень 1+
— Одне РКД285 порівнювало депо-медрол щомісячно із плацебо додатково до звичайного DMARD та виявило покращення за HAQ на 6-й місяць, яке, однак, не зберігалося через 1 чи 2 роки. Рівень 1++
— Одне РКД276 оцінювало вплив метилпреднізолону внутрішньом’язово на 0-й, 4-й та 8-й тижні після початку внутрішньом’язового введення золота порівняно з плацебо. Виявлено покращення HAQ у глюкокортикоїдній групі на 4-й та 12-й тижні, але не на 8-й та 24-й тижні. На жодній стадії в стероїдній групі не було покращення показника сили стискання. Рівень 1+
— Одне РКД275 оцінювало вплив різних доз перорального преднізолону, який давався у режимі зменшення дози починаючи із 30 мг і до дози між 2,5 мг і 15 мг (визначалася пацієнтом). У 1-й рік у глюкокортикоїдній групі мало місце значне покращення HAQ та сили стискання. Рівень 1+
7.2.5. Економічний аналіз охорони здоров’я: документальні докази
Bae et al.288 зробив висновок, що глюкокортикоїди є дешевшими та більш ефективними, ніж НППЗ, при довготривалому лікуванні пацієнтів із РА, але відмінності між двома групами препаратів як за вартістю, так і за результатами заходів з охорони здоров’я є відносно малими. Дослідження виконувалося і в Сполучених Штатах, тому використані ресурси та супутні витрати можуть дуже відрізнятися у Великобританії. У дослідженні Verhoeven et al.241 аналіз виявив, що комбіноване лікування преднізолоном, метотрексатом та сульфазалазином із поступовим зниженням дози буде більш ефективним, ніж тільки сульфазалазином, за такої ж чи меншої вартості. Група комбінованого лікування мала менші витрати на непротокольні медикаменти та стаціонарне лікування та менші витрати поза системою охорони здоров’я, що компенсує більш високу вартість протокольних медикаментів і моніторингу.
7.2.6 Узагальнені результати відносно документальних доказів
Ранній РА
— При ранньому РА режим використання низької дози перорального стероїду сприяє покращенню симптоматики та якості життя аж до 3-го місяця,286 але це зазвичай не зберігається через рік або пізніше277, 280–284.
— Не існує переконливого доказу функціонального покращення при застосуванні глюкокортикоїдів277, 280, 282–284.
— Низька доза стероїдів зазвичай добре переноситься277,281,284 та може дещо зменшувати потребу у супутньому лікуванні281–283.
— Більшість випробувань наводить на думку, що глюкокортикоїди модифікують перебіг захворювання, уповільнюючи радіологічне пошкодження через 2 роки280–284.
РА з хронічним перебігом
— Ін’єкції стероїду у колінний суглоб дають стійку користь з точки зору симптоматики та функціонування (хоча вказаний стероїд не використовується у Великобританії)287.
— Внутрішньом’язовий, внутрішньовенний та пероральний шляхи введення стероїдів найбільш цінні у найближчі строки, не призводять до стійкої симптоматичної користі275, 276, 278, 285.
— Використовуючи пероральні глюкокортикоїди у різних дозах для контролю симптомів, можна покращити функціонування протягом 1 року275.
— Доказ того, що використання стероїдів при встановленому РА може модифікувати перебіг захворювання, є суперечливим, окремі випробування, імовірно із недостатньою потужністю, показали відсутність значного ефекту. Ця доказова база не є настільки сильною, як доказова база відносно РА з нещодавнім початком275, 276, 285.
Характерні ознаки як раннього, так і пізнього РА
— Глюкокортикоїди зазвичай дають лише короткотривалу симптоматичну та функціональну користь та користь відносно якості життя.
— Більшість випробувань мають ознаки того, що глюкокортикоїди є засобами, які модифікують перебіг захворювання.
7.2.7. Від доказів до рекомендацій
Ранній РА
ГРН відмітила, що між доступними даними та тим, що насправді відбувається у клінічній практиці, існує значна невідповідність. Наприклад, як при початковому прояві захворювання, так і протягом загострень глюкокортикоїди (пероральні, внутрішньом’язові та інтраартикулярні) часто використовуються для досягнення симптоматичної користі та контролю захворювання поки очікується ефект повільно діючих DMARD, незважаючи на недостатність доказів на підтримку цього. Клінічна ефективність цього підходу є настільки традиційною, що є сумнівним, що майбутні рандомізовані контрольовані клінічні випробування будуть коли-небудь проведені, і ГРН вважає, що використання глюкокортикоїдів повинно бути рекомендоване як у пацієнтів із вперше діагностованим ревматоїдним артритом, які ще не приймали глюкокортикоїдів та DMARD (див. рекомендацію R22), так і для лікування загострення раннього чи пізнього РА.
РА з хронічним перебігом
ГРН відмітила, що доказ для використання глюкокортикоїдів при пізньому РА є недостатнім, обмеженої якості та що у двох випробуваннях як препарати порівняння були використані більш старі препарати — пеніциламін та золото. Була необхідність встановити показники комбінування стероїдів з такими препаратами, як метотрексат при встановленому захворюванні, для якого існує набагато менше доказів про модифікацію перебігу захворювання стероїдами, ніж при ранньому РА.
Хоча стійкою рисою як для раннього, так і для пізнього РА є те, що симптоматична користь, яку надають глюкокортикоїди, є зазвичай лише короткотривалою, ГРН відмітила, що у стандартній клінічній практиці є, однак, окремі пацієнти, які, ймовірно, залежать від довготривалості прийому низької дози стероїдів, оскільки припинення їх приймання призводить до загострення активності захворювання. Таке використання стероїдів у цій окремій групі пацієнтів, імовірно, слід прийняти, навіть якщо ситуація не є ідеальною, хоча завжди слід робити спроби замінити глюкокортикоїди на інші засоби, які модифікують перебіг захворювання, та продовжувати глюкокортикоїди у найменшій дозі, яка контролює симптоми. Також здавалося важливим підкреслити можливі специфічні серйозні ускладнення, пов’язані із довготривалою терапією глюкокортикоїдами.
Рекомендації
R22 Розгляньте пропозицію короткотривалого лікування глюкокортикоїдами (пероральними, внутрішньом’язовими чи інтраартикулярними) для швидкого покращення симптомів у хворих із вперше діагностованим РА, якщо вони ще не приймають глюкокортикоїди в якості частини комбінованої терапії DMARD.
R23 Запропонуйте короткотривале лікування глюкокортикоїдами для врегулювання загострень у хворих із раннім чи пізнім РА для швидкого зменшення запалення.
R24 У хворих із пізнім РА продовжуйте лікування за допомогою глюкокортикоїдів, лише якщо:
— ускладнення, викликані довготривалою терапією глюкокортикоїдами, були повністю обговорені та
— були запропоновані всі інші варіанти лікування (включно із біопрепаратами).
7.3. Біологічні препарати
7.3.А Біопрепарати та стандартні DMARD у пацієнтів із встановленим РА у випадку постійної активності захворювання
7.3.1. Клінічне впровадження
Хоча терапія біопрепаратами мала величезний вплив на лікування РА, дуже необхідно мати загальновживані DMARD. Крім того, біопрепарати є значно дорожчими, ніж звичайні DMARD. Тому доцільно дослідити порівняльну ефективність цього нового лікування та визначити, яку додаткову цінність вони додають до лікування РА порівняно з дешевшими та більш загальновизнаними препаратами. Окремі біологічні препарати вже мають завершену оцінку методології NICE, наприклад, ритуксимаб10 та інгібітори ФНП-а — адалімумаб, етанерцепт та інфліксимаб130. Нещодавно був оцінений абатацепт і був визнаний у NHS нерентабельним при використанні11. Інші біологічні препарати, такі як цертолізумаб пегол, вже розпочали процес оцінки методології.
7.3.2. Клінічне методологічне впровадження
Ми шукали дослідження, які вивчали ефективність та безпечність біологічних препаратів порівняно із DMARD (окремо чи у комбінації) щодо симптомів, пошкодження суглобів, функціонування та якості життя у пацієнтів із встановленим РА. В зв’язку із великим об’ємом матеріалів були обрані лише РКД, які мали об’єм вибірки N ≥ 100 та були британською цільовою групою.
Два MA289, 290, 10 РКД291–304 та одне розширене дослідження305 із 2 РКД були визнані такими, що задовольняють критеріям. Одне РКД (випробування TEMPO) було опубліковане у вигляді п’яти окремих статей292, 293, 300, 303, 304, у яких повідомлялося про різні результати та час спостереження, тому випробування було підраховано лише один раз, однак результати з усіх статей представлені тут і включені до списку літератури. Всі випробування (включно із MA) були проведені у пацієнтів із встановленим РА. Методичні обмеження РКД полягали у наступному: ті, що були класифіковані як 1+, були або подвійними сліпими та не мали ITT-аналізу (2 РКД), або були не сліпими та мали ITT-аналіз (1 РКД). Випробування, класифіковані як 1++, були сліпими та ITT-аналіз був здійснений (7 РКД).
Перший SR/MA289 фокусувався на 6 подвійних сліпих РКД з N = 2381 пацієнтів, у яких порівнювали монотерапію адалімумабом або у комбінації з DMARD із плацебо або іншим DMARD. І сам MA, і дослідження, які він включав, були проведені на належному рівні. Дослідження, включені до аналізу, відрізнялися стосовно наступного:
— втручання – доза та режим;
— розмір дослідження (діапазон від N = 54 до N = 636);
— тривалість дослідження — тривалість втручання (від 12 тижнів до 52 тижнів).
Другий SR/MA290 фокусувався на 3 подвійних сліпих РКД із N = 1040 пацієнтів, у яких порівнювали інгібітори ФНП-а + МТ із МТ при тривалості лікування від 50 до 55 тижнів. І сам MA, і дослідження, які він включав, були проведені на належному рівні. Дослідження, включені до аналізу, відрізнялися стосовно наступного:
— втручання (1 РКД інфліксимаб (ІНФ) + МТ, 1 РКД етарнерцепт (ETN) + МТ, 1 РКД адалімумаб (ADA) + МТ);
— втручання — доза та режим;
— розмір дослідження (діапазон від N = 174 до N = 459).
Примітка. Два MA289, 290 включали РКД, вже внесені до цього розділу. Однак здавалося важливим повідомити про РКД окремо аби побачити ефекти окремих препаратів на всі показники результатів, оскільки MA або об’єднував класи препаратів разом, або об’єднував дані за окремими результатами (оскільки не всі випробування використовували одні й ті самі показники результатів).
Всі 10 РКД291–304 були паралельно груповими, але були дуже різними за типом лікування та мали різні критерії включення. Випробування відрізнялися стосовно наступного:
— об’єм вибірки (діапазон: від N = 161 to N = 2987);
— сліпий метод (9 подвійних сліпих R РКД CT і 1 одинарне РКД);
— тривалість випробування (діапазон: від 16 тижнів до 4 років);
— лікування — тип використаних біопрепарату та DMARD;
— режим лікування — порівнювалися окремі препарати та комбінації;
— режим лікування — доза.
Внесене розширене дослідження305 включало пацієнтів, які початково були рандомізовані у 2 РКД для приймання або етанерцепту (10, 25 або 50 мг), або плацебо. У 5-річній розширеній фазі всі пацієнти отримували етанерцепт у дозі 25 мг двічі на тиждень.
Примітка. У більшості випробувань популяція складалася із пацієнтів, які не почувалися добре чи не відповідали на свою терапію із використанням DMARD. Ці пацієнти були в подальшому рандомізовані або продовжувати прийом цього DMARD, або приймати біологічний препарат. Тому у дизайні дослідження може бути деяка упередженість на користь біологічного препарату, оскільки ті, хто був у групі дослідження, яка продовжувала прийом свого DMARD, який був недостатньо ефективним, навряд чи мали покращення порівняно із тими, хто переходив на прийом біологічного препарату.
7.3.3. Економічний аналіз охорони здоров’я: методологічне впровадження
У звіті НТА, названому «Систематичний огляд ефективності адалімумабу, етанерцепту та інфліксимабу при лікуванні ревматоїдного артриту у дорослих та економічна оцінка їхньої рентабельності», зробленому Chen із співавторами у 2000 році237, був здійснений огляд публікацій, пов’язаних із економічними оцінками біопрепаратів. У цьому звіті були розглянуті публікації, датовані до лютого 2005 року. Деталі використаного методу пошуку можна знайти у звіті НТА. Аби привести цей звіт до сучасного рівня, ми здійснили пошук економічних оцінок, опублікованих у 2005–2007 рр.
Результати систематичного огляду економічних оцінок
Ми здійснили пошук публікацій, датованих січнем 2005 року — 1-м жовтня 2007 року, використовуючи ті самі пошукові терміни, які використані для клінічного огляду. Пошук за 2005–2007 рр. виявив 58 посилань для розгляду, із яких 14 посилань пов’язані із дослідженнями рентабельності DMARD та біопрепаратів. Із 14 публікацій, пов’язаних із дослідженнями рентабельності, 8 посилань були виключені, оскільки вони були тезисами чи оглядами, та два посилання були вже включені до аналітичного звіту НТА, один був виключений по причині того, що він стосувався раннього РА. В результаті для включення до огляду було знайдено 4 нових посилання — три як результат пошуку, а також один препринт. Дослідження Jobanputra із співавторами (2002) зараз є застарілим і замінене звітом НТА Chen із співавторами (2006)237 і тому виключене зі списку розглянутих публікацій.
7.3.4. Клінічні документальні докази
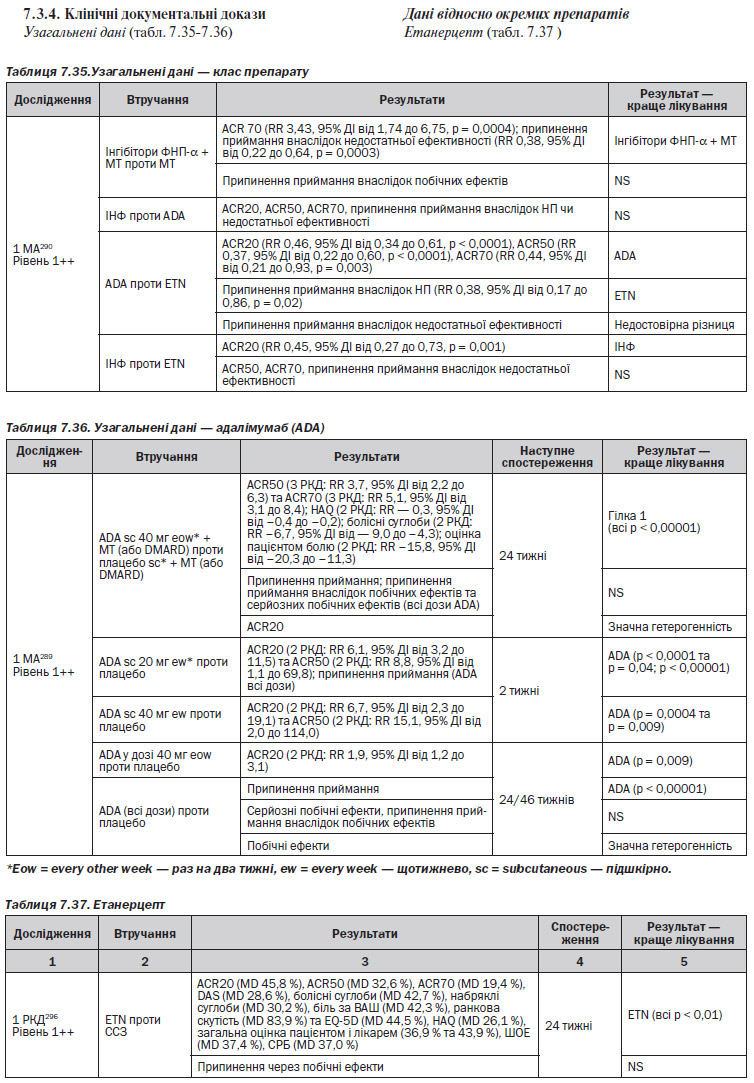
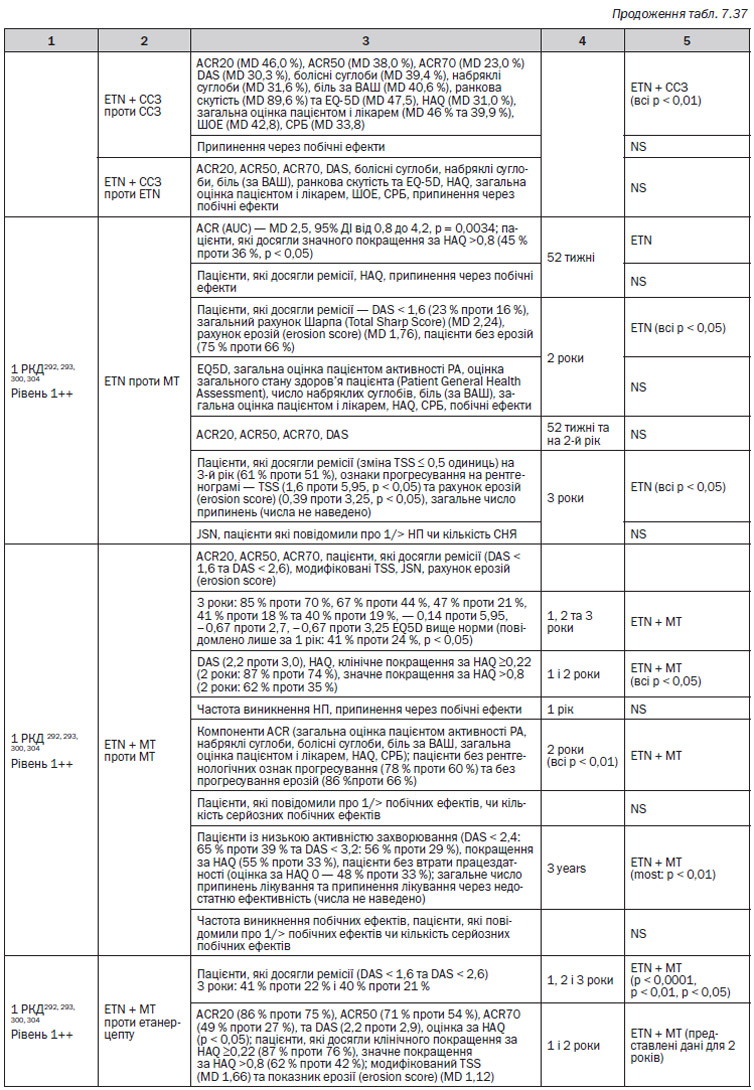
Узагальнені дані (табл. 7.35–7.36)
Дані відносно окремих препаратів
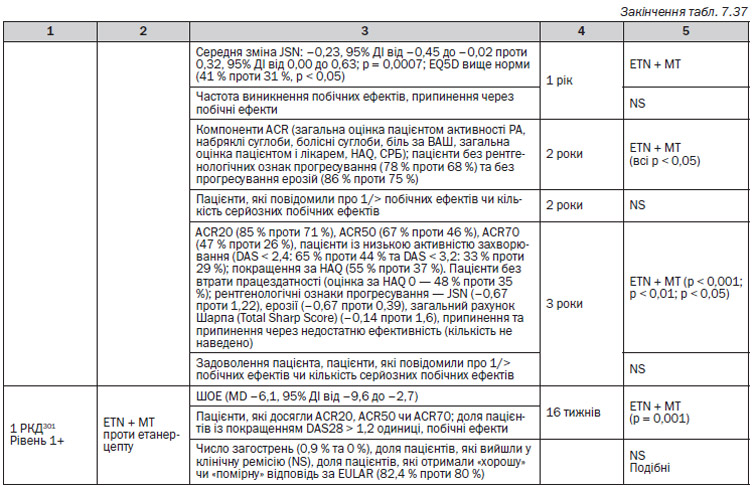
Етанерцепт (табл. 7.37 )
Розширені дослідження: етанерцепт
— Одне розширене РКД305 виявило, що пацієнти, яких лікували за допомогою етанерцепту, мали стабільні ACR20, ACR50 та ACR70 (всі NS); знижену загальну оцінку пацієнтом і лікарем (значення не подані), DAS (значення не подане) та індекси HAQ (39% покращення), рівні ШОЕ і СРБ (–31,3 мг/л і –19,5 мм/год), покращені оцінки пацієнтом болю (49,2 %) та знижене число болісних і набряклих суглобів (71 % та 72 % зменшення). Крім того, двома найбільш частими причинами припинення були побічні ефекти (73 %) та незадовільна реакція (58 %). Чисельної переваги певних побічних ефектів, що призводили до відміни препарату, не було. Рівень 3
— Одне розширене РКД303 виявило, що у 1-й рік між групами не було значимої різниці (ETN + МТ проти МТ із ETN проти ETN із додаванням МТ) за показниками DAS «ремісія» (< 1,6) та DAS «низька активність захворювання» (< 2,4). Рівень 1++
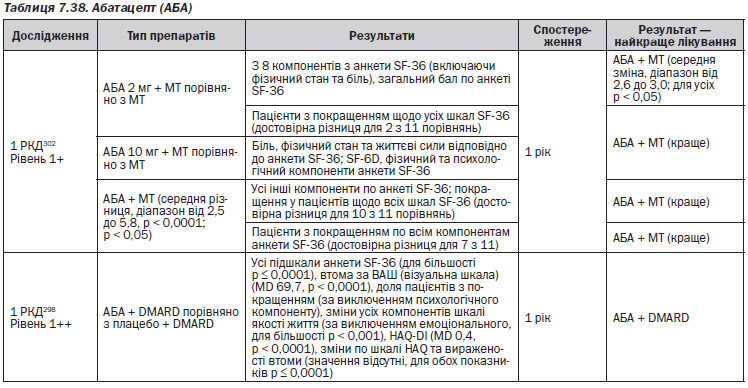
Абатацепт (АБА) (табл. 7.38)
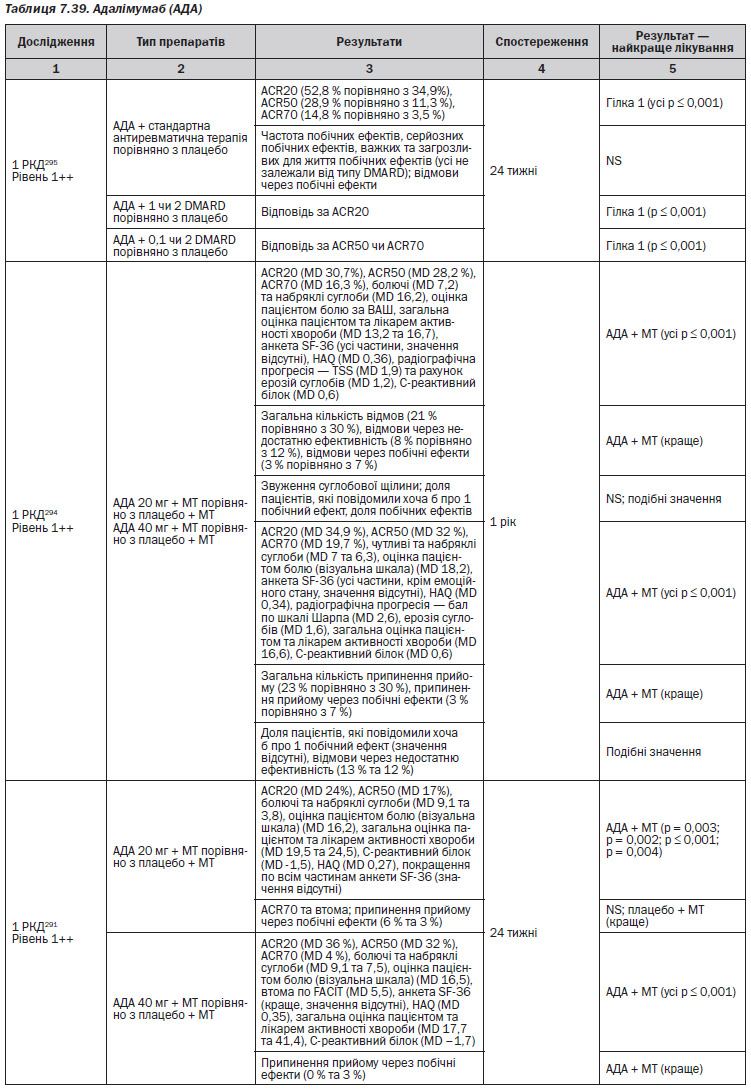
Адалімумаб (АДА) (табл. 7.39–7.40)
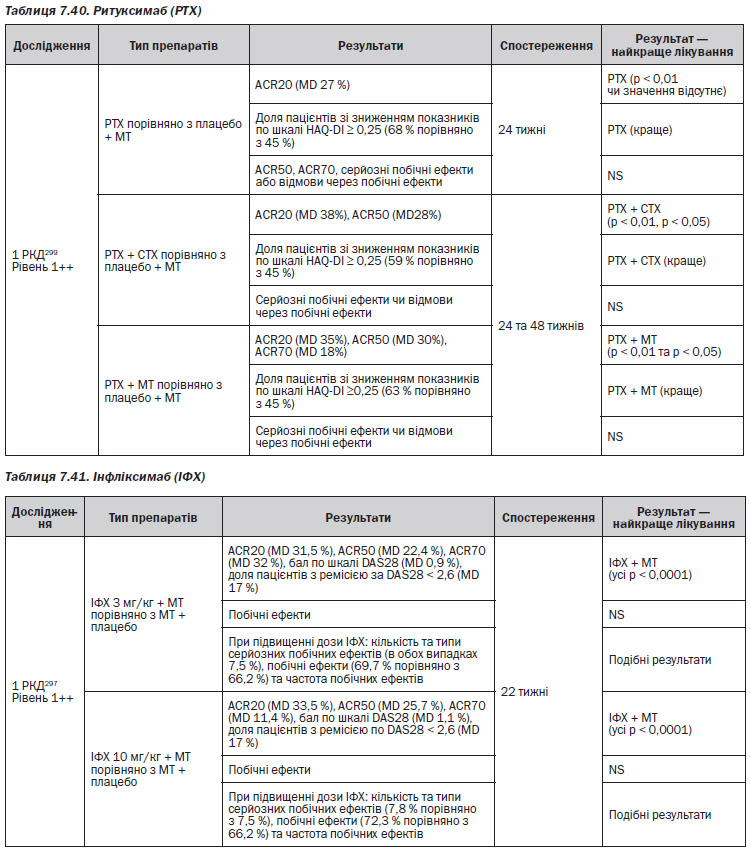
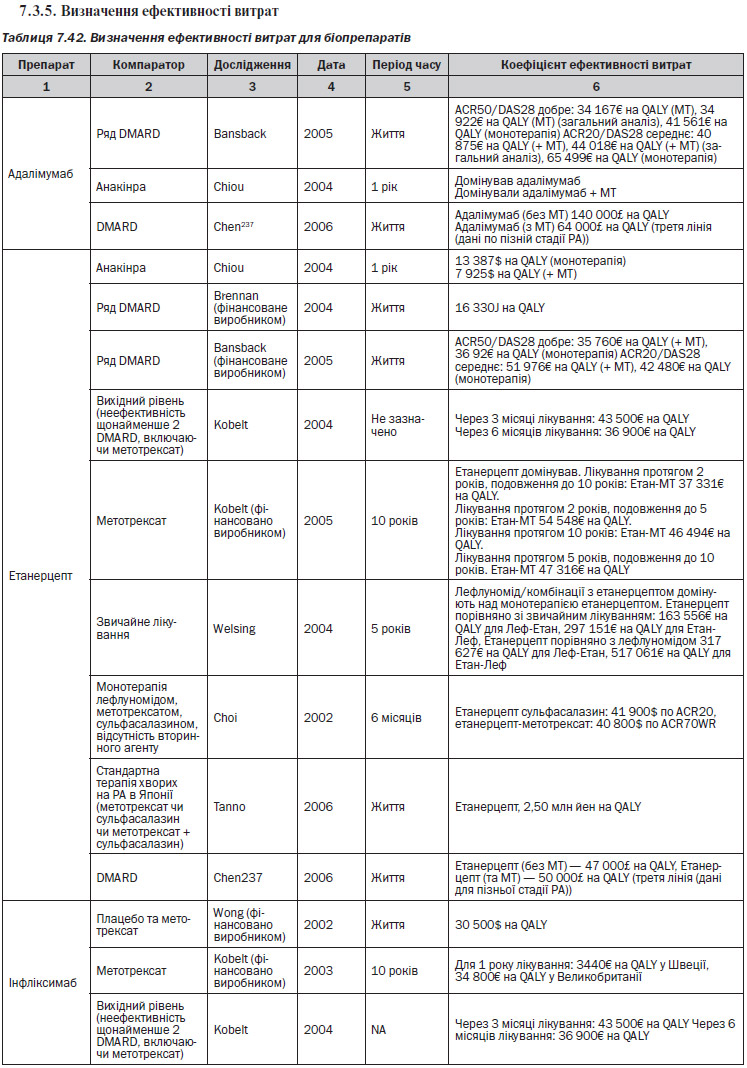
Інфліксимаб (ІФХ) (табл. 7.41)
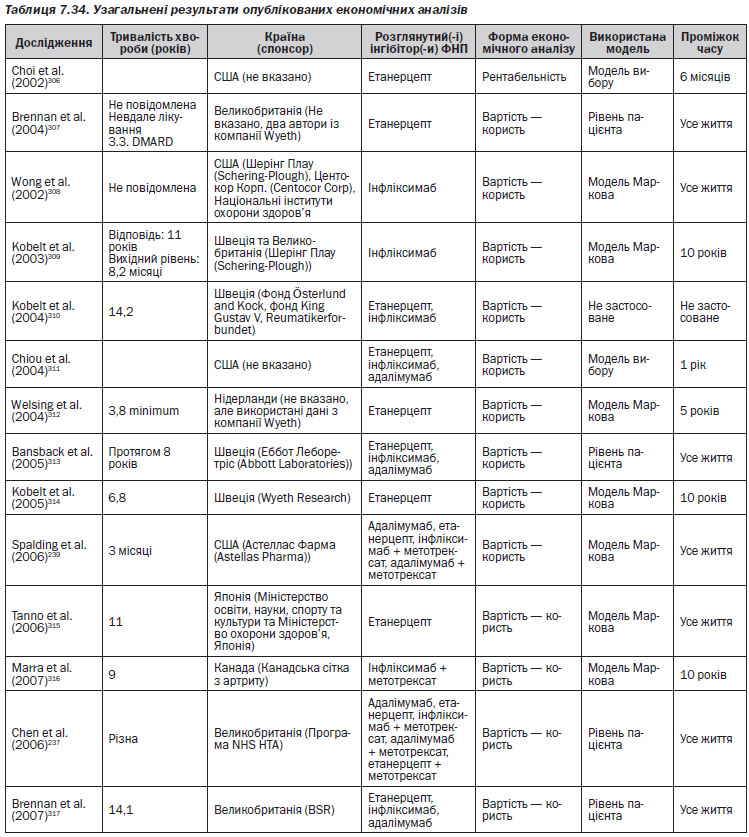
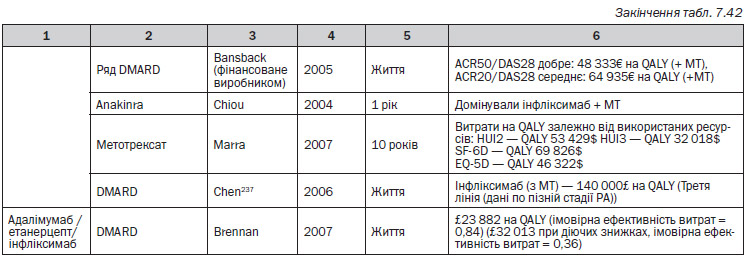
Серед досліджень, які були проаналізовані, лише чотири237, 307, 309, 317 були виконані у Великобританії. В Англії та Уельсі межа рентабельності, як правило, знаходиться в діапазоні 20 000–30 000£ на QALY. З 4 економічних аналізів, виконаних у Великобританії, справедливими є наступні результати, незалежно від встановленої межі:
— Адалімумаб — Chen (2006) продемонстрував, що коефіцієнт ефективності витрат вище, ніж межа NICE237.
— Етанерцепт — Brennan et al. (2004)307 продемонстрували, що коефіцієнт ефективності витрат був нижче межі, але Chen et al.237 продемонстрували протилежні результати.
— Інфліксимаб — відповідно до Kobelt et al. коефіцієнт ефективності витрат був нижче межі, але Chen et al. продемонстрували протилежні результати.
Для групи препаратів інгібітори ФНП–, Brennan et al. (2007)317 встановили, що коефіцієнт ефективності витрат знаходиться в межах 20–30 000£. Дане дослідження базується на даних Реєстру біологічних препаратів Спілки ревматологів Великобританії, але якщо використати дані NICE, коефіцієнт перевищить 30 000£.
Очевидно, що результати опублікованих економічних підрахунків відрізняються: в деяких аналізах надаються свідчення, що інгібітори ФНП потрапляють в звичайний прийнятний діапазон витрати-ефективність, в інших — про високі коефіцієнти ефективності витрат. Пряме порівняння коефіцієнтів ефективності витрат з різних досліджень є неможливим через різні підходи до моделювання, особливо в тому, що стосується проміжку часу, довжини циклу, країни проведення, обраної перспективи, вибору дозувань та препаратів-компараторів.
Виробники фармацевтичних препаратів фінансували 4 опубліковані аналізи, ще одне мало зв’язок з фармацевтичною кампанією. У двох дослідженнях не вказані спонсори, а шість інших не пов’язані з будь-якими виробниками. В усіх економічних аналізах, крім одного, використовувалася модель аналізу рішень. Опубліковані моделі відрізняються щодо деяких важливих аспектів, наприклад, по типу моделі, що використовується, можливості зміни терапії, комбінації препаратів, порівняльній терапії, проміжку часу та тривалості циклу. В різних дослідженнях використовувалися різні норми скидки. В деяких дослідженнях застосовувалися 3 % або 4 % норми, як для витрат, так і для QALY, в деяких — 6 % для витрат і 1,5 % для QALY. Витрати та прибутки в аналізах моделювали із розрахунку на різні проміжки часу, включаючи: 6 місяців, 1 рік, 5 років, 10 років та тривалість життя. У чотирьох дослідженнях аналіз витрати-ефективність був проведений з використанням моделі симуляції на рівні пацієнта.
7.3.6. Висновки
— Додавання біологічних препаратів до терапії пацієнтів з розгорнутою стадією хвороби, що отримують звичайні препарати, які модифікують хворобу, зазвичай дозволяє суттєво покращити контроль симптомів, функціональні можливості та якість життя291–296, 298–300, 302, 305.
— У дослідженнях, присвячених радіологічним пошкодженням, було виявлено, що комбінація біопрепарату та метотрексату має ряд переваг292, 294, 300 порівняно з метотрексатом окремо.
— Комбінація інгібіторів ФНП-а та метотрексату краще, ніж інгібітори ФНП-а, окремо щодо симптоматичних проявів, функціональної активності та ушкодження суглобів291–294, 298, 300.
— В єдиних дослідженнях, де безпосередньо порівнюється терапія біопрепаратами зі звичайною терапією DMARD у хворих з розгорнутою стадією РА, було продемонстровано, що етанерцепт дозволяє краще контролювати симптоми та має більші функціональні переваги, ніж сульфасалазин296, а ритуксимаб — ніж метотрексат299.
— Порівняння етанерцепту з метотрексатом для лікування розгорнутої стадії РА продемонструвало відсутність значимої різниці у контролі симптомів та відсутність функціональних переваг, хоча етанерцепт краще уповільнює рентгенологічне прогресування порівняно з метотрексатом292, 300.
7.3.7. Обґрунтування рекомендацій
Наявні на сьогоднішній день дані не відповідають на клінічне питання, на яку терапію повинен перейти пацієнт, який не реагує не звичайну терапію DMARD, на терапію іншим DMARD чи на біопрепарати. Відсутні дослідження, де порівнювалися би ці варіанти. В єдиних дослідженнях, в яких порівнювали біопрепарати з DMARD, було продемонстровано, що етанерцепт краще за сульфасалазин, а ритуксимаб краще за метотрексат контролюють симптоми хвороби та мають більше функціональних переваг. Однак порівняння етанерцепту з метотрексатом продемонструвало відсутність значимої різниці у контролі симптомів та відсутність функціональних переваг, хоча етанерцепт краще уповільнює рентгенологічне прогресування порівняно з метотрексатом. Це дозволяє припустити відсутність зв’язку між, з одного боку, здатністю препаратів конт–ролювати активність хвороби, а з іншого — уповільнювати радіологічну прогресію. В інших дослідженнях було продемонстровано, що додавання біопрепаратів, таких як інгібітори ФНП-а чи ритуксимаб, до звичайної терапії DMARD для лікування пацієнтів з активною стадією хвороби, дозволяє отримати додаткові суттєві переваги у контролюванні симптомів, покращенні функціональних можливостей та якості життя. Це порівняно з продовженням прийому метотрексату, відповідь на який не була повною, тому що пацієнти, що мали ознаки досить активного захворювання, незважаючи на прийом метотрексату, включались у дослідження. В цих дослідженнях, присвячених радіологічному ушкодженню, було продемонстровано, що комбінація біопрепарату та метотрексату має переваги над метотрексатом окремо. Комбінація етанерцепту та метотрексату дозволяє отримати симптоматичні та функціональні переваги, переваги у якості життя та меншу швидкість ушкодження суглобів, ніж при використанні метотрексату як монотерапії. В інструкціях до етанерцепту та адалімумабу міститься рекомендація, що за відсутності протипоказань метотрексат має бути призначений разом з ними. Дослідження послідовного використання адалімумабу, етанерцепту та інфліксимабу для лікування ревматоїдного артриту не входило до завдань даного керівництва, оскільки ці препарати аналізувалися в межах дослідження NICE. Щоб отримати детальнішу інформацію про цей аналіз, зверніться до вебсайту NICE www.nice.org.uk.
Рекомендації
З рекомендаціями можна ознайомитися в главі 10.
7.3. Анакінра
7.3.9. Вступ (клінічні аспекти)
Інтерлейкін-1 (IL-1) є прозапальним цитокіном. Існує багато доказів, що ця молекула приймає участь в патогенезі РА, пришвидшуючи руйнування хряща та ресорбцію кісток. Анакінра — рекомбінантна форма антагоніста рецепторів IL-1 людини, яка інгібує активність IL-1, теоретично захищаючи і хрящ, і кістку. Препарат рекомендовано для використання у комбінації з метотрексатом у пацієнтів, які не мали необхідної відповіді на метотрексат окремо. NICE опублікувала результати технологічної оцінки анакінри у листопаді 2003 (ТА 72)9. Комітет, який проводив оцінку, не міг рекомендувати анакінру, виходячи із співвідношення клінічних переваг та ефективності витрат, вартість на QALY перевищувала 69 000£. Комітет рекомендував проведення подальших досліджень для оцінки ефективності та безпечності анакінри протягом тривалого часу, а також порівняльні дослідження з DMARD та інгібіторами ФНП. В межах даного керівництва ГРН проводила нову оцінку анакінри.
7.3.10. Вступ (клініко-методологічні аспекти)
Був проведений пошук досліджень, в яких вивчали ефективність та безпечність анакінри окремо чи в комбінації з іншими DMARD, порівняно з плацебо чи з іншими препаратами, на основі оцінки симптомів, функціональної здатності, якості життя та здатності препарату позитивно впливати та структурні зміни, викликані РА. Дослідження обирали у відповідності з критеріями, які використовувалися NICE при оцінці анакінри318, оскільки метою даного дослідження була саме повторна оцінка попереднього аналізу. Розглядалися усі дослідження, які були опубліковані після завершення аналізу NICE. Були знайдені два РКД319, 320, які відповідали критеріям. Робота Cohen319 вже була включена до аналізу NICE, однак в ній були представлені додаткові результати. ГРН мала мету встановити тривалий вплив анакінри на пацієнтів з РА; були знайдені 3 додаткові роботи, які були продовженнями РКД. Одне з них321 було виключене, оскільки в ньому вказувалися лише побічні ефекти, друге та третє322, 323 були продовженнями одного дослідження, однак в них були представлені різні результати. Тому вони були включені як окремі роботи.
2 РКД319, 320 були подвійними сліпими (але ІТТ аналіз не був проведений) дослідженнями у паралельних групах, в них оцінювали пацієнтів, які паралельно продовжували звичайне лікування МТ.
Перше РКД (Cohen et al.)319 включало 6 гілок, в яких порівнювали анакінру з плацебо у N = 419 пацієнтів. Пацієнти отримували раз на день анакінру (5 груп з дозуванням від 0,04 мг/кг до 2,0 мг/кг) чи плацебо (1 група) протягом 12 чи 24 тижнів. Друге РКД (Genovese et al.)320 включало 3 гілки, в яких порівнювали анакінру + біопрепарат порівняно з біопрепаратом окремо у 244 пацієнтів. Пацієнти отримували анакінру (100 мг 4 рази/тиждень) + біопрепарат (2 групи: етанерцепт 25 мг 1 та 2 рази/тиждень) порівняно з біопрепаратом (1 група: етанерцепт, 25 мг двічі/тиждень) протягом 24 тижнів лікування та з 4-тижневим періодом спостереження після завершення лікування чи після передчасної відмови від участі.
У продовженні дослідження322, 323 приймали участь пацієнти, які з початку були рандомізовані у групи для прийому анакінри чи плацебо протягом 24 тижнів лікування. У фазі продовження (яка тривала 52 тижні, тобто загальна тривалість дослідження становила 76 тижнів) усі пацієнти приймали анакінру (30 мг, 75 мг, 150 мг). Пацієнти в групі плацебо були рандомізовані для прийому анакінри, а ті, які вже її приймали, продовжили приймати ту дозу, для прийому якої були раніше рандомізовані (30 мг, 75 мг, 150 мг). Результати наведені для 48 тижня (тобто 24 тижні у фазі продовження).
7.3.11. Аналіз ефективності витрат
Аналіз ефективності витрат формально не проводився, оскільки вже був проведений під час попередньої оцінки NICE. Вартість та клінічна ефективність препарату не змінилися у достатній мірі, щоб терапія стала рентабельною9.
7.3.12. Результати клінічних досліджень
Анакінра — продовження досліджень (усі дослідження отримали 3 рівень достовірності)
Симптоми
Під час продовження досліджень322, 323 на 48 тиждень (24 тижні у фазі продовження лікування анакінрою) було виявлено наступне:
— В оригінальній групі плацебо доля пацієнтів, які досягли відповіді за ACR20 (р = 0,007), була вірогідно вищою, було достовірно вищим також її збереження (р < 0,001) порівняно з 24 тижнем. Щодо окремих доз анакінри, не було зареєстровано достовірної різниці у кількості пацієнтів, які досягли ACR20 порівняно з 24 тижнем. Однак була виявлена достовірна різниця у кількості пацієнтів, які утримали ACR20 після прийому анакінри в дозі 75 мг (р = 0,016) та 150 мг (р = 0,022).
— В оригінальній групі плацебо відповідь ACR50 збільшилась порівняно з 24 тижнем, а ACR70 залишилася без змін.
— В оригінальній групі плацебо було достовірне покращення порівняно з 24 тижнем за наступними симптомами: кількість набряклих суглобів (р < 0,001), кількість болючих суглобів (p < 0,001), біль (р < 0,005), С-реактивний білок (р < 0,005), швидкість осідання еритроцитів (р < 0,001). Достовірні покращення були зареєстровані для індивідуальних доз анакінри порівняно з 24 тижнем для 30 мг: С-реактивний білок (р < 0,05), швидкість осідання еритроцитів (р < 0,005); для 75 мг: кількість набряклих суглобів (р < 0,05), кількість болючих суглобів (р < 0,005), швидкість осідання еритроцитів (р < 0,001); анакінра 150 мг: кількість набряклих суглобів (р < 0,005), кількість болючих суглобів (р < 0,05).
— В усіх оригінальних групах, які приймали анакінру, порівняно з 24 тижнем була встановлена несуттєва різниця у долі пацієнтів, які досягли відповіді ACR20 чи утримали ACR20. Була встановлена також несуттєва різниця для кожної з індивідуальних доз анакінри. ACR50 зросла порівняно з 24 тижнем, однак ACR70 не змінилася.
— В усіх оригінальних групах, які приймали анакінру, порівняно з 24 тижнем не було встановлено достовірної різниці у кількості набряклих суглобів, болючих суглобів, інтенсивності болю, кількості С-реактивного білка (р < 0,005) та швидкості осідання еритроцитів. В групі, яка приймала 150 мг анакінри, було встановлено суттєве погіршення відчуття болю (р < 0,05).
У продовженні дослідження322, 323 на 48 тиждень (24 тижні у фазі продовження лікування анакірною) було виявлено наступне:
— Достовірно менше ушкоджень суглобів в усіх групах (оригінально рандомізованих для прийому плацебо чи анакінри) порівняно з 24 тижнем (р < 0,001).
— В оригінальній групі плацебо було виявлене достовірне зниження рентгенологічного рахунку за шкалою Шарпа, вираженості ерозій за модифікованою шкалою Шарпа, звуження суглобових щілин за модифікованою шкалою Шарпа для всіх доз анакінри (р < 0,001).
— В оригінальних групах, які приймали анакінру, TMSS та модифікований раунок ерозій за Шарпом були достовірно нижче для більш високих доз анакінри (75 та 150 мг/день) при відсутності достовірної різниці для дози 30 мг/день та для рахунку звуження суглобової щілини по модифікованій шкалі Шарпа для всіх доз препарату.
Функція
У продовженні дослідження322, 323 на 48 тиждень (24 тижні у фазі продовження лікування анакірною) було виявлено наступне:
— В оригінальній групі плацебо було виявлено достовірне покращення порівняно з 24 тижнем для рахунку HAQ (р < 0,001). Для індивідуальних доз анакінри було достовірне покращення порівняно з 24 тижнем для дози 30 мг: HAQ (p < 0,005); 150 мг: HAQ (p < 0,005).
— В усіх оригінальних групах, які приймали анакінру, порівняно з 24 тижнем було виявлено суттєве погіршення рахунку HAQ (р < 0,05). В групі, яка приймала 150 мг анакінри, було виявлено достовірне зниження рахунку HAQ (p < 0,05).
Загальна оцінка
У продовженні дослідження322, 323 на 48 тиждень (24 тижні у фазі продовження лікування анакінрою) було виявлено наступне:
— В оригінальній групі плацебо було виявлено суттєве покращення загальної оцінки пацієнтом (p < 0,05) та лікарем (p < 0,05) порівняно з 24 тижнем. Для індивідуальних доз анакінри достовірні покращення порівняно з 24 тижнем були виявлені для дози 30 мг: загальна оцінка пацієнтом (p < 0,05).
— В усіх оригінальних групах, які приймали анакінру, порівняно з 24 тижнем було виявлено достовірне погіршення загальної оцінки активності хвороби пацієнтом та лікарем. У групі, яка приймала 150 мг препарату, було виявлено достовірне погіршення загальної оцінки активності хвороби пацієнтом.
Відмови від участі
У продовженні дослідження322, 323 на 48 тиждень (24 тижні у фазі продовження лікування анакінрою) було виявлено наступне:
— Частота відмов була такою ж, як і до 24 тижня.
— Кількість відмов через побічні ефекти не змінилася.
— Загострення артриту було однією з основних причин відмов через побічні ефекти.
Анакінра порівняно з плацебо
Функція
— В одному РКД319 (N = 419) було виявлено, що відповідно до HAQ-DI (зміна порівняно з початковим рівнем) анакінра в дозі 1,0 мг/кг та 2,0 мг/кг була достовірно краще, ніж плацебо на 12 (1,0 мг: –0,35, р < 0,05; 2,0 мг: –0,39, р < 0,01) та 24 тиждень дослідження (1,0 мг: –0,37, р < 0,05; 2,0 мг: –0,51, р < 0,01). Однак різниця між дозами 0,04 мг/кг, 0,1 мг/кг, 0,4 мг/кг та плацебо була недостовірною. Рівень 1+
— В тому ж РКД319 (N = 419) було продемонстровано, що доля пацієнтів, в яких були відсутні погіршення функціональних можливостей (HAQ-DI = 0), була достовірно вищою в групі, яка приймала анакінру 1,0 мг/кг, порівняно з плацебо на 24 тижні, в кінці дослідження (18,6 % та 5,4 % відповідно, р < 0,05; OR 4,76, 95% ДІ 1,1–20,0). Однак різниця між дозами 0,04мг/кг, 0,1 мг/кг, 0,4 мг/кг, 2,0 мг/кг та плацебо була недостовірною. Рівень 1++
Анакінра + біопрепарат порівняно з біопрепаратом окремо
Симптоми (усі рівні 1+)
— В одному РКД320 (N = 244) було виявлено, що етанерцепт достовірно краще, ніж анакінра + етанерцепт, один раз/тиждень (68 % та 51 % відповідно; OR 1,98, 95% ДІ 1,05–3,78; р = 0,037) впливав на відповідь ACR20 через 24 тижні (кінець лікування). Однак достовірної різниці між етанерцептом та анакінрою + етанерцепт (двічі/тиждень) виявлено не було.
— В тому ж РКД320 (N = 244) було виявлено, що немає достовірної різниці між етанерцептом та анакінрою + етанерцепт (один раз/тиждень чи двічі/тиждень) у відповіді ACR50 через 24 тижні (кінець лікування). В тому ж РКД320 (N = 244) не було виявлено достовірної різниці між етанерцептом та анакінрою + етанерцепт (один раз/тиждень чи двічі/тиждень) у відповіді ACR70 через 24 тижні (кінець лікування).
— В тому ж РКД320 (N = 244) було виявлено, що етанерцепт краще, ніж анакінра + етанерцепт один раз/тиждень (79 % та 73 % відповідно) впливав на відповідь за EULAR через 24 тижні (кінець лікування).
— В тому ж РКД320 (N = 244) було виявлено, що етанерцепт мав такий же вплив, як анакінра + етанерцепт, один раз/тиждень (39 % та 40 % відповідно) та двічі/тиждень (39 % та 41 %, відповідно) на рахунок DAS через 24 тижні (кінець лікування).
Побічні ефекти
— В одному РКД320 (N = 244) було виявлено, що за кількістю серйозних побічних ефектів, кількістю інфекцій та кількістю серйозних інфекцій етанерцепт був кращим за анакінру + етанерцепт раз/тиждень та двічі/тиждень на 24-му тижні (кінець лікування). Рівень 1+
Відмови від участі
— В одному РКД320 (N = 244) було виявлено, що кількість відмов через побічні ефекти при прийомі етанерцепту була достовірно меншою, ніж при прийомі анакінри + етанерцепту раз на тиждень (0 % та 8,6 % відповідно, значення р відсутнє) та двічі/тиждень (0 % та 7,4 % відповідно, значення р відсутнє) на 24-му тижні (кінець лікування).
— В одному РКД320 (N = 244) було виявлено, що кількість відмов від участі при прийомі етанерцепту була меншою, ніж при прийомі анакінри + етанерцепту раз на тиждень (7 % та 12 %, відповідно) та двічі/тиждень (7 % та 20 % відповідно) на 24-му тижні (кінець лікування).
7.3.13. Висновки
— Різні дози анакінри показали свою ефективність при продовженні лікування пацієнтів, попередньо рандомізованих для прийому плацебо щодо симптомів хвороби, функціональної здатності319, 322, 323, швидкості рентгенологічного прогресування322, 323.
— Препарат добре переноситься322, 323.
— Етанерцепт окремо виявився кращим, ніж в комбінації з анакінрою, щодо деяких показників ефективності, переносимості та зменшення кількості інфекцій320.
7.3.14. Обґрунтування рекомендацій
Від часу публікації у 2003 році NICE результатів дослідження анакінри було проведено небагато досліджень високої якості. Продовження клінічних досліджень не виявили жодних фактів, які б підтвердили достовірне покращення ефективності анакінри після перших 24 тижнів лікування, чи будь-якого впливу на зниження HAQ (показник, що використовувався в економічному моделюванні NICE TA) після 24 тижнів спостереження. ГРН відмітила, що вартість анікінри знизилася, але недостатньо, щоб переглянути результати аналізу ефективності витрат, проведеного NICE.
Також було відмічено, що додавання анакінри до етанерцепту не впливає на ефективність, більш того, багато показників свідчили про те що, комбінація є гіршою порівняно з монотерапією з використанням етанерцепту. Прийом комбінації препаратів також пов’язаний з підвищенням числа серйозних інфекцій. ГРН вважає за можливе екстраполювати ці дані на всі інші види терапії з інгібіторами ФНП-а препаратами, оскільки всі вони мають однакову здатність підвищувати ризик виникнення інфекцій. Спираючись на результати проведеного аналізу, ГРН зробила висновок, що рекомендації попереднього аналізу залишаються справедливими, за виключенням додаткової рекомендації щодо неприпустимості призначення анакінри разом з інгібіторами ФНП-а.
Рекомендації
R25 Прийнявши до уваги усі клінічні переваги та економічно зважену ефективність, анакінра не рекомендується для лікування РА, за виключенням використання у контрольованих, тривалих клінічних дослідженнях.*
R26 Якщо різко перервати лікування пацієнтів з РА, які у даний час приймають анакінру, їх самопочуття може погіршитися. Тому терапія анакінрою повинна продовжуватися до прийняття пацієнтом разом з консультантом рішення про припинення прийому препарату.*
R27 Не рекомендується комбінована терапія РА анакінрою та інгібіторами ФНП-а.
* Ця рекомендація наведена з «Anakinra for rheumatoid arthritis». NICE technology appraisal 72. ГРН переглянула доказову базу для анакінри, але залишила рекомендації без змін.
Коментар робочої групи
На момент створення даної адаптованої клінічної настанови в Україні зареєстровано 5 лікарських засобів біологічних агентів, які призначаються для лікування РА: інфліксимаб, адалімумаб, етанерцепт (інгібітори ФНП-а), тоцилізумаб (інгібітор ІЛ-6), ритуксимаб (анти-СD-20).
Інгібітори ІЛ-1 в Україні не зареєстровані, тобто даний розділ не може прийматися до уваги при призначенні хворому на РА терапії біологічними агентами.
На момент створення Клінічної настанови NICE пункт 7.3 «Біопрепарати» було доповнено щодо використання Тоцилізумабу у хворих з РА (Tocilizumab for the treatment of rheumatoid arthritis (rapid review of technology appraisal guidance 198). — NICE. — Feb. 2012. — TA247):
1. Тоцилізумаб в комбінації з метотрексатом рекомендується в якості опції для лікування ревматоїдного артриту у дорослих, якщо:
— відповідь на хворобомодифікуючі протиревматичні препарати (БПЗП) є незадовільною і Тоцилізумаб використовується так, як описано для лікування з використанням інгібіторів ФНП — адалімумаб, інфліксимаб, етанерцепт для лікування ревматоїдного артриту (Настанова з оцінки технологіЇ NICE 130), зокрема стосовно рекомендацій щодо активності захворювання та вибору методу лікування, або
— відповідь на БПЗП та інгібітор ФНП є незадовільною і хворий не може отримати ритуксимаб через протипоказання до ритуксимабу або тому, що прийом ритуксимабу було припинено через несприятливі події, і Тоцилізумаб використовується так, як описано для лікування з використанням інгібіторів ФНП — адалімумаб, інфліксимаб, етанерцепт для лікування ревматоїдного артриту після невдалого застосування інгібітору ФНП (настанова з оцінки технології NICE 195), зокрема стосовно рекомендації щодо активності захворювання, або
— відповідь на один або більше інгібіторів ФНП та ритуксимабу є незадовільною та
— виробник надає Тоцилізумаб зі знижкою, що є частиною схеми переходу хворого на нову схему лікування.
2. Пацієнти, які в даний час отримують Тоцилізумаб для лікування ревматоїдного артриту та не відповідають критеріям, зазначеним у п. 1, повинні мати можливість продовжувати лікування, поки вони та їх лікарі не вважатимуть за доцільне його припинити.
7.4. Контроль симптомів
7.4. А Анальгетики
7.4.1. Вступ (клінічні аспекти)
Коли хворих на РА просять визначити пріоритети у лікуванні хвороби, на першому місці майже завжди опиняється полегшення болю. Біль є основною ознакою запалення, тому адекватний контроль хвороби означає також звільнення від больових відчуттів багатьох хворих на РА. Однак не всім хворим вдається полегшити симптоми або вони можуть відчувати механічний біль через пошкодження суглобів або оточуючих структур. Анальгетики використовуються усіма хворими на РА у той чи інший час протягом хвороби. Основними питаннями є:
— Чи допомагають анальгетики для зняття болю при РА?
— Чи є побічні ефекти від прийому анальгетиків, які можуть бути проблемою для хворих на РА?
— Чи допомагає додавання анальгетиків до інших знеболюючих (переважно НППЗ) краще контролювати больові відчуття?
— Чи кращі анальгетики порівняно з НППЗ щодо певних аспектів контролю болю?
— Чи існують докази, які б обґрунтовували доцільність використання низьких доз антидепресантів у хворих з РА, базуючись на їх використанні при лікуванні інших хвороб, пов’язаних з хронічним болем?
7.4.2. Вступ (клініко-методологічні аспекти)
Був проведений пошук досліджень, в яких з’ясували ефективність та безпечність анальгетиків, базуючись на полегшенні симптомів, покращенні функціональних можливостей та якості життя пацієнтів з ранньою та розгорнутою стадіями ревматоїдного артриту. Через велику кількість досліджень анальгетиків роботи включали відповідно до наступних критеріїв: об’єктом виступали хворі з Великобританії; якщо вибірка була змішаною, доля РА повинна була складати > 75 % або повинна була бути виділена окрема підгрупа РА для аналізу; розмір вибірки для опіатів чи порівнянь опіат–парацетамол повинен був становити > 50; для порівнянь антидепресантів були виключені роботи, в яких пацієнти вже мали депресію або приймали дози антидепресантів, більші за ті, що використовуються в клінічній практиці для аналгезивного ефекту. Були знайдені 8 досліджень324–331, які відповідали критеріям. Були знайдені дослідження, в яких досліджували опіати, опіати + парацетамол, НППЗ + парацетамол, антидепресанти та інші анальгетики (нефопам). Не було знайдено досліджень, в яких досліджували лише парацетамол. Усі дослідження були добре методично обґрунтовані.
Зауваження: в усіх знайдених дослідженнях пацієнти мали або розгорнуту стадію РА, або тривалість хвороби вказана не була, не було знайдено жодного дослідження, в яких приймали участь пацієнти з ранньою стадією РА.
Опіати та опіати-парацетамол
Було знайдене 1 РКД324 та два дослідження серії випадків (проспективні)325, 326, які відповідали критеріям для опіатів та анальгетиків, що містять опіати-парацетамол. РКД324 було подвійним сліпим дослідженням у паралельних групах, в яких досліджували використання опіатів чи анальгетиків, що містять опіати-парацетамол, для лікування пацієнтів з розгорнутою стадією РА, або з РА, тривалість якого не була вказана. Порівнювали 2 різні гілки (кодеїн 90 мг/день + парацетамол 1500 мг/день + диклофенак 50 мг раз/день порівняно з диклофенаком 100 мг/день) у 60 пацієнтів з РА протягом 7-денної фази лікування.
У двох дослідженнях серії випадків325 досліджували фентаніл (трансдермально) та порівнювали результати лікування з вихідним рівнем. В першому дослідженні серії випадків325 обстежено 104 пацієнтів (тривалість хвороби не вказана), що приймали учать у фазі лікування тривалістю 28 днів, в другому 226 пацієнтів з розгорнутою стадією РА приймали участь у фазі лікування тривалістю 30 днів та 12 місяців.
НППЗ + парацетамол
Були знайдені 2 РКД327, 328 (обидва подвійні сліпі, ІТТ аналіз відсутній, N = 20 пацієнтів), в яких досліджували НППЗ + парацетамол. Перше РКД328 було дослідженням у паралельних групах, в яких порівнювали 2 різні гілки лікування (індометацин 50 мг/день + парацетамол 4 г/день порівняно з індометацином 150 мг/день) протягом фази лікування тривалістю 4 тижні. Друге РКД327 було перехресним дослідженням, в якому порівнювали 6 різних гілок дослідження (напроксен 500 мг/день, 1000 мг/день чи 1500 мг/день + парацетамол 4 г/день порівняно з напроксеном 500 мг/день, 1000 мг/день чи 1500 мг/день) протягом фази лікування тривалістю 2 тижні.
Антидепресанти
Були знайдені два РКД329, 331 (обидва подвійні сліпі, ІТТ аналіз відсутній, тривалість хвороби не вказана), в яких досліджували анальгетичний ефект антидепресантів. Перше РКД329 було перехресним дослідженням, в якому приймали участь 256 пацієнтів та порівнювалися 3 гілки: амітриптилін (1 мг/кг/день протягом 3 днів, потім 1,5 мг/кг/день) порівняно з тразодоном (1,5 мг/кг/день протягом 3 днів, потім 3 мг/кг/день) та порівняно з плацебо протягом фази лікування тривалістю 7 тижнів. Друге РКД331 було дослідженням у паралельних групах, в якому приймали участь 36 пацієнтів та порівнювалися 2 гілки: амітриптилін (25 мг/день для першого тижня, потім 50 мг/день протягом 2-го тижня і 75 мг/день надалі) порівняно з плацебо протягом фази лікування тривалістю 12 тижнів.
Інші анальгетики
Було знайдене 1 РКД330, в якому досліджували інші анальгетики. РКД було подвійним сліпим, перехресним дослідженням (ІТТ аналіз проведений не був), в якому приймали участь 27 пацієнтів з розгорнутою стадією РА та порівнювали нефопам 180 мг/день та плацебо протягом фази лікування тривалістю 4 тижні.
7.4.3. Визначення ефективності витрат
Не було знайдено досліджень, присвячених визначенню ефективності витрат.
7.4.4. Клінічні результати
Опіати та опіати-парацетамол
Симптоми, функція, якість життя, загальна оцінка самопочуття
— В 1 РКД332 було виявлено, що опіат Sativex достовірно краще, ніж плацебо, щодо: DAS, біль при рухах та у спокої, якість сну та SF-MPQ. Не було виявлено достовірної різниці стосовно ранкової скутості та SF-MPQ показників загального болю у даний момент та інтенсивності болю у даний момент. Рівень 1+
— В одному РКД324 продемонстровано відсутність різниці між кодеїном + парацетамол + диклофенак порівняно з диклофенаком щодо: біль (ВАШ), ранкова скутість, індекс Рітчі, оцінка пацієнтом ефективності, оцінка лікарем переносимості та кількість прокидань уночі по шкалі недієздатності. Рівень 1+
— В одному проспективному дослідженні326 було виявлено, що лікування фентанілом (трансдермально) порівняно з початковими показниками достовірно краще впливає на наступні показники: ADLs, соціальна активність, інтенсивність болю, проблеми зі сном через біль, якість сну, задоволення лікуванням болю через 30 днів; покращення загального самопочуття через 30 днів та задоволеності, інтенсивності болю, ADLs та соціальної активності зберігалось стабільними через 12 місяців та 85 % симптомів зникли наприкінці дослідження. Рівень 3
— В одному проспективному дослідженні325 було виявлено, що лікування фентанілом (трансдермально) порівняно з початковими показниками достовірно краще впливає на наступні показники: контроль болю, біль за WBPI, біль, зазначений у щоденнику пацієнта, оцінка лікування пацієнтом, бал по шкалі HAQ та компонентам HAQ стосовно прийому їжі, активності та підйомів. Рівень 3
Використання препаратів невідкладної терапії, відмови від участі та побічні ефекти
— В 1 РКД332 було виявлено, що опіат Sativex достовірно краще, ніж плацебо, стосовно відмови від участі через побічні ефекти та серйозні побічні ефекти та має такий же вплив на нудоту та болі, пов’язані з артритом. Рівень 1+
— В одному РКД324 була продемонстрована невірогідна різниця між кодеїном + парацетамол + диклофенак порівняно з диклофенаком у впливі на наступні показники: побічні ефекти та відмови через побічні ефекти. Рівень 1+
— В одному проспективному дослідженні325 було виявлено, що серед пацієнтів, які отримували лікування фентанілом (трансдермально), 27 % відмовилися від участі через побічні ефекти, 65 % мали побічні ефекти, але серйозні побічні ефекти були відсутні. Рівень 3
— В одному проспективному дослідженні326 було виявлено, що серед пацієнтів, які приймали лікування фентанілом (трансдермально), 17 % мали побічні ефекти, 10 % відмовилися від участі через побічні ефекти і 40 % використовували препарати невідкладної терапії. Рівень 3
НППЗ + парацетамол
— В одному РКД328 була виявлена невірогідна різниця між індометацином + парацетамол та індоментацином окремо у впливі на наступні показники: ранковий біль (ВАШ), нічний біль, ранкова скутість, рухливість суглобів, оцінка пацієнтом терапевтичної ефективності та суглобовий індекс Рітчі. У двох групах були подібні значення швидкості осідання еритроцитів, С-реактивного білка та число побічних ефектів. Рівень 1+
— В одному РКД327 було виявлено, що напроксен в дозі 500 мг/день + парацетамол достовірно краще, ніж напроксен (500, 1000 та 1500 мг/день), впливає на наступні показники: суглобовий індекс, біль у суглобах, ранкова скутість та загальна оцінка активності хвороби. Була виявлена невірогідна різниця стосовно ADLs. Рівень 1+
— В тому ж РКД327 було виявлено, що напроксен в дозі 1000 мг/день + парацетамол достовірно краще, ніж напроксен (500, 1000 та 1500 мг/день), впливає на наступні показники: кількість болючих суглобів (Рітчі); ранкова скутість; біль у спокої та при рухах (ВАШ) та загальна оцінка активності хвороби. Рівень 1+
— В тому ж РКД327 було виявлено, що напроксен в дозі 500 мг/день + парацетамол достовірно краще, ніж напроксен (1000 мг/день), впливає на наступні показники: кількість побічних ефектів. Більш того, побічні ефекти були достовірно пов’язані з дозою напроксену. Рівень 1+
Коментар робочої групи
Sativex — торгова назва лікарського засобу з діючою речовиною екстракт конопель (канабіс), який призначається для лікування спастичних станів при розсіяному склерозі. Станом на 01.11.2013 р. в Україні лікарські засоби, що містять канабіс, не зареєстровані.
Антидепресанти
— В одному РКД329 було виявлено, що амітриптилін достовірно краще, ніж плацебо, впливає на наступні показники: інтенсивність болю, найвища інтенсивність болю, кількість болючих суглобів, сумарний рейтинг вираженості болю та чутливості суглобів, але різниця у показнику найменшого болю (ВАШ) виявилась невірогідною. Невірогідною також виявилась різниця в обмеженні фізичних можливостей. Рівень 1+
— В тому ж РКД329 було виявлено, що тразодон достовірно краще, ніж плацебо, впливає на стан депресії. Однак була виявлена невірогідна різниця для показників найменш інтенсивного болю (ВАШ) та обмеження фізичних можливостей. Рівень 1+
— В одному РКД331 була виявлена несуттєва різниця між амітриптиліном та плацебо на 12 тижні у показниках болю та болючості суглобів. Між групами були подібні показники у загальній кількості відмов (N = 4), кількості відмов через побічні ефекти (N = 2 та N = 3 відповідно) та кількості відмов через недостатню ефективність (N = 2 та N = 1 відповідно). Рівень 1+
Інші анальгетики
— В одному РКД330 було виявлено, що нефопам достовірно краще, ніж плацебо, впливає на наступні показники: біль, ранкова скутість, сила стискання, болісність суглобів. Однак він викликав більшу кількість побічних ефектів, а різниця у швидкості осідання еритроцитів була недостовірною. Рівень 1+
7.4.5. Висновки
— Було знайдено лише кілька клінічних досліджень анальгетиків при РА, виконаних на належному рівні. Більшість досліджень були короткотривалими, в деяких була невелика вибірка учасників.
— Багато анальгетиків є корисними для симптоматичного лікування РА (зниження болю, кращий сон, покращення щоденної активності, соціальної активності, задоволення препаратом)325, 326, 330, 332.
— Анальгетики добре переносяться325, 326, 332.
— В деяких дослідженнях демонструється зменшення симптомів «запалення», таких як ранкова скутість та сила стискання324, 330.
— Амітриптилін (у достатньо великих дозах) успішно знижує набряк суглобів, покращує настрій та полегшує відчуття хронічної втоми329.
— Відсутні докази, які б підтверджували корисність низьких доз амітриптиліну протягом 3-місячного дослідження331.
— Диклофенак 100 мг не має переваг над комбінацією диклофенак 50 мг + парацетамол + кодеїн324.
— Індометацин 150 мг не має переваг над комбінацією індометацин 50 мг + парацетамол328.
— Додавання парацетамолу до напроксену дозволяє краще контролювати біль327.
7.4.6. Обґрунтування рекомендацій
Не зважаючи на те, що доказів користі анальгетиків при РА небагато, ГРН вважає, що існуючих даних достатньо для того, щоб підтвердити їх ефективність у контролі болю, і тому вони можуть бути рекомендовані, якщо інші підходи виявилися неефективними щодо знеболення. Крім того, зважаючи на необхідність прийому НППЗ та інгібіторів ЦОГ-2 в найнижчих ефективних дозах та протягом найкоротших проміжків часу (див. рекомендацію 29), варто підкреслити, що анальгетики можуть вважатися одним із шляхів для зниження використання цих препаратів.
ГРН також відмітила, що, незважаючи на широке використання низьких доз антидепресантів у клінічній практиці для лікування болю та порушень сну у пацієнтів з РА, відсутні докази, які б це підтвердили, за виключенням свідоцтв самих пацієнтів та їх лікарів. Для вивчення цього питання рекомендується проведення подальших досліджень.
Рекомендації
R28 Анальгетики (наприклад, парацетамол, кодеїн чи комбіновані препарати) можуть бути запропоновані хворим на РА, яким не вдається досягти адекватного контролю болю, щоб знизити їх потребу у тривалому лікуванні нестероїдними протизапальними засобами (НППЗ) чи інгібіторами циклооксигенази-2 (ЦОГ-2).
7.4.В. Нестероїдні протизапальні засоби (НППЗ)
7.4.8. Вступ (клінічні аспекти)
НППЗ (наприклад, ібупрофен, диклофенак, напроксен) та інгібітори ЦОГ-2 (наприклад, рофекоксиб, целекоксиб та еторикоксиб) мають протизапальні та аналгезивні властивості, багато хворих на РА можуть підтвердити їх ефективність щодо симптомів захворювання. Так, якість життя багатьох хворих суттєво погіршилася би при неможливості продовження лікування НППЗ, які вони можуть потребувати у значних дозах протягом багатьох років. Дані, які б підтверджували модифікуючий вплив НППЗ на перебіг РА, відсутні, ці препарати мають виключно симптоматичну дію.
Вже досить давно стало зрозумілим, що НППЗ мають значні недоліки, а саме були отримані докази їх високої токсичності, особливо по відношенню до шлунково-кишкового тракту, а також по відношенню до інших систем (ниркова недостатність, погіршення перебігу астми), їх взаємодії з іншими препаратами, які часто призначаються (варфарин, діуретики, інгібітори АПФ). Для зменшення смертності через побічні ефекти з боку ШКТ були розроблені селективні інгібітори ЦОГ-2, існують докази, які підтверджують їх переваги щодо впливу на ШКТ. Однак інгібітори ЦОГ-2 можуть призводити до дисбалансу у співвідношенні простацикліну та тромбоксану, а також приводять до підвищення рівнів серцево-судинної захворюваності та смертності. В дослідженні VIGOR були продемонстровані чіткі та ранні розходження між рофекоксибом та напроксеном у здатності викликати побічні ефекти з боку серцево-судинної системи, і, врешті, виникла необхідність відмінити рофекоксиб через переважання токсичності над його ефективністю. Дані по целекоксибу є неоднозначними, у деяких дослідженнях був виявлений підвищений серцево-судинний ризик, в інших дослідженнях та обзорах підтверджено відсутність підвищення ризику. В дослідженні MEDAL була продемонстрована відсутність впливу прийому еторикоксибу на ризики серцево-судинної смертності порівняно зі звичайними НППЗ, однак інгібітор ЦОГ-2 асоціювався зі збільшенням вираженості периферичних набряків та гіпертензії. Останні дослідження свідчать про підвищення серцево-судинного ризику при прийомі усіх НППЗ незалежно від їх ЦОГ-2 специфічності, і регуляторні органи в усьому світі наголошують на потребі у додатковій увазі перед використанням цих препаратів. Тому слід вважати, що усі НППЗ та інгібітори ЦОГ-2 мають однаковий вплив на серцево-судинний ризик. Приймаючи до уваги викладені факти, було б зрозумілим, якби пацієнти уникали прийому НППЗ та інгібіторів ЦОГ–2, але це означало б відмову від препаратів, які дозволяють ефективно контролювати симптоми захворювання. Звичайно, слід пересвідчитися, що хворим на РА не протипоказані ці препарати з будь-якої причини. Якщо їх використання є виправданим, відповідно до існуючих рекомендацій від регуляторних органів слід використовувати найнижчі дози протягом найкоротшого часу. Це також стосується використання препаратів, для яких не доведена їх роль у лікуванні самої хвороби. На ранніх стадіях РА можуть знадобитися високі дози НППЗ для симптоматичного лікування, але якщо необхідність в таких препаратах зберігається, це є свідченням того, що контроль над хворобою є недостатнім. Свідченнями ефективності DMARD є зниження необхідності в НППЗ, що необхідно регулярно перевіряти під час хвороби. ГРН мала завдання поновити дані існуючого аналізу інгібіторів ЦОГ-2, розглянути висновки, зроблені колегами в Настанові NICE щодо остеоартрозу, та визначити, чи призводять фактори, пов’язані з різницею у ефективності чи токсичності, до висновків, які не співпадають з висновками щодо остеоартрозу. Основними питаннями були:
— Яка клінічна та економічна ефективність НППЗ та ЦОГ-2 у зниженні симптомів РА?
— Які ризики пов’язані з використанням НППЗ та ЦОГ-2 при РА?
— Чи існують відмінності у клінічній та економічній ефективності, а також токсичності НППЗ та ЦОГ-2 при лікуванні РА?
— Чи існують відмінності між окремими препаратами в межах класу в токсичності, клінічній та економічній ефективності при лікуванні РА?
— Чи є комбінація НППЗ з інгібіторами протонної помпи більш економічно обґрунтованою, ніж інгібітори ЦОГ-2?
— Чи існують обставини, при яких комбінація інгібіторів протонної помпи та інгібіторів ЦОГ-2 буде економічно обґрунтованою при лікуванні РА?
7.4.9. Вступ (клініко-методологічні аспекти)
Був проведений пошук досліджень, в яких вивчали ефективність та безпечність НППЗ та інгібіторів ЦОГ-2 у покращенні симптомів, функціональних можливостей та якості життя пацієнтів з ранньою та розгорнутою стадіями РА. Дослідження інгібіторів ЦОГ-2 обирали відповідно до критеріів, які використовувалися NICE HTA для ЦОГ-2333, оскільки метою даного керівництва було переглянути HTA. Враховували усі дослідження, опубліковані після завершенні аналізу HTA. Критерії відбору:
1. ЦОГ-2: целекоксиб, рофекоксиб, мелоксикам та етодолак.
2. Компаратори: плацебо, НППЗ, інші ЦОГ-2.
3. Дози: дозволені щоденні дози — целекоксиб (200–400 мг), рофекоксиб (не вказана для РА), мелоксикам (15 мг) та етодолак (600 мг).
4. Тривалість лікування: ≥ 4 тижні.
5. Тип дослідження: РКД/ дослідження серії випадків/метааналіз (дослідження рівня 1).
6. Розмір досліджень: N > 50 в кожній гілці.
7. Вибірка: РА (будь-яка тривалість), будь-яка країна. Дослідження, в яких вивчали рофекоксиб, виключали, оскільки даний препарат більше не має ліцензії у Великобританії.
Через велику кількість робіт, присвячених НППЗ та ЦОГ-2, не перерахованих в аналізі, вибирали лише РКД та метааналізи, опубліковані після 1997 року, в яких приймали участь хворі з Великобританії, якщо вибірка була змішаною, доля РА повинна була складати >75 % або повинна була бути виділена окрема підгрупа для РА, та проводилися наступні порівняння: НППЗ чи ЦОГ-2 порівняно з плацебо, анальгетики чи НППЗ (інші або ті ж НППЗ, включаючи різні способи прийому та дозування). В деяких дослідженнях, присвячених ЦОГ-2, також були гілки, присвячені порівнянню НППЗ та плацебо, тому вони також були включені до аналізу.
Було знайдено 12 досліджень, які відповідали критеріям (11 РКД та одне продовження РКД)334–346. Одне з РКД було опубліковане у вигляді 2 окремих робіт343, 345, в яких наводилися різні результати, тому ці дослідження враховувалися як одне. Однак посилання відбувається на обидві частини досліджень. Одне з досліджень346 було продовженням вже включеного дослідження338 та було включене окремо. Два дослідження335, 336 були виключені через методологічні недоліки.
Зауваження: в усіх знайдених дослідженнях приймали участь пацієнти з розгорнутою стадією РА, не було знайдено жодного дослідження, де приймали участь пацієнти з ранньою стадією РА.
ЦОГ-2 селективні препарати (поновлення результатів аналізу NICE)
Був знайдений один метааналіз335 та одне РКД336, які відповідали критеріям для поновлення даних NICE з ЦОГ-2 у хворих на РА. Обидва дослідження335, 336 були виключені через методологічні обмеження (гетерогенність в метааналізі, РКД не було сліпим, ІТТ аналіз проведений не був), тому жодне з досліджень не було включено для поновлення результатів аналізу NICE.
Інші ЦОГ-2
Були знайдені 2 РКД337, 338 та одне продовження РКД346, в яких вивчали інші ЦОГ-2 при РА. Обидва РКД були методологічно правильними, рандомізованими дослідженнями у паралельних групах з фазою лікування тривалістю 12 тижнів. В першому РКД337 вивчали ЦОГ-2 у 891 пацієнтів з розгорнутою стадією РА. В дослідженні порівнювали 3 різні гілки (еторикоксиб 90 мг, напроксен 1000 мг та плацебо). Гілка, в якій порівнювали напроксен та плацебо, буде описана в розділі про НППЗ. В другому РКД338 вивчали ЦОГ-2 у 816 пацієнтів з розгорнутою стадією РА. В дослідженні порівнювали 3 різні гілки (еторикоксиб 90 мг, напроксен 1000 мг та плацебо). Гілка, в якій порівнювали напроксен та плацебо, буде описана в розділі про НППЗ. В продовженні РКД наведені результати серед пацієнтів, які приймали еторикоксиб 90 мг порівняно з напроксеном 1000 мг протягом усього дослідження та його продовження (121 тиждень).
НППЗ
Були знайдені 9 РКД334, 337–345, в яких досліджували НППЗ при РА. Три з цих РКД334, 337, 338 були включені в розділ ЦОГ-2, але в них додатково порівнювалися НППЗ та плацебо, тому ці порівняння включені в даний розділ. Одне з цих РКД було опубліковане у вигляді 2 окремих робіт343, 345, в яких наводилися різні результати, тому ці дослідження враховувалися як одне. Однак посилання відбувається на обидві частини досліджень. Усі 9 РКД були рандомізовані, подвійні сліпі, достатньо великі (від N = 346 до N = 1149) дослідження у паралельних групах, в яких порівнювали напроксен 1000 мг (500 мг двічі/день) та плацебо у пацієнтів з розгорнутою стадією РА протягом фази лікування, тривалістю 12 тижнів (за виключенням 1 РКД — Geussens et al.334, в якому фаза лікування тривала 26 тижнів, та 1 РКД — Krug et al.342, в якому напроксен порівнювався з набуметоном). В деяких дослідженнях були гілки, в яких досліджувався ЦОГ-2, які були включені до попереднього розділу, присвяченого ЦОГ-2, або стосувалися ЦОГ-2, які не мають ліцензії у Великобританії. Методологічні обмеження РКД: усі, крім одного, мали рівень 1+, оскільки були подвійними сліпими, але ІТТ аналіз проведений не був. Останнє дослідження отримало рівень 1++, оскільки було сліпим та авторами був проведений ІТТ аналіз.
7.4.10. Визначення ефективності витрат
У роботі Brown et al.347 був проведений системний огляд економічної оцінки ЦОГ-2 препаратів. В огляді були знайдені 9 робіт, які включалися до оцінки. Був проведений пошук робіт, в яких проводилася економічна оцінка ефективності після аналізу NICE, але такі роботи були відсутні.
7.4.11. Клінічні доказові положення
— ЦОГ-2 селективні препарати (поновлення даних)
Відсутні дослідження, які б поновили результати аналізу NICE.
— Інші ЦОГ-2 (табл. 7.43-7.48)
— НППЗ (табл. 7.49-7.56)
7.1.12. Визначення ефективності витрат (табл. 7.57)
З десяти проаналізованих робіт єдиною економічною оцінкою ЦОГ-2, проведеною у Великобританії, була робота Brown et al.347, єдиним економічним дослідженням неселективних НППЗ — дослідження, проведене McCabe et al.350. Пряме порівняння коефіцієнтів рентабельності є неможливим через різницю у гілках порівняння, моделях оцінки, вартості та структурі системи охорони здоров’я. У трьох дослідженнях348, 351, 356 був зроблений висновок, що ЦОГ-2 є рентабельними для пацієнтів, які мають високий ризик виникнення побічних ефектів з боку ШКТ. У двох дослідженнях349, 355 був зроблений висновок, що ЦОГ-2 має переваги над неселективними НППЗ. У двох роботах348, 351 було з’ясовано, що ЦОГ-2 не є рентабельними для пацієнтів, які не мають підвищеного ризику виникнення побічних ефектів з боку ШКТ. В жодному з досліджень не проводиться аналіз ефективності витрат для окремої популяції хворих на РА.
7.4.13. Узагальнені результати відносно документальних доказів і таблиць
— НППЗ та інгібітори ЦОГ-2 є корисними для зменшення симптомів РA (кількість болючих та набряклих суглобів, біль (за ВАШ), ранкова скутість, припинення лікування через недостатню ефективність, досягнення ACR20, покращення у функціонуванні, загальна оцінка активності захворювання пацієнтом і дослідником)334, 337–339, 341, 343–345.
— Доступні дослідження НППЗ та інгібіторів ЦОГ-2 на великій кількості пацієнтів з РA, але часто вони охоплюють відносно короткі проміжки часу та пацієнтів, які задовольняють чисельним критеріям виключення, що робить їх у клінічній практиці лише частково репрезентативною вибіркою пацієнтів з РА334, 337–339, 341, 343–345.
— В обраних вибірках, які мають право увійти до випробувань НППЗ і ЦОГ-2, препарати зазвичай добре переносилися,334 хоча у деяких дослідженнях повідомлялося про підвищену частоту гіпертонії та диспепсії в активних групах337–339, 341, 343–345.
— Немає доказу, який відповідав би раніше отриманому, про наявність відмінностей за ефективністю при порівнянні одних НППЗ з іншими або інгібіторами ЦОГ-2337, 342.
— Докази відносно економічних показників застосування інгібіторів ЦОГ-2 є суперечливими, але вони можуть бути ефективними у пацієнтів із високим ризиком ускладнень з боку шлунково-кишкового тракту248, 251, 256. Жоден із розглянутих документальних доказів не є специфічним для популяції пацієнтів з РА.
7.4.14. Обґрунтування рекомендацій
Існує доказ того, що як НППЗ, так й інгібітори ЦОГ-2 є ефективними при лікуванні симптомів РА. Користь від цих препаратів потребує порівняння зі шкідливим впливом, в основному на шлунково-кишкову та серцево-судинну системи. Схоже, разом із тим, що дані не дозволяють припустити наявність чітких відмінностей між НППЗ та інгібіторами ЦОГ-2 за ефективністю, існують відмінності у профілі токсичності. Будуть окремі пацієнти, у яких ці препарати будуть протипоказані, та такі, яким слід використовувати їх з обережністю, якщо вони є переконливо ефективними. ГРН вважає, що в усіх випадках ці препарати слід використовувати у найменшій ефективній дозі протягом найкоротшого проміжку часу та скоріше «коли це необхідно», ніж регулярно. Хоча й немає специфічного клінічного випробування на доказ цього, у клінічній практиці була визнана важливою стратегія мінімізації використання цих препаратів.
У симптоматичних пацієнтів повинен бути зроблений акцент на моніторинг активності захворювання (див. розділ 8.1), і якщо пацієнти потребують високих доз НППЗ або інгібіторів ЦОГ-2 на регулярній основі, це повинно бути розглянуто як показник того, що терапія, яка модифікує перебіг захворювання, може не працювати належним чином і що можуть бути необхідні зміни у лікуванні.
ГРН усвідомлювала зміни, які було зроблено у NICE Technology Appraisal Guidance (Настанова NICE з оцінки технології) відносно інгібіторів ЦОГ-2 для пацієнтів з остеоартрозом (OA), і прийняла це до уваги при внесенні поправок для пацієнтів з РА. Було вирішено, що при порівнянні популяцій пацієнтів з РA та OA, вірогідно, ризики, пов’язані із шлунково-кишковим трактом, повинні бути подібними (за винятком ризику, збільшеного в пацієнтів з одночасно призначеними стероїдами), але ризики, пов’язані із серцево-судинною системою, повинні бути вищими в популяції пацієнтів з РA (див. розділ 8.2). Численні моделювання, які мали місце для складення настанов щодо OA, були розглянуті як такі, що навряд чи дуже відрізняються для популяції хворих з РА, і тому відносно потенційної користі одночасно призначених інгібіторів протонної помпи, які є важливим елементом аналізу рентабельності, слід зробити подібні рекомендації. Гелі НППЗ при РA мають набагато більш обмежене значення та доказову базу, ніж при OA, в основному через поліартикулярну природу захворювання. Рекомендації настанов щодо OA, які мають відношення до цього, вважалися неприйнятними для РA.
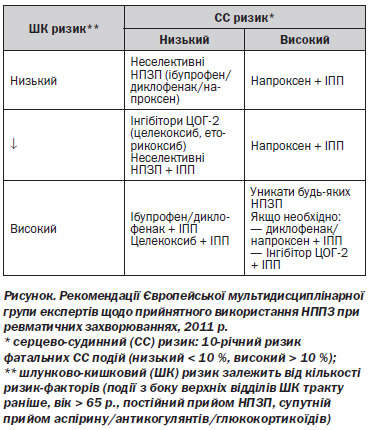
ГРН також вирішила, що повинна бути рекомендація для пацієнтів з РA, подібна до такої для пацієнтів з OA, які вже приймають супутній низькодозовий аспірин, у тому сенсі, що перед призначенням НППЗ або інгібіторів ЦОГ-2 повинні бути розглянуті інші анальгетики.
Рекомендації
R29 Пероральні НППЗ та інгібітори ЦОГ-2 повинні бути використані у найменшій ефективній дозі протягом найкоротшого можливого періоду часу.
R30 При призначенні лікування за допомогою НППЗ або інгібітору ЦОГ-2 спершу слід обрати стандартний НППЗ або інгібітор ЦОГ-2 (крім еторикоксибу в дозі 60 мг). У будь-якому випадку вони повинні бути призначені одночасно з ІПП, слід обирати препарат із найменшою покупною вартістю.
R31 Всі пероральні НППЗ та інгібітори ЦОГ-2 мають знеболюючий ефект подібної інтенсивності, який, однак, відрізняється за потенційною токсичністю для шлунково-кишкового тракту, печінки, серця та нирок; тому при виборі засобу та дози працівник охорони здоров’я повинен брати до уваги індивідуальні фактори ризику пацієнтів, у тому числі вік. При призначенні цих препаратів увагу слід приділити належній оцінці та/або поточному контролю цих факторів ризику.
R32 Якщо особа з РA потребує приймання низькодозового аспірину, працівник охорони здоров’я перед заміною чи додаванням НППЗ або інгібітору ЦОГ-2 (з ІПП), якщо купірування болю є неефективним або недостатнім, повинен розглянути інші анальгетики.
R33 Якщо НППЗ або інгібітори ЦОГ-2 не забезпечують належного контролю симптомів, слід переглянути режим прийому препаратів, які модифікують перебіг захворювання.
Коментар робочої групи
До рекомендацій R30 та R31: підбір селективного ЦОГ-2 чи неселективного НППЗ та супутньої терапії (ІПП, аспірин) має здійснюватися з урахуванням вихідних рівнів ризику з боку травної та серцево-судинної систем для конкретного хворого, що відображено в рекомендаціях Європейскої мультидисциплінарної групи експертів відносно зваженого використання НППЗ при ревматичних захворюваннях, 2011р. (Burmester G. et al. The appropriate use of non-steroidal anti-inflammatory drugs in rheumatic disease: opinions of a multidisciplinary Europеan expert panel // Ann Rheum Dis 2011; 70, № 5: 818–822).
Рисунок. Рекомендації Європейської мультидисциплінарної групи експертів щодо прийнятного використання НППЗ при ревматичних захворюваннях, 2011 р.
* серцево-судинний (СС) ризик: 10-річний ризик фатальних СС подій (низький < 10 %, високий > 10 %);
** шлунково-кишковий (ШК) ризик залежить від кількості ризик-факторів (події з боку верхніх відділів ШК тракту раніше, вік > 65 p., постійний прийом НПЗП, супутній прийом аспірину/антикогулянтів/глюкокортикоїдів)
Вказані рекомендації передбачають кількісну градацію ШК та СС ризиків і, відповідно, виділення 6 категорій хворих. СС ризик пропонується кількісно оцінювати за відомою шкалою HeartScore Європейської асоціації кардіологів (Conroy RM, et al. Eur. Heart J. 2003; 24: 987–1003, дивись рис.), а ШК ризик — залежно від кількості супутніх факторів ризику. У хворих, які не мають ШК та СС факторів ризику, можливе застосування як класичних НППЗ, так і ЦОГ-2-специфічних інгібіторів без ІПП. За наявності будь-якого фактора ШК ризику застосування класичних НППЗ без ІПП стає неприйнятним. Хворим з низьким СС та помірним ШК ризиком (відсутність чи неускладнені події з боку верхніх відділів ШК тракту в анамнезі) слід призначати інгібітори ЦОГ-2 (целекоксиб, еторикоксиб) або класичні НППЗ в поєднанні з ІПП. При комбінації низького СС ризику з високим ШК ризиком (зокрема, ускладнені події з боку верхніх відділів ШК тракту раніше) рекомендовано застосовувати інгібітори ЦОГ-2 разом з ІПП або ібупрофен/диклофенак в поєднанні з ІПП.
У пацієнтів з високим СС і низьким чи помірним ШК ризиком з усіх НППЗ можливе застосування тільки напроксену (має найкращий профіль СС безпеки), але в комбінації з ІПП, оскільки напроксен має несприятливий профіль ШК безпеки. При сполученні високого СС та ШК ризиків рекомендують уникати призначення будь-яких НППЗ; в разі клінічної необхідності допускається застосування інгібіторів ЦОГ-2 або диклофенаку/напроксену в комбінації з ІПП. Вважається, що пацієнти з підвищеним СС ризиком за відсутності протипоказань повинні приймати низькі дози ацетилсаліцилової кислоти.
Думка Європейської мультидисциплінарної групи експертів щодо хворих з високим ШК ризиком практично співпадає з висновками кокранівського огляду 39 рандомізованих клінічних досліджень по попередженню НППЗ-індукованих виразок верхніх відділів ШК тракту [Rostom A., Dube С., Wells G.A. et al. Prevention of NSAID-induced gastroduodenal ulcers. Issue 6 — 2011 // Cochrane Database Syst. Rev. — 2011. — 4: CD002296], згідно з якими у хворих високого ШК ризику з однаковим успіхом можуть застосовуватись ЦОГ-2-інгібітори чи класичні НППЗ + ІПП, хоча їх ефективність стосовно повторних виразкових кровотеч недостатня. Тому як найбезпечніша пропонується стратегія застосування ЦОГ-2-інгібітору + ІПП.
8. Моніторинг ревматоїдного артриту
8.1 Моніторинг захворювання
8.1.1. Вступ (клінічні аспекти)
Моніторинг активності хвороби при РA традиційно здійснювався суб’єктивно та базувався на інформації відносно запалення, доступній для пацієнта та працівника охорони здоров’я, таких як симптоми (біль, набряклість, тривалість ранкової скутості, лихоманка, втрата ваги) та ознаки (припухання суглобів, жар та болісність). Він може бути проведений більш об’єктивно шляхом лабораторних досліджень запальної активності, таких як С-реактивий білок (СРБ), швидкість осідання еритроцитів (ШОЕ). Було визнано, що будь-яка індивідуальна оцінка активності хвороби має обмеження. Наприклад, біль виключно усвідомлюється пацієнтами, та це усвідомлення знаходиться під впливом багатьох факторів, які виходять за межі активності захворювання. Маркери гострої фази можуть бути підвищені внаслідок іншої інтеркурентної хвороби, такої як інфекція. Жодна окрема оцінка активності хвороби задовільно не охоплює комплексність причини чи не є вільною від впливу інших оцінок, аби оцінювати лише активність РА. Тому для використання при РА були затверджені об’єднання окремих оцінок. Більшість з них бере початок у випробуваннях, але все більше використовується у клінічній практиці для об’єктивізації процесу прийняття рішення.
З причини флуктуацій та хронічної природи РA існує обмежена кількість інформації про вимірювання активності хвороби в окремий момент часу та свідчень того, що «площа під кривою»1 існуючого запалення тісно пов’язана із пошкодженнями та втратою працездатності, які накопичуються з часом. Крім того, у вимірюванні активності захворювання немає сенсу, якщо результати ігноруються. Висока активність захворювання дозволяє припустити, що контроль захворювання є неадекватним і вимагає належної реакції. Тривала низька активність хвороби чи ремісія можуть дати можливість обережно знизити дозу медикаментів (див. рекомендацію 20). У цьому розділі розглядаються найкращі методи оцінювання існуючої на даний час активності захворювання та відповідної реакції на інформацію, яку надають ці методи.
8.1.2. Вступ (клініко-методологічні аспекти)
Ми шукали дослідження, що визначали, які методи оцінки поточної активності захворювання у пацієнтів з РА є найбільш ефективними (щодо ранніх та пізніх стадій захворювання). У зв’язку із великим об’ємом доказових даних, були відібрані дослідження, які стосувалися цільової групи у Великобританії та мали об’єм вибірки N > 70. Для статей, що оцінюють випробування, впорядковане за індексом активності захворювання, були включені лише ті, які розглядали сумарні бали, а для статей, що оцінюють показники активності захворювання, показники мали бути представлені у динаміці (тобто оцінки у > 2 часових проміжках). Було знайдено три РКД242, 357, 358, один об’єднаний аналіз359, 4 — серії випадків360–363, які задовольняли критеріям включення. Методологічні обмеження включених РКД полягали у наступному: об’єднаний аналіз РКД та кластерне РКД були класифіковані як 1+, оскільки всі РКД були не сліпими, але у них був здійснений ITT-аналіз. Інші 2 РКД, класифіковані як 1++, були сліпими, і автори здійснили ITT-аналіз.
Ранній РA
Були знайдені два РКД242, 358 та одна серія випадків364. Обидва РКД були одинарними сліпими дослідженнями у паралельних групах, в яких досліджували корегування лікування з моніторингом активності захворювання. Перше РКД242 було здійснене у 111 пацієнтів, які були випадковим чином розподілені на 2 різні групи: інтенсивний моніторинг (кожного місяця) активності захворювання проти звичайного моніторингу (кожні 3 місяці) протягом 18 місяців. Друге РКД358 було здійснене у 299 пацієнтів, які випадковим чином були розподілені на 2 групи: інтенсивний моніторинг (кожного місяця) 20 % відповіді проти звичайного моніторингу (кожні 3 місяці) протягом 2 років. У дослідженні серії випадків358 вивчали моніторинг активності захворювання протягом принаймні 3 років у 110 пацієнтів.
Пізній РА
Було знайдено одне кластерне РКД357, 1 об’єднаний аналіз трьох РКД359 та 4 серії випадків360–363. Кластерне РКД357 було одинарним сліпим дослідженням у паралельних групах, в якому з’ясували корегування лікування відповідно до моніторингу активності захворювання у пацієнтів, які випадковим чином були розподілені на 2 групи: систематичний моніторинг DAS28 порівняно зі звичайним планом ведення хворих (без моніторингу/регулювання) протягом 24 тижнів. Об’єднаний аналіз359 перевіряв дані трьох РКД лефлуноміду та моніторував визначення активності захворювання протягом 1 року у 1839 пацієнтів.
4 дослідження серії випадків360–363 вивчали моніторинг визначення активності захворювання із плином часу. Дослідження відрізнялися відповідно до об’єму вибірки (діапазон від N = 71 до N = 233) та тривалості наступного спостереження (діапазон від 24 тижнів до 30 місяців).
8.1.3. Методологічне клінік-економічне обґрунтування
Статей відносно економічного аналізу охорони здоров’я виявлено не було.
8.1.4. Клінічні доказові положення
Ранній РА (табл. 8.1–8.2)
Пізній РA (табл. 8.3)
8.1.5. Узагальнені результати відносно документальних доказів
— При ранньому РА узгоджений у часі СРБ прогнозує рентгенологічне прогресування364, а середній рівень СРБ корелює із суглобовим індексом361.
— У двох дослідженнях раннього РА стратегії інтенсивного лікування з метою утримання індексу активності хвороби на низьких рівнях в основному давали кращі результати порівняно зі звичайним доглядом за більшістю показників активності захворювання, ремісією, функціональним статусом та рентгенологічним прогресуванням2, 42, 358. Подібний підхід при пізньому РА також в результаті сприяв кращому контролю захворювання357.
— При пізньому РА дослідження показали високу кореляцію між індексами активності захворювання359.
— При пізньому РА зміни в активності захворювання корелюють зі змінами у функціональному статусі362, а індекси, які поєднують декілька показників активності захворювання, демонструють більшу достовірність, ніж кращі індивідуальні показники активності захворювання360, 362.
— При пізньому РА такий індекс активності захворювання виконує свою роль краще, ніж індекс Riel та індекс Mallya для кореляцій із клінічним статусом, пошкодженням суглоба та можливістю розрізнити низьку та високу активність захворювання363.
8.1.6. Обґрунтування рекомендацій
ГРН відмітила, що не було ані індивідуального, ані складеного показника, який був би кращим, ніж будь-який інший, і здавалося логічним рекомендувати як лабораторний показник активності захворювання, такий як СРБ, так і добре обґрунтований сумарний індекс активності захворювання, такий як DAS28. Було також відмічено, що розрахунки DAS28 були обов’язковими для включення та моніторингу терапії інгібіторами ФНП-а відповідно до сучасних настанов NICE (див. розділ 10). ГРН категорично вирішила, що такі числові оцінки були кращими за описові слова, такі як «краще», «гірше». До того ж такі оцінки можуть потребувати періодичного виконання, аби давати інформацію для прийняття клінічного рішення, що може включати посилення лікування для стримування активності захворювання при наявності такої, чи, навпаки, обережного зменшення дози препарату, коли активність хвороби була визнана прийнятно низькою. ГРН була вражена доказом на користь частих (щомісячних) оцінок у пацієнтів із раннім активним захворюванням, у яких стратегії агресивного лікування, спрямованого на утримання DAS28 на низьких рівнях, давали значно кращі результати. Частий моніторинг таких пацієнтів на ранніх стадіях захворювання був визнаний важливим у контексті кращого результату, але пацієнти зі стабільним хронічним добре контрольованим захворюванням потребували б таких оцінок нечасто.
Рекомендації
R34 Слід регулярно оцінювати СРБ та ключові компоненти активності захворювання (із використанням сумарного індексу, такого як DAS28) у хворих із РА, аби отримати інформацію для прийняття рішення відносно:
— посилення лікування для контролю захворювання;
— обережного зменшення інтенсивності лікування, коли хвороба є контрольованою.
R35 У хворих із ранньою активною стадією РA слід оцінювати СРБ та ключові компоненти активності захворювання (використовуючи сумарний індекс, такий як DAS28) щомісячно, доки лікування не контролюватиме хворобу на рівні, попередньо узгодженому з хворим на РА.
8.2. Інформаційне наповнення та частота оглядів
8.2.1. Вступ (клінічні аспекти)
РA є хронічним і непередбачуваним захворюванням із флуктуаціями активності. Активність захворювання сприяє пошкодженню скелетно-м’язової та інших систем. Традиційним підходом для довготривалої терапії було спостерігати пацієнта з частотою, яку визначали:
— відповідно до проблем при будь-якому візиті (активні проблеми, які ведуть до більш частих візитів);
— практичні питання, коли клінічний простір дозволяє зробити призначення.
Такі огляди мали тенденцію фокусуватися на невідкладних проблемах, їм не вистачало системи і вони не приділяли достатньої уваги іншим, менш явним, патологічним процесам, які можуть впливати на захворюваність та смертність. Стандарти лікування ARMA пропонували передбачали щорічний огляд («ARMA Standards of Care for people with Inflammatory Arthritis» — Стандарти лікування ARMA для хворих із запальним артритом)365. Щорічний огляд міг бути використаний для впевненості у тому, що:
— статус захворювання розглянутий із використанням відповідних показників активності захворювання, ремісії та функціонального статусу;
— враховані сучасні лікарські препарати, освітні потреби, фізичні та психосоціальні питання, депресія та втомлюваність;
— має місце оцінка та скринінг ускладнень РА та інших супутніх захворювань, особливо остеопорозу та атеросклерозу.
При РА проблеми поза межами скелетно-м’язової системи можуть бути напряму пов’язані із хворобою. Для деяких пацієнтів, у яких хвороба уражає системи відмінні від скелетно-м’язової, термін РA є помилковим. Ці прояви пов’язані з:
— власне процесом запалення суглоба, таким як необоротне пошкодження шийного відділу хребта, яке викликає кісткову нестабільність і деформацію та потенціальну мієлопатію;
— запальним процесом, який відбувається в інших органах і системах, таких як очі (склерит), легені (фіброз легенів та плевральний випіт), та васкуліт.
Цей розділ розглядає дані відносно інформаційного наповнення та частоти регулярного огляду, аби гарантувати, що контроль захворювання оптимізований, а проблеми напряму чи не напряму пов’язані з хворобою належним чином оцінені та об’єктивно розглянуті, та аби гарантувати, що немає явних чи прихованих проблем, які ведуть до попереджувального впливу на якість життя пацієнта.
8.2.2. Вступ (клініко-методологічні аспекти)
Ми шукали дослідження, які вивчали питання, що повинні бути інформаційним наповненням регулярного огляду пацієнтів із пізнім РА. Внаслідок нечисленності документів були розглянуті всі типи досліджень. Було знайдено три РКД366–369, які задовольняли критеріям включення, і не було знайдено жодного дослідження, яке стосувалося регулярного огляду в контексті супутніх захворювань. Одне РКД367, 369 було опубліковано у вигляді двох окремих статей, у яких повідомлялося про різні строки наступного спостереження, і, таким чином, воно було враховано лише один раз, хоча представлені результати і включені до списку літератури обидві статті.
Пізній РА
Три включених РКД366, 367, 368 були одинарними сліпими (але не був здійснений ІТТ-аналіз) випробуваннями в паралельних групах. Перше РКД366 вивчало щорічні огляди та огляди кожні 4 місяці у 466 пацієнтів, які випадковим чином були розподілені на 2 групи: контроль симптомів/загальні умови догляду порівняно з агресивним лікуванням/лікарняними умовами. Пацієнти у групі з контролем симптомів оцінювалися за HAQ кожні 4 місяці та щорічно за OMERАCT, ORА, DAS28 та позасуглобовими проявами. Пацієнти у групі агресивного лікування оцінювалися за HAQ, ШОЕ, СРБ та за болючими/припухлими суглобами кожні 4 місяці та щорічно за OMERАCT, ORА, DAS28 та позасуглобовими проявами. Тривалість дослідження складала 3 роки. Друге РКД367, 369 вивчало огляд 209 пацієнтів, які випадковим чином були розподілені на 2 групи: загальні умови догляду лікарем загальної практики (без стандартного лікарняного огляду, але із швидким доступом на вимогу) порівняно з традиційним лікарняним доглядом (регулярний запланований огляд кожні 3–4 місяці). Тривалість випробування складала 2 роки, а наступного спостереження — 4 роки. Третє РКД вивчало огляд 132 пацієнтів, які випадковим чином були розподілені на 3 групи: спостереження лікарем загальної практики (огляд на вимогу) порівняно зі звичайним лікарняним спостереженням (огляд кожні 3 місяці) та порівняно з ОТ-спостереженням (огляд кожні 3 місяці). Тривалість випробування складала 2 роки.
8.2.3. Методологічне клініко-економічне обґрунтування
Статей щодо клініко-економічного аналізу виявлено не було.
8.2.4. Клінічні доказові положення
Пізній РА
Швидкий доступ (загальний догляд лікарем загальної практики) порівняно з регулярним оглядом кожні 3–4 місяці (традиційний лікарняний догляд)
Одне РКД367, 369 виявило, що швидкий доступ був значно кращим, ніж традиційний лікарняний регулярний огляд (кожні 3–4 місяці), за показниками болю (за ВАШ), зміни болю (за ВАШ) та оцінка власної ефективності на 2–й рік (всі р < 0,05), за ROM (правий лікоть, р < 0,05) та задоволенням і довірою пацієнта (р < 0,01) на 4-й рік. Однак за оцінкою за HAQ, рентгенологічним прогресуванням (рахунок за Larsen) і тривогою та депресією на 2-й рік і за оцінкою за HAQ, болем (за ВАШ), ранковою скутістю, ROM (лівий лікоть та обидва коліна) та думкою пацієнта про активність хвороби на 4-й рік значних відмінностей не було. Рівень 1+
Контроль симптомів порівняно з агресивним лікуванням (обидва оцінювалися принаймні кожні 4 місяці)
Одне РКД366 виявило, що на 3-й рік агресивне лікування було значно кращим, ніж контроль симптомів за оцінками активності захворювання за ORА (OR –0,40, 95% ДІ від — 0,71 до –0,10, p = 0,01). Однак за оцінкою за HAQ, загальною оцінкою пацієнтом і лікарем, кількістю болісних і напухлих суглобів, болем (за ВАШ), DAS28, рентгенологічним прогресуванням (рахунок за Larsen), оцінкою пошкодження за ORА, кількістю суглобів з ерозією та ШОЕ вірогідної різниці не було. Рівень 1+
Спостереження лікарем загальної практики (на вимогу) порівняно зі стандартним лікарняним спостереженням (кожні 3 місяці) та OT-спостереженням (кожні 3 місяці)
Одне РКД368 виявило, що OT-спостереження (кожні 3 місяці) було значно кращим, ніж спостереження лікарем загальної практики (на вимогу) та стандартне лікарняне спостереження (кожні 3 місяці) за суглобовим індексом на 2-й рік (p < 0,05). Однак за суглобовим індексом у 1-й рік, функціональною здатністю та ШОЕ у 1-й і 2-й рік значних відмінностей не було. Рівень 1+
8.2.5. Обґрунтування рекомендацій
ГРН відмітила непослідовність у доказах, пов’язаних із частотою оглядів, місцем огляду та оцінкою агресивного лікування. Було відмічено, що жоден із підходів не є універсальним для всіх; для деяких підходять регулярні огляди, тоді як деякі пацієнти можуть час від часу ініціювати такі огляди. Було, зокрема, вирішено, що у тих хворих, яким вважалося доцільним надати спостереження, ініційоване пацієнтом, скоріше, ніж стандартне регулярне спостереження, було суттєвим те, що вони були добре освічені відносно своєї хвороби і знали, коли та як отримати подальшу допомогу, наприклад, шляхом контакту із названим призначеним членом мультидисциплінарної команди (див. рекомендації у розділі 6.1). ГРН також відмітила, що було рівною мірою необхідно, щоб спостереження, ініційоване пацієнтом, було визнане адекватним, стандартний моніторинг препаратів мав бути продовженим, оскільки ці хворі у протилежному випадку можуть лише отримувати стандартний щорічний огляд.
ГРН була розчарована тим, що не було знайдено опублікованих доказів відносно складових частин, які повинні досліджуватися при спостереженні. ГРН обговорила пункти GP QOF (Quality Outcomes FРАmework — система якості та результатів) і таблицю з неопублікованих настанов BSR відносно РА, які розглядають взаємозв’язок між первинним та вторинним доглядом. Члени ГРН, які були залучені до складання настанов BSR відносно РA, відмітили недостатність доказів на підтримку інформаційного наповнення оглядів. За відсутності будь-якого доказу ГРН було вирішено, що резонним є щорічний огляд хворих (з об’єктивними оцінками активності, пошкодження та функціональної здатності), ускладнень та супутніх захворювань та що інформаційне наповнення огляду повинне включати оцінку статусу захворювання, первинну профілактику ішемічної хвороби серця, оцінку остеопорозу, засвідчення того, що пацієнт не перебуває у депресії, перевірку того, що його шийний відділ є стабільним, та перевірку інших можливо уражених органів (наприклад, очей, легенів, судин).
ГРН обговорювала, що пацієнти та працівники охорони здоров’я, які їх лікують, часто не усвідомлюють, що хворі на РA знаходяться під загрозою збільшеного серцево-судинного ризику. Клініки, що надають спеціалізовану допомогу при РA, повинні бути набагато більше поінформовані про це, і ГРН вирішила, що важливим є введення спеціалістів з РA із середньою спеціальною освітою. ГРН вирішила, що є необхідність у підвищенні поінформованості щодо зв’язку РA з коморбідними ризиками. Всі практикуючі спеціалісти потребують усвідомлення того, що лікування РA є не просто лікуванням та оцінкою власне РA, але також лікуванням супутніх захворювань — ішемічної хвороби серця, депресії та остеопорозу.
Рекомендації
R36 Запропонуйте людям із задовільно контрольованим пізнім РA призначення огляду із частотою та місцем проведення, які відповідають його потребам. Крім того, переконайтеся, що вони:
— мають можливість додаткових візитів з приводу загострення хвороби;
— знають, коли та як отримати швидкий доступ до спеціаліста, та
— мають систематичний моніторинг медикаментозного лікування.
R37 Запропонуйте пацієнтам із РA щорічний огляд для:
— оцінки активності захворювання та пошкодження і виміряйте функціональну здатність (використовуючи, наприклад, анкету оцінки стану здоров’я Health Assessment Questionnaire [HAQ]);
— перевірте розвиток супутніх захворювань, таких як артеріальна гіпертензія, ішемічна хвороба серця, остеопороз і депресія;
— оцініть симптоми, які наводять на думку про ускладнення, такі як васкуліт і захворювання шийного відділу хребта, легенів чи очей;
— організуйте належне перенаправлення у межах мультидисциплінарної команди;
— оцініть потребу у направленні на операцію (див. розділ 8.3);
— оцініть, який вплив має хвороба на життя хворого.
8.3. Вибір часу та направлення на операцію
8.3.1. Вступ (клінічні аспекти)
Незважаючи на останні досягнення у медичному забезпеченні хворих на РA, які ведуть до зменшення потреби в операції, значне число хворих із цим захворюванням все ще переходять до розвитку необоротного пошкодження суглобів та сухожилків. Для пацієнтів з необоротним або локалізованим пошкодженням скелетно-м’язової системи, яке не відповідає на лікування, хірургічне втручання може бути ефективним рішенням для полегшення болю, відновлення функціонування, попередження прогресуючої деформації та покращення якості життя. Вибір часу направлення на операцію буде, очевидно, залежати від клінічної невідкладності нагальної проблеми. Мієлопатія внаслідок тиску на шийний відділ хребта через його нестабільність може в найгіршому випадку призвести до смерті. Крім цього, її результатом може бути необоротне неврологічне пошкодження із наступною інвалідністю. Тому, очевидно, нестабільність шийного відділу, яка є причиною мієлопатії, потребує негайного втручання. На відміну від цього тиск на периферійні нерви (наприклад, синдром зап’ястного каналу) може призводити до болю та слабкості, але невідкладність втручання є меншою, ніж при тиску на шийний відділ хребта.
Окремі операції стають технічно більш складними чи мають гірші результати, якщо пошкодження прогресувало надто значно. Це є однією з причин, чому після консультації з відповідними членами мультидисциплінарної команди на початку прогресування хвороби може бути необхідною думка хірурга.
Як і у випадку будь-якого лікування, медикаментозного чи хірургічного, рішення про проведення операції має бути обговорене з пацієнтом. Потенційні ризики та переваги операції повинні бути порівняні з ризиками та перевагами продовження консервативного лікування та узгоджуватись із побажаннями проінформованого пацієнта.
Методи хірургічного втручання та анестезії значно покращилися. Ризики, пов’язані із втручанням, значною мірою знизилися, а результати більшості операцій є відмінними та мають довготривалі переваги (зокрема, заміна кульшового та колінного суглобів). Оскільки РA уражає багато суглобів, важливо, аби хірург володів знанням для оцінки всіх проблем пацієнта з РA, усвідомлював мультисистемну природу захворювання, знав препарати, які приймає пацієнт, і мав час і ресурси, аби детально оцінити пацієнтів. Незважаючи на те, що хірург повинен мати повну здатність оцінити потреби пацієнта, фізичні та психологічні, малоймовірно, що який-небудь хірург матиме набір професійних навичок, необхідний для здійснення всіх операцій, які можуть знадобитися.
У цьому розділі велика увага приділяється не типу втручання, що виходить далеко за межі призначення цих клінічних настанов, а вибору часу направлення на операцію.
8.3.2. Вступ (клініко-методологічні аспекти)
Ми шукали дослідження, які оцінювали фактори, що визначають вибір часу направлення на операцію. Внаслідок невеликого числа документів відібрані були всі типи досліджень, які стосувалися британської популяції. Було знайдено чотири перехресних дослідження370–374 та одна ретроспективна серія випадків375, які задовольняли критеріям включення. Одне дослідження370, 371 було опубліковане у вигляді 2 окремих статей, які перевіряють різні результати та різні популяції (лікарів або пацієнтів) і, таким чином, воно було враховано лише одного разу, хоча представлені результати і включені до списку літератури обидві статті.
Перше перехресне дослідження370 здійснювало спостереження за 1000 лікарів (N = 500 ревматологів і N = 500 хірургів) та 126 пацієнтами. Спостереження фокусувалося на показаннях лікарів та виборі часу різних типів хірургічного втручання з приводу ревматоїдного ураження кистей і пріоритетах та готовності пацієнта до операції. Друге перехресне дослідження373 здійснювало спостереження за 1379 пацієнтами з РA і фокусувалося на змінах, пов’язаних з ортопедичною операцією чи TJR. Третє та четверте і перехресні дослідження372, 374 здійснювали спостереження за 62 та 56 пацієнтами відповідно та фокусувалися на прогностичних факторах пацієнтів з РA, які вже були прооперовані.
Ретроспективна серія випадків375 оцінювала симптоматику 111 пацієнтів із ревматоїдною шийною мієлопатією, яким проводили МРТ чи операцію на шийному відділі хребта, або і те й інше.
8.3.3. Методологічне клініко-економічне обґрунтування
Статей відносно клініко-економічного аналізу виявлено не було.
8.3.4. Клінічні доказові положення
Всім дослідженням був наданий рівень доказовості 3 (табл. 8.5–8.7).
8.3.5 Узагальнені результати відносно документальних доказів
— Кількість документальних доказів стосовно вибору часу для направлення на операцію є недостатньою, їх якість незадовільна. Спостереження кистьових хірургів та ревматологів узгоджені відносно того, що найбільш вдалим часом для операції є стадія 3 захворювання метакарпофалангового суглоба та 3–6 місяць стійкого синовіту для тендонектомії розгинального м’яза370, 371.
— Спостереження ревматологів і кистьових хірургів виявили згоду відносно показань до артропластики метакарпофалангового суглоба (функція і біль) та відносно резекції дистального кінця ліктьової кістки (розрив сухожилка та біль у зап’ястку). Однак існує розходження у думках відносно об’єму синовектомії дрібного суглоба між кистьовими хірургами, які вважають, що прогресуючий синовіт суглоба є показанням, та більшістю ревматологів, які вважають, що це ніколи не показано370, 371.
— Більшість пацієнтів відносить функціонування руки та біль до проблем, які викликають найбільше занепокоєння370, 371, 372, і вони сподіваються, що операція усуне їх.374
— Зовнішній вигляд руки мав невелике значення при визначенні необхідності в операції в одному дослідженні370, 371, але в іншому — основними сподіваннями були покращення функціонування та зовнішнього вигляду374.
8.3.6. Обґрунтування рекомендацій
ГРН відмітила недостатність документальних доказів, які дійсно стосувалися цього питання, та вирішила, що надзвичайно малоймовірно, що які–небудь відповідні клінічні випробування могли б бути спеціально присвячені цьому питанню. Фактично ГРН вирішила, що в окремих випадках було б неетично проводити такі випробування. Було вирішено, що на даний час існує значне варіювання у показаннях до залучення хірурга у розробку плану лікування для пацієнтів, які могли б у кінцевому підсумку потребувати операції.
ГРН вирішила, що було б доречно залучати хірургів на ранніх етапах, навіть якщо операція можливо терміново не показана. Було відмічено, що оцінка необхідності направлення на операцію була вже рекомендована в якості частини щорічного огляду (див. розділ 6 та розділ 8.2.6). Було узгоджено, що існує 4 основні причини для розгляду можливості направлення на операцію:
— персистуючий біль внаслідок пошкодження суглоба чи інша пов’язана із м’якою тканиною причина, що піддається ідентифікації;
— погіршення функціонування;
— прогресуюча деформація;
— персистуючий локалізований синовіт.
Додаткові причини включають розрив сухожилка, стискання нерва, нестабільність суглоба (наприклад, шийного), інфекцію та другорядні результати рентгенографії, такі як стресовий перелом. Хоча потреба та терміновість можливого хірургічного втручання може варіювати залежно від причин, ГРН вирішила, що завжди слід отримати думку хірурга на ранніх етапах, особливо у випадках, коли результат хірургічної процедури може бути поставлений під загрозу затримкою із направленням на операцію.
При розриві сухожилка, локалізованому синовіті, який не відповідає на лікування, компресії нерва, септичному артриті та стресовому переломі було вирішено доцільним посилатися на думку хірурга до того, як пошкодження призведе до незворотних змін. Множинний розрив сухожилка, персистуючі неврологічні розлади та деформація, яка не піддається корекції, що викликають недієздатність, можуть розглядатися як невдача для команди. Для більш довготривалих проблем, таких як біль, функціонування та деформація, необхідність у направленні не є настільки терміновою, але направлення не повинне відкладатися до тих пір, доки відбудуться подальші незворотні зміни.
Було декілька випадків, наприклад шийна мієлопатія, у яких термінова дія була явно необхідною, і, незважаючи на те, що доказ відносно цього стану був із ретроспективного дослідження, ГРН вирішила, що за присутності відповідних симптомів чи ознак були б необхідні термінове МРТ та думка нейрохірурга.
ГРН відмітила, що у той же час у цілому показання до заміни суглоба для хворих із РA повинні розглядатися таким же чином, що і для хворих з OA8. Пацієнти з РA можуть бути значно молодшими та амортизація при артропластиці могла би бути набагато меншою, враховуючи поліартритичну форму їх захворювання та знижене навантаження на суглоб. Тому ГРН вирішила, що повинна бути надана особлива рекомендація, яка звертає увагу на те, що порівняно з пацієнтами з OA відносна молодість пацієнтів з РA не повинна виключати розглядання заміни суглоба.
Рекомендації
R38 Пропонуйте людям з РA звернутися до хірурга для отримання його думки на ранніх етапах, якщо будь-що з наведеного нижче не відповідає на оптимальне нехірургічне лікування:
— персистуючий біль через пошкодження суглоба чи інша пов’язана із м’якою тканиною причина, що піддається ідентифікації;
— погіршення функціонування суглоба;
— прогресуюча деформація;
— персистуючий локалізований синовіт.
R39 Пропонуйте людям із наведеними нижче ускладненнями звернутися до хірурга для отримання його думки, перш ніж пошкодження чи деформація стане незворотною:
— неминучий або фактично існуючий розрив сухожилка;
— компресія нерва (наприклад, зап’ястний синдром);
— стресовий перелом.
R40 Коли операція пропонується людям з РA, поясність, що головними* очікуваними перевагами є:
— знеболення;
— покращення функціонування суглоба чи попередження подальшого руйнування та
— попередження деформації.
R41 Запропонуйте термінове комбіноване медикаментозне та хірургічне лікування людям з РA, які мають підозру чи підтверджений септичний артрит (особливо протезованого суглоба).
R42 Якщо у людини з РA розвиваються будь-які симптоми чи ознаки, що вказують на шийну мієлопатію*:
— вимагайте термінової МРТ та
— направте на консультацію до хірурга.
R43 Не дозволяйте занепокоєнню відносно довготривалості функціонування протезованих сулобів впливати на рішення запропонувати заміну суглоба більш молодим хворим з РA.
Коментар робочої групи
Робоча група вважає, що для ефективного впровадження рекомендацій щодо моніторингу хвороби доцільним є створення міждисциплінарної групи фахівців, яка, крім ревматолога, повинна включати загального хірурга, ортопеда-травматолога, нейрохірурга та медичну сестру — координатора (спеціаліст з РА), які ознайомлені з особливостями цієї групи хворих.
9. Інші аспекти та лікування
9.1. Дієта
9.1.1. Вступ (клінічні аспекти)
Кожний працівник охорони здоров’я має знати про хворих з ревматоїдним артритом, які експериментували зі своєю дієтою і можуть засвідчити покращення в активності своєї хвороби. Окремі пацієнти, здається, мали специфічну непереносимість, коли деяка їжа чи напої викликали загострення хвороби у суглобах, і тому вони уникали їх. Інші книги та інтернет-сайти підтримують спеціальні включення чи виключення із раціону, які викликають великі сумніви щодо їхньої ефективності. Експериментування з дієтою дає людині з РA добру нагоду здійснювати контроль над важливим аспектом свого життя та визначити, чи приносять користь включені або виключені продукти. Цей розділ не фокусується на зниженні ваги, але перевіряє, чи існує який-небудь доказ на підтримку позитивного впливу спеціальних дієтичних маніпуляцій на контроль ревматоїдного артриту. У цьому огляді документальні докази впливу зниження ваги спеціально не вивчалися. Зниження ваги охоплюють клінічні настанови відносно остеоартрозу211.
9.1.2. Вступ (клініко-методологічні аспекти)
Ми шукали дослідження, які вивчали ефективність різних типів дієт або дієтичних добавок стосовно симптомів, пошкодження суглобів, функціонування та якості життя пацієнтів з РA (рання стадія та розгорнуте захворювання). Через великий обсяг документів відібрані були лише MA та РКД, які стосувалися популяції з Великобританії, та якщо вибірка була змішаною, вона повинна була мати > 75 % РA або аналіз підгрупи РA.
Було знайдено три MA376–378 та 14 РКД379–394, які задовольняли критеріям включення. Одне із цих РКД було опубліковано у вигляді трьох окремих статей389–391, в яких повідомлялися різні результати, і тому випробування було враховано лише одного разу, хоча представлені результати і включені до списку літератури всі три статті. Одне РКД394 було виключене через методологічні обмеження (не сліпе та не здійснений ITT-аналіз). Методологічні обмеження інших включених РКД і MA полягали у наступному: РКД, класифіковані як 1+, були або сліпими, а ITT-аналіз не був здійснений, або не сліпими, але ITT-аналіз був здійснений. РКД, класифіковані як 1++, були сліпими та ITT-аналіз був здійснений. MA, класифіковані як 1++, здійснювали як якісну оцінку випробувань, так і тести на гетерогенність. Досліджень, в яких брали участь пацієнти з раннім РA, знайдено не було, всі випробування проводилися у пацієнтів з розгорнутим РА, а два MA використовували випробування, здійснені на змішаній популяції (рання та розгорнута стадії РA).
Змішана вибірка (рання та розгорнута стадії РА)
Було знайдено три МА, які задовольняли критеріям і фокусувалися на РКД, що порівнювали або добавки омега-3 та риб’ячий жир377, лікування травами376, або лактовегетаріанську, сувору вегетаріанську чи середземноморську дієти378 у пацієнтів з РА.
Перший SR/MA376 включав 11 РКД, які були подвійними сліпими плацебо-контрольованими випробуваннями. Однак вони відрізнялися щодо:
— втручання — 7 РКД використовували гамма-ліноленову кислоту (GLA) (джерела: олія енотери, олія чорної смородини, олія огірочника аптечного); 1 РКД використовувало піретрум дівочий, 1 РКД використовувало трикрильник Вільфорда (Trypterygium wilfordii hook F), 1 РКД використовувало топічний капсаїцин та 1 РКД використовувало ревмалекс (Reumalex) (містить кору іви);
— розміру дослідження (діапазон від N = 20 до N = 70);
— якості дослідження — максимальна оцінка 5 (10 досліджень від задовільної до високої якості; 1 дослідження низької якості);
— тривалості дослідження — тривалості втручання (від 4 тижнів до 15 місяців).
Другий SR/MA377 включав 17 РКД, які були подвійними сліпими плацебо-контрольованими (інертна субстанція) випробуваннями. Однак вони відрізнялися щодо:
— втручання — загальна омега-поліненасичена жирна кислота (не повідомляється та діапазон від 1,7 г до 9,6 г);
— розміру дослідження (діапазон від N = 12 до N = 90);
— якості дослідження — максимальна оцінка 5 (12 досліджень від задовільної до високої якості; 5 досліджень низької якості);
— тривалості дослідження — тривалості втручання (від 1 місяця до 15 місяців).
Третій МА378 не був систематичним оглядом, але був об’єднаним аналізом 3 не сліпих плацебо-контрольованиих РКД, які відрізнялися щодо:
— плану (2 РКД паралельні; 1 РКД перехресне);
— втручання — (1 РКД середземноморська дієта порівняно із західною дієтою, 1 РКД лактовегетаріанська дієта порівняно зі звичайною, 1 РКД сувора вегетаріанська дієта порівняно з контрольним періодом);
— розміру дослідження (діапазон від N = 22 до N = 56);
— тривалості дослідження — тривалості втручання (від 9 тижнів до 4 місяців).
Пізній РА
Було знайдено чотирнадцять РКД378–393, які задовольняли критеріям включення. Одне із цих РКД було опубліковано у вигляді трьох окремих статей389–391, в яких повідомлялися різні результати, і тому випробування було враховано лише одного разу, хоча представлені результати і включені до списку літератури всі три статті. Всі 14 РКД були паралельно-груповими випробуваннями, але вони відрізнялися щодо:
— об’єму вибірки (діапазон: від N = 30 до N = 116);
— сліпого методу (6 РКД подвійні сліпі, 6 РКД одинарні сліпі, 2 РКД не сліпі/сліпий метод не згадується);
— тривалості випробування (діапазон: від 4 тижнів до 9 місяців; наступне спостереження у діапазоні від 2 місяців до 1 року після лікування);
— лікування — дієти (4 РКД — харчова непереносимість та алергія; 4 РКД — вегетаріанська чи сувора вегетаріанська дієта; 2 РКД — вітаміни та мінеральні добавки; 1 РКД — риб’ячий жир; 1 РКД — середземноморська дієта; 1 РКД — експериментальна дієта; 1 РКД — дієта з обмеженою кількістю калорій);
— режиму лікування — доза та супутнє.
9.1.3. Методологія клініко-економічного обґрунтування
Статей відносно клініко-економічного аналізу виявлено не було.
9.1.4 Клінічні доказові положення
Змішана вибірка (рання та розгорнута стадії РА)
GLA порівняно з плацебо
— Один МА376 виявив, що GLA була значно кращою, ніж плацебо, за наступними показниками: біль (за ВАШ) та шкала болю (0–4); загальна оцінка пацієнтом, ранкова скутість та болісність суглобів. Однак за показниками: біль (абсолютна шкала), ранкова скутість (шкала), припухання суглоба та зменшення витрати НППЗ значної різниці не було. За загальною оцінкою лікарем мала місце значна гетерогенність. Рівень 1++
— Omega-З поліненасичені жирні кислоти порівняно з плацебо.
— Один МА377 виявив, що омега-3 поліненасичені жирні кислоти були значно кращими, ніж плацебо, за наступними показниками: оцінка пацієнтом болю, ранкова скутість, число болючих суглобів, витрата НППЗ. Однак за RАI та оцінкою болю лікарем значної різниці не було. Рівень 1++
Вегетаріанська та середземноморська дієти
— Один об’єднаний аналіз378 виявив, що лактовегетаріанська, сувора вегетаріанська та модифікована критсько-середземноморська дієти були значно кращими, ніж контрольні дієти, за наступними показниками: однофакторний аналіз — втрата ваги та біль. Рівень 1+
Розгорнута стадія РА
Безглютенова сувора вегетаріанська дієта із наступною лактовегетаріанською дієтою
— Одне РКД389–391 виявило, що відповідачі були значно кращі, ніж не відповідачі та контрольна група, за наступними показниками: біль, ранкова скутість, оцінка за HAQ, число болючих і припухлих суглобів, загальна оцінка та RАI. Однак за рентгенологічною оцінкою, силою стискання та ШОЕ значної різниці не було. Рівень 1++
9.1.5. Узагальнені результати відносно документальних доказів
— Більшість випробувань показують деяку користь при використанні різних дієтичних модифікацій чи добавок, але здається, що модифікації не чинять глобального покращення на активність хвороби та функціонування376–379, 381–391.
— Найбільш ефективною дієтою була безглютенова дієта із наступною вегетаріанською дієтою, хоча ці пацієнти також отримували фізіотерапію389–391. Інші дієти з корисним впливом на активність захворювання включають «безалергенову» дієту385, елементну дієту382 та дієту з обмеженою кількістю алергенів у деяких пацієнтів384, середземноморську дієту378, 379, омега-3 та поліненасичені жирні кислоти377.
9.1.6. Обґрунтування рекомендацій
ГРН відмітила, що багато дієтичних втручань, здавалося, були корисними при застосуванні разом із загальноприйнятим лікуванням. Однак дієта не давала позитивних результатів у широкому спектрі показників та на підтримку рекомендації лише дієти не було достатньо доказів. Не було послідовного доказу переваги якої-небудь окремої дієти. Окремі дієти могли бути непопулярними у деяких пацієнтів, такі як вегетаріанські дієти, а інші могли бути неприємними, що призводило до недотримання, такі як елементні дієти. Було вирішено, що у рекомендації слід надати пацієнтам з РA певні орієнтири. Мала місце дискусія відносно доказу того, що принципи середземноморської дієти* можуть бути корисними у хворих з РA, зокрема з причині впливу такої дієти на серцево-судинні фактори ризику. Оскільки:
— хворі з РA мають більший ризик серцево-судинного захворювання, ніж інша частина популяції;
— така дієта може бути корисною для скелетно-м’язових симптомів РА;
— цього типу дієти дотримуються з більшою імовірністю, ніж деяких інших несмачних дієт.
Рекомендації
R44 Надайте інформацію людям з РА, які бажають поекспериментувати зі своєю дієтою, що немає переконливого доказу, що це буде корисно для їхнього артриту. Однак вони можуть бути заохочені дотримуватися принципів середземноморської дієти (більше хліба, фруктів, овочів та риби; менше м’яса та заміна масла та сиру на продукти на основі овочевих та рослинних олій).
9.2. Додаткові методи лікування
9.2.1. Вступ (клінічні аспекти)
Загальновживані підходи до лікування РА не завжди є настільки успішними, як того хотіли би працівники охорони здоров’я чи пацієнти. Пацієнти часто непокояться відносно побічних ефектів призначених препаратів, про що свідчать дзвінки на телефон гарячої лінії Національного товариства ревматоїдного артриту (NРАS — National Rheumatoid Arthritis Society) із цього питання. У поєднанні з неповною ефективністю та тривогою відносно токсичності при застосуванні загальновживаних препаратів зрозуміло, що хворі з РА будуть вивчати інші підходи аби намагатися допомогти собі зі своєю хворобою. Вони не мають нестачі готових рішень за допомогою безлічі статей та рекламних об’яв у газетах, журналах, інтернеті, на телебаченні та радіо, які дають інформацію про додаткові альтернативні та інші нефармакологічні втручання, які заявляють, що полегшать або (свідома неправда) вилікують їх артрит. Спостереження показали, що значна частина хворих з РА буде випробовувати додаткові та альтернативні методи395 при імовірній нестачі повного задоволення загальновживаними підходами, а також бажанні допомогти собі. Пацієнти із запальним артритом на ранній стадії можуть спробувати альтернативні засоби, перш ніж звернутися до свого сімейного лікаря. Із бази даних NРАS випадковим чином були відібрані 100 членів NРАS та 100 добровольців NРАS із Великобританії, яких попросили перерахувати, яким серед всіх доступних варіантів терапії вони віддають перевагу, і за інформаційним пошуком був відібраний «топ-шість». Найбільш популярними способами лікування були: акупунктура, мідні браслети, ароматерапія, масаж, рефлексотерапія та гомеопатія.
9.2.2. Вступ (клініко-методологічні аспекти)
Ми шукали дослідження, що оцінювали, які аспекти додаткових, альтернативних чи інших нефармакологічних втручань є ефективними у пацієнтів з РА (рання та розгорнута стадії). Внаслідок невеликого обсягу документів були відібрані всі типи випробувань, які стосувалися популяції з Великобританії.
Був знайдений один МА396, 2 РКД397–399 та 1 серія випадків400, які задовольняли критеріям включення. Один РКД398, 399 був опублікований у вигляді двох окремих статей, у яких повідомлялося про різні строки спостереження, однак воно було виключене через методологічні обмеження (не сліпе і не здійснений ІТТ-аналіз). Методологічні обмеження досліджень, які залишилися, полягали у наступному: РКД, класифіковане як 1+, було не сліпим і не мало виключень. МА, класифікований як 1++, здійснював якісну оцінку включених випробувань і тестував гетерогенність.
Змішана вибірка (рання та розгорнута стадії РА)
SR/MA кокранівської бази даних (Cochrane data base)396 був добре проведеним. 2 РКД, включені до аналізу, порівнювали акупунктуру із плацебо. Однак вони відрізнялися у відношенні:
— втручання (РКД використовувало акупунктуру (маніпуляція голками); РКД використовувало електроакупунктуру);
— розміру дослідження (діапазон N = 20 та N = 64);
— якості дослідження — максимальна оцінка 5 (1 дослідження гарної якості; 1 дослідження задовільної якості);
— тривалості дослідження — тривалість втручання (1 РКД 5 тижнів; 1 РКД 3 місяці).
Додаткове РКД397 оцінювало лікування за допомогою масажу порівняно зі стандартним лікуванням у 22 пацієнтів (тривалість хвороби пацієнтів не згадувалася) у 4-тижневий період.
Розгорнута стадія РА
Серія випадків400 — досліджували гомеопатичні препарати на рослинній основі + антиоксиданти (вітамін С 1000 мг і вітамін Е 800 мг внутрішньом’язово) у 30 пацієнтів у 5-тижневий період.
9.2.3. Методологія клініко-економічного обґрунтування
Статей відносно клініко-економічного аналізу виявлено не було.
9.2.4. Клінічні доказові положення
Змішана вибірка (рання та розгорнута стадії РA)
— Один МА396 виявив, що електроакупунктура була значно кращою, ніж плацебо, за показниками: біль (шкала 0–4) у кінці лікування — 24 години та на 4-й місяць наступного спостереження. Рівень 1++
— Той самий МА396 виявив, що між акупунктурою та плацебо не було значної різниці в кінці лікування — 5 тижнів за показниками: біль (за ВАШ) в кінці лікування — 5 тижнів; припухлі та болючі суглоби в кінці лікування — 5 тижнів; активність хвороби (за DAS); оцінка за опитувальником загального стану здоров’я (global health questionnaire); ШОЕ; СРБ; споживання анальгетиків; загальна оцінка пацієнтом. Рівень 1++
— Одне РКД виявило, що ручний масаж був значно кращим, ніж контроль (стандартне лікування), на 4-й тиждень (кінець лікування, зміна відносно вихідного рівня) за показниками: біль (за ВАШ), тривога (STAI), депресія (POMS) та сила стискання. Рівень 1+
Розгорнута стадія РА
Одна серія випадків400 виявила, що на 5-й тиждень (кінець дослідження, зміна відносно вихідного рівня) пацієнти, яких лікували за допомогою гомеопатичних препаратів на рослинній основі + антиоксиданти, відчули зниження болю (за ВАШ) (зміна відносно вихідного рівня –1,5), підвищений рівень самопочуття (за ВАШ) та знижене обмеження рухів. Крім того, мало місце успішне зменшення доз препаратів, які пацієнти перед тим приймали (всі препарати, які викликають побічні ефекти — НППЗ, МТ та/чи парацетамол — були одразу ж виключені). Рівень 3
9.2.5. Обґрунтування рекомендацій
ГРН вирішила, що докази на користь ефективності будь-якої додаткової терапії чи медикаментів були недостатніми; ГРН було розчарована цим, беручи до уваги загальну популярність такого лікування. Підтверджуючий доказ мали лише короткострокове дослідження електроакупунктури та 4-тижневе дослідження ручного масажу. Змішування гомеопатичних препаратів на рослинній основі у короткостроковому дослідженні дозволяло знизити дозу анальгетиків. Однак ГРН вирішила, що ніщо із цього не представляє собою вагомий доказ, аби надати офіційні рекомендації. ГРН виявила, що користь додаткової терапії була схожою з користю анальгетиків, що забезпечували короткостроковий позитивний результат і що це повинно бути відображено у рекомендаціях. Відчувалось, що інформацію відносно недостатності доказів слід надавати пацієнтам, але якщо вони таки обирають спробувати додаткове чи альтернативне лікування, тоді слід забезпечити, щоб вони не виключали звичайну терапію. Окремі члени відмітили, що, із їхнього досвіду, у пацієнтів, які використовують додаткове лікування, може розвиватися систематична помилка оцінки, що може вплинути на лікування, яке надається міждисциплінарною командою. ГРН вирішила, що цю точку зору не слід підтримувати.
Рекомендації
R45 Надайте інформацію людям з РА, які бажають спробувати додаткові способи лікування, що хоча окремі із них можуть забезпечити короткотривалу симптоматичну користь, їх довготривала ефективність слабо доведена чи немає доказів.
R46 Якщо особа з РА вирішує спробувати додаткову терапію, попередьте її, що:
— ці підходи не повинні заміняти звичайне лікування;
— це не повинно наносити шкоди установкам членів міждисциплінарної команди чи впливати на запропоноване лікування.
Коментар робочої групи
Враховуючи прихильність вітчизняних хворих до нетрадиційної медицини, слід особливо ретельно роз’яснити хворому на РА, що ніякі нетрадиційні методи лікування не зможуть суттєво вплинути на перебіг хвороби, а основна роль належить фармакотерапії, зокрема базисним препаратам.
10. Рекомендації, пов’язані з оцінкою технології NICE
Рекомендації у цьому розділі є чинними настановами NICE з оцінки технології. Вони були сформульовані як частина оцінки технології і не розробниками власне рекомендацій. Вони повинні бути включені у ці настанови разом з процедурами розробки клінічних настанов NICE, і доказ на підтримку таких рекомендацій може бути знайдений за допомогою окремих оцінок.
Ревматоїдний артрит (резистентний) — ритуксимаб (Настанова NICE з оцінки технології 126)
Доступно на www.nice.org.uk/TA126
Ритуксимаб у комбінації з метотрексатом рекомендований як варіант для лікування дорослих з важким активним ревматоїдним артритом, які мали неадекватну відповідь чи непереносимість інших засобів, що модифікують перебіг ревматичного захворювання (DMARD), включаючи лікування за допомогою принаймні одного інгібітору фактора некрозу пухлини а (ФНП-а).
Лікування за допомогою ритуксимабу із метотрексатом слід продовжувати, лише якщо після початку терапії є адекватна відповідь. Адекватна відповідь визначається як покращення індексу активності хвороби (DAS28) на 1,2 бала чи більше. Повторення курсу лікування за допомогою ритуксимабу із метотрексатом слід проводити не частіше ніж кожні 6 місяців.
Лікування за допомогою ритуксимабу із метотрексатом повинно розпочинатися, спостерігатися та оцінюватися на предмет відповіді лікарем-спеціалістом, який має досвід у діагностиці та лікуванні ревматоїдного артриту.
Ревматоїдний артрит (резистентний) — абатацепт (Настанова NICE з оцінки технології 141)
Доступно на www.nice.org. ик/ТА141
Абатацепт не рекомендований (в межах його реєстраційного свідоцтва) для лікування хворих з ревматоїдним артритом.
Пацієнти, які на даний час приймають абатецепт для лікування ревматоїдного артриту, повинні мати право вибору продовжувати терапію доки вони та їхні лікарі не вирішать доцільним припинити її.
Адалімумаб, етанерцепт та інфліксимаб для лікування ревматоїдного артриту (Настанова NICE з оцінки технології130)
Доступно на www.nice.org.uk/TAlSO
Інгібітори фактора некрозу пухлини альфа (ФНП-а) — адалімумаб, етанерцепт та інфліксимаб — рекомендовані як варіанти лікування дорослих, які мають обидві вказані нижче характеристики:
— Активний ревматоїдний артрит, оцінений за індексом активності хвороби (DAS28) вище ніж 5,1, підтверджений принаймні двічі, 1 місяць різниці.
— Мали випробування двох засобів, що модифікують перебіг ревматичного захворювання (DMARD), включно із метотрексатом (якщо не протипоказаний). Випробування DMARD визначається як нормальне тривалістю 6 місяців, із 2 місяцями на стандартній дозі, якщо тільки значна токсичність не обмежила дозу чи тривалість лікування*.
Інгібітори ФНП-а12 у нормі повинні бути використані у комбінації з метотрексатом. Якщо пацієнт не переносить метотрексат або якщо лікування метотрексатом було визнане недоцільним, адалімумаб і етанерцепт можуть призначатися як монотерапія11.
Лікування із використанням інгібіторів ФНП-а12 слід продовжувати, лише якщо на 6-й місяць після початку терапії має місце адекватна відповідь. Адекватна відповідь визначається як покращення показника DAS28 на 1,2 бала чи більше11, 12.
Після початкової відповіді лікування* повинне контролюватися не рідше ніж раз у 6 місяців із оцінкою DAS28. Лікування повинне бути припинене, якщо адекватна відповідь (як визначено у 1.4.4.6) не підтримується11.
Альтернативний інгібітор ФНП-а12 може розглядатися для пацієнтів, у яких лікування припинене через небажане явище перед початковою 6-місячною оцінкою ефективності, за умови, що ризики та користь були повністю обговорені з пацієнтом і задокументовані.
Збільшення дози інгібіторів ФНП-а12 вище дозволеної стартової дози не рекомендоване11.
Лікування12 у нормі має бути розпочато за допомогою найменш дорогого препарату (враховуючи вартість введення, необхідну дозу та ціну за дозу). Це може вимагати потреби у варіюванні в індивідуальних випадках через різницю у способі введення та схемі лікування11.
Використання інгібіторів ФНП-а12 для лікування важкого, активного прогресуючого ревматоїдного артриту у дорослих, які раніше не лікувалися за допомогою метотрексату чи інших DMARD, не рекомендоване11.
Початок використання інгібіторів ФНП-а12 та наступна оцінка відповіді на лікування та небажаних явищ має проводитися лише спеціалістом ревматологом з досвідом використання цього засобу11.
11. Області для подальшого дослідження
Наскільки рентабельними є МРТ та ультразвук у встановленні діагнозу та прогнозу синовіту дрібного суглоба?
Наскільки рентабельним є використання анти-ЦЦП у встановленні діагнозу та прогнозу раннього запального артриту?
Подальші оцінки, у тому числі дослідження рентабельності у хворих з ревматоїдним артритом, повинні включати наступне:
— Пов’язана із хворобою письмова інформація на ранній стадії захворювання.
— Письмові матеріали відносно самостійного лікування на ранній та розгорнутій стадії захворювання.
— Структурована 1 : 1 інформація, що дається на ранній та розгорнутій стадії захворювання.
— Курси підвищення кваліфікації та уточнення.
— Довготривала користь програм групової поведінкової терапії.
— Програма самостійного лікування артриту та самостійного лікування хронічного захворювання на ранній стадії та розгорнутого із досліджуваними вибірками, рекрутованими у клініках для амбулаторних хворих.
У хворих із ревматоїдним артритом повинні мати місце наступні подальші оцінки, у тому числі дослідження рентабельності:
— Відносно тренувань, найкращих методів харчування, оптимального режиму та рівня активності та методів максимізації довготривалої відповідності.
— Окремі компоненти загальної фізіотерапії із акцентом на ефективності електрофізичних засобів та вибір оптимального часу для них протягом хвороби.
У хворих із ревматоїдним артритом повинні мати місце наступні подальші оцінки, у тому числі дослідження рентабельності:
— Загальна трудотерапія.
— Користь трудових реабілітаційних програм як для тих, хто нині працює, але ризикує втратити роботу, так і для тих, хто вже безробітний, але потребує допомоги у працевлаштуванні.
Повинна бути оцінена роль DMARD у лікуванні легкого ревматоїдного артриту.
Повинна бути оцінена рентабельність раннього лікування за допомогою біопрепаратів (до невдачі з двома загальновживаними DMARD).
Який вплив тривалості симптомів на наслідки хвороби?
Яка стратегія лікування є найбільш відповідною, коли перший інгібітор ФНП-а зазнав невдачі?
Мають бути досліджені елементи ролі медсестри, які справляють найбільшу користь на результати при ранньому та розгорнутому РA.
Джерело: EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease–modifying antirheumatic drugs, 2010. Ann Rheum Dis 2010; 69, № 6: 964–975 (published online May 5, 2010).
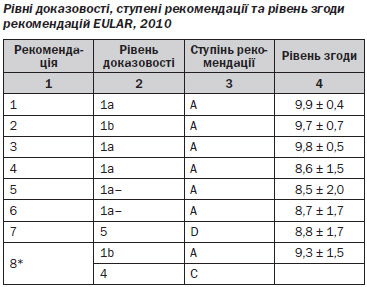
12. Рекомендації EULAR 2010
Шкала рівнів доведеності і градації рекомендацій
(Джерело — Oxford Centre for Evidence-based Medicine, March 2009)
Градація рекомендацій
Учасники кожної підгрупи докладно обговорювали докази, підготовлені науковими співробітниками в рамках SLR, і узгодили п’ять з восьми рекомендацій з відповідної тематики. Ці попередні твердження стосовно лікування РА синтетичними DMARD, ГК та біологічними засобами, а також стосовно стратегій лікування та економічних аспектів, пройшли ретельний аналіз усією Робочою групою, були узагальнені та пройшли процес голосування. У результаті цього процесу були розроблені 15 рекомендацій стосовно медикаментозного лікування та терапевтичних стратегій. Кожну з цих 15 рекомендацій оцінили з економічної точки зору відповідно до результатів, отриманих економічною підгрупою Робочої групи.
15 рекомендацій представлені нижче. Рівень доказової бази та ступінь переконливості кожної рекомендації представлені у таблиці. Економічна оцінка наведена у таблиці 3. 15 рекомендацій згруповані не за ступенем важливості, а у логічній послідовності або у процедурній чи хронологічній послідовності, окрім двох перших пунктів, які є основою для усіх наступних пунктів. Вони також є основою алгоритму, наведеного на малюнку 1.
* — різні рівні доказовості для окремих складових рекомендації — див. пояснення в тексті.
(1) Синтетичні DMARDs на ранньому етапі. Робоча група дійшла одностайної думки про те, що для переважної більшості хворих на РА перший лікувальний підхід має включати синтетичні DMARDs, адже значний відсоток пацієнтів може досягти дуже низького рівня активності захворювання або ремісії36–39. Типи DMARD із доведеною ефективністю розглянуті у пунктах 3–6. Окрім того, оскільки будь-яка затримка початку застосування DMARD у пацієнтів з РА може призводити до гіршого наслідку порівняно з початком лікування на ранньому етапі8, 10, 40, лікування DMARD слід розпочинати якнайшвидше після встановлення діагнозу РА. Однак нелегко діагностувати РА на дуже ранньому етапі, тому підозра на діагноз РА може бути достатньою для призначення DMARD. Важливо підкреслити, що Американський коледж ревматології (ACR) та EULAR спільно розробили нові критерії, що стосуються цієї фази захворювання41.
(2) Лікування, спрямоване на досягнення ремісії чи низької активності захворювання. Безсумнівно, досягнення ремісії чи низької активності захворювання забезпечує кращі структурні та функціональні наслідки, аніж лікування, яке призводить до збереження у пацієнта залишкової активності захворювання11, 42–46. Чим раніше буде досягнуто цей стан, тим краще43, 47. Отже, ремісія є основною терапевтичною метою, особливо на ранній стадії РА, хоча низька активність захворювання може бути належною альтернативою, зокрема, у пацієнтів з тривалим РА. Цей висновок підтвердив експертний комітет, який нещодавно залучили до процесу визначення терапевтичної мети при РА48. Стратегічні дослідження показали, що досягнення низької активності захворювання або ремісії шляхом корегування лікування кожні 1–3 місяці у поєднанні з суворим моніторингом забезпечує кращі клінічні, рентгенологічні та функціональні наслідки, аніж неструктуроване подальше спостереження11, 13, 39. Отже, терапевтичної мети бажано досягти чи майже досягти упродовж 3 місяців, і її необхідно обов’язково досягти максимум упродовж 6 місяців. Оскільки зазначений період не вивчали під час порівняльних досліджень, він визначений експертами з огляду на 1–3-місячний період для переходу з одного лікування на інше у процесі стратегічних досліджень11–14, а також з огляду на дані про те, що активність захворювання через 3–6 місяців після початку лікування визначає наслідки на пізніших етапах50. Упродовж цього періоду у 3–6 місяців пацієнти повинні перебувати під ретельним спостереженням (при потребі щомісяця), і призначене їм лікування доцільно збільшувати чи кардинально змінювати на інше48. Згідно з цими рекомендаціями необхідно проводити регулярний моніторинг. Хоча у різноманітних стратегічних дослідженнях застосували різні способи вимірювання21, експерти рекомендують застосовувати комплексні засоби визначення активності захворювання, які містять суглобові рахунки48. У цьому зв’язку нещодавно проаналізували актуальні засоби визначення активності захворювання, які включають: рахунок активності захворювання (DAS), рахунок активності захворювання за 28 суглобами (DAS28), спрощений індекс активності захворювання та клінічний індекс активності захворювання51.
(3) МТ як препарат першого вибору. МТ є високоефективним лікарським засобом, який модифікує перебіг захворювання52. Нещодавно проведені дослідження вказують на те, що МТ у більш високих щотижневих дозах (20–30 мг) є ефективнішим за МТ у більш низьких щотижневих дозах (7,5–15 мг)2, 53. МТ вважають основним лікарським засобом при РА54 з точки зору його ефективності як монотерапії і його здатності підвищувати ефективність біологічних DMARDs у комбінованій терапії55–59. Він також має позитивний профіль довготривалої безпеки60. МТ ефективний у пацієнтів з раннім РА, які раніше не отримували DMARD13, 49, 56, 61, і його клінічну ефективність не перевершують ані інші синтетичні DMARDs, ані монотерапія інгібітором фактора некрозу пухлини (ФНП)37, 55, 56, 62. Саме тому Робоча група дійшла висновку, що лікування МТ слід розпочинати якомога раніше у пацієнтів з РА. Окрім рекомендації щодо застосування МТ це твердження обумовлює ще три аспекти: по-перше, словосполучення «частина першої терапевтичної стратегії» вказує на те, що МТ необхідно поєднувати з іншими засобами (див. нижче); по-друге, вказівка на «активний РА» наголошує, що пацієнти з низькою активністю захворювання не обов’язково потребують лікування МТ; і, по-третє, твердження опосередковано вказує на те, що стратегію лікування МТ слід застосувати у пацієнтів з активним РА, які раніше не отримували МТ, а лише інші синтетичні DMARDs. Як правило, ця рекомендація не поширюється на пацієнтів, яким протипоказане застосування МТ (див. нижче).
(4) Лефлуномід, ССЗ або ін’єкційні препарати золота. На сьогоднішній день немає достатніх доказів того, що лефлуномід, ССЗ або внутрішньом’язове застосування солей золота є гіршими за МТ37, 38, 62–64. Тим не менше, з огляду на масив даних стосовно ефективності та безпечності МТ, три вищевказаних DMARDs слід застосовувати замість МТ в якості першої терапії DMARD, переважно у випадку протипоказань (чи при непереносимості) МТ. За аналогією з попереднім пунктом ці альтернативи МТ слід також розглядати як елемент стратегії лікування. Досить суттєва роль парентерального застосування солей золота є предметом активних дебатів, проте цей вид терапії може бути обґрунтований наявними на даний момент доказами високого рівня63, 65, 66. Зрештою це рішення підтримала більшість членів Робочої групи. Окрім вищевказаних лікарських засобів, при РА також застосовують протималярійні засоби (гідроксихлорохін та хлорохін). Вони демонструють певну ефективність в якості монотерапії з точки зору ознак та симптомів67 і часто використовуються у складі комбінованих видів лікування42, 68, 69. Однак ще не вдалося чітко встановити, чи забезпечують протималярійні засоби у складі комбінованої терапії додаткову ефективність. Окрім того, протималярійні засоби достатньо не впливають на структурні ушкодження, особливо порівняно з іншими засобами, наприклад ССЗ70. Отже, ці засоби не вказані у рекомендації більш настійливо. Тим не менше, з огляду на їх клінічну ефективність у формі монотерапії, вони можуть мати певну користь для пацієнтів з легким перебігом захворювання, яким протипоказані інші сполуки.
(5) Монотерапія або комбінована терапія синтетичними DMARD. За останні два десятиріччя встановили, що комбінована терапія різноманітними синтетичними DMARDs забезпечувала кращу ефективність, аніж монотерапія7, 42, 68, 69, 71. На підтримку припущення про додаткові переваги часто використовували результати клінічних досліджень, під час яких вивчали додавання синтетичних DMARDs до МТ у пацієнтів із залишковою активністю захворювання, незважаючи на лікування МТ72, 73, проте ці дослідження не передбачали відповідну контрольну групу (переведення на інший вид лікування), а кількість пацієнтів з відповіддю на лікування, які отримували комбінований режим, не перевищувала кількість пацієнтів з відповіддю на лікування на фоні відповідної монотерапії74. Для глибокого усвідомлення цієї рекомендації доцільно розглянути той факт, що у більшості клінічних досліджень, під час яких проводили пряме порівняння комбінованої терапії і монотерапії, ГК використовували або в якості обов’язкового елементу у групі комбінованої терапії, або режим застосування ГК відрізнявся в обох групах, що, можливо, пояснює перевагу комбінованої терапії74. Декілька інших досліджень вказують на те, що за відсутності ГК ані застосування комбінації синтетичних DMARDs, ані покрокова стратегія використання комбінованої терапії не є кращими за монотерапію чи переведення на інші DMARDs з точки зору основних наслідків захворювання49,75–77. Систематичний аналіз літератури з цього питання дозволив дійти достовірного висновку18. Окрім того, у пацієнтів, які раніше не отримували DMARD, співвідношення ефективності і токсичності свідчить на користь монотерапії МТ замість комбінованої терапії, хоча ці докази не були переконливими у пацієнтів з неадекватною відповіддю на DMARD78. Отже, у цьому випадку Робоча група використовує слово «може». Важливо пам’ятати про те, що якщо комбінована терапія синтетичними DMARDs не дозволяє досягти терапевтичної мети, неможливо встановити, який з лікарських засобів був недостатньо ефективним, і це заважає краще використовувати синтетичні DMARDs. Це твердження містить ще й інший елемент, а саме словосполучення «незалежно від включення ГК». Комітет дійшов одностайної думки про те, що включення ГК до монотерапії чи до комбінованої терапії DMARDs покращує наслідки захворювання. Однак дослідження, які передбачали пряме порівняння ГК плюс монотерапія DMARD порівняно з ГК плюс комбінована терапія DMARDs, не проводили.
(6) Глюкокортикоїди. ГК демонструють не лише протизапальний ефект, але й чітко вказують на здатність модифікувати захворювання5, 79, 80. Підтвердження того, що монотерапія DMARD так само ефективна, як комбінована терапія DMARD, вказує на те, що значно кращі наслідки досліджень комбінованого лікування синтетичними DMARDs і ГК порівняно з монотерапією DMARD можна пояснити наявністю ГК у схемі лікування7, 12, 42. Важливі докази цього підходу були отримані під час досліджень, які довели корисний ефект включення ГК до монотерапії DMARD3, 4. Додавання ГК до DMARDs виявилося успішним при низьких дозах ГК (< 10 мг/добу)3, 4, 42, однак швидшого покращення можна досягти при використанні ГК у більш високих дозах на короткий період7, 49. Однак більшу ефективність ГК у високих дозах ще не порівнювали з ефективністю ГК у низьких дозах, і, отже, цей висновок не має достатніх доказів. Слід зауважити, що довготривале застосування ГК може призводити до побічних явищ81, проте проблеми безпеки можуть виникати і у проміжний період, хоча більшість досліджень токсичності ГК є недостатньо якісними і нетривалими. Тим не менш, на думку Робочої групи, не слід нехтувати токсичністю ГК, особливо у проміжний і довготривалий період. Отже, ГК слід застосовувати з обережністю і, бажано, лише нетривалими курсами. Відповідно, дозу ГК слід знижувати якнайшвидше з огляду на клінічну ситуацію. Безпечність ГК також стала важливим аспектом рекомендацій EULAR стосовно лікування ГК82.
(7) Включення до схеми лікування біологічного DMARD або перехід на інший синтетичний DMARD. Це твердження підкреслює важливість прогностичних маркерів у прийнятті терапевтичних рішень при РА. До факторів, які здатні незалежно прогнозувати несприятливі наслідки, відносять: (a) наявність аутоантитіл, тобто ревматоїдного фактора та/або антитіл до цитрулінованого пептиду, особливо у високих титрах; (b) високу активність захворювання, що визначається за допомогою комплексних засобів оцінки (DAS, DAS28, Спрощеного індексу активності захворювання та Клінічного індексу активності захворювання), оцінки припухлих суглобів або реактантів гострої фази (С-реактивний білок, швидкість осідання еритроцитів); (с) виникнення ерозії на ранньому етапі83–87. Ці фактори нещодавно поєднали у моделі ризиків88. Робоча група погодилася, що пацієнтів, які не досягають терапевтичної мети при застосуванні початкової стратегії лікування синтетичними DMARDs і у яких відсутні вищевказані несприятливі прогностичні маркери, можна переводити на інший синтетичний DMARD за 3–6 місяців до прийняття подальших рішень стосовно призначення біологічного препарату. Ці інші DMARD вказані у рекомендації 4. Однак пацієнти, у яких початкова терапія DMARD виявилася неефективною і у яких наявні несприятливі прогностичні маркери, повинні отримувати біологічний DMARD на додаток до синтетичного DMARD. Цікаво, що під час нещодавно проведеного дослідження (не увійшло до SLR), намагаючись подолати брак інформації завдяки введенню контрольної групи з активним лікуванням, було встановлено, що у пацієнтів з раннім РА, у яких не вдалося досягти низької активності захворювання після 3 місяців монотерапії МТ, включення до схеми лікування інгібітору ФНП забезпечило значно кращі клінічні наслідки, аніж включення у лікування ССЗ плюс гідроксихлорохін89. Ці дані також підтримують висновки, представлені у рекомендаціях 5 і 6, про те, що комбіноване лікування синтетичними DMARD без додавання ГК (навіть потрійне лікування МТ, ССЗ та гідроксихлорохіном) має обмежену ефективність і може не мати більшу ефективність, ніж переведення пацієнтів на лікування ССЗ, що було продемонстровано у дослідженні BeSt12. Ця обмежена (проте частково продемонстрована) ефективність зазначеного режиму лікування синтетичними DMARD також підтримує думку експертів про необхідність переведення пацієнтів, для яких перша стратегія лікування на основі DMARD виявилася неефективною, на інший DMARD (або зрештою на комбіноване лікування DMARD). І навпаки, у пацієнтів, у яких початковий курс МТ чи інших синтетичних DMARDs (в ідеалі з ГК) виявився неефективним і у яких виявлені несприятливі прогностичні фактори, можна застосовувати біологічний DMARD загалом та інгібітор ФНП зокрема. Однак слід підкреслити, що цей підхід на основі диференційованого лікування, яке визначається за прогностичними факторами, ще не досліджували під час рандомізованих, контрольованих чи обсерваційних клінічних досліджень. Отже, це твердження відповідає рівню експертної думки, проте підтверджується різноманітними непрямими доказами, які представлені в опублікованій літературі.
(8) Початок лікування інгібітором ФНП. Це розширює рекомендацію 7 стосовно пацієнтів, вказаних у попередній рекомендації, наголошуючи на ефективності біологічних препаратів у випадку неефективності синтетичних DMARDs (рівень 1а, ступінь А) і необхідності їх комбінування з МТ (або іншими DMARDs), оскільки такий комбінований режим має більшу ефективність, аніж монотерапія більшістю біологічних препаратів; це добре встановлено стосовно інгібіторів ФНП (на підставі відповідних порівняльних досліджень фази ІІІ55, 56) та стосовно ритуксимабу та тоцилізумабу (на підставі порівняльних досліджень фази ІІ58, 59) (рівень 1b, ступінь A). На момент систематизованого аналізу літератури інгібітори ФНП та тоцилізумаб були єдиними біологічними препаратами, ліцензованими у Європі для лікування пацієнтів з активною формою РА, незважаючи на лікування синтетичними DMARD. Ритуксимаб та абатацепт на сьогоднішній день ліцензовані лише для застосування після встановлення неефективності інгібіторів ФНП. У США (але на даний момент не у Європі) абатацепт також можна застосувати у цій першій категорії пацієнтів. У світлі нещодавно отриманих даних клінічних досліджень90, 91 європейські регуляторні органи можуть у плановому порядку затвердити абатацепт та ритуксимаб за аналогічними показаннями як перші біологічні препарати. Слід зауважити, що деякі інгібітори ФНП, наприклад адалімумаб або етанерцепт, ліцензовані як монотерапія з огляду на їх ефективність у клінічних дослідженнях, проте дані про їх клінічні переваги відносно монотерапії МТ неоднозначні55, 56, 92. Згідно з нещодавно отриманими даними монотерапія тоцилізумабом є більш ефективною, аніж монотерапія DMARDs, наприклад, МТХ93, 94. Однак дизайн цього рандомізованого клінічного дослідження не передбачав третю групу комбінованого лікування обома препаратами. Отже, залишається незрозумілим, чи є монотерапія тоцилізумабом у пацієнтів з раннім РА такою ж чи менш ефективною, аніж комбінована терапія тоцилізумабом та МТ. На сьогоднішній день найбільший масив даних безпеки був накопичений стосовно інгібіторів ФНП, адже їх застосовують понад десятиріччя і наявні великі реєстри із даними за тривалий період. До цих сполук відносяться адалімумаб, етанерцепт та інфліксимаб, проте цертолізумаб та голімумаб також затверджені. Проте слід пам’ятати, що це відображає сучасну думку експертів, яка може змінитися у майбутньому, зокрема, внаслідок затвердження інших біологічних засобів як потенціального першого біологічного засобу для пацієнтів з неадекватною відповіддю на DMARD, тобто тоцилізумабу у Європі та абатацепту у США та інших неєвропейських країнах. При цьому доцільно зауважити, що у клінічних дослідженнях анакінра, антагоніст рецептора ІЛ-1, не продемонструвала високого рівня клінічної ефективності95, 96 і, отже, не рекомендується як основний біологічний засіб при РА.
(9) Абатацепт, ритуксимаб чи тоцилізумаб. При проведенні рандомізованого контрольованого дослідження (по одному для кожного препарату) отримали переконливі докази того, що абатацепт, голімумаб, ритуксимаб та тоцилізумаб ефективні у пацієнтів, у яких лікування інгібітором ФНП було неефективним97–100 (рівень 1b, ступінь A). Ці дані частково підтверджують обсерваційні дослідження, проведені за даними реєстрів, які вказують на те, що перехід з одного інгібітору ФНП на інший, а також перехід з інгібітору ФНП на ритуксимаб забезпечує терапевтичний ефект101–103. На сьогоднішній день Комітет не виявив рандомізованих контрольованих досліджень, під час яких перехід з одного виду лікування на інший порівнювали у контексті застосування різних біологічних препаратів. Отже, за таких обставин не можна надавати переваги певному біологічному препарату104.
(10) Азатіоприн, циклоспорин А або циклофосфамід. При РА може розвиватися резистентність до кількох DMARDs та біологічних засобів, і перебіг захворювання може бути дуже деструктивним та інвалідизуючим99, 100, 105, 106. Хоча у попередніх рекомендаціях йшлося про чотири синтетичні DMARDs та дев’ять біологічних засобів, які забезпечують різноманітні терапевтичні можливості, резистентність може і буде розвиватися. Для задоволення потреб відповідної категорії пацієнтів Робоча група звернулися до препаратів, стосовно яких у літературі є докази ефективності. Однак слід пам’ятати про токсичність, особливо у випадку циклоспорину А та циклофосфаміду. Останній препарат слід застосовувати лише за виключних обставин. Декілька можливих DMARDs виключені з цього розділу, оскільки підтвердження їх ефективності вважають недостатнім. До таких DMARDs відносяться D-пеніцилінамін, міноциклін, ауранофін, такролімус та хлорамбуцил. Дані про протималярійні препарати представлені у пункті стосовно рекомендації 4.
(11) Стратегії інтенсивного медикаментозного лікування. Це твердження доповнює декілька попередніх рекомендацій стосовно медикаментозного лікування. Думка про стратегії інтенсивного медикаментозного лікування пов’язана зі змістом самої стратегії лікування, наприклад, МТ плюс ГК або МТ плюс біологічні засоби, а також передбачає ретельний моніторинг та швидкий перехід з одного лікування на інше у випадку недосягнення терапевтичних цілей (контрольний аналіз)12, 107. Твердження про те, що пацієнти з поганими прогностичними факторами мають отримувати більшу користь від лікування, виходить з того, що пацієнти зі сприятливим прогнозом дуже часто однаково реагують на монотерапію низької інтенсивності або на стратегії інтенсивного медикаментозного лікування87, 88, а пацієнти з важким та агресивним перебігом захворювання часто не реагують достатньо добре на монотерапію DMARD чи комбіновану терапію без додання до схеми лікування ГК чи біологічних засобів.
(12) Зменшення дозування біологічних DMARDs. На сьогоднішній день незрозуміло, як продовжувати або як припиняти лікування у пацієнтів з ремісією. Ретельно проведене рандомізоване контрольоване дослідження з вивчення питання припинення синтетичних DMARDs у пацієнтів у період ремісії довело, що лише близько третини пацієнтів, які продовжували приймати DMARDs, мали рецидив, на відміну від близько двох третин пацієнтів, яким відмінили DMARDs108. Окрім того, після припинення DMARDs пацієнтам набагато важче досягти ремісії знов109. Такий самий висновок був зроблений у нещодавно проведеному метааналізі, присвяченому цьому питанню110. Перший аспект цього твердження пов’язаний з тривалістю ремісії: вона має бути стійкою, тобто тривати декілька місяців, перш ніж розглядати питання про зниження дозування синтетичних та/або біологічних DMARDs. Однак перш ніж знижувати дозування DMARDs, необхідно зменшити дозу ГК відповідно до рекомендації № 6 та переконатися у стійкості ремісії. На думку Робочої групи (думка експертів), після цього біологічні препарати можна поступово знижувати шляхом збільшення інтервалу між застосуваннями препарату або шляхом зниження дозування, продовжуючи при цьому застосовувати синтетичні DMARDs. При цьому не зазначено певного періоду, оскільки немає відповідних даних. На думку експертів, ремісію, що триває щонайменше 12 місяців, можна вважати «стійкою»110.
(13) Зменшення дозування синтетичних DMARDs. Це твердження відповідає попередньому, вказуючи на те, що можливість зменшення дози синтетичного DMARD у випадках тривалої ремісії слід розглядати після відміни ГК та біологічних препаратів. Немає доказів на підтримку цього підходу, а також даних про період зменшення дозування, тривалість застосування препарату чи інтервал дозування. Отже, засоби зменшення дозування визначають пацієнт і лікар. Однак у світлі наявних даних про те, що припинення DMARDs підвищує частоту рецидивів108, 110, Комітет вважає, що зниження дозування необхідно проводити з обережністю і ретельно оцінювати.
(14) Лікування біологічними засобами у пацієнтів, які раніше не отримували DMARD. Хоча біологічні DMARDs, відповідно до рекомендацій 7 та 8, загалом слід призначати пацієнтам, у яких синтетичний(і) DMARD(s) виявився(лися) неефективним(и), Комітет переконаний, що є деякі пацієнти, для яких доцільно розглянути в якості терапії першої лінії біологічні засоби у комбінації з МТ. Як правило, у таких пацієнтів спостерігають несприятливі прогностичні ознаки, у т.ч. дуже активне захворювання або структурні деформації на ранньому етапі. На сьогоднішній день для цієї категорії пацієнтів дозволяється використовувати лише інгібітори ФНП, проте інші біологічні препарати можуть у майбутньому отримати аналогічне ухвалення після накопичення достатнього масиву даних досліджень. При оцінці результатів досліджень, під час яких пацієнти, які раніше не отримували МТ, застосовували інгібітори ФНП плюс МТ, та досліджень цих сполук серед пацієнтів з активним захворюванням, незважаючи на лікування МТ1, 55, 56, 61, 111–113, виявили, що пацієнти, які раніше не отримували МТ, демонстрували більш високі показники відповіді на лікування, аніж пацієнти з недостатньою відповіддю на МТ. Але багато пацієнтів, які раніше не отримували МТ і опинилися у групах комбінованого лікування, у будь–якому випадку мали відповідь на монотерапію МТ. Отже, хоча існують додаткові підтвердження, отримані під час стратегічних досліджень, про те, що застосування інгібіторів ФНП плюс МТ на ранньому етапі є ефективним лікуванням36, 49, нещодавно отримані дані вказують на те, що у пацієнтів з раннім РА цей підхід може не бути більш ефективним, аніж призначення спочатку синтетичних DMARDs та швидке включення біологічного препарату до схеми лікування DMARD (у зазначеному дослідженні — через 3 місяці), якщо у них спостерігають активне захворювання114. Однак досі жодне клінічне дослідження не вивчало фактичні експертні рекомендації щодо використання цієї стратегії у кількох відібраних пацієнтів, як зазначено вище. Насправді це твердження отримало найнижчий рівень згоди (8,0/10) і було єдиним пунктом, щодо якого велика кількість ревматологів зазначили, що він не відповідає їх поточній практиці, і що ця рекомендація змінить їх практику.
(15) Корекція лікування. При призначенні ліків від РА необхідно застосовувати розважливий підхід і знання з метою врахування токсичності та супутніх захворювань пацієнта. Однак швидкість ураження суглобів на додаток до активності захворювання та інші прогностичні фактори можуть стати додатковими факторами у процесі прийняття рішень у зв’язку з рекомендаціями 7 та 14, особливо якщо ураження суглобів значно прогресує, незважаючи на досягнення необхідної терапевтичної мети. Однак перш ніж приймати таке рішення, необхідно враховувати періоди затримки ефекту лікування47.
Коментар робочої групи
Активність захворювання при РА визначається за допомогою таких клінічних індексів (Siri Lillegraven, Femke H.M. Prince, Nancy A Shadick, Remission and radiographic outcome in rheumatoid arthritis: application of the 2011 ACR/EULAR remission criteria in an observational cohort. — Ann. Rheum. Dis. — 2012. — Vol. 71: 5. — P. 681–686.): DAS 28 — індекс активності захворювання з урахуванням 28 суглобів (2 плечових, 2 ліктьових, 2 променезап’ясткових, по 2 п’ясно-фалангових 1–5 пальців кисті, 2 міжфалангових 1 пальця та по 2 проксимальних міжфалангових 2–5 пальців кисті, 2 колінних); SDAI — спрощений індекс активності захворювання; CDAI — клінічний індекс активності захворювання. На сьогодні найбільш доказово обґрунтованим та уніфікованим для використання в клінічній практиці залишається DAS 28.
Формули для підрахунку індексів активності захворювання:
DAS 28 = 0,56√ЧБС + 0,28√ЧПС + 0,70[ln(ШОЕ)] + + 0,014 ЗОЗП.
Для обрахунку слід використовувати стаціонарні калькулятори або офіційні онлайн-калькулятори:
http://www.das-score.nl/das28/DAScalculators/dasculators.html або
http://www.4s-dawn.com/DAS28/ або
http://prodiagnosi.com/DAS28/ (російськомовний).
SDAI = ЧБС + ЧПС + ЗОАЗП + ЗОАЗЛ + СРБ
CDAI = ЧБС + ЧПС + ЗОАЗП + ЗОАЗЛ,
де ЧБС — число болючих суглобів (0–28), ЧПС — число суглобів з припухлістю (0–28), ШОЕ — швидкість осідання еритроцитів в мм/год, ЗОЗП — загальна оцінка здоров’я пацієнтом, оцінюється за візуально-аналоговою шкалою в мм (0–100), ЗОАЗП — загальна оцінка активності захворювання пацієнтом, оцінюється за візуально-аналоговою шкалою в см (0–10), ЗОАЗЛ — загальна оцінка активності захворювання лікарем, оцінюється за візуально-аналоговою шкалою в см (0–10), СРБ — вміст С-реактивного білка в сироватці крові в мг/дл (при використанні методик, для яких нормальні значення складають < 1 мг/дл, діапазон вимірювань — від 0,1 до 10 мг/дл).
Загальний коментар Робочої групи щодо рекомендацій EULAR
Рекомендації є вивіреними, адаптованими до реальної клінічної практики, та, що важливо, базуються на сучасних принципах агресивної терапії, в першу чергу, раннього РА, в тому числі з застосуванням біологічних агентів.
Чітко визначено місце синтетичних та біологічних базисних препаратів в схемі лікування хворих з РА.
На момент створення Клінічної настанови розпочато редакцію Рекомендацій EULAR 2010 р., основні зміни доповідались на конгресі EULAR 2013, зокрема:
1. П. 1 рекомендацій синтетичні DMARDs на ранньому етапі замінено на DMARDs на ранньому етапі, рекомендована комбінована базисна терапія з використанням синтетичних DMARDs як терапія 1-ї лінії.
2. З П. 4 виключено препарати золота.
3. Згідно з рекомендаціями 2013 р. у хворих, які не відповіли на лікування з використанням синтетичних DMARDs, слід застосовувати біологічні препарати (інгібітори ФНП, абатацепт, тоцилізумаб, та, при певних обставинах, ритуксимаб). При цьому тоцилізумаб може застосовуватись як монотерапія, без комбінації з синтетичними DMARDs. Рекомендації 2010 року віддавали перевагу інгібіторам ФНП як першим біологічним агентам.
4. Виключено пункти 9 та 10 рекомендацій 2010 року.
5. В п. 13 слово титрування дози синтетичних DMARDs замінено на зниження.
6. Розглядаються питання щодо рекомендацій стосовно тофацитинібу та біоеквівалентних біологічних препаратів.
Необхідно зазначити, що станом на 01.11.2013 року лікарський засіб тофацитиніб в Україні не зареєстровано.
Перегляд адаптованої клінічної настанови: листопад 2017 року.
Список літератури знаходиться в редакції