Газета «Новости медицины и фармации» Неврология (518) 2014 (тематический номер)
Вернуться к номеру
Применение холина альфосцерата (Глиатилин) у пациентов с ишемическим инсультом
Авторы: Виноградов О.И., Даминов В.Д., Рыбалко Н.В. - Национальный медико-хирургический центр им. Н.И. Пирогова, г. Москва
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 17-19
Инсульт является одной из ведущих причин смертности и инвалидизации населения [1, 2]. Рост заболеваемости инсультом связан с ведущими факторами риска — сердечно-сосудистой патологией, хроническим стрессом, нарушением питания, вредными привычками, старением населения и др. [1].
Наиболее эффективным методом лечения ишемического инсульта в первые часы заболевания является тромболитическая терапия. Однако частота ее выполнения остается низкой и не превышает 10 % (в большинстве стран Европы данный показатель составляет приблизительно 3 %), что во многом связано с узкими временными рамками терапевтического окна [15]. В связи с этим актуальны исследования, направленные на изучение возможных механизмов продления жизни мозговой ткани в зоне ишемической полутени и, соответственно, увеличение терапевтического окна, а также на определение тактики лечения пациентов, по тем или иным причинам не подлежащих проведению тромболизиса.
Нейропротекторная терапия рассматривается как одно из перспективных направлений комплексного лечения пациентов с острым нарушением мозгового кровообращения (ОНМК) [14]. К настоящему времени проведено большое число исследований, посвященных применению нейропротекторных препаратов у больных с ишемическим инсультом, однако их результаты неоднозначны [5–7, 13, 16]. В связи с этим во всех современных клинических рекомендациях по лечению острых неврологических заболеваний нейропротекторная терапия не рекомендуется к использованию. В то же время на основании эмпирического опыта, а также в рамках собственных протоколов во многих лечебных учреждениях препараты с предполагаемой нейропротекторной активностью находят широкое применение. Можно предположить, что причиной являются недостатки дизайна проведенных клинических исследований: выбор неадекватного терапевтического окна, нецеленаправленный отбор пациентов с учетом патогенетического варианта инсульта и других особенностей заболевания, использование заведомо недостаточных дозировок препаратов и длительности их приема, выбор конечных точек с низкой чувствительностью и переоценка возможного эффекта терапии [8, 10].
Одним из препаратов, обладающих нейропротекторным и нейротрофическим действием, является холина альфосцерат (Глиатилин). При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат. Холин участвует в биосинтезе ацетилхолина — одного из основных нейромедиаторов, глицерофосфат является предшественником фосфолипидов (фосфатидилхолина) мембраны нейрона. Таким образом, Глиатилин усиливает церебральную холинергическую проводимость и положительно воздействует на пластичность нейрональных мембран [11]. Накоплен определенный опыт применения холина альфосцерата у пациентов, перенесших ОНМК, однако данных о его влиянии на процесс реабилитации пациентов с инсультом пока недостаточно [3, 4, 9, 11, 12, 14].
Цель настоящего исследования — оценка влияния холина альфосцерата на динамику восстановления утраченных функций и положительные результаты нейрореабилитационных мероприятий у пациентов с полушарным ишемическим инсультом.
Материал и методы
Обследованы 60 пациентов: 37 мужчин и 23 женщины (средний возраст — 64,7 ± 15,2 года) в острейшем периоде полушарного ишемического инсульта.
Пациенты были рандомизированы в 2 группы по 30 человек в каждой. Обе группы были сопоставимы по полу, возрасту, тяжести заболевания, сопутствующей патологии. Пациенты 1-й (основной) группы помимо унифицированной терапии инсульта получали внутривенные инъекции Глиатилина по 1000 мг в сутки в течение 10 дней с последующим переходом на пероральный прием препарата в виде капсул по 400 мг 3 раза в день в течение 20 дней. Терапия Глиатилином была начата не позднее 12 ч с момента развития инсульта. 2-ю группу (группу сравнения) составили пациенты, не получавшие Глиатилин.
Унифицированная терапия инсульта включала: коррекцию респираторных нарушений, артериального давления, уровня глюкозы, водно–электролитного баланса, температуры тела, питания, вторичную профилактику (антитромботическая, гиполипидемическая, антигипертензивная терапия, коррекция других факторов риска) и комплексное восстановительное лечение (лечебная физкультура с максимально ранней вертикализацией, физиотерапия, массаж, роботизированная механотерапия, занятия с логопедом и нейропсихологом).
Все пациенты при поступлении были обследованы по стандартной схеме. Диагноз ишемического инсульта верифицировали данными КТ/МРТ головного мозга. Патогенетический вариант уточняли с помощью лабораторных тестов, дуплексного сканирования брахиоцефальных артерий, транскраниальной допплерографии, билатерального допплеровского мониторинга средней мозговой артерии с эмболодетекцией, ЭКГ, в том числе с холтеровским мониторированием, эхокардиографии. Оценку тяжести неврологического дефицита проводили по шкале NIHSS, оценку функционального состояния — по шкале Рэнкина и данным нейрофизиологических методов исследования (ЭЭГ, соматосенсорные вызванные потенциалы — ССВП в 1, 10, 20 и 30-е сутки терапии).
Больных, которым была выполнена тромболитическая терапия, в исследование не включали.
Результаты
После 30-дневного курса терапии было проведено сравнение тяжести состояния и степени функционального восстановления у пациентов двух групп. После 30-дневного курса лечебных мероприятий тяжесть инсульта по шкале NIHSS уменьшилась на 50,8 % (с 12,8 ± 4,6 до 6,1 ± 1,2 балла, р < 0,05) у пациентов 1-й группы и на 36,8 % (с 12,1 ± 5,8 до 9,1 ± 1,8 балла, р > 0,05) — у пациентов 2-й группы. Разница исходных и конечных показателей была достоверна (р < 0,05) только в группе пациентов, получавших Глиатилин.
При изучении динамики функционального состояния по шкале Рэнкина на 30-е сутки отмечалось улучшение показателей на 45,4 % (с 3,9 ± 0,2 до 2,0 ± 0,5 балла, р > 0,05) у пациентов 1-й группы и на 34,5 % (с 3,6 ± 0,3 до 2,4 ± 0,5 балла, р > 0,05) — у пациентов 2-й группы.
Пациенты 1-й группы статистически значимо чаще достигали поставленных реабилитационных целей (р < 0,05). Так, реабилитационные цели были достигнуты после проведенной комплексной терапии у 79 % пациентов 1-й группы (33 % перемещались самостоятельно, 41 % перемещались с посторонней помощью или с использованием ходунков, 14 % были адаптированы к инвалидной коляске, 12 % оставались прикованными к постели) и только у 38 % пациентов 2-й группы (15 % перемещались самостоятельно, 25 % перемещались с посторонней помощью или с использованием ходунков, 39 % были адаптированы к инвалидной коляске, 21 % оставались прикованными к постели).
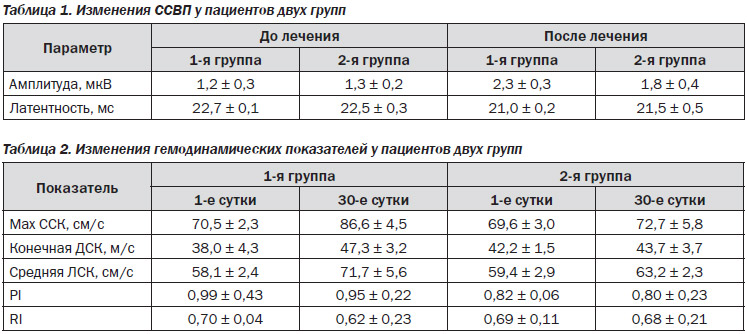
Исследование ССВП после проведения терапевтических мероприятий у пациентов двух групп выявило увеличение амплитуды и уменьшение латентности коркового ответа N20. Данные изменения были более выражены в 1-й группе, однако различия не достигли уровня статистической значимости (табл. 1).
При проведении транскраниальной магнитной стимуляции до начала терапевтических мероприятий у всех пациентов в зоне пораженного полушария вызывался непостоянный корковый ответ со сниженной амплитудой менее 1,5 мкВ. На 30-й день терапии у пациентов 1-й группы корковый ответ регистрировался более регулярно и амплитуда его возросла до 2–2,5 мкВ. У пациентов 2-й группы амплитуда коркового ответа увеличилась незначительно (до 1,6–1,7 мкВ).
У 27 (90 %) пациентов 1-й группы к 10-м суткам заболевания определялась наиболее полная нормализация паттерна ЭЭГ в виде достоверного регресса межполушарной асимметрии в a-диапазоне и минимальной выраженности медленноволновой активности в проекции очага ишемии мозга. У пациентов 2-й группы даже на 20–30-е сутки были выявлены остаточные изменения в виде стойкого очага медленных волн в проекции ишемии, межполушарная асимметрия в a-1-диапазоне с преобладанием мощности в интактном полушарии.
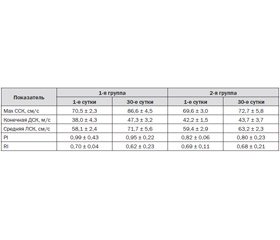
По данным контрольной допплерографии, у пациентов двух групп на 30-е сутки отмечалось повышение линейной скорости кровотока (ЛСК) и снижение индексов периферического сосудистого сопротивления на стороне очага поражения, что свидетельствует об усилении перфузии в аффектированном сосудистом бассейне. Несмотря на то, что данные изменения не достигли уровня статистической значимости, подобная тенденция была более выражена у пациентов 1-й группы (табл. 2).
Проведенное исследование показало, что применение холина альфосцерата (Глиатилин) не позднее 12 ч с момента развития ишемического инсульта приводит к достоверному регрессу тяжести неврологической симптоматики и достижению поставленных реабилитационных целей. Более выраженное повышение церебральной перфузии в пораженном сосудистом бассейне на фоне приема холина альфосцерата может быть следствием нейрометаболической активации и усиления пластических процессов в зоне ишемии. Стабилизация нейрофизиологических показателей на фоне приема Глиатилина не достигла достоверных значений, но происходила в более короткие сроки и в большем объеме.
Таким образом, в настоящем исследовании была сделана попытка оценить эффективность ранней нейропротекторной терапии препаратом Глиатилин у больных с полушарным ишемическим инсультом, а также динамику клинического статуса пациентов, скорость и полноту восстановления утраченных функций, успешность решения реабилитационных задач. Кроме того, была проведена оценка церебральной гемодинамики пораженного полушария, динамики нейрофизиологических показателей (ЭЭГ, ССВП, ТМС).
Впервые опубликовано в «Журнале неврологии
и психиатрии», 2013, № 1
1. Гусев Е.И., Скворцова В.И., Стаховская Л.В. Эпидемиология инсульта в России // Журн. неврол. и психиатр. (Приложение «Инсульт»). — 2003. — 8. — 4–9.
2. Кузнецов А.Н. Лечение инсульта в Пироговском центре // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. — 2006. — 1. — 1. — 63–65.
3. Саватеева Т.Н., Якуцени П.П., Лукьянова И.Ю., Афанасьев В.В. Структура — функция — терапевтический эффект (к вопросу о лечебных свойствах генериков и инновационных препаратов на примере центральных холинергических веществ) // Атмосфера. Нервные болезни. — 2011. — 2. — 27–36.
4. Скоромец А.А., Стаховская Л.В., Белкин А.А. и др. Новые возможности нейропротекции в лечении ишемического инсульта // Журн. неврол. и психиатр. (Приложение «Инсульт»). — 2008. — 22. — 32–38.
5. De Deyn P.P., Orgogozo J.M., De Reuck J. Acute treatment of stroke. PASS group. Piracetam Acute Stroke Study // Lancet. — 1998. — 25. — 352. — 9124. — 326.
6. Heiss W.D., Brainin M., Bornstein N.M., Tuomilehto J., Hong Z. Cerebrolysin Acute Stroke Treatment in Asia (CASTA) Investigators. Cerebrolysin in patients with acute ischemic stroke in Asia: results of a double-blind, placebo-controlled randomized trial // Stroke. — 2012. — 43. — 3. — 630–636.
7. Horn J., de Haan R.J., Vermeulen M., Limburg M. Very Early Nimodipine Use in Stroke (VENUS): a randomized, double-blind, placebo-controlled trial // Stroke. — 2001. — 32. — 2. — 461–465.
8. Kobak K.A., Kane J.M., Thase M.E., Nierenberg A.A. Why do clinical trials fail? The problem of measurement error in clinical trial: time to tesy new paradigms? // Jornal of clinical Psychopharmacology. — 2007. — 27. — 1.
9. Labiche L.A., Grotta J.C. Clinical trial for cytoprotection in stroke // NeuroRx. — 2004. — 1. — 46–70.
10. Ledford H. Ways to fix the clinical trial // Nature. — 2011. — 477. — 29.
11. Monzani D., Genovese E., Marrara A. Stimulation of the cholinergic neurotransmissions enhances the efficacy of vestibular rehabilitation // Acta Otorhinolaryngol Ital. — 2010. — 30. — 1. — 11–19.
12. Rosser N., Floel A. Pharmacological enhancement of motor recovery in subacute and chronic stroke // Neuro Rehabilitation. — 2008. — 23. — 1. — 95–103.
13. Saver J.L., Kidwell C., Eckstein M., Starkman S. Prehospital neuroprotective therapy for acute stroke: results of the Field Administration of Stroke Therapy-Magnesium (FAST-MAG) pilot trial // Stroke. — 2004. — 35. — 5. — 106–108.
14. Sprigg N., Bath P. Pharmacological enhancement of recovery from stroke // Curr. Med. Literature Stroke Rev. — 2005. — 8. — 33–39.
15. Wardlaw J.M., Sandercock P.A., Murray V. Should more patients with acute ischaemic stroke receive thrombolytic treatment? // BMJ. — 2009. — 339. — 4584.
16. Weir C.J., Kaste M., Lees K.R. Glycine Antagonist in Neuroprotection (GAIN) International Steering Committee and Investigators. Targeting neuroprotection clinical trials to ischemic stroke patients with potential to benefit from therapy // Stroke. — 2004. — 35. — 9. — 2111–2116.