Международный неврологический журнал 1 (71) 2015
Вернуться к номеру
Вплив препаратів поліпептидного походження на показники нейронального метаболізму при крововиливах на ґрунті розривів внутрішньочерепних артеріальних аневризм
Авторы: Шевага В.М., Нетлюх А.М., Кобилецький О.Я., Щибовик Д.В. - Львівський національний медичний університет ім. Данила Галицького
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Обстежені 35 хворих із геморагічним інсультом на ґрунті розриву внутрішньочерепних артеріальних аневризм різної локалізації. У 24 хворих проводилася стандартна терапія (група 1). У всіх хворих групи 1 спостерігались біохімічні прояви оксидативного стресу, нейронального ушкодження, клітинної інтоксикації й запальної відповіді у строки формування ускладнень інсульту (на 4–12-ту добу захворювання). В 11 хворих до стандартної терапії підключали Кортексин у дозі 10 мг/добу внутрішньом’язово з 1–3-ї доби захворювання на 10 днів (група 2). Під впливом терапії Кортексином установлено вірогідне зниження в сироватці крові хворих рівня продуктів перекисного окиснення ліпідів і білків, вірогідне зниження активності нейронспецифічної енолази, рівня інтерлейкіну-6 і молекул середньої маси. Отже, використання в комплексі терапії поліпептидних препаратів сприяє більш швидкому усуненню наявних біохімічних відхилень.
Обследованы 35 больных с геморрагическим инсультом на почве разрывов внутричерепных артериальных аневризм различной локализации. У 24 больных проводилась стандартная терапия (группа 1). У всех больных группы 1 наблюдались биохимические проявления окислительного стресса, нейронального повреждения, клеточной интоксикации и воспалительного ответа в сроки формирования осложнений инсульта (на 4–12-е сутки заболевания). У 11 больных к стандартной терапии подключали Кортексин в дозе 10 мг/сут-
ки внутримышечно с 1–3-х суток заболевания на 10 дней (группа 2). Под воздействием терапии Кортексином установлено достоверное снижение в сыворотке крови больных уровня продуктов перекисного окисления липидов и белков, достоверное снижение активности нейронспецифической энолазы, уровня интерлейкина-6 и молекул средней массы. Таким образом, использование в комплексе терапии полипептидных препаратов способствует более быстрому устранению имеющихся биохимических отклонений.
We have examined 35 patients with hemorrhagic stroke caused by rupture of intracranial arterial aneurysms of various locations. In 24 patients we have used standard therapy (group 1). All patients of group 1 reported biochemical manifestations of oxidative stress, neuronal damage, cell intoxication and inflammatory response within a period of stroke complications onset (on 4–12th day of the disease). In 11 patients, standard therapy was added by Cortexin in a dose of 10 mg/day intramuscularly from the 1st-3rd days of the disease, for 10 days (group 2). Under the influence of Cortexin therapy, we have noted a significant decrease in the blood serum of patients of levels of lipid peroxidation products and proteins, a significant decrease in the activity of neuron-specific enolase, levels of interleukin-6 and the average-weight molecules. Thus, the use in combination therapy of polypeptide drugs promotes more rapid normalization of biochemical abnormalities.
геморагічний інсульт, аневризма, нейропротекція, поліпептидні препарати, Кортексин.
геморрагический инсульт, аневризма, нейропротекция, полипептидные препараты, Кортексин.
hemorrhagic stroke, aneurysm, neuroprotection, polypeptide drugs, Cortexin.
Статья опубликована на с. 50-54
У наш час концепція й основні поняття нейропротекції продовжують уточнюватися й доповнюватися. Під нейропротекцією слід розуміти різноманітні заходи та засоби, здатні убезпечити нервову тканину, зокрема головний мозок, від пошкодження. Концепція нейропротекції поступово еволюціонує від блокади вибіркових патофізіологічних механізмів до нейромодуляції — мультимодальних впливів, що зміщують баланс механізмів пошкодження та захисту нервової тканини [1].
Наявні дослідження (Малахов В.О. та співавт., 2010 та ін.) свідчать про визначальний вплив біохімічних факторів на перебіг захворювання при інсульті та, як результат, на формування стійкого вторинного неврологічного дефіциту [7].
Відмічено [12], що пік підвищення ІЛ–6 при субарахноїдальному крововиливі (САК) спостерігається на 6–ту добу. Вірогідне зростання рівня інтерлейкіну–6 (ІЛ–6) на 7–му добу після геморагічного інсульту порівняно з 1–3–ю добою може служити додатковим критерієм прогнозу ризику розвитку церебрального вазоспазму й вторинного ішемічного ушкодження головного мозку [3]. Підвищення концентрації деяких цитокінів, зокрема ІЛ–6, у сироватці крові є проявом розвитку запальної реакції в нервовій системі [12], що, в свою чергу, може поглибити нейрональне ушкодження при вторинній ішемії головного мозку.
В останні роки виявлена важлива роль перекисного окиснення білків (ПОБ) у розвитку ряду захворювань, навіть вважається, що ці процеси передують активації перекисного окиснення ліпідів (ПОЛ) і є маркерами оксидативного стресу [6]. На думку Ю.І. Губского та співавт. [10], ПОБ може бути пусковим механізмом патологічних процесів, що мають місце при стресі, а також є найбільш раннім маркером оксидативного стресу. За динамікою змін продуктів ПОБ можна судити про ступінь ураження клітини в умовах оксидативного стресу, а також про резервно–адаптаційні можливості організму. У ряді клінічних досліджень відмічено суттєві зміни продуктів ПОБ, причому ступінь окисної модифікації білкової молекули корелювала з тяжкістю перебігу захворювання [10].
Інтегральним показником вираженості порушень метаболізму та деструктивних змін у нервовій тканині є концентрація нейроспецифічних білків, одним з яких є нейронспецифічна енолаза (НСЕ) [4]. Кількісне виявлення цього білка в сироватці крові та лікворі свідчить про ступінь ушкодження нейронів та порушення цілості гематоенцефалічного бар’єра [4].
Вказані біохімічні порушення є як проявом первинного пошкодження головного мозку, так і ймовірними патогенетичними факторами розвитку його вторинного пошкодження. Відома тканинно–специфічна дія препаратів поліпептидного походження на кору головного мозку, що викликає зниження токсичних ефектів ней–ротропних речовин, стимулює репаративні процеси в головному мозку, прискорює відновлення функцій головного мозку після стресових впливів [5].
Відомим є спосіб лікування когнітивних порушень у гострому та віддаленому періодах черепно–мозкової травми, гострому та віддаленому періодах церебрального ішемічного інсульту за допомогою комплексу низькомолекулярних поліпептидних фракцій (препарат Кортексин) [8]. Наявні також дані про нейропротективний вплив Кортексину при геморагічному інсульті [11]. Проте нами не знайдено в літературі даних про вплив лікування з використанням поліпептидних препаратів на біохімічні показники запального процесу в пацієнтів із геморагічним інсультом на ґрунті розривів внутрішньочерепних артеріальних аневризм.
Мета дослідження: вивчити біохімічні показники оксидативного стресу, рівень маркерів імунно–запальної відповіді, нейронального ушкодження й клітинної інтоксикації при геморагічному інсульті на ґрунті розривів внутрішньочерепних артеріальних аневризм та вплив на них препаратів поліпептидного походження.
Матеріал і методи дослідження
Обстежено 35 хворих із геморагічним інсультом на ґрунті розривів артеріальних аневризм різної локалізації. Діагноз встановлювався на підставі клінічних даних і підтверджувався методом комп’ютерної томографії, магнітно–резонансної томографії та церебральної ангіографії.
Показники перекисного окиснення ліпідів визначали спектрометричним методом Р.А. Тімірбулатова та Є.І. Селезньова (1981). Окиснювальна модифікація білків (ПОБ) визначалась методом спектрофотометрії за методикою Дубініної та співавт. (1995). Концентрацію середніх молекул (МСМ) у плазмі крові визначали скринінговим методом Н.І. Габрієля та В.І. Ліпатової (1993). Визначення рівня ІЛ–6 проводилось у сироватці крові пацієнтів з використанням набору реагентів «Интерлейкин–6–ИФА–БЕСТ» А–8768. Кількісне визначення концентрації нейронспецифічної енолази в сироватці крові проводили методом твердофазного імуноферментного аналізу з використанням набору реактивів «NSE–ИФА–БЕСТ».
Дослідження виконувалися шляхом випадкового відбору пацієнтів на 4–13–ту добу після САК, тобто в строки, що відповідали загальноприйнятим уявленням про час появи ускладнень субарахноїдального крововиливу, зокрема початку розвитку вазоспазму, піку вазоспазму й період його закінчення. У 24 хворих із САК проводилась стандартна терапія (група 1), 8 із них надалі мали несприятливий результат лікування (33,3 %). В 11 хворих до стандартної терапії включали Кортексин у дозі 10 мг/до–бу внутрішньом’язово з 1–3–ї доби захворювання на 10 днів (група 2), з них у 3 пацієнтів перебіг захворювання був несприятливим (27,3 %) — розвивалась вторинна ішемія головного мозку тяжкого ступеня або наставала смерть хворого внаслідок ускладнень геморагічного інсульту. Статистична обробка даних проводилась за допомогою програми Statistica 6.0 із визначенням показника Стьюдента.
Результати дослідження та їх обговорення
У сироватці крові пацієнтів групи 1 на 4–12–ту добу після САК спостерігається активація процесів ПОЛ, рівень продуктів ПОЛ у цей період становить 0,18 ± ± 0,03 ум.од., р = 0,002 (контроль — 0,07 ± 0,01 ум.од.) (рис. 1).
/51/51.jpg)
Як показано на рис. 1, у пацієнтів групи 2 на 4–12–ту добу після САК спостерігається незначна активація процесів ПОЛ, рівень продуктів ПОЛ у цей період становить 0,10 ± 0,01 ум.од. (у контролі 0,07 ± 0,01 ум.од., р > 0,5) і є вірогідно нижчим, ніж відповідний показник у групі 1 (0,18 ± 0,03 ум.од., р = 0,03).
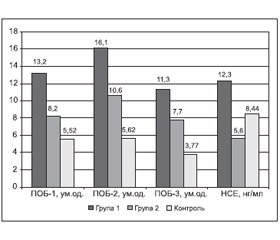
У групі 1 спостерігалось підвищення рівня нейтральних альдегідних продуктів ПОБ (ПОБ–1, спектрофотометрія при довжині хвилі 356 нм), коли їх рівень в сироватці крові становив 13,2 ± 1,0 ум.од. (р < 0,001) при контрольному рівні 5,52 ± 0,58 ум.од. (рис. 2). При проведенні спектрофотометрії при довжині хвилі 370 нм спостерігались подібні зміни — вірогідне (p < 0,001) порівняно з контролем підвищення рівня нейтральних кетонових продуктів ПОБ (ПОБ–2) до 16,1 ± 1,0 ум.од. при контрольному рівні 5,62 ± 0,62 ум.од. При довжині хвилі 430 нм дані спектрофотометрії свідчили про підвищення рівня основних альдегідних продуктів ПОБ (ПОБ–3), їх рівень становив 11,3 ± 0,8 ум.од. (p < 0,001) при контрольному 3,77 ± 0,44 ум.од. Рівень НСЕ становив 12,3 ± 2,0 нг/мл при контрольному 8,44 ± 0,45 нг/мл і був невірогідно підвищеним (р = 0,07).
Як показано на рис. 2, у групі 2 в сироватці крові хворих спостерігалось підвищення нейтральних альдегідних продуктів (ПОБ–1) до 8,2 ± 1,1 ум.од., що вірогідно відрізнялось від аналогічного показника в групі 1 (13,2 ± 1,0 ум.од., р = 0,035) та було на рівні контролю (5,52 ± 0,58 ум.од., р = 0,09). При проведенні спектрофотометрії при довжині хвилі 370 нм спостерігались подібні зміни — вірогідне (р = 0,003) порівняно з контролем підвищення рівня нейтральних кетонових продуктів (ПОБ–2) до 10,6 ± 1,4 ум.од. при контрольному рівні 5,62 ± ± 0,62 ум.од. При цьому цей показник був вірогідно нижчим від аналогічних даних у групі 1 (16,1 ± 1,0 ум.од., р = 0,003). Дані спектрофотометрії при довжині хвилі 430 нм свідчили про підвищення основних альдегідних продуктів (ПОБ–3) у сироватці крові хворих групи 2 до 7,7 ± 1,2 ум.од. (p = 0,0035) при контрольному рівні 3,77 ± 0,44 ум.од. У той же час ці дані не відрізнялись від показника в групі 1 (11,3 ± 0,8 ум.од., р = 0,06). Рівень НСЕ у хворих 2–ї групи становив 5,6 ± 1,0 нг/мл і був вірогідно нижчим від контрольного рівня (8,44 ± 0,45 нг/мл, р = 0,035) і аналогічного показника в групі 1 (12,3 ± ± 2,0 нг/мл, р = 0,015).
У групі 1 спектрофотометрія, проведена при довжині хвилі 530 нм, виявила відсутність змін активності основних кетонових продуктів ПОБ (ПОБ–4). Їх рівень становив 1,46 ± 0,33 ум.од. (р > 0,2) при контрольному рівні 2,01 ± 0,45 ум.од. Рівень МСМ у групі 1 сягав 1,15 ± 0,11 ум.од. (р < 0,001), що було вірогідно вищим від контролю (0,22 ± 0,01 ум.од.) (рис. 3).
Як показано на рис. 3, спектрофотометрія, проведена у хворих групи 2 при довжині хвилі 530 нм, виявила вірогідне зниження активності основних кетонових продуктів ПОБ (ПОБ–4). Їх рівень становив 0,66 ± ± 0,08 ум.од. (р = 0,04) при контрольному рівні 2,01 ± ± 0,45 ум.од. Порівняно з групою 1 (1,46 ± 0,33 ум.од.) їх активність була невірогідно нижчою (р = 0,07). Концентрація МСМ у сироватці хворих групи 2 становила 0,49 ± 0,13 ум.од (р = 0,07), будучи невірогідно вищою від контролю (0,22 ± 0,01 ум.од.) та вірогідно нижчою від показника в групі 1 (1,15 ± 0,11 ум.од., р = 0,004).
Рівень ІЛ–6 у сироватці крові хворих групи 1 становив 22,6 ± 5,1 пг/мл, будучи вірогідно (p < 0,001) підвищеним порівняно з контролем (1,9 ± 0,1 пг/мл) (рис. 4).
Рівень ІЛ–6 в сироватці крові хворих групи 2 невірогідно підвищувався (8,5 ± 2,9 пг/мл, p = 0,05) порівняно з контролем (1,9 ± 0,1 пг/мл) та вірогідно був нижчим, ніж показник у групі 1 (22,6 ± 5,1 пг/мл, р = 0,045).
Отже, бачимо вірогідну нормалізацію досліджуваних показників у хворих групи 2 при застосуванні препаратів поліпептидного складу. Пептиди в Кортексині становлять 46 % від усього об’єму препарату. У даний час деякими дослідниками він розглядається як один із перспективних нейротрофічних засобів [9]. Згідно з даними літератури, Кортексин захищає клітини мозку від оксидативного стресу, викликаного акустичною дією на щурів, генетично схильних до геморагічного інсульту [2].
Механізм дії Кортексину пов’язаний із його метаболічною активністю [5]. Проведене нами дослідження показало зменшення в пацієнтів із геморагічним інсультом біохімічних проявів запальної реакції, оксидативного стресу, нейронального ушкодження й клітинної інтоксикації під впливом терапії Кортексином. Це проявлялося у вигляді вірогідного зниження в сироватці крові в строк формування ускладнень інсульту рівня продуктів ПОЛ і більшості продуктів ПОБ, а також вірогідного зниження активності НСЕ, рівня ІЛ–6 та МСМ.
Висновки
1. У хворих із геморагічним інсультом на ґрунті розривів внутрішньочерепних артеріальних аневризм спостерігаються біохімічні прояви оксидативного стресу, клітинної інтоксикації, запальної відповіді в термін формування ускладнень на 4–12–ту добу захворювання.
2. Використання в комплексі терапії поліпептидних препаратів сприяє швидкій нормалізації наявних біохімічних відхилень.
3. Необхідні подальші дослідження для визначення клінічного ефекту терапії Кортексином у групі хворих із геморагічним інсультом на ґрунті розривів внутрішньочерепних артеріальних аневризм.
1. «Академія інсульту — 2013»: підсумки року і погляд у майбутнє // Здоров’я України. — 2013. — № 24 (325) — С. 48–49.
2. Анализ содержания 8–оксо–2’–дезоксигуанозина в ДНК клеток мозга крыс при изучении защитного действия кортексина / Д.С. Есипов, О.В. Есипова, Т.В. Зиневич, Т.А. Горбачева, Т.С. Невредимова, А.Л. Крушинский, В.С. Кузенков, В.П. Реутов // Вестник МИТХТ. — 2012. — Т. 7, № 1. — С. 59–63.
3. Динаміка інтерлейкіну–6 як прояв імунно–запальної реакції при аневризматичному субарахноїдальному крововиливі / Шевага В.М., Нетлюх А.М., Щибовик Д.В., Діжак Я.І. // Ендоваскулярна нейрорентгенохірургія. — 2013. — № 1. — С. 54–59.
4. Карякина Г.М. Нейронспецифическая энолаза как индикатор поражения мозговой ткани при ишемических инсультах / Г.М. Карякина, М.А. Хинко // Неврологический вестник. — 2007. — № 1. — С. 41–44.
5. Компедіум. Інструкція із застосування препарату Кортексин [Електронний ресурс]. — Режим доступу: URL: http://compendium.com.ua/info/169794/print/kompanija–farmarketinga–zdravo–/korteksin–sup–sup–. — Назва з екрану.
6. Коренєв М.М. Показники перекисного окислення білків і антиоксидантного захисту у дітей із різною патологією міокарда / М.М. Коренєв, Л.І. Рак // Вісник Харківського національного університету ім. В.Н. Каразіна. — 2009. — № 855, вип. 17. — С. 34–38.
7. Малахов В.О. Дослідження ефективності Кортексину в гострий період ішемічного інсульту з урахуванням функціонального стану імунонейроендокринної системи / В.О. Малахов, В.О. Монастирський // Ліки України. — 2010. — № 5 (141). — С. 78–83.9.
8. Патент 72268 України, МПК А61К 31/00, А61Р 25/00. Спосіб лікування когнітивних порушень за допомогою комплексу низькомолекулярних поліпептидних фракцій (препарату «кортексин») / В.М. Шевага, Р.В. Кухленко, А.В. Паєнок, О.Я. Кухленко, Б.В. Задорожна; заявник і патентовласник Львівський національний медичний університет ім. Данила Галицького. — № u201201593; заявл. 14.02.2012; опубл. 10.08.2012. Бюл. № 15.
9. Скороходов А.П. Кортексин — пятилетний опыт отечественной неврологии / Под ред. А.А. Скоромца, М.М. Дьяконова. — СПб.: Наука, 2006. — С. 68–81.
10. Токсикологические последствия окислительной модификации белков при различных патологических состояниях (обзор литературы) / Ю.И. Губский, И.Ф. Беленичев, Е.Л. Левицкий [и др.] // Сучасні проблеми токсикології. — 2005. — № 3. — C. 20–26.
11. Hemorrhagic stroke: neuroprotective effects of peptide drug cortexin / V. Reutov, A. Krushinsky, V. Kuzenkov et al. // 8th IBRO World congress of neuroscience. Florence. Italy. July 14–18. 2011. — 2011. — P. 429–429.
12. MacDonald, Robert Loch. Cerebral Vasospasm: Advances in Research and Treatment. — Thieme, 2005 — 333 р.

/52/52.jpg)