Журнал «Почки» 4 (10) 2014
Вернуться к номеру
Современные принципы нефропрофилактики и ренопротективные эффекты малобелковой диеты с применением кетоаналогов незаменимых аминокислот у пациентов с хронической болезнью почек
Авторы: Ромаданова О.И., Семидоцкая Ж.Д., Власенко М.А., Власенко Е.М., Бутикова Е.А. - Харьковская медицинская академия последипломного образования, кафедра терапии и нефрологии
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена одной из наиболее актуальных проблем в нефрологии — хронической болезни почек. Дана характеристика факторов риска развития этой патологии, а также основных направлений ее лечения. Подчеркнута немаловажная роль коррекции питания в комплексе лечения хронической болезни почек. Патогенетически обоснованным является применение малобелковой диеты с включением кетоаналогов аминокислот (Кетостерила), что обеспечивает ренопротективное действие, дает возможность увеличить додиализный период и способствует улучшению качества жизни больных с хронической болезнью почек.
Стаття присвячена одній з найбільш актуальних проблем у нефрології — хронічній хворобі нирок. Надано характеристику факторів ризику розвитку цієї патології, а також основних напрямків її лікування. Подкреслено немаловажну роль корекції харчування в комплексі лікування хронічної хвороби нирок. Патогенетично обґрунтованим є застосування малобілкової дієти з включенням кетоаналогів амінокислот (Кетостерилу), що забезпечує ренопротективну дію, дає можливість збільшити додіалізний період і сприяє покращенню якості життя хворих із хронічною хворобою нирок.
The article deals with one of the most pressing problems in nephrology — chronic kidney disease. Characteristics of risk factors for this disease, as well as the main directions of its treatment are provided. The important role of nutrition correction in the complex of treatment for chronic kidney disease is accentuated. The use of low-protein diet with inclusion of ketoanalogues of amino acids (Ketosteril) is pathogenetically substantiated that provides a renoprotective effect, gives the possibility to increase the predialysis period and improves the quality of life of patients with chronic kidney disease.
хроническая болезнь почек, диета, кетоаналоги аминокислот.
хронічна хвороба нирок, дієта, кетоаналоги амінокислот.
chronic kidney disease, diet, ketoanalogues of amino acids.
Статья опубликована на с. 59-66
Хроническая болезнь почек (ХБП) — общемедицинская проблема, имеющая глубокие социально–экономические последствия, связанные с ее широкой распространенностью в популяции (10–15 % населения), утратой трудоспособности и смертностью вследствие развития терминальной почечной недостаточности и сердечно–сосудистых осложнений (ССО), риск которых у пациентов с нарушенной функцией почек возрастает в десятки раз [1–5].
ХБП — понятие наднозологическое и одновременно не являющееся формальным объединением хронических заболеваний почек различной природы в одну большую аморфную группу, подменяя этиологический принцип. Понятие ХБП отражает наличие общих факторов риска развития и прогрессирования нефропатии, универсальных механизмов формирования нефросклероза и, как следствие, способов первичной и вторичной профилактики, а также наличие общего прогноза — развития терминальной почечной недостаточности.
Следует подчеркнуть, что понятие ХБП не отменяет нозологического подхода к диагностике заболеваний почек. Необходимо добиваться идентификации конкретной причины (или причин) развития повреждения почек для того, чтобы установить нозологический диагноз и максимально рано назначить соответствующую этиотропную и патогенетическую терапию. В то же время концепция ХБП при различных нозологических формах является универсальным инструментом для определения степени нарушения функции, расчета риска развития терминальной почечной недостаточности и сердечно–сосудистых осложнений, планирования и оценки эффективности нефропротективного лечения, подготовки и начала заместительной почечной терапии. Под ХБП понимают наличие маркеров почечного повреждения (характеризующих активность заболевания) и/или снижение скорости клубочковой фильтрации (СКФ) ниже 60 мл/мин/1,73 м2 (характеризующее стадию и скорость прогрессирования заболевания), сохраняющееся в течение 3 мес. и более.
Данные о нозологическом составе ХБП требуют уточнения, поскольку популяционные исследования, как правило, не подразумевают проведения детального нефрологического обследования, а создаваемые в настоящее время регистры ХБП не включают пациентов на ее ранних стадиях.
В Украине, по данным Национального реестра больных хронической болезнью почек, в 2011 году различные виды заместительной почечной терапии получали 5578 человек, около 50 % из которых были в возрасте 18–44 лет (Колесник Н.А., 2012). То есть в значительной степени страдает молодая, работоспособная часть населения. На сегодняшний день, несмотря на определенный прогресс в развитии заместительной почечной терапии в Украине за последние 10 лет, обеспеченность населения страны этими видами лечения остается значительно ниже, чем в странах Евросоюза и США. В то же время возможности нефропротекторной терапии, которая позволяет затормозить прогрессирование ХБП и стабилизировать функцию почек, используются неэффективно. Отметим, что расходы на нефропротекторную терапию в 100 раз ниже, чем на заместительную почечную терапию.
/69/69.jpg)
Почки элиминируют факторы, повреждающие эндотелий, поэтому при нарушении их работы усиливается неблагоприятное влияние на сердечно–сосудистую систему традиционных, «фремингемских» факторов риска (ФР): артериальной гипертонии (АГ), инсулинорезистентности, гиперлипидемии. В то же время при СКФ < 60 мл/мин/1,73 м2 начинает проявляться и возрастает по мере ее дальнейшего снижения роль специфических «почечных» ФР ССО: нарушений фосфорно–кальциевого обмена, синдрома белково–энергетической недостаточности (БЭН), анемии, хронического воспаления, гиперурикемии. Появляются новые предикторы ССО: уровень в сыворотке крови фосфора, кальция, гемоглобина, альбумина, паратиреоидного гормона, фактора роста фибробластов 23, белка Klotho [28–30], требующие специальных методов коррекции. В результате оценка прогноза у пациентов с ХБП с использованием традиционной Фремингемской шкалы оказывается неточной и дает существенно заниженные результаты в отношении как смертности, так и кардиальных событий [26].
В то же время СКФ как интегративный показатель прогрессирования ХБП, начиная с уровня ниже 60 мл/мин/1,73 м2, является мощным предиктором ССО и смертности. Каждая последующая стадия ХБП, начиная с 3а, характеризуется дополнительным повышением сердечно–сосудистого риска в 1,5–3 раза (Co A. et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization // N. Engl. J. Med. — 2004. — 351(13). — 1296–305.)
Высокая распространенность ХБП, ее неблагоприятные исходы закономерно поднимают проблему целесообразности разработки и внедрения мероприятий по ее выявлению и нефропротекции.
В Великобритании программы ведения ХБП строятся на 4 принципах: обучение и мотивация пациентов, назначение нефропротективных препаратов, подбор диеты, оптимизация тактики наблюдения и контроля достижения целевых показателей (Richards N. et al. Primaiy care–based disease management of chronic kidney disease (CKD), based on estimated glomerular filtration rate (eGFR) reporting, improves patient outcomes // Nephrol. Dial. Transplant. — 2008. — 23(2). — 549–55).
В силу своей гомеостатической роли почки очень чувствительны к рациону питания. При этом сдвиги их деятельности направлены на предотвращение резких изменений параметров гомеостаза, в частности осмотического давления, концентрации ионов во внеклеточной жидкости, pH крови и др. [11]. В свою очередь, в процесс регуляции деятельности почек вовлечены различные нейрогуморальные системы (ренин–ангиотензин–альдостероновая (РААС), вазопрессиновая, простагландиновая), атриальный натрийуретический пептид, паратгормон (ПТГ) — витамин D3 — кальцитонин, фактор роста фибробластов, провоспалительные цитокины, что, в конечном итоге, изменяет экскреторные возможности почек, позволяя выделять вещества при избытке или экономить при недостатке их в пище.
О существовании связи между потреблением белка и прогрессированием хронических заболеваний почек стали говорить более 150 лет назад. Еще в 1836 г. Ричард Брайт предложил ограничить потребление протеина, чтобы замедлить нарастающую азотемию у больных с хроническим гломерулонефритом. С тех пор диетотерапия стала важнейшей частью лечебных и профилактических мероприятий при различных заболеваниях, и особенно при хронической болезни почек, накоплен богатый клинический и экспериментальный материал о влиянии диет с низким содержанием белка на течение патологических процессов в почках людей и животных. В экспериментальных исследованиях показано, что диета с высоким содержанием белка животного происхождения усиливает гемодинамическую нагрузку на оставшиеся нефроны, увеличивает гипертрофию клубочков и протеинурию, повышает смертность у животных с субтотальной –нефрэктомией [2]. Гипертрофия клубочкового аппарата приводит к ишемии почечных структур и развитию гломерулосклероза. Диета с низким содержанием протеина уменьшает гипертрофию и выраженность структурных изменений почек при уменьшении количества функционирующих нефронов [3]. Развитие альбуминурии также ассоциируется с увеличением потребления белка с пищей [4]. Динамика скорости клубочковой фильтрации существенно различается в ответ на острую нагрузку белками животного и растительного происхождения [5, 6], а применение кетоаналогов незаменимых аминокислот замедляет прогрессирование почечной недостаточности независимо от их суточной дозы [7, 8]. Данный эффект, в частности, может быть обусловлен снижением экспрессии провоспалительных цитокинов (TGF–, МСР–1, TNF–а) — важнейших факторов развития и прогрессирования фиброза в почках [9].
Использование малобелковой диеты (МБД) у пациентов с ХБП уменьшает выраженность вторичного гиперпаратиреоза в результате снижения уровней ПТГ [10] и фосфора в сыворотке крови, повышения продукции кальцитриола [11, 12], нормализует липидный спектр [13]. Кроме того, правильно сбалансированная МБД, замедляя прогрессирование ХБП, не оказывает отрицательного воздействия на последующую выживаемость пациентов, получающих гемодиализ [14]. Однако на вопрос, способна ли диета с низким содержанием белка животного происхождения существенно продлевать додиализный период, до настоящего времени не найдено однозначного ответа. Неоднозначные результаты применения МБД, опасность развития белково–энергетической недостаточности требуют проведения дальнейших клинических и экспериментальных исследований.
Изменения метаболизма белка при патологии почек связаны с нарушением содержания ряда аминокислот (АК). У больных с ХБП снижаются в крови уровни лизина, триптофана, тирозина, изменяется (снижается) отношение незаменимых аминокислот к заменимым (валин/глицин, тирозин/фенилаланин). Эти сдвиги обусловлены как недостаточным потреблением белка, так и ацидозом.
Полноценное сбалансированное питание должно поддерживать нейтральный азотистый баланс. Это зависит от того, в какой мере уравновешивают друг друга два противоположных процесса — поступление белков с пищей и белково–синтетическая функция печени, с одной стороны, и катаболизм белков вместе с их потерей — с другой. Нарушение сбалансированности аминокислотного состава диетических протеинов приводит к нарушению синтеза белков в организме, сдвигая динамическое равновесие белкового анаболизма и катаболизма в сторону преобладания распада собственных белков, в том числе белков–ферментов. Для предотвращения этих негативных процессов используют различные пищевые добавки или препараты, содержащие незаменимые АК, их кетоаналоги.
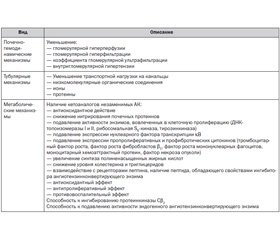
Патогенетическим обоснованием для применения малобелковой диеты послужили заключения В.М. Brenner о роли гиперфильтрации в прогрессировании ХБП [15]. На фоне повышенного потребления белка наблюдается нарастание конечных продуктов гликозилирования, которые запускают сложный каскад реакций, включая генерацию активных форм кислорода. Последние, в свою очередь, активируют сигнальные пути митоген–активирующей протеинкиназы, протеинкиназы С и активаторов транскрипции. Это сопровождается нарастанием экспрессии провоспалительных (NF–kB, моноцитарного хемоаттрактантного протеина–1, фактора некроза опухоли) и профибротических (трансформирующего фактора роста, фактора роста соединительной ткани, фактора роста тромбоцитарного происхождения) субстанций. В такой ситуации происходит трансформация канальцевых клеток в миофибробласты, что, в конце концов, приводит к тубулярной атрофии и фиброзу интерстиция. Свой вклад в формирование почечных повреждений в условиях высокого потребления белка вносит усиление ацидоза и активация эндотелина–1 (Uribarri J. и соавт., 2006; Wesson D.E. и соавт., 2007).
Необходимо отметить, что вопрос о взаимоотношениях между потреблением белков и состоянием почек крайне сложный (Lentine K. и соавт., 2004; Pecoits–Filho R., 2007).
Пожалуй, такие взаимосвязи определяются не только количеством, но и качеством пищевого протеина. Есть основания считать, что растительные белки оказывают меньшую нагрузку на почки, чем животные. При этом протеины сои (даже при высоком потреблении белка) не только оказывают, возможно, меньшее негативное влияние на почечную гемодинамику, но и имеют кардиопротекторное, нефропротективное и антисклеротическое действие (Кучер А.Г. и соавт., 2007; Uribarri J. и соавт., 2006; Sacks F.M. и соавт., 2006).
Высокое содержание белка животного происхождения и фосфора в рационе, артериальная гипертензия способствуют развитию гиперфильтрации. Среди причин, приводящих к гиперфильтрации на фоне белковых нагрузок, можно выделить:
— участие РААС;
— усиление синтеза NО за счет увеличения поступления L–аргинина к местам образования оксида азота в почках;
— прямое вазодилататорное действие аминокислот L–аргинина, глицина, аланина;
— подавление активности механизма канальце–клубочковой обратной связи;
— изменение гомеостаза и почечного транспорта кальция;
— активацию секреции глюкагона;
— повышение активности провоспалительных цитокинов (MCP–1, TNF–a, TGF–b1).
В практике лечения больных на додиализных стадиях ХБП есть достаточно много вариантов диетических рекомендаций, связанных с ограничением поступления белка, хотя результаты применения малобелковой диеты (0,6–0,8–1,0 г белка/кг/сут) в плане замедления прогрессирования ХБП оказались неоднозначными (Klahr S. и соавт., 1994; Hansen H.P. и соавт., 2002; Me–loni C. и соавт., 2002; Pijls L.T. и соавт., 2002; Meloni C. и соавт., 2004). Тем не менее последние накопленные данные позволяют считать, что ограничение белка в рационе действительно приводит к умеренному положительному эффекту в плане почечного прогноза при ХБП (Fouque D., Laville M., 2009).
Включение в МБД комбинации кетоаналогов аминокислот приводит к замедлению прогрессирования ХБП (Teschan P.E. и соавт., 1998; Prakash S. и соавт., 2004; Mitch W.E., 2005). При использовании препаратов кетоаналогов эссенциальных аминокислот длительное применение малобелковой диеты в додиализном периоде не вызывает нарушения белкового обмена, что благоприятно отражается на результатах дальнейшей заместительной терапии (Chauveau P. и соавт., 2009).
Консервативное лечение хронической почечной недостаточности (ХПН) применяют при III–IV стадии хронической болезни почек (I–III степени ХПН) с целью сохранения остаточной функции почек, коррекции нарушений гемостаза, выведения продуктов азотистого обмена, замедления ее прогрессирования путем воздействия на его основные патогенетические механизмы (Ротова А.А. Практические навыки).
Показано также, что при увеличении в крови концентрации АК с разветвленной цепью (валин, лейцин, изолейцин) происходит усиление выработки простагландинов, способствующих дилатации приносящей артериолы и повышению перфузионного давления в клубочковых капиллярах.
В данной ситуации применение МБД с кетоаналогами незаменимых АК может снизить некоторые отрицательные последствия гиперфильтрации.
В настоящее время известно, что многие растительные протеины, даже содержащие все незаменимые АК, усваиваются плохо. Это вызвано несколькими причинами: 1) толстые оболочки растительных клеток часто не поддаются действию пищеварительных соков; 2) наличием ингибиторов пищеварительных ферментов в некоторых растениях, например в бобовых; 3) трудностью расщепления растительных белков до АК.
Полагают, что кетоаналоги незаменимых АК являются мощными и специфическими ингибиторами тирозинкиназы, которая связана с клеточными рецепторами нескольких факторов роста: тромбоцитарным фактором роста, фактором роста мононуклеарных фагоцитов [16]. Он также модулирует на уровне тран–скрипции регуляцию TGF–b1 — цитокина, вовлеченного в клеточную пролиферацию, синтез и накопление внеклеточного матрикса [17, 18].
Актуальной проблемой клинической медицины, и в частности нефрологии, является дальнейшее нарастание количества больных с первичными и вторичными гломерулярными повреждениями, быстрое развитие склеротических процессов в почках, а также резистентность к терапии [19, 20]. Известно, что болезни почек чаще поражают лиц молодого возраста, приводя к их быстрой инвалидизации и смерти от уремии, требующей лечения заместительной почечной терапией. Поэтому основной задачей клинической нефрологии является выбор таких терапевтических подходов, которые позволяли бы не только продлить додиализный период ХБП, но и уменьшить выраженность симптомов уремии, а также замедлить развитие таких осложнений, как метаболический ацидоз, ренальная остеодистрофия, нарушение метаболизма глюкозы, АГ. Результаты клинических исследований подтверждают, что контролируемое ограничение белка (МБД с различным содержанием белка и применение незаменимых кетоаминокислот) в преддиализной стадии не вызывает нарушений питания и не оказывает отрицательного влияния на показатели смертности больных в начале диализа и в течение дальнейшей заместительной терапии.
Выводы
1. Концепция ХБП, обеспечивающая унификацию подходов как к профилактике, так и к диагностике и лечению нефропатии различной природы, создает предпосылки для решения этих важных задач здравоохранения.
2. МБД с включением кетоаналогов аминокислот (Кетостерила) необходимо назначать уже на ранних стадиях ХБП с целью ренопротективного действия. Причем применение Кетостерила должно быть длительным и постоянным с целью увеличения додиализного периода и улучшения качества жизни больных с ХБП.

/70/70.jpg)
/71/71.jpg)
/72/72.jpg)
/74/74.jpg)
/75/75.jpg)
/75/75_2.jpg)