Журнал «Медицина неотложных состояний» 1 (64) 2015
Вернуться к номеру
Застосування препарату Гліатилін при консервативній фармакотерапії тяжкої черепно-мозкової травми з контузійним ураженням речовини головного мозку
Авторы: П’ятикоп В.О., Кутовий І.О., Бабалян Ю.О., Стогній А.В. — Харківський національний медичний університет; Котляревський Ю.О., Пшеничний А.О. — КЗОЗ «Обласна клінічна лікарня — центр екстреної медичної допомоги та медицини катастроф»
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Наведені дані дослідження ефективності препарату Гліатилін (холіну альфосцерат) у терапії гострого періоду черепно-мозкової травми (ЧМТ), забою головного мозку тяжкого ступеня з порушенням свідомості у випадку, коли оперативне втручання не показано, але є верифіковані контузійні вогнища з порушенням свідомості. У дослідження були включені 40 пацієнтів (28 чоловіків і 12 жінок) віком від 21 до 63 років (середній вік — 42 роки) із ЧМТ тяжкого ступеня. Пацієнти були розділені на 2 групи по 20 осіб (по 14 чоловіків та 6 жінок) за призначеною терапією. I група отримувала стандартизовану метаболічну, протинабрякову, антибіотикотерапію та ноотропну терапію. II група — таку ж терапію, доповнену Гліатиліном у дозі 1000 мг/добу внутрішньовенно краплинно. На тлі проведеної фармакотерапії в динаміці відстежувалася її ефективність протягом усього курсу (14 діб) за шкалою коми Глазго, за даними епідурального сенсора внутрішньочерепного тиску та за даними спіральної комп’ютерної томограми головного мозку.
Представлены данные исследования эффективности препарата Глиатилин (холина альфосцерат) в терапии острого периода черепно-мозговой травмы (ЧМТ), ушиба головного мозга тяжелой степени с нарушением сознания в случае, когда оперативное вмешательство не показано, но есть верифицированные контузионные очаги с нарушением сознания. В исследование были включены 40 пациентов (28 мужчин и 12 женщин) в возрасте от 21 до 63 лет (средний возраст — 42 года) с ЧМТ тяжелой степени. Пациенты были разделены на 2 группы по 20 человек (по 14 мужчин и 6 женщин) согласно назначенной терапии. I группа получала стандартизированную метаболическую, противоотечную, антибиотикотерапию и ноотропную терапию. II группа — такую же терапию, дополненную Глиатилином в дозе 1000 мг/сутки внутривенно капельно. На фоне проведенной фармакотерапии в динамике отслеживалась ее эффективность на протяжении всего курса (14 суток) по шкале комы Глазго, по данным эпидурального сенсора внутричерепного давления и по данным спиральной компьютерной томограммы головного мозга.
There are provided the data from a study on Gliatilin (choline alfoscerate) efficacy in the treatment of acute period of traumatic brain injury, severe brain contusion with impaired consciousness, when surgery is not indicated, but contusion foci with impaired consciousness are detected. The study included 40 patients (28 men and 12 women) aged 21 to 63 years (mean age — 42 years) with severe traumatic brain injury. Patients were divided into 2 groups of 20 people (14 men and 6 women), according to prescribed therapy. I group received standardized metabolic, antiedemic, antibiotic and nootropic therapy. II group— the same therapy with additional intravenous fluid drip administration of Gliatilin at a dose of 1000 mg/day. On the background of pharmacotherapy, we have observed its efficacy in the dynamics throughout the whole course (14 days) by Glasgow Coma Scale, according to the data of epidural intracranial pressure monitoring and spiral computed tomography of the brain.
черепно-мозкова травма, лікування, Гліатилін.
черепно-мозговая травма, лечение, Глиатилин.
traumatic brain injury, treatment, Gliatilin.
Статья опубликована на с. 60-63
Актуальність
У сучасному суспільстві з кожним роком все більш актуальною стає проблема травматичного ураження головного мозку. Близько 1,5 мільйона осіб страждає від черепно-мозкової травми (ЧМТ) щороку, та 5,3 мільйона страждають від наслідків перенесеної ЧМТ, а летальність становить до 10 %. Дані, отримані в Німеччині, показують, що нейрохірургічного втручання потребує близько 30 % всіх пацієнтів із тяжкою травмою голови [1, 2]. Також потрібно відзначити, що перенесене травматичне ураження головного мозку часто призводить до тяжкої інвалідизації внаслідок неврологічних порушень (моторної, сенсорної, емоційно-афективної сфер та ін.) та є однією з основних передумов до розвитку у віддаленому періоді хронічних неврологічних та нейропсихологічних розладів, включаючи деменцію та паркінсонізм [3, 4]. Прогноз при забою головного мозку тяжкого ступеня нерідко несприятливий та обумовлюється характером травми, швидкістю та об’ємом надання спеціалізованої медичної допомоги. Перебіг гострого періоду тяжкої ЧМТ є головним фактором, що впливає на об’єм подальших ускладнень та порушень когнітивної сфери: пам’яті, уваги, швидкості переробки інформації, що надходить, виконавчі функції, зорово-просторове сприйняття. Все це обумовлює розробку високоефективних шляхів лікування даної нозології, як хірургічних, так і фармакологічних [5, 6].
Дотепер актуальною є розробка фармакотерапії з метою запобігання в ранній період гострої тяжкої ЧМТ вторинному ураженню речовини головного мозку через природну внутрішню запальну та імунологічну реакцію центральної нервової системи. Тому є потреба в розробці та введенні у практику новітніх медичних речовин для запобігання вторинним ураженням, викликаним гострою тяжкою ЧМТ, та їх лікування [4].
У результаті серії досліджень нейрохімічного профілю при ЧМТ доведена роль конкретних нейрохімічних речовин як маркерів біохімічного перебігу черепно-мозкової травми. Наприклад, зниження N-ацетил-аспартату при травматичному ураженні головного мозку свідчить про дисфункцію мітохондрій нейронів, підвищений лактат є предиктором гіпоксії, а підвищений холін та міоінозитол причетні до порушення цілісності мембрани та/або запалення. Крім того, зміни в деяких нейрохімічних речовинах корелюють із тяжкістю травми та пов’язані з результуючими когнітивними порушеннями у хворого, який переніс ЧМТ [6–9].
Ацетилхолін, що має велике значення в нормальному функціонуванні нервової системи, є сполукою, що відіграє вирішальну роль у розвитку кори головного мозку, її активності, контролю внутрішньомозкового кровопостачання та циклу «сон — неспання», а також є модулятором когнітивних функцій, навчання та процесів запам’ятовування [7].
У недавньому експериментальному дослідженні виявлена наявність спільного патофізіологічного механізму травматичного ураження головного мозку, що призводить до втрати альфа-нікотинового рецептора, що індукує ексайтотоксичне ураження, запалення та когнітивні порушення після травми головного мозку [9].
Bansal та його колеги також припустили, що холінергічна система здатна зменшити посттравматичну реакцію запалення, ймовірно, через вторинний медіатор. Таким чином, цілком можливо, що холінергічна стимуляція здатна запобігати запаленню при ЧМТ. Однак тому що це єдина робота на сьогодні, подальші дослідження можуть знадобитися для того, щоб повною мірою оцінити роль ацетилхоліну в перебігу ЧМТ [7].
Таким чином, можливо зауважити, що однією з цілей фармакотерапії гострого періоду травматичного ураження головного мозку є відшкодування запасів ацетилхоліну в центральній нервовій системі. Тут набувають важливого клінічного значення хімічні речовини, що є прекурсорами ацетилхоліну, яскравим представником яких є холіну альфосцерат (Гліатилін). Структурна формула холіну альфосцерату наведена на рис. 1.
/61/61.jpg)
Холіну альфосцерат бере участь у метаболізмі фосфоліпідів мозку — він розщеплюється ферментом гліцеролфосфорилхоліндіестеразою на молекулу холіну та гліцерол-1-фосфат. Холін може бути використаний для синтезу ацетилхоліну, тоді як гліцерол-1-фосфат після фосфорилювання поповнює пул фосфоліпідів. Активація цих шляхів може забезпечити вільний холін та фосфоліпіди як для синтезу ацетилхоліну, так і для відтворення компонентів мембрани нервової клітини. З іншого боку, як холінкінази, так і фосфохолінацилтрансферази здатні перетворювати холін на фосфоліпіди. Тому холіну альфосцерат є джерелом холіну того ж виду, який клітина буде отримувати, розщеплюючи власні мембрани, та, можливо, такою формою холіну, яку нейрони використовують для синтезу ацетилхоліну, коли виникає потреба у великій кількості холіну або коли він погано доступний. Також, враховуючи той факт, що на відміну від прекурсорів ацетилхоліну першого покоління (холін, лецитин) холіну альфосцерат виявляє добру здатність до проникнення через гематоенцефалічний бар’єр, його можна розглядати як важливий елемент у фармакотерапії травматичного ураження головного мозку [4].
Метою даного дослідження було виявлення ефективності препарату Гліатилін (холіну альфосцерат) у терапії гострого періоду черепно-мозкової травми, забою головного мозку тяжкого ступеня з порушенням свідомості у випадку, коли оперативне втручання не показане, але є верифіковані контузійні вогнища з порушенням свідомості.
Матеріал і методи
У дослідження були включені 40 пацієнтів (28 чоловіків і 12 жінок) віком від 21 до 63 років (середній вік — 42 роки) з ЧМТ тяжкого ступеня.
Критерії включення в дослідження:
— вік від 18 до 70 років;
— діагноз «гостра закрита черепно-мозкова травма, забій головного мозку тяжкого ступеня з формуванням контузійних вогнищ»;
— порушення свідомості на час прибуття у стаціонар згідно зі шкалою коми Глазго (ШКГ) від 5 до 9 балів;
— час надходження до стаціонару до 24 годин.
Критерії виключення:
— наявність тяжкої соматичної патології;
— наявність внутрішньомозкової патології, що потребує оперативного втручання (епі- та субдуральні гематоми, контузійні вогнища об’ємом понад 50 см3 у лобових частках та понад 30 см3 в інших ділянках головного мозку, дані датчика внутрішньочерепного тиску (ВЧТ) понад 30 мм рт.ст.).
Пацієнти були розподілені на 2 групи по 20 осіб (по 14 чоловіків та 6 жінок) за призначеною терапією:
— I група отримувала стандартизовану метаболічну, протинабрякову, антибіотикотерапію та ноотропну терапію;
— II група — таку ж терапію, доповнену Гліатиліном у дозі 1000 мг/добу внутрішньовенно краплинно.
Для оцінки ефективності терапії використовувались:
1) шкала коми Глазго — для оцінки рівня свідомості два рази на день;
2) дані епідурального сенсора внутрішньочерепного тиску — для оцінки динаміки внутрішньомозкового тиску при гострій травмі протягом перших 5 діб від початку терапії;
3) дані спіральної комп’ютерної томограми (СКТ) головного мозку — еволюція об’ємних розмірів контузійних вогнищ у процесі лікування.
Результати та обговорення
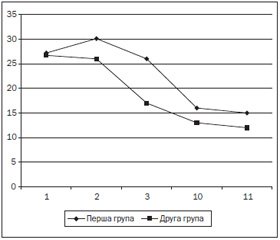
На тлі проведеної фармакотерапії в динаміці відстежувалася її ефективність протягом усього курсу (14 діб) за трьома вищеозначеними параметрами. При визначенні змін рівня порушення свідомості була виявлена позитивна динаміка середнього коефіцієнту ШКГ в обох контрольних групах із вірогідно більшим рівнем у групі із використанням Гліатиліну, з помітною позитивною динамікою вже з перших часів лікування та значним наростанням із третьої доби (рис. 2) (р < 0,05). При визначенні внутрішньочерепного тиску визначалась вірогідна різниця в першій і другій групах із більш ефективною нормалізацією у другій (рис. 3) (р < 0,05).
/62/62_2.jpg)
Також треба відмітити кореляцію покращення рівня свідомості щодо нормалізації внутрішньомозкового тиску, яка починаючи з третьої доби захворювання разюче відрізнялася в першій та другій групах (рис. 2 та 3) (р < 0,05). Також у процесі лікування було проведено серію контрольних СКТ із вимірюванням середнього сумарного об’єму вогнищ мозкової речовини та оцінкою його динаміки в процесі лікування. Дані вимірювання показали значне зменшення вогнища у другій групі порівняно з першою (рис. 4) (р < 0,05), що вкупі з усіма спостережуваними ознаками свідчить про ефективність комплексної терапії з препаратом Гліатилін порівняно зі стандартною терапією. Застосування базового курсу патогенетичної й симптоматичної терапії також призводило до позитивної динаміки показників.
Таким чином, під впливом лікування препаратом Гліатилін вірогідно позитивна динаміка основних неврологічних та нейрофізіологічних параметрів відзначена вже на третю добу.
Висновки
В умовах сучасного суспільства на фоні збільшення випадків високоенергетичної травми все більш актуальним стає питання розробки та введення у практику таких консервативних та хірургічних методів лікування, що базуються перш за все на інноваційних дослідженнях патогенезу, біохімії та фізіології травматичного ураження головного мозку. Новітні дослідження дозволяють моделювати та оцінювати перебіг травматичного ураження головного мозку на клітинному рівні, на рівні біохімічних процесів, що виникають або порушуються у клітинах головного мозку внаслідок травми, що, у свою чергу, дозволяє формувати такі протоколи лікувальної тактики, що будуть компенсувати ці патологічні ланцюги або навіть призводити до їх регресу. Експериментальним методом була доведена виникаюча у клітинах головного мозку внаслідок біохімічної дезорганізації травми недостатність такого важливого нейромедіатора, як ацетилхолін, що, у свою чергу, призводить до поглиблення патологічних реакцій та розростання пенумбри. Одним з ефективних як in vitro, так і in vivo методів компенсування недостатності інтрацелюлярних запасів ацетилхоліну є поповнення резервів речовин, необхідних для його синтезу, що більш ефективно засвоюються нейронами та дозволяють системам авторегуляції організму корегувати його вміст та компенсувати патологічні втрати та функціональний дефіцит. Одним із таких препаратів є холіну альфосцерат (Гліатилін). Холіну альфосцерат має доведену ефективність при лікуванні ішемічних та дегенеративних уражень головного мозку та наслідків перенесеної черепно-мозкової травми. У нашому дослідженні проведення динамічного контролю стану пацієнтів із гострим травматичним ураженням головного мозку на фоні включення у лікувальний протокол препарату Гліатилін дозволило об’єктивізувати клінічну цінність препарату в гострому періоді травматичного ураження головного мозку за відсутності показань до оперативного втручання.
1. Педаченко Е.Г. Современные представления о патогенезе закрытой черепно-мозговой травмы. — К.: Задруга, 1996. — 282 с.
2. Нейрохирургия. Европейское руководство / Под ред. В. Арнольд, У. Ганцер. — 2013. — Т. 1. — 371 с.
3. Лихтерман Л.Б. Черепно-мозговая травма // Медицинская газета. — 2000. — № 16. — С. 12-13.
4. Loane D.J., Faden A.I. Neuroprotection for traumatic brain injury: translational challenges and emerging therapeutic strategies // Trends. Pharmacol. Sci. — 2010. — 31. — 596-604.
5. Parnetti L., Mignini F., Tomassoni D., Traini E., Amenta F. Cholinergic precursors in the treatment of cognitive impairment of vascular origin: ineffective approaches or need for re-evaluation? // J. Neurol. Sci. — 2007. — 257. — 264-269.
6. Hoffmeister P.G., Donat C.K., Schuhmann M.U., Voigt C., Walter B., Nieber K., Meixensberger J., Bauer R., Brust P. Traumatic brain injury elicits similar alterations in a7 nicotinic receptor density in two different experimental models // Neuromolecular. Med. — 2011. — 13. — 44-53.
7. Bansal V., Ryu S.Y., Lopez N. et al. Vagal stimulation modulates inflammation through a ghrelin mediated mechanism in traumatic brain injury // Inflammation. — 2011 Mar 1.
8. Mandat T., Wilk A., Manowiec R., Koziarski A., Zieliņski G., Podgorski J.K. Preliminary evaluation of risk and effectiveness of early choline alphoscerate treatment in craniocerebral injury // Neurol. Neurochir. Pol. — 2003. — 37. — 1231-1238.
9. Harris J.L., Yeh H.W., Choi I.Y., Lee P., Berman N.E., Swerdlow R.H., Craciunas S.C., Brooks W.M. Altered neurochemical profile after traumatic brain injury: (1)H-MRS biomarkers of pathological mechanisms // J. Cereb. Blood Flow Metab. — 2012. — 32, № 12. — Р. 2122-34.

/62/62.jpg)