Газета «Новости медицины и фармации» Кардиология и ревматология (529) 2015 (тематический номер)
Вернуться к номеру
Застосування статинів у профілактиці серцево-судинних захворювань (огляд літератури)
Авторы: Анікєєва Т.В. — д.м.н., доцент, кафедра внутрішньої медицини № 2 НМУ ім. О.О. Богомольця, м. Київ
Рубрики: Ревматология, Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 20-24
Вступ
Три з п’яти найбільш «дорогих» захворювань у світі — це серцево-судинні захворювання (ССЗ), а їх профілактика в даний час визнається терміновою потребою охорони громадського здоров’я. У 2011 році ООН прийняла резолюцію про зниження смертності від хронічних неінфекційних захворювань (НІЗ) на 25 % до 2025 року. Для цього необхідно залучати всі верстви суспільства, від лікарів загальної практики до політиків, тому що:
— серцево-судинні захворювання становлять більшу частину НІЗ у світі (17 млн осіб щорічно), потім йдуть онкологічні захворювання (7,6 млн), хвороби органів дихання (4,2 млн), а також цукровий діабет (1,3 млн);
— на ці чотири групи припадає близько 80 % усіх смертей від НІЗ;
— для всіх них спільними є наступні чотири фактори ризику: вживання тютюну, відсутність фізичної активності, надмірне вживання алкоголю та неправильне харчування.
Необхідність зниження рівня холестерину (ХС) для профілактики ССЗ та їх ускладнень сумніву не викликає. Неоднозначне ставлення лікарів до медикаментозного втручання при дисліпідеміях у минулому було обумовлене неможливістю швидко оцінити позитивний вплив препаратів. Однак з появою методик, що наочно оцінюють ефективність застосування гіполіпідемічних засобів, інтерес до терапії цими препаратами став підвищуватися [3, 4]. У даний час визначені три принципові детермінанти високого ризику розвитку атеросклерозу: високі рівні холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), тригліцеридів і низькі значення ХС ліпопротеїнів високої щільності (ХС ЛПВЩ) і апо-А1 [4]. Нещодавно проведено систематичний огляд і метааналіз понад 100 рандомізованих досліджень, який показав, що в цілому підвищення рівня ХС ЛПВЩ супроводжується зниженням частоти ССЗ, проте цей ефект був обумовлений і зниженням рівнів ХС ЛПНЩ. При зниженні ХС ЛПНЩ на кожні 0,26 ммоль/л смертність від ішемічної хвороби серця (ІХС) знижувалася на 7,2 %, ризик подій ІХС — на 7,1 %, а ризик смерті від всіх причин — на 4,4 %. Збільшення ХС ЛПВЩ не завжди супроводжувалося позитивними ефектами щодо смертності від ССЗ [5, 6].
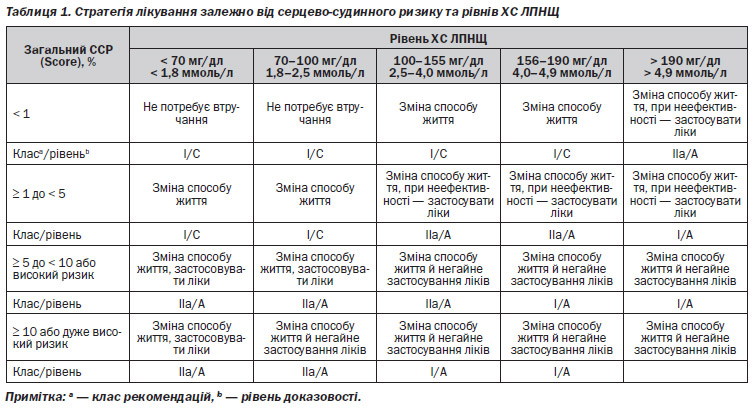
У Японії у 2009 році в дослідженні, у якому протягом 14 років спостерігали за 2634 особами віком 40 років і більше, була запропонована нова модель прогнозування ризику ССЗ. Фіксувалася частота таких подій, як ІХС, інсульт, інфаркт міокарда, коронарна реваскуляризація і раптова смерть. Нова модель, що включає вік, стать, систолічний артеріальний тиск, куріння, цукровий діабет 2-го типу, ХС ЛПНЩ, ХС ЛПВЩ, але не тригліцериди, виявилася з прогностичної точки зору дуже точною [7]. Значущість зниження ХС ЛПНЩ за принципом «чим нижче, тим краще» була підтверджена й у серії ангіографічних або регресійних досліджень протягом 90-х років минулого століття [8, 9]. Українська асоціація кардіологів застосувала дані цих досліджень для розробки стратегії лікування залежно від серцево-судинного ризику (ССР) та рівнів ХС ЛПНЩ (табл. 1) [2].
Кому, які статини потрібні і скільки?
Значення статинів у первинній профілактиці ССЗ особливо зросло після того, як при первинній профілактиці ІХС протягом декількох років було отримано вірогідне зниження серцево-судинної смертності на 28 і 34 % (при застосуванні ловастатину у дослідженні AFCAPS/TexCAPS і правастатину у дослідженні WOSCOPS відповідно) [10, 11].
У подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні JUPITER взяли участь 17 802 пацієнти: чоловіки віком від 50 років та жінки віком від 60 років з відсутністю в анамнезі інфаркту міокарда, інсульту або артеріальної реваскуляризації, з рівнем ХС ЛПНЩ менше ніж 130 мг/дл. Результати дослідження показали, що застосування розувастатину в дозі 20 мг дозволило на 44 % зменшити кількість значних серцево-судинних подій, таких як комбінований ризик розвитку інфаркту міокарда, інсульту, артеріальної реваскуляризації, госпіталізації з приводу нестабільної стенокардії, серцево-судинної смерті, порівняно з плацебо. Переносимість лікування була доброю. Саме ці дослідження відкривали перспективи для первинної профілактики ІХС та атеросклерозу статинами [12, 13]. Згідно з додатковими результатами дослідження, у пацієнтів з низьким рівнем ХС ЛПНЩ (рівень ХС ЛПНЩ у середньому 1,42 ммоль/л), які отримували статини, рівень ХС ЛПВЩ не впливав на кардіоваскулярний ризик. У пацієнтів, які отримували плацебо і мали середній рівень ХС ЛПНЩ (2,8 ммоль/л на початку і протягом терапії), рівень ХС ЛПВЩ обернено корелював з кардіоваскулярним ризиком. Надалі для визначення ефективності втручання була проведена оцінка числа осіб, які потребують лікування (number needed to treat — NNT) для запобігання 1 випадку фатальних і нефатальних серцево-судинних подій. П’ятирічний показник NNT у середньому становив 20, хоча в різних підгрупах він коливався (наприклад, для чоловіків він становив 17, для жінок ефект був нижчим — 21). Цей коефіцієнт сильно розрізнявся залежно від спадковості, маси тіла, наявності метаболічного синдрому, але особливо різнився (від 14 до 37) в осіб із сумарним ризиком < 10 і ≥ 10 % за Фрамінгемською шкалою [14].
WOSCOPS (West of Scotland Coronary Prevention Study — Західношотландське дослідження) було першим з рандомізованих плацебо-контрольованих досліджень з первинної профілактики ІХС у чоловіків середнього віку з високим ризиком коронарного атеросклерозу і з гіперхолестеринемією (ХС ЛПНЩ ≥ 5 ммоль/л). Правастатин у дозі 40 мг/добу порівнювали з плацебо. Дослідження включало 6595 осіб і тривало 5 років. У процесі дослідження в групі, що приймала правастатин, рівень ХС ЛПНЩ був знижений на 26 %, частота смертельних наслідків і нефатальних інфарктів міокарда знизилася на 31 %, необхідність в аортокоронарному шунтуванні — на 37 % [11].
ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial — Lipid Lowering Arm) — дослідження (за участю 10 305 осіб) з первинної профілактики ІХС у пацієнтів з артеріальною гіпертензією і нормальним або незначно підвищеним рівнем холестерину (≤ 6,5 ммоль/л), у якому аторвастатин (10 мг/добу) порівнювали з плацебо. Дослідження було завершено раніше запланованого терміну у зв’язку зі значним зниженням випадків розвитку інфаркту міокарда та смертності від ІХС (36 %), зниженням ризику інсультів (27 %) у групі аторвастатину [15, 16]. Доведено, що має значення не тільки доза, але і тип препарату. Переконливі дані з клінічної ефективності зниження ліпідів були отримані і за результатами дослідження захисту серця (Heart Protection Study, HPS) при застосуванні симвастатину в дозі 40 мг/добу протягом 5 років у 10 000 пацієнтів [17]. Було отримано вірогідне зниження серцево-судинної смертності (–24 %), загальної смертності (–13 %), кількості інсультів (–25 %) в осіб з високим ризиком ІХС незалежно від віку, статі, попереднього медичного анамнезу, вихідного рівня холестерину. Вірогідність результатів була дуже високою (p ≤ 0,0001 згідно з основними висновками). Важливо відзначити, що підвищення ризику смерті від несерцевих причин, включаючи злоякісні новоутворення, не було. Переносимість лікування була доброю. Підвищення активності трансаміназ печінки (АСТ і АЛТ) понад 4 верхніх межі норми спостерігалося лише в 0,42 % хворих, які приймали симвастатин, і в 0,32 % пацієнтів з групи плацебо (відмінності невірогідні). У групі хворих, які приймали в тому ж дослідженні антиоксидантний коктейль (вітаміни Е, С, бета-каротин), вірогідних змін серцево-судинної і загальної смертності отримано не було.
У дослідженні STELLAR (Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin) при порівнянні ефективності різних доз розувастатину, аторвастатину, симвастатину і правастатину щодо зниження рівня ХС ЛПНЩ у 2431 особи з гіперхолестеринемією (ХС ЛПНЩ у середньому 4,9 ммоль/л) протягом 6 тижнів терапії було показано, що максимальне зниження ХС ЛПНЩ досягається при прийомі різних доз розувастатину [18]. Розува-статин у дозі 10–40 мг/добу протягом 52 тижнів забезпечив досягнення цільових рівнів ХС ЛПНЩ (за критеріями Національної освітньої програми з холестерину США NCEP/ATP III) у 96,2 % пацієнтів, у той час як аторвастатин у дозі 10–80 мг/добу виявився настільки ж ефективним у 87,1 % хворих. Відмінності при низьких дозах препаратів були ще більш виражені: у 82,1 % випадків досягнуті цільові значення при використанні 10 мг розувастатину порівняно з 58,6 % на тлі лікування 10 мг аторвастатину [19, 20]. Встановлено також, що під впливом розувастатину активується синтез основного білка ЛПВЩ апо-А1. Він підвищується при різних дозах від 5 до 15 % [21]. Розувастатин також справляв дозозалежний позитивний вплив на рівень тригліцеридів, що був особливо помітний у пацієнтів з гіпертригліцеридемією (зниження рівня тригліцеридів було досягнуто в 40 %) [22].
Отримано дані про ефективність статинів у первинній профілактиці фібриляції передсердь у хворих з артеріальною гіпертонією, особливо при коморбідних станах (CHADS коефіцієнт ≥ 2) [23]. Аналіз ряду опублікованих досліджень показав, що для досягнення цільових рівнів ХС ЛПНЩ потрібно не тільки збільшувати дози статину або переходити на більш ефективний препарат щодо зниження ХС ЛПНЩ, тригліцеридів і підвищення ХС ЛПВЩ, але й додавати до статину ліпідокоригуючий агент або призначати фіксовану комбіновану холестеринзнижувальну терапію. Так, призначення езетимібу (10 мг/добу) до раніше застосовуваної терапії статинами забезпечувало додаткове зниження ХС ЛПНЩ приблизно на 20 % в осіб з первинною гіперхолестеринемією незалежно від статі, віку, раси і факторів ризику ІХС [24].
Систематичний огляд з аналізом 63 клінічних досліджень, що включав 27 363 хворих, проведений в період з 1980 по 2012 р., був опублікований у 2014 р. У роботі визначали прогностичну цінність різних сироваткових маркерів запалення та ефективність статинотерапії в профілактиці післяопераційної фібриляції передсердь (ФП), частота розвитку якої становила 25,5 %. Підвищені рівні СРБ, інтерлейкіну-2, -6, -8 і лейкоцитів були пов’язані з високим ризиком розвитку ФП, але найбільш переконливий зв’язок був виявлений з високим рівнем лейкоцитів. З усіх лікарських засобів із протизапальними властивостями статини виявилися найефективнішими в профілактиці післяопераційної ФП. Після статинів за ефективністю йшли: антиоксиданти (вітамін C, N-ацетилцистеїн, омега-3 поліненасичені жирні кислоти), стероїди (дексаметазон) і колхіцин. Нестероїдні протизапальні препарати не показали статистично значущої ефективності [26].
Як наочно доведено дію статинів?
Багато років лікарям та пацієнтам розповідали про біохімічні та фармакологічні властивості статинів, але, зважаючи на повільний механізм дії, переконати в нагальній потребі застосування їх було складно. Зі збільшенням і поширенням інструментальних сучасних методів оцінки атеросклеротичного ураження судин все частіше діагностуються субклінічні ураження та демонструється зменшення атером під дією статинів [1].
У дослідженні METEOR ультразвуковим методом вивчалася динаміка важливого показника — товщини інтима-медіа (ТІМ) у 12 ділянках сонних артерій (СА) на тлі тривалого прийому розувастатину особами без ІХС з відносно низьким серцево-судинним ризиком [28]. Пацієнти (984 особи) без клінічної ІХС з помірною гіперхолестеринемією, які мали вихідні показники ТІМ СА в межах 1,2–3,5 мм, булі рандомізовані на дві групи для прийому розувастатину в дозі 40 мг/добу (n = 702) або плацебо (n = 282) протягом 24 міс. Після закінчення курсу терапії розувастатин вірогідно перевершував плацебо за здатністю позитивно впливати на холестериновий профіль крові та показники ТІМ СА. Рівень ХС ЛПНЩ у пацієнтів групи активного лікування знизився в середньому на 48,8 %, а рівень ХС ЛПВЩ підвищився на 8 %, апо-А1 — на 6,7 % (у групі плацебо — 0,3; 2,8 та 1 % відповідно, p < 0,001). З огляду на тривалість високодозової терапії розувастатином у дослідженні METEOR велику увагу було приділено оцінці безпеки й переносимості лікування. Вивчена порівняна частота розвитку небажаних явищ у групах розувастатину та плацебо: підвищення активності сироваткової АЛТ спостерігалося в 0,6 і 0,4 % пацієнтів; підвищення креатинфосфокінази — в 0,1 і 0,7 %; протеїнурія зареєстрована в 0,3 і 0,4 % хворих відповідно. При цьому не були зареєстровані випадки рабдоміолізу, гепатиту і ниркової недостатності [28].
Дослідження ASTEROID також показало зменшення ТІМ, об’єму атером і бляшок на тлі зниження середнього рівня ХС ЛПНЩ в середньому до 1,6 ммоль/л [21, 25, 27, 28]. ASTEROID доказав здатність розувастатину зменшувати розмір атеросклеротичної бляшки в осіб з ІХС і високим ризиком розвитку її ускладнень. 349 пацієнтам віком понад 18 років зі зменшенням просвіту коронарних артерій ≤ 50 % на протязі ≥ 40 мм за даними коронарографії було виконано внутрішньосудинне ультразвукове дослідження для визначення вихідної тяжкості атеросклеротичного ураження судин і його динаміки через 24 міс прийому розувастатину у добовій дозі 40 мг [25]. Паралельно під час спостереження за хворими оцінювалася переносимість терапії високими дозами розувастатину та її гіполіпідемічна активність. Слід зазначити, що в дослідженні ASTEROID не було групи контролю, тому що вже у 2002 р. непризначення статинів пацієнтам з гіперліпідемією і атеросклерозом коронарних артерій вважалося неетичним. Середні значення показників холестеринового спектра крові у включених у дослідження хворих досить точно відображали характеристику дисліпідемії в кардіологічних пацієнтів: загальний холестерин — 5,3 ммоль/л, ХС ЛПНЩ — 3,4 ммоль/л, ХС ЛПВЩ — 1,1 ммоль/л, тригліцериди — 1,7 ммоль/л. У даному дослідженні розувастатин продемонстрував очікуваний гіполіпідемічний ефект. Варто відзначити, що після завершення періоду активної терапії рівень ХС ЛПНЩ знизився в середньому на 53 % від вихідного, а рівень антиатерогенного ХС ЛПВЩ підвищився на 15 %. Однак основний результат дослідження полягав у вірогідному зменшенні обсягів атероми за даними внутрішньосудинного ультразвукового дослідження: у 78 % хворих зменшився обсяг атероми на протязі 10 мм найбільш ураженого сегмента артерії, а у 64 % пацієнтів було досягнуто зменшення об’єму бляшок. При цьому просвіт коронарної артерії після курсу лікування практично не змінювався. Ризик тромботичної оклюзії знижувався саме за рахунок впливу статинів на розмір і площу атеросклеротичної бляшки. Результати дослідження ASTEROID вперше підтвердили можливість не тільки загальмувати розвиток атероми (що раніше також було продемонстровано в дослідженні REVERSAL [27] із застосуванням аналогічної методики вивчення динаміки атеросклеротичного процесу), але й викликати її регресування.
Разом з тим були отримані суперечливі дані щодо значущості зниження ТІМ СА на тлі лікування комбінацією препаратів порівняно з монотерапією [29]. Це можна пояснити тим, що вибір ТІМ СА як сурогатного маркера каротидного і коронарного атеросклерозу не завжди коректний [27]. Існує думка, що розмір каротидної атеросклеротичної бляшки або її площа є кращими предикторами нестабільності бляшки і серцево-судинних ускладнень, ніж ТІМ СА [30, 31].
У цілому потрібно відзначити інтерес, що проявляється до комбінованої терапії. У дослідженні ACCORD Lipid — фрагменті великого дослідження Action To Control Cardiovascular Risk In Diabetes (2010) — уперше оцінювалася клінічна ефективність комбінованої терапії фенофібратом і статинами у пацієнтів з цукровим діабетом з високим серцево-судинним ризиком. Переваги комбінації симвастатину з фенофібратом над монотерапією статинами стосовно таких кінцевих точок, як коронарна смерть, фатальні і нефатальні інфаркти міокарда та інші серцево-судинні ускладнення, не виявлені [32].
Отже, з появою нових класів статинів та удосконаленням методик, що наочно оцінюють ефективність гіполіпідемічних засобів, інтерес до їх призначення став підвищуватися. Труднощі на цьому шляху можуть виникнути у зв’язку з ідентифікацією істинної первинної профілактики. Величезне значення також повинна мати оцінка сумарного серцево-судинного ризику у практично здорових осіб. Саме ці критерії повинні служити підставою для застосування статинів у профілактиці ССЗ.
Висновки
Проведений за останні роки метааналіз більше ніж 10 досліджень за участю близько 100 000 пацієнтів показав відсутність впливу статинів на загальну смертність в осіб з високим кардіоваскулярним ризиком, незважаючи на відмінність характеристик і рівнів ліпідів у різних дослідженнях щодо застосування статинів. Частково цей феномен пояснюється короткостроковістю досліджень — у середньому 4 роки [33]. Подібного висновку дійшли в роботі [34] на підставі метааналізу даних 70 000 пацієнтів без ССЗ, що підтвердив ефективність статинів у пацієнтів з низьким ризиком, але не виявив значних відмінностей у старших вікових групах (> 65 років), у жінок з діабетом. У той же час метааналіз 29 досліджень за участі 80 711 осіб (2011) демонструє ефективність статинів у первинній профілактиці захворюваності та смертності від ССЗ [3, 35].
На сьогодні фармацевтичний ринок України пропонує чималий асортимент статинів. Яким з них віддати перевагу, вирішувати лікарю, враховучи дані доказової медицини, власний досвід та, на жаль, фінансові можливості пацієнта. Генерики застосовуються у всіх країнах світу, і багато страхових компаній надають перевагу саме їм, враховучи співвідношення ціни, ефективності та безпеки. Одним з якісних генеричних препаратів розувастатину є Розватор, який може розглядатися як препарат з перевіреною ефективністю та одночасно доступною ціною, що вкрай важливо в умовах нашого сьогодення.
Проте Cochrane Heart Group (2012) на підставі проведеного огляду вважає, що, попри на клінічну ефективність і відносну безпечність застосування статинів, є поки що лише поодинокі роботи про їх економічну ефективність та вплив на якість життя. І враховуючи це, а також короткостроковість досліджень, необхідно з обережністю призначати статини особам із низьким ризиком [36].
Практичне значення статинів для профілактики активно обговорюється і, очевидно, ще довго буде осмислюватися. Інтерпретація результатів надзвичайно складна. У роботі [37] автори говорять про необхідність подальшого вивчення цього досвіду і про те, що найкращою повинна бути середньозважена, у контексті всіх інших випробувань оцінка статинів [2].
На думку багатьох авторів, основа запобігання ССЗ у здорових людей із середнім ризиком — виключення куріння, оптимальна вага, розумна дієта і регулярні фізичні вправи. Навіть хірургічне лікування ожиріння на дає такого ефекту, зробив висновок С. Klein, MD, професор медицини і дієтології, після оцінки 100 оперативних випадків: «Незважаючи на видалення великої кількості підшкірного жиру — близько 20 % від загального об’єму тіла — не було жодних корисних лікувальних ефектів. Якби ці пацієнти втратили масу, сидячи на дієті та займаючись фізичними навантаженнями, ми б побачили помітне поліпшення чутливості до інсуліну та зменшення інших факторів ризику серцево-судинних захворювань» [38].
1. Аникеева Т.В. Поражения коронарных артерий у больных с экстракардиальным атеросклерозом // Питання експериментальної та клінічної медицини. — 2012. — Вип. 16, т. 1. — С. 21–24
2. Мітченко О.І., Лутай М.І. Дисліпідемії: діагностика, профілактика та лікування: Методичні рекомендації Асоціації кардіологів України. — 2011.
3. Еганян Р.А. Статины в первичной профилактике ишемической болезни сердца // Профилактическая медицина. — 2013. — 3. — С. 37–43.
4. Козиолова Н.А. Комбинированная липидкорригирующая терапия: выбор стратегии и тактики // Кардиоваск. тер. и проф. — 2010. — 9, 4. — 107–115.
5. Brief M., Ferreira-Gonzalez I., You J.J., Karanicolas P.J., Akl E.A., Wu P., Blechacz B., Bassler D., Wei X., Sharman A., Whitt I., Alves da Silva S., Khalid Z., Nordmann A.J., Zhou Q., Walter S.D., Vale N., Bhatnagar N., O’Regan C., Mills E.J., Bucher H.C., Montori V.M., Guyatt G.H. Association between change in high density lipoprotein cholesterol and cardiovascular disease morbidity and mortality: systematic review and meta–regression analysis // BMJ. — 2009. — 338. — b92.
6. Sharrett A.R., Ding J., Criqui M.H., Saad M.F., Liu K., Polak J.F., Folsom A.R., Tsai M.Y., Burke G.L., Szklo M. Smoking, diabetes, and blood cholesterol differ in their association with subclinical atherosclerosis; the Multiethnic Study of Atherosclerosis (MESA) // Atherosclerosis. — 2006. — 186, — 2. — 441–447.
7. Arima H., Yonemoto K., Doi Y., Ninomiya T., Hata J., Tanizaki Y., Fukuhara M., Matsumura K., Iida M., Kiyohara Y. Development and validation of a cardiovascular risk prediction model for Japanese: the Hisayama study // Hypertens Res. — 2009. — 32, 12. — 1119–1122.
8. Thompson G.R., Holyer J., Waters D.D. Percentage change rather than plasma level of LDL-cholesterol determines therapeutic response in coronary heart disease // Curr. Opin. Lipidol. — 1995. — 6, 6. — 386–388.
9. Thompson G.R. What targets should lipid-modulating therapy achieve to optimise the prevention of coronary heart disease? // Atherosclerosis. — 1997. — 131, 1. — 1–5.
10. Sacks F.M., Pfeffer M.A., Moye L.A., Rouleau J.L., Rutherford J.D., Cole T.G., Brown L., Warnica J.W., Arnold J.M., Wun C.C., Davis B.R., Braunwald E. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels // The New England Journal of Medicine. — 1996. — 335.
11. Scotland Coronary Prevention Study (WOSCOPS) // Circulation. — 1998. — 97, 15. — 1440–1445.
12. Rosuvastatin in the primary prevention of cardiovascular disease among patients with low levels of low-density lipoprotein cholesterol and elevated high-sensitivity C-reactive protein: rationale and design of the JUPITER trial // Circulation. — 2003. — 108, 19. — 2292–2297.
13. Ridker P.M., Danielson E., Fonseca F.A., Genest J., Gotto A.M. Jr, Kastelein J.J., Koenig W., Libby P., Lorenzatti A.J., MacFadyen J.G., Nordestgaard B.G., Shepherd J., Willerson J.T., Glynn R.J.; JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein // N. Engl. J. Med. — 2008. — 359, 21. — 2195–2207.
14. Ridker P.M., MacFadyen J.G., Fonseca F.A., Genest J., Gotto A.M., Kastelein J.J., Koenig W., Libby P., Lorenzatti A.J., Nordestgaard B.G., Shepherd J., Willerson J.T., Glynn R.J.; JUPITER Study Group. Number needed to treat with rosuvastatin to prevent first cardiovascular events and death among men and women with low low-density lipoprotein cholesterol and elevated high-sensitivity C-reactive protein: justification for the use of statins in prevention: an intervention trial evaluating rosuvastatin (JUPITER) // Circulat. Cardiovasc. Qual. Outcomes. — 2009. — 2, 6. — 616–623.
15. Sever P.S., Dahlöf B., Poulter N.R., Wedel H., Beevers G., Caulfield M., Collins R., Kjeldsen S.E., Kristinsson A., McInnes G.T., Mehlsen J., Nieminen M., O’Brien E., Ostergren J.; ASCOT Investigators. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have aver-age or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial — Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial // Lancet. — 2003. — 361. — 1149–1158.
16. Sever P., Dahlöf B., Poulter N., Wedel H., Beevers G., Caulfield M., Collins R., Kjeldsen S., Kristinsson A., McInnes G., Mehlsen J., Nieminem M., O’Brien E., Ostergren J.; ASCOT Steering Committee Members. Potential synergy between lipid-lowering and blood-pressure-lowering in the Anglo-Scandinavian Cardiac Outcomes Trial // Eur. Heart. J. — 2006. — 27, 24. — 2982–2988.
17. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial // Lancet. — 2002. — 360. — 7–22.
18. Jones P.H., Davidson M.H., Stein E.A., Bays H.E., McKenney J.M., Miller E., Cain V.A., Blasetto J.W.; STELLAR Study Group. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR Trial) // Am. J. Cardiol. — 2003. — 92. — 152– 160.
19. Kjekshus J., Pedersen T.R., Olsson A.G., Faergeman O., Pyorala K. The effects of simvastatin on the incidence of heart failure in patients with coronary heart disease // J. Cardiol. Fail. — 1997. — 3, 4. — 249–254.
20. Schuster H., Fox J.C. Investigating cardiovascular risk reduction — the Rosuvastatin GALAXY Programme // Expert Opin. Pharmacother. — 2004. — 5, 5. — 1187–1200.
21. Blasetto J.W., Stein E.A., Brown W.V., Chitra R., Raza A. Efficacy of rosuvastatin compared with other statins at selected starting doses in hypercholesterolemic patientsand in special population groups // Am. J. Cardiol. — 2003. — 91, 5A. 3С–10С.
22. Hunninghake D.B., Stein E.A., Bays H.E., Rader D.J., Chitra R.R., Simonson S.G., Schneck D.W. Rosuvastatin improves the atherogenic and atheroprotective lipid profiles in patients with hypertriglyceridemia // Coron. Artery Dis. — 2004. — 15, 2. — 115–123.
23. Hung C.Y., Lin C.H., Lohel W., Ting C.T., Wu T.J. CHADS(2) score, statin therapy, and risks of atrial fibrillation // Am. J. Med. — 2013. — 126, 2. — 133–140.
24. Kosoglou T., Meyer I., Veltri E.P., Statkevich P., Yang B., Zhu Y., Mellars L., Maxwell S.E., Patrick J.E., Cutler D.L., Batra V.K., Affrime M.B. Pharmacodynamic interaction between the new selective cholesterol absorption inhibitor ezetimibe andsimvastatin // Br. J. Clin. Pharmacol. — 2002. — 54, 3. — 309–319.
25. Nissen S.E., Nicholls S.J., Sipahi I., Libby P., Raichlen J.S., Ballantyne C.M., Davignon J., Erbel R., Fruchart J.C., Tardif J.C., Schoenhagen P., Crowe T., Cain V., Wolski K., Goormastic M., Tuzcu E.M.; ASTEROID Investigators. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial // JAMA. — 2006. — 295, 13. — 1556–1565.
26. Jacob K.A., Nathoe H.M., Dieleman J.M. et al. Inflammation in new-onset atrial fibrillation after cardiac surgery: a systematic review // Eur. J. Clin. Invest. — 2014. — 44 (4). — 402–28. DOI: 10.1111/eci.12237.
27. Bale B.F., Doneen A.L., Drueding R., Charland S.L. Aggressive risk factor modification in patients with subclinical atherosclerosis reduces plaque burden and regresses carotid artery wall thickness // Atherosclerosis. — 2006. — 7, Suppl. 161.
28. Crouse J.R. 3rd, Raichlen J.S., Riley W.A., Evans G.W., Palmer M.K., O’Leary D.H., Grobbee D.E., Bots M.L.; METEOR Study Group. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial // JAMA. — 2007. — 297, 12. — 1344–1353.
29. Fleg J.L., Mete M., Howard B.V., Umans J.G., Roman M.J., Ratner R.E., Silverman A., Galloway J.M., Henderson J.A., Weir M.R., Wilson C., Stylianou M., Howard W.J. Effect of statins alone versus statins plus ezetimibe on carotid atherosclerosis in type 2 diabetes: the SANDS (Stop Atherosclerosis in Native Diabetics Study) trial // J. Am. Coll. Cardiol. — 2008. — 52, 25. — 2198–2205.
30. Sharma K., Blaha M.J., Blumenthal R.S., Musunuru K. Clinical and research applications of carotid intima-media thickness // Am. J. Cardiol. — 2009. — 103, 9. — 1316–1320.
31. Finn A.V., Kolodgie F.D., Virmani R. Correlation between carotid intimal-media thickness and atherosclerosis: a point of view from pathology // Arteriosсler. Thromb. Vasc. Biol. — 2010. — 30, 2. — 177–181.
32. ACCORD Study Group; ACCORD Eye Study Group, Chew E.Y., Ambrosius W.T., Davis M.D., Danis R.P., Gangaputra S., Greven C.M., Hubbard L., Esser B.A., Lovato J.F., Perdue L.H., Goff D.C. Jr, Cushman W.C., Ginsberg H.N., Elam M.B., Genuth S., Gerstein H.C., Schubart U., Fine L.J. Effects of combination lipid therapy in type 2 diabetes mellitus // N. Engl. J. Med. — 2010. — 362, 17. — 1563–1574.
33. Кухарчук В.В. Медикаментозная терапия нарушений липидного обмена у больных сахарным диабетом: решенные и нерешенные вопросы // Consilium Medicum. Болезни сердца и сосудов. — 2006. — 2, 2.
34. Brugts J.J., Deckers J.W. Statin prescription in men and women at cardiovascular risk: to whom and when? // Curr. Opin. Cardiol. — 2010. — 25, 5. — 484–489.
35. Tonelli M., Lloyd A., Clement F., Conly J., Husereau D., Hemmelgarn B., Klarenbach S., McAlister F.A., Wiebe N., Manns B.; Alberta Kidney Disease Network. Efficacy of statins for primary prevention in people at low cardiovascular risk: a metaanalysis // CMAJ. — 2011. — 183, 16. — E1189–E1202.
36. Statins for the primary prevention of cardiovascular disease (Review). Copyright 2012. The Cochrane Collaboration. — John Wiley & Sons Ltd, 2012.
37. Yusuf S., Lonn E., Bosch J. Lipid lowering for primary prevention // Lancet. — 2009. — 374. — 1152–1155.
38. http://www.westchesterhealth.com/wh/klein