Газета «Новости медицины и фармации» Кардиология и ревматология (529) 2015 (тематический номер)
Вернуться к номеру
Болезнь-модифицирующая терапия остеоартроза: новые возможности
Авторы: Татьяна Чистик
Рубрики: Ревматология, Кардиология
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 35-38
Мышечно-скелетные заболевания чрезвычайно распространены в популяции, поражают все возрастные группы, как правило, уменьшают функциональную способность больных вплоть до инвалидности, что приводит к экономическим нагрузкам и для самого больного, и для общества. Социально-экономический ущерб вследствие мышечно-скелетных заболеваний велик — в основном за счет болей в нижней части спины, остеоартроза (ОА) и ревматоидного артрита. Боль является основным симптомом всех заболеваний суставов, при ОА именно боль определяет нетрудоспособность и ухудшение качества жизни. В среднем распространенность клинически манифестного ОА в большинстве стран составляет около 10–12 %. С возрастом нарастает частота обращений в связи с болью при остеоартрозе крупных суставов (до 25 % и более).
Многие годы считалось, что ОА является следствием возрастного «изнашивания» хряща. Однако в настоящее время не вызывает сомнения, что ОА — заболевание со сложным патогенезом, так что изучение его звеньев до сих пор является актуальным. Данная патология рассматривается как гетерогенная группа заболеваний суставов, патоморфологически характеризующихся фокальным разрушением суставного хряща, изменениями в субхондральной кости (включая микропереломы и образование кист) и образованием остеофитов, а также сопутствующим поражением других компонентов сустава (синовиальная оболочка, связки, капсула и периартикулярные мышцы). Рентгенологически ОА характеризуется сужением суставной щели, остеофитозом, субхондральным склерозом, образованием кист и неровными костными контурами. Основные звенья патогенеза ОА — дегенеративные процессы в хрящевой ткани, развитие воспаления в синовиальной оболочке и патологические процессы в субхондральной кости. Нормальный метаболизм хрящевой ткани изменяется с превалированием катаболических процессов над анаболическими. При ОА синтез хондроцитами гликозаминогликанов (ГАГ) снижается. Снижается синтез коллагена II типа с повышением синтеза коллагена I, III, X типов. Активация хондроцитов приводит не только к ухудшению синтеза полноценных компонентов матрикса хряща, но и к повышенной экспрессии провоспалительных цитокинов (интерлейкина (ИЛ) 1, ИЛ-6, фактора некроза опухоли альфа), циклооксигеназы 2-го типа, оксида азота. Важная роль в деградации хряща принадлежит матриксным металлопротеиназам (ММП), основными мишенями которых становятся структурные компоненты экстрацеллюлярного матрикса (протеогликаны и коллаген 2-го типа). Кроме того, коллагенолитические ММП влияют и на функциональную активность клеток субхондральной кости, усугубляя остеокластическую резорбцию.
В настоящее время патогенетическая терапия остеоартроза направлена на подавление синовиального воспаления и снижение активности провоспалительных ферментов. И здесь в существенно большей степени, чем при каком-либо другом заболевании, актуален вопрос о безопасности фармакотерапии, так как, с одной стороны, хроническая боль и депрессия, тяжелые функциональные нарушения оказывают негативное воздействие на прогноз заболевания, с другой — многие лекарственные средства, используемые при остеоартрозе, способны вызывать тяжелые, потенциально смертельные осложнения, риск которых особенно велик из-за наличия множественных коморбидных заболеваний у людей пожилого возраста.
В первую очередь это касается назначения нестероидных противовоспалительных препаратов (НПВП), являющихся эффективным патогенетическим средством лечения боли, связанной с тканевым повреждением и воспалением. Однако клинические достоинства НПВП во многом уменьшает серьезный риск развития класс-специфических осложнений, опасность которых в пожилом возрасте весьма велика. Это прежде всего так называемые НПВП-гастропатии, характеризующиеся поражением верхних отделов желудочно-кишечного тракта с развитием эрозий, язв и опасных осложнений (ЖКТ-кровотечения и перфорации). Риск развития этих осложнений у больных, регулярно принимающих НПВП, возрастает по сравнению с таковым в популяции более чем в 4 раза. Пациенты, регулярно принимающие НПВП, погибают от подобных осложнений в 2–3 раза чаще, чем лица, не получающие НПВП и/или низкие дозы аспирина.
Также серьезной проблемой, связанной с использованием НПВП, является опасность развития класс-специфических осложнений со стороны сердечно-сосудистой системы: дестабилизация артериальной гипертензии, прогрессирование сердечной недостаточности и повышение риска кардиоваскулярных катастроф.
Именно поэтому особое значение придается безопасной болезнь-модифицирующей терапии, которая способна не только эффективно влиять на боль и воспаление, снижая частоту и тяжесть клинических рецидивов заболевания, но и воздействовать на структуру хряща, замедляя прогрессирование заболевания и нарастание инвалидизации на длительное время.
18–19 марта в Киеве состоялась научно-практическая конференция «Редкие и резистентные к фармакотерапии ревматические заболевания», в рамках которой были рассмотрены важнейшие вопросы современной болезнь-модифицирующей терапии остеоартроза, открывающей новые возможности и перспективы лечения данного заболевания.
С докладом «Болезнь-модифицирующая терапия остеоартроза: новые возможности» выступила профессор, старший научный сотрудник отдела некоронарных заболеваний сердца НЦЦ «Институт кардиологии им. академика Н.Д. Стражеско» НАМН Украины Проценко Галина Александровна.
Из всех заболеваний суставов остеоартроз является наиболее распространенным — им страдают около 80 % всех пациентов с патологией опорно-двигательного аппарата. Это хроническое прогрессирующее заболевание суставов, которое характеризуется деградацией суставного хряща (СХ) с дальнейшими изменениями в субхондральной костной ткани, развитием краевых остеофитов, что приводит к потере СХ и сопутствующему поражению других компонентов сустава.
В развитии остеоартроза принимают участие многие факторы, среди которых выделяют локальные модифицирующие факторы риска — недостаточную силу мышц, высокую физическую активность/занятость, поражение сустава, неправильное положение сустава относительно оси, неодинаковую длину нижних конечностей, системные — ожирение, нарушение метаболизма костной ткани, индивидуальные — пол, возраст и генетическую предрасположенность.
Согласно рекомендациям по лечению остеоартроза разной локализации EULAR 2003, 2005, 2007:
1. Оптимальное ведение пациентов с ОА коленных, тазобедренных и суставов кисти требует индивидуализированной комбинации нефармакологических методов лечения и фармакотерапии.
2. Обучение методам защиты суставов (как избежать нежелательных механических воздействий) и физическим упражнениям (как способствующим увеличению объема движений, так и укрепляющим) рекомендуется всем пациентам с ОА разной локализации.
3. Локальные тепловые процедуры (аппликации парафина, горячие компрессы), особенно предшествующие выполнению упражнений, а также ультразвуковая терапия являются целесообразными при ОА кисти.
4. При ОА пястно-фалангового сустава І пальца для профилактики и коррекции латерального сгибания и сгибательной деформации рекомендовано применение шин и ортезов.
5. Локальная терапия имеет преимущества перед системной, особенно в случаях незначительной или умеренной боли, при поражении небольшого количества суставов. Топические формы НПВП и капсаицин эффективны и безопасны при лечении пациентов с ОА кистей и коленных суставов.
6. Пероральным обезболивающим средством первого ряда является парацетамол (в дозе до 4 г/сут) с учетом его эффективности и безопасности, и при наличии эффекта его также следует предпочесть для длительной пероральной анальгезии.
7. При неадекватном ответе на парацетамол следует применять НПВП в минимальной эффективной дозе самым коротким курсом. Потребность пациента в НПВП и ответ на них следует периодически пересматривать. Пациентам с повышенным риском гастроинтестинальных осложнений следует назначать комбинацию неселективного НПВП с гастропротекторным средством или селективный ингибитор ЦОГ-2 (коксиб). Пациентам с повышенным кардиоваскулярным риском коксибы противопоказаны, а неселективные НПВП следует назначать с осторожностью.
8. Симптоматические медленно действующие препараты для лечения ОА — SYSADOA (например, глюкозамин, хондроитина сульфат, неомыляемые соединения авокадо и сои (Пиаскледин), диацереин, гиалуронат для внутрисуставного введения) обладают симптоматическим действием и могут оказывать симптоматический эффект, обладают низкой токсичностью.
9. Внутрисуставные инъекции пролонгированных глюкокортикоидов являются эффективными при обострениях ОА кистей, коленных и тазобедренных суставов.
10. Оперативное вмешательство (интерпозиционная артропластика, остеотомия или артродез) является эффективным методом лечения тяжелого ОА, и его следует рассмотреть при сильных артралгиях и/или функциональных нарушениях, когда консервативная терапия неэффективна.
Общей рекомендацией по консервативному лечению остеоартроза Международного сообщества по изучению ОА (OARSI) 2014 года, независимо от количества пораженных суставов и наличия коморбидной патологии, является использование таких основных нефармакологических методов лечения, как выполнение обычных упражнений на воде, уменьшение веса, тренировка силы, самостоятельные упражнения и обучение.
Фармакотерапия остеоартроза направлена на облегчение боли и уменьшение функциональных нарушений. Медикаменты, используемые в терапии ОА, делятся на две основные группы: симптом-модифицирующие препараты (анальгетики и нестероидные противовоспалительные средства), которые снимают боль и воспаление в суставах, и структурно-модифицирующие препараты, способные модифицировать структуру хряща. Эта группа препаратов не только замедляет прогрессирование заболевания, но и активно влияет на основные симптомы ОА — воспаление и боль, т.е. обладает и симптом-модифицирующим эффектом. Эту группу препаратов называют также SYSADOA (symptomatic slow acting drugs for osteoarthritis), и одним из ее представителей является Пиаскледин, обладающий доказанной клинической эффективностью и потенциальными хондропротективными свойствами.
Пиаскледин представляет собой комплекс неомыляемых фитостеролов и жирных кислот из масел авокадо и соевых бобов в пропорции 1:2, полученный методом молекулярной дистилляции. Причем установлено, что сочетанное применение экстрактов авокадо и сои вызывает более выраженную ингибицию цитокинов по сравнению с их изолированным применением, а степень ингибиции зависит от соотношения этих ингредиентов.
Пиаскледин продемонстрировал разнообразное влияние на патологически значимые активные соединения, участвующие в деградации хряща. Так, было установлено, что он повышает экспрессию трансформирующего фактора роста b1 и b2; экспрессию ингибитора активатора плазминогена; стимулирует синтез протеогликанов и образование коллагеновых волокон; ингибирует и блокирует ИЛ-1, подавляя его коллагенолитический эффект на хондроциты и синовиоциты; при воздействии на человеческие хондроциты Пиаскледин ингибирует синтез коллагеназы, стромелизина, ИЛ-6 и ИЛ-8, а также простагландина Е2, т.е. тех биологических субстанций, которые активно участвуют в развитии воспалительной реакции и, как следствие, последующем повреждении хряща при остеоартрозе.
Изучение эффективности и безопасности Пиаскледина было оценено в ряде рандомизированных клинических исследований.
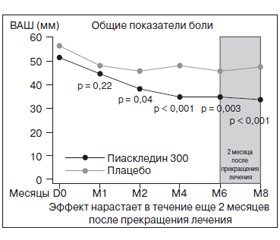
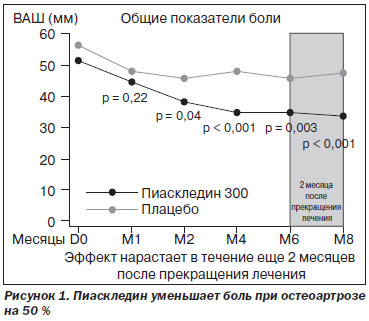
Так, в проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании Maheu et al. (1995) было продемонстрировано симптом-модифицирующее действие Пиаскледина. В нем приняли участие 164 пациента с остеоартрозом коленных (n = 114) и тазобедренных суставов (n = 50) с умеренными или сильными болями в течение 3 месяцев и более и с продолжительностью активной фазы заболевания на протяжении не менее 6 месяцев. Все больные были распределены на 2 группы: Пиаскледина и плацебо. Длительность исследования пациентов составила 6 месяцев с последующим наблюдением еще в течение 2 месяцев. Оценка состояния проводилась по функциональному индексу Лекена; интенсивности боли — по визуальной аналоговой шкале (ВАШ); также оценивался общий балл недееспособности, уровень успешности лечения (наличие или отсутствие потребности в НПВП).
Результаты исследования показали симптоматическую эффективность Пиаскледина в отношении боли и функционального индекса Лекена при лечении остеоартроза. Данный эффект отмечался со второго месяца приема препарата и продолжался по окончании курса лечения еще в течение 2 месяцев, что подтверждает наличие у Пиаскледина эффекта последействия (рис. 1).
В рандомизированном клиническом двойном слепом плацебо-контролируемом исследовании (Blotman et al., 1997) была оценена потребность в НПВП у 163 больных с умеренными и сильными болями при остеоартрозе коленных и тазобедренных суставов, получавших либо 300 мг/сут Пиаскледина, либо плацебо. В качестве дополнительного анальгетика использовали парацетамол (в режиме «по требованию»). Длительность исследования составила 3 месяца. Первичными конечными точками являлись количество пациентов, возобновивших прием НПВП после первой половины исследования (45-й день), и время приема НПВП. В качестве вторичных конечных точек (45–90-й день) — кумулятивная и среднесуточная доза НПВП; количество пациентов, которые отказались от приема НПВП на протяжении второй половины исследования; изменение индекса Лекена.
В ходе исследования было установлено, что на фоне приема Пиаскледина потребность в нестероидных противовоспалительных препаратах оказалась достоверно меньше в сравнении с плацебо (43,4 и 69,7 % соответственно; р < 0,001). Кроме того, в основной группе отмечалось достоверно большее улучшение функционального индекса Лекена: в среднем 2,3 и –1,0 балла (р < 0,001).
В 3-месячном многоцентровом рандомизированном клиническом исследовании, проведенном Аppelboom et al. (2001), оценивались эффективность и безопасность разных доз Пиаскледина (300 и 600 мг/сут) у 260 пациентов с гонартрозом. Результаты исследования показали, что эффективность Пиаскледина в дозах 300 и 600 мг/сут была значительно выше плацебо во всех контрольных точках, разницы между двумя дозировками обнаружено не было. Кроме того, 71 % больных, принимавших Пиаскледин, смогли уменьшить дозу НПВП больше чем в 2 раза, тогда как в группе плацебо такой эффект был достигнут только у 36 % пациентов.
Структурно-модифицирующий эффект Пиаскледина был продемонстрирован в исследовании, проведенном M. Lequesne et al. в 2002 г., которое включало 163 пациента с одно- или двухсторонним коксартрозом. Стадия по Kellgren-Lawrence к началу исследования была I–III. Обязательными критериями включения в исследование были регистрируемое рентгенологически сужение щели тазобедренного сустава, постоянная боль в пораженных суставах продолжительностью не менее 6 месяцев, 4 балла и более по индексу Лекена.
Рандомизированно пациенты были разделены на 2 группы: 85 больных на протяжении всего времени исследования получали 300 мг/сут Пиаскледина, 78 пациентов — плацебо. По демографическим и клиническим параметрам группы были сопоставимы. Длительность исследования — 2 года.
Результаты исследования продемонстрировали, что в обеих группах отмечались сходные изменения суставной щели. Однако среди больных, имевших ширину суставной щели в начале исследования менее 2 мм, прием Пиаскледина уменьшил отрицательную динамику по сравнению с плацебо практически в 2 раза: при приеме Пиаскледина уменьшение ширины щели в год составило 0,24 мм и на фоне плацебо — 0,47 мм (p < 0,05).
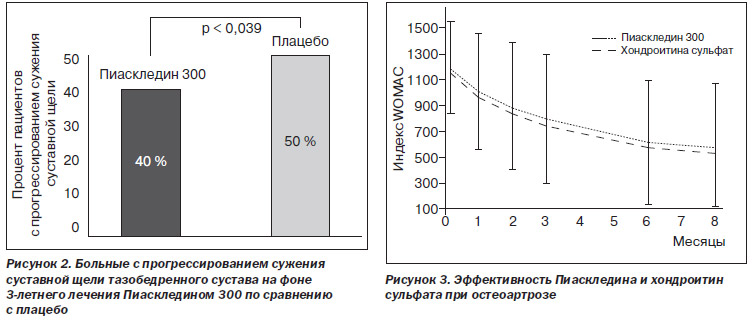
В 2009 г. Maheu и соавт. представили результаты еще одного исследования структурно-модифицирующего действия Пиаскледина у 399 больных коксартрозом (ERADIAS). Пациенты были стратифицированы по тяжести коксартроза (ширина суставной щели < 2,5 или > 2,5 мм) и рандомизированы в 2 группы, одна из которых получала 300 мг Пиаскледина (166 больных), а другая — плацебо (179 больных) в течение 3 лет. И хотя различие в сужении суставной щели за 3 года между группами Пиаскледина и плацебо оказалось статистически недостоверным (–0,64 и –0,67 мм соответственно; р = 0,72), больных с прогрессированием остеоартроза в группе Пиаскледина было на 20 % меньше, чем в группе плацебо (р = 0,039), что свидетельствует о наличии у препарата структурно-модифицирующих свойств (рис. 2).
В большом сравнительном исследовании, в которое были включены 364 больных ОА коленных суставов, проведенном Pavelka и соавт. (2010), изучались эффективность и безопасность Пиаскледина (300 мг/сут) в сравнении с хондроитина сульфатом (400 мг 3 раза в день) в течение 6 месяцев лечения. Препараты показали сходные результаты. В середине и конце исследования у больных обеих групп функциональные индексы WOMAC и Лекена уменьшились приблизительно на 50 %, а в течение последующих 2 месяцев наблюдения эти показатели продолжали снижаться, демонстрируя наличие эффекта последействия. Почти 80 % пациентов в сравниваемых группах оценили эффективность терапии как «значительное улучшение» и «улучшение», и практически все больные смогли снизить суточную дозу НПВП. Переносимость Пиаскледина, как и хондроитина сульфата, была хорошей. Также авторы отметили, что однократный прием Пиаскледина наиболее удобен для больных и может значительно повысить комплайентность терапии (рис. 3).
Метаанализ 4 контролируемых клинических исследований Пиаскледина включал в себя данные 664 пациентов с остеоартрозом тазобедренных (41,4 %) и коленных суставов (58,6 %), из которых 336 больных получали активный препарат по 300 мг/сут и 328 — плацебо в течение 6–24 месяцев (Christenen R. еt al., 2008). Было показано, что Пиаскледин превосходит плацебо по влиянию на боль (среднее уменьшение боли по ВАШ составило 10,7 % при гонартрозе и 11,3 % — при коксартрозе; р = 0,04) и функциональный индекс Лекена (р = 0,0003).
Высокая безопасность Пиаскледина была отмечена во всех клинических исследованиях, ни в одном из них не было зарегистрировано каких-либо значимых побочных эффектов или случаев передозировки препарата, даже при длительном его приеме. Также немаловажным аспектом безопасности являлось отсутствие значимых лекарственных взаимодействий Пиаскледина с известными лекарственными средствами, что особенно важно для пожилых больных, страдающих остеоартрозом и вынужденных принимать довольно широкий набор препаратов для лечения сопутствующих заболеваний.
Таким образом, Пиаскледин 300 — это европейский оригинальный препарат с высоким уровнем стандарта производства и клинически доказанной эффективностью и безопасностью (1А). Уникальный состав препарата способствует замедлению развития дегенеративного процесса в хрящевой ткани суставов, уменьшению боли и восстановлению двигательной функции больного. Кроме того, Пиаскледин оказывает регенерирующее действие на хрящ, стимулируя синтез протеогликанов и коллагена, способствует замедлению разрушения хрящевой ткани. Обладает симптоматическим противовоспалительным и анальгезирующим действием и возможным структурным эффектом.
Высокая эффективность Пиаскледина была подтверждена в многочисленных клинических исследованиях. Препарат нивелирует симптоматику при остеоартрозе и замедляет прогрессирование данной патологии, что позволяет снизить дозу НПВП, а в некоторых случаях и отменить их прием. Также важным аспектом являются высокий уровень безопасности, хорошая переносимость препарата и отсутствие взаимодействия с другими лекарственными средствами, что особенно ценно для пожилых пациентов с коморбидной патологией.