Журнал «Медицина неотложных состояний» 2 (65) 2015
Вернуться к номеру
Оценка эффективности тотальной внутривенной анестезии на основе инфузии пропофола по целевой концентрации при лапароскопических холецистэктомиях
Авторы: Машин А.М., Кобеляцкий Ю.Ю. — ГУ «Днепропетровская медицинская академия МЗ Украины», кафедра анестезиологии и интенсивной терапии; КУ «Днепропетровская областная больница им. И.И. Мечникова»
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Статья посвящена сравнительному изучению эффективности тотальной внутривенной анестезии на основе инфузии пропофола по целевой концентрации (TCI). Был сделан вывод, что устройства для TCI создают условия для качественной анестезии, стабильной гемодинамики или предсказуемости пробуждения. Никаких неблагоприятных событий, связанных с TCI, не было зарегистрировано во время этих исследований. Качество анестезии, наблюдаемой при TCI, всегда было схожим или лучше, чем при ручном введении, и сопоставимо по управляемости с ингаляционной анестезией, что в сравнении с ценой оборудования для проведения ингаляционной анестезии методом низкого потока делает ее более выгодной для больниц с ограниченным объемом финансирования.
Стаття присвячена порівняльному вивченню ефективності тотальної внутрішньовенної анестезії на основі інфузії пропофолу за цільовою концентрацією (TCI). Був зроблений висновок, що пристрої для TCI створюють умови для якісної анестезії, стабільної гемодинаміки або передбачуваності пробудження. Ніяких несприятливих подій, пов’язаних із TCI, не було зареєстровано під час цих досліджень. Якість анестезії, що спостерігається при TCI, завжди була схожа за керованістю з інгаляційною анестезією, що порівняно з ціною обладнання для проведення інгаляційної анестезії методом низького потоку робить її більш вигідною для лікарень з обмеженим об’ємом фінансування.
The article deals with the comparative study of the effectiveness of total intravenous anesthesia based on target-controlled infusion (TCI) of propofol. It was concluded that devices for TCI enable high-quality anesthesia, stable hemodynamics or predictability of recovery from anesthesia. No adverse events related to TCI have been reported during these studies. The quality of anesthesia observed at TCI has always been similar to or even better than the manual introduction, and is comparable in controllability with inhalation anesthesia, that in comparison with the cost of equipment for low-flow inhalation anesthesia makes it more profitable for hospitals with limited funding.
анестезия, TCI, пропофол, севофлюран, лапароскопическая холецистэктомия.
анестезія, TCI, пропофол, севофлюран, лапароскопічна холецистектомія.
anesthesia, target-controlled infusion, propofol, sevoflurane, laparoscopic cholecystectomy.
Статья опубликована на с. 150-154
Введение
Термин «внутривенная инфузия по целевой концентрации» (Target Controlled Infusion — ТСI) используется для обозначения нового способа применения препарата, являясь способом доставки внутривенных наркотических анальгетиков, анестетиков, который упрощает технику внутривенного введения и улучшает контроль за действием препарата [1–3].
Рациональность использования ТСI основана на установке желаемой «целевой» концентрации, которая достигается устройством и поддерживается в плазме или эффекторной зоне (biophase) [2]. Целевая концентрация устанавливается априорно анестезиологом для достижения желаемого клинического эффекта, а система Diprifusor ТСI управляет скоростью инфузии дипривана для достижения желаемой концентрации препарата в крови, то есть глубиной анестезии. Это преобразование осуществляется автоматически микропроцессором в насосе, который запрограммирован на алгоритм введения с учетом фармакокинетической модели вводимого лекарственного препарата.
Для описания фармакокинетики лекарственных средств используются фармакологические камерные модели [1–3]. Это математические модели, представляющие собой упрощенные схемы элиминации и перераспределения препарата в камерах. Каждая модель определяет количество камер и их объемы, скорость метаболизма и элиминации препарата, а также скорость перераспределения между камерами.
Трехкамерная модель необходима для адекватного описания первичного распределения, перераспределения и элиминации дипривана (рис. 1). Общепринято центральной (V1) называть камеру, в которую вводится препарат; вторую и третью (если они представлены в модели) — периферическими камерами. Камеры моделей являются теоретическими и не имеют реальных анатомо-физиологических связей. Скорость метаболизма и распределения препарата описывается константами скорости (k) (Absalom A.R., 2007).
/150/150.jpg)
После начала введения препарата наблюдается короткий латентный период между подъемом его плазменной концентрации и появлением клинического эффекта, а после прекращения инфузии снижение концентрации предшествует снижению эффекта введенного препарата. Это объясняется тем, что клинический эффект определяется концентрацией лекарства не в плазме крови, а в ткани-мишени. Для лучшей интерпретации фармакокинетики и фармакодинамики анестетиков к фармакологической модели добавлена эффекторная камера (Hull C.J., 1978), отражающая концентрацию препарата в месте его действия (Ce). Скорость движения препарата в эту камеру и выведения его описывается только одной константой, которая обычно обозначается как ke0. Так как концентрация препарата в органе-мишени не может быть напрямую измерена, но расчет Ce осуществляется на основе константы ke0, которая отражает время до достижения пиковой концентрации препарата в эффекторной камере. Эта константа была установлена путем измерения клинического эффекта, например, при помощи электроэнцефалографии.
Этот алгоритм интерактивно рассчитывает скорость инфузии, необходимую для достижения целевой концентрации, и передает эту информацию насосу. Он основан на классическом режиме (схеме) инфузии, описанном в 1968 году Kruger-Thiemer [4] для быстрого достижения и поддержания постоянной концентрации в плазме внутривенного препарата.
Систему Diprifusor ТСI можно рассматривать как интеллектуальную инфузионную систему, которая во время вводной анестезии, используя фармакокинетическую модель, вычисляет нагрузочную дозу, включает высокую (до 1500 мл в час) скорость до достижения целевой концентрации препарата в крови. Далее автоматически поддерживает выбранную целевую концентрацию, которая может быть изменена анестезиологом в любой момент времени. Выбор более высокой концентрации ведет к назначению болюса и увеличению скорости инфузии. Выбор анестезиологом более низкой концентрации сопровождается выключением мотора шприца и, после модельно вычисленного достижения новой целевой концентрации, назначением более низкой инфузионной скорости.
Материалы и методы
На базе отделения анестезиологии КУ «Днепропетровская областная больница им. И.И. Мечникова» проводилось исследование, целью которого являлось сравнение методов анестезиологического пособия исходя из оценки управляемости анестетиков на основании оценки глубины наркозного сна и показателей гемодинамики.
Исследование проведено у 60 пациентов физического статуса ASA I–II, которым проводились оперативные вмешательства по поводу желчно-каменной болезни и острого калькулезного холецистита методом лапароскопической холецистэктомии. Средний возраст больных — 56 ± 12 лет, продолжительность операции составила 60 ± 25 мин.
Все пациенты получали стандартную премедикацию: седативные препараты на ночь накануне операции и сибазон 10 мг + фентанил 100 мкг внутримышечно за 0,4 ч до индукции.
Индукцию проводили последовательным внутривенным введением дипривана (2,1 ± 0,4 мг/кг), фентанила (5 мкг/кг) и эсмерона (0,6 мг/кг). После интубации трахеи начинали искусственную вентиляцию легких кислородно-воздушной смесью (FiO2 0,4) наркозной станцией S/5 Avance (Datex-Ohmeda), релаксацию обеспечивали болюсным введением миорелаксантов.
Этапы исследования: исходные показатели пациента на операционном столе, показатели фазы индукции, разрез, основной наркоз, показатели во время просыпания на момент экстубации.
В случайном порядке, определяемом каждый раз в день операции с помощью компьютера, больные в зависимости от метода поддержания анестезии попадали в одну из трех исследуемых групп.
1. Группа TIVA тотальная внутривенная анестезия (ТВА) на основе дипривана и фентанила с инфузией гипнотика через инфузомат B. Braun perfusor compact (Германия) — 20 человек.
2. Группа ТСI — ТВА на основе дипривана и фентанила с инфузией гипнотика по целевой концентрации с помощью инфузомата B. Braun perfusor space (Германия) — 20 человек.
3. Группа SEVO — ингаляционная анестезия на основе севорана методом низкого потока и фентанила аппаратом S/5 Avance Datex-Ohmeda — 20 человек.
Анестезиологическое пособие, а также мониторинг параметров в группах исследования проводили следующим образом:
— в группе TIVA скорость инфузии дипривана по разработанной болюсно-инфузионной схеме 10–8–6 для пропофола. Оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики. Анестезиолог самостоятельно выбирал достаточную, по его мнению, скорость инфузии. Мониторинг глубины наркозного сна оценивался методом биспектрального индекса (BIS™, Aspect MS, Norwood, MA, USA);
— в группе ТСI инфузию дипривана проводили в соответствии со следующим алгоритмом, приближенном к рекомендациям компании Astra Zeneca. Анестезиолог, если это не создавало значительных трудностей, не должен был нарушать нижний (3,5 мкг/мл) и верхний (5,3 мкг/мл) пределы целевых концентраций препарата в эффекторной зоне (модель Shnider). Оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики. Мониторинг глубины наркозного сна (BIS™, Aspect MS, Norwood, MA, USA);
— в группе SEVO целевую концентрацию севорана выбирали в соответствии с показателями системы «Мультигаз» с оценкой МАК и концентрации ингаляционного агента в конце выдоха, оценку эффективности анестезиологической защиты проводили на основе анализа клинических симптомов и изменений основных показателей гемодинамики, с использованием мониторинга глубины наркозного сна (BIS™, Aspect MS, Norwood, MA, USA).
Всем пациентам проводили мониторинг FiO2, электрокардиографию с подсчетом частоты сердечных сокращений, измеряли АД (неинвазивно) с расчетом среднего артериального давления (САД), насыщения артериальной крови кислородом (пульсоксиметрия), ЕТСО2 (капнографию) с помощью монитора S/5 Datex (Финляндия).
Полученные данные обрабатывались методами вариационной статистики с помощью стандартного пакета программ Microsoft Exсel 2003 и Statistica 6.1.
Результаты и их обсуждение
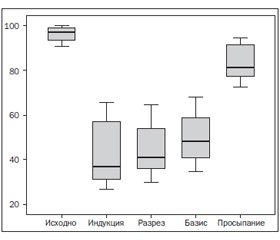
В первой группе (TIVA) средняя скорость введения дипривана составила 6,9 ± 1,6 мг/кг/час, то есть на 34,3 % (р < 0,05) меньше, чем рекомендуется для методики ТСI. В данной группе не было зарегистрировано случаев стойкой гипотонии (рис. 1), а снижение АД определялось на основании комплексной оценки клинических признаков эффективности анестезии и динамики BIS. Было зарегистрировано 5 непродолжительных эпизодов недостаточной защиты и только у 3 пациентов — случаи чрезмерного углубления анестезии (рис. 2).
Во второй исследуемой группе (ТСI) в соответствии с заданным алгоритмом целевая концентрация дипривана (Ce) устанавливалась в диапазоне от 3,5 до 4 мкг/мл. При анализе интраоперационных изменений было отмечено ожидаемое снижение BIS после вводного наркоза до 47,6 ± 9,8 отн.ед. и дальнейшее прогрессирующее снижение до 40,5 ± 4,2 отн.ед., что было расценено нами как необоснованное (избыточное, но не опасное) углубление анестезии (рис. 3). Нижний порог в 40 отн.ед., установленный нами для состояния глубокой эффективной анестезии, был перейден 4 пациентами. Только у одного пациента был зарегистрирован эпизод неэффективной защиты, видимо, вследствие неоправданного снижения дозы фентанила. В последнем случае наблюдаемые изменения были купированы болюсным введением опиоида.
В третьей группе (SEVO) изменение целевой концентрации севорана контролировалось врачом на основании мониторинга системы «Мультигаз» и интраоперационной динамики BIS (рис. 4). В результате средняя целевая концентрация севорана в конце выдоха составила 0,9 ± 0,2 МАК. После проведения внутривенной индукции у 4 пациентов отмечалось явление краткосрочной гипотонии (рис. 7) с углублением показателей наркозного сна до 40,2 ± 3,2; в дальнейшем динамика глубины наркозного сна оставалась в рекомендованных пределах — 40–60 отн.ед., эпизодов неэффективной защиты не отмечалось.
Динамика показателей числа сердечных сокращений в группах представлена на рис. 8–10.
Выводы
Сравнительные исследования между TCI и ручным введением показали лучшую стабильность гемодинамики, более быстрое восстановление и более низкие дозы для индукции при TCI. Устройства для TCI создают условия для качественной анестезии стабильной гемодинамики или предсказуемости пробуждения. Никаких неблагоприятных событий, связанных с TCI, не было зарегистрировано во время этих исследований. Качество анестезии, наблюдаемой при TCI, всегда было схожим или лучше, чем при ручном введении, и сопоставимо по управляемости с ингаляционной анестезией, что в сравнении с ценой оборудования для проведения ингаляционной анестезии методом низкого потока делает ее более выгодной для больниц с ограниченным объемом финансирования.
В заключение необходимо подчеркнуть, что анестезия с TCI никак не уменьшает необходимый уровень мониторинга состояния пациента. Более того, дальнейшее совершенствование TCI авторам метода видится в разработке систем с обратной связью на основе применения более сложных методов оценки глубины анестезии, таких как слуховые вызванные потенциалы, спектральный и биспектральный анализ.
1. Glass P.S., Shafer S.L., Reves J.G. Intravenous drug delivery systems. — New-York: Churchil Livingstone, 2000. — P. 377-411.
2. Van den Nieuwenhuyzen M.C., Engbers F.H., Vuyk J., Burm A.G. Target-controlled infusion systems: role in anaesthesia and analgesia // Clin. Pharmacokinet. — 2000. — Vol. 38. — P. 181-190.
3. Schraag S. Theorical basis of target controlled anaesthesia history, concept and clinical perspectives // Best Practice & Research Clinical Anaesthesiology. — 2001. — Vol. 15. — P. 1-17.
4. Kruger-Thiemer E. Continuous intravenous infusion and multicompartment accumulation // Eur. J. Pharmacol. — 1968. — Vol. 4. — P. 317-324.

/152/152.jpg)
/153/153.jpg)