Газета «Новости медицины и фармации» Кардиология и ревматология (541) 2015 (тематический номер)
Вернуться к номеру
Пересмотр критериев Джонса для диагностики острой ревматической лихорадки в эпоху допплеровской эхокардиографии Научное заявление Американской ассоциации сердца (в сокращении) Одобрены Всемирной организацией здравоохранения (ВОЗ)
Авторы: Michael H. Gewitz, MD, FAHA, Co-Chair; Robert S. Baltimore, MD, Co-Chair; Lloyd Y. Tani, MD, FAHA; Craig A. Sable, MD, FAHA; Stanford T. Shulman, MD; Jonathan Carapetis, MBBS; Bo Remenyi, MBBS; Kathryn A. Taubert, PhD, FAHA; Ann F. Bolger, MD, FAHA; Lee Beerman, MD; Bongani M. Mayosi, MBChB; Andrea Beaton, MD; Natesa G. Pandian, MD; Edward L. Kaplan, MD, FAHA; on behalf of the American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young
Рубрики: Ревматология, Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 43-56
Хотя частота возникновения острой ревматической лихорадки (ОРЛ) в Европе и Северной Америке за последние 4–6 десятилетий снизилась, данная патология по-прежнему остается одной из наиболее важных причин сердечно-сосудистой заболеваемости и смертности среди социально и экономически неблагополучных групп населения во всем мире, особенно в развивающихся странах, в которых проживает большинство населения мира. Распространенность заболевания в упомянутых странах по-прежнему достигает эпидемического уровня [1]. Критерии Джонса, которыми руководствуются в диагностике ОРЛ с 1944 года, в последний раз пересматривались Американской ассоциацией сердца (American Heart Association, AHA) в 1992 году [2]. Их повторное подтверждение в целом состоялось в 2000 году [3] на научной конференции, спонсором которой выступила AHA. Критерии исторически представляют клинический стандарт для постановки диагноза ОРЛ. Тем не менее новые разработки в ряде отраслей, наблюдавшиеся за последние несколько лет, побудили к пересмотру традиционных критериев Джонса. Например, теперь основное внимание уделяется ограниченной диагностической роли эхокардиографии при выявлении кардита, установленной в критериях Джонса пересмотра 1992 года [5]. Сегодня необходимость в такой позиции исчезает, поскольку в течение последних 2 лет во всем мире все более широко применяются эхокардиографические методики и оборудование, в том числе количественное и цветовое допплеровское картирование. Недавно в другие национальные и региональные рекомендации диагностики ОРЛ также было включено применение эхокардиографии и допплерографии [4, 5]. Многочисленные исследования, проведенные в различных клинических условиях, показали, что эхокардиографию можно более широко использовать в качестве метода диагностики кардита даже при отсутствии явных клинических признаков данного нарушения («субклинический кардит») [6–30]. Кроме того, в мировых скрининговых программах эхокардиография (ЭхоКГ) стала краеугольным камнем для оценки распространенности ревматической болезни сердца (РБС) [31–35].
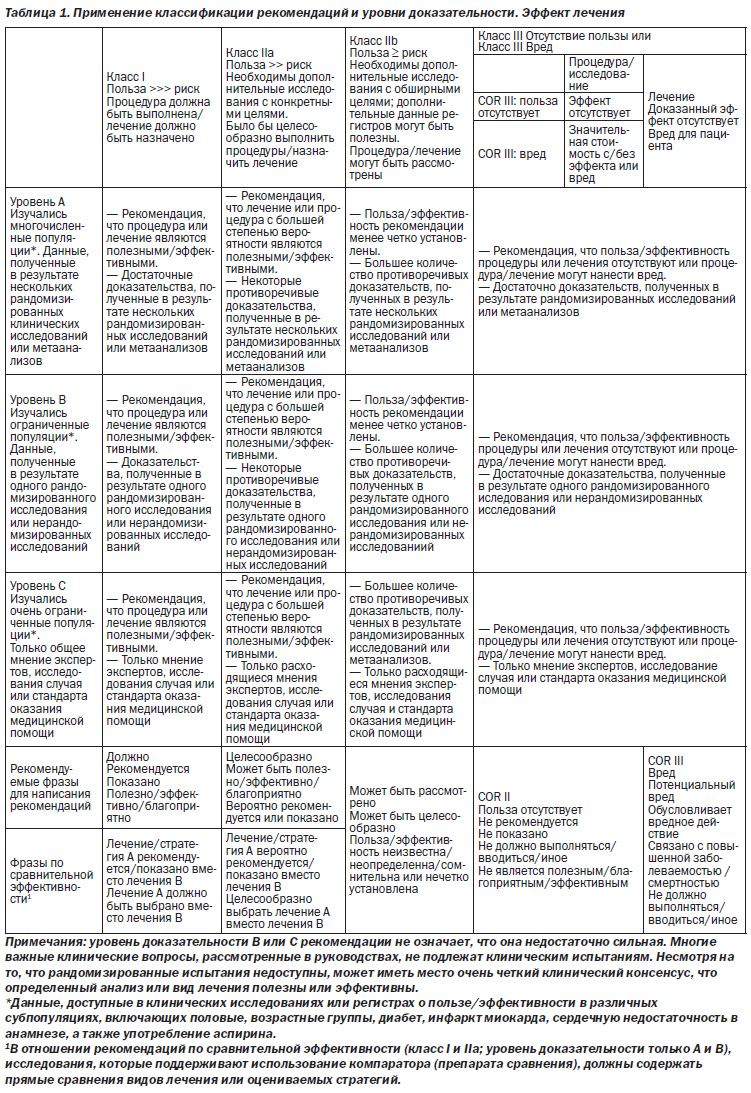
Кроме обсуждения надлежащей роли эхокардиографии в диагностике ОРЛ, поднимались вопросы из других клинических областей. Например, в критериях Джонса редакции 1992 года [2] моноартрит предлагался к рассмотрению в том случае, если пациент получал лечение нестероидными противовоспалительными препаратами до постановки диагноза; с тех пор были опубликованы доказательные данные, свидетельствующие, что в отдельной популяции высокого риска моноартрит может служить основным проявлением артрита [36]. Кроме того, в предыдущих руководствах АНА по ОРЛ рекомендации не были классифицированы с использованием категорий текущей Классификации рекомендаций и уровней доказательности, преимущество которой отдается во всем мире. Перед группой авторов была поставлена задача провести оценку доказательных данных и привести классификацию рекомендаций в соответствие с системой классификации Американского колледжа кардиологии/AHA [37]. Классификация рекомендаций представляет собой оценку размера эффекта лечения, в которой учитываются риски и преимущества в дополнение к доказательным данным и/или соглашениям относительно того, являются или нет данные лечение или процедура полезными/эффективными или, как вариант, могут ли причинить пациенту вред. Уровень доказательности — это оценка определенности или точности лечебного эффекта. Группа авторов рассмотрела и распределила доказательные данные в поддержку каждой рекомендации, оценивая их значимость как уровень доказательности A, B или C в соответствии с конкретными обозначениями, приведенными в табл. 1.
В условиях, при которых имеется недостаточно доказательных данных, рекомендации основываются на консенсусе экспертов и клиническом опыте, им присваивают уровень доказательности С. Данная система также предлагает фразы для написания рекомендаций с учетом их класса.
Наконец, при рассмотрении вопроса, у каких пациентов может быть установлен диагноз ОРЛ, нужно ссылаться и на последние мнения в отношении диагностики острого стрептококкового фарингита, которые были рассмотрены в научном заявлении AHA 2009 года [38].
Как и в прошлых заявлениях AHA о критериях Джонса, данный пересмотр сосредоточен на диагностике ОРЛ, а не на вопросах, касающихся наблюдения и диагностики хронической РБС или ее последствий.
Эпидемиологические предпосылки
Понимание того, каким образом лучше всего определить правильное применение диагностических критериев для ОРЛ в определенной популяции, требует краткого обзора текущей эпидемиологии заболевания.
Хорошо известно, что в течение ХХ столетия частота развития ОРЛ и распространенность РБС существенно снизились в Европе, Северной Америке и развитых странах других географических регионов [39, 40]. Эта тенденция была обусловлена улучшением личной гигиены, доступа к антибиотикам и медицинской помощи, снижением бытовой скученности и другими социально-экономическими изменениями [39, 41]. Изменения эпидемиологии ассоциированных с ОРЛ инфекционных заболеваний, вызванных конкретными штаммами стрептококка группы А, также могли сыграть определенную роль в снижении отмеченного выше уровня заболеваемости [42]. Хотя в развитых странах по-прежнему наблюдались спорадические случаи ОРЛ, наиболее тяжелое бремя данной болезни в настоящее время наблюдается в странах с низким и средним уровнем доходов и среди отдельных коренных народов различных регионов мира. Картина заболеваемости в регионах с высокой распространенностью ОРЛ часто гиперэндемична; при этом случаи болезни регистрируются круглогодично и практически полностью отсутствуют вспышки. Напротив, в странах с высоким уровнем доходов наблюдается низкий фоновый уровень заболеваемости с периодически регистрируемыми вспышками [28, 43].
Существуют также свидетельства различий уровня заболеваемости даже в популяциях, обитающих в пределах одной страны, что еще раз демонстрирует непропорциональность распространения заболевания. Например, хотя общий средний уровень заболеваемости ОРЛ в Новой Зеландии за последние 2 десятилетия вырос на 55 %, этот же показатель среди населения Новой Зеландии, не принадлежащего к маори, и выходцев Океании за тот же период снизился на 70 % [44]. Аналогичные расхождения в распространенности наблюдаются и в Австралии, где среди коренного населения был отмечен один из самых высоких в мире уровней заболеваемости ОРЛ (количество ежегодно регистрируемых случаев ОРЛ составляет 153–380 на 100 000 человек в 5–14-летней возрастной группе [45]), тогда как в других группах австралийского населения уровень заболеваемости приближается к европейским и североамериканским показателям.
В целом глобальное распределение ОРЛ/РБС является явно диспропорциональным. Некоторые географические регионы и конкретные этнические и социально-экономические группы населения испытывают очень высокие уровни заболеваемости ОРЛ, в то время как в других регионах заболевание практически исчезло. Это привело к озабоченности по поводу равномерной чувствительности критериев Джонса, даже несмотря на их регулярный пересмотр в течение многих лет, когда дело касается применения к географическим областям или группам населения в регионах, где ОРЛ является гиперэндемичным заболеванием.
Применение результатов эпидемиологического анализа
Учитывая то, что клиническое применение диагностических исследований определяется рядом факторов, в том числе предсказуемостью результатов испытаний и фоновым уровнем заболеваемости, и в связи с отмеченной выше неоднородностью глобального распространения заболевания одного набора диагностических критериев может быть недостаточно для всех групп населения и географических регионов. Чтобы избежать гипердиагностики в странах, где наблюдается низкий уровень заболеваемости, и гиподиагностики — в группах населения с высоким риском ОРЛ, авторы австралийских рекомендаций по ревматической лихорадке считают целесообразным делать различия в применении диагностических критериев среди населения с низким риском по сравнению с населением с высоким риском ОРЛ [4]. Появляются эпидемиологические данные, указывающие на следующее:
1. Низкий риск развития ОРЛ целесообразно рассматривать у человека, который проживает в условиях или относится к популяции с низким риском ОРЛ или РБС (класс рекомендации IIa; уровень доказательности C).
2. При наличии надежных эпидемиологических данных низкий риск целесообразно определять при уровне заболеваемости ОРЛ < 2 случаев на 100 000 детей школьного возраста (обычно 5–14 лет) в год или распространенности РБС среди всех возрастных групп ≤ 1 на 1000 человек в год (класс рекомендации IIa; уровень доказательности С).
3. Детей, принадлежность которых к популяции с низким уровнем риска четко не определена, следует рассматривать как имеющих умеренный или высокий риск развития ОРЛ в зависимости от их референтной популяции (класс рекомендации I; уровень доказательности С).
Клинические проявления ОРЛ
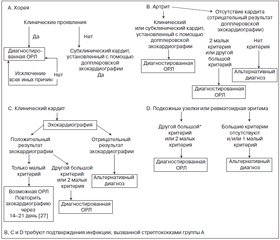
В целом клинический профиль ОРЛ в странах с низким и средним уровнем доходов напоминает таковой в странах с высоким уровнем доходов [46–48]. Наиболее распространенными проявлениями во время первого эпизода ОРЛ (большие критерии диагностики) остаются кардит (50–70 %) и артрит (35–66 %) [1, 9, 28, 46–48]. За ними следуют по частоте хорея (10–30 %), которая, как было установлено, преобладает среди женщин, а затем подкожные узелки (0–10 %) и ревматоидная эритема (< 6 %), которые остаются значительно более редкими, но весьма специфическими проявлениями ОРЛ [9, 46–48]. Несмотря на эту общую закономерность развития каждого из классических основных проявлений заболевания, недавние данные предполагают возможность существенной изменчивости данных проявлений в определенных обстоятельствах и популяциях.
Например, в группах населения наиболее высокого риска, таких как коренное население Австралии, были описаны различия в типичных проявлениях критериев Джонса [9, 36, 45]. Как обсуждается ниже, сюда относятся такие проявления, как асептический моноартрит, полиартралгия и субфебрильная температура тела (в отличие от традиционно рассматриваемой лихорадки). Эти переменные проявления были учтены в австралийских критериях 2012 года [4] с целью повышения чувствительности диагностики у пациентов из упомянутых групп населения высокого риска. На сегодняшний день, однако, применимость данных переменных клинических проявлений в популяции с низким риском развития ОРЛ проверена не была, и поэтому они не могут быть рекомендованы к применению.
В целом стандартной практикой остается продолжительное наблюдение за пациентом в случае клинических проявлений ОРЛ. Непрерывная переоценка поступающей клинической информации важна для любого пациента, поскольку при применении критериев Джонса всегда существовал риск «наложения» диагнозов, то есть диагностирования заболеваний с частично совпадающими симптомами. В дополнение к вышесказанному, также было уделено много внимания роли соответствующих неинвазивных методов визуализации сердца, а именно — эхокардиографии в сочетании с допплерографией в диагностике кардита, вызванного ОРЛ.
Кардит: диагностика в эпоху широкодоступной эхокардиографии
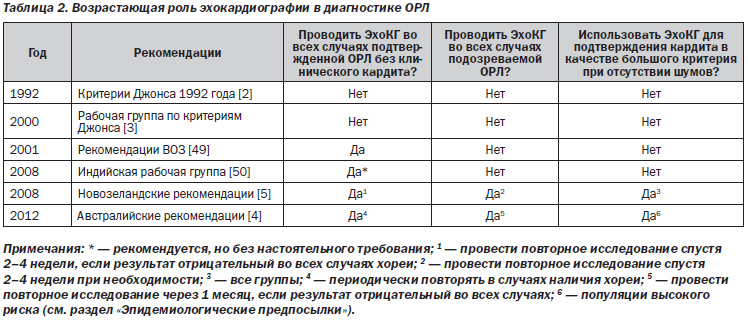
Классически, как описано в заявлении AHA о пересмотре критериев Джонса 1992 года, кардитом в качестве основного проявления ОРЛ считался клинический диагноз, поставленный на основе аускультации типичных шумов, указывающих на недостаточность митрального или аортального клапана (одного или двух). Таким образом, хотя кардит при ОРЛ считается панкардитом и может включать поражение эндокарда, миокарда и перикарда, вальвулит на сегодняшний день является наиболее характерной особенностью ОРЛ, а изолированный перикардит или миокардит редко, если вообще, считается имеющим ревматическое происхождение. Клинически проявляющийся кардит остается общепринятым основным проявлением ОРЛ во всех популяциях; однако вследствие появления новых доказательных данных возникли некоторые вопросы, требующие, по крайней мере, определенного пересмотра классической точки зрения. Кроме того, в эпоху, когда клинические навыки аускультации могут ухудшаться наряду с повсеместным распространением достоверных ультразвуковых методов исследования сердца, эхокардиография все чаще используется для диагностики кардита. Таким образом, понятие субклинического кардита было включено в другие рекомендации и совместные экспертные заявления в качестве утвержденного основного проявления ревматической лихорадки [4, 5], как показано в табл. 2.
Субклинический кардит относится исключительно к тем случаям, когда классические аускультативные признаки клапанной дисфункции либо отсутствуют, либо не были выявлены врачом, но при этом эхокардиография/допплерография указывают на наличие воспаления митрального или аортального клапанов. Применение эхокардиографических данных и обоснование их использования с целью определения связанных с ОРЛ изменений клапанов рассмотрены ниже. Эти изменения приведены в табл. 3, 4 и являются аналогичными нарушениям со стороны клапанов, также описанным при РБС в недавнем заявлении Всемирной федерации сердца по данному заболеванию [51].
Клинические исследования роли эхокардиографии
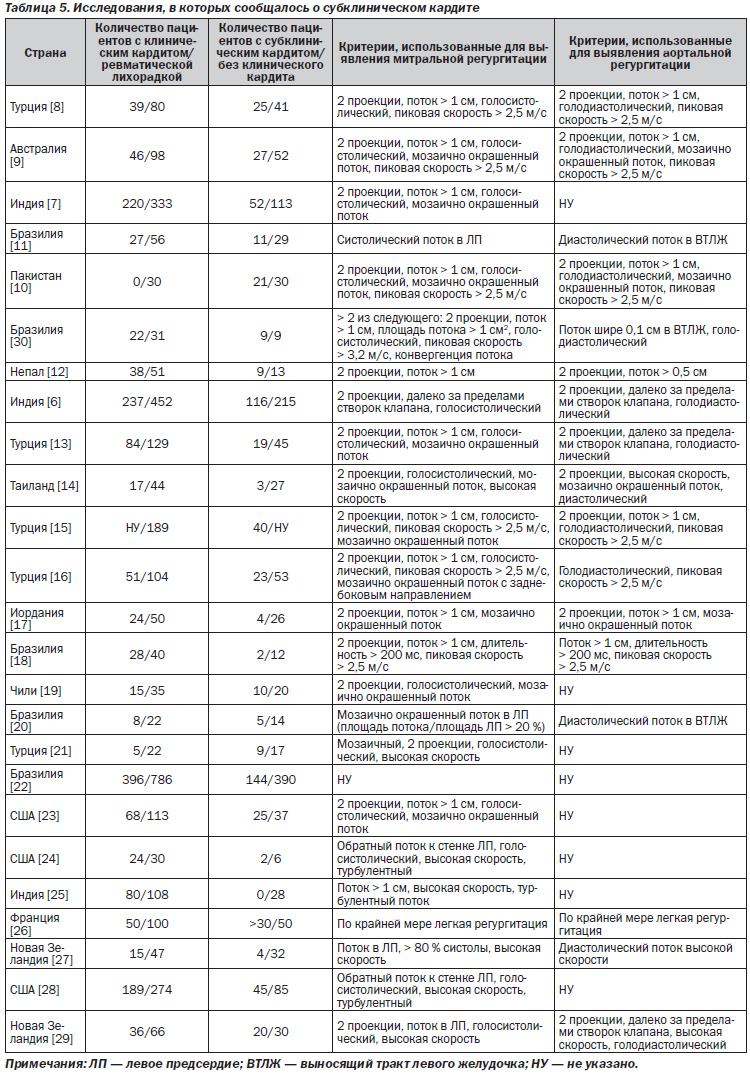
В многочисленных исследованиях, проведенных в течение последних 20 лет, оценивалась роль эхокардиографии (по сравнению с непосредственно клинической оценкой) в диагностике ОРЛ. Отчеты о данных исследованиях (как минимум 20 случаев ОРЛ) рассматриваются в табл. 5.
В целом более чем в 25 исследованиях сообщалось о данных эхокардиографических/допплеровских исследований, свидетельствовавших о недостаточности митрального или аортального клапана у больных с ОРЛ при отсутствии классических аускультативных признаков. Данные исследования проводились в различных географических регионах и популяциях. Отчеты о вспышке ОРЛ в штате Юта были одними из первых в развитых странах мира, которые указали на применимость допплеровской эхокардиографии в диагностике кардита, вызванного ОРЛ [23]. В отличие от всех упомянутых выше отчетов за тот же период времени только в 1 исследовании сообщалось о том, что эхокардиография не имеет дополнительной диагностической ценности у пациентов без традиционных клинических признаков кардита [25]. В поддержку результатов целого ряда отдельных исследований свидетельствует метаанализ исследований субклинического кардита при ОРЛ [52]. В данном обзоре 23 статей распространенность субклинического кардита варьировала от 0 % (1 исследование) до 53 %. Взвешенная общая распространенность субклинического кардита составляла 16,8 % (95% доверительный интервал 11,9–21,6 %). Данный показатель несколько увеличился (до 18,1 %), когда анализ был ограничен 10 исследованиями, в которых использовались полные критерии Всемирной организации здравоохранения [49]. Взвешенный общий показатель персистенции или ухудшения течения заболевания у пациентов с субклиническим кардитом составил 44,7 % (95% доверительный интервал 19,3–70,2 %) [52]. Однако авторы отметили, что качество данных последующего наблюдения в большинстве исследований было неудовлетворительным, длительность периодов последующего наблюдения отличалась, а также нарушалась непрерывность наблюдения за пациентами, у которых отмечались признаки улучшения состояния.
Кроме того, ни в одном из упомянутых исследований не ставилась под сомнение польза эхокардиографии/допплерографии для оценки сердечно-сосудистого статуса пациентов с ОРЛ, подтвержденной обычными клиническими критериями, или их применения в рамках долгосрочного наблюдения за пациентом. В целом, не принимая во внимание приведенный выше отдельный доклад 1996 года, все рассмотренные исследования в подавляющем большинстве выступали в поддержку использования результатов эхокардиографии/допплерографии в качестве диагностических критериев для подтверждения наличия кардита у пациентов с подозреваемой ОРЛ. Соответственно, рабочая группа пришла к следующим выводам.
1. Допплерографию следует выполнять во всех случаях подтвержденной и подозреваемой ОРЛ (класс рекомендации I; уровень доказательности B).
2. Целесообразно рассмотреть необходимость выполнения последовательных эхокардиографических/допплеровских исследований у любого пациента с подтвержденной или подозреваемой ОРЛ, даже при отсутствии ранее подтвержденного кардита во время исследования (класс рекомендации IIa; уровень доказательности C).
3. Эхокардиографию/допплерографию следует проводить (со строгим выполнением рекомендаций по поиску патологических изменений, указанных в табл. 2, 3) для оценки наличия кардита при отсутствии аускультативных признаков, в частности, среди представителей групп населения умеренного и высокого риска и в случаях, когда ОРЛ не может быть исключена (класс рекомендации I; уровень доказательности B).
4. Результаты эхокардиографии/допплерографии, не согласующиеся с признаками кардита, должны исключать данный диагноз у пациентов с сердечными шумами, которые прежде вызвали подозрения на ревматический кардит (класс рекомендации I; уровень доказательности B).
Артрит
Согласно критериям Джонса пересмотра 1992 года [2], в большинстве случаев при ОРЛ воспаление суставов представляет собой мигрирующий полиартрит, а наиболее часто поражаются более крупные суставы, в том числе коленные, голеностопные, локтевые, лучезапястные. Быстрое улучшение при использовании салицилатов или нестероидных противовоспалительных препаратов также довольно характерно для ОРЛ. Как правило, артрит при ОРЛ имеет ограниченное течение (даже без терапии) продолжительностью около 4 недель [53].
Долгосрочная деформация суставов не наблюдается. Поражение мелких суставов рук и ног и позвоночника при ревматическом артрите встречается гораздо реже, чем при других видах артрита.
Реактивный артрит
В первоначальных критериях Джонса 1944 года [54] артралгия рассматривалась в качестве основного проявления ОРЛ, но с внесением изменений в 1956 году [55, 56] основным проявлением ОРЛ начали считать только мигрирующий полиартрит, а артралгию классифицировали как второстепенное проявление данного заболевания. Пациенты с инфекцией, вызванной бета-гемолитическим стрептококком группы А, и поражением суставов, не соответствующим классическим критериям Джонса для постановки диагноза ОРЛ, иногда рассматриваются как имеющие постстрептококковый реактивный артрит/артралгию. В настоящее время однозначного мнения относительно вторичной профилактики для этих пациентов нет [57]. У некоторых пациентов детского возраста с постстрептококковым реактивным артритом позже развиваются эпизоды ОРЛ или РБС [58, 59], что, вероятно, указывает на то, что первоначальным диагнозом все же была ОРЛ. Напротив, в проспективном исследовании, проведенном в Нидерландах среди взрослого белокожего населения с низким уровнем риска развития ОРЛ, было выявлено, что постстрептококковый реактивный артрит не ассоциируется с долгосрочными негативными последствиями со стороны сердца [60].
Асептический моноартрит
Исследования, проведенные в Индии, Австралии и Фиджи, указали, что асептический моноартрит может быть важным клиническим проявлением ОРЛ в определенных популяциях высокого риска [9, 36, 61–64]. Было обнаружено, что среди коренного населения Австралии с высоким риском асептический моноартрит присутствует в 16–18 % подтвержденных случаев ОРЛ. Согласно результатам одного исследования [36], у 55 % представителей данной популяции (15/27), которые удовлетворяли бы критериям Джонса в случае, если бы моноартрит считался основным критерием, впоследствии развились бы либо ОРЛ, либо РБС. Имеется только 1 североамериканский доклад о небольшой серии случаев асептического моноартрита [65].
1. В настоящее время положение о том, что моноартрит может быть одним из проявлений ОРЛ, должно ограничиваться пациентами с умеренным — высоким риском развития данного заболевания (класс рекомендаций I; уровень доказательности C).
Полиартралгия
Полиартралгия является очень распространенным и крайне неспецифическим проявлением целого ряда ревматических заболеваний. До 1956 года данный признак считался основным критерием для диагностики ОРЛ, но поскольку критерии Джонса на протяжении десятилетий пересматривались с целью выполнения первоначального намерения доктора Джонса не допустить гипердиагностики ОРЛ, полиартралгия была переведена в категорию малых проявлений. Настоящая рабочая группа не нашла убедительных доказательных данных для внесения изменений в этот вывод в популяциях с низким уровнем риска развития ОРЛ.
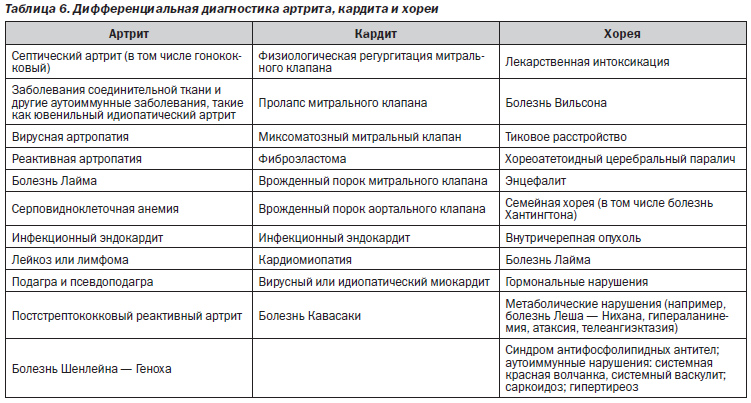
Как отмечалось ранее, артрит, вызванный ОРЛ, хорошо поддается терапии салицилатами и нестероидными противовоспалительными препаратами, которые в настоящее время доступны по всему миру без рецепта и, следовательно, часто используются еще до клинической оценки состояния пациента. Использование таких препаратов до момента установления диагноза может маскировать развитие классической мигрирующей природы полиартрита и подчеркивает необходимость тщательного сбора анамнеза у всех пациентов с подозреваемой ОРЛ. Кроме того, предрасположенные к развитию ОРЛ пациенты часто имеют повышенный риск развития других инфекционно-воспалительных заболеваний, которые могут проявляться артралгией или артритом. Поэтому врачи должны быть осведомлены о необходимости проведения исчерпывающей дифференциальной диагностики поражений суставов и особенно осторожны при исключении других причин артрита, в особенности септического артрита (табл. 6).
Как отмечается в прочих разделах настоящего заявления, положительная прогностическая ценность любого признака или симптома увеличивается по мере повышения распространенности заболевания в популяции. Таким образом, дети с полиартралгией имеют повышенную вероятность развития ОРЛ, если они относятся к популяции с высоким уровнем заболеваемости ОРЛ в сравнении с противоположными случаями, если бы они относились к популяции с низким уровнем заболеваемости. Как подтвердила рабочая группа, в последнем случае полиартралгия почти всегда является симптомом другого заболевания, отличного от ОРЛ, и поэтому эксперты высказались за необходимость оставить полиартралгию в качестве малого проявления ОРЛ в популяциях низкого риска в соответствии с первоначальными критериями Джонса.
1. Включение полиартралгии в категорию основных проявлений ОРЛ допустимо только для популяций с умеренным или высоким уровнем заболеваемости и только после тщательного рассмотрения и исключения других причин артралгии, таких как аутоиммунные, вирусные или реактивные артропатии (табл. 6) (класс рекомендаций IIb; уровень доказательности C).
Хорея (хорея Сиденгама)
Хорея при ОРЛ характеризуется непреднамеренными, непроизвольными, нестереотипными движениями туловища или конечностей [66]. Данное нарушение часто связано с мышечной слабостью и эмоциональной лабильностью. В табл. 6 представлена дифференциальная диагностика хореи. У некоторых пациентов хорея может быть преимущественно односторонней и требует тщательного неврологического обследования с целью исключения других неврологических расстройств. Следует исключить хорею Хантингтона, системную красную волчанку, болезнь Вильсона и побочные реакции на лекарственные средства, а движения необходимо дифференцировать от тиков, атетоза, конверсионных реакций и гиперкинезов. Доказательство связи хореи с недавно перенесенной стрептококковой инфекцией может оказаться сложной или даже невозможной задачей ввиду длительного латентного периода между развитием стрептококковой инфекции и началом хореи. Ухудшение хореиформных движений у ребенка с перенесенной слабовыраженной остаточной хореей трудно отличить от нового приступа хореи.
Кожные признаки
Ревматоидная эритема — это специфичная кратковременная розовая сыпь с бледным центром и закругленными или серпигинозными (ползучими) краями.
Сыпь обычно присутствует на туловище и верхних конечностях, однако не наблюдается на лице. Появление сыпи может провоцироваться воздействием тепла, а при надавливании ее элементы бледнеют. Как и в случае с другими высыпаниями, ревматоидную эритему труднее обнаружить у темнокожих лиц. Подкожные узелки являются твердыми безболезненными образованиями в виде бугорков, которые обнаруживаются на разгибательных поверхностях определенных суставов, в том числе коленных, локтевых и лучезапястных, а также в области затылка и вдоль остистых отростков грудных и поясничных позвонков. Для них не характерна расовая или популяционная вариабельность. Узелки чаще наблюдаются у пациентов с кардитом и, как и в случае с ревматоидной эритемой, практически никогда не встречаются в качестве изолированного основного проявления ОРЛ.
Другие клинические признаки: малые критерии
В критериях Джонса пересмотра 1965 года [56] авторы отметили, что во время эпизода ОРЛ температура тела, как правило, превышает 38 °C, а в редакции 1992 года [2] данный показатель был изменен на 39 °С. Тем не менее в вышеупомянутой популяции коренных жителей Австралии, являющейся группой населения высокого риска, определение лихорадки как температуры тела > 38 °С привело к повышению чувствительности диагностического критерия: 75 % лиц с ОРЛ соответствовали данному критерию по сравнению только с 25 % в случае, когда граничное значение было увеличено до > 39 °C. Граничное значение > 37,5 °С позволило бы диагностировать лихорадку в 90 % подозреваемых случаев ОРЛ. Это имеет потенциально важное значение, поскольку у 41 % представителей данной конкретной группы населения с недиагностированной ОРЛ вследствие отсутствия лихорадки (определяемой как температура тела 38 °C или 39 °C) впоследствии развилась ОРЛ или РБС [36]. Однако в большинстве случаев, включая все популяции с низким уровнем риска, связанная с ОРЛ лихорадка, как правило, превышает 38,5 °C при измерении температуры тела в ротовой полости. Как и в случае с артритом, широкое распространение жаропонижающих лекарственных средств требует детального сбора анамнеза для правильной трактовки повышенной температуры.
Как правило, между популяциями и регионами низкого и более высокого риска не отмечалось разницы в частоте развития других малых клинических проявлений ОРЛ (повышение уровня С-реактивного белка, скорости оседания эритроцитов (СОЭ), удлинение интервала PR на электрокардиограмме, анамнез ревматической лихорадки или РБС) [2, 4, 45, 61]. Для большинства групп населения СОЭ > 60 мм в первый час и уровень С-реактивного белка > 3,0 мг/дл считаются типичными для ОРЛ.
При ОРЛ значения уровня С-реактивного белка всегда должны превышать верхнюю границу нормы любой лаборатории и, как правило, составляют > 7,0 мг/дл или даже выше, в зависимости от используемого лабораторного метода. Некоторые эксперты, впрочем, рассматривают СОЭ > 30 мм/ч как сопоставимую с диагнозом ОРЛ [4]. Нормальные значения скорости оседания эритроцитов и уровня С-реактивного белка делают необходимым серьезный пересмотр диагноза ОРЛ, потому что, за исключением пациентов с изолированной хореей, данные показатели в случае ОРЛ практически никогда не находятся в пределах нормального диапазона.
Боль в области живота, учащенный пульс в положении лежа, несоизмеримая с лихорадкой тахикардия, недомогание, анемия, лейкоцитоз, носовое кровотечение и боль в области сердца также могут наблюдаться у пациентов с ОРЛ. Хотя приведенные выше клинические и лабораторные особенности не имеют особой диагностической ценности, они, конечно, совместимы с наличием ОРЛ. Поскольку данные признаки и симптомы часто встречаются и при многих других заболеваниях, их диагностическая польза меньше, чем у основных малых критериев. Семейный анамнез ревматической лихорадки также может усилить подозрения относительно данного заболевания.
Доказательства перенесенной стрептококковой инфекции
Поскольку другие заболевания могут достаточно сильно напоминать ОРЛ, при возможности необходимо получить лабораторные данные, подтверждающие перенесенную ранее инфекцию, вызванную стрептококком группы А; в случае отсутствия таких доказательных данных диагноз ставится под сомнение. Исключением является хорея, которая может быть единственным проявлением ревматической лихорадки во время ее развития, и, редко, хронический вялотекущий ревматический кардит с постепенным началом и медленным прогрессированием. Последний касается пациентов, у которых отсутствует ОРЛ в анамнезе, имеющих субклинический кардит, не обнаруженный ранее, который может быть единственным проявлением перенесенной ОРЛ у пациентов с наличием сердечно-сосудистых последствий обострения ОРЛ спустя некоторое время после начального эпизода [34]. Интерпретация результатов серологических исследований может быть затруднена в популяциях с эндемическим уровнем инфекций кожи или верхних дыхательных путей, вызванных стрептококком группы А. В данных условиях отрицательный результат анализа на антистрептококковые антитела позволяет исключить недавно перенесенную инфекцию, но положительный результат не обязательно указывает на наличие инфекции в последние несколько месяцев.
Согласно недавнему заявлению AHA, любой из приведенных ниже признаков может служить подтверждением перенесенной стрептококковой инфекции [38].
1. Повышенный или возрастающий титр антистрептолизина О или других антистрептококковых антител (анти-ДНКазы В) (класс рекомендаций I; уровень доказательности B) [38]. Нарастание титра антител является более надежным подтверждением в сравнении с однократно определенным повышенным титром.
2. Положительный результат культурального исследования мазка из зева на β-гемолитический стрептококк группы A (класс рекомендаций I; уровень доказательности B) [38].
3. Положительный результат быстрого теста на углеводный антиген стрептококка группы А у ребенка, клиническая картина которого свидетельствует о высокой вероятности предварительного диагноза стрептококкового фарингита (класс рекомендаций I; уровень доказательности B) [38].
Дифференциальная диагностика ОРЛ
Очень важно иметь рабочий дифференциальный диагноз с учетом каждого из основных критериев диагностики ОРЛ. В табл. 6, созданной на основе австралийских и новозеландских рекомендаций [4, 5], представлен список альтернативных диагнозов, которые необходимо принимать во внимание при оценке пациентов с артритом, кардитом или хореей. Принятие основанных на результатах ЭхоКГ критериев диагностики кардита при отсутствии клинических данных требует знания других признаков, которые могли бы указывать на ревматический кардит, особенно в популяциях с низким уровнем риска. Эхокардиографический диагноз кардита лучше всего устанавливать в строгом соответствии с табл. 3 и 4. В этом отношении частью эхокардиографической оценки считается учет условий циркуляторной нагрузки. На 3 из 4 критериев, используемых для диагностики патологической митральной или аортальной регургитации (длина потока, скорость и завершенность допплеровской огибающей), влияет системное артериальное давление [67]. Поскольку у взволнованных пациентов и пациентов с лихорадкой артериальное давление имеет тенденцию к быстрому изменению, целесообразно, если позволяют обстоятельства, измерять артериальное давление во время проведения эхокардиографии с целью установления наличия аномальной циркуляторной нагрузки (высокой или низкой), и при регистрации серии эхокардиограмм включать показатели артериального давления, что будет способствовать соответствующему сравнению их результатов. Следует также рассматривать возможность наличия других неревматических нарушений митрального клапана, включая физиологическую митральную регургитацию, пролапс митрального клапана, миксоматозный митральный клапан, синдром Барлоу и врожденные нарушения митрального клапана. Эндокардит и расширение фиброзного кольца митрального клапана, вызванные состояниями, связанными с дилатацией левых отделов сердца, в том числе миокардитом и кардиомиопатией, также следует включить в дифференциальную диагностику. Постоянно-волновая допплерография регургитационного потока митрального клапана позволяет отличить физиологическую регургитацию от патологической. Сигналы, не являющиеся голосистолическими, и пиковая скорость < 3,0 м/с, скорее всего, указывают на физиологическую, нежели патологическую регургитацию. Пролапс митрального клапана у пациентов с ОРЛ отличается от такового при миксоматозном митральном клапане и синдроме Барлоу [68]. При вальвулите, вызванном ОРЛ, пролабирует только смыкающаяся часть края передней створки митрального клапана и не наблюдается пролабирование медиальной части или тела створки. Пролапс края створки приводит к патологическому смыканию створок, образованию регургитационного отверстия митрального клапана и регургитационного потока, который, как правило, направлен в заднебоковом направлении.
Изолированные врожденные аномалии митрального клапана встречаются относительно редко, но их необходимо включать в дифференциальную диагностику вновь выявленной митральной регургитации. К таким нарушениям относятся расщепленный митральный клапан, митральный клапан с двойным отверстием, варианты парашютного митрального клапана и фиброэластомы. Врожденные аномалии аортального клапана следует включать в дифференциальную диагностику вновь выявленной аортальной регургитации; однако изолированная аортальная регургитация редко является единственным клапанным признаком ревматического кардита. К врожденным нарушениям, которые следует принимать во внимание, относятся двустворчатый аортальный клапан, спонтанно закрывшийся дефект межжелудочковой перегородки с пролапсом аортального клапана, мембранный субаортальный стеноз и синдромное расширение корня аорты. Инфекционный эндокардит можно ошибочно принять за ревматический кардит, если очевидные вегетации отсутствуют, а повреждение клапана уже произошло.
Рецидивы ревматической лихорадки
Согласно рекомендациям 1992 года [2], пациенты с анамнезом ОРЛ или РБС в случае повторного инфицирования стрептококками группы А имеют высокий риск повторного обострения. Такое обострение считается новым эпизодом ОРЛ, но таковым, при котором полный набор критериев Джонса, даже пересмотренных, не может быть полностью удовлетворен.
1. При наличии подтвержденного анамнеза ОРЛ или установленной РБС и при условии подтвержденной инфекции, вызванной стрептококком группы А, 2 больших или 1 большого и 2 малых, или 3 малых критериев может быть достаточно для постановки предварительного диагноза (класс рекомендаций IIb; уровень доказательности С).
2. При наличии только малых критериев ОРЛ перед постановкой диагноза рецидива ОРЛ рекомендуется исключить другие, более вероятные причины клинической картины (класс рекомендаций I; уровень доказательности C).
Возможная ревматическая лихорадка
В некоторых случаях клинические проявления могут не соответствовать обновленным критериям Джонса, однако врач может иметь серьезный повод подозревать диагноз ОРЛ. Подобная ситуация может возникнуть в условиях с высоким уровнем заболеваемости, когда, например, результаты лабораторных анализов для выявления реактантов острой фазы или для подтверждения недавно перенесенной стрептококковой инфекции отсутствуют, медицинская документация не содержит четких данных или анамнез заболевания не считается надежным. В таких ситуациях клиницисту следует действовать по своему усмотрению, используя свои собственные клиническое чутье и суждение при постановке наиболее вероятного, как ему кажется, диагноза и назначении соответствующего лечения.
1. При наличии подлинной неопределенности целесообразно рассмотреть вопрос о проведении 12-месячной вторичной профилактики с последующей переоценкой, включающей тщательный сбор анамнеза и физикальное обследование в дополнение к повторной эхокардиографии (класс рекомендаций IIa; уровень доказательности С).
2. При рецидиве симптомов (в частности, с вовлечением суставов) у пациента, который был привержен рекомендациям по профилактике, но у которого не хватает серологических признаков стрептококковой инфекции группы А и эхокардиографических доказательств вальвулита, разумно прийти к выводу, что текущие симптомы, вероятно, не связаны с ОРЛ. В таком случае целесообразным может быть прекращение антибиотикопрофилактики (класс рекомендаций IIa; уровень доказательности С).
Влияние модификации критериев Джонса в популяциях высокого риска
В ретроспективном исследовании, проведенном в Северном Квинсленде, Австралия, изучалось влияние добавления субклинического кардита, моноартрита и субфебрильной температуры тела (> 37,5 °C) в перечень критериев Джонса пересмотра 1992 года [36]. Из 98 пациентов с клиническим диагнозом ОРЛ только 71,4 % удовлетворяли пересмотренным критериям Джонса. Обсуждаемая выше модификация критериев привела к увеличению доли случаев, соответствующих диагностическим критериям, до 91,8 %. Среди 28 человек, не отвечающих традиционным критериям Джонса, у 12 (42 %) впоследствии возникли признаки хронической РБС. При подтверждении результатов данного исследования можно предположить, что добавление в критерии Джонса моноартрита и субклинического кардита в качестве основных проявлений и субфебрильной температуры тела в качестве малого проявления может увеличить чувствительность критериев при применении в группах населения высокого риска. Кроме того, исследование применения новозеландских рекомендаций по ОРЛ продемонстрировало увеличение диагностирования ОРЛ на 16 % по сравнению с критериями Джонса пересмотра 1992 года [29]. Дополнительные данные, которые бы подтверждали указанные результаты для популяций с более низкой частотой развития ОРЛ, отсутствуют.
Подводя итог вышесказанному, в контексте предыдущего обсуждения стоит отметить, что пересмотр критериев Джонса с целью удовлетворения текущих технологических достижений и клинических потребностей является оправданным. Таким образом, строгое применение результатов эхокардиографии/допплерографии (табл. 3, 4) может быть полезно для подтверждения основного критерия ОРЛ — кардита, даже при отсутствии классических аускультативных признаков. Кроме того, моноартрит или полиартралгия могут рассматриваться в качестве основных критериев артрита, но только в популяциях с умеренным или высоким риском. Для популяций низкого риска моноартрит не включается в критерии, а полиартралгия остается малым критерием. Кроме того, требование наличия лихорадки может быть выполнено при условии задокументированной температуры тела 38 °С, измеренной в ротовой полости, тимпанальном канале или ректально в группах населения с умеренным — высоким риском, однако для всех остальных популяций температура должна составлять ≥ 38,5 °C. Рабочая группа подтверждает целесообразность сохранения проверенного временем подхода, за который изначально выступал доктор Джонс, отдававший предпочтение низкой чувствительности и высокой специфичности в оценке критериев для диагностики ОРЛ в популяциях с низким уровнем риска.
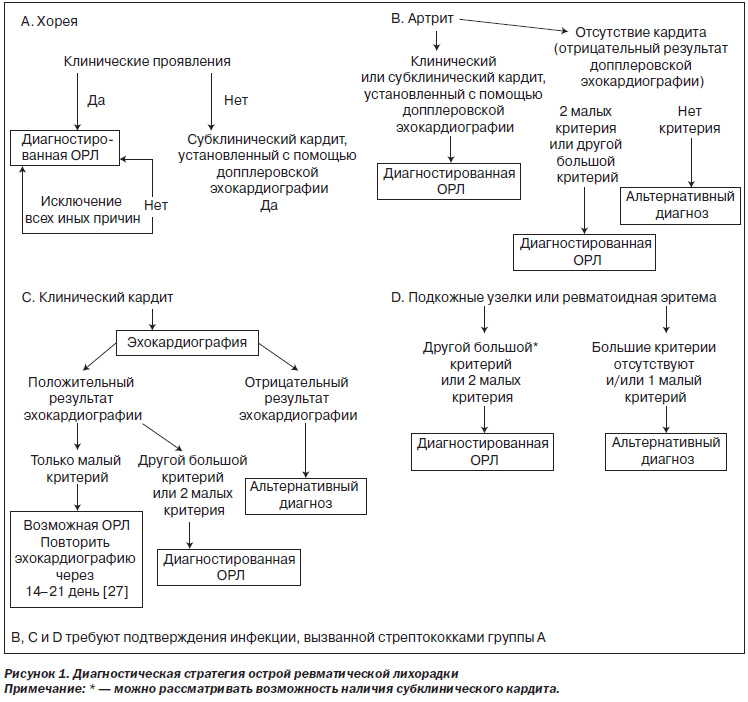
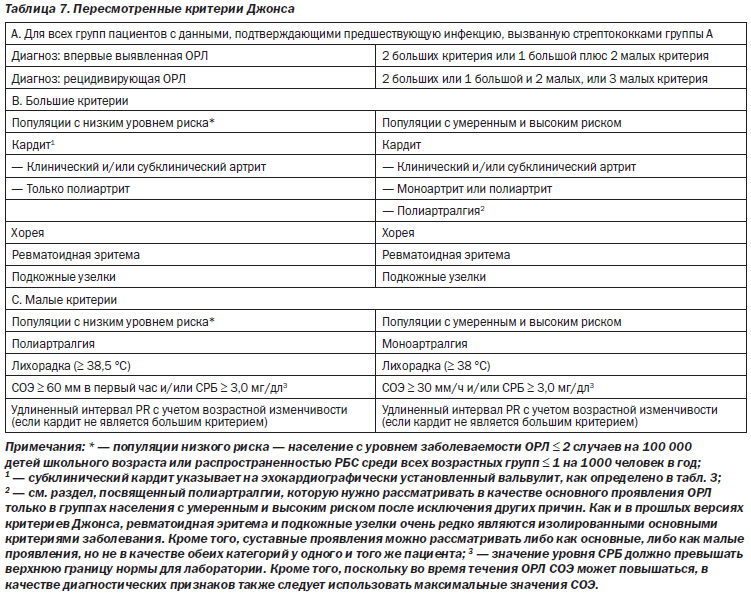
В табл. 7 и на рис. 1 обобщены диагностические стратегии с использованием пересмотренных критериев Джонса.
Перспективы
В дополнение к эпидемиологическим вопросам и широкому распространению грамотного применения эхокардиографии, что привело к предлагаемым изменениям в критериях Джонса, описанным в данном заявлении, недавние находки, свидетельствующие о генетических факторах предрасположенности к ОРЛ [69–71], однажды могут указать на совершенно новый набор диагностических средств. При изменениях в будущем необходимо продолжать выполнять первоначальную цель доктора Джонса, в частности, в популяциях с низким уровнем риска, чтобы избежать гипердиагностики и ее нежелательных последствий [54].
1. Seckeler M.D., Hoke T.R. The worldwide epidemiology of acute rheumatic fever and rheumatic heart disease // Clin. Epidemiol. 2011; 3: 67–84. doi: 10.2147/CLEP.S12977.
2. Dajani A.S., Ayoub E., Bierman F.Z., Bisno A.L., Denny F.W., Durack D.T., Ferrieri P., Freed M., Gerber M., Kaplan E.L., Karchmer A.W., Markowitz M., Rahimtoola S.H., Shulman S.T., Stollerman G., Takahashi M., Taranta A., Taubert K.A., Wilson W., Durack; Special Writing Group of the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young of the American Heart Association. Guidelines for the diagnosis of rheumatic fever: Jones criteria, 1992 update [published correction appears in JAMA. 1993; 269: 476] // JAMA. 1992; 268: 2069–2073.
3. Ferrieri P.; for the Jones Criteria Working Group. Proceedings of the Jones criteria workshop // Circulation. 2002; 106: 2521–2523.
4. RHDAustralia (ARF/RHD Writing Group), National Heart Foundation of Australia, Cardiac Society of Australia and New Zealand // The Australian Guideline for Prevention, Diagnosis, and Management of Acute Rheumatic Fever and Rheumatic Heart Disease (2nd ed). Casuarina, Australia: RHDAustralia; 2012.
5. Atatoa-Carr P., Lennon D., Wilson N.; New Zealand Rheumatic Fever Guidelines Writing Group. Rheumatic fever diagnosis, management, and secondary prevention: a New Zealand guideline // N. Z. Med. J. 2008; 121: 59–69.
6. Vijayalakshmi I.B., Mithravinda J., Deva A.N. The role of echocardiography in diagnosing carditis in the setting of acute rheumatic fever // Cardiol. Young. 2005; 15: 583–588. doi: 10.1017/S1047951105001745.
7. Vijayalakshmi I.B., Vishnuprabhu R.O., Chitra N., Rajasri R., Anuradha T.V. The efficacy of echocardiographic criterions for the diagnosis of carditis in acute rheumatic fever // Cardiol. Young. 2008; 18: 586–592. doi: 10.1017/S1047951108003107.
8. Ozdemir O., Işık S., Abacı A., Hızlı S., Akelma A.Z., Kışlal F.M., Celik A., Razi C.H., Koзak M. Silent enemy in acute rheumatic fever: subclinical carditis [in Turkish] // Turk. Kardiyol. Dern. Ars. 2011; 39: 41–46.
9. Cann M.P., Sive A.A., Norton R.E., McBride W.J., Ketheesan N. Clinical presentation of rheumatic fever in an endemic area // Arch. Dis. Child. 2010; 95: 455–457. doi: 10.1136/adc.2008.157107.
10. Beg A., Sadiq M. Subclinical valvulitis in children with acute rheumatic fever // Pediatr. Cardiol. 2008; 29: 619–623. doi: 10.1007/s00246-007-9173-0.
11. Caldas A.M., Terreri M.T., Moises V.A., Silva C.M., Len C.A., Carvalho A.C., Hilаrio M.O. What is the true frequency of carditis in acute rheumatic fever? A prospective clinical and Doppler blind study of 56 children with up to 60 months of follow-up evaluation // Pediatr. Cardiol. 2008; 29: 1048–1053. doi: 10.1007/s00246-008-9242-z.
12. Rayamajhi A., Sharma D., Shakya U. Clinical, laboratory and echocardiographic profile of acute rheumatic fever in Nepali children // Ann. Trop. Paediatr. 2007; 27: 169–177. doi: 10.1179/146532807X220271.
13. Ozer S., Hallioğlu O., Ozkutlu S., Celiker A., Alehan D., Karagоz T. Childhood acute rheumatic fever in Ankara, Turkey // Turk. J. Pediatr. 2005; 47: 120–124.
14. Panamonta M., Chaikitpinyo A., Kaplan E.L., Pantongwiriyakul A., Tassniyom S., Sutra S. The relationship of carditis to the initial attack of Sydenham’s chorea // Int. J. Cardiol. 2004; 94: 241–248. doi: 10.1016/j.ijcard.2003.04.020.
15. Ozkutlu S., Hallioglu O., Ayabakan C. Evaluation of subclinical valvar disease in patients with rheumatic fever // Cardiol. Young. 2003; 13: 495–499.
16. Karaaslan S., Demirоren S., Oran B., Baysal T., Başpinar O., Uсar C. Criteria for judging the improvement in subclinical rheumatic valvitis // Cardiol. Young. 2003; 13: 500–505.
17. Khriesat I., Najada A., Al-Hakim F., Abu-Haweleh A. Acute rheumatic fever in Jordanian children // East Mediterr. Health J. 2003; 9: 981–987.
18. Lanna C.C., Tonelli E., Barros M.V., Goulart E.M., Mota C.C. Subclinical rheumatic valvitis: a long-term follow-up // Cardiol. Young. 2003; 13: 431–438.
19. Figueroa F.E., Fernаndez M.S., Valdés P., Wilson C., Lanas F., Carriуn F., Berríos X., Valdés F. Prospective comparison of clinical and echocardiographic diagnosis of rheumatic carditis: long term follow up of patients with subclinical disease // Heart. 2001; 85: 407–410.
20. Hilаrio M.O., Andrade J.L., Gasparian A.B., Carvalho A.C., Andrade C.T., Len C.A. The value of echocardiography in the diagnosis and followup of rheumatic carditis in children and adolescents: a 2 year prospective study // J. Rheumatol. 2000; 27: 1082–1086.
21. Elevli M., Celebi A., Tombul T. Cardiac involvement in Sydenham’s chorea: clinical and Doppler echocardiographic findings // Acta Paediatr. 1999; 88: 1074–1077.
22. Da Silva C.H.; Pediatric Committee, Sao Paulo Pediatric Rheumatology Society. Rheumatic fever: a multicenter study in the state of Sao Paulo // Rev. Hosp. Clin. Fac. Med. Sao Paolo. 1999; 54: 85–90.
23. Minich L.L., Tani L.Y., Pagotto L.T., Shaddy R.E., Veasy L.G. Doppler echocardiography distinguishes between physiologic and pathologic «silent» mitral regurgitation in patients with rheumatic fever // Clin. Cardiol. 1997; 20: 924–926.
24. Hoffman T.M., Rhodes L.A., Pyles L.A., Balian A.A., Neal W.A., Einzig S. Childhood acute rheumatic fever: a comparison of recent resurgence areas to cases in West Virginia // W. V. Med. J. 1997; 93: 260–263.
25. Vasan R.S., Shrivastava S., Vijayakumar M., Narang R., Lister B.C., Narula J. Echocardiographic evaluation of patients with acute rheumatic fever and rheumatic carditis // Circulation. 1996; 94: 73–82.
26. Maheu B., Costes P., Lionet P., Kamblock J., Papouin G., Mansourati J., Genet L., Blanc J.J. Contribution of Doppler echocardiography to the diagnosis of the first attack of acute rheumatic fever [in French] // Arch. Mal. Coeur. Vaiss. 1995; 88: 1833–1839.
27. Abernethy M., Bass N., Sharpe N., Grant C., Neutze J., Clarkson P., Greaves S., Lennon D., Snow S., Whalley G. Doppler echocardiography and the early diagnosis of carditis in acute rheumatic fever // Aust. N. Z. J. Med. 1994; 24: 530–535.
28. Veasy L.G., Tani L.Y., Hill H.R. Persistence of acute rheumatic fever in the intermountain area of the United States // J. Pediatr. 1994; 124: 9–16.
29. Wilson N.J., Voss L., Morreau J., Stewart J.M., Lennon D. New Zealand guidelines for the diagnosis of acute rheumatic fever: small increase in the incidence of definite cases compared to the America Heart Association Jones criteria // N. Z. Med. J. 2013; 126: 50–59.
30. Caldas A.M., Terreri M.T., Moises V.A., Silva C.M., Carvalho A.C., Hilаrio M.O. The case for utilizing more strict quantitative Doppler echocardiographic criterions for diagnosis of subclinical rheumatic carditis // Cardiol. Young. 2007; 17: 42–47. doi: 10.1017/S1047951106001296.
31. Marijon E., Ou P., Celermajer D.S., Ferreira B., Mocumbi A.O., Jani D., Paquet C., Jacob S., Sidi D., Jouven X. Prevalence of rheumatic heart disease detected by echocardiographic screening // N. Engl. J. Med. 2007; 357: 470–476. doi: 10.1056/NEJMoa065085.
32. Saxena A., Ramakrishnan S., Roy A., Seth S., Krishnan A., Misra P., Kalaivani M., Bhargava B., Flather M.D., Poole-Wilson P.P. Prevalence and outcome of subclinical rheumatic heart disease in India: the RHEUMATIC (Rheumatic Heart Echo Utilisation and Monitoring Actuarial Trends in Indian Children) study // Heart. 2011; 97: 2018–2022. doi: 10.1136/heartjnl-2011-300792.
33. Paar J.A., Berrios N.M., Rose J.D., Cаceres M., Peсa R., Pеrez W., Chen-Mok M., Jolles E., Dale J.B. Prevalence of rheumatic heart disease in children and young adults in Nicaragua // Am. J. Cardiol. 2010; 105: 1809–1814. doi: 10.1016/j.amjcard.2010.01.364.
34. Beaton A., Okello E., Lwabi P., Mondo C., McCarter R., Sable C. Echocardiography screening for rheumatic heart disease in Ugandan schoolchildren // Circulation. 2012; 125: 3127–3132. doi: 10.1161/CIRCULATIONAHA.112.092312.
35. Webb R.H., Wilson N.J., Lennon D.R., Wilson E.M., Nicholson R.W., Gentles T.L., O’Donnell C.P., Stirling J.W., Zeng I., Trenholme A.A. Optimising echocardiographic screening for rheumatic heart disease in New Zealand: not all valve disease is rheumatic // Cardiol. Young. 2011; 21: 436–443.
36. Carapetis J.R., Currie B.J. Rheumatic fever in a high incidence population: the importance of monoarthritis and low grade fever // Arch. Dis. Child. 2001; 85: 223–227.
37. Gibbons R.J., Smith S., Antman E. American College of Cardiology/American Heart Association clinical practice guidelines: part 1: where do they come from? // Circulation. 2003; 107: 2979–2986. doi: 10.1161/01.CIR.0000063682.20730.A5.
38. Gerber M.A., Baltimore R.S., Eaton C.B., Gewitz M., Rowley A.H., Shulman S.T., Taubert K.A. Prevention of rheumatic fever and diagnosis and treatment of acute streptococcal pharyngitis: a scientific statement from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Translational Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research // Circulation. 2009; 119: 1541–1551. doi: 10.1161/CIRCULATIONAHA.109.191959.
39. Gordis L. The virtual disappearance of rheumatic fever in the United States: lessons in the rise and fall of disease: T. Duckett Jones Memorial Lecture // Circulation. 1985; 72: 1155–1162.
40. Levinson S.S., Bearfield J.L., Ausbrook D.K., Muriel H., Shireman L., Pacelli C., Stanton H., Masterson J. The Chicago rheumatic fever program: a 20 plus year history // J. Chronic. Dis. 1982; 35: 199–206.
41. Markowitz M. The decline of rheumatic fever: role of medical intervention: Lewis W. Wannamaker Memorial Lecture // J. Pediatr. 1985; 106: 545–550.
42. Shulman S.T., Stollerman G., Beall B., Dale J.B., Tanz R.R. Temporal changes in streptococcal M protein types and the near-disappearance of acute rheumatic fever in the United States // Clin. Infect. Dis. 2006; 42: 441–447. doi: 10.1086/499812.
43. Pastore S., De Cunto A., Benettoni A., Berton E., Taddio A., Lepore L. The resurgence of rheumatic fever in a developed country area: the role of echocardiography // Rheumatology (Oxford). 2011; 50: 396–400. doi: 10.1093/rheumatology/keq290.
44. Milne R.J., Lennon D.R., Stewart J.M., Vander Hoorn S., Scuffham P.A. Incidence of acute rheumatic fever in New Zealand children and youth // J. Paediatr. Child Health. 2012; 48: 685–691. doi: 10.1111/j.1440–1754.2012.02447.x.
45. Parnaby M.G., Carapetis J.R. Rheumatic fever in indigenous Australian children // J. Paediatr. Child Health. 2010; 46: 527–533. doi: 10.1111/j.1440-1754.2010.01841.x.
46. Jamal M., Abbas K.A. Clinical profile of acute rheumatic fever in children // J. Trop. Pediatr. 1989; 35: 10–13.
47. Vinker S., Zohar E., Hoffman R., Elhayany A. Incidence and clinical manifestations of rheumatic fever: a 6 year community-based survey // Isr. Med. Assoc. J. 2010; 12: 78–81.
48. Grassi A., Fesslovа V., Carnelli V., Boati E., Dell’era L., Salice P., Bardare M., Corona F. Clinical characteristics and cardiac outcome of acute rheumatic fever in Italy in the last 15 years // Clin. Exp. Rheumatol. 2009; 27: 366–372.
49. World Health Organization. Rheumatic Fever and Rheumatic Heart Disease: Report of a WHO Expert Consultation, Geneva, 29 October — 1 November 2001. Geneva, Switzerland: World Health Organization; 2001. WHO Technical Report Series 923. http://www.who.int/cardiovascular_diseases/resources/en/cvd_trs923.pdf. Accessed May 18, 2011.
50. Working Group on Pediatric Acute Rheumatic Fever and Cardiology Chapter of Indian Academy of Pediatrics. Consensus guidelines on pediatric acute rheumatic fever and rheumatic heart disease // Indian Pediatr. 2008; 45: 565–573.
51. Remеnyi B., Wilson N., Steer A., Ferreira B., Kado J., Kumar K., Lawrenson J., Maguire G., Marijon E., Mirabel M., Mocumbi A.O., Mota C., Paar J., Saxena A., Scheel J., Stirling J., Viali S., Balekundri V.I., Wheaton G., Zuhlke L., Carapetis J. World Heart Federation criteria for echocardiographic diagnosis of rheumatic heart disease: an evidence-based guideline // Nat. Rev. Cardiol. 2012; 9: 297–309. doi: 10.1038/nrcardio.2012.7.
52. Tubridy-Clark M., Carapetis J.R. Subclinical carditis in rheumatic fever: a systematic review // Int. J. Cardiol. 2007; 119: 54–58. doi: 10.1016/j.ijcard.2006.07.046.
53. Jaggi P. Rheumatic fever and post group-A streptococcal arthritis // Pediatr. Infect. Dis. J. 2011; 30: 424–425.
54. Jones T.D. Diagnosis of rheumatic fever // JAMA. 1944; 126: 481–484. doi:10.1001/jama.1944.02850430015005.
55. Jones criteria (modified) for guidance in the diagnosis of rheumatic fever: report of the Committee on Standards and Criteria for Programs of Care // Circulation. 1956; 13: 617–620.
56. Committee Report. Jones criteria (revised) for guidance in the diagnosis of rheumatic fever // Circulation. 1965; 32: 664–668.
57. De Cunto C.L., Giannini E.H., Fink C.W., Brewer E.J., Person D.A. Prognosis of children with poststreptococcal reactive arthritis // Pediatr. Infect. Dis. J. 1988; 7: 683–686.
58. Merino Muсoz R., Viota Losada F., Sancho Madrid B., Castro Gussoni C., Garcia-Consuegra Molina J. Rheumatic fever and post-streptococcal arthritis: clinical review [in Spanish] // An. Esp. Pediatr. 1991; 35: 239–242.
59. Koзak G., Imamoğlu A., Tutar H.E., Atalay S., Turkay S. Poststreptococcal reactive arthritis: clinical course and outcome in 15 patients // Turk. J. Pediatr. 2000; 42: 101–104.
60. Van Bemmel J.M., Delgado V., Holman E.R., Allaart C.F., Huizinga T.W., Bax J.J., van der Helmvan Mil A.H. No increased risk of valvular heart disease in adult poststreptococcal reactive arthritis // Arthritis Rheum. 2009; 60: 987–993. doi: 10.1002/art.24401.
61. Tani L.Y. Rheumatic fever and rheumatic heart disease / Allen H.D., Driscoll M.D., Shaddy R.E., Feltes T.F. // Moss and Adams’ Heart Disease in Infants, Children, and Adolescents. 8th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2013: 1303–1330.
62. Parks T., Kado J., Colquhoun S., Carapetis J., Steer A. Underdiagnosis of acute rheumatic fever in primary care settings in a developing country [published correction appears in Trop. Med. Int. Health. 2010; 15: 384] // Trop. Med. Int. Health. 2009; 14: 1407–1413. doi: 10.1111/j.1365–3156.2009.02385.x.
63. Noonan S., Zurynski Y.A., Currie B.J., McDonald M., Wheaton G., Nissen M., Curtis N., Isaacs D., Richmond P., Ramsay J.M., Elliott E.J., Carapetis J.R. A national prospective surveillance study of acute rheumatic fever in Australian children // Pediatr. Infect. Dis. J. 2013; 32: e26–e32. doi: 10.1097/INF.0b013e31826faeb3.
64. Sanyal S.K., Thapar M.K., Ahmed S.H., Hooja V., Tewari P. The initial attack of acute rheumatic fever during childhood in North India: a prospective study of the clinical profile // Circulation. 1974; 49: 7–12.
65. Harlan G.A., Tani L.Y., Byington C.L. Rheumatic fever presenting as monoarticular arthritis // Pediatr. Infect. Dis. J. 2006; 25: 743–746. doi: 10.1097/01.inf.0000227726.44519.00.
66. Markowitz M., Kuttner A.G. Rheumatic Fever. Philadelphia, PA: WB Saunders; 1972.
67. Stout K.K., Verrier E.D. Acute valvular regurgitation // Circulation. 2009; 119: 3232–3241. doi: 10.1161/CIRCULATIONAHA.108.782292.
68. Anyanwu A.C., Adams D.H. Etiologic classification of degenerative mitral valve disease: Barlow’s syndrome and fibroelastic deficiency // Semin. Thorac. Cardiovasc. Surg. 2007; 19: 90–96.
69. Guilherme L., Kоhler K.F., Postol E., Kalil J. Genes, autoimmunity and pathogenesis of rheumatic heart disease // Ann. Pediatr. Cardiol. 2011; 4: 13–21. doi: 10.4103/0974–2069.79617.
70. Bryant P.A., Robins-Browne R., Carapetis J.R., Curtis N. Some of the people, some of the time: susceptibility to acute rheumatic fever // Circulation. 2009; 119: 742–753. doi: 10.1161/CIRCULATIONAHA.108.792135.
71. Engel M.E., Stander R., Vogel J., Adeyemo A.A., Mayosi B.M. Genetic susceptibility to acute rheumatic fever: a systematic review and meta-analysis of twin studies // PLoS One. 2011; 6: e25326. doi: 10.1371/journal. pone.0025326.