Журнал «Медицина неотложных состояний» 4 (67) 2015
Вернуться к номеру
Ефективність аналгезії поперечного площинного блока (ТАР — transversus abdominis plane block) після абдомінальної хірургії в дітей
Авторы: Дмитрієв Д.В. — Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Дослідження проведені у 22 дітей, прооперованих із приводу пухлин черевної порожнини та пухлин заочеревинного простору. Залежно від методики знеболювання пацієнти були поділені на дві групи: перша група — 10 пацієнтів (використовувалась мультимодальна аналгезія, ТАР-блок та безперервна внутрішньовенна інфузія фентанілу), друга група — 12 дітей (призначалась лише внутрішньовенна безперервна інфузія фентанілу). Доведено, що проведення багатокомпонентної аналгезії (ТАР-блок та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) значно зменшує негативні наслідки недостатнього знеболювання в дітей та сприяє ефективній аналгезії після травматичних операцій, зменшує прояви синдрому гіпералгезії, покращує показники гемодинаміки та кровотоку в судинах черевної порожнини.
Исследования проведены у 22 детей, прооперированных по поводу опухолей брюшной полости и опухолей забрюшинного пространства. В зависимости от методики обезболивания пациенты были поделены на две группы: первая группа — 10 пациентов (использовалась мультимодальная аналгезия, ТАР-блок и непрерывная внутривенная инфузия фентанила), вторая группа — 12 детей (назначалась только непрерывная внутривенная инфузия фентанила). Доказано, что проведение многокомпонентной аналгезии (ТАР-блок и непрерывная внутривенная инфузия опиоидных анальгетиков) значительно уменьшает негативные последствия недостаточного обезболивания у детей и способствует эффективной аналгезии после травматических операций, уменьшает проявления синдрома гипералгезии, улучшает показатели гемодинамики и кровоток в сосудах брюшной полости.
The studies were carried out in 22 children who underwent surgery for abdominal and retroperitoneal tumors. Depending on the method of anesthesia, patients were divided into two groups: the first group — 10 patients (multimodal analgesia, transversus abdominis plane (TAP) block and continuous intravenous infusion of fentanyl were used), the second group — 12 children (continuous intravenous infusion of fentanyl was only used). It is proved that multicomponent analgesia (TAP-block and continuous intravenous infusion of opioid analgesics) significantly reduces the negative effects of inadequate anesthesia in children and contributes to the effective analgesia after traumatic surgeries, reduces the manifestations of hyperalgesia, improves parameters of hemodynamics and blood flow in the vessels of the abdominal cavity.
гіпералгезія, діти, післяопераційний період.
гипералгезия, дети, послеоперационный период.
hyperalgesia, children, postoperative period.
Статья опубликована на с. 45-50
Вступ
Відомо, що біль, який відчувала дитина в ранньому післяопераційному періоді, змінює розвиток системи ноцицепції і призводить до необоротних функціональних і структурних змін у центральній нервовій системі, чим змінює програму відповіді на біль у майбутньому [1].
Основними причинами неадекватної аналгезії в післяопераційному періоді у дітей є: відсутність загальновизнаних і простих методів оцінки тяжкості больового синдрому в педіатрії; використання переважно наркотичних анальгетиків; неможливість або обмеження використання ефективних сучасних методів післяопераційної аналгезії та переконання частини лікарів, що такі діти є менш чутливими до болю [1, 3]. Неадекватна аналгезія в ранньому післяопераційному періоді погіршує перебіг і прогноз цього періоду в дітей і збільшує рівень післяопераційних ускладнень та сприяє розвитку гіпералгезії.
Гіпералгезія — це стан підвищеної чутливості до болю, що виникає внаслідок інтенсивної ноцицептивної стимуляції або може бути індукований опіоїдними анальгетиками [7, 9].
Гіпералгезія реалізується переважно на рівні спинного мозку й асоціюється зі збільшенням інтенсивності болю та, відповідно, розвитком стрес-відповіді на біль, підвищенням ризику хронізації болю, розвитком толерантності до опіоїдів та потребою в підвищенні доз [3, 5, 8].
Для діагностики гіпералгезії стандартно виконують визначення больового порогу за допомогою монофіламентів фон Фрея в зоні післяопераційної рани, використовуючи монофіламенти у зростаючому порядку до найменшої сили тиску, що сприймається досліджуваним як больове відчуття [4, 6].
Анестезія поперечного простору живота (ТАР-блок) є новим підходом у блокуванні аферентних нервів передньої черевної стінки за допомогою введення місцевого анестетика в ділянку трикутника Petit. Для виконання цієї процедури зазвичай використовують анатомічні орієнтири й тактильні відчуття. На сьогодні доведено, що застосування ультразвукової підтримки збільшує відсоток успіху блокади і практично виключає можливість ненавмисної пункції черевної порожнини [10, 11].
Мета: оцінити ефективність ТАР-блоку, виконаного під ультразвуковим контролем, у перші години після операції на органах черевної порожнини у дітей.
Об’єкт та методи дослідження
Дослідження проведені у 22 дітей (14,7 ± 2,4 року), прооперованих із приводу пухлин черевної порожнини (14 дітей, 63,6 %), пухлин заочеревинного простору (8 дітей, 37,4 %).
Залежно від методики знеболювання пацієнти були поділені на дві групи: перша група — 10 пацієнтів (використовувались мультимодальна аналгезія, ТАР-блок та безперервна внутрішньовенна (в/в) інфузія фентанілу), друга група — 12 дітей (призначалась лише внутрішньовенна безперервна інфузія фентанілу) [2–4]. Всім хворим проводилось комплексне інтенсивне лікування: інфузійна та трансфузійна терапія, респіраторна підтримка апаратом Hamillton C2 — режим ASV за параметрами: FiO2 30 %, PEEP 2 см H2О, PIP 15–20 см H2О; антибактеріальне лікування, посиндромна терапія.
Оцінка ефективності знеболювання в ранньому післяопераційному періоді проводилась за допомогою вивчення показників: частоти дихання (ЧД), частоти серцевих скорочень (ЧСС), артеріального тиску систолічного (АТсист.), діастолічного (АТдіаст.), середнього артеріального тиску (САТ), сатурації кисню (SaO2), концентрації CO2 у повітрі, що видихається (CO2 ET), рівня кортизолу в крові, клініки перебігу анестезії. Додатково вивчались показники центральної гемодинаміки: ударний об’єм (УО), об’єм кровообігу за хвилину (ХОК).
Дослідження проводились на таких етапах знеболювання: 1-й етап — 24 години до оперативного втручання, 2-й етап — закінчення оперативного втручання (повне відновлення свідомості), 3-й етап — 6-та година після оперативного втручання та 4-й етап — 12-та година після оперативного втручання.
Пацієнту в ранньому післяопераційному періоді (6–12 годин) визначали периметр мінімального порогу болю навколо післяопераційної рани. Проекція лінії післяопераційної рани умовно розподілялась на два рівні відрізки трьома точками, через які в 16 векторних напрямках, із кутом між ними в 45°, за допомогою набору з 10 каліброваних монофіламентів фон Фрея здійснювали тиск на шкіру зі зростаючою силою від 4 г (39,216 mN) до 300 г (2941,176 mN) (Touch-Test Sensory Evaluator, North Coast Medical Inc., CA, USA), притискаючи монофіламенти у зростаючому порядку до поверхні шкіри під кутом 90°, доки монофіламент не зігнеться, на 1–1,5 с.
Між дослідженнями витримували адаптаційний інтервал у 10 с. Механічний больовий поріг визначали як найменшу силу тиску, що спричинювала больову реакцію пацієнта (4 бали або більше за поведінковою шкалою оцінки болю (Behavioral Pain Scale, BPS) (табл. 1). Больовий поріг вимірювали на поверхні навколо післяопераційної рани.
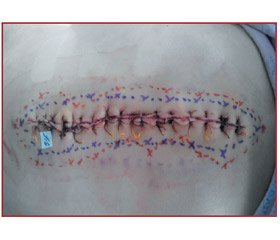
Кожну з 16 визначених точок відмічали кольоровим маркером на шкірі, а з’єднавши їх між собою, отримували дійсний периметр мінімального порогу болю навколо післяопераційної рани, з наступною фотофіксацією, що реалізувалась паралельно до площини шва як площина периметра зони гіпералгезії на тілі пацієнта (рис. 1).
/46/46.jpg)
Аналогічно відбувалось визначення зовнішнього контуру гіпералгезії шляхом маркування її контрольних точок. На етапі фотофіксації біля функціонального або анатомічного об’єкта з метою масштабування розміщували паперовий квадратний маркер площею в 1 см2. У подальшому отримане зображення інтегрується в програмне середовище Kompas-3DV13 (ліцензія № АГ-12-00651), у якому за допомогою графічних кривих визначається площа об’єкта в цифровому вираженні.
Оскільки досліджувана зона зазвичай має виражені нерегулярні геометричні параметри, дублювання контуру реалізували за допомогою кривих Безьє, що цілком лежать в опуклій оболонці своїх контрольних точок. Крива Безьє — параметрична крива, що задається виразом:
/47/47.jpg)
де Pi — функція компонент векторів контрольних точок, а bi, n (t) — базисні функції кривої Безьє, що також називаються поліномами Бернштейна.
/47/47_2.jpg)
— число n за i, n — ступінь полінома, i — порядковий номер контрольної точки.
Після відтворення контурного сплайна кривих Безьє зони периметра функціонального або анатомічного об’єкта за допомогою вмонтованого модуля «Вирахувати» ідентифікуємо величину площі отриманої зони.
Статистичну обробку отриманих даних проводили із застосуванням методів варіаційної статистики за допомогою програми Stаtistica 5.5 (належить ЦНІТ ВНМУ імені М.І. Пирогова, ліцензійний № AXXR910A374605FA). Оцінювали та визначали середні значення, стандартні відхилення та похибки середнього. Вірогідність різниць значень між кількісними величинами в разі відповідності розподілів нормальному визначали критеріями Стьюдента та Фішера. Вірогідними вважались відмінності при р < 0,05.
Результати дослідження
Перша група — 10 пацієнтів, у яких знеболювання проводилось методом комбінованої ТАР-блокади бупівакаїном 0,375% (Лонгокаїн, «Юрія-Фарм») та безперервною внутрішньовенною інфузією фентанілу в дозі 10 мкг/кг/год (середня доза 10,0 ± 0,3 мг/кг); у 12 дітей 2-ї групи знеболювання проводили безперервною внутрішньовенною інфузією фентанілу в дозі 10 мкг/кг/год (середня доза 10,7 ± 0,6 мг/кг) [2–4]. У групі ТAP-блоку після введеного наркозу 10–20 мл 0,375% Лонгокаїну було введено в нейрон-фасціальний простір поперечного м’яза живота в ділянці трикутника Petit з обох сторін.
Пункція виконувалась голкою для спінальної анестезії G 22 (B. Braun). Для візуалізації структур і контролю просування голки використовувався конвексний датчик 4–6 МГц (Logiq 100, GE, USA) [10, 11].
Показаннями для введення додаткових болюсів наркотичних анальгетиків були больова поведінка, десинхронізація зі штучною вентиляцією легень і тахікардія. У першій групі була відсутня необхідність додаткового введення морфіну, у 2-й групі 3 дітям (33 %) було введено додаткові болюси морфіну (0,5 мг/кг).
Середня сума балів, що характеризувала інтенсивність больового синдрому в ранньому післяопераційному періоді на всіх етапах дослідження (за BPS), у хворих другої групи була вірогідно більшою (р < 0,05) за відповідні значення порівняно з першою групою на всіх етапах дослідження.
Динаміка рівня кортизолу та глюкози в крові на всіх етапах дослідження свідчить про можливий розвиток гіпералгезії в більшості дітей протягом перших 6–12 годин після операції, виникнення якої пов’язано з операцією і/або недостатньою аналгезією після операції в групі фентанілу.
У всіх пацієнтів рухова реакція на 6–12-ту годину після операції була вже на подразнення з силою тиску 8 або 10 г, повністю відповідала високій оцінці за BPS і становила понад 4 бали (5,2 ± 0,2 бала та 5,1 ± 0,3 бала), що свідчило про знижений больовий поріг у хворих другої групи (фентанілу) у ранньому післяопераційному періоді (табл. 2). Слід зазначити, що в першої групі (ТАР-блок) дані прояви значно зменшувались.
Визначення зони периметра гіпералгезії (рис. 2) на 6-ту та 12-ту годину в післяопераційному періоді показало значне зменшення площі гіпералгезії при застосуванні мультимодальної аналгезії з використанням ТAP-блоку, а саме з 98,2 ± 10,4 см2 проти 123,4 ± 20,4 см2 у групі фентанілу, що приблизно в 1,4 раза менше, ніж у другої групі.
/47/47_3.jpg)
Аналіз ЧСС у дітей 1-ї групи виявив, що в більшості пацієнтів (8 дітей, 80 %) середнє значення ЧСС за весь час інфузії фентанілу та проведення ТАР-блоку було менше 115 уд/хв. Мінімальне значення середньої ЧСС за весь час дослідження становило 106,4 ± 10,4 уд/хв, максимальне — 122,0 ± 12,4 уд/хв. У 1-й групі середнє значення систолічного АТ за весь час введення препаратів становило 80,2 ± 6,2 мм рт.ст., а середнє значення діастолічного АТ за весь час дослідження — 51,6 ± 2,4 мм рт.ст. У другій групі в більшості дітей (11 осіб, 91,6 %) середнє значення ЧСС за весь час введення фентанілу залишалось менше 140 уд/хв. Мінімальна середня ЧСС протягом усього дослідження була 118,6 ± 3,3 уд/хв, максимальна — 146,2 ± 3,4 уд/хв. При дослідженні в другій групі середніх значень систолічного АТ за весь час інфузії фентанілу було виявлено, що у 8 дітей (66,6 %) цей показник був понад 80 мм рт.ст., у 4 пацієнтів середнє значення систолічного АТ знаходилось у межах 68–79 мм рт.ст. Показники SaO2 під час усього дослідження у всіх дітей 1-ї та 2-ї груп залишались стабільними в 98–99 % випадків (табл. 3).
Вірогідне зменшення на останніх етапах дослідження середніх значень ЧСС і АТ в пацієнтів першої групи може свідчити про ліквідацію гемодинамічних змін, що пов’язані з основним захворюванням і операцією, і про досягнення достатнього рівня аналгезії і седації. Ізольовані гемодинамічні зміни, що свідчать про больовий синдром, зустрічаються досить рідко. У більшості випадків вони є короткотривалими у відповідь на збільшення фізичного навантаження при реакції больової поведінки. Дослідження артеріального кровообігу у верхній брижовій артерії виявило високий індекс резистентності у 2-й групі (0,98 ± 0,02) і, відповідно, у 1-й групі (0,74 ± 0,04, при нормі 0,6–0,8) (р < 0,05), що патогенетично відображає блокаду мікроциркуляторного русла і, як наслідок, неефективне знеболювання [11, 12].
Таким чином, ефективність використання ТАP-блоку та безперервної інфузії фентанілу ґрунтується на можливості впливу на різні механізми виникнення болю, як на центральний (наркотичні анальгетики), так і на периферичний механізм (ТАP-блок) [9]. Проведення ТАP-блоку дозволяє значно знизити потребу в опіоїдах, а їх комбінування може відновити аналгетичний потенціал останніх. Різні механізми дії даних препаратів дозволяють призначати їх у комбінації і в малих дозуваннях із метою досягнення значного аналгетичного ефекту.
Висновки
1. Комплексне вивчення реакцій больової поведінки, фізіологічних показників і лабораторних стресових тестів показало, що використання комбінованої схеми ТАР-блоку 0,375% Лонгокаїном та безперервної внутрішньовенної інфузії фентанілу в дозі 10 мкг/кг/год для післяопераційного знеболювання призводить до ефективної аналгезії після травматичних онкологічних оперативних втручань.
2. Проведення мультимодальної аналгезії (ТАР-блок та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) значно зменшує негативні наслідки недостатнього знеболювання у дітей, прооперованих з приводу пухлин черевної порожнини, і можливе її застосування для ведення післяопераційного періоду.
3. Мультимодальна аналгезія (ТАР-блок та безперервна внутрішньовенна інфузія опіоїдних анальгетиків) покращує показники центральної та мезентеріальної гемодинаміки в дітей, прооперованих із приводу пухлин черевної порожнини, і, можливо, знижує ризик розвитку ускладнень у післяопераційному періоді.
4. Доведено, що неадекватна аналгезія у ранньому післяопераційному періоді у дітей, прооперованих із приводу пухлин черевної порожнини, може призводити до розвитку гіпералгезії, а застосування комбінованої схеми ТАР-блоку 0,375% Лонгокаїном та безперервної внутрішньовенної інфузії фентанілу в дозі 10 мкг/кг/год для післяопераційного знеболювання призводить до зменшення проявів гіпералгезії.
1. Айзенберг В.Л., Ульрих Г.Э., Цыпин Л.Е., Заболотский Д.В. Региональная анестезия в педиатрии. — СПб.: Синтез Бук, 2012. — 304 с.
2. Кучин Ю.Л., Глумчер Ф.С., Бєлка К.Ю. Опіоїд-індукована гіпералгезія під час анальгоседації у пацієнтів з черепно-мозковою травмою // Біль, знеболювання та інтенсивна терапія. — 2012. — № 1 (Д). — С. 254-257.
3. Кучин Ю.Л. Стрес-індукована гіпералгезія у пацієнтів з множинною травмою // Біль, знеболювання та інтенсивна терапія. — 2013. — № 2 (Д). — С. 262-266.
4. Angst M.S., Clark J.D. Opioid-induced hyperalgesia // Anesthesiology. — 2006. — 104. — 570-87.
5. Celerier E., Gonzalez J.R., Maldonado R. et al. Opioid-induced hyperalgesia in a murine model of postoperative pain: role of nitric oxide generated from the inducible nitric oxide synthase // Anesthesiology. — 2006. — 104(3). — Р. 546-55.
6. Wilder-Smith O.H., Arendt-Nielsen L. Postoperative hyperalgesia: its clinical importance and relevance // Anesthesiology. — 2006. — 104(3). — Р. 601-7.
7. Lavand’homme P., De Kock M., Waterloos H. Intraoperative epidural analgesia combined with ketamine provides effective preventive analgesia in patients undergoing major digestive surgery // Anesthesiology. — 2005. — 103(4). — Р. 813-20.
8. Kopert W. The impact of opioid-induced hyperalgesia for postoperative pain // Best Practice & Research: Clinical Anaesthesiology. — 2007. — 21(1). — 65-83.
9. Lee M., Silverman S., Hansen H., Patel V., Manchikanti L. A comprehensive review of opioid-induced hyperalgesia // Pain Physician. — 2011. — 14(2). — 145-161.
10. McDonnell J.G., O’Donnell B.D., Tuite D. et al. The regional abdominal field infiltration (R.A.F.I.) technique: computerised tomographic and anatomical identification of a novel approach to the transversus abdominis neuro-vascular fascial plane // Anesthesiology. — 2004. — 101. — A899.
11. O’Donnell B.D., McDonnell J.G., McShane A.J. The transversus abdominis plane (TAP) block in open retropubic prostatectomy // Reg. Anesth. Pain Med. — 2006. — 31. — 91.

/46/46_2.jpg)
/49/49.jpg)