Газета «Новости медицины и фармации» Кардиология и ревматология (546) 2015 (тематический номер)
Вернуться к номеру
Нехирургическое лечение остеоартроза: тенденции последних лет
Авторы: Яременко О.Б.
Д.м.н., профессор, заведующий кафедрой внутренних болезней стоматологического факультета
Национального медицинского университета им. акад. А.А. Богомольца, главный внештатный ревматолог МЗ Украины, г. Киев
Рубрики: Ревматология, Кардиология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 15-20
В связи с общим постарением человеческой популяции в мире наблюдается тенденция к увеличению заболеваемости остеоартрозом (ОА). В настоящее время в развитых странах мира это заболевание находится на 2–3-м месте по распространенности после ишемической болезни сердца и цереброваскулярных заболеваний. В Украине, по данным за 2012 г., зарегистрировано чуть более 400 тыс. людей, страдающих этой патологией, что, безусловно, не отражает истинную распространенность ОА.
ОА — это хроническое медленнопрогрессирующее дегенеративное заболевание суставов, в основе которого лежит дегенерация суставного хряща с последующим или одновременным изменением костных суставных поверхностей и подлежащей кости, развитием краевых остеофитов, деформацией сустава. Этим процессам закономерно сопутствует субклинически выраженное воспаление, которое иногда становится клинически явным и квалифицируется как реактивный синовит. Более подвержены заболеванию женщины в возрасте 40–60 лет, после 60 лет заболевание встречается практически у всех людей.
ОА развивается при изменении структурно-функциональных свойств хряща (артриты, генетические дефекты синтеза коллагена II типа, метаболические артропатии, включая подагру, синдром гипермобильности суставов, слабость периартикулярных мышц) либо при нормальных нагрузках на сустав, либо при чрезмерных нагрузках (профессиональные и спортивные перегрузки, избыточная масса тела, дисплазии вертлужной впадины, дислокация головки бедренной кости) при неизмененных свойствах хряща, кости и связочно-мышечного аппарата.
Основными факторами риска развития ОА являются: женский пол, пожилой возраст, эндокринные и метаболические расстройства (например, снижение уровня женских половых гормонов), избыточная масса тела, слабость мышечного аппарата (в основном четырехглавой мышцы бедра), травмирование суставов, перегрузка, операции и воспалительные заболевания суставов. Наиболее неблагоприятными видами профессиональных нагрузок являются работа при согнутых коленях или стоя на коленях, длительное сидение на корточках, хождение по лестнице (особенно с грузом) и перенос тяжестей. Эти факторы сами по себе, и особенно в сочетании с переохлаждением, вызывающим спазм периартикулярных мышц и ишемизацию тканей, способствуют развитию заболевания.
Доступные методы борьбы с факторами риска включают нормализацию массы тела; укрепление периартикулярных мышц; предупреждение травм и перегрузок суставов, переохлаждения; адекватное лечение предрасполагающих заболеваний (воспалительных и эндокринных артропатий); прием витамина D в комплексе с препаратами кальция женщинами в постменопаузальном периоде, более подверженными развитию остеопороза. Остеопороз неизбежно сопровождается уменьшением механической прочности тканей, происходят микротрабекулярные внутрикостные переломы, что способствует развитию либо прогрессированию ОА.
При ОА прежде всего происходит деградация внутрисуставного хряща, состоящего на 97 % из внеклеточного матрикса и на 3 % — из хондроцитов. Прочность хряща обеспечивают коллагеновые волокна; основное вещество состоит из гиалуроновой кислоты и протеогликанов, обладающих высокой гидрофильностью. Вода составляет 70 % основного вещества хряща. В свою очередь, протеогликаны состоят из гликозаминогликанов и белка. Гликозаминогликаны представлены хондроитина сульфатом, синтезируемым из глюкозамина, и кератана сульфатом. Хондроциты синтезируют все компоненты хрящевого матрикса — коллаген I и II типа, гликозаминогликаны и гиалуроновую кислоту.
Считается, что при развитии ОА в первую очередь нарушается функция хондроцитов. Этот процесс индуцируется метаболическими агентами и биомеханическими факторами (неравномерной нагрузкой на хрящ) и обусловливает снижение синтеза матрикса в комплексе с ускорением деградации хряща. Деградация хряща происходит при участии цитокинов (ИЛ-1, ИЛ-6, TNF-α), металлопротеиназ (коллагеназы, эластазы и др.), оксида азота и других веществ. В результате хрящ теряет эластичность, истончается, происходит его растрескивание, разволокнение.
Чаще всего ОА манифестирует у людей в возрасте 40–45 лет. На ранних стадиях заболевания страдает один или несколько суставов, прогрессирование симптомов и структурных нарушений происходит медленно, внесуставные проявления не характерны.
Основной задачей при лечении ОА является замедление прогрессирования заболевания, сохранение структурно-функциональной целостности хряща и, таким образом, улучшение качества жизни и предупреждение инвалидности. Параллельно решаются задачи симптоматической терапии — уменьшения боли и воспаления и частоты обострений.
Согласно рекомендациям Европейской противоревматической лиги (EULAR) по лечению ОА коленного, тазобедренного суставов и кисти (2003, 2005, 2007 гг.), рекомендациям Американской коллегии ревматологов (ACR) (Hochberg M.C. et al., 2012) и рекомендациям Международного общества исследования остеоартрита (OARSI) по лечению ОА коленного сустава (McAlindon T.E. et al., 2014), лечение заболевания включает медикаментозные и немедикаментозные методы воздействия. К последним относят обучение пациентов и социальную поддержку, снижение массы тела, физические упражнения (на суше и в воде), укрепление мышц, ношение супинаторов при плоскостопии, поддерживающие средства, физио-терапевтические процедуры, хирургические методы (остеотомия, артропластика, артродез).
Что касается медикаментозной терапии, то в настоящее время остается актуальной классификация лекарственных препаратов для лечения ОА, рекомендованная комитетом ВОЗ (Lequesne M. et al., 1994) и поддержанная OARSI. Согласно этой классификации выделяют симптоматические препараты быстрого действия, медленнодействующие симптоматические препараты (SYSADOA) и препараты, модифицирующие течение заболевания.
Быстродействующие симптоматические препараты характеризуются быстрым началом и короткой продолжительностью лечебного эффекта. Они должны обладать способностью купировать боль и воспаление не позднее 1–4 недель после начала лечения и не оказывают положительного влияния на структурные изменения суставных тканей. К этой группе относят аналгетики (парацетамол, трамадол) и нестероидные противовоспалительные препараты (НПВП), применяемые системно или местно (в виде кремов, мазей). По существу, указанным требованиям соответствуют и внутрисуставные инъекции глюкокортикоидов (ГК).
Медленнодействующие симптоматические препараты оказывают положительный эффект на боль и нарушения функции через несколько месяцев, и этот результат сохраняется некоторое время после прекращения лечения. Лечение этими средствами сопровождается снижением потребности в аналгетиках и НПВП. В эту группу препаратов входят хондроитина сульфат, глюкозамина сульфат, неомыляемые экстракты сои и авокадо, диацереин и гиалуроновая кислота.
Модифицирующие течение ОА (структуромодифицирующие) препараты предназначены, чтобы предотвратить, замедлить, стабилизировать морфологические изменения в пораженных суставах, прежде всего со стороны хряща, или вызвать их обратное развитие. Модифицирующие структуру хряща качества должны быть доказаны прямыми методами оценки анатомии сустава типа рентгенографии, и особенно — рентгенологическим измерением ширины суставной щели, или МРТ. На момент разработки классификации ни один из известных препаратов не продемонстрировал подобных свойств. И в настоящее время международные медицинские организации не внесли в эту группу ни одного лекарственного средства. Хотя делались многочисленные попытки доказать способность медленнодействующих симптоматических препаратов замедлять прогрессирование ОА (сужение суставной щели), полученные результаты были либо противоречивы, либо неубедительны, либо методология проведения исследований была признана несовершенной. Последняя такая попытка была предпринята для относительно нового лекарственного сред-ства — стронция ранелата. В исследовании SEKOIA с соблюдением современных требований к рентгенологической оценке структуромодифицирующего действия (EMA, 2010) была продемонстрирована способность стронция ранелата замедлять по сравнению с плацебо сужение суставной щели у больных с ОА коленных суставов. Это подтвердили и результаты анализа количественной МРТ (Pelletier J-P. et al., 2013). Однако в феврале 2014 г. EMA приняло решение ограничить использование этого препарата из-за вероятного повышения сердечно-сосудистого риска (21 February 2014. EMA/84749/2014).
В целом в последнее время, по мере повышения требований к качеству проведения клинических исследований, наметилась тенденция к более критичному отношению к эффективности ряда медленнодействующих симптоматических препаратов (хондропротекторов). По мнению европейских экспертов (Pendleton A. et al., 2000), SYSADOA находятся на 11-й позиции в рейтинге полезности различных лечебных мероприятий при ОА коленных суставов, пропуская вперед физические упражнения, НПВП, внутрисуставные инъекции ГК, использование трости и другие воздействия. По результатам исследования GAIT (Sawitzke A.D. et al., 2008) и сетевого метаанализа исследований, посвященных оценке эффективности глюкозамина сульфата и хондроитина сульфата при ОА коленного и тазобедренного суставов (Wandel S. et al., 2010), каждый из этих препаратов ни в отдельности, ни в сочетании не обладает клинически значимым влиянием на суставную боль и скорость сужения суставной щели (потерю хряща). Авторы сделали заключение, что специалистам в области здравоохранения и страховым компаниям не следует покрывать расходы на эти препараты; пациентам, еще не получающим лечение, не следует назначать указанные препараты. Эти выводы нашли отражение в рекомендациях ACR по лечению ОА кисти, тазобедренного и коленного суставов (Hochberg M.C. et al., 2012): «ACR не рекомендует пациентам с ОА использовать хондроитина сульфат и глюкозамин». Довольно красноречива также формулировка, содержащаяся в рекомендациях OARSI 2014 г. по нехирургическому лечению ОА коленных суставов (McAlindon T.E. et al., 2014): «Лечение неопределенной целесообразности для конкретных клинических субфенотипов включает иглоукалывание, неомыляемые экстракты авокадо/сои, хондроитин, костыли, диацереин, глюкозамин, внутрисуставное введение гиалуроновой кислоты, опиоиды (пероральные и трансдермальные), шиповник, чрескожную электрическую стимуляцию нервов и ультразвук». Тем не менее в условиях а) отсутствия препаратов для лечения ОА с общепризнанной, доказанной способностью замедлять прогрессирование заболевания («базисных») и б) высокого риска развития осложнений при приеме НПВП лицами пожилого возраста даже «неопределенная целесообразность» позволяет считать оправданным применение SYSADOA хотя бы с целью достижения пролонгированного симптоматического эффекта, пусть даже у части больных. При этом важное значение имеет хороший профиль безопасности большинства медленнодействующих симптоматических препаратов, за исключением диацереина (в 40 % случаев — диарея).
Симптоматические препараты быстрого действия
Эффективность НПВП в симптоматическом лечении ОА показана во многих исследованиях, но положительного их влияния на течение заболевания не выявлено. Быстродействующие симптоматические препараты при системном применении довольно часто вызывают серьезные побочные эффекты. Для НПВП характерно развитие в основном желудочно-кишечных (со стороны слизистой желудочно-кишечного тракта и печени) и сердечно-сосудистых осложнений (артериальные тромбозы, артериальная гипертензия). НПВП и парацетамол могут ухудшать процессы метаболизма хряща за счет ингибирования синтеза гликозаминогликанов, однако степень выраженности этого эффекта различная для разных препаратов. Наиболее выражен этот эффект у индометацина, меньше — у парацетамола, напроксена, ибупрофена. В целом НПВП должны применяться прерывистыми курсами по несколько недель и с учетом наличия сопутствующих заболеваний (Burmester G. et al., 2011; приказ МЗ Украины № 263 от 11.04.2014).
Внутрисуставное введение микрокристаллических суспензий ГК (дипроспан, кеналог, депо-медрол) является надежным методом купирования реактивного синовита, оказывает обезболивающий эффект и на некоторое время улучшает функцию сустава. На заседаниях Совета экспертов-ревматологов и ортопедов-травматологов Украины в 2008 и 2014 гг., базируясь на последних рекомендациях EULAR, OARSI, ACR, была подтверждена целесообразность внутрисуставного введения ГК, но лишь по строгим показаниям и согласно установленной схеме: ГК назначаются при наличии воспаления, частота введения препарата — не более 1 раза в 3 мес. В таком случае купируется воспалительный процесс, способствующий дальнейшей дегенерации хряща при ОА, при минимальном риске повреждения хряща.
Медленнодействующие симптоматические препараты
Из препаратов этой группы наиболее близким к быстродействующим симптоматическим средствам по направленности влияния на звенья патогенеза ОА является диацереин — ингибитор синтеза и активности провоспалительного цитокина ИЛ-1. Соответственно основной результат применения диацереина заключается в блокаде биологических эффектов ИЛ-1 — уменьшении воспаления, боли и, возможно, замедлении процесса разрушения хряща. В клинических условиях симптоматический эффект в виде уменьшения боли в суставах начинает проявляться не ранее чем через 1 месяц лечения и сохраняется несколько месяцев после прекращения лечения. Препараты, содержащие компоненты протеогликанов хряща — хондроитина сульфат и глюкозамина сульфат, характеризуются широким спектром действия, включая и антиинтерлейкиновые эффекты. Ослабление симптомов ОА также отсрочено во времени и сохраняется довольно продолжительное время после отмены этих препаратов. Гиалуроновая кислота представляет собой линейный гликозаминогликан, состоящий из повторяющихся дисахаридов глюкуроновой кислоты и N-ацетилглюкозамина. Препараты гиалуроновой кислоты предназначены для внутрисуставного введения. Лечебное действие инъекций гиалуроновой кислоты связывают с повышением вязкости синовиальной жидкости, возможной стимуляцией синтеза гиалуроновой кислоты хондроцитами, противовоспалительным эффектом, предупреждением дезинтеграции матрикса и активизацией репаративных процессов. В последние годы наметилось более осторожное отношение к применению этих препаратов. Степень улучшения после курса инъекций сопоставима с результатом внутрисуставного введения ГК. Необходимо также иметь в виду, что лечебный эффект в значительной степени зависит от точности попадания препарата в полость сустава. Между тем известно, что при внутрисуставных инъекциях ГК более чем в 30 % случаев лекарственное средство оказывается введенным в периартикулярные ткани. В связи с этим прибегать к инъекциям гиалуроновой кислоты целесообразно лишь у больных, у которых отсутствует эффект от других препаратов или же их применение невозможно из-за побочных эффектов, и предпочтительнее — под ультразвуковым контролем.
Недавно на фармацевтическом рынке Украины появился еще один представитель этой группы препаратов — Пиаскледин 300. Он представляет собой комплекс неомыляемых фитостеролов и насыщенных жирных кислот, полученный методом молекулярной дистилляции из экстрактов авокадо и сои. Препарат выпускается Laboratories Expanscience (Франция) и не имеет аналогов. Одним из основных механизмов действия Пиаскледина 300 является его влияние на экспрессию цитокинов (Henrotin Y.E. et al., 1998).
Пиаскледин 300 ингибирует ИЛ-1, -6, -8, предотвращая их повреждающее действие на хондроциты и синовиоциты, стимулирует синтез коллагена и протеогликанов. Помимо влияния на синтез и высвобождение провоспалительных цитокинов, простагландинов и активных форм кислорода, что свойственно также некоторым другим препаратам группы SYSADOA, Пиаскледин 300 имеет характерные фармакологические особенности. В частности, он повышает экспрессию трансформирующего фактора роста β1, трансформирующего фактора роста β2, а также ингибитора плазминогена-1 (PAI-1) (Altinen L. et al., 2007; Boumediene K. et al., 1999), которые активно влияют на синтез макромолекул межклеточного вещества суставного хряща — протеогликанов и коллагена II типа и обладают анаболическим эффектом. Что касается PAI-1, то он снижает продукцию плазминогена, который опосредованно принимает участие в повреждении хряща путем стимуляции металлопротеаз.
Эффективность Пиаскледина 300 в лечении ОА была доказана результатами многочисленных контролируемых исследований (Maheu E. et al., 1998; Blotman F. et al., 1997; Appelboom T. et al., 2001; Shostak N.A., Pravdyuk N.G., 2008; Lequesne M. et al., 2002; Maheu E. et al., 2009).
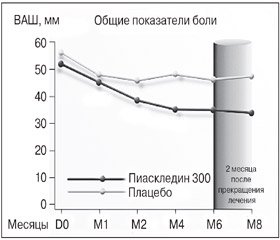
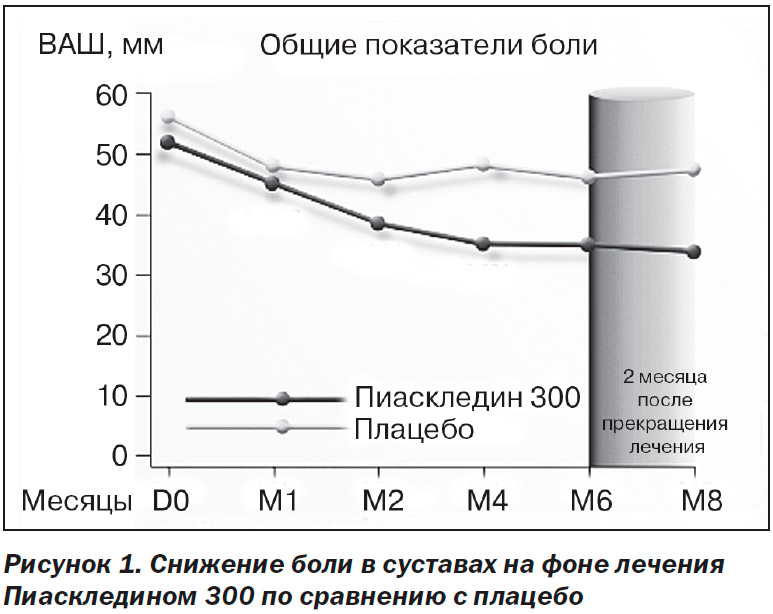
В рандомизированном двойном слепом плацебо-контролируемом мультицентровом исследовании, включавшем 164 больных с ОА коленных и тазобедренных суставов, назначалась стандартная доза препара-та — 1 капсула (300 мг) в сутки (Maheu E. et al., 1998). Длительность терапии составляла 6 месяцев, затем больных наблюдали еще в течение 2 месяцев. На фоне проводимой терапии отмечалось достоверное снижение интенсивности боли в суставах более чем на 50 % от исходного уровня (рис. 1) и функционального индекса Лекена (в 1,58 и 1,42 раза через 6 мес. и через 2 мес. после прекращения приема Пиаскледина 300 соответственно), а также достоверное улучшение глобальной оценки пациентами своего состояния. 57 % больных основной группы смогли отказаться от приема НПВП в связи со значительным уменьшением интенсивности болей в суставах или их полным прекращением. Достигнутая положительная динамика основных клинических показателей заболевания сохранялась в течение 2-месячного периода наблюдения после отмены препарата, что подтверждает наличие у Пиаскледина 300 последействия и/или кумулятивных свойств.
Аналогичный симптом-модифицирующий эффект был получен и в двойном слепом плацебо-контролируемом исследовании по оценке эффективности и безопасности приема Пиаскледина 300, включавшем 164 пациента с ОА коленных и тазобедренных суставов (Blotman F. et al., 1997). В течение 3 месяцев больные с умеренными или сильными болями получали Пиаскледин 300 мг/сутки или плацебо. Основным критерием оценки эффективности препарата являлась потребность в НПВП: в интервале между 60-м и 90-м днями терапии она была достоверно меньше в группе Пиаскледина 300 (43,4 vs 69,7 % в группе плацебо; р < 0,001). Кроме этого, кумулятивная доза НПВП, используемая пациентами в интервале между 45-м и 90-м днями лечения, была также достоверно ниже в группе Пиаскледина 300 (р < 0,01).
Аppelbооm T. и соавт. (2001) изучали сравнительную эффективность и переносимость различных доз Пиаскледина 300 у 260 больных с гонартрозом. Длительность терапии составляла 3 месяца. Эффективность Пиаскледина 300 оказалась примерно одинаковой при приеме 300 и 600 мг/сутки и достоверно выше по сравнению с плацебо. На фоне приема Пиаскледина 300 удалось сократить в 2 раза и более суточное потребление НПВП у 71 % больных, причем этот показатель оказался одинаковым у больных, принимавших как 300, так и 600 мг/сутки. Переносимость двух доз Пиаскледина 300 была хорошей и схожей с переносимостью плацебо. Эти данные не только демонстрируют отчетливый симптом-модифицирующий эффект Пиаскледина 300, но и обосновывают целесообразность применения его в низких дозах (300 мг/сутки).
По данным многочисленных исследований, нежелательные явления при приеме Пиаскледина 300 немногочисленны и включают диспептические нарушения и боли в верхней половине живота, которые развиваются в основном в первые 1–1,5 месяца его приема. Частота побочных эффектов не превышала таковую при приеме плацебо. В редких случаях отмечалась общая слабость, головная боль, кожная сыпь. Однако эти побочные реакции могли быть связаны не только с приемом Пиаскледина 300, но и с использованием НПВП или аналгетиков, которые назначали больным в начале лечения, параллельно с Пиаскледином 300.
Шостак Н.Г. и соавт. провели открытое рандомизированное исследование эффективности и безопасности Пиаскледина 300 в комбинации с НПВП в сравнении с только НПВП в 2 параллельных группах пациентов с болью в нижней части спины, ассоциированной со спондилоартрозом (Shostak N.A., Pravdyuk N.G., 2008). На фоне комбинированной терапии с использованием Пиаскледина 300 наблюдалось уменьшение выраженности болевого синдрома, особенно по мере увеличения длительности приема препарата. Применение Пиаскледина 300 при спондилоартрозе показало его клиническую эффективность у 89,2 % больных: значительно снизились показатели болевого синдрома в спине, улучшилось функциональное состояние позвоночника, что сочеталось с хорошей переносимостью препарата.
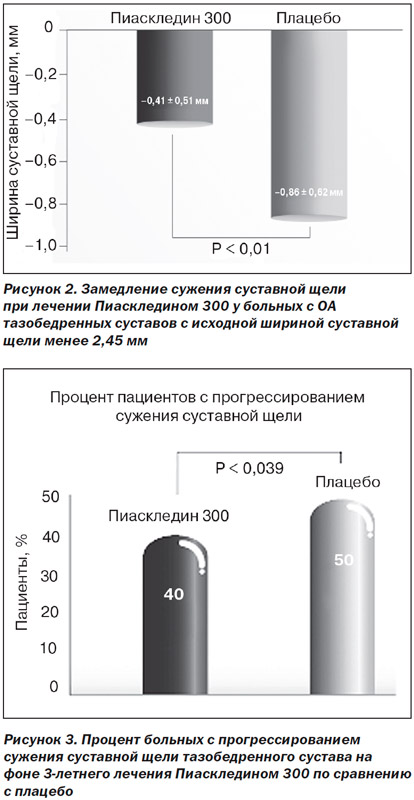
Структуромодифицирующий эффект Пиаскледина 300 продемонстрировали результаты мультицентрового рандомизированного двойного слепого плацебо-контролируемого исследования (Lequesne M. et al., 2002). В исследование были включены 163 больных с одно- или двусторонним коксартрозом I–III cтадии по Kellgren-Lawrence. У всех больных была постоянная боль в тазобедренных суставах на протяжении минимум 6 месяцев и альгофункциональный индекс Лекена 1–4. Основным критерием включения являлось сужение щели тазобедренных суставов по данным рентгенографии. Все больные были разделены на две группы. Больные первой группы, которая включала 85 пациентов, принимали 300 мг/сутки Пиаскледина 300 на протяжении 2 лет, а остальные 78 пациентов составили контрольную группу и принимали плацебо. Больные как основной, так и контрольной групп могли использовать НПВП по собственному усмотрению при наличии болей в суставах. Исследуемые группы были сопоставимы по возрасту, полу, весу, росту, стадии и длительности ОА, индексу Лекена, выраженности спонтанной боли. В обеих группах в целом не было выявлено существенного различия в динамике сужения суставной щели — наиболее важного показателя структуромодифицирующей активности изучаемого препарата. Однако у больных с исходной шириной суставной щели менее 2,45 мм на фоне лечения Пиаскледином 300 наблюдалось в 2 раза более медленное дальнейшее ее сужение по сравнению с группой контроля (рис. 2).
В 2009 г. Maheu Е. и соавт. представили результаты исследования структуромодифицирующего действия Пиаскледина 300 у 345 больных коксартрозом (исследование ERADIAS). Пациенты были стратифицированы по тяжести коксартроза (ширина суставной щели < 2,5 мм или > 2,5 мм) и рандомизированы в 2 группы, одна из которых получала 300 мг Пиаскледина 300 (166 больных), а другая — плацебо (179 больных) в течение 3 лет. И хотя различие в сужении суставной щели за 3 года между группами Пиаскледина 300 и плацебо оказалось статистически недостоверным (–0,64 и –0,67 мм соответственно; р = 0,72), больных с прогрессированием ОА в группе Пиаскледина 300 было на 20 % меньше, чем в группе плацебо (р = 0,039), что свидетельствует о наличии у препарата структуромодифицирующих свойств, проявляющихся по крайней мере у части больных (рис. 3).
Метаанализ данных 4 рандомизированных исследований, в которых принял участие 421 больной, продемонстрировал высокий уровень безопасности Пиаскледина 300 (Christenen R. et al., 2008). Частота нежелательных явлений колебалась от 9 до 15 %. Только 13 из 421 пациента (3 %) прекратили лечение в связи с нежелательными явлениями, которые, вероятнее всего, были связаны с сопутствующим приемом НПВП.
Пиаскледин 300 представлен в 53 странах мира, более 20 лет не имеет аналогов и в данное время во Франции является наиболее часто назначаемым препаратом из группы SYSADOA.
Пиаскледин 300 — оригинальный европейский препарат с уникальным составом — комплекс неомыляемых фитостеролов и насыщенных жирных кислот, воздействует на механизмы, лежащие в основе нарушений метаболизма хряща при ОА. Он способствует уменьшению боли в пораженных суставах и позвоночнике как в покое, так и при движении, снижению индекса тяжести гонартроза и коксартроза, а также уменьшению потребности в НПВП и сохранению функциональной активности пораженных суставов. Пиаскледин 300 способен у части больных замедлять прогрессирование ОА, что существенно повышает качество жизни пациентов. Эти данные неоднократно подтверждены в международных плацебо-конт-ролируемых исследованиях. Уникальный механизм действия Пиаскледина 300, его клиническая эффективность, удобство применения (1 капсула в сутки до или во время еды) и хорошая переносимость позволяют рекомендовать этот препарат для лечения ОА как эффективное средство, обладающее симптом-модифицирующими и у части больных — структуромодифицирующими свойствами. Для получения максимального эффекта препарат применяется в течение 3–6 месяцев.
Таким образом, медикаментозное лечение ОА не должно ограничиваться назначением НПВП и аналгетиков. Высокая частота серьезных побочных эффектов этих препаратов, потребность в постоянном приеме, возможное повреждающее действие на хрящ и отсутствие положительного влияния на течение заболевания делают нецелесообразным их длительное, бесконтрольное применение. Разумной альтернативой и дополнением к лечению НПВП являются медленнодействующие симптоматические препараты, в том числе неомыляемые соединения авокадо и сои. Эти лекарственные средства практически не имеют побочных действий, оказывают симптоматический эффект, могут применяться курсами продолжительностью в несколько месяцев с такими же перерывами, не повреждают суставной хрящ, а у части больных могут замедлять прогрессирование заболевания. Внутрисуставные инъекции ГК и гиалуроновой кислоты следует рассматривать как терапию резерва.
Список литературы
1. Lequesne M. et al. Guidelines for testing slow acting drugs in osteoarthritis // J. Rheumatol. — 1994. — 21 (suppl. 21). — 65-73.
2. EULAR Recommendations 2003 for management of knee osteoarthritis // Ann. Rheum. Dis. — 2003. — 62, 12. — 1145-1155.
3. EULAR evidence based recommendations for the management of hip osteoarthritis // Ann. Rheum. Dis. — 2005. — 64. — 669-681.
4. EULAR evidence based recommendations for the management of hand osteoarthritis // Ann. Rheum. Dis. — 2007. — 66. — 377-388.
5. Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee // Arthritis Care Res. — 2012. — 64 (4). — 455-474.
6. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis and Cartilage. — 2014. — 22 (3). — 363-388.
7. Burmester G. et al. The appropriate use of non-steroidal anti-inflammatory drugs in rheumatic disease: opinions of a multidisciplinary Europian expert panel // Ann. Rheum. Dis. — 2011. — 70 (5). — 818-822.
8. Наказ МОЗ України № 263 від 11.04.2014 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ревматоїдному артриті». http://www.moz.gov.ua, http://www.dec.gov.ua/mtd/index.html.
9. Guideline on clinical investigation of medicinal products used in the treatment of osteoarthritis // EMA. — 2010.
10. Pelletier J.-P., Raynauld J.-P. et al. Disease-modifying effect of strontium ranelate in a subset of patients from the Phase III knee osteoarthritis study SEKOIA using quantitative MRI: reduction in bone marrow lesions protects against cartilage loss // Ann. Rheum. Dis. — doi: 10.1136/annrheumdis-2013-203989.
11. Pendleton A., Arden N., Dougados M. et al. EULAR recommendations for the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann. Rheum. Dis. — 2000. — 59. — 936-944.
12. Sawitzke A.D., Shi H., Finco M.F. et al. The effect of glucosamine and/or chondroitin sulfate on the progression of knee osteoarthritis: a report from the glucosamine/chondroitin arthritis intervention trial // Arthritis Rheum. — 2008. — 58 (10). — 3183-3191.
13. Wandel S., Juni P., Tendal B. et al. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis // Brit. Med. J. — 2010. — 341. — 4675-4682.
14. Henrotin Y.E., Labasse A.H., Jaspar J.M. et al. Effects of three avocado/soybean unsopanifiable miхtures on metalloproteinases, cytokines and prostaglandin E2 production by human articular chondrocytes // Clinical Rheum. — 1998. — 17. — 31-39.
15. Altinen L., Saritas Z.K., Kose K.C. et al. Treatment with unsaponifiable extracts of avocado and soybean increases TGF-beta1 and TGF-beta2 levels in canine joint fluid // Tohocu J. Exp. Med. — 2007. — 211. — 181-186.
16. Boumediene K. et al. // Arthritis Rheum. — 1999. — 42. — 148-156.
17. Maheu E., Mazieres B., Valat J.-P. et al. Symptomatic efficacy of avocado/soybean unsaponifiables in the treatment of osteoarthritis of the knee and hip // Arthritis Rheum. — 1998. — 41. — 81-91.
18. Blotman F., Maheu E., Wulwic A. et al. Efficacy and safety of avocado/soybean unsaponifiables in the treatment osteoarthritis of the knee and hip // Rev. Rhum. (Engl. ed.). — 1997. — 64. — 825-834.
19. Appelboom T., Schuermans J., Verbruggen G. et al. Symptoms modifying effect of avocado/soybeanunsaponifiables (ASU) in knee osteoarthritis. A double blind, prospective, placebo-controlled study // Scand. J. Rheumatol. — 2001. — 30 (4). — 242-247.
20. Shostak N.A., Pravdyuk N.G. Degenerative spine: presentation of a disease, therapy approach (own data) // Modern rheumatology. — 2008. — № 3. — 30-35.
21. Lequesne M., Maheu E., Cadet C. et al. Structural effect of avocado/soybean unsopanifiables on joint space loss in osteoarthritis of hip // Arthritis Care Research. — 2002. — 47. — 50-58.
22. Maheu E. et al. 73rd Meeting of the ACR, Pennsylvania, PA; 2009 Oct. Abstract 847.
23. Christenen R., Barteles E.M., Astrup A. et al. Symptomatic efficacy of avocado/soybean unsaponifiables (ASU) in Osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials // Osteoarthritis Cartilage. — 2008. — 16 (2). — 339-408.