Газета «Новости медицины и фармации» Гастроэнтерология (553) 2015 (тематический номер)
Вернуться к номеру
Современные подходы к лечению болевого синдрома билиарного и панкреатического генеза
Авторы: Ткач С.М.
Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 11-17
Абдоминальная боль является одним из наиболее частых гастроэнтерологических синдромов и может встречаться при самой разнообразной патологии желудочно-кишечного тракта (ЖКТ). В зависимости от причины абдоминальный болевой синдром имеет свои характерные клинические особенности, механизмы развития, а также свою фармакологию.
Основные причины болевого синдрома билиарного и панкреатического генеза
К возникновению болевого синдрома могут приводить как органические, так и функциональные заболевания практически всех отделов ЖКТ. Одной из наиболее частых причин абдоминального болевого синдрома является билиарная и панкреатическая патология, в частности желчнокаменная болезнь (ЖКБ), функциональные билиарные расстройства (ФБР) и хронические панкреатиты (ХП).
Желчнокаменная болезнь — одно из самых распространенных заболеваний внутренних органов (находится на третьем месте после кардиоваскулярной патологии и сахарного диабета). ЖКБ страдают каждая 5-я женщина и каждый 10-й мужчина в возрасте старше 40 лет. Частота образования камней увеличивается с возрастом. Так, в возрасте до 50 лет заболеваемость ЖКБ составляет 7–11 %, 50–69 лет — 11–23 %, > 70 лет — 33–50 % [1].
Хотя у части больных (примерно у 30 %), особенно с единичным камнем, расположенным в области тела и дна желчного пузыря (ЖП), болезнь длительное время (и даже всю жизнь) может протекать без симптомов, все же у большинства пациентов ЖКБ проявляется клинически. Наиболее типичный, классический симптом ЖКБ — это приступ желчной колики (интенсивная боль в правом подреберье или эпигастрии продолжительностью от 15 минут до 5 часов, требующая приема спазмолитиков и/или обезболивающих), связанный с продвижением камня, спазмом или обтурацией желчных путей. У многих больных ЖКБ болевой синдром не носит характера желчной колики, а проявляется тупыми, ноющими болями или чувством тяжести в правом подреберье, усиливающимися или появляющимися только в периоды обострений (как правило, после диетических погрешностей), а также признаками билиарной диспепсии [3].
Генез билиарной боли при ЖКБ достаточно понятен и складывается из таких механизмов, как воспаление и отек, механическая травматизация стенок ЖП конкрементом, протоковая и внутриполостная гипертензия, вторичные нарушения моторики (гипокинезия с растяжением стенки ЖП или рефлекторные сокращения ЖП при раздражении конкрементом) [3].
Функциональные билиарные расстройства — это комплекс клинических симптомов, которые развиваются в результате моторно-тонической дисфункции желчного пузыря и/или сфинктерного аппарата желчевыводящих путей (ЖВП) [5, 7, 10]. В основе их развития лежат нарушения синхронности работы — несогласованные чрезмерные (гиперфункция) или недостаточные (гипофункция) сокращения. Полагают, что психоэмоциональные нагрузки и социальная дезадаптация могут играть немаловажную роль в развитии ФБР, а в сочетании с генетической предрасположенностью — определять формирование моторных нарушений и висцеральной гиперчувствительности [4]. В индустриально развитых странах ФБР отмечаются примерно у 5 % взрослого населения (хотя у лиц старше 60 лет наблюдаются с частотой примерно 25 %). ФБР значительно чаще встречаются у женщин, чем у мужчин (соответственно 20 и 8 %). Постхолецистэктомический синдром в 30–40 % случаев обусловлен дисфункцией сфинктера Одди (ДСО) [7].
Периодические нарушения тонуса и моторики ЖП и ЖВП отмечают у большинства пациентов с патологией билиарного тракта. Функциональными оказываются примерно 70 % из них. В других случаях дисфункция развивается при наличии органической патологии печени, ЖП, ЖВП, ЖКТ. В связи с этим выделяют первичные и вторичные функциональные расстройства билиарной системы [5].
Первичные дисфункции отмечают в среднем в 10–15 % случаев, преимущественно у женщин молодого возраста (18–35 лет), астенической конституции, с эмоционально лабильной психикой. Их развитие связывают с нарушениями нервно-гуморальной регуляции моторики ЖВП на фоне психоневротических, конституциональных, эндокринных воздействий. При этом признаки сопутствующей органической патологии (воспаления, камнеобразования) отсутствуют.
Вторичные дисфункции диагностируют значительно чаще — при сопутствующей органической патологии, некоторых гормональных сдвигах и эндокринных заболеваниях (например, предменструальном и климактерическом синдромах, беременности, сахарном диабете, патологии щитовидной железы), системных заболеваниях, психоэмоциональных нарушениях.
Согласно Римским критериям III выделяют два основных типа ФБР — дисфункцию (дискинезию) желчного пузыря (ДЖП) и дисфункцию сфинктера Одди [14].
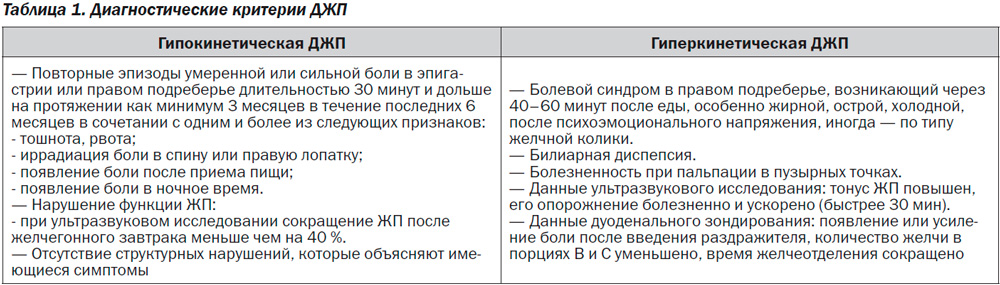
ДЖП — это нарушение сократительной функции ЖП, которое проявляется болью билиарного типа вследствие первичных метаболических (перенасыщение желчи холестерином) или двигательных нарушений при отсутствии, по крайней мере изначально, изменений состава желчи. ДЖП подразделяется на два типа — гиперкинетическую (гипермоторную) и гипокинетическую (гипомоторную) (табл. 1) [10, 16, 20].
В международном консенсусе по ФБР отмечено, что дисфункции ЖП протекают преимущественно по гипокинетическому типу с нарушением сократимости или опорожнения пузыря. Первичные нарушения сократимости могут иметь врожденный, генетически детерминированный характер и быть связаны с нарушением чувствительности гладких мышц ЖП к различным стимулирующим импульсам, среди которых ведущую роль играют холецистокинин, мотилин и вагусные парасимпатические влияния [10]. Вторичные нарушения сократимости и опорожнения ЖП развиваются на фоне различных системных заболеваний. Механизмы этих дисфункций различны. Например, при целиакии гипокинезия ЖП обусловлена резким снижением синтеза холецистокинина в слизистой оболочке двенадцатиперстной кишки при ее атрофии. Простагландины и соматостатин оказывают прямое релаксирующее действие на стенку ЖП. При циррозе печени нарушается печеночная инактивация гормонов и пептидов, обладающих релаксирующим влиянием на ЖП, в частности эстрогенов. Высокая концентрация эстрогенов в крови вызывает стойкую гипотонию пузыря (аналогичный механизм имеет гипотония ЖП при беременности и приеме гормональных контрацептивов).
В клинической практике часто встречается вторичная гипотония ЖП, обусловленная нарушением оттока желчи и высоким сопротивлением в протоках при функциональном (спазм) или органическом (стриктура, папиллит) поражении слизистой оболочки. В этих случаях сократительная способность стенки пузыря не страдает, нарушается лишь отток желчи. Вторичные дисфункции часто развиваются при ЖКБ даже на ее ранних стадиях, при отсутствии клинических симптомов (до 80 %) и, тем более, в условиях воспаления [3, 5].
Гиперкинетические нарушения ЖП встречаются реже, чем гипокинезии, имеют кратковременный эпизодический характер, возникают, как правило, в острой стрессовой ситуации и часто купируются самопроизвольно.
ДСО — функциональное билиарное расстройство, обусловленное нарушением сократительной функции cфинктера Одди, которое мешает нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии органической патологии. Обычно ее связывают с несколькими клиническими синдромами: 1) билиарная боль после холецистэктомии; 2) билиарная боль при интактном ЖП; 3) идиопатический острый рецидивирующий панкреатит; 4) хронический панкреатит. В зависимости от нарушений оттока и характера болевого синдрома выделяют билиарный тип ДСО (трех типов) и панкреатический тип ДСО [8, 10, 14, 24].
Диагностические критерии ДСО
Билиарная дисфункция сфинктера Одди 1-го типа (вероятность 65–95 %)
Приступ боли билиарного типа в сочетании с 3 следующими признаками:
— повышение аспартатаминотрансферазы (АСТ) и/или щелочной фосфатазы (ЩФ) в 2 раза и больше при двухразовых исследованиях;
— задержка оттока желчи больше 45 минут;
— расширение общего желчного протока больше 12 мм.
— повышение аспартатаминотрансферазы (АСТ) и/или щелочной фосфатазы (ЩФ) в 2 раза и больше при двухразовых исследованиях;
— задержка оттока желчи больше 45 минут;
— расширение общего желчного протока больше 12 мм.
Билиарная дисфункция сфинктера Одди 2-го типа (вероятность 50–63 %)
Приступ боли билиарного типа в сочетании с 1 или 2 следующими признаками:
— повышение АСТ и/или ЩФ в 2 раза и больше при двухразовых исследованиях;
— задержка оттока желчи больше 45 минут;
— расширение общего желчного протока больше 12 мм.
— повышение АСТ и/или ЩФ в 2 раза и больше при двухразовых исследованиях;
— задержка оттока желчи больше 45 минут;
— расширение общего желчного протока больше 12 мм.
Билиарная дисфункция сфинктера Одди 3-го типа (вероятность 12–28 %)
Только приступ боли билиарного типа.
Панкреатический тип ДСО
— Классическая картина острого панкреатита, сопровождающаяся повышением липазы и амилазы сыворотки крови.
— При минимальных проявлениях боли носят такой же характер, но не повышается уровень панкреатических ферментов, у многих пациентов данные проявления могут трактоваться как синдром функциональной абдоминальной боли.
— Классическая картина острого панкреатита, сопровождающаяся повышением липазы и амилазы сыворотки крови.
— При минимальных проявлениях боли носят такой же характер, но не повышается уровень панкреатических ферментов, у многих пациентов данные проявления могут трактоваться как синдром функциональной абдоминальной боли.
Наиболее ярким клиническим проявлением ФБР является функциональная билиарная боль. Ее диагностические критерии согласно Римским критериям III представлены ниже [14].
Диагностические критерии функциональной билиарной боли
Эпизодическая (достаточно интенсивная) рецидивирующая боль в эпигастрии и правом верхнем квадранте живота, которая сочетается со следующими признаками:
— длительность не меньше 30 минут;
— не меньше одного приступа на протяжении последних 6 мес.;
— боль носит постоянный характер, не уменьшается после дефекации, изменения положения тела или приема антацидов, прерывает трудоспособность и/или требует скоропомощной консультации врача;
— отсутствие структурных изменений, которые позволяют объяснить имеющиеся симптомы;
— как правило, наличие замедленного опорожнения ЖП.
— длительность не меньше 30 минут;
— не меньше одного приступа на протяжении последних 6 мес.;
— боль носит постоянный характер, не уменьшается после дефекации, изменения положения тела или приема антацидов, прерывает трудоспособность и/или требует скоропомощной консультации врача;
— отсутствие структурных изменений, которые позволяют объяснить имеющиеся симптомы;
— как правило, наличие замедленного опорожнения ЖП.
Основными причинами возникновения абдоминальной боли при билиарной патологии является спазм гладкой мускулатуры, перерастяжение стенки желчного пузыря и желчных протоков в результате развития билиарной гипертензии, механическое раздражение стенки желчного пузыря и протоковой системы билиарным сладжем или конкрементом. В связи с этим различается и характер боли. Она может возникать внезапно или усиливаться постепенно, продолжаться в течение минут или часов, сохраняться длительно или рецидивировать с различной периодичностью, быть локализованной или распространенной [3, 20].
Важнейшее место в патогенезе приступов билиарной боли занимает спазм гладкомышечной мускулатуры. Состояние сократительного аппарата гладкомышечных клеток находится в прямой зависимости от ионного состава, в котором главенствующую роль играют ионы кальция (Са2+). Повышение их концентрации в цитоплазме миоцитов сопровождается сокращением, а снижение — релаксацией мышечного волокна. Транспорт ионов Са2+ через клеточные мембраны осуществляется посредством специальных кальциевых, или медленных, каналов, которые представлены встроенными в мембрану клетки макромолекулярными белками, содержащими рецепторы, распознающие ионы Са2+. В регуляции транспорта ионов Са2+ участвует ряд нейрогенных медиаторов — ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Так, связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку, что сопровождается деполяризацией мембраны и открытием потенциалзависимых кальциевых каналов, через которые ионы Са2+ поступают в клетку. Взаимодействуя с цитоплазматическим кальций-связывающим белком кальмодулином, они активируют киназу легких цепей двигательного белка миозина. Последняя отщепляет фосфорный остаток от молекулы аденозинтрифосфорной кислоты, связанной с волокнами миозина. Благодаря этому миозин приобретает способность к взаимодействию с другим двигательным белком — актином. В результате между актином и миозином устанавливаются «молекулярные мостики», благодаря которым они «сдвигаются» по отношению друг к другу, что приводит к укорочению клетки [4, 7, 16].
Одним из условий, необходимых для сокращения мышечного волокна, является высокая активность фермента фосфодиэстеразы, которая участвует в расщеп–лении циклического аденозинмонофосфата (цАМФ) и циклического гуанозинмонофосфата (цГМФ), молекулы которых снижают содержание ионов Са2+ в цитоплазме и тем самым способствуют снижению сократительной активности клетки [1, 4, 5]. Основной механизм снижения тонуса и сократительной активности гладких мышц зависит от импульсов со стороны симпатической нервной системы и стимуляции норадреналином α1-адренегических рецепторов наружной мембраны миоцитов, что приводит к открытию быстрых ионных каналов, утечке положительно заряженных ионов из клетки и ее гиперполяризации. В условиях нарастания мембранного потенциала медленные кальциевые каналы прекращают функционировать, концентрация цитозольного Са2+ резко снижается и наступает релаксация мышечного волокна [7, 8, 16]. В связи с этим в лечении болевого синдрома, обусловленного спазмом гладкомышечной мускулатуры, применяются как неселективные спазмолитики, блокирующие фосфоди–эстеразу цАМФ и цГМФ, так и селективные блокаторы кальциевых или натриевых каналов.
Кроме того, важную роль в генезе функциональной билиарной боли играет формирование билиарного сладжа и последующее появление в желчи микролитов [16]. Как известно, основные этапы холестеринового литогенеза включают в себя: 1) перенасыщение желчи холестерином; 2) нуклеацию и преципитацию кристаллов холестерина; 3) агрегацию кристаллов и формирование микролитов.
С теоретической и практической точки зрения наиболее приемлемой является диагностика предкаменной стадии ЖКБ на III этапе — агрегации кристаллов моногидрата холестерина с последующим формированием микролитов. С теоретической точки зрения эта предкаменная стадия является наиболее продвинутой, и, по результатам наших исследований, биохимические свойства на этой стадии мало отличаются от стадии сформировавшегося холецистолитиаза [1].
Изменение микроструктуры желчи в виде сформировавшихся микролитов делает их макроскопически видимыми, что легко выявляется с помощью транс–абдоминальной ультрасонографии и трактуется как различные варианты билиарного сладжа, при наличии которого с целью предупреждения образования более крупных желчных камней следует проводить профилактику препаратами урсодезоксихолевой кислоты (УДКХ).
Билиарный сладж, содержащий микролиты, может свободно проходить по всей протоковой системе, постоянно раздражая богатую болевыми рецепторами слизистую оболочку желчных путей (особенно сфинктерного аппарата), и обусловливать возникновение болевого синдрома. По последним данным, причиной «необъяснимых» болей в правом подреберье у 83 % больных может быть билиарный сладж [1, 5]. Причиной болей при билиарном сладже являются и дисфункции сфинктерного аппарата желчных путей, которые в данной ситуации носят вторичный характер. Так, например, дисфункция сфинктера Одди при билиарном сладже выявляется в 50–93 % случаев. Кроме того, длительная персистенция билиарного сладжа и постоянный пассаж его в двенадцатиперстную кишку может осложняться развитием стриктур терминального отдела общего желчного протока и/или стенозирующего папиллита. Билиарный сладж — частая причина билиарного панкреатита. Исследованиями установлено, что частота выявления билиарного сладжа у больных с идиопатическим панкреатитом достаточно высока и, по данным разных авторов, достигает 33–90 % [4, 5, 10, 16]. Основные причины развития панкреатита при билиарном сладже обусловлены дисфункцией сфинктера Одди, создающей условия для билиарных рефлюксов в протоковую систему поджелудочной железы, стенозом сфинктера Одди и/или панкреатического протока.
Более редкие осложнения билиарного сладжа — развитие острого холецистита, холангита. В отдельных случаях при наличии замазкообразной желчи возможно отключение желчного пузыря вследствие закупорки пузырного протока.
Как и у больных с функциональной патологией кишечника, важное значение в развитии болевого синдрома также имеет вегетативная дисфункция с пре–обладанием холинергической стимуляции [8]. В отличие от синдрома раздраженной кишки при функциональной билиарной боли мало изучена роль центральной и периферической гиперчувствительности.
Тесная анатомо-функциональная взаимосвязь билиарной системы с гастропанкреатодуоденальной зоной обусловливает смешанный характер болей при билиарной патологии, при этом абдоминальная боль редко встречается в виде самостоятельного симптома, а часто сочетается с другой симптоматикой желудочно-кишечного тракта (тошнотой, рвотой, горечью во рту, изжогой, чувством переполнения в желудке, метеоризмом, поносами, запорами и т.д.).
Хронический панкреатит, согласно общепринятому определению, — это длительный воспалительный процесс, характеризующийся болевым синдромом и приводящий к необратимым изменениям поджелудочной железы (ПЖ) и потере экзокринной, а затем и эндокринной функции [2, 15]. Болевой синдром является наиболее ярким проявлением ХП и доминирует у 80–90 % больных [6, 12]. Характер панкреатических болей чрезвычайно разнообразен. Они могут быть приступообразными, с длительностью атак от нескольких часов до двух-трех суток, постоянными с приступообразным усилением или постоянными, что характерно для так называемых болевых ХП. При гиперферментных панкреатитах боли чаще приступообразные, обычно очень интенсивны, вплоть до болевого шока, атаки четко очерчены, имеют внешние причины, такие как погрешность в диете, прием алкоголя, хорошо купируются холодом. При гипоферментных ХП боли чаще постоянные или постоянные с периодическим усилением, умеренной интенсивности, обострения нечетко очерчены, холод менее эффективен, они чаще уменьшаются при приеме спазмолитиков, ненаркотических или наркотических анальгетиков [2, 19].
Таким образом, болевой синдром является наиболее серьезной клинической проблемой и основным показанием к хирургическому вмешательству у больных с хроническим панкреатитом. Сильная боль приводит к уменьшению аппетита, что обусловливает недостаточное питание и уменьшение массы тела. Хотя общая продолжительность боли при ХП может быть непредсказуемой, однако в целом со временем (около 10 лет) эта проблема у большинства пациентов (90–95 %) разрешается, и с началом появления экзокринной недостаточности боль исчезает [21].
Патогенез панкреатических болей многообразен. Они могут возникать как вследствие воспалительно-деструктивных изменений самой поджелудочной железы и повышения давления в ее ткани (растяжение капсулы) и протоковой системе (протоковая гипертензия), так и вследствие пара- и перипанкреатического фиброза с вовлечением нервных стволов, развития билиарных стриктур и дуоденостеноза, кист ПЖ, рака ПЖ, ишемии ПЖ и органов брюшной полости (абдоминальный ишемический синдром), солярита, изменений со стороны соседних органов (панкреатогенные язвы, тромбоз селезеночной вены, компрессия и/или смещение желудка, двенадцатиперстной кишки) [2, 19].
Принципы лечения боли билиарного и панкреатического генеза
При боли в животе билиарного генеза (типичная желчная колика при ЖКБ, функциональная билиарная боль при ФБР) с целью ее купирования на первое место выходят спазмолитики — препараты, воздействующие на проведение нервного импульса к гладкомышечным клеткам (антихолинергические спазмолитики) и непосредственно вызывающие их расслабление (миотропные спазмолитики). Лечебный эффект спазмолитиков основан на вмешательстве в механизмы мышечного сокращения. Спазмолитики также не только купируют боль, но и способствуют восстановлению пассажа по кишечной трубке и секреции по выводным протокам (желчь, панкреатический секрет) [18, 22].
К сожалению, эффективность блокаторов мускариновых рецепторов антихолинергическими препаратами, такими как скополамин (гиосцин), ограничивается их неселективностью, что приводит к атропиноподобным побочным эффектам и обусловливает неблагоприятный профиль безопасности и переносимости, ограничивающий их клиническое применение.
Среди миотропных спазмолитиков выделяют 3 основные группы с разными механизмами действия. Первая группа — это неселективные спазмолитики, такие как папаверин и дротаверин, являющиеся блокаторами фосфодиэстеразы циклического аденозинмонофосфата и циклического гуанозинмонофосфата. Вторая группа — селективные блокаторы кальциевых каналов, которые избирательно воздействуют на гладкие мышцы ЖКТ. Третья группа — это селективные блокаторы натриевых каналов гладких мышц ЖКТ. Конечный этап действия любого из этих спазмолитиков — уменьшение концентрации ионов кальция в миоците и гладкомышечная релаксация [5, 22]. Они проявляют свою эффективность в отношении симптоматики в связи с тем, что снижают сократительную активность или спазмы пищеварительного тракта, которые ассоциируются с болью.
В литературе многократно обсуждались особенности, преимущества и недостатки применения различных спазмолитиков при разнообразной гастроэнтерологической патологии [5, 7, 10, 16, 18, 23]. Какой группе препаратов отдавать предпочтение, в конечном счете решает клиницист с учетом конкретной клинической ситуации. Однако не вызывает сомнения то, что при относительно сравнимой клинической эффективности указанных групп медикаментов препараты с селективным действием на гладкие мышцы пищеварительной системы (мебеверин, отилония бромид, пинаверия бромид и др.), безусловно, предпочтительнее, поскольку лишены побочных эффектов холинолитиков (ощущение сухости во рту, нарушение зрения, задержка мочеиспускания, рефлекторная гипотония кишечника) и системного вазодилатирующего действия, свойственного дротаверину и папаверину. В связи с этим антихолинергические препараты и неселективные спазмолитики в настоящее время применяются все реже, тогда как селективные спазмолитики по-прежнему популярны и широко используются.
В 2013 году на рынке Украины появился инновационный селективный комбинированный препарат Энтероспазмил, который в Европе является одним из наиболее применяемых спазмолитиков (в Европе известен как Meteoxane). Энтероспазмил представляет собой комбинацию флороглюцинола дигидрата и симетикона, в связи с чем имеет целый ряд преимуществ по сравнению с другими спазмолитиками [9].
Флороглюцинола дигидрат — неатропиновый спазмолитик, селективный блокатор кальциевых каналов с элементами системного действия. После приема внутрь он быстро абсорбируется и метаболизируется. Время достижения максимальной концентрации в плазме крови Тmax — 1 час, T1/2 — 2 часа, системная биодоступность после перорального приема составляет 30 %. Флороглюцинол селективно блокирует Сa2+-каналы и Сa2+-депо при переизбытке Ca2+, ограничивает выход К+ из клетки и препятствует развитию спазма гладкомышечной клетки, не вызывая атонии или гипотонии кишечника. Благодаря системному всасыванию и выведению спазмолитический эффект осуществляется не только на кишечник, но и на желчевыводящие протоки, а также на урогенитальный тракт. В отличие от неселективных спазмолитиков у флороглюцинола отсутствуют генерализованные системные побочные явления.
Симетикон является наиболее известным и безопасным антифлатулентом, уже в течение почти сорока лет применяющимся для симптоматического лечения метеоризма, а также для подготовки перед рентгеновским, эндоскопическим или сонографическим обследованием ЖКТ. Он увеличивает поверхностное натяжение жидкости и разрушает мелкие газообразные пузырьки в пене, вследствие чего достигается противопенный и антифлатулентный эффект. Симетикон не всасывается, химически инертен, нетоксичен и не вызывает побочных эффектов.
Таким образом, Энтероспазмил за счет двойного действия флороглюцинола и симетикона быстро и эффективно устраняет спазм сфинктера Одди и желчных протоков, а также уменьшает метеоризм, что способствует уменьшению и/или исчезновению болевого синдрома билиарного генеза. В настоящее время Энтероспазмил широко применяется с целью нормализации моторно-эвакуаторной функции желчевыводящих путей и устранения спазма сфинктера Одди: обычно по 2 капсулы 3 раза в день курсами различной продолжительности (от 1 недели до 1 месяца).
При наличии признаков гипомоторной ДЖП, наличия в ЖП билиарного сладжа, так называемой «замазки», с целью предупреждения формирования желч–ных конкрементов рекомендуется прием препаратов урсодезоксихолевой кислоты и желчегонных средств [5, 20, 23].
Высокая распространенность билиарного сладжа у больных с патологией билиарной системы (40–50 %) позволила накопить обширный клинический материал, свидетельствующий об особенностях его клинического течения, прогноза, осложнений, что обосновывает необходимость проведения качественной диагностики и эффективной терапии. Основное клиническое значение билиарного сладжа заключается в том, что он является источником камнеобразования. Однако это отнюдь не означает, что у всех больных с билиарным сладжем обязательно образуются камни. Несмотря на то, что билиарный сладж является исходным материалом для формирования желчных камней, они, по разным оценкам, образуются только у 5–20 % пациентов за 1–3-летний период. Это связано с тем, что при исчезновении причин, способствующих образованию сладжа, последний исчезает спонтанно.
Для снижения литогенных свойств желчи традиционно применяются препараты желчных кислот, и в частности урсодезоксихолевой кислоты. Одним из свойств УДХК является способность уменьшать насыщенность желчи холестерином за счет угнетения абсорбции в кишечнике и подавления синтеза в печени, что сопровождается снижением его секреции в желчь. В связи с этим клинический эффект препаратов УДХК при билиарном сладже в первую очередь обусловлен снижением литогенности желчи и, как следствие, увеличением времени нуклеации, что в конечном итоге предупреждает образование микролитов, а также способствует растворению холестериновых камней. Курс лечения препаратами, содержащими УДХК, зависит от формы билиарного сладжа. Для элиминации билиарного сладжа в виде взвеси гиперэхогенных частиц обычно достаточно месячного курса лечения. При других формах билиарного сладжа курс лечения более длительный, но, как правило, не превышающий трех месяцев. Эффективность лечения препаратами УДХК в сроки до 3 месяцев в зависимости от вида билиарного сладжа составляет 75–85 %.
Одним из эффективных инновационных комбинированных препаратов, содержащих УДХК и применяющихся для лечения билиарного сладжа и предупреждения формирования холестериновых конкрементов, является Холоплант. Этот препарат содержит три компонента: экстракт артишока (200 мг), УДХК (100 мг) и дягель ангелика (50 мг). Такое сочетание компонентов Холопланта уменьшает или устраняет застой желчи и билиарный сладж, препятствует образованию холестериновых конкрементов, уменьшает/снимает спазм и воспаление. Обычно применяется по 1–2 капсулы 3 раза в день в течение 1 месяца.
В качестве редкого варианта лечения выраженной гипомоторной дисфункции ЖП при отсутствии эффекта от консервативного лечения может рассматриваться холецистэктомия. У пациентов с первым типом ДСО целесообразно проведение эндоскопического лечения — сфинктеротомии или сфинктеропластики [11].
Купирование боли при ХП является сложной задачей и варьирует от медикаментозного лечения (пероральный прием спазмолитиков, ферментов, нестероидных противовоспалительных препаратов и анальгетиков) до эндоскопической терапии, хирургических и нейрохирургических вмешательств: характер вмешательств во многом зависит от патофизиологии боли.
Во многих случаях, особенно если нет расширения протоков и препятствий для оттока панкреатического секрета, эффективной является консервативная медикаментозная терапия. При назначении симптоматической противоболевой терапии в настоящее время предложен ступенчатый алгоритм рационального обезболивания. Основным принципом такого подхода является выбор необходимого препарата и ступенчатый переход от более простых, эффективных и безопасных препаратов, которые могли бы применяться больными в качестве самолечения, к более мощным средствам и комбинированному лечению, в зависимости от интенсивности боли и основного патогенетического механизма ее развития [6, 19, 22].
Поскольку универсальным патофизиологическим эквивалентом хронической боли в животе билиарного и/или панкреатического генеза служит спазм желчных и панкреатических протоков, на первой ступени лидирующие позиции при лечении боли слабой и средней интенсивности прочно удерживают спазмолитические препараты. В этом плане при хроническом панкреатите билиарного генеза, в частности связанном с ЖКБ или ДСО, можно рекомендовать рассмотренный выше Энтероспазмил, быстро и эффективно устраняющий спазм сфинктера Одди, желчных и панкреатических протоков, а также уменьшающий часто сопутствующий ХП метеоризм.
Тем не менее большинству пациентов с ХП для контроля боли необходим прием анальгетиков. Согласно рекомендациям Всемирной организации здраво–охранения для купирования боли при ХП могут применяться различные анальгетики, как ненаркотические, так и наркотические. При умеренной боли применяют такие периферические анальгетики, как парацетамол и метамизол. При их неэффективности сначала добавляются центральные анальгетики (пентазоцин), затем — легкие опиоиды (трамадол) и, наконец, наиболее сильные опиоиды (морфин, бупренорфин) [19]. Для тех, кому необходимы сильные наркотические препараты, разумно рассмотреть начало приема дополнительного агента. Эти дополнительные препараты имеют своей целью минимизировать дозу наркотических анальгетиков, необходимую для контроля боли. Они включают трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина, комбинированные ингибиторы обратного захвата серотонина и норэпинефрина (дулоксетин) и α2δ-ингибиторы (габапентин или прегабалин). Эти вещества еще недостаточно изучены, чтобы говорить о преимуществе какого-то из них при лечении ХП, но они все использовались при множестве состояний, связанных с хронической болью, и поэтому заслуживают проведения дальнейших клинических испытаний [19, 22].
Одним из важных патогенетических составляющих болевого синдрома при ХП является внешнесекреторная недостаточность поджелудочной железы, в связи с чем в таких случаях целесообразно применять фермент–ные препараты. Следует, однако, помнить, что противоболевую активность проявляют только таблетированные ферменты с неэнтеросолюбильным покрытием (в нашей стране не зарегистрированы) либо кишечнорастворимые микротаблетки, или мини-микросферы, с высоким содержанием протеаз (не менее 1200 ЕД) [6, 19].
Существуют также дополнительные консервативные лечебные методики для купирования боли, но они изучены недостаточно, и их эффективность точно не известна. К таким методам лечения относится применение антиоксидантов или октреотида [17].
У пациентов с отсутствием эффекта на медикаментозную терапию можно рассматривать такие дополнительные методы, как невральная блокада, невролиз, эндоскопическое или хирургическое лечение. Эндоскопические или хирургические техники преимущественно используются у пациентов с расширенным панкреатическим протоком. У этих пациентов чаще всего выявляется длительно существующее заболевание и наиболее часто — алкогольный ХП. Эндоскопическое лечение включает в себя стентирование или дилатацию стриктур панкреатического протока и удаление обтурирующих панкреатических проток камней. Решение о хирургическом лечении также рассматривается у пациентов при неэффективности медикаментозной терапии [13].
В заключение хотелось бы еще раз напомнить врачам, что абдоминальный болевой синдром любого генеза, включая билиарную или панкреатическую боль, — это не только свидетельство физического страдания, но и серьезная психоэмоциональная, стрессовая ситуация в жизни больного, которая существенно снижает качество его жизни и нарушает трудоспособность. Врач не должен допускать ситуаций, при которых пациент длительно испытывает боли и ждет, пока определят их причину и назначат лечение. В первую очередь мы должны избавить пациента от страданий и назначить симптоматическую терапию боли, выбрав наиболее эффективное и безопасное средство для ее купирования. Наиболее часто с этой целью в качестве препаратов первой ступени применяются спазмолитики. Одним из эффективных инновационных комбинированных спазмолитиков, купирующих болевой синдром билиарного и панкреатического генеза, является Энтероспазмил.
Список литературы
1. Вовк Е.И. Желчнокаменная болезнь в XXI веке: лечение или профилактика? // Consilium Medicum. — 2010. — № 2. — С. 37-44.
2. Губергриц Н.Б., Христич Т.Н. Клиническая панкреатология. — Донецк: ООО «Лебедь», 2000. — 416 с.
3. Губергриц Н.Б. Симптомы и синдромы в клинике желчнокаменной болезни: перечитаем лекции С.П. Боткина // Новости медицины и фармации. — 2010. — № 4(309). — С. 18-19.
4. Лоранская И.Д., Кукушкин М.Л., Малохова Е.В., Вишневская В.В. Дисфункции билиарного тракта: механизмы регуляции боли, диагностические критерии // Гепатология. — 2004. — № 5. — С. 10-15.
5. Минушкин О.Н., Масловский Л.В. Диагностика и лечение функциональных расстройств билиарного тракта // Русский медицинский журнал. — 2010. — № 18(5). — С. 277-279.
6. Anaparthy R., Pasricha P.J. Pain and chronic pancreatitis: is it the plumbing or the wiring? // Curr. –Gastroenterol. Rep. — 2008. — № 10. — Р. 101-6. — PMID: 18462594.
7. Behar J., Corazziari E., Guelrud M. et al. Functional gallbladder and sphincter of Oddi disorders // Gastroente–rol. — 2006. — № 130. — Р. 1498-1509.
8. Bennett E., Evans P., Dowsett J. et al. Sphincter of Oddi dysfunction: psychosocial distress correlates with manometric dyskinesia but not stenosis // World J. Gastroenterol. — 2009. — № 15. — Р. 6080-5.
9. Chassany O., Bonaz B., Bruley S. et al. Acute exacerbation of pain in irritable bowel syndrome: efficacy of phloroglucinol/trimethylphloroglucinol. A randomized, double-blind, placebo-controlled study // Aliment. Pharmacol. Ther. — 2007 May. — № 25(9). —Р. 1115-1123.
10. Corazziari E., Shaffer E.A., Hogan W.J. et al. Functional disorders of the biliary tract and pancreas // Gut. — 1999. — № 45(2). — Р. 48-54.
11. Cotton P.B., Durkalski V., Romagnuolo J. et al. Effect of endoscopic sphincterotomy for suspected sphincter of Oddi dysfunction on pain-related disability following cholecystectomy: the EPISOD randomized clinical trial // JAMA. — 2014. — № 311. — Р. 2101-9.
12. Dimcevski G., Sami S.A., Funch-Jensen P. et al. Pain in chronic pancreatitis: the role of deorganization in the central nervous system // Gastroenterology. — 2007. — № 132. — Р. 1546-56
13. Dıte P., Ruzicka M., Zboril V., Novotny I. A prospective, randomized trial comparing endoscopic and surgical therapy for chronic pancreatitis // Endoscopy. — 2003. — № 35. — Р. 553-8.
14. Drossman D.A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. — 2006. — Vol. 130. — P. 1377-1390.
15. Etemad B., Whitcomb D.C. Chronic pancreatitis: diagnosis, classification, and new genetic developments // Gastroenterology. — 2001. — № 120. — Р. 682-707.
16. Goussous N., Kowdley G.C., Sardana N. et al. Gallbladder dysfunction: How much longer will it be controversial? // Digestion. — 2014. — № 90. — Р. 147-154.
17. Kirk G.R., White J.S., McKie L. et al. Combined antioxidant therapy reduces pain and improves quality of life in chronic pancreatitis // J. Gastrointest. Surg. — 2006. — № 10. — Р. 499-503.
18. Kurucsai G., Joo I., Fejes R. et al. Somatosensory hypersensitivity in the referred pain area in patients with chronic biliary pain and a sphincter of Oddi dysfunction: new aspects of an almost forgotten pathogenetic mechanism // Am. J. Gastroenterol. — 2008. — № 103. — Р. 2717-25.
19. Ljeb J.G., Forsmark C.E. Review article: pain and chronic pancreatitis // Aliment. Pharmacol. Ther. — 2009. — № 29. — Р. 706-719.
20. Makharia G.K. Understanding and treating abdominal pain and spasms in organic gastrointestinal diseases: inflammatory bowel disease and biliary diseases // J. Clin. Gastroenterol. — 2011. — № 45. — Р. 89-93.
21. Mullhaupt B., Truninger K., Ammann R. Impact of etiology on the painful early stage of chronic pancreatitis: a long-term prospective study // Z. Gastroenterol. — 2005. — № 43. — Р. 1293-1301.
22. Patrizi F., Freedman S.D., Pascual-Leone A., Fregni F. Novel therapeutic approaches to the treatment of chronic abdominal visceral pain // Sci. World J. — 2006. — № 6. — Р. 472-90.
23. Rastogi A., Slivka A., Moser A.J. et al. Controversies concerning pathophysiology and management of acalculous biliary-type abdominal pain // Dig. Dis. Sci. — 2005. — № 50. — Р. 1391-401.
24. Winstead N.S., Wilcox C.M. Health-related qua–lity of life, somatization, and abuse in Sphincter of Oddi dysfunction // J. Clin. Gastroenterol. — 2007. — № 41. — Р. 773-6.