Статья опубликована на с. 61-67
В структуре неврологической патологии в Украине наиболее актуальными и социально значимыми остаются цереброваскулярные заболевания (ЦВЗ). В свою очередь, среди ЦВЗ первое место занимают не инсульты и транзиторные ишемические атаки, а хронические нарушения мозгового кровообращения (ХНМК) (около 90 %) [1–3]. В Украине для обозначения ХНМК, или хронической церебральной ишемии, используют термин «дисциркуляторная энцефалопатия» (ДЭ), который был предложен еще в 60-х гг. прошлого столетия и вошел в классификацию сосудистых заболеваний головного и спинного мозга, принятую в 1984 г. (Е.В. Шмидт, A.М. Максудов).
В настоящее время термин «дисциркуляторная энцефалопатия», несмотря на многочисленные дискуссии, остается жизнеспособным и действующим и определяется как состояние, обусловленное хронической сосудистой мозговой недостаточностью и/или повторными эпизодами острых нарушений мозгового кровообращения, которое проявляется прогрессирующими многоочаговыми нарушениями функций головного мозга [3–5].
На сегодняшний день артериальная гипертензия (АГ) рассматривается как самый значимый фактор риска развития как острой, так и хронической ишемии мозга (дисциркуляторной энцефалопатии), а также расстройств памяти и других когнитивных нарушений. Многочисленными исследованиями доказана связь стойкого повышения артериального давления (АД) с риском прогрессирования когнитивных нарушений, в частности умеренных когнитивных нарушений [4, 6]. Известно, что длительно существующая АГ часто сопровождается нарушениями когнитивных функций в пожилом возрасте [7–10]. Так, в исследовании SCOPE было показано, что повышение АД у пожилых людей приводит к ухудшению познавательных функций и развитию деменции [11]. Большинством исследователей показано, что предиктором деменции является повышение систолического давления [6, 8, 11–13]. В некоторых исследованиях выявлена взаимосвязь между развитием когнитивных нарушений и уровнем диастолического АД [14].
Ядром клинической картины гипертензивной ДЭ (ГДЭ) являются неврологические (пирамидные, экстрапирамидные, атактические синдромы и т.п.), когнитивные и эмоциональные расстройства, которые являются результатом структурных изменений головного мозга [7, 8, 14]. Снижение качества жизни при ДЭ, кроме развития очаговых неврологических синдромов, связано с возникновением когнитивных и эмоциональных расстройств. На сегодняшний день цереброваскулярные заболевания называются второй по частоте причиной развития приобретенного когнитивного дефицита, в том числе сосудистой деменции, а также играют значительную роль в развитии нейродегенеративных церебральных заболеваний, включая болезнь Альцгеймера [10, 14–16].
Коморбидность когнитивных и эмоциональных нарушений при хронической церебральной ишемии обсуждается многими исследователями, причем подчеркивается сложность и неоднозначность их взаимо-связи. Такая взаимосвязь, по мнению многих авторов, обусловлена прежде всего анатомо-физиологическими особенностями развития церебральной дисциркуляции, особенно при артериальной гипертензии, в глубинных структурах мозга, приводящей к развитию феномена разобщения [6, 11, 17]. Эмоциональные нарушения не просто сочетаются с когнитивными, но и могут оказывать неблагоприятное влияние на когнитивную сферу. По мнению некоторых авторов, наличие эмоциональных нарушений способно усугублять выраженность когнитивных расстройств из-за повышения уровня тревоги и связанных с этим трудностей сосредоточения, неуверенности и ожидания неудачи [7, 18].
Так, результаты работы G. Grace и соавт. продемонстрировали влияние тревожных черт (но не депрессии) на результаты оценки памяти и скорости переработки информации, причем выраженность тревожных черт коррелировала с результатами исследования с расчетом индекса отсроченного воспроизведения шкалы памяти Векслера [19].
Влияние стресса на когнитивные функции опо-средует передняя цингулярная кора (ПЦК). В пределах ПЦК различают два отдела: аффективный и когнитивный. Аффективный отдел ПЦК связан с миндалиной, передним островком и орбитофронтальной корой и, таким образом, участвует в регуляции эмоционального состояния. Когнитивный отдел ПЦК связан с такими структурами, как латеральная префронтальная кора, и, таким образом, участвует в регуляции функции внимания, выборе способа реагирования, рабочей памяти. ПЦК осуществляет функцию исполнительного внимания (переключение с одного задания на другое, распределение ресурсов внимания и др.). Кроме того, ПЦК входит в корково-таламомезенцефальную систему, которая участвует в процессе переключения внимания [7, 14–16].
Поэтому для адекватной терапии хронической церебральной ишемии, возникшей на фоне АГ, и профилактики прогрессирования заболевания логичным является, с одной стороны, коррекция АД, а с другой — воздействие на мозговой кровоток и облигатные синдромы гипертонической дисциркуляторной энцефалопатии, а именно когнитивные и эмоционально-вегетативные [20–23].
В связи с этим еще одной проблемой является низкая приверженность пациентов к терапии ввиду необходимости приема большого количества лекарственных препаратов. Поэтому важным является поиск путей минимизации количества лекарственных средств, которые нужно назначать данной категории пациентов и при этом воздействовать на максимальное количество симптомов.
Целью настоящего исследования является изучение влияния Олатропила на когнитивные, вегетативные и психоэмоциональные показатели у лиц с хронической церебральной ишемией на фоне артериальной гипертензии.
Выбор Олатропила при хронической церебральной ишемии, возникшей на фоне артериальной гипертензии, основывается на следующих положениях:
1. Ноотропы, к которым относится Олатропил, являются оптимальной группой средств для применения в качестве препаратов для лечения неврологических проявлений цереброваскулярной патологии. Их уникальность основана на сочетанном воздействии на различные звенья функционально-метаболических процессов в центральной нервной системе и вместе с тем на регулируемые этими процессами психосоматические и психоэмоциональные взаимоотношения [24–27].
2. Олатропил представляет собой сочетание в одной лекарственной форме (капсуле) двух «истинных»
ноотропов — пирацетама и аминалона и является первым «истинно ноотропным» комбинированным препаратом [28, 29]. Чем привлекает такая комбинация? Фармакотерапевтические свойства Олатропила определяются механизмами действия его компонентов. Пирацетам, до настоящего времени остающийся эталоном среди препаратов-ноотропов, воздействующих на когнитивные функции, обладает, с одной стороны:
— мембраностабилизирующим действием;
— антигипоксическим действием;
— антиоксидантным действием;
— влиянием на биосинтез белков;
— нейромедиаторным действием;
— вазотропным действием [30–35].
С другой стороны, монотерапия пирацетамом, в связи с наличием у него достаточно сильного активирующего влияния на ЦНС, в ряде случаев связана с развитием побочных эффектов — возбуждения, бессонницы, раздражительности и т.д. А как мы уже обсуждали, для пациентов с гипертонической ДЭ как раз характерны эмоциональные расстройства тревожного ряда [20, 22, 36].
Именно поэтому в качестве компонента, способствующего нейтрализации упомянутых эффектов, а также с целью расширения механизмов действия Олатропила в его состав включен аминалон.
Аминалон (гамма-аминомасляная кислота — ГАМК) обладает принципиально иным действием на ЦНС. Являясь естественным нейромедиатором, ГАМК служит центральным звеном в реализации процессов цент-рального торможения путем взаимодействия со спе-
цифическими ГАМК-рецепторами в различных регионах мозга. При этом также достигается благоприятное влияние на энергетику нейрона, нейродинамику, мозговое кровообращение, сочетание успокаивающего и мягкого психостимулирующего действия, что в результате оказывает положительное воздействие на когнитивные и неврологические функции, мозговую гемодинамику, возможность достижения анксиолитического эффекта [37, 38].
Роль ГАМК в патогенезе возрастных нарушений деятельности ЦНС чрезвычайно важна. Известно, что именно ослабление ГАМК-ергических процессов является значимым звеном развития хронического возбуждения и, соответственно, дальнейшего истощения нейрональных структур мозга в условиях долговременной ишемии и гипоксии [3, 10, 14]. Кроме того, при старении также отмечается значительный дефицит ГАМК-ергической медиации за счет снижения как ее активной синаптической концентрации, так и количества постсинаптических ГАМК-рецепторов [15, 16].
Таким образом, пирацетам и ГАМК обладают различными, взаимодополняющими клинико-фармакологическими эффектами, далеко выходящими за рамки собственно ноотропного действия. С учетом механизмов воздействия Олатропил призван одновременно влиять как на когнитивные, так и на вегетативно-эмоциональные расстройства.
3. Имеется достаточная доказательная база клинической эффективности Олатропила в неврологической практике, этому посвящено значительное количество публикаций [28, 29, 39]. Препарат оказался эффективным инструментом терапии различных форм цереброваскулярной патологии, улучшая когнитивные функции, психическую активность, психоэмоциональный статус, вегетативные функции, благоприятно влияя на качество жизни пациентов. При этом за счет синергизма действия его компонентов возможно уменьшение стандартных дозировок пирацетама и аминалона, применяемых в рамках монотерапии, что способствует высокому уровню безопасности Олатропила и упрощает его применение в условиях комплексной терапии различных форм неврологических заболеваний, позволяет оптимизировать ноотропную терапию.
Характеристика пациентов и методов исследования
Под нашим наблюдением находилось 60 пациентов с эссенциальной артериальной гипертензией I–II ст. и гипертензивной дисциркуляторной энцефалопатией 1-й ст. в возрасте от 39 до 49 лет (37 женщин, 23 мужчины). Диагноз верифицировался согласно протоколу «Надання медичної допомоги за спеціальністю «Неврологія» (Наказ № 487 МОЗ України) с помощью клинического неврологического осмотра, нейропсихологического исследования, изучения церебральной гемодинамики (УЗДГ), с учетом консультативных заключений терапевта или кардиолога (наличие артериальной гипертензии), а также данных нейровизуализации и исследования глазного дна.
В связи с наличием у всех пациентов вегетативной дисфункции было проведено тщательное изучение вегетативного гомеостаза с помощью субъективной и объективной вегетативных шкал (А.М. Вейн, 2000). Эмоциональные нарушения (количественная выраженность тревоги и депрессии) исследовались с помощью теста Спилбергера — Ханина, шкалы депрессии Гамильтона, теста САН. Для определения выраженности когнитивных нарушений пациенты тестировались по Монреальской шкале оценки когнитивных функций (МоСА) и шкале ММSE с отдельной оценкой внимания по методу отсчитывания чисел и кратковременной памяти [40]. Кроме того, исследовались внимание и слухоречевая память по А.Р. Лурия, а также использовались таблицы Шульте.
Статистическая обработка полученных результатов проводилась с помощью пакета прикладных программ Microsoft Exсel, Statistica (версия 6), с оценкой средних значений М, их ошибки n, критерия Стьюдента и достоверности статистических показателей p. Различия считались достоверными при р ≤ 0,05.
У обследованных пациентов наблюдались следующие неврологические синдромы: цефалгический, вегетативной дисфункции, вестибулярно-атактический, пирамидных нарушений в виде повышения сухожильных рефлексов и анизорефлексии, легких стволовых дисфункций в виде нарушения зрачковых реакций и глазодвигательных расстройств, легкого когнитивного дефицита в виде нарушения внимания, забывчивости, снижения памяти, некоторой торпидности процессов удержания интеллектуальной нагрузки и уменьшения продуктивности запоминания, а также эмоциональных нарушений тревожного и тревожно-депрессивного характера (рис. 1).
В обеих группах исследованных пациентов выявленные неврологические синдромы имели статистически подтвержденную тождественность количественного распределения (р ≤ 0,01).
В связи с этим согласно протоколу оправданным был выбор терапии, направленной на коррекцию сосудистых, когнитивных и эмоционально-аффективных нарушений у пациентов с ГДЭ.
Для изучения влияния Олатропила на эффективность терапии пациентов, страдающих ГДЭ 1-й ст., пациенты методом случайной выборки были разделены на две группы, идентичные по полу и возрасту: 1-я группа — основная (30 пациентов); 2-я группа — сравнения (30 пациентов). Обе группы пациентов получали антигипертензивную терапию под контролем артериального давления до достижения целевых цифр. Первой группе пациентов дополнительно назначался Олатропил по одной капсуле трижды в сутки в течение месяца. Контроль эффективности терапии осуществлялся через месяц после начала лечения. Результаты оценивали по динамике жалоб, неврологическому и нейропсихологическому исследованию.
Результаты и их обсуждение
Клинико-неврологическое обследование выявило у пациентов обеих групп наличие цефалгического синдрома (85 % пациентов), вестибулярно-атактического синдрома (45 % больных), стволово-пирамидной симптоматики с асимметрией сухожильных рефлексов, ослаблением зрачковых реакций и легкими глазодвигательными нарушениями, а также снижение памяти, внимания и работоспособности. У всех пациентов в начале лечения выявлялся синдром вегетативной дистонии разной степени выраженности, наличие эмоциональных и когнитивных расстройств.
Так, пациенты обеих групп предъявляли жалобы на сложности умственного сосредоточения (основная группа — 20 пациентов, 66,6 %; группа сравнения — 19 больных, 63,3 %), на проблемы с запоминанием информации (25 пациентов, 83,3 %, и 26 больных, 86,6 % соответственно), снижение концентрации внимания (у всех пациентов обеих групп (100 %)).
Средний балл по шкале ММSE составил 26,20 ± 0,15 в основной группе и 26,17 ± 0,16 в группе сравнения. С помощью теста отсчитывания чисел в обеих группах в 100 % случаев выявлены быстрая утомляемость, снижение концентрации внимания, некоторое затруднение умственной деятельности. Наиболее часто встречались следующие варианты ошибок: ошибки в единицах при переходе через десяток при отсчитывании чисел (63,3 % среди пациентов основной группы, 66,6 % в группе сравнения), характерные для затруднения умственной деятельности; ошибки в десятках, свойственные пациентам с неустойчивым вниманием (53 и 50 % соответственно). У 86,6 и 83,3 % больных соответственно к окончанию тестирования возрастала длительность пауз, что свидетельствовало о повышенной утомляемости и истощаемости.
Таким образом, при оценке нейропсихологического статуса была выявлена тенденция к нарушению памяти и воспроизведения, а также достоверное нарушение внимания и счета.
У пациентов обеих групп регистрировался синдром вегетативной дисфункции (СВД). При этом больные первой группы имели достоверное увеличение фонового показателя теста А.М. Вейна по объективной и субъективной шкалам — 39,1 ± 2,5 и 28,0 ± 2,7 балла; пациенты второй группы — 38,87 ± 2,8 балла и 27,81 ± 3,4 балла. Клинически синдром вегетативной дистонии проявлялся эмоциональными расстройствами, немотивированной тревогой, раздражительностью, общей слабостью, кардиалгическим, кардиосенестопатическим, цефалгическим, мышечно-тоническим синдромами. Практически у всех пациентов с СВД выявлялись неврозоподобные расстройства в виде астенических, тревожных, ипохондрических, тревожно-депрессивных расстройств.
Выраженность эмоциональных нарушений и тяжесть тревожно-депрессивной симптоматики определялись прежде всего структурой личности пациента и его реакцией на заболевание. Уровень личностной тревожности у пациентов обеих групп был охарактеризован как высокий (основная группа — 38,2 ± 3,0; группа сравнения — 33,84 ± 3,0 балла). Это свидетельствовало о том, что больные ГДЭ склонны воспринимать даже незначительные стрессовые и жизненные ситуации как угрожающие. Уровень депрессии у пациентов обеих групп был оценен по шкале Гамильтона как легкий.
В результате проведенной терапии состояние пациентов обеих групп улучшилось по всем изучаемым показателям, что свидетельствовало об участии церебральной дисциркуляции в патогенезе вегетативно-эмоциональных и когнитивных расстройств. Следует отметить, что результаты терапии у пациентов основной группы были достоверно выше (р ≤ 0,05) по всем показателям, отражающим состояние когнитивных функций, вегетативного статуса и психоэмоциональной сферы.
Пациентами обеих групп была отмечена положительная динамика при выполнении тестов, оценивающих показатели когнитивной сферы, а именно более легкий процесс умственного сосредоточения, улучшение памяти и повышение концентрации внимания. Однако у пациентов основной группы на фоне приема Олатропила происходило более выраженное улучшение когнитивных показателей (р ≤ 0,05), у пациентов же группы сравнения наблюдалась тенденция к улучшению показателей когнитивной сферы, не достигающая уровня статистической значимости (рис. 2).
Также на фоне терапии препаратом Олатропил отмечалось достоверное уменьшение времени, затраченного пациентами на выполнение задания по таблицам Шульте (р ≤ 0,05). Аналогичные результаты были получены при изучении теста Лурия по воспроизведению 10 слов. Показатель достоверно повышался на фоне лечения препаратом Олатропил через месяц после начала терапии (р ≤ 0,05).
Пациенты группы сравнения через месяц наблюдения показали некоторое улучшение когнитивных функций на фоне приема гипотензивной терапии, не достигающее уровня статистической значимости (рис. 3, 4).
Таким образом, можно говорить об оптимизирующем влиянии препарата Олатропил на внимание и мышление. Об этом свидетельствует тот факт, что на фоне приема препарата Олатропил происходило сокращение общего времени выполнения пробы Шульте и количества совершаемых ошибок при пробах со слухоречевой памятью по А.Р. Лурия. Кроме того, это может свидетельствовать о сопряженности анксиолитического эффекта препарата Олатропил с улучшением кратковременной памяти, хотя полученные данные требуют дальнейшего изучения.
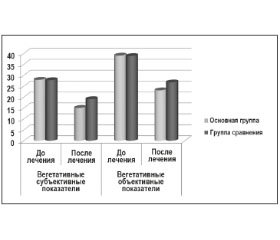
При лечении пациентов основной группы с использованием препарата Олатропил на фоне антигипертензивной терапии через 30 дней наблюдения отмечалось достоверное уменьшение параметров, определяющих уровни тревожности и депрессии у исследуемых больных, что сопровождалось достоверным снижением выраженности вегетативных симптомов как по субъективной, так и по объективной шкале (р ≤ 0,05). У пациентов группы сравнения на фоне нормализации артериального давления также наблюдалась тенденция к снижению выраженности тревожности и вегетативных нарушений, однако не достигающая уровня статистической значимости (рис. 5, 6).
/66.jpg)
Выявленная взаимосвязь, очевидно, свидетельствует о том, что на фоне повышенных цифр АД у пациентов, страдающих ГДЭ, ухудшается кровоток в лимбико-ретикулярных структурах, что приводит к усилению тревожности и депрессивных нарушений. Однако только лишь снижение АД не приводило к полной нормализации тревожных и вегетативных нарушений, что служит убедительным основанием для назначения комбинированной терапии с использованием препарата Олатропил.
Следует также отметить, что ни в одном случае при приеме препарата Олатропил не наблюдалось побочных эффектов, препарат легко переносился.
Таким образом, результаты проведенного исследования могут свидетельствовать о патогенетической роли тревожных нарушений в клиническом оформлении хронических церебральных ишемий, в частности гипертензивной дисциркуляторной энцефалопатии, и их (тревожных нарушений) негативном влиянии на течение цереброваскулярной патологии. Подобные результаты негативного влияния синдрома тревоги на течение и прогноз всех видов патологии сердца получены в кардиологии [6, 8, 18, 20, 21]. Кроме того, можно предполагать, что синдром тревоги ухудшает ответ на фармакотерапию вазоактивными препаратами, хотя подобное утверждение нуждается в дополнительном изучении.
Выводы
1. Применение комбинированного ноотропного препарата Олатропил в комплексном лечении ГДЭ способствует повышению эффективности терапии в целом за счет уменьшения тревожности, вегетативной лабильности и улучшения когнитивных функций.
2. Использование в терапии хронической церебральной ишемии, развившейся на фоне артериальной гипертензии, препарата Олатропил приводило к более эффективной коррекции когнитивных и эмоционально-вегетативных нарушений.
3. Препарат Олатропил трижды в сутки в течение 1–3 месяцев следует рекомендовать для повышения эффективности лечения пациентов, страдающих хронической церебральной ишемией, развившейся на фоне артериальной гипертензии.
Список литературы
1. Міщенко Т.С. Сучасна діагностика і лікування у неврології та психіатрії / За ред. Т.С. Міщенко, В.С. Підкоритова. — К.: Доктор-Медіа, 2008. — 624 с.
2. Стан неврологічної служби України в 2011 році / М.К. Хобзей, О.М. Зінченко, М.В. Голубчиков, Т.С. Міщенко. — Харків, 2012. — 25 с.
3. Кадыков А.С. Хронические сосудистые заболевания головного мозга (Дисциркуляторная энцефалопатия) / А.С. Кадыков, Л.С. Манвелов, Н.В. Шахпаронова. — М.: ГЭОТАР-Медиа, 2006. — 224 с.
4. Антипина Е.А. Дисциркуляторная энцефалопатия. Патология, клиника, лечение: Учебное пособие / Е.А. Антипина, А.В. Густов. — Нижний Новгород, 2000. — 36 с.
5. Евтушенко С.К. Дисциркуляторная энцефалопатия как анахронизм отечественной неврологии / С.К. Евтушенко // Международный неврологический журнал. — 2010. — № 6(36). — С. 181-187.
6. Трещинская М.А. Артериальная гипертензия и цереброваскулярная патология / М.А. Трещинская // Новости медицины и фармации. — 2009. — Спецвыпуск. — С. 30-35.
7. Челышева И.А. Когнитивные и эмоциональные расстройства при дисциркуляторной энцефалопатии: Автореф. дис… д-ра мед. наук. — М., 2004.
8. Остроумова О.Д. Артериальная гипертензия и тревожные состояния / О.Д. Остроумова // Кардиология. — 2002. — № 2. — С. 95- 99.
9. Бурчинский С.Г. Комбинированные нейротропные средства и проблема нейрогеропротекции (обзор) / Бурчинский С.Г. // Теорія та практика сімейної медицини. — 2011. — № 2. —С. 86-89.
10. Анисимов В.Н. Молекулярные и физиологические механизмы старения / В.Н. Анисимов. — СПб.: Наука, 2003. — 467 с.
11. Lithell H. SCOPE Study group. The Study on Cognitorand Prognosisuinthe elderly (SCOPE) / Н. Lithell, I. Scoog, D. Elmfeldt et al. // J. Hypertens. — 2003. — 21. — 875-886.
12. Psychopharmacotherapy in the Elderly / Ed. by M.Bergener & M. Tropper. — N.Y.: Springer, 1993. — 460 p.
13. Turnheim K. When drug therapy gets old: pharmacokinetics and pharmacodynamics in the elderly / К. Turnheim // Exp. Gerontol. — 2003. — V. 38. — P. 843-853.
14. McEwen B.S. Stress and hyppocampal plasticity / B.S. McEwen // Annu. Rev. Neurosci. — 1999. — Vol. 22. — P. 105-122.
15. Старение мозга / Под ред. В.В. Фролькиса. — Л.: Наука, 1991. — 277 с.
16. Hock C. Biochemical aspects of dementia / С. Hock // Dial. Clin. Neurosci. — 2003. — V. 5. — P. 27-34.
17. Lloyd-Jones D. Heart disease and stroke statistics — 2010 update: a report from the American Heart Association / D. Lloyd-Jones, R.J. Adams, Т.М. Brown et al. // Circulation. — 2010. — 121. — e46-215.
18. Ибатов И. Тревога и ишемическая болезнь сердца / И. Ибатов, А. Сыркин, А. Вейн // Врач. — 2003. — № 9. — С. 8-11.
19. Grace G.M. Concentration and memory deficits / G.M. Grace, W.R. Nielson, M. Hopkins et al. // J. Clin. Exp. Neuropsychol. — 1999. — Vol. 21. — P. 477-487.
20. Медведев В.Э. Психофармакотерапия тревожных расстройств у больных с сердечно-сосудистыми заболеваниями / В.Э. Медведев, А.П. Троснова, А.В. Добровольский // Журн. неврол. психиат. — 2007. — Т. 107, № 7. — С. 25-29.
21. Булдакова Н.Г. Психофармакотерапия в кардиологии / Н.Г. Булдакова // Рус. мед. журн. — 2006. — Т. 14, № 10. — С. 8-13.
22. Морозова О.Г. Коррекция вегетативных и тревожных нарушений в практике врача-интерниста / О.Г. Морозова, И.В. Киреев // Психиатрия и неврология. — 2007. — 215; Новости мед. и фарм. — 2007. — № 7. — С. 6-7.
23. Приходько В.Ю. Коррекция психосоматических расстройств в практике терапевта / В.Ю. Приходько, Н.А. Масленникова, Л.А. Редько // Новости мед. и фарм. — 2008. — № 4. — С. 18-20.
24. Аведисова А.С. Анализ зарубежных исследований ноотропных препаратов (на примере пирацетама) / А.С. Аведисова, Р.В. Ахапкин, В.И. Ахапкина, Н.И. Вериго // Рос. психиатр. журн. — 2001. — № 1. — С. 46-53.
25. Бурчинский С.Г. Ноотропы: классификация, механизмы действия, сравнительная характеристика фармакологических свойств / С.Г. Бурчинский. — К., 2004. — 21 с.
26. Бурчинский С.Г. Новые подходы к созданию комбинированных ноотропных средств: ожидания неврологов и клиническая практика / С.Г. Бурчинский // Укр. вісн. психоневрол. — 2006. — Т. 14, вип. 3. — С. 59-63.
27. Воронина Т.А. Ноотропные препараты, достижения и перспективы / Т.А. Воронина, С.Б. Середенин // Эксп. клин. фармакол. — 1998. — № 4. — С. 3-9.
28. Бурчинський С.Г. Олатропіл — новий комбінований ноотропний препарат / С.Г. Бурчинский // Мед. перспективи. — 2006. — Т. 11, № 4. — С. 53-56.
29. Ярош O.K. Клініко-експериментальна оцінка церебропротективної дії Олатропілу / O.K. Ярош, О.Т. Дудко, Л.О. Громов // Клін. фармація. — 2005. — № 1. — С. 12-17.
30. Winblad B. Piracetam: a review of pharmacological properties and clinical use / В. Winblad // CNS Drug. Rev. — 2005. — V. 11. — P. 169.
31. Muller W.E. Piracetam: novelty in a unique mode of action / W.E. Muller, G.P. Eckert, А. Eckert // Pharmacopsychiatry. — 1999. — V. 32, Suppl.1. — P. 2-9.
32. Gouliaev A.H. Piracetam and other structurally related nootropics / А.Н. Gouliaev, А. Senning // Brain Res. Rev. — 1994. — V. 19. — P. 180-222.
33. Mondadori C. Involvement of a steroidal component in the mechanism of action of piracetam-like nootropics / С. Mondadori // Behav. Brain Res. — 1990. — V. 506. — P. 101-108.
34. SMART Drugs: Enhance cognitive function with piracetam. — Basel, 1999. — 629 p.
35. Tacconi M.T., Wurtman R.J. Piracetam: physiological disposition and mechanism of action / М.Т. Tacconi, R.J. Wurtman // Adv. Neurol. — 1986. — V. 43. — P. 675-685.
36. Кушнир Г.М. Комбинация ноотропов в лечении ранней цереброваскулярной патологии / Г.М. Кушнир, А.А. Микляев // Укр. вісн. психоневрол. — 2007. — Т. 15, вип. 3. — С. 13-15.
37. Островская Р.У. Ноотропные свойства производных гамма-аминомасляной кислоты / Р.У. Островская, С.С. Трофимов // Бюл. эксперим. биол. мед. — 1984. — № 12. — С. 170 - 172.
38. Ellergast J.P. Gamma-aminobutyric acid — mediated neurophysiological effects in the central nervous system / J.P. Ellergast // Brain neurophysiology. — Chicago: Illinois Univ. Press, 2000. — P. 497-530.
39. Антипчук Е.Ю. Олатропил в лечении когнитивных нарушений у пострадавших вследствие Чернобыльской катастрофы / Е.Ю. Антипчук, К.Н. Логановский, Н.Ю. Чупровская и др. // Укр. неврол. журн. — 2007. — № 4. — С. 75-81.
40. Folstein M.F. Mini-Mental State a practical guidefor grading the mental state of patients for the clinician / M.F. Folstein // J. Psych. Res. — 1975. — Vol. 22. — P. 1037-1045.
/64.jpg)

/65.jpg)
/66.jpg)