Статья опубликована на с. 16-20 (Мир)
Останнім часом істотно виріс рівень вродженої патології (майже на 30 %), пов’язаної з внутрішньоутробним інфікуванням, що сьогодні становить від 10 до 50 % [1]. Одне з провідних місць у її структурі займають внутрішньоутробні TORCH-інфекції, і передусім токсоплазмоз, рівень захворюваності на який у новонароджених може досягати понад 10–12 на 10 000, а летальність — 10 % [2]. Актуальність проблеми підтверджується високою інфікованістю токсоплазмами (T. gondii) населення в різних регіонах світу — 30–90 %, серед якого переважають жінки. Так, в Україні інфікованість жінок токсоплазмами досягає майже 50–70 % [3]. Сьогодні ця інвазія залишається ще недостатньо вивченою, незважаючи на те, що токсоплазмоз активно вивчається з початку минулого століття. Дотепер повною мірою ще не вирішені питання діагностики токсоплазмозу. Клінічною особливістю захворювання є те, що токсоплазмоз в більшості випадків в імунокомпетентних осіб має безсимптомний або субклінічний перебіг і тільки в 1 % з них викликає виражену клінічну симптоматику. Крім цього суттєвою особливістю захворювання є те, що після первинного інфікування у понад 95–98 % осіб воно стає хронічним [3, 4].
Сьогодні має місце повсюдна гіпердіагностика хронічного токсоплазмозу, оскільки зазвичай такий діагноз базується тільки на серологічному методі дослідження — виявленні протитоксоплазмозних IgG. Але для підтвердження діагнозу хронічного токсоплазмозу необхідний досить широкий комплекс клінічних, молекулярно-генетичних, паразитологічних та інструментальних методів дослідження, які вказували б на реактивацію цієї інвазії, її прогресування, що супро–воджуються рядом відповідних клінічних і/або параклінічних проявів [3, 5]. Без таких додаткових даних коректно говорити тільки про iнфiкування (свіже чи давнє) токсоплазмами.
Як правило, лише в осіб з імуно–дефіцитами, рівень яких сьогодні неухильно зростає, первинне інфікування токсоплазмами або реактивація хронічної інвазії нерідко призводять до генералізованих і тяжких форм токсоплазмозу. До імунодефіцитів варто також зарахувати і вагітність з огляду на механізми формування у матері імунної толерантності до плода, а також через зниження резервних та адаптаційних можливостей її організму для захисту і забезпечення життєдіяльності плода. Тому очевидні ризик і висока ймовірність внутрішньоутробної інвазії плода при первинному ураженні вагітної T. gondii [6]. У разі хронічного латентного токсоплазмозу його реактивація в імунокомпетентних вагітних украй рідкісна та можлива, як правило, тільки за наявності вродженого або набутого імунодефіциту.
Відомо, що при інфікуванні вагітної T. gondii в 1-2-му триместрі ймовірність внутрішньоутробного ураження плода становить близько 35–40 %, а в 3-му триместрі — понад 60 %. Поряд із цим інфікування плода T. gondii на ранніх термінах розвитку плода (1-й триместр вагітності) призводить до його загибелі в 60–70 % випадків. У 2-му триместрі вагітності суттєве ушкодження плода відбувається в 25 %. випадків. У 3-му триместрі інфікування плода токсоплазмами має, як правило, безсимптомний перебіг [6–8]. Тому украй важливо виявити інфікування матері й плода якомога раніше для вирішення питання про необхідність переривання вагітності або призначення адекватної хіміотерапії.
Внутрішньоутробне ураження плода можливе при первинному інфікуванні жінки T. gondii або при реактивації хронічної токсоплазмозної інвазії під час вагітності. Також інфікування плода у вагітної можливе в разі, якщо первинне інфікування жінки токсоплазмами або реактивація у неї хронічної інвазії сталися протягом 6 міс. до настання вагітності. Зазвичай в імунокомпетентних жінок, інфікованих T. gondii за 6 міс. до вагітності, реактивація токсоплазмозу не відбувається. Навпаки, наявність хронічної латентної форми токсоплазмозу в імунокомпетентної жінки до вагітності є сприятливим фактором щодо практичної неможливості внутрішньоутробної інвазії плода T. gondii. Навіть у випадку первинної інвазії імунокомпетентної вагітної і внутрішньоутробного зараження її плода T. gondii наступні вагітності вже через 6–8 міс. можна вважати практично безпечними щодо виникнення вродженого токсоплазмозу в дитини [7, 9]. Однак це стосується тільки імунокомпетентних жінок, але не є абсолютним, тому що в ряді випадків при хронічному токсоплазмозі можлива реактивація інвазії, а отже, внутрішньо–утробна інвазія плода T. gondii, хоча це і малоймовірно.
Тактика діагностики токсоплазмозу у вагітних включає такі етапи:
1) встановити наявність або відсутність інфікування T. gondii (оптимально при плануванні вагітності до її на–стання);
2) у разі інфікування визначити клінічну форму паразитозу — гострий (первинна інвазія) або хронічний;
3) при хронічній формі токсоплазмозу встановити або виключити її реактивацію;
4) за наявності первинного інфікування T. gondii або реактивації хронічної форми токсоплазмозу у вагітної встановити або виключити внутрішньоутробне інфікування плода T. gondii [3].
Останнє є найважливішим у діагностиці токсоплазмозу вагітних тому, що від цього залежить подальша терапевтична тактика стосовно вагітної та її майбутньої дитини.
При первинній інвазії чи реактивації хронічного токсоплазмозу під час вагітності або за 6 міс. до неї у випадку доведеної відсутності інфікування плода призначається специфічна етіотропна терапія вагітної препаратами, що практично не проникають через плаценту (спіраміцин), що кумулюються в ній, унеможливлюючи вертикальний шлях передачі T. gondii від матері до плода. Таку терапію можна вважати щадною тому, що вона практично не впливає на плід, який розвивається, однак і її призначення має бути суворо обґрунтованим, оскільки зазначене антипаразитарне лікування повинно тривати до кінця вагітності. Ще суворішим має бути обґрунтування наявності інфікування плода T. gondii тому, що в такій ситуації необхідно вирішувати питання про внутрішньоутробну антипаразитарну терапію або переривання вагітності, якщо йдеться про значні вади розвитку плода чи ушкодження, несумісні з подальшою життєдіяльністю дитини. Варто наголосити, що в такому випадку остаточне рішення про переривання вагітності залишається за самою жінкою [3, 10].
У разі необхідності антипаразитарної терапії плода її проводять етіотропними препаратами, що проникають через плаценту. На жаль, практично всі ці препарати мають тератогенні й токсичні властивості (хлоридин, сульфаніламіди, метронідазол, тетрацикліни, макроліди). Зазначена терапія повинна тривати не тільки до кінця вагітності, але й пролонгуватися вже і новонародженій дитині (призначатися немовляті) [3].
У більшості (понад 95 %) первинно інфікованих T. gondii вагітних паразитоз має безсимптомний або субклінічний перебіг. Украй рідко (в 1–3 %) в інфікованих вагітних є або мали місце протягом останніх 6 міс. гарячка, лімфаденопатія, збільшення печінки і селезінки, міалгії, ознаки міокардиту, хоріоретиніту. Отже, клініцисту при вирішенні питання про первинне інфікування або реактивацію хронічного токсоплазмозу вагітної, а також при діагностиці вродженого токсоплазмозу в основному доводиться спиратися тільки на дані лабораторних досліджень (переважно імунологічних), рідше — висновки сонологічного дослідження плода та ще рідше — на дані досліджень суміжних фахівців — окуліста й кардіолога.
Та все ж за будь-яких обставин основою діагностики токсоплазмозу вагітних і внутрішньоутробного інфікування плода є лабораторне дослідження, на вірогідність даних якого впливає чимало факторів, передусім якість діагностичних тест-систем, обладнання та професійний рівень лаборантів.
Усе це зумовлює найвищий ступінь відповідальності лікаря, якому доводиться вирішувати комплекс вкрай складних проблем, пов’язаних із діагностикою токсоплазмозу у вагітних. У такій ситуації значна частина відповідальності клініциста лягає й на лікаря-лаборанта, який проводив необхідні дослідження і відповідає за їх вірогідність. Питання про відповідальність лікаря в цьому випадку обумовлене можливістю серйозних наслідків його дій щодо вагітної та її майбутньої дитини. Передусім це стосується необґрунтованого переривання вагітності, немотивованого призначення тератогенної і токсичної антипаразитарної хіміотерапії або, навпаки, відмови лікарів від неї у разі її потреби. У більшості наукових і практичних робіт, присвячених токсоплазмозу, не розглядаються складності діагностики токсоплазмозу вагітних, жорстка залежність терапевтичної тактики від діагностики, а також відповідальність лікаря за наслідки такого лікування. Підтвердженням цьому є те, що, незважаючи на високу технічну оснащеність медичних лабораторій, навіть у США на сьогодні немає референс-лабораторії з діагностики внутрішньоутробного і вродженого токсоплазмозу. У разі потреби така діагностика проводиться в Канаді [11].
Вирішальне значення у лабораторній діагностиці токсоплазмозу сьогодні належить імунологічним методам, серед яких провідні позиції посів імуноферментний аналіз (ІФА). Використовуючи ІФА, у крові пацієнтки можна виявити антитіла різних класів. На практиці використовують визначення IgM, IgG і рідше IgА не тільки якісно, але й кількісно, а також досліджують ступінь авідності IgG та рівень високо- і низькоавідних специфічних IgG. Це дає можливість визначити гостроту процесу, термін інфікування і динаміку перебігу токсоплазмозу. Відомо, що наявність у крові пацієнтки специфічних IgM та IgА свідчить про недавнє інфікування або реактивацію хронічної інвазії. Однак динаміка рівня специфічних IgА при токсоплазмозі вивчена недостатньо [12].
Суттєву роль відіграє динаміка рівня IgG. Так, при гострому інфікуванні в ранній період вагітності (2–3 тижн.) IgG можуть не визначатися, але це не означає, що при гострому інфікуванні у крові й тканинах їх немає. Це зумовлено межею рівня чутливості методу і його діагностичною можливістю. Так, для ІФА-тест-систем різних виробників чутливість може коливатися від 5 до 20 МО/мл [3, 13]. Через 2–3 тижн. при гострому інфікуванні T. gondii відзначається поява IgG до антигенів T. gondii, а ще через 2–4 тижн. — істотне зростання їх рівня. При хронічному токсоплазмозі протягом 2–4 тижн. після реактивації також відзначається ріст рівня специфічних IgG. Діагностично значущим вважають підвищення рівня IgG у 2–4 рази, але не менше ніж у 2 рази. Початковий рівень IgG до T. gondii при одноразовому дослідженні не має суттєвого діагностичного значення. Найбільш важлива динаміка їх рівня [3]. Відповідно до рекомендацій Всесвітньої організації охорони здоров’я (ВООЗ), рівень IgG до T. gondii понад 200 МО/мл є одним із критеріїв первинного інфікування T. gondii або реактивації хронічного токсоплазмозу. Але варто відзначити діагностичну обмеженість згаданих рекомендацій ВООЗ з огляду на низький рівень можливих варіантів (йдеться тільки про 9 варіантів рівня IgG) і динамічних комбінацій, тому що вони складені тільки з урахуванням динаміки рівнів IgM та IgG до T. gondii, без оцінки авідності IgG, наявності IgА, а також даних паразитологічної діагностики і генетичних методів дослідження, про які йтиметься далі.
Одним із найважливіших діагностичних критеріїв первинного інфікування T. gondii або реактивації хронічного токсоплазмозу є сероконверсія — при динамічному дослідженні зникнення з крові IgM до T. gondii, поява специфічних IgG та зростання їх рівня в динаміці. За даними літератури, що підтверджуються і нашими дослідженнями, специфічні IgM та IgG з’являються в достатньому для визначення в ІФА рівні тільки через 1–2 тижні після інфікування T. gondii, далі протягом 1 міс. IgM досягають максимуму, а потім протягом 3 міс. після інфікування зникають у 70 % пацієнтів [3]. Варто відзначити, що ряд авторів стверджують про неможливість повторного виявлення IgM при реактивації хронічного токсоплазмозу, за винятком осіб, хворих на ВІЛ-інфекцію [14, 15]. Рівень IgG досягає максимуму через 1–2 міс. після інфікування T. gondii. Після цього він поступово знижується до індивідуального для кожного пацієнта рівня, зберігається довічно (в імунокомпетентних осіб) і надалі може хвилеподібно змінюватися в невеликих межах, що не є показником активності хронічного токсоплазмозу, а відображає формування нестерильного імунітету.
Оцінка імунологічних методів дослідження коректна тільки в імунокомпетентних осіб і пов’язана зі значними труднощами при діагностиці токсоплазмозу у плода й дитини в перші місяці життя. Це зумовлено недосконалістю імунної системи –плода і немовляти (здатність до синтезу специфічних IgG з’являється тільки на 3–6-му міс. життя дитини), а також можливістю проходження IgG матері через плаценту.
Слід зазначити і можливість розвитку у вагітних імунних реакцій із синтезом антитіл, що мають перехресну специфічність. Це істотно ускладнює діагностику токсоплазмозу і визначення строків інфікування токсоплазмами. Передусім це стосується високої ймовірності синтезу у вагітних низькоспецифічних IgM і ревматоїдного фактора, які забезпечують отримання в ІФА хибнопозитивних результатів виявлення IgM до T. gondii. Це істотно обме–жує діагностичну цінність ІФА, призводить до гіпердіагностики, та, що особливо небезпечно, до призначення необґрунтованої етіотропної терапії. Тому виявлення у крові ревматоїдного фактора і його рівня має бути обов’язковим дослідженням при лабораторній діагностиці токсоплазмозу у вагітних. Сьогодні існують етапні тест-системи для визначення в ІФА IgM до T. gondii, що забезпечують видалення з досліджуваної сироватки крові ревматоїдного фактора до початку визначення специфічних IgM. Однак широкого застосування цей метод не знайшов. Незважаючи на запобігання хибнопозитивним результатам визначення IgM до T. gondii, пов’язаним із ревматоїдним фактором, ця тест-система не забезпечувала їх негативацію, обумовлену неспецифічними IgM. Така проблема була вирішена за допомогою впровадження в діагностику різновиду ІФА — імуноблотингу, що забезпечує високу селективність і детекцію саме специфічних до T. gondii антитіл [1, 16]. Але з огляду на високу ціну цей метод діагностики токсоплазмозу сьогодні практично не застосовується.
Попри це, провідним у діагностиці інфікування вагітної і плода досі залишається виявлення в їх крові саме IgM. Однак у деяких осіб антитіла класу IgM з’являються і зберігаються до 18–24 міс. від моменту інвазії, що значно утруднює визначення часу інфікування пацієнтки. У такій ситуації при підозрі на сероконверсію раціонально було б поряд із визначенням рівня IgG до T. gondii визначати й рівень специфічних IgM. Але діагностичні ІФА-тест-системи з кількісним визначенням IgM до T. gondii сьогодні не виробляються. За необхідності можна використати існуючі ІФА-тест-системи, титруючи (за розведеннями) досліджувану сироватку й одержуючи кількісні (логарифмічні) показники рівня IgM, які можна порівнювати в динаміці. У цій ситуації конче потрібно проводити динамічні дослідження з отриманою первинною (замороженою) сироваткою.
Вирішити наявність первинного інфікування можна також шляхом виявлення у крові вагітної рівня низько- та високоавідних антитіл, а також їх співвідношення (індекс авідності — відношення рівня високоавідних до токсоплазм IgG до загального рівня специфічних антитоксоплазмозних IgG). Відомо, що на початкових етапах розвитку інвазії в макроорганізмі синтезуються IgG із низькою специфічністю (авідністю) до антигену, а через декілька місяців після закінчення активного інфекційного процесу відбувається активний синтез високоспецифічних IgG, а рівень низько–авідних антитіл різко знижується [17].
У гострому періоді токсоплазмозу виявляється низький рівень високоавідних IgG — до 30–40 %, а при хронічних формах і перенесеній інвазії понад 6 міс. тому їх рівень перевищує 50 %. Рівень авідно–сті 40–50 % входить у так звану сіру зону і в ІФА означає сумнівний результат.
Індекс авідності, менший ніж 0,2, свідчить про гострий активний токсоплазмоз із тривалістю інвазії, що не перевищує 4 міс. При індексі в межах 0,2–0,3 тривалість інвазії становить 4–6 міс., а при показнику понад 0,3 свідчить про давнє інфікування, оскільки тривалість інвазії, як правило, перевищує півроку. Однак і низька авідність IgG не може інтерпретуватися як однозначний показник недавнього інфікування T. gondii, тому що в окремих осіб IgG мають постійну низьку авідність протягом багатьох місяців після інфікування [3].
Слід зазначити, що діагностичну цінність ІФА обмежує необхідність обов’язкового визначення рівнів специфічних антитіл у динаміці з інтервалом не менше ніж 2–3 тижн. Але такий тривалий час очікування результатів приховує у собі загрозу пізньої діагностики гострого токсоплазмозу, а отже й пізнього призначення етіотропної терапії. Вкрай важливе значення це має в інфікованих вагітних, особливо в 1-му триместрі вагітності, у яких пізно розпочата етіотропна терапія може призвести до інфікування плода з фатальними для нього наслід–ками.
Динамічні повторні дослідження (через 2–3 тижні) сироватки крові в ІФА для підвищення вірогідності отриманих результатів і можливості їх порівняння з початковими показниками необхідно проводити обов’язково одночасно з використанням первинних зразків сироватки від конкретної пацієнтки в одній і тій же постановці ІФА. Первинні зразки сироватки необхідно заморожувати при температурі не вище –18–24° С і зберігати до наступної постановки ІФА. При такому зберіганні зразків припустимий рівень зниження рівня антитіл не перевищує 5–10 %.
Ще однією практично нерозв’язною проблемою імунологічної діагностики токсоплазмозу є відсутність уніфікованого підрахунку результатів ІФА (особливо для кількісних методик). Результати тестів ІФА видаються лабораторіями у вигляді рівнів оптичної щільності, титрів антитіл, (МО/мл) та ін. Досі в ряді лабораторій ще використовують низькоінформативні та низькочутливі реакції зв’язування комплементу, непрямої гемаглютинації та імуно–флюоресценції. Не враховується початкове розведення сироватки в різних тестах ІФА (різна чутливість ІФА різних виробників). Окремі виробники ІФА-тест-систем взагалі вказують так звані норми і референсні рівні або межі специфічних імуноглобулінів і норми оптичної щільності. Однак про які норми може йтися при виявленні анти–токсоплазмозних антитіл, адже імунні реакції в кожної людини індивідуальні? Багато лабораторій видають результати у титрах, рівень яких залежить від розведення. У результаті насправді невисокий абсолютний рівень антитіл у конкретної пацієнтки (у МО/мл) відповідає високим титрам антитіл, що призводить до небезпечних діагностичних помилок. Нерідко при дослідженні однієї й тієї ж сироватки з використанням наборів для ІФА різних виробників виявлялося, що результати тестів досить сильно розрізнялися. У цих випадках не було об’єктивних причин для таких розбіжностей (тест-набори мали достатні терміни придатності, з працюючими вбудованими контролями і достатньою повторюваністю досліджень та ін.). Швидше за все, розбіжності пов’язані з різними початковими антигенами T. gondii, які використовують виробники ІФА-тестів. З іншого боку, набори деяких виробників ІФА-тестів для діагностики токсоплазмозу мають низький рівень повторюваності.
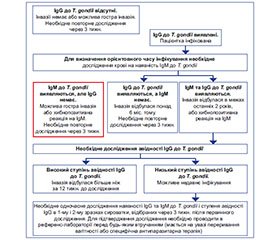
Найбільш вдала з погляду послідовно–сті, логіки, простоти сприйняття й лаконічності тактика діагностики токсоплазмозу, розроблена американським Центром контролю хвороб [19], в яку ми, зважаючи на проведені дослідження, внесли деякі доповнення, що раніше не були враховані розробниками (рис. 1).
Однак у такій розробці чітко не відображені умови діагностики, пов’язані з рівнем IgG та їх динамікою. Також можна навести й рекомендації Food and Drug Administration (FDA, 1997) з діагностичної тактики дослідження пацієнтки на предмет токсоплазмозу (табл. 1), які, незважаючи на давність розробки, не втратили своєї актуальності й сьогодні успішно використовуються.
Виявлення у крові особи антитіл до T. gondii — початковий етап діагностики токсоплазмозу. В імунокомпетентних осіб використовують алгоритм, наведений у табл. 2–5.
Спочатку з метою визначення початкового імунного статусу проводять дослідження крові на наявність IgG до T. gondii. Наявність IgG свідчить тільки про інфікування пацієнтки, а їх відсутність — або про відсутність інфікування T. gondii, або про ранні строки інфікування, що не перевищують 3 тижн. Для визначення ймовірного часу інфікування T. gondii необхідно подальше дослідження на наявність у крові відповідних IgM. Їх відсутність (варіант А) фактично виключає недавнє інфікування токсоплазмами, а виявлення з огляду на можливість циркуляції IgM до T. gondii до 18 міс. після інфікування інтерпретувати важко.
Можливі такі варіанти: В — особи з наявністю IgM та IgG; C — особи з наявністю IgM і відсутністю IgG до T. gondii; D — особи з відсутністю IgM і наявністю IgG. При варіанті В з упевненістю можна стверджувати, що інфікування відбулося протягом останніх 24 міс., що не виключає і ранні строки (3–6 тижн.), а також наявність неспецифічних IgM.
Необхідне повторне дослідження через 3 тижн. Якщо при повторному дослідженні знову вірогідно виявляються IgM, а рівень IgG не змінюється — це свідчить про інфікування понад 4–6 міс. до дослідження. Не виключається в цьому випадку і наявність неспецифічних або анамнестичних IgM. Якщо IgM будуть повторно виявлятися або зникнуть, а рівень IgG підвищиться у 2 рази і більше — це свідчення сероконверсії. Необхідне повторне дослідження через 3 тижн. Якщо при повторному дослідженні знову вірогідно виявляються IgM, а рівень IgG не змінюється — це свідчить про інфікування понад 4–6 міс. до дослідження. Не виключається в цьому випадку і наявність неспецифічних або анамнестичних IgM. Якщо IgM будуть повторно виявлятися або зникнуть, а рівень IgG підвищиться у 2 рази і більше — це свідчення сероконверсії.
Варіант С — малоймовірний. Але якщо результати дослідження вірогідні, то необхідне його повторне проведення через 2–3 тижн., обов’язково з початковими зразками сироватки з огляду на можливе гостре інфікування T. gondii. Якщо інфікування відбулося недавно, то при повторному дослідженні IgG повинні обов’язково з’явитися поряд зі збереженням IgM. Якщо IgG при повторному дослідженні не виявляються, a IgM вірогідно виявляються в обох зразках крові — результат розцінюється як хибнопозитивний, виявлені IgM — як неспецифічні, а пацієнтка вважається не інфікованою T. gondii.
При варіанті D найбільш імовірно, що інфікування відбулося понад 6 міс. тому. Однак не виключена і сероконверсія. Необхідне повторне дослідження через 3 тижн. Якщо IgM при повторному дослідженні не буде, а рівень IgG не зміниться, то це буде свідчити про інфікування, яке сталося понад 6 міс. тому. Якщо ж рівень IgG підвищиться у 2 рази і більше — має місце сероконверсія.
У наведених таблицях при складних діагностичних випадках немає рекомендацій стосовно проведення імуноблотингу і визначення рівня IgM, тому що ці методи в практичній охороні здоров’я використовують украй рідко.
У всіх вагітних обов’язкове дослідження авідності IgG. Висока авідність (понад 50 %) та індекс авідності понад 0,2 свідчать про те, що інфікування T. gondii відбулося від 3 до 6 міс. тому. Одночасно низька авідність не може бути показником недавнього інфікування, про що зазначалось вище. У випадках підозри на сероконверсію і при діагностичних складностях необхідне проведення полімеразної ланцюгової реакції (ПЛР) для виявлення у крові вагітної ДНК T. gondii (як маркера реплікації токсоплазм) та ІФА для виявлення IgА — маркера недавнього інфікування T. gondii.
У випадку одтримання сумнівних результатів, неможливих комбінацій і перед–усім підтвердження у вагітної сероконверсії, а отже й гострого інфікування T. gondii, всі дослідження необхідно продовжувати на базі референс-лабораторій і з використанням референс-тест-систем. Однак в умовах України це неможливо: таких лабораторій і тест-наборів у країні немає. В цій ситуації обов’язкове проведення повторних досліджень у тест-системах (ІФА і ПЛР) інших виробників і в іншій незалежній лабораторії. Якщо і після цього отримано суперечливі дані — обов’язкові повторні дослідження ще в одній незалежній лабораторії. Тільки за таких умов можна домогтися високої вірогідності та правомірності оцінки даних з огляду на серйозний ризик для вагітної та її плода помилок діагностики, про що йшлося вище. Однак необхідно також відзначити і те, що іноді результати досліджень декількох лабораторій можуть істотно відрізнятися. У цих випадках конче потрібно детально оцінити ризик для вагітної та її плода від призначення етіотропної терапії або відмови від неї та прийняти всебічно обґрунтоване і правомірне рішення.
Наведені вище дані показують, що тільки дослідження IgM та IgG до T. gondii без урахування градацій рівня IgG, як у рекомендаціях ВООЗ, при 4 початкових варіантах (5 у рекомендаціях ВООЗ), при повторному дослідженні дають 20 можливих комбінацій (всього 4 у рекомендаціях ВООЗ). За необхідності одночасного врахування результатів із даними рівня IgG (2 градації: 6–200 і понад 200 МО/мл) число комбінацій зростає до 36, з урахуванням авідності IgG (3 градації: до 30 %; 30–50 % і понад 50 %) рівень можливих комбінацій зростає до 108, з урахуванням даних ПЛР (2 градації: виявлення або відсутність ДНК T. gondii) — до 216, а з урахуванням даних дослідження IgА та імуноблотингу (по 2 градації: наявність або відсутність антитіл) — до 864. Кожний новий показник, введений у систему діагностичного пошуку, ще в декілька разів підвищить рівень можливих комбінацій. Природно, таке число комбінацій у клінічній практиці врахувати нереально. Тому наведені дані показують необхідність створення математичної моделі та комп’ютерної програми з алгоритмом, що дозволяє аналізувати дані досліджень, відкидаючи неможливі комбінації і на підставі цього давати рекомендації з діагностики або подальшого діагностичного пошуку.
Не вирішує проблему діагностики токсоплазмозу у вагітних і абсолютно вірогідний — золотий стандарт діагностики — паразитологічний метод (виділення токсоплазм із крові матері та плода, навколоплідних вод, ліквору, гомогенатів тканин, плаценти та ін.). Метод має істотні обмеження тому, що для виділення токсоплазм необхідні живі біосистеми (культури клітин, курячі ембріони або лабораторні тварини). Використовують сьогодні і звичайну світлову мікроскопію, а також імунофлюоресцентний метод дослідження тканин (плаценти і плода, у випадку його загибелі, амніотичних вод) на наявність у них токсоплазм. Першорядне значення має виявлення за межами клітин саме трофозоїтів T. gondii як показника гостроти процесу. Виявлення цист збудника є тільки показником інфікування токсоплазмами (за винятком випадків внутрішньоутробного інфікування плода). Однак негативні результати цих досліджень не означають відсутності активної токсоплазмозної інвазії. Такі дослідження трудомісткі, вимагають висококваліфікованого персоналу та достатньої оснащеності лабораторії, а висока вартість і складність цих методів робить їх сьогодні неприйнятними для практичної охорони здоров’я.
Вирішити проблему паразитологічної діагностики токсоплазмозу без виділення живого збудника, переборовши тим самим технічні труднощі і високу вартість досліджень, дозволяє найбільш перспективний нині метод виявлення ДНК токсоплазм у біосубстратах макроорганізму (в тому числі у крові) — ПЛР. Це дуже чутливий і високоспецифічний метод діагностики, практично ідентичний за результативністю до культурального методу. Виявлення в ДНК токсоплазм у крові матері або плода, амніотичній рідині, плаценті та інших тканинах у випадку вірогідності дослідження свідчать про наявність активної реплікації T. gondii. Так, у перші тижні після інфікування ДНК токсоплазм у крові пацієнтів виявляється у понад 50 %, поступово знижуючись до 30–35 % у перші місяці після інфікування. Тому необхідно вказати, що відсутність ДНК-збудника в досліджуваних зразках не означає відсутності активної токсоплазмозної інвазії, а також не можна не враховувати і можливості хибно–позитивних результатів ПЛР з огляду на її високу чутливість [20–22].
Незважаючи на це, сьогодні ПЛР — реальне майбутнє діагностики в інфектології. Технічні обмеження методу вже вирішуються, вартість устаткування і тест-наборів для ПЛР постійно знижується, що робить ПЛР-дослідження доступними і дозволяє рекомендувати їх для широкого впровадження у практику діагностики токсоплазмозу як один із провідних методів. До позитивних сторін методу можна внести високу специфічність, високу чутливість, відносну простоту проведення тесту, швидке отримання результату (6–12 год), невисоку собівартість досліджень, високу стабільність і повторюваність ПЛР-тестів, можливість діагностики токсоплазмозу в імунодефіцитних пацієнтів, можливість визначення кількісних характеристик інфікованості тканин токсоплазмами. Необхідно також вказати і на існуючі сьогодні недоліки та обмеження ПЛР: відносно дороге обладнання і спеціальні вимоги до лабораторії; метод ще недостатньо вивчений стосовно діагностики токсоплазмозу; високий рівень помилок при недотриманні техніки виконання ПЛР через високу чутливість методу і летючості праймерів; зниження чутливості методу через низьку специфічність праймерів в окремих виробників. Однак переваги ПЛР безсумнівні і переважають недоліки.
Додатково для діагностики токсоплазмозу у вагітних необхідні і консультації інших спеціалістів (окуліста та кардіолога). Так, наявність активного хоріоретиніту або його залишкових змін із великою ймовірністю може свідчити про недавнє інфікування T. gondii або реактивацію хронічного токсоплазмозу, а наявність рубців на сітківці без ознак запалення — тільки про наявність хронічного токсоплазмозу і відсутність його реактивації. Певну діагностичну значимість має також наявність у вагітної ознак міокардиту, виявленого на ЕКГ і/або при сонологічному дослідженні серця.
Дуже важливу роль у діагностиці токсоплазмозу вагітної відіграє сонологічне дослідження плода, особливо при використанні УЗД-апаратів із можливістю тривимірного відображення досліджуваного об’єкта. УЗД-дослідження плода для діагностики внутрішньоутробного токсоплазмозу може бути проведене не раніше 20–24 тижн. гестації, коли у плода вже сформовані центральна нервова система, основні органи і тканини. Так, за наявності у плода ураження головного мозку (розширення шлуночків мозку, кісти, гідро–цефалія та ін.) має місце висока ймовірність внутрішньоутробного вертикального інфікування плода T. gondii.
Для прижиттєвої діагностики внутрішньоутробного токсоплазмозу плода в інфікованої T. gondii вагітної необхідне проведення досліджень навколоплідних вод, крові плода, а іноді й плаценти. Абсолютним критерієм зараження плода є виявлення токсоплазм або їх структурних компонентів у цих біосубстратах. Це можуть забезпечити тільки паразитологічні дослідження або ПЛР, діагностична значимість і особливості якої були викладені вище. Забір матеріалу для цих досліджень (навколоплідних вод, ділянок плаценти і особливо крові плода) поєднаний із технічними труднощами і високим ризиком передчасного переривання вагітності (маніпуляції на матці та тканинах плода). Крім цього існують і тимчасові обмеження зазначених вище досліджень. Так, проведення амніоцентезу можливе не раніше 16 тижн. вагітності (тільки до цього моменту повністю формується плацента і є можливість забору амніотичної рідини). Проведення кордоцентезу (забору крові з пуповини плода) можливе не раніше 18 тижн. вагітності, тому що тільки з цього часу починає активно функціонувати плацентарний кровообіг і з’являється технічна можливість маніпуляцій на судинах плода і плаценти. Отже, реально виявити інфікування плода можна тільки в 2-му триместрі вагітності. Крім цього, істотно обмежують використання кордоцентезу технічні труднощі проведення методики (вона доступна тільки великим спеціалізованим медичним центрам, вимагає високої лікарської кваліфікації і складного дорогого устаткування).
Використання комплексу сучасних імунологічних тестів не дозволяє вирішити проблему діагностики інфікування плода T. gondii. Адже дослідження наявності та рівня IgG до T. gondii у крові плода не має сенсу з огляду на вільне проходження материнських специфічних IgG у кровообіг плода через плаценту, а також відсутність у плода здатності до синтезу цього класу антитіл, а дослідження наявності специфічних IgM обмежене відсутністю у плода здатності до їх синтезу і недосконалістю його імунологічних реакцій, особливо на ранніх термінах розвитку.
Суттєво допомогти можуть сонологічні дослідження, але вони не дозволяють із достатньою вірогідністю стверджувати саме про токсоплазмозне ураження плода. Однак сонологічні дані про ураження плода, які пов’язані з імовірним його інфікуванням токсоплазмами, можуть бути отримані тільки на 20–24-му тижн. гестації (виявлення вад розвитку нервової системи) і вимагають високої кваліфікації сонолога.
Підбиваючи підсумки, необхідно навести практичний діагностичний алгоритм реально можливого на сьогодні обстеження вагітної та її плода щодо інфікування T. gondii.
Початковий етап — дослідження вагітної:
1) визначення у крові наявності IgM до T. gondii — ІФА;
2) визначення у крові наявності та рівня IgG до T. gondii (у МО/мл) — ІФА.
При підозрі на недавнє інфікування T. gondii — повторне дослідження вагітної:
1) визначення авідності, індексу авідності IgG до T. gondii — ІФА;
2) виявлення у крові ДНК T. gondii — ПЛР;
3) визначення у крові IgА до T. gondii — ІФА;
4) визначення у крові наявності, а можливо, і рівня IgM — ІФА, імуноблотинг, високоселективний ІФА;
5) визначення у крові наявності й рівня ревматоїдного фактора;
6) динамічне сонологічне дослідження плода.
Додаткові дослідження:
1) консультація окуліста щодо хоріо–ретиніту;
2) проведення ЕКГ щодо міокардиту;
3) консультація кардіолога щодо міокардиту.
При підозрі на внутрішньо–утробне інфікування плода T. gondii:
1) виявлення ДНК T. gondii в амніотичній рідини (амніоцентез), ділянках плаценти (плацентоцентез), крові плода (кордоцентез) — ПЛР;
2) виявлення T. gondii у біоптатах плаценти — імунофлюоресцентне дослідження, ПЛР або культуральне дослідження;
3) динамічне сонологічне дослідження плода.
На завершення варто зазначити, що сьогодні провідним і найбільш доступним методом діагностики токсоплазмозу є ІФА. Однак для виключення діагностичних помилок слід ураховувати всі недоліки й обмеження методу. Необхідна стандартизація методів ІФА хоча б у межах одного міста, краще регіону (використання тест-наборів одного або декількох перевірених виробників із високою стабільністю і повторюваністю результатів). Наш досвід дозволяє стверджувати, що сьогодні такою лабораторією, яка гарантовано забезпечує вказану стабільність і повторюваність резуль–татів, а отже й заслуговує на довіру, є «Сінево» — європейська мережа медичних лабораторій в Україні.
Висновки
Проблема діагностики гострого токсоплазмозу у вагітних і внутрішньо–утробного токсоплазмозу сьогодні далека від свого вирішення і ставить більше запитань, ніж дає відповідей, що нагально потребує нових, обґрунтованих та удосконалених практичних рішень і формує нагальні завдання науково-практичних досліджень. Однак вже сьогодні застосування запропонованих рекомендацій дозволяє:
1. Максимально індивідуалізувати та оптимізувати діагностику токсоплазмозу у вагітних та внутрішньоутробного токсоплазмозу плода, суттєво зменшити ризик неправильної діагностики інфікування вагітної та плода токсоплазмами, а також уникнути проведення у вагітної та плода необґрунтованої етіотропної терапії і, що вкрай важливо, перешкодити необґрунтованому перериванню вагітності.
2. Вірогідно довести вкрай низький ризик вертикальної передачі T. gondii від імунокомпетентних матерів при їх хронічному інфікуванні токсоплазмами, що фактично виводить цю групу осіб з групи ризику стосовно внутрішньоутробного токсоплазмозу і робить недоцільним обстеження зазначеної категорії жінок щодо токсоплазмозу при подальших вагітностях.
3. Визначити як нагальну та найбільш раціональну необхідність проведення діагностики TORCH-інфекцій і визначення строків інфікування у жінок саме до вагітності.
4. Ілюструє нагальну необхідність для практичної охорони здоров’я створення протоколів діагностики і терапії для вагітних, інфікованих T. gondii, і для внутрішньоутробного токсоплазмозу.
Список литературы
1. Бондаренко А.Н. Диагностика токсоплазмоза у беременных / А.Н. Бондаренко, А.А. Бондаренко // Сучасні інфекції. — 2008. — № 4. — С. 11-24.
2. Васильев В.В. Токсоплазмоз: современные научно-практические подходы / В.В. Васильев // Вестник инфектологии и паразитологии. — http://infectology.ru/mnenie/ index.asp, 10.08.2007
3. Сучасна діагностика та етіотропне лікування токсоплазмозу у вагітних: Методичні рекомендації / А.М. Бондаренко, В.С. Копча. — К.: –Мінерал АГН України, 2010. — 66 с.
4. Лобзин Ю.В. Токсоплазмоз у беременных: достижения и нерешенные вопросы / Ю.В. Лобзин // Российский медицинский журнал. — 2001. — № 3. — С. 37-39.
5. Лобзин Ю.В. Приобретенный токсоплазмоз: критерии диагностики и принципы лечения / Ю.В. Лобзин, В.В. Васильев // Там же. — 2001. — № 2. — С. 43-45.
6. Лобзин Ю.В. Токсоплазмоз у беременных: клинические проявления, терапия и медикаментозная профилактика врожденного токсоплазмоза / Ю.В. Лобзин, В.В. Васильев // Там же. — 2001. — № 5. — С. 40-41.
7. Пипа Л.В. Токсоплазмозна інфекція у дітей: особливості перебігу, діагностики, лікування: Дис... докт. мед. наук. — К., 2005. — 326 с.
8. Токсоплазмоз у беременных / Ю.В. Лобзин, В.В. Васильев, В.Н. Тимченко, И.С. Васильева // Российский медицинский журнал. — 2001. — № 4. — С. 24-27.
9. Токсоплазмоз: ризик ураження плода та методи діагностики у вагітних / Ю.А. Рандюк, В.Д. Москалюк, А.М. Сокол, А.Г. Трефаненко // Інфекційні хвороби. — 2008. — № 4. — С. 55-62.
10. Токсоплазмоз. Клініка, діагностика та лікування / [Г.М. Дубинська, О.М. Ізюмська, П.М. Козюк та ін.]: Метод. реком. // Новости медицины и фармации. — 2003. — № 1(129). — С. 23-25.
11. Congenital toxoplasmosis: a review / [J.L. Jones, A. Lopez, M. Wilson et al.] // Obstet. Gynecol. Surv. — 2001. — Vol. 56, № 5. — Р. 296-305.
12. Screening for congenital toxoplasmosis: accuracy of immunoglobulin M and immunoglobulin A tests after birth / [R.E. Gilbert, L. Thalib, H.K. Tan et al.] / Med. Screen. — 2007. — Vol. 14, № 1. — Р. 8-13.
13. Evaluation of a commercial IgG/IgM Western blot assay for early postnatal diagnosis of congenital toxoplasmosis / [V. Rilling, K. Dietz, D. Krczal et al.] // Eur. J. Clin. Microbiol. Infect. Dis. — 2003. — Vol. 22, № 3. — Р. 174-180.
14. Lynfield R. Screening methods for congenital toxoplasma and risk of disease / R. Lynfield, H.W. Hsu, N.G. Guerina // Lancet. — 1999. — Vol. 353, № 9168. — P. 1899-1900.
15. Martinelli P. Screening for toxoplasmosis in pregnancy / P. Martinelli, A. Agangi, G.M. Maruotti // Lancet. — 2007. — Vol. 369, № 9556. — Р. 115-122.
16. Menard D. Immunoblot applied to the diagnosis of congenital toxoplasmosis / D. Menard, L. Paris, M. Danis // Pathol. Biol. — 1999. — Vol. 47, № 8. — Р. 797-804.
17. Собезжанска Б.М. Авидность антител класса Ig G к Toxoplasma gondii — новый серологический показатель острого токсоплазмоза / Б.М. Собезжанска // Новости bioMerieux. — 1999. — № 1. — С. 2-5.
18. IgG avidity assay firms up the diagnosis of acute toxoplasmosis on the first serum sample in immunocompetent pregnant women / [E. Candolfi, R. Pastor, R. Huber et al.] // Diagn. Microbiol. Infect. Dis. — 2007. — Vol. 58, № 1. — Р. 83-88.
19. Toxoplasmosis // Centers for Disease Control and Prevention. Parasites & Health // http://www.dpd.cdc.gov/DPDx/HTML/Toxoplasmosis.htm; http://www.dpd.cdc.gov/DPDx/images/IndexBar/LabDiag2-red.gif 16.08.2007
20. Detection of Toxoplasma gondii in amniotic fluid using quantitative real-time PCR method / [B. Nagy, L. Lazar, G. Nagy et al.] // Orv. Hetil. — 2007. — Vol. 148, № 20. — Р. 935-938.
21. Prediction of congenital toxoplasmosis by polymerase chain reaction analysis of amniotic fluid / [L. Thalib, L. Gras, S. Romand et al.] // BJOG. — 2005. — Vol. 112, № 5. — Р. 567-574.
22. Real-time quantitative PCR for toxoplasmosis diagnosis / [I. Ordinaire, A. Simon, E. Frealle et al.] // Ann. Biol. Clin. — 2005. — Vol. 63, № 1. — Р. 67-73.

/18_m.jpg)
/19_m.jpg)