Статья опубликована на с. 16-22
Осложненные инфекции мочевых путей (ОИМП) — это инфекции, возникающие на фоне структурных или функциональных нарушений почек и мочевых путей либо на фоне сопутствующих заболеваний, влияющих на защитные механизмы макроорганизма и повышающих риск развития инфекции или неэффективности лечения. ОИМП могут вызываться широким спектром микроорганизмов. Этот спектр намного шире, чем при неосложненных ИМП, к тому же имеется более высокая вероятность того, что возбудители будут резистентны к антибиотикам, особенно при ОИМП, связанных с лечением [1, 10].
Факторы, обусловливающие ОИМП:
— наличие постоянного катетера или стента (уретрального, мочеточникового, почечного) или периодическая катетеризация мочевого пузыря;
— объем остаточной мочи > 100 мл;
— обструктивная уропатия любой этиологии, например инфравезикальная обструкция (включая нейрогенный мочевой пузырь), камни и опухоли;
— пузырно-мочеточниковый рефлюкс или другие функциональные нарушения;
— реконструктивные операции на мочевых путях с использованием сегмента подвздошной кишки или созданием кондуита;
— химические или лучевые повреждения уроэпителия;
— пери- и послеоперационные ИМП;
— почечная недостаточность и трансплантация почек, сахарный диабет и иммунодефицитные состояния [7].
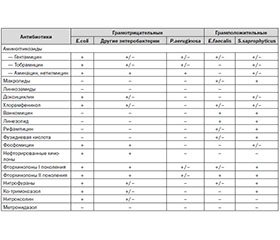
Ведущими возбудителями ОИМП являются энтеробактерии, среди которых 1-е место занимает E.coli (кишечная палочка). Однако грамотрицательные неферментирующие бактерии (например, Pseudomonas aeruginosa) и грамположительные кокки (например, стафилококки и энтерококки) также могут играть важную роль в развитии этих инфекций, в зависимости от сопутствующих условий [4] (табл. 1).
Тактика лечения ОИМП зависит от степени тяжести заболевания. Лечение состоит из 3 основных направлений: устранение урологических нарушений, антимикробная терапия и, при необходимости, поддерживающая терапия. Для того чтобы избежать появления резистентных штаммов, лечение по возможности должно проводиться на основании результатов культурального исследования мочи. При необходимости эмпирической терапии спектр активности выбранного антибиотика должен охватывать наиболее вероятных возбудителей (степень рекомендаций А).
Рекомендуемыми препаратами являются: фторхинолоны с преимущественным выведением почками, ингибиторзащищенные аминопенициллины, цефалоспорины 2-й или 3-й группы или, при необходимости парентеральной терапии, аминогликозиды (уровень доказательности 1b, степень рекомендаций B) [12].
При неэффективности стартовой терапии или в случае клинически тяжелой инфекции следует выбрать антибиотик с более широким спектром, который будет также активен и в отношении Pseudomonas spp. (уровень доказательности 1b, степень рекомендаций B), например фторхинолон (если не использовался для стартовой терапии), ингибиторзащищенный ациламинопенициллин (пиперациллин), цефалоспорин 3b группы или карбапенем с аминогликозидом (уровень доказательности 1b, степень рекомендаций B). Продолжительность лечения обычно составляет 7–14 дней (уровень доказательности 1b, степень рекомендаций A), но иногда может быть увеличена до 21 дня (уровень доказательности 1b, степень рекомендаций A) [8] (табл. 2).
Добиться полного излечения без рецидивов инфекции обычно невозможно до тех пор, пока не будут полностью устранены предрасполагающие факторы. Культуральное исследование мочи следует проводить через 5–9 дней после завершения терапии и затем еще через 4–6 нед. (степень рекомендаций В) [5].
К уропатогенным микроорганизмам, вызывающим более 90 % инфекций мочевыводящих путей, относятся бактерии семейства Enterobacteriaceaе, а также P.aeruginosa, Enterococcus faecalis, Staphylococcus saprophyticus. В то же время такие микроорганизмы, как S.aureus, S.epidermidis, Gardnerella vaginalis, Streptococcus spp., дифтероиды, лактобациллы, анаэробы, практически не вызывают эти инфекции, хотя также колонизуют прямую кишку, влагалище и кожу [9].
Следует подчеркнуть, что внебольничные инфекции мочевыводящих путей в амбулаторной практике и стационаре в подавляющем большинстве случаев вызываются одним микроорганизмом — кишечной палочкой, поэтому определяющими при выборе антибиотика являются его естественная активность в отношении E.coli и в некоторой степени уровень приобретенной резистентности в популяции. В то же время при госпитальных инфекциях возрастает значение других уропатогенных микроорганизмов с непредсказуемым уровнем резистентности (который определяется локальными эпидемиологическими данными) [2].
Таким образом, определяющим фактором возможности применения антибиотика при урогенитальных инфекциях является его активность в отношении доминирующих возбудителей.
Как следует из многоцентровых национальных и международных исследований, уже более 10 лет P.aeruginosa выступает в качестве одного из наиболее частых возбудителей госпитальных инфекций, особенно в отделениях реанимации и интенсивной терапии (ОРИТ) [3]. Частота развития синегнойной инфекции во многом определяется нозологической структурой пациентов, тяжестью их исходного состояния, распространенностью инвазивных процедур, в частности числом больных, нуждающихся в длительной респираторной поддержке, катетеризации мочевого пузыря или проведении длительной инфузионной терапии.
Необходимость обсуждения проблемы антибактериальной терапии инфекций, вызванных данным микроорганизмом, наряду с их высокой распространенностью, связана также с ростом его резистентности практически ко всем используемым в широкой практике антибиотикам, с трудностями эрадикации из тканей и высокой летальностью.
В отличие от подавляющего большинства представителей своего рода синегнойная палочка обладает многочисленными факторами вирулентности. Ее патогенность детерминирована способностью к инвазии и персистенции в тканях, а также к цитотоксическому эффекту и стимуляции генерализованной воспалительной реакции. Факторами, непосредственно влияющими на формирование локального и системного воспаления, являются липополисахарид, экзотоксин S, флагеллин, нитратредуктаза, пиоцианин, фосфолипаза С. Большинство из них инициируют секрецию ключевого провоспалительного медиатора — фактора некроза опухоли, а фосфолипаза способствует и либерации IL-1, IL-6, γ-интерферона из моноцитов, полиморфноядерных нейтрофилов и Т-лимфоцитов [4, 5]. У Р.aeruginosa, как и у других грамотрицательных бактерий, описана система экскреции III типа (своеобразный «молекулярный шприц»), обеспечивающая выведение экзоэнзимов из внутренней среды бактериальной клетки и их транслокацию внутрь эукариотической клетки, непосредственно к мишеням. К веществам, выделяемым данной системой, у синегнойной палочки относятся экзотоксины (ExoS, ExoT, ExoY, ExoU) [6].
Непосредственные внутриклеточные эффекты под действием экзотоксинов заключаются в ингибиции синтеза ДНК, стимуляции апоптоза, изменении клеточной формы, потере способности к локальной адгезии. Доказано, что секреция указанных экзотоксинов сопровождается снижением системного артериального давления и развитием септического шока. Популяции Р.aeruginosa гетерогенны с позиций способности к синтезу и секреции факторов токсичности: различные штаммы этого микроорганизма обладают разной токсичностью [11]. По-видимому, на экспрессию факторов вирулентности оказывают влияние условия внешней среды и процесс индивидуального взаимодействия макроорганизма и бактерий, а также плотность популяции последних.
Одним из механизмов, обусловливающих экспрессию факторов вирулентности, является присущий синегнойной палочке феномен кооперативной чувствительности (quorum sensing). Его суть заключается в модификации физиологических функций бактерий при изменении их численности, в результате продукции внеклеточных сигнальных молекул (аутоиндукторов), их детекции и формирования ответной реакции нового качества. Под контролем данной системы находится синтез всех экзотоксинов, а также образование биопленки. Блокада механизмов реализации феномена кооперативной чувствительности у Р.aeruginosa приводит к выраженному снижению вирулентности.
P.aeruginosa обладает способностью к неспецифической адгезии на имплантируемых устройствах (катетеры, эндотрахеальные трубки и др.). Наряду с этим присутствует и механизм специфической адгезии: молекулы, входящие в состав плазменных белков, являются адгезинами для микроорганизмов. Адгезия возрастает при нарушениях мукоцилиарного транспорта, развивающихся у подавляющего большинства пациентов ОРИТ, в послеоперационном или посттравматическом периодах, при острой сердечной и дыхательной недостаточности, любой дегидратации и во всех случаях проведения искусственной вентиляции легких. В дальнейшем микроколонии бактерий объединяются в сплошную биопленку, которая представляет собой несколько слоев микробных клеток, покрытых общим гликокаликсом (полимер полисахаридной природы). Подавляющее большинство клеток находится в состоянии покоя и характеризуется крайне низкой чувствительностью к воздействию антибиотиков. Периодически возникающие очаги спонтанного размножения являются источником выделения в окружающую среду свободных микробных клеток. Прежде всего данный процесс лежит в основе катетерассоциированных инфекций. Распространение по внеклеточным пространствам обеспечивают секретируемые белки, обладающие ферментативной активностью: протеазы, эластаза, липаза. При любой локализации первичного очага инфекции возможно развитие бактериемии, существенно ухудшающей прогноз болезни [13].
Главная проблема — высокий уровень резистентности P.aeruginosa к большинству доступных антибактериальных препаратов. Одним из препаратов, к которому чувствительна P.aeruginosa, является антибиотик группы аминогликозидов — тобрамицин.
Группа аминогликозидов объединяет родственные по химическому строению, антимикробному спектру, фармакокинетическим свойствам, характеру вызываемых ими побочных явлений антибиотики олигосахаридной (или псевдоолигосахаридной) природы. Общее название «аминогликозиды» обусловлено наличием в их молекуле аминосахаридов, соединенных гликозидной связью. Аминогликозиды характеризуются широким спектром антибактериального действия. Выделяют аминогликозиды I, II и III поколений. К аминогликозидам I поколения относят стрептомицин, неомицин, мономицин, канамицин. Внедрение в практику гентамицина (II поколение) связано с возникновением устойчивых штаммов микроорганизмов к аминогликозидам I поколения и высокой активностью этого препарата в отношении синегнойной палочки.
Аминогликозиды III поколения (тобрамицин, сизомицин, амикацин, дидезоксиканамицин В, нетилмицин и т.д.) созданы в то время, когда были раскрыты молекулярные механизмы резистентности, обнаружены и выделены специфические ферменты, инактивирующие данные антибиотики. Аминогликозиды II и III поколений отличают более высокая антибактериальная активность, более широкий спектр антимикробного действия, и они постепенно вытесняют препараты I поколения из традиционных областей их применения.
По степени убывания силы антимикробного действия аминогликозиды располагаются в следующем порядке: нетилмицин, изомицин, гентамицин, тобрамицин, неомицин, канамицин, мономицин.
Устойчивость к аминогликозидам у клинических штаммов микроорганизмов частично перекрестная. Стрептомицинустойчивые штаммы стафилококков и грамотрицательных микроорганизмов в большинстве случаев чувствительны ко всем другим аминогликозидам. Резистентные к канамицину возбудители чаще всего устойчивы к мономицину, но многие из них чувствительны к неомицину. Микроорганизмы, устойчивые к аминогликозидам I поколения, чувствительны к гентамицину и другим новым аминогликозидам. Однако гентамицин–устойчивые штаммы зачастую резистентны к препаратам I поколения. Аминогликозиды III поколения активны в отношении микроорганизмов, устойчивых к гентамицину.
Резистентность микроорганизмов к аминогликозидам обусловлена их способностью продуцировать специфические ферменты, инактивирующие эти антибиотики. В настоящее время детально изучены и описаны три механизма энзиматической инактивации аминогликозидов: ацетилирование NH2-группы, аденилирование и фосфорилирование OH-группы.
Для всех аминогликозидов характерно избирательное нейро- и нефротоксическое действие, что определяет необходимость четкого обоснования показаний к их назначению, тщательного контроля концентрации в крови, почечной функции и снятия аудиограммы не реже одного раза в неделю. По степени снижения общей токсичности препараты можно расположить следующим образом: сизомицин, гентамицин, тобрамицин, нетилмицин, неомицин, стрептомицин, мономицин, канамицин.
Тобрамицин (тобрацин, тобрамицетин, небцин, обрамицин) по спектру антимикробного действия аналогичен гентамицину. В отношении P.aeruginosa тобрамицин в 2–4 раза эффективнее гентамицина, но уступает ему в активности при действии на стафилококки, клебсиеллу, серрацию и протей [12].
Белками сыворотки крови тобрамицин не связывается. По основным фармакокинетическим характеристикам он похож на гентамицин. При внутримышечном введении хорошо всасывается. Пик концентрации тобрамицина в крови фиксируется через 30 мин — 1 ч. T1/2 равен 2–2,5 ч. При повторных введениях препарата через 8 ч в дозах 25 и 50 мг или по 100 мг через 12 ч кумуляция его в организме не наблюдается. Дозу от 2 до 4–5 мг/кг массы тела вводят 3–4 раза в сутки в течение 7–10 дней.
При внутривенном введении тобрамицина его T1/2 равен 1,5 ч. Пик концентрации при этом составляет не более 12 мкг/мл. Внутривенно капельно вводят 100 мг препарата в течение 1 ч, при этом концентрация его в крови достигает 5 мкг/мл. Через 2 ч после окончания инфузии концентрация снижается до 3,6 мкг/мл.
При нарушении функции почек выведение препарата замедляется, а концентрация его в крови возрастает. При клиренсе креатинина менее 2 мл/мин T1/2 может составлять 56 ч, при 5–10 мл/мин — 20–36 ч. Тобрамицин хорошо проникает в большинство тканей, наибольшее количество его обнаруживается в почках, наименьшее — в тканях мозга. С почками выводится за сутки 90 % препарата в биологически активной форме. При приеме внутрь он не всасывается. При гемодиализе концентрация антибиотика в крови снижается в среднем на 50 %.
Показания к применению тобрамицина те же, что гентамицина. Антибиотик используется как резервный препарат в лечении инфекций, вызванных устойчивыми штаммами P.aeruginosa. При тяжелом течении инфекционного процесса и необходимости немедленного химиотерапевтического вмешательства тобрамицин в комбинации с β-лактамными антибиотиками можно назначать до установления бактериологического диагноза и определения антибиотикограммы возбудителя [3].
Целью нашего исследования была оценка клинической и бактериологической эффективности, а также безопасности препарата Браксон (тобрамицин производства «Юрия-фарм», Украина) при лечении осложненных инфекций мочевых путей у 30 больных в комплексе с другими препаратами патогенетической и симптоматической терапии. Все больные были в возрасте от 18 до 78 лет, преобладали женщины (23 пациентки). В исследование не включали больных, имевших непереносимость аминогликозидов в анамнезе, хроническую почечную недостаточность, а также принимавших антибиотики в течение последнего месяца.
Препарат применялся внутримышечно (в/м) или внутривенно (в/в) капельно. Для в/м применения соответствующую дозу препарата вводили непосредственно из ампулы. При в/в введении раствор разводили в 100–200 мл 0,9% раствора натрия хлорида или 5% раствора глюкозы, вводили в течение 20–60 мин. Разовая доза у взрослых и детей старше 1 года — 1 мг/кг, суточная — 3 мг/кг, максимальная суточная доза — 5 мг/кг.
Посев мочи и антибиотикограмма выполнялись всем больным до приема препарата и после 7 суток его применения. Учитывались возбудители, выделенные из мочи в клинически значимых концентрациях (10 000 КОЕ/мл и выше). Также проводили общие анализы крови и мочи, определение уровня креатинина крови, ультразвуковое исследование (УЗИ) и, по необходимости, компьютерную томографию.
Оценка эффективности лечения основывалась на изучении клинико-лабораторных и микробиологических показателей после 7 суток терапии. Основными клиническими и лабораторными параметрами, характеризующими активность воспалительного процесса, были боль, дизурия, наличие симптомов интоксикации (тахикардия, тошнота, рвота, сухость во рту), температурная реакция, озноб, лабораторные показатели (лейкоцитоз, сдвиг лейкоцитарной формулы влево, повышение скорости оседания эритроцитов (СОЭ), лейкоцитурия, уровень креатинина крови), УЗ-мониторинг почек.
Согласно данным табл. 3 у всех больных были установлены мочевые катетеры, что давало основание предполагать наличие у них госпитальной инфекции.
В результате микробиологического исследования у 30 больных с ОИМП микробный возбудитель выделен и идентифицирован у 25 (83,3 ± 7,0 %) из них. Анализ антибиотикограмм показал, что общее количество чувствительных к тобрамицину штаммов составило 86,7 %. Нечувствительными in vitro оказались по одному штамму Enterobacter, Enterococcus и Pseudomonas.
В табл. 4 и 5 представлены соответственно бактериологические и клинические результаты лечения. Выраженный положительный эффект при терапии препаратом Браксон имел место у 76,7 % больных.
На 2-е — 3-и сутки лечения температура тела снизилась до нормальной или субфебрильной, регрессировали озноб, боль в поясничной области и боковых участках живота, дизурия, симптомы интоксикации. Лабораторный контроль показал значительное улучшение общих анализов крови и мочи, а у отдельных больных — нормализацию показателей уже на 4-е сутки терапии. По результатам контрольного микробиологического исследования наблюдалась стерилизация мочи. При УЗ-мониторинге размеров почек и толщины почечной паренхимы на 7-е сутки зафиксирована положительная динамика с приближением этих показателей к норме (рис. 1).
/20.jpg)
При удовлетворительном результате лечения у 13,3 % больных динамика клинико-лабораторных показателей была минимальной, отдельные симптомы заболевания, изменения лейкограммы, лейкоцитурия сохранялись на момент контрольного обследования. Наблюдалось снижение активности инфекционно-воспалительного процесса при наличии патологических изменений в общем анализе мочи. Отмечалась стерилизация мочи или замена условно-патогенного микроорганизма (рис. 2).
При неудовлетворительном результате лечения у 6,7 % больных сохранялась субфебрильная или фебрильная температура тела. По лабораторным и бактериологическим критериям позитивная динамика также не зафиксирована.
Тошнота и рвота зафиксированы у 3 больных, что могло быть следствием интоксикации. Нет достаточных оснований рассматривать эти явления в качестве побочных эффектов. Незначительные диспепсия и головная боль не требовали отмены препарата. После коррекции диеты жалобы самостоятельно купировались. Клинически значимых изменений лабораторных показателей крови и мочи, связанных с приемом препарата, не наблюдалось. Очень важно, что не зафиксировано нефротоксических и ототоксических проявлений (табл. 6).
/21_2.jpg)
Подводя итог проведенного исследования, следует отметить, что применение препарата Браксон было эффективным у пациентов с осложненными инфекциями мочевых путей, обусловленными наличием мочевых катетеров и присоединением госпитальной инфекции. Некоторым больным до назначения препарата Браксон проводилась антибактериальная терапия, которая оказалась неэффективной. Использование препарата Браксон в условиях монотерапии позволило купировать воспалительный процесс у 93,3 % больных и добиться эрадикации возбудителя у 86,7 % пациентов при отсутствии таких побочных эффектов, которые потребовали бы отмены препарата.
Выводы
1. При клинико-бактериологическом исследовании эффективности применения препарата Браксон у больных с осложненными инфекциями мочевых путей подтверждена целесообразность использования препарата у этой категории больных.
2. Результаты лабораторного исследования антимикробной активности препарата Браксон свидетельствуют о его высокой эффективности (86,7 %) в отношении большинства возбудителей ОИМП.
3. При применении препарата Браксон, наряду со значительной эффективностью у 93,3 % больных, продемонстрирован высокий уровень безопасности у подавляющего числа пациентов, что позволяет рекомендовать его при осложненных инфекциях мочевых путей в качестве монотерапии.
Конфликт интересов: не заявлен.
Рецензенты: информация скрыта.
/20.jpg)
/21.jpg)

/17.jpg)
/18.jpg)
/20_2.jpg)
/21_2.jpg)