Статья опубликована на с. 13-19
Блестящая книга, быстро исчезавшая с прилавков, несмотря на повторные издания [6, 7], не зря называется «Сто лет головной боли»: эта буквальная боль ее жертв остается фигуральной «головной болью» анестезиологов, особенно акушерских. Еще в монографии полувековой давности [34] описано 49 методов лечения постпункционной цефалгии. А проблема остается.
Консервативное лечение
Психологическая поддержка. Даже заранее предупрежденные (а это надо делать всегда) о возможности появления головной боли пациенты воспринимают ее плохо, особенно это касается родильниц, надеявшихся ухаживать за своим долгожданным ребенком. Поэтому, кроме объяснений по поводу высокой вероятности самостоятельного прекращения цефалгии — больше 95 % случаев за полтора месяца (табл. 1), приходится назначать даже не очень эффективное, но безопасное лечение.
Классическая триада — постельный режим, нагрузка жидкостью (выпитой или в инфузиях) и кофеин — давно вызывает сомнения в своей эффективности, о чем говорит уже название статьи авторов из Калифорнии [26]: «Миф: жидкости, постельный режим и кофеин эффективны для профилактики и лечения пациентов с постпункционной головной болью». Зато лечение не обременительно: лежать и пить кофе может каждый, а там и спонтанное выздоровление может наступить (табл. 1).
Постельный режим — логичная мера: пациенты сами принимают самую щадящую позу — лежачую. В течение десятилетий невропатологи после диагностической пункции весьма толстой иглой рекомендовали позу «лежа на животе»: повышенное внутрибрюшное давление и, следовательно, эпидуральное давление должны препятствовать утечке ликвора и облегчать головную боль. Но эта поза явно не комфортна после большинства операций и даже после вагинальных родов. К тому же специальные исследования не подтвердили ее способность ускорить лечение цефалгии [35].
Подвязывание живота или специальный брюшной бандаж по той же причине могут облегчать цефалгию, но слабый бандаж неэффективен, а тугой — неудобен и мало где применяется [35].
Избегание натуживания (усиливающего и дополнительную утечку ликвора, и головную боль) с помощью соответствующей диеты и «стулосмягчающих» таблеток широко признано [3].
Обильное питье (или инфузия при неспособности много пить) также не признано надежным способом лечения цефалгии, хотя и может уменьшить потребность в более агрессивной терапии [35].
Кофеин — ингибитор фосфодиэстеразы цАМФ из группы метилксантинов — является стимулятором центральной нервной системы и суживает церебральные сосуды, чем и объясняют его лечебный эффект при постпункционной головной боли, зависящей от расширения этих сосудов [35]. В последние годы рекомендуемая доза — 300–500 мг per os или внутривенно 1–2 раза в сутки [35]. Для сравнения: в чашке кофе или кофеинсодержащих напитков обычно 35–50 мг кофеина. LD50 для кофеина — около 150 мг/кг, однако даже при терапевтических дозах описаны случаи токсических проявлений со стороны центральной нервной системы (тремор или даже судороги) и сердца (мерцание предсердий). Доказательная база для его применения слаба: все обзоры ссылаются на старое исследование [31], где он был применен у 41 пациента после неэффективности более консервативных мер. Позже у родильниц выявлена эффективность перорального кофеина (300 мг) [18]. Простота, дешевизна и относительная безопасность лечения кофеином и кофеинсодержащими таблетками с ненаркотическими анальгетиками (цитрамон и т.п.) делают его популярным средством первого ряда [1], но после нечаянного дурального прокола при эпидуральном обезболивании родов большинство анестезиологов Северной Америки не применяют кофеин, считая его неэффективным [14].
Теофиллин — еще один метилксантин, подобный кофеину: при назначении per os несколько снижал интенсивность головной боли [12], но не обрел популярности. Эффективен был и применяемый per os габапентин — агонист ГАМКергических рецепторов, применяемый для лечения эпилепсии и нейропатических болей [37].
Суматриптан — агонист 5-HT1D-рецепторов, применяемый подкожно для лечения мигрени и, подобно кофеину, суживающий церебральные сосуды, и внутримышечный адренокортикотропный гормон неоднократно предлагались для лечения постпункционной головной боли, но их эффективность считают не доказанной [12].
Глюкокортикоиды предложены не только для профилактики, но и для лечения постпункционной головной боли. Анестезиологи из Ирана [10] и Бангладеш [9] достигали значительного снижения ее интенсивности назначением внутривенного гидрокортизона по 100 мг каждые 8 часов в течение двух суток (у иранцев первая доза составляла 200 мг).
Оперативное лечение — ушивание дурального отверстия
Хирургическое вмешательство с целью закрыть дуральное отверстие может быть предпринято, если ничто из вышеописанного не помогает [3]. Но обычно оперировать приходится при другой причине головной боли — спонтанной ликворной гипотензии (синдроме Вольфа — Шальтенбранда). Если характерный для этого заболевания дефект оболочек спинного мозга не удается закрыть эпидуральной пломбировкой, даже на нескольких уровнях, может быть выполнено ушивание дефекта [3].
Дефинитивное (окончательное) лечение — пломбировка аутокровью
Механизм эффекта не вполне ясен. Его объясняют, во-первых, «заклеиванием» отверстия в оболочках кровяной «заплаткой», во-вторых, воспалительной реакцией тканей в области этого отверстия.
Объем. Еще Квинке [30] заметил, что после «кровавой» спинальной пункции толстой иглой ликвор вытекает меньше. Позже это же увидел американский хирург Джеймс Гормли [23] и предложил вводить эпидурально 2–3 мл аутокрови для профилактики и лечения головной боли после спинальной анестезии. Он тонкой иглой прокалывал твердую оболочку, вводил субарахноидально 0,9% NaCl (что мгновенно устраняло боль), подтягивал на себя иглу до прекращения аспирации ликвора, то есть в эпидуральное пространство, куда вводил 2 мл аутокрови для образования «заплаты», которая закрывала бы отверстие в оболочках [23]. Англичанин Крофорд (не тот американец, который предложил иглу Крофорда, а однофамилец) рекомендовал более надежный объем — 20 мл [22]. Международное многоцентровое исследование 121 родильницы с сильной головной болью после нечаянного дурального прокола иглами калибра от G16 до G18 и пломбировкой объемами 10, 20 или 30 мл [27] показало, что объем 20 мл лучше всего устраняет боль, а превышение этого объема иногда заставляло прекратить введение из-за боли в спине. Детям рекомендуют объем 0,2–0,3 мл/кг, подросткам — 0,2 мл/кг [3].
Куда попадает аутокровь при пломбировке? Она распространяется в эпидуральном пространстве выше и ниже уровня инъекции.
Когда выполнять? Инвазивность, риск повторной нечаянной дуральной пункции и других (к счастью, редких) осложнений делают логичным поначалу консервативное лечение (постельный режим, нагрузка жидкостью, кофеин, анальгетики). Кроме того, ранняя пломбировка чаще бывает неудачной: при выполнении ее ранее 1-х суток после дуральной пункции она бывает неудачной, а ранее 2-х суток — чаще требует повторной пломбировки из-за рецидива головной боли [3].
Какова эффективность? В первой половине –1970-х эта новая методика, по оценкам тогда еще не избалованных пациентов и врачей, способствовала значительному облегчению головной боли в не менее чем 89 % случаев. В наше время, когда оценивают полное устранение боли или снижение ее интенсивности по визуальной аналоговой шкале, результаты скромнее: после 20 мл аутокрови полное или частичное устранение боли происходит в 73–93 % случаев, полное — в 32–75 % [3]. Но чем позже, тем эффективнее.
На каком уровне вводить? На том же, где была пункция, приведшая к головной боли, или на один позвонок ниже, поскольку кровь, введенная эпидуральной иглой Туи (Tuohy), распространяется больше в краниальном направлении.
Откуда набирать кровь? Ни в коем случае не из давно введенного внутривенного катетера: он почти всегда инфицирован. Поэтому всю процедуру должны выполнять два оператора: первый (сзади от пациента) в строго асептических условиях идентифицирует эпидуральное пространство, затем второй (спереди от пациента) тоже в строго асептичных условиях пунктирует вену, набирает 20 мл крови и передает шприц первому.
Каковы особенности эпидуральной пункции? Эпидуральной набор стандартный, но катетер и бактериальный фильтр не нужны. Местным анестетиком (обычно лидокаином) инфильтрируются кожа и подкожная клетчатка, идентификация эпидурального пространства — минимальным объемом физраствора (чтобы не сильно разводить аутокровь, которая в эпидуральном пространстве должна образовать сгусток).
Что делать, если игла «провалилась» субарахноидально? Извлечь ее и снова ввести на один позвонок ниже [3]. Но тогда вводить кровь особенно медленно, чтобы она через довольно большое отверстие от первой попытки не затекала в подпаутинное пространство.
Каковы особенности венопункции? Идеальная асептика — как при взятии крови на гемокультуру. Протоколы некоторых зарубежных клиник требуют введения остатков крови из шприца в стерильную пробирку на посев.
Какой темп введения аутокрови? Медленный, примерно 1 мл за 3 секунды, в ритме вальса: «раз-два-три — кубик» [3].
Что может ощущать пациент? Лучше заранее попросить сообщать о всех новых ощущениях, чтобы потом непрерывно иметь доверительный речевой контакт. Уже после введения 5–7 мл возможен легкий дискомфорт в пояснице, а при продолжении введения — чувство распирания в пояснице, ягодицах, бедрах или голенях. При нарастании этого ощущения (обычно после 12–15 мл) введение лучше прекратить, если дискомфорта нет — медленно ввести весь объем (обычно 20 мл).
После извлечения эпидуральной иглы быстро наложить асептическую наклейку и уложить больного навзничь (на спину), чтобы введенная кровь скапливалась в заднем эпидуральном пространстве, напротив отверстия. Перевозка в палату осуществляется на каталке в той же позе. В палате больному необходимо лежать в той же позе не менее 2 часов, под колени ему можно подложить валик для уменьшения поясничного лордоза и накопления аутокрови в поясничном отделе.
Инструкция пациентам после пломбировки: в течение 2–3 дней (а мнительным и потому послушным — 2–3 недели) продолжать обильное питье; не напрягаться; стараться не кашлять; не поднимать тяжестей; поднимая легкие предметы с пола, не нагибаться, а приседать. Все это выполняется для того, чтобы пломба не «лопнула» под напором ликвора. Немедленно сообщить анестезиологу о гипертермии, боли в пояснице или ногах, возобновлении головной боли.
Чего ожидать и не пугаться? В большинстве случаев головная боль исчезает сразу, но иногда может угасать постепенно в течение одних суток. До 3–5 дней возможна слабая боль в пояснице, у менее 2 % больных — слабые парестезии, боли в шее, корешковые боли.
Чего бояться? Рецидива головной боли и осложнений (о них будет сказано далее).
Что делать при рецидиве головной боли? Во-первых, не очень удивляться. По данным финских авторов [33], после пломбировки (10–15 мл) отличный первоначальный эффект был достигнут у 91 % пациентов, но постоянный — только у 61 %, 87 % пациентов были довольны ее результатом. Во-вторых, рассмотреть возможность повторной пломбировки через сутки. В австралийском исследовании родильниц с головной болью после нечаянной дуральной пункции толстой эпидуральной иглой [11] первая пломбировка аутокровью (7–25 мл) дала облегчение 95 % женщин, а полное устранение боли отмечалось лишь у 67 %, сильные головные боли вновь возобновились у 31 % пациентов, а повторные пломбировки понадобились 28 % больных.
Профилактическая эпидуральная пломбировка аутокровью предлагалась сразу после нечаянного прокола оболочек эпидуральной иглой, но ее эффективность не доказана [3]. Результаты недавнего кохрейновского обзора 9 исследований (379 пациентов) [16] не выявили эффективности профилактической пломбировки, а боль в спине после нее встречалась чаще. К тому же надо помнить о противопоказаниях и возможных осложнениях.
Противопоказания для эпидуральной пломбировки аутокровью
Из последующего текста будет видно, что эпидуральная пломбировка аутокровью — процедура небезопасная. Поэтому большинство авторов рекомендует ее выполнять не ранее 2-х суток после спинальной пункции, вызвавшей головную боль, а до этого обходиться консервативной терапией (см. выше). То же касается и детей. Однако после нечаянного дурального прокола толстой эпидуральной иглой 81 % акушерских анестезиологов США и Канады выполняет пломбировку ранее 1-х суток после возникновения головной боли, что понятно — трудно ждать эффекта консервативной терапии при большом отверстии в оболочках.
Откладывать пломбировку не стоит и при таких тяжелых последствиях ликворной гипертензии, как параличи из-за натяжения черепных нервов. Хотя наличие неврологических симптомов после спинальной пункции является относительным противопоказанием для эпидуральной пломбировки, очень тяжелая головная боль, неукротимая рвота, признаки натяжения черепных нервов — VI (диплопия) или VIII (потеря слуха) — позволяют пренебречь этим противопоказанием.
Но абсолютными противопоказаниями (теми же, что для эпидуральной анестезии): инфекцией в области предполагаемой пункции, нарушениями гемостаза — пренебрегать нельзя, о чем будет сказано ниже.
Осложнения эпидуральной пломбировки аутокровью
Почти все осложнения обычной эпидуральной блокады возможны и при пломбировке аутокровью (если еще учесть создание нами целенаправленной эпидуральной гематомы, рассматриваемой далее среди других отдаленных осложнений спинальной анестезии), при этом выше риск эпидурального абсцесса. Поэтому нужна настороженность в отношении его признаков: лихорадки, боли в спине и местной болезненности при пальпации. Ведь, в сущности, результат эпидуральной пломбировки — преднамеренная эпидуральная гематома.
При щепетильном отношении к техничности исполнения и асептике осложнения крайне редки, хотя описаны спорадические случаи сильной боли в пояснице и спине, радикулопатии, субдуральной или субарахноидальной гематомы, эпидурального абсцесса, арахноидита, пневмоцефалии, менингизма, параличей черепных нервов, даже тотальной спинальной анестезии [3]. Еще в 1970-х годах американские анестезиологи [8] добились уменьшения проявления постпункционной цефалгии после первой пломбировки у 105 из 118 пациентов, после второй — еще у 10 из 13 остальных (суммарная эффективность — 97,5 %), однако вскоре у одного развился паралич лицевого нерва, а у еще одного — звон в ушах, атаксия и головокружение без головной боли; среди поздних осложнений — боль в пояснице (у 22 чел.) и парестезии (у двоих). Боль в спине отмечается в 35 % случаев, в шее — в 0,9 %, временное увеличение температуры тела (на сутки-двое) — в 5 %. Крайне редкие параличи черепных нервов (в том числе лицевого нерва — описано два случая) объясняют их ишемией из-за повышения ликворного давления после пломбировки. Известны случаи тромбоза церебральных венозных синусов. Описаны также случаи вазовагальных реакций с глубокой брадикардией.
Нечаянный прокол всех оболочек спинного мозга не столь уж редок. Но описан и случай прокола лишь твердой оболочки с введением аутокрови в субдуральную щель.
Обидный для анестезиологов случай произошел в Англии: из-за нечаянной дуральной пункции при эпидуральном обезболивании родов через эпидуральный катетер произвели профилактическую пломбировку, но все равно через 2 суток развилась боль в голове, шее и надплечьях; пломбировку повторили, но эти симптомы только усилились.
Как правило, эпидуральная пломбировка аутокровью не обтурирует эпидуральное пространство и в дальнейшем не препятствует спинальной, эпидуральной или каудальной анестезии. Но бывают и исключения: описано два случая неудачной эпидуральной анестезии из-за фиброза эпидурального пространства вследствие неполной резорбции предшествовавшей «заплаты», в одном из них катетер нечаянно ввели субдурально.
Эпидуральное введение физраствора
Хотя эпидуральная пломбировка аутокровью благодаря своей надежности считается золотым стандартом лечения постпункционной головной боли, она может и не помочь в некоторых случаях, и тогда требуются нестандартные методы. Если эпидуральное введение крови противопоказано или не привело к успеху, возможно введение физиологического раствора, которое предложили еще в 1967 году: по 30–60 мл каждые 6 часов четырехкратно. Позже была предложена более эффективная эпидуральная инфузия физиологического раствора или Рингера лактата в темпе 1–1,5 л за сутки. На сегодняшний день она менее тягостна для пациентов благодаря наличию легких эластомерных инфузионных помп, позволяющих даже ходить. Описана эпидуральная пломбировка физраствором и у 10-летнего ребенка.
Физиологический раствор применяли и интратекально в объеме 10 мл перед извлечением интратекального катетера, вводимого при нечаянном попадании эпидуральной иглы в подпаутинное пространство. Это еще больше снижало частоту головной боли и потребность в пломбировке аутокровью.
Декстраны как замена физраствора для пломбировки не оправданны: как и физраствор, в отличие от крови, они не вызывают воспалительной реакции в эпидуральном пространстве, способствующей закрытию пункционного отверстия. Впрочем, недавно анестезиологи из Франции [36] с успехом применили ГЭК при противопоказаниях к введению аутокрови: в одном случае — из-за бактериемии (Streptococcus agalactiae), в другом — из-за острой лейкемии.
Старинное лечение — внутривенная акватерапия
История внутривенной акватерапии стерильной дистиллированной водой для инъекций при ликворной гипотензии связана с именем знаменитого французского хирурга Рене Лериша, писавшего еще в 1925 году: «Достаточно внутривенной инъекции 40 мл дистиллированной воды для повышения давления ликвора, чтобы эти проблемы исчезли. Я считаю себя не одиноким в этом мнении; распространение лечения инъекцией дистиллированной воды — лучшее тому доказательство» [25]. Этот метод использовался во Франции и после Второй мировой войны: «Лечение состояло из внутривенных инъекций 40–50 мл дистиллированной воды. Результаты были поразительными» [29].
Механизм этого эффекта объяснили эксперименты на котах, выполненные сразу же после Первой мировой войны военными врачами из США [38]. Измеряя давление ликвора через иглу, введенную между атлантом и затылочной костью, они обнаружили, что вскоре после внутривенного введения 30% натрия хлорида это давление снижается, иногда даже ниже атмосферного, а после внутривенного введения стерильной дистиллированной воды это давление быстро и надолго повышается. Непосредственную причину таких изменений обнаружили те же авторы [39], наблюдая за головным мозгом котов сквозь трепанационные отверстия: через несколько минут после введения гипертонического раствора мозг сморщивался, а при внутривенном введении дистиллированной воды уже после первых ее миллилитров мозг набухал.
Метод внутривенной акватерапии по Рене Леришу применялся на Западе еще полвека назад [13], но сейчас забыт. В Украине возрождение внутривенной акватерапии Лериша связано с именем киевского акушерского анестезиолога Руслана Афанасьевича Ткаченко: его методика включает медленное внутривенное введение 0,2–0,25 мл/кг (в среднем 20 мл) стерильной дистиллированной воды для инъекций с последующей инфузией 1,6–2,0 л 0,9% натрия хлорида [4]. В Харькове методика Р.А.Ткаченко успешно используется с 2004 года, обычно для устранения головной боли хватает от одного до трех сеансов (ежедневно). Мы [5] даже пытались использовать ее с профилактической целью, вводя 20 мл дистиллированной воды с последующей инфузией 0,9% натрия хлорида в первые и вторые сутки после операции; была выявлена тенденция к клинически существенному, но статистически незначительному снижению частоты умеренной и тяжелой головной боли (табл. 2). В последнее время для лечения цефалгии мы используем также старый метод Лериша: 40 мл стерильной дистиллированной воды без последующей инфузии.
-vak/17-2.jpg)
Побочные эффекты при быстром введении: тахикардия, жалобы на жжение по ходу вены и общий дискомфорт; при медленном введении дистиллированной воды для инъекций (Aqua pro injectionibus) никаких проявлений мы не наблюдали.
Противопоказание (теоретическое): нарушение ликвородинамики, поскольку мы вызываем набухание головного мозга.
Недостатки внутривенной акватерапии: 1) набухание головного мозга как механизм эффекта (противоположно сморщиванию головного мозга при лечении мочевиной внутричерепной гипертензии); 2) симптоматическое действие (причина — отверстие в оболочках — остается); 3) иногда — необходимость повторных ежедневных сеансов (до трех-четырех).
Преимущество внутривенной акватерапии — значительно меньшая инвазивность по сравнению с более надежной пломбировкой аутокровью: трудно убедить женщину полечить мучительную головную боль после сверхтонкой спинальной иглы значительно более толстой эпидуральной иглой.
Малоинвазивное лечение — блокада крылонебного узла
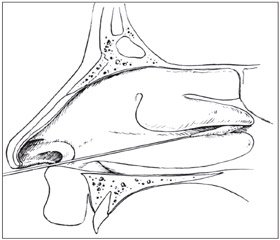
Но есть еще более древний и менее инвазивный способ — блокада крылонебного узла, применяемая с 1908 года [32] для регионального обезболивания [15] и для лечения ряда хронических болевых синдромов [28]. Крылонебный узел (ганглий Меккеля; ganglion pterygopalatinum — по современной терминологии [28], ganglion sphenopalatinum — по старой базельской номенклатуре [32]) может блокироваться уколом через кожу, носовую или ротовую полости [28], а также тампоном, введенным в нос (рис. 1), так как узел находится под слизистой носа на глубине лишь 1–2 мм [24]. Благодаря возможности быстрой диффузии описаны способы его блокады инстилляцией в нос аэрозоля с раствором местного анестетика [24].
Недавно запатентовано специальное устройство (рис. 2) для введения в нос водного раствора бупивакаина или ропивакаина, иногда с добавлением дексаметазона [17].
Лечение постпункционной головной боли блокадой крылонебного узла с помощью носового аппликатора с мазью лидокаина или кремом EMLA на тампоне (рис. 1) проводили в США [19–21]. Эффективность, по данным разных публикаций, — около 70 %. Случаи неэффективности объясняют анатомическими особенностями — более удаленным от слизистой носа расположением крылонебного узла, который изредка может лежать на глубине 7–9 мм [24, 32].
На сегодняшний день мы [2] имеем опыт лишь двух блокад крылонебного узла. У одной женщины, с сильной головной болью через два дня после спинальной анестезии для тотальной гистерэктомии, внутривенная акватерапия по Ткаченко (40 мл воды для инъекций медленно болюсно, затем инфузия 1200 мл 0,9% NaCl) была неэффективной. В каждую ноздрю выполнено по два впрыскивания аэрозольной формы 10% лидокаина. Через 5 минут, приняв вертикальное положение, пациентка отметила значительное облегчение. После очистительной клизмы пациентка продолжала ходить, головная боль была незначительной. На следующее утро головной боли не было, никакого дополнительного лечения не потребовалось.
У другой женщины астенического телосложения, с головной болью через два дня после спинальной анестезии для кесарева сечения, аналогичная блокада лишь незначительно снизила интенсивность боли. После этого боль была устранена внутривенной акватерапией по Ткаченко. Разную эффективность блокады крылонебного узла можно объяснить разной глубиной расположения узла под слизистой оболочкой носа.
Таким образом, благодаря легкости выполнения блокада крылонебного узла путем впрыскивания в нос аэрозоля может стать минимально инвазивным лечением первого выбора при постпункционной цефалгии. При неудаче можно перейти к более надежным способам: внутривенной акватерапии и эпидуральной пломбировке аутокровью.
Список литературы
1. Запорожан В.Н., Тарабрин О.А., Басенко И.Л., Ткаченко Р.А., Буднюк А.А., Бутенко О.Л., Николаев О.К. Спинальная анестезия при оперативном родоразрешении. — К.: Старт, 2013. — 320 с.
2. Настенко О.М., Назаренко Л.Г., Фесенко В.С. Застосування блокади крило-піднебінного вузла для лікування післяпункційного головного болю // Біль, знеболювання і інтенсивна терапія. — 2015. — № 3.
3. Суслов В.В., Фесенко У.А., Фесенко В.С. Спинальная анестезия и аналгезия: руководство для врачей. — Харьков: СИМ, 2013. — 544 с.
4. Ткаченко Р.А. Лечение постпункционных головных болей после регионарных методов обезболивания // Біль, знеболювання і інтенсивна терапія. — 2003. — № 2д. — С. 219-221.
5. Фесенко В.С., Настенко О.М. Застосування методу Ткаченка для профілактики головного болю після спінальної анестезії // Біль, знеболювання, інтенсивна терапія. — 2008. — № 2д. — С. 317-318.
6. Шифман Е.М. Сто лет головной боли. Клиническая физиология постпункционной головной боли. — Петрозаводск: Изд-во ПетрГУ, 1999. — 72 с.
7. Шифман Е.М. Сто лет головной боли. Клиническая физиология постпункционной головной боли: Пособие для врачей. — 2-е изд., испр. — М.: МежЭкспертПресс; Петрозаводск: ИнтелТек, 2004. — 64 с.
8. Abouleish E., de la Vega S., Blendinger I., Tio T. Long-term follow-up of epidural blood patch // Anesth. Analg. — 1975. — Vol. 54, № 4. — P. 459-463.
9. Alam M.R., Rahman M.A., Ershad R. Role of very short-term intravenous hydrocortisone in reducing postdural puncture headache // J. Anaesthesiol. Clin. Pharmacol. — 2012. — Vol. 28, № 2. — P. 190-193.
10. Ashraf M.A., Sadeghi A., Azarbakht Z., Salehi S., Hamediseresht E. Hydrocortisone in post-dural puncture headache // Middle East J. Anesth. — 2007. — Vol. 19, № 2. — P. 415-422.
11. Banks S., Paech M., Gurrin L. An audit of epidural blood patch after accidental dural puncture with a Tuohy needle in obstetric patients // Int. J. Obstet. Anesth. — 2001. — Vol. 10, № 3. — P. 172-176.
12. Basurto Ona X., Martínez García L., Solà I., Bonfill Cosp X. Drug therapy for treating post-dural puncture headache // Cochrane Database Syst. Rev. — 2011. — Vol. 10, № 8. — CD007887.
13. Bell W.E., Joynt R.J., Sahs A.L. Low spinal fluid pressure syndromes // Neurology. — 1960. — Vol. 10. — P. 512-521.
14. Berger C.W., Crosby E.T., Grodecki W. North American survey of the management of dural puncture occuring during labor epidural analgesia // Can. J. Anaesth. — 1998. — Vol. 45, № 2. — P. 110-114.
15. Blatt I.M. Regional anesthesia in otorhinolaryngology // Intern. Anesthesiol. Clin. — 1963. — Vol. 1, № 3. — P. 681-695.
16. Boonmak P., Boonmak S. Epidural blood patching for preventing and treating post-dural puncture headache // Cochrane Database Syst. Rev. — 2010. — № 1. — CD001791.
17. Cady R., Saper J., Dexter K., Manley H.R. A double-blind, placebo-controlled study of repetitive transnasal sphenopalatine ganglion blockade with Tx360 as acute treatment for chronic migraine // Headache. — 2015. — Vol. 55, № 1. — P. 101-116.
18. Camann W.R., Murray R.S., Mushlin P.S., Lambert D.H. Effects of oral caffeine on postdural puncture headache. A double-blind, placebo-controlled trial // Anest. Analg. — 1990. — Vol.70, № 2. — P. 181-184.
19. Cohen S., Trnovski S., Zada Y. A new interest in an old re-medy for headache and backache for our obstetric patients: a sphenopalatine ganglion block // Anaesthesia. — 2001. — Vol. 56, № 6. — P. 606-607.
20. Cohen S., Sakr A., Katyal S., Chopra D. Sphenopalatine ganglion block for postdural puncture headache // Anaesthesia. — 2009. — Vol. 64, № 5. — P. 574-575.
21. Cohen S., Ramos D., Grubb W., Mellender S., Mohiuddin A., Chiricolo A. Sphenopalatine ganglion block: a safer alternative to epidural blood patch for postdural puncture headache // Reg. Anesth. Pain Med. — 2014. — Vol. 39, № 6. — P. 563.
22. Crawford J.S. Experiences with epidural blood patch // –Anaesthesia. — 1980. — Vol. 35, № 5. — P. 513-515.
23. Gormley J.B. Treatment of post-spinal headache // Anesthesio–logy. — 1960. — Vol. 21. — P. 565-566.
24. Kanai A., Suzuki A., Kobayashi M., Hoka S. Intranasal lidocaine 8% spray for second-division trigeminal neuralgia // Br. J. Anaesth. — 2006. — Vol. 97, № 4. — P. 559-563.
25. Leriche R. Spinal anaesthesia // Ann. Surg. — 1925. — Vol. 81, № 1. — P. 38-44.
26. Lin W., Geiderman J. Myth: fluids, bed rest, and caffeine are effective in preventing and treating patients with post-lumbar puncture headache // West. J. Med. — 2002. — Vol. 176, № 1. — P. 69-70.
27. Paech M.J., Doherty D.A., Christmas T., Wong C.A. The volume of blood for epidural blood patch in obstetrics: a randomized, blinded clinical trial // Anesth. Analg. — 2011. — Vol. 113, № 1. — P. 126-133.
28. Piagkou M., Demesticha T., Troupis T., Vlasis K., Skandalakis P., Makri A., Mazarakis A., Lappas D., Piagkos G., Johnson E.O. The pterygopalatine ganglion and its role in various pain syndromes: from anatomy to clinical practice // Pain Pract. — 2012. — Vol. 12, № 5. — P. 399-412.
29. Puech P., Leriche R. et al. Discussion on intracranial hypotension // Proc. R. Soc. Med. — 1948. — Vol. 41, № 11. — P. 771-776.
30. Quincke H.I. Die Lumbalpunktion des Hydrocephalus // Berl. Klin. Wochenschr. — 1891. — Bd. 28. — S. 929-933.
31. Sechzer P.H., Abel L. Post-spinal anesthesia headache treated with caffeine: evaluation with demand method — part I // Curr. Ther. Res. — 1978. — Vol. 24. — P. 307-312.
32. Sluder G. The anatomical and clinical relations of the sphenopalatine ganglion to the nose // N. Y. State J. Med. — 1909. — Vol. 90. — P. 293-298.
33. Taivainen T., Pitkanen M., Tuominen M., Rosenberg P.H. Efficacy of epidural blood patch for post-dural headache // Acta Anaesthesiol. Scand. — 1993. — Vol. 37, № 7. — P. 702-705.
34. Tourtellotte W.W., Haerer A.F., Heller G.L., Somers J.E. Post-Lumbar Puncture Headaches. — Springfield (Ill.): Charles C. Thomas Publisher Ltd., 1964.
35. Turnbull D.K., Shepherd D.B. Post-dural puncture headache: pathogenesis, prevention and treatment // Br. J. Anaesth. — 2003. — Vol. 91, № 5. — P. 718-729.
36. Vassal O., Baud M.C., Bolandard F., Bonnin M., Vielle E., Bazin J.E., Chassard D. Epidural injection of hydroxyethyl starch for the management of obstetric postdural puncture headache // Int. J. Obstet. Anesth. — 2013. — Vol. 22, № 2. — P. 153-155.
37. Wagner Y., Storr F., Cope S. Gabapentin in the treatment of post-dural puncture headache: a case series // Anaesth. Intensive Care. — 2012. — Vol. 40, № 4. — P. 714-718.
38. Weed L.H., McKibben P.S. Pressure changes in the cerebro-spinal fluid following intravenous injection of solutions of various concentrations // Am. J. Physiol. — 1919. — Vol. 48, № 4. — P. 512-530.
39. Weed L.H., McKibben P.S. Experimental alteration of brain bulk // Am. J. Physiol. — 1919. — Vol. 48, № 4. — P. 531-558.

-vak/13-1.jpg)
-vak/17-2.jpg)
-vak/17-1.jpg)
-vak/18-1.jpg)