Резюме
Регіонарна анестезія є важливим методом анестезіологічного забезпечення в дітей, проте різні методики можуть розрізнятися профілем безпеки.
Мета: вивчити частоту виникнення та характер небажаних явищ і ускладнень при різних видах блокад передньої черевної стінки в дітей.
Матеріали та методи. Досліджено 156 пацієнтів, яким виконано поверхневі операції на передній черевній стінці в умовах анестезії пропофолом у поєднанні з однією з регіонарних методик (каудальна анестезія (n = 28), тораколюмбальна паравертебральна блокада (n = 49), блокада поперечного простору живота (n = 49), блокада клубово-підчеревного та клубово-пахвинного нервів (n = 39) 0,25% розчином бупівакаїну). Вивчалися частота виникнення та характер небажаних явищ і ускладнень регіонарних блоків.
Результати. Спостерігались такі небажані явища та ускладнення, як аспірація крові, аспірація ліквору, необхідність повторного виконання блокади, виконання блокади не з першої спроби, депресія дихання, нудота/блювання, затримка сечовипускання, продовжений моторний блок. Найбільша кількість ускладнень спостерігалась у групі каудальної анестезії.
Висновки. Периферичні регіонарні блокади передньої черевної стінки у дітей мають вищий рівень безпеки та супроводжуються меншою кількістю ускладнень порівняно з каудальною анестезією.
Регионарная анестезия является важным методом анестезиологического обеспечения у детей, однако различные методики могут различаться профилем безопасности.
Цель: изучить частоту возникновения и характер нежелательных явлений и осложнений при различных видах блокад передней брюшной стенки у детей.
Материалы и методы. Исследовано 156 пациентов, которым выполнены поверхностные операции на передней брюшной стенке в условиях анестезии пропофолом в комбинации с одной из регионарных методик (каудальная анестезия (n = 28), тораколюмбальная паравертебральная блокада (n = 49), блокада поперечного пространства живота (n = 49), блокада подвздошно-подчревного и подвздошно-пахового нервов (n = 39) 0,25% раствором бупивакаина). Изучались частота возникновения и характер нежелательных явлений и осложнений регионарных блоков.
Результаты. Наблюдались такие нежелательные явления и осложнения, как аспирация крови, аспирация ликвора, необходимость повторного выполнения блокады, выполнение блокады не с первой попытки, депрессия дыхания, тошнота/рвота, задержка мочеиспускания, продленный моторный блок. Наибольшее количество осложнений наблюдалась в группе каудальной анестезии.
Выводы. Периферические регионарные блокады передней брюшной стенки у детей имеют более высокий уровень безопасности и сопровождаются меньшим количеством осложнений по сравнению с каудальной анестезией.
Regional anesthesia is the important method of anesthetic management in children, but different techniques may have different safety profile.
Objective: to study the incidence and nature of adverse events and complications in different types of regional anterior abdominal wall blocks in children.
Materials and methods. The study included 156 patients who underwent open surgeries on anterior abdominal wall under propofol-based anesthesia in combination with one of the regional techniques (caudal anesthesia (n = 28), thoracolumbar paravertebral block (n = 49), transversus abdominis plane block (n = 49), iliohypogastric and ilioinguinal nerve block (n = 39) with 0.25% bupivacaine). Incidence and nature of adverse events and complications of regional blocks were studied.
Results. We have detected such adverse events and complications, as blood aspiration, cerebrospinal fluid aspiration, need to redo block, more than one attempt to do block, respiratory depression, nausea/vomiting, urinary retention, prolonged motor block. The incidence of complications was highest in the group of caudal anesthesia.
Conclusions. Peripheral regional anterior abdominal wall blocks in children have better safety profile and are associated with lower incidence of complications compared to caudal anesthesia.
Статтю опубліковано на с. 119-124
Вступ
Регіонарна анестезія дедалі частіше використовується у дітей для забезпечення інтраопераційної та післяопераційної аналгезії [3, 21]. Регіонарна анестезія дозволяє знизити потребу в опіоїдних анальгетиках як в інтра-, так і в післяопераційному періоді, забезпечити комфортний перебіг післяопераційного періоду, а також знизити частоту небажаних ефектів, пов’язаних із використанням опіоїдних анальгетиків [3, 11, 22]. На думку низки авторів, регіонарна анестезія має бути застосована у всіх випадках обов’язково, коли для неї немає протипоказань [3]. За даними літератури, загальна кількість ускладнень від регіонарних методів знеболювання в дітей є низькою [21], проте деякі епідеміологічні дослідження свідчать про вищий рівень безпеки периферичних блокад порівняно з нейроаксіальними [7, 14, 25].
Мета: вивчити частоту виникнення й характер небажаних явищ та ускладнень при проведенні різних видів регіонарної анестезії передньої черевної стінки в дітей.
Матеріали та методи
У дослідження було включено 165 дітей, госпіталізованих у КЗ ЛОР «ЛОДКЛ «ОХМАТДИТ», віком від 1 місяця до 5 років, якім виконувались поверхневі хірургічні втручання на передній черевній стінці. Хірургічні втручання виконувались з приводу пахових гриж, водянок яєчка та крипторхізму. Спектр оперативних втручань у групах не відрізнявся. Перед включенням у дослідження в батьків була отримана інформована згода на участь дитини в ньому. Фізичний статус дітей відповідав 1–2-му класу за ASA. Усім дітям за 10–15 хвилин до надходження в операційну виконувалась внутрішньом’язова премедикація кетаміном (5 мг/кг) з атропіном (30 мкг/кг).
В операційній після катетеризації периферичної вени проводилась внутрішньовенна індукція та тотальна внутрішньовенна анестезія пропофолом (болюс 2,5 мг/кг та інфузія 6 мг/кг/год відповідно). Після налагодження інфузії пропофолу виконувалась одна з методик регіонарної анестезії. Залежно від техніки регіонарної анестезії діти були розподілені на 4 групи (табл. 1).
-vak/38-1.jpg)
Каудальна анестезія виконувалась у положенні дитини на боці за анатомічними орієнтирами [8]. Тораколюмбальна паравертебральна блокада виконувалась на рівні Th12-L1 ізольованою голкою для електростимуляції Stimuplex A G22 50 мм (B. Braun Melsungen AG, Melsungen, Germany). Ідентифікація паравертебрального простору здійснювалась за допомогою електростимуляції пристроєм Stimuplex HNS-12 (B. Braun Melsungen AG, Melsungen, Germany) та полягала в отриманні рухової відповіді з м’язів передньої черевної стінки при силі струму 0,4 мA [17, 18]. Блокада поперечного простору живота (TAP-блок) та блокада клубово-підчеревного та клубово-пахвинного нервів виконувались під контролем ультрасонографії за допомогою голки для спінальної анестезії типу Quincke 22 G 50 мм (Becton-Dickinson, New Jersey, USA) та ультразвукового сканера SonoSite Titan (SonoSite Inc., Washington, USA) з лінійним датчиком з частотою 5–10 МГц. Візуалізація голки проводилась у площині датчика (in-plane). У випадку TAP-блоку розчин місцевого анестетика вводився між внутрішнім косим та поперечним м’язами живота по аксилярній лінії [10]. При виконанні блокади клубово-підчеревного та клубово-пахвинного нервів розчин місцевого анестетика вводився між внутрішнім косим та поперечним м’язами живота в паховій ділянці [27]. У всіх випадках перед введенням розчину місцевого анестетика проводилась аспіраційна проба.
Через 20 хвилин після виконання регіонарної блокади хірургом проводився розріз шкіри. При наявності рухової відповіді або гемодинамічної реакції на розріз у схему анестезії додавався фентаніл, що титрувався по 1 мкг/кг. Після завершення операції діти транспортувались у палату пробудження. Після виконання критеріїв переводу з палати пробудження [6] діти переводились у палати під спостереження батьків.
Небажані явища та ускладнення реєструвались під час проведення блокади, в інтраопераційному періоді та в першу добу післяопераційного періоду. Небажане явище визначалось як будь-яка несприятлива зміна в стані здоров’я пацієнта, який отримував регіонарну анестезію, незалежно від причинного зв’язку з цією інтервенцією. Ускладнення визначалось як небажане явище, у якого спостерігався причинний зв’язок з інтервенцією [2].
Депресія дихання реєструвалась за наявності однієї з таких ознак, як брадипное, зниження сатурації крові до 90 % та нижче та необхідність інгаляції кисню, обструкція верхніх дихальних шляхів, що вимагала інтервенції (підтримання прохідності дихальних шляхів за допомогою виведення щелепи або за допомогою пристроїв) [12, 19]. Затримка сечі визначалася як відсутність сечовипускання у дитини в перші 12 годин після оперативного втручання [4, 13]. Продовжений моторний блок в нижніх кінцівках відзначався при оцінці дитини понад 0 балів за модифікованою шкалою Bromage більше ніж через 12 годин після операції [5]. У решті випадків реєструвалась кількість епізодів небажаних явищ або ускладнень. Обчислювався відсоток епізодів небажаних явищ або ускладнень від загальної кількості регіонарних анестезій.
Статистична обробка даних була виконана в програмі Statistica 8.0 (StatSoft Inc., Tulsa, США) та полягала у визначенні середнього значення (M) та стандартної помилки (m) величин. Значущість різниць середніх значень між групами обчислювалася за допомогою критерію Стьюдента та виражалася у вигляді величини P. Значущість різниці між групами за кількістю епізодів небажаних явищ та ускладнень обчислювалася за допомогою точного критерію Фішера й також виражалась у вигляді величини P.
Результати та обговорення
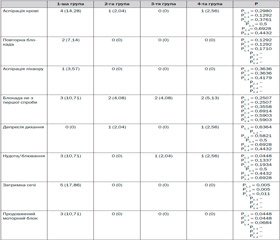
Небажані явища та ускладнення зустрічались у групах з різною частотою. Під час проведення блокади були зареєстровані такі: аспірація крові, аспірація ліквору, необхідність повторного виконання блокади (унаслідок аспірації крові або ліквору), виконання блокади не з першої спроби. У післяопераційному періоді спостерігались такі явища, як депресія дихання, нудота/блювання, затримка сечовипускання, продовжений моторний блок. Кількість та характер небажаних явищ та ускладнень подані в табл. 2.
-vak/39-1.jpg)
Аспірація крові під час аспіраційної проби трапилась у 4 випадках (14,28 %) у групі каудальної анестезії, що було частіше, ніж в групах паравертебральної блокади, TAP-блоку та блокади клубово-підчеревного та клубово-пахвинного нервів (1, 0 та 1 випадок — 2,04; 0 та 2,56 % відповідно), але різниця між групами не досягла статистичної значущості (P = 0,1292–0,6928). У 2 випадках (17,86 %) у групі каудальної анестезії це призвело до необхідності виконати блокаду повторно з нового уколу. У решті випадків було достатньо незначно змінити положення або глибину введення голки. У групах паравертебральної блокади, TAP-блоку та блокади клубово-підчеревного та клубово-пахвинного нервів частота позитивної аспіраційної проби була низькою, не відрізнялась між групами та не вимагала проведення блокади повторно. В одному з епідеміологічних досліджень регіонарної анестезії в дітей [21] зазначається, що частота пункції судини при проведенні каудальної анестезії становить 38 випадків на 6011 каудальних анестезій (0,632 %). Ці дані також збігаються з результатами аналізу Suresh et al., згідно з яким частота аспірації крові при проведенні каудальної анестезії становить 0,5–0,8 % [26]. В іншому дослідженні [7] автори також відмічають позитивну аспіраційну пробу серед ускладнень, характерних для нейроаксіальних блокад, однак не зазначають її поширеність. Вища частота позитивної аспіраційної проби в нашому дослідженні, можливо, пояснюється похибкою, пов’язаною з суттєво нижчою кількістю включених в наше дослідження пацієнтів. Більша частота пункції судини в групі каудальної анестезії може бути пояснена високим ступенем васкуляризації епідурального простору, зокрема в дітей [16].
При проведенні каудальної анестезії в одному випадку (3,57 %) була зареєстрована пункція суб-арахноїдального простору та аспірація ліквору під час аспіраційної проби, проте різниця між групами не досягла статистичної значущості (P = 0,3636–0,4179). У дослідженні Polaner et al. [21] описано 5 випадків пункції субарахноїдального простору на 6011 каудальних анестезій, що становить 0,083 %. Така ж цифра зазначена в роботі Suresh et al. [26]. У нашому дослідженні ця цифра значно вища, однак це може бути пояснено різницею в кількості включених у дослідження пацієнтів. Положення дурального мішка є тим нижчим, чим меншим є вік пацієнта (S4 у новонародженого, S2 у дитини 1 року) [9], тому в новонароджених та немовлят ризик пункції субарахноїдального простору є вищим.
Неможливість виконати блокаду з першої спроби є ще одним ускладненням при проведенні регіонарної анестезії. Частота такого ускладнення в 1, 2, 3 та 4-й групах становила 3 (10,71 %), 2 (4,08 %), 2 (4,08 %) та 2 (5,13 %) відповідно та не відрізнялась між групами (P = 0,2507–0,6914).
Також групи не відрізнялись між собою за частотою виникнення післяопераційної депресії дихання (0 (0 %), 1 (2,04 %), 0 (0 %) та 1 (2,56 %) відповідно (P = 0,4432–0,6928)).
Післяопераційні нудота та блювання частіше спостерігались у групі каудальної анестезії порівняно з групами периферичних блокад (3 (10,71 %), 0 (0 %), 1 (2,04 %) та 1 (2,56 %) відповідно). Різниця за даним показником виявилася статистично значущою тільки між групою каудальної анестезії та групою паравертебральної блокади (P = 0,0448). Між решта групами різниця була незначущою (P = 0,1337–0,6928). Цей факт може бути пояснений тим, що тривалість післяопераційної аналгезії після каудальної блокади зазвичай менша порівняно з периферичними блокадами, тому діти групи каудальної анестезії в післяопераційному періоді могли отримувати більшу кількість опіоїдних аналгетиків, що могло впливати на частоту нудоти та блювання [1].
Група каудальної анестезії статистично значуще (P = 0,005–0,011) відрізнялась від груп периферичних блокад за таким ускладненням, як затримка сечі. Затримка сечі була зареєстрована в 5 пацієнтів з групи каудальної анестезії та не була відзначена в жодного пацієнта з групи периферичних блокад. Пацієнти каудальної групи мали перше спонтанне сечовипускання в середньому через 369,80 ± 37,29 хв на відміну від груп периферичних блокад, у яких у пацієнтів перше сечовипускання відбувалося через 180,88 ± 10,28 хв, 183,90 ± 10,39 хв та 192,13 ± 13,63 хв відповідно (P = 0,00000005–0,0000048). Групи периферичних блокад за даним показником не відрізнялись (P = 0,5093–0,8368). Максимальний час до першого сечовипускання в групі каудальної анестезії становив 820 хв. Затримка сечі на фоні нейроаксіальних блокад описана в літературі [16]. Однак стосовно дітей та немовлят у дослідників існують протиріччя. Низка авторів вважають клінічно значущим факт затримки сечі після каудальної анестезії та вважають корисним йому запобігати, особливо в умовах амбулаторної анестезії [15, 25]. У той же час, за даними інших дослідників, каудальна анестезія не викликає клінічно вираженої затримки сечі та не відрізняється за даним показником від периферичних блокад [20, 24].
Продовжений моторний блок в нижніх кінцівках після операції виник у 3 пацієнтів (10,71 %) у групі каудальної анестезії. У групах периферичних блокад випадків післяопераційного моторного блоку нижніх кінцівок зареєстровано не було. За даним показником група каудальної анестезії статистично значуще відрізнялась від груп паравертебральної блокади та TAP-блоку (P = 0,0448). Порівняно з групою блокади клубово-підчеревного та клубово-пахвинного нервів різниця не була статистично значущою (P = 0,0684). Результати нашого дослідження збігаються з літературними даними, що свідчать про небезпеку розвитку післяопераційного моторного блоку після каудальної анестезії в дітей [24, 25]. Незважаючи на використання розчину місцевого анестетика низької концентрації, розвиток моторного блоку можливий та більш імовірний у дітей раннього віку внаслідок незрілості нервової системи та недостатньої мієлінізації нервових волокон у даній віковій категорії [16].
Сумарна кількість небажаних явищ та ускладнень в групах показана в табл. 3.
Зареєстровані в нашому дослідженні небажані явища та ускладнення не потребували лікування (крім забезпечення прохідності дихальних шляхів у випадках депресії дихання), не мали короткотривалих та довготривалих наслідків для здоров’я дітей, не призвели до збільшення терміну госпіталізації або смерті.
У нашому дослідженні не спостерігались інші описані в літературі небажані явища та ускладнення з боку серцево-судинної системи (брадикардія, гіпотензія), з боку нервової системи (судоми, неврологічний дефіцит внаслідок пошкодження нервових структур), а також системна токсичність місцевих анестетиків, помилки, пов’язані з маркуванням або введенням медикаментозних препаратів.
Більшу загальну кількість ускладнень під час проведення регіонарної анестезії передньої черевної стінки в дітей у нашому дослідженні порівняно з даними літератури [7, 21] можна пояснити тим, що в указаних роботах не враховувались такі післяопераційні небажані явища та ускладнення, як післяопераційні нудота/блювання, післяопераційна затримка сечі та продовжений моторний блок. Крім того, кількість пацієнтів, включених в наше дослідження, була суттєво меншою, що могло впливати на похибку.
Проте результати нашого дослідження підтверджують загальну тенденцію, що наявна в сучасних епідеміологічних дослідженнях регіонарної анестезії у дітей та полягає в твердженні, що периферичним регіонарним блокадам притаманний вищий рівень безпеки та менша кількість ускладнень порівняно з центральними блокадами [7, 14, 25, 26].
Висновки
Периферичні регіонарні блокади передньої черевної стінки в дітей мають вищий рівень безпеки та супроводжуються меншою кількістю ускладнень порівняно з каудальною анестезією.
Список литературы
1. Альбокрінов А.А. Аналгетична ефективність різних видів блокад передньої черевної стінки у дітей / А.А. Альбокрінов // Хірургія України. — 2015. — № 2(54). — С. 24-28.
2. Основы доказательной медицины. Учебное пособие для системы послевузовского и дополнительного профессионального образования врачей / Под общей редакцией академика РАМН, профессора Р.Г. Оганова. — М.: Силицея-Полиграф, 2010. — 136 с.
3. Boretsky K.R. Regional anesthesia in pediatrics: marching forward // Curr. Opin. Anaesthesiol. — 2014 Oct. — 27(5). — 556-60. doi:10.1097/ACO.0000000000000106.
4. Carsi B., Gould A., Clarke N.M. Bladder control increases the incidence of urinary retention after epidural analgesia after paediatric orthopaedic surgery // Br. J. Anaesth. — 2012 Aug. — 109(2). — 294-5. doi:10.1093/bja/aes244.
5. Chipde S., Banjare M., Arora K., Saraswat M. Prospective randomized controlled comparison of caudal bupivacaine and ropivacaine in pediatric patients // Ann. Med. Health Sci. Res. — 2014 Jul. — 4(Suppl. 2). — S115-8. doi:10.4103/2141-9248.138025.
6. Coté C.J. Coté and Lerman’s a Practice of Anesthesia for Infants and Children. — 5th ed. — Philadelphia, PA: Elsevier/Saunders, 2013. — 990 р.
7. Ecoffey C., Lacroix F., Giaufré E., Orliaguet G., Courrè-ges P. Epidemiology and morbidity of regional anesthesia in children: a follow-up one-year prospective survey of the French-Language Society of Paediatric Anaesthesiologists (ADARPEF) // Paediatr. Anaesth. — 2010 Dec. — 20(12). — 1061-9. doi:10.1111/j.1460-9592.2010.03448.x.
8. Gregory A., Andropoulos D.B. Gregory’s Pediatric Anesthesia. — Chichester, West Sussex: Wiley-Blackwell, 2012.
9. Hadzic A. Textbook of Regional Anesthesia and Acute Pain Management. — New York: McGraw-Hill, Medical Pub. Division, 2007. — Chapter 54. Regional Anesthesia in Pediatric Patients.
10. Hebbard P., Fujiwara Y., Shibata Y., Royse C. Ultrasound-guided transversus abdominis plane (TAP) block // Anaesth. Intensive Care. — 2007 Aug. — 35(4). — 616-7. PubMed PMID:18020088.
11. Jöhr M. Practical pediatric regional anesthesia // Curr. Opin. Anaesthesiol. — 2013 Jun. — 26(3). — 327-32. doi:10.1097/ACO.0b013e3283606a1e.
12. Ko S., Goldstein D.H., VanDenKerkhof E.G. Definitions of «respiratory depression» with intrathecal morphine postoperative anal-gesia: a review of the literature // Can. J. Anaesth. — 2003 Aug-Sep. — 50 (7). — 679-88. doi:10.1007/BF03018710.
13. Koomen E., Janssen S., Anderson B.J. Use of ultrasound bladder monitoring in children after caudal anaesthesia // Paediatr. -Anaesth. — 2002 Oct. — 12(8). — 738-41. PubMed PMID:12472714.
14. Lacroix F. Epidemiology and morbidity of regional anaesthesia in children // Curr. Opin. Anaesthesiol. — 2008 Jun. — 21. — 345-9. doi:10.1097/ACO.0b013e3282ffabc5.
15. Metzelder M.L., Kuebler J.F., Glueer S., Suempelmann R., Ure B.M., Petersen C. Penile block is associated with less urinary retention than caudal anesthesia in distal hypospadia repair in children // World J. Urol. — 2010 Feb. — 28(1). — 87-91. doi:10.1007/s00345-009-0420-2.
16. Miller’s anesthesia / N. Cohen, R. Miller, L. Eriksson, L. Fleisher, J. Wiener-Kronish, W. Young. — Philadelphia: Elsevier/Saunders, 2015.
17. Naja Z.M., Raf M., El-Rajab M., Ziade F.M., Al Tannir M.A., Lönnqvist P.A. Nerve stimulator-guided paravertebral blockade combined with sevoflurane sedation versus general anesthesia with syste-mic analgesia for postherniorrhaphy pain relief in children: a prospective randomized trial // Anesthesiology. — 2005 Sep. — 103(3). — 600-5. PubMed PMID:16129986.
18. Naja Z.M., Raf M., El-Rajab M., Daoud N., Ziade F.M., Al-Tannir M.A., Lönnqvist P.A. A comparison of nerve stimulator guided paravertebral block and ilio-inguinal nerve block for analgesia after inguinal herniorrhaphy in children // Anaesthesia. — 2006 Nov. — 61(11). — 1064-8. PubMed PMID:17042844.
19. Niesters M., Overdyk F., Smith T., Aarts L., Dahan A. Opioid-induced respiratory depression in paediatrics: a review of case reports // Br. J. Anaesth. — 2013 Feb. — 110(2). — 175-82. doi:10.1093/bja/aes447.
20. Pappas A.L., Sukhani R., Hatch D. Caudal anesthesia and urinary retention in ambulatory surgery // Anesth. Analg. — 1997 Sep. — 85(3). — 706. PubMed PMID:9296439.
21. Polaner D.M., Taenzer A.H., Walker B.J., Bosenberg A., Krane E.J., Suresh S., Wolf C., Martin L.D. Pediatric Regional Anesthesia Network (PRAN): a multi-institutional study of the use and incidence of complications of pediatric regional anesthesia // Anesth. Analg. — 2012 Dec. — 115(6). — 1353-64. doi:10.1213/ANE.0b013e31825d9f4b.
22. Rigg J.R., Jamrozik K., Myles P.S., Silbert B.S., Peyton P.J., Parsons R.W., Collins K.S.; MASTER Anaethesia Trial Study Group. Epidural anaesthesia and analgesia and outcome of major surgery: a randomised trial // Lancet. — 2002 Apr 13. — 359(9314). — 1276-82. PubMed PMID:11965272.
23. Schultz-Machata A.M., Weiss M., Becke K. What’s new in pediatric acute pain therapy? // Curr. Opin. Anaesthesiol. — 2014 Jun. — 27(3). — 316-22. doi:10.1097/ACO.0000000000000074.
24. Seyedhejazi M., Sheikhzadeh D., Adrang Z., Rashed F.K. Comparing the analgesic effect of caudal and ilioinguinal iliohypogastric nerve blockade using bupivacaine-clonidine in inguinal surge-ries in children 2–7 years old // Afr. J. Paediatr. Surg. — 2014 Apr-Jun. — 11(2). — 166-9. doi:10.4103/0189-6725.132821.
25. Shanthanna H., Singh B., Guyatt G. A systematic review and meta-analysis of caudal block as compared to noncaudal regional techniques for inguinal surgeries in children // Biomed. Res. Int. — 2014. — 2014. — 890626. doi:10.1155/2014/890626.
26. Suresh S., Long J., Birmingham P.K., De Oliveira G.S. Jr. Are caudal blocks for pain control safe in children? an analysis of 18,650 caudal blocks from the Pediatric Regional Anesthesia Network (PRAN) database // Anesth. Analg. — 2015 Jan. — 120(1). — 151-6. doi:10.1213/ANE.0000000000000446.
27. Yarwood J., Berrill A. Nerve blocks of the anterior abdominal wall // Continuing Education in Anaesthesia, Critical Care and Pain. 2010;10:182–186. doi:10.1093/bjaceaccp/mkq035.

-vak/38-1.jpg)
-vak/39-1.jpg)
-vak/40-1.jpg)