Международный эндокринологический журнал 6 (70) 2015
Вернуться к номеру
Использование альфа-липоевой кислоты и бенфотиамина для коррекции нарушений моторно-эвакуаторной функции желудка у больных сахарным диабетом 1-го типа
Авторы: Костицкая И.А. - ГВУЗ «Ивано-Франковский национальный медицинский университет»
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Проведено оцінку ефективності препаратів α-ліпоєвої кислоти й бенфотіаміну при лікуванні симптомів гастропарезу у хворих на цукровий діабет 1-го типу. Визначені патогенетичні взаємозв’язки між зростанням концентрації периферичного мієлінового білка й зниженням моторно-евакуаторної функції шлунка. Отримані результати тримісячного курсу патогенетичної терапії свідчать про ефективність комбінованої терапії, яка не пов’язана з покращанням компенсації вуглеводного й ліпідного обміну, а є наслідком безпосереднього впливу препаратів на досліджені ланки метаболізму й відновлення мієлінізації нервових волокон.
Проведена оценка эффективности препаратов α-липоевой кислоты и бенфотиамина при лечении симптомов гастропареза у больных сахарным диабетом 1-го типа. Определены патогенетические взаимосвязи между повышением концентрации периферического миелинового белка и снижением моторно-эвакуаторной функции желудка. Полученные результаты трехмесячного курса патогенетической терапии свидетельствуют об эффективности комбинированной терапии, которая не связана с улучшением компенсации углеводного и липидного обмена, а является следствием непосредственного влияния препаратов на исследованные звенья метаболизма и восстановления миелинизации нервных волокон.
The therapeutic effectiveness of α-lipoic acid and benfotiamine in treating symptoms of gastroparesis in type 1 diabetic patients was evaluated. Pathogenetic correlations between increased concentration of peripheral myelin protein and a decrease in the gastric motor-evacuation function were determined. The results of a three-month course of pathogenetic therapy demonstrate the effectiveness of combination therapy which is not associated with an improved compensation of carbohydrate and lipid metabolism. It is a result of the direct effect of preparations on the investigated metabolic processes and restoration of myelination of the nerve fibers.
діабетичний гастропарез, периферичний мієліновий білок, α-ліпоєва кислота, бенфотіамін.
диабетический гастропарез, периферический миелиновый белок, α-липоевая кислота, бенфотиамин.
diabetic gastroparesis, peripheral myelin protein, α-lipoic acid, benfotiamine.
Статтю опубліковано на с. 19-23
На сьогодні відсутні фактичні дані про поширеність діабетичного гастропарезу (ДГ), якому не приділяють достатньої уваги лікарі-клініцисти, що зумовлено тяжкістю ранньої діагностики у зв’язку з його перебігом під масками інших нозологічних одиниць, а також відмінностями в методології проведення досліджень моторно-евакуаторної функції (МЕФ) шлунка у хворих на цукровий діабет (ЦД) [2, 6–8, 17]. Вважають, що прогресування уражень периферичних і вегетативних нервових закінчень є одним із потенційно загрозливих для життя хронічних ускладнень цукрового діабету. Діабетична автономна нейропатія шлунка характеризується дисфункцією блукаючого нерва й нервових закінчень, що іннервують шлунок та його кровоносні судини з розвитком симптомів функціональної диспепсії. За результатами багатьох наукових досліджень, симптоми гастропарезу у хворих на ЦД не є рідкісним явищем: 25–60 % обстежених відзначають у себе принаймні один симптом [8–10, 13]. Третина пацієнтів демонструє поєднання декількох проявів одночасно, а саме відчуття переповнення, швидкого насичення після прийому їжі, тяжкість/дискомфорт в епігастральній ділянці, для тяжкого перебігу характерні зригування, блювота фонтаном, що не дає полегшення, і різке схуднення пацієнта. Багатогранність клінічних проявів спричиняє труднощі в установленні діагнозу й несприятливий прогноз, а також відсутність своєчасного лікування. Проблема вчасної діагностики, профілактики й лікування ДГ є надзвичайно актуальною, а лікувальний алгоритм має бути безпечним і патогенетично обґрунтованим.
Матеріали і методи дослідження
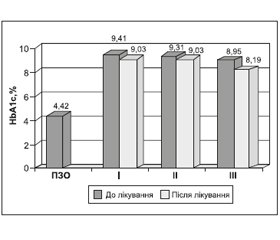
Результати і їх обговорення
/21_2.jpg)
Висновки
1. Зуєв К.О. Бенфотіамін і теорія ускладнень цукрового діабету Майкла Браунлі / К.О. Зуєв // Сімейна медицина. — 2011. — № 4. — С. 37-40.
2. Кляритская И.Л. Рекомендации по диагностике и лечению пациентов с гастропарезом / И.Л. Кляритская, Е.И. Стилиди // Крымский терапевтический журнал. — 2014. — № 1. — С. 68-79.
3. Маньковский Б.Н. Лечение периферической диабетической полинейропатии / Б.Н. Маньковский // Здоровье Украины. — 2013. — С. 32-33.
4. Новиков В.И. Бенфотиамин и пиридоксин: новые горизонты в терапии осложнений сахарного диабета / В.И. Новиков, К.Ю. Новиков // Международный эндокринологический журнал. — 2013. — № 7 (55). — С. 39-44.
5. Панькив В.И. Эффективность использования альфа-липоевой кислоты при диабетической нейропатии / В.И. Панькив // Международный эндокринологический журнал. — 2015. — № 2 (66). — С. 59-65.
6. Погромов А.П. Диабетическая автономная невропатия и органы пищеварения / А.П. Погромов, В.Ю. Батурова // Фарматека. — 2011. — № 5. — С. 42-45.
7. Трухан Д.И., Тарасова Л.В., Трухан Л.Ю. Гастроэнтерологические нарушения у пациентов с сахарным диабетом // Справочник врача общей практики. — 2013. — № 8. — С. 51-59.
8. Циммерман Я.С. Сахарный диабет и функционально-структурные изменения в гастродуоденальной зоне: клинико-эпидемиологическое исследование / Я.С. Циммерман, М.Р. Зинатуллин // Тер. архив. — 2011. — № 2. — С. 71-75.
9. Шептулин А.А. Нарушения двигательной функции желудка и современные возможности их патогенетической терапии / А.А. Шептулин // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. — 2007. — № 5. — С. 49-54.
10. Шульпекова Ю.О. Гастроэнтерологические проявления автономной диабетической нейропатии // Русский медицинский журнал. — 2011. — № 17.
11. Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential / К. Shay, R. Moreau, E. Smith еt al. // Biochim. Biophys. Acta. — 2009. — Vol. 1790 (10). — Р. 1149-1160.
12. Benfotiamine in Diabetic Polyneuropathy (BENDIP): Results of a Randomised, Double Blind, PlacebocontrolledClinical Study / H. Stracke, W. Gaus, U. Achenbach, K. Federlin, R.G. Bretzel // Exp. Clin. Endocrinol. Diabetes. — 2008. — doi 10.1055/s-2008-1065351.
13. Clinical guideline: management of gastroparesis / M. Camilleri, H.P. Parkman, M.A. Shafi, T.L. Abell, L. Gerson, American College of Gastroenterology // Am. J. Gastroenterol. — 2013. — Vol. 108, № 1. — Р. 18-37.
14. Characterization of a monoclonal antibody specific for human peripheral myelin protein 22 and its use in immunohistochemical studies of the fetal and adult nervous system / N.A. Gregson,
G. Zhang, J. Pritchard [et al.] // J. Peripher. Nerv. Syst. — 2007. — Vol. 12 (1). — P. 2-10.
15. Diabetes induced myelin abnormalities are associated with an altered lipid pattern: protective effects of LXR activation / G. Cermenati, F. Abbiati, S. Cermenati [et al.] // Journal of lipid research. — 2012. — Vol. 53 (2). — P. 300-310.
16. Efficacy and safety of antioxidant treatment with α-Lipoic acid over 4 years in diabetic polyneuropathy / D. Ziegler, А.L. Phillip, J.L. William [et al.] // Diabetes Care. — 2011. — Vol. 34. — P. 2054-2060.
17. Martin C.L. Neuropathy Among the Diabetes Control and Complications Trial Cohort 8 Years After Trial Completion / C.L. Martin, J. Albers, W.H. Herman [et al.] // Diabetes Care. — 2006. — Vol. 29. — P. 340-344.
18. Oral treatment with α-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial / D. Ziegler, A. Ametov, A. Barinov [et al.] // Diabetes Care. — 2006. — 29. — P. 2365-2370.
19. Peripheral myelin protein 22 is expressed in human central nervous system / Y. Ohsawa, T. Murakami, Y. Miyazaki [et al.] // J. Neurol. Sci. — 2006. — Vol. 15. — № 247 (1). — P. 11-15.
20. Rickey E. Modeling nerve conduction criteria for diagnosis of diabetic polyneuropathy / E.С. Rickey, J. William // Muscle and Nerve. — 2011. — Vol. 44. — P. 340-345.
21. Singh U. Alpha-lipoic acid supplementation and diabetes / U. Singh, I. Jialal // Nutr. Rev. — 2008. — № 66 (11). — Р. 646-657.

/21.jpg)
/22.jpg)