Статтю опубліковано на с. 28-32
Вступ
Множинний склероз (МС) є хронічним демієлінізуючим захворюванням центральної нервової системи, що, як правило, вражає осіб молодого віку. Середньорічна захворюваність на МС у Європі становить 4,3 випадку на 100 000 нас. [17]. Симптоми МС, такі як м’язова слабкість, втрата чутливості, атаксія, що безпосередньо пов’язані з демієлінізацією та втратою аксонів, призводять до функціональних обмежень, інвалідності та зниження якості життя [12]. Оцінка показників якості життя, що є джерелом різнопланової додаткової інформації, характеризує зміни суб’єктивного стану фізичної, емоційної та соціальної сфери пацієнта.
У ряді досліджень було продемонстровано, що пацієнти з MС мають більш низьку якість життя порівняно як із загальною популяцією, так і з хворими на інші хронічні захворювання, зокрема діабет, епілепсію, ревматоїдний артрит тощо [9, 12]. Неповне відновлення після рецидивів, прогресування неврологічного дефіциту, накопичення нових функціональних розладів заважають повсякденній діяльності хворих із МС та негативно впливають на їх благополуччя [10].
Останнім часом було отримано переконливі дані про негативний вплив інвалідизації, депресії, втоми [2, 11], тривоги [2] коморбідності [1, 4], розладів сну [13], сексуальної дисфункції [14] на якість життя хворих із МС.
Оцінка якості життя все частіше визнається необхідною під час аналізу ефективності методів лікування. За даними літератури, модифікуюча терапія та перебіг МС, що сприяють зменшенню частоти рецидивів та сповільненню прогресування захворювання, позитивно впливають на оцінку якості життя [7]. Адитивні фармакологічні засоби, що зменшують вираженість когнітивних порушень та загальних симптомів, таких як депресія, втома, біль, поряд із змінами способу життя та реабілітаційними програмами також є важливими заходами поліпшення якості життя [10].
На сьогодні існують докази існування асоціації між симптомами депресії, втоми і когнітивних порушень та рівнем 25-гідроксихолекальциферолу (25(OH)D) у хворих на МС [5, 6], встановлено існування оберненої кореляції між низьким рівнем циркулюючого 25(OH)D та розвитком рецидивів й прогресування захворювання [8, 16], отримано дані про те, що поєднана терапія інтерфероном-b-1b та вітаміном D3 призводить до зниження МРТ-активності та показників EDSS [3, 15]. Водночас на сьогодні дані стосовно впливу вітаміну D на якість життя хворих на МС відсутні.
Мета роботи — вивчити вірогідний вплив річного курсу компенсації дефіциту обміну 25(OH)D за допомогою офіцинального препарату вітаміну D3 на якість життя хворих із МС.
Матеріал та методи
Дизайн дослідження: нерандомізоване відкрите контрольноване. За період 2014–2015 років в умовах Він-ницького обласного науково-практичного центру МС та споріднених демієлінізуючих захворювань, що створений на базі кафедри нервових хвороб ВНМУ ім. М.І. Пирогова та КЗ «Вінницька обласна психоневрологічна лікарня ім. акад. О.І. Ющенка», було обстежено 57 (37 жінок, 20 чоловіків) хворих із рецидивуючо-ремітуючим МС, середній вік яких становив 35,93 ± 8,07 року (21–55 років), середня оцінка за шкалою EDSS — 3,74 ± 0,58 бала (3,0–5,5 бала), середня тривалість захворювання — від 1 до 27 років (9,03 ± 5,76 року). Обстеження проведено в період клінічної ремісії в амбулаторних умовах. Організація дослідження ґрунтувалася на Гельсінській декларації (World Medical Association — WMA) 1975 року та її перегляду 1983 року.
Критеріями включення в дослідження були: вік від 18 років, вірогідний діагноз МС згідно з критеріями McDonald (2010), рецидивуючо-ремітуючий перебіг МС, фаза клінічної ремісії, оцінка за шкалою EDSS < 5,0, інформована згода хворого на участь у дослідженні. Критеріями виключення слугували: первинно- або вторинно-прогресуючий МС, наявність соматичних захворювань у стадії декомпенсації.
Відповідно до мети роботи нами були виділені 2 клінічні групи. Групу І (контроль) становили 25 хворих із природним перебігом МС. До групи ІІ увійшли 32 хворі, яким був призначений офіцинальний препарат холекальциферолу (вітаміну D3) — аквадетрим® вітамін D3 у дозі 4000 МО/добу (8 крапель) наприкінці осені та взимку, 500–1500 МО/добу (1–3 краплі) — навесні та влітку.
Усім пацієнтам проводилося стандартне неврологічне обстеження з оцінкою за шкалою тяжкості стану хворих — Expanded Disability Status Scale (EDSS). Рівень астенії визначався за допомогою стандартної версії модифікованої шкали втоми (Modified Fatigue Impact Scale — MFIS), когнітивної дисфункції — за методикою MMSE (Mini Mental State Examination), тривоги та депресії — за шкалами Гамільтона для оцінки тривоги (Hamilton Rating Scale for Аnxiety — HARS) та депресії (Hamilton Rating Scale for Depression — HDRS).
Для оцінки якості життя в роботі використовували опитувальник SF-36 (The MOS 36-item Short Form Health Survey), який містить 36 питань, що формують 8 основних аспектів здоров’я: фізичні функції (PF), рольове фізичне функціонування (RP), рольове емоційне функціонування (RE), оцінка болю (BP), загального благополуччя (GН), життєздатності (VT), соціального функціонування (SF), психічного здоров’я (MH).
На початку дослідження пацієнтам було проведено визначення концентрації 25(ОН)D у сироватці крові за допомогою рідинної хроматографії з використанням стандартного комерційного набору реактивів «25-OH-VITAMIN D» (Agilent Technologies, США) згідно з інструкціями фірми-виробника. Вміст загального кальцію в сироватці крові визначали уніфікованим методом плазменної фотометрії (нормативи: 2,15–2,50 ммоль/л).
Обстеження, ідентичне первинному, проводилося через 12 місяців.
Статистичну обробку даних виконували в статистичному пакеті SPSS 20 (©SPSS Inc.). Аналізовані параметри подані у вигляді M ± SD (середнє значення ± середнє квадратичне відхилення) або n (%). Статистично значущими вважалися відмінності при р < 0,05 (95% рівень значущості).
Результати дослідження
У дослідженні взяли участь 57 пацієнтів (37 жінок (63,2 %) та 20 чоловіків (36,8 %)) із рецидивуючо-ремітуючим МС. Основні клініко-демографічні характеристики обстежених пацієнтів із МС наведені в табл. 1.
У момент включення в дослідження середній рівень 25(ОН)D у крові в аналізованих пацієнтів становив 53,33 ± 15,73 нмоль/л (15,6–75,4 нмоль/л), середній рівень кальцію в крові — 2,32 ммоль/л (2,1–2,58 ммоль/л). Групи порівняння були порівнянними за віком, статтю, тривалістю захворювання, а також рівнем 25(ОН)D та кальцію в сироватці крові (табл. 1). На початку дослідження групи вірогідно не відрізнялися за середньої кількістю релапсів у попередньому році, середніми оцінками за шкалами EDSS, MFIS, MMSE, HARS, HDRS, а також середніми значеннями показників, що становлять концепцію якості життя протоколу SF-36 (табл. 2).
/30_2.jpg)
У процесі порівняння середніх значень клініко-психологічних показників, визначених за відповідними опитувальниками та тестами через 12 місяців, у хворих із природним перебігом МС та групи, що приймала препарат холекальциферолу, отримано значні відмінності в середніх оцінках тільки втоми (р = 0,003) (табл. 2). З’ясовано, що відмінність цих груп за показником вираженості втоми обумовлена вірогідно нижчими показниками когнітивної та психосоціальної втомлюваності (10,69 ± 9,98 бала та 2,81 ± 2,44 бала проти 15,48 ± 7,42 бала та 5,48 ± 5,22 бала в І групі відповідно; р = 0,042 та р = 0,013), тоді як середні оцінки фізичної втоми між групами вірогідно не відрізнялися (17,92 ± 6,22 бала та 16,03 ± 9,96 бала відповідно, р = 0,411).
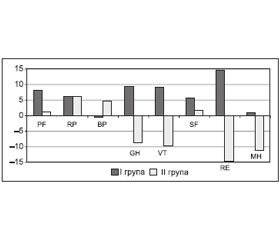
Під час порівняння середніх значень якості життя, визначених за опитувальником SF-36 через 12 місяців, установлено значущі відмінності між групами в загальному сприйнятті здоров’я (р = 0,002), життєздатності (р = 0,003), ролі емоційних проблем в обмеженні життєдіяльності (р = 0,01), показнику психічного здоров’я (р = 0,008). Зведені дані про зміни показників якості життя (SF-36) наведені в табл. 2, а графічне зображення — на рис. 1.
/30.jpg)
Таким чином, річний курс компенсації дефіциту обміну 25(ОН)D за допомогою препарату холекальциферолу найбільшою мірою асоціювався із покращенням психологічних складових якості життя, котрі демонструють суб’єктивну оцінку загального стану здоров’я (GH), суб’єктивну оцінку настрою та енергійності (VT), емоційну здатність людини займатися професійною працею (RE) та суб’єктивну оцінку емоційного стану (MH). Слід зазначити, що на момент завершення дослідження ІІ група мала меншу частку хворих із депресивними розладами (18,8 проти 56 % у І групі; р = 0,005), що, ймовірно, і позначилося на покращенні психологічного компонента якості життя пацієнтів цієї групи.
Результати кореляційного аналізу підсумовані в табл. 3, 4. Гірші показники фізичного компонента якості життя асоціювалися з вищими базовими оцінками за шкалою EDSS, HАRS, HDRS та MFIS (р < 0,01). Усі психологічні субшкали якості життя були переважно пов’язані з оцінкою за HАRS, HDRS та MFIS (р < 0,01). Лікування холекальциферолом переважно впливало на показники психологічного компонента якості життя (р < 0,05), тоді як базовий сироватковий рівень 25(ОН)D3 на показники якості життя не впливав (табл. 3, 4).
У подальшому погіршення більшості показників фізичного (табл. 3) та психологічного (табл. 4) компонентів якості життя вірогідно корелювало із збільшенням оцінок за шкалами HDRS (р < 0,01), MFIS (р < 0,05) та частково MMSE (р < 0,05). Зміни в оцінках за шкалою EDSS не впливали на субшкали SF-36, за виключенням фізичного функціонування (PF), р = 0,037.
Висновки
1. Установлено, що річний курс компенсації дефіциту обміну 25(OH)D за допомогою офіцинального препарату вітаміну D3 дозволяє суттєво поліпшити окремі показники психічного компонента якості життя: оцінку загального сприйняття здоров’я (р = 0,002), життєздатності (р = 0,003), ролі емоційних проблем в обмеженні життєдіяльності (р = 0,01), показника психічного здоров’я (р = 0,008) у хворих експозиційної групи.
2. Погіршення показників якості життя вірогідно корелювало із збільшенням оцінок ступеня депресії, тривоги, втоми (р < 0,05). Зміни в оцінках за шкалою EDSS не впливали на субшкали SF-36, за виключенням фізичного функціонування (р = 0,037).
Список литературы
1. Костюченко А.В. Коморбідність і якість життя при множинному склерозі / А.В. Костюченко // Укр. науково-медичний молодіжний журнал. — 2011. — № 1. — С. 303.
2. Соколова Л.И. Влияние депрессии и тревожности на качество жизни больных рассеянным склерозом / Л.И. Соколова, А.В. Гудзенко // Укр. неврол. журн. — 2011. — № 1(18). — С. 47-51.
3. A randomised, double blind, placebo controlled trial with vitamin D3 as an add on treatment to interferon β-1b in patients with multiple sclerosis / M. Soilu-Hänninen, J. Aivo, B.M. Lindström et al. // J. Neurol. Neurosurg. Psychiatry. — 2012. — Vol. 83, № 5. — Р. 565-571.
4. Cumulative impact of comorbidity on quality of life in MS / R.A. Marrie, R. Horwitz, G. Cutter, T. Tyry // Acta Neurol. Scand. — 2012. — Vol. 125, № 3. — Р. 180-186.
5. Dietary intake of vitamin D during adolescence and risk of multiple sclerosis / K.L. Munger, T. Chitnis, A.L. Frazier et al. // J. Neurol. — 2011. — Vol. 258, № 3. — Р. 479-485.
6. Effect of vitamin D supplement on depression scores in people with low levels of serum 25-hydroxyvitamin D: nested case-control study and randomised clinical trial / M. Kjaergaard, K. Waterloo, C.E. Wang et al. // Br. J. Psychiatry. — 2012. — Vol. 201, № 5. — Р. 360-368.
7. Interferon-beta-1a treatment has a positive effect on quality of life of relapsing-remitting multiple sclerosis: results from a longitudinal study / F. Patti, A. Pappalardo, E. Montanari et al. // J. Neurol. Sci. — 2014. — Vol. 337, № 1–2. — Р. 180-185.
8. Lower serum vitamin D levels are associated with a higher relapse risk in multiple sclerosis / T.F. Runia, W.C. Hop, Y.B. de Rijke et al. // Neurology. — 2012. — Vol. 79, № 3. — Р. 261-266.
9. Quality of life and its assessment in multiple sclerosis: integrating physical and psychological compon / A.J. Mitchell, J. Benito-Leon, J.M. Gonzalez, J. Rivera-Navarro // Lancet Neurol. — 2005. — Vol. 4, № 9. — Р. 556-566.
10. Quality of life in multiple sclerosis: effects of current treatment options / O. Kargiotis, A. Paschali, L. Messinis, P. Papathanasopoulos // Int. Rev. Psychiatry. — 2010. — Vol. 22, № 1. — P. 67-82.
11. Quality of life in multiple sclerosis-association with clinical features, fatigue and depressive syndrome / B. Łabuz-Roszak, K. Kubicka-Baczyk, K. Pierzchała et al. // J. Psychiatr. Pol. — 2013. — Vol. 47, № 3. — Р. 433-442.
12. Quality of life in patients with multiple sclerosis / V.B. Kes, L. Čengić, M. Cesarik et al. // Acta Clin. Croat. — 2013. — Vol. 52, № 1. — Р. 107-111.
13. Sleep Disorders Reduce Health-Related Quality of Life in Multiple Sclerosis (Nottingham Health Profile Data in Patients with Multiple Sclerosis) / C. Veauthier, G. Gaede, H. Radbruch et al. // Int. J. Mol. Sci. — 2015. — Vol. 16, № 7. — Р. 16514-16528.
14. The impact of sexual dysfunction on health-related quality of life in people with multiple sclerosis / L.C. Schairer, F.W. Foley, V. Zemon et al. // Mult. Scler. — 2014. — Vol. 20, № 5. — Р. 610-616.
15. Vitamin D and disease activity in multiple sclerosis before and during interferon treatment / K.I. Løken-Amsrud, T. Holmøy, S.J. Bakke // Neurology. — 2012. — Vol. 79, № 3. — Р. 267-273.
16. Vitamin D as an Early Predictor of Multiple Sclerosis Activity and Progression / A. Ascherio, K.L. Munger, R. White et al. // JAMA Neurol. — 2014. — Vol. 71, № 3. — Р. 306-314.
17. Кoutsouraki E. Epidemiology of multiple sclerosis in Europe: a review / E. Кoutsouraki, V. Costa, S. Baloyannis // Int. Rev. Psychiatry. — 2010. — Vol. 22, № 1. — Р. 2-13.
/30.jpg)

/29.jpg)
/30_2.jpg)
/31.jpg)