Статья опубликована на с. 105-110
Цереброваскулярные заболевания относятся к наиболее распространенным неинфекционным болезням в мире. Острое нарушение мозгового кровообращения (ОНМК) является самой опасной их формой и встречается чаще, чем острый инфаркт миокарда. В мире ежегодно регистрируется около 15 млн инсультов. Почти половина случаев инсульта и треть смертельных исходов наблюдается у пациентов младше 70–75 лет. С этой патологией связаны 10 % всех смертей (почти 6 млн в год), что делает инсульт причиной смерти № 2 на планете. Вследствие острого мозгового инсульта (ОМИ) в Украине ежегодно умирает от 40 до 45 тысяч пациентов. В 2010 году зарегистрировано 39 694 случая смерти вследствие мозгового инсульта, что составляет 86,7 на 100 000 населения, тогда как в Европе этот показатель более чем в 2 раза ниже. Такие показатели говорят о несомненной актуальности проблемы ОНМК, и острого мозгового инсульта в частности.
12–13 ноября в Киеве состоялся пятый научно-образовательный форум «Академия инсульта». Мероприятие было организовано Национальной академией последипломного образования имени П.Л. Шупика, научным обществом неврологов, психиатров и наркологов Украины и ВОО «Украинская ассоциация борьбы с инсультом».
С докладом «Острые нарушения мозгового кровообращения: алгоритмы диагностики, оказания медицинской помощи» выступил д.м.н., профессор кафедры анестезиологии, интенсивной терапии с последипломной подготовкой Одесского национального медицинского университета А.А. Буднюк.
Факторами риска возникновения острого геморрагического инсульта (ОГИ) являются наличие гипертонической болезни или симптоматической артериальной гипертензии, заболевания крови, использование антикоагулянтов и антиагрегантов, артериальные церебральные аневризмы и врожденные сосудистые мальформации, а также церебральная амилоидная ангиопатия. Риск развития острого ишемического инсульта (ОИИ) выше при наличии у больного гипертонической болезни или выраженной артериальной гипотензии, васкулитов, поражения сосудов атеросклерозом, аритмии, эндокардита, аневризмы левого желудочка, коагулопатий и тромбоцитоза, церебрального венозного тромбоза, а также при употреблении кокаина. На догоспитальном этапе диагностика ОМИ возможна при проведении оценки неврологического статуса больного по шкале FAST. Этот тест включает в себя выявление нарушений речи, пареза мимической мускулатуры и слабости в правой или левой руке. Время его выполнения не должно превышать 7 минут. План дальнейшего обследования больного в условиях стационара включает ангиографию, компьютерную (КТ) или магнитно-резонансную томографию (МРТ) для нейровизуализации очага поражения, дуплексное исследование интра- и экстракраниальных сосудов, электрокардиографию (ЭКГ), эхокардиографию, пульсоксиметрию, анализ крови с определением уровня глюкозы, липидограммы и коагулограммы, а также консультации окулиста, кардиолога и нейрохирурга.
В лечении острого инсульта крайне важным фактором является период от момента наступления мозговой катастрофы до начала терапевтических мероприятий. Отсрочка старта терапии может привести к необратимым изменениям клеток мозга, ухудшению прогноза заболевания вплоть до гибели больного. Базисная терапия ОМИ включает в себя поддержку функции сердечно-сосудистой системы и коррекцию артериального давления (АД), поддержание функции дыхания, коррекцию уровня глюкозы крови, инфузионную терапию и нормализацию температуры тела. Кроме этого при наличии показаний используются хирургические методы лечения, а также специфическая терапия. На сегодняшний день существуют различные мнения относительно тактики антигипертензивной терапии у больных с ОИИ. Результаты большого количества исследований достаточно неоднозначны, но в большинстве своем свидетельствуют о безопасности умеренного подхода к снижению АД при данной патологии. Однако нет довольно четких установленных уровней АД, при которых требуется неотложное лечение, а также не определены скорость и предел его снижения. Повышенное АД у пациентов с ОИИ корректируют в зависимости от возможности проведения тромболитической терапии. Больным, которым планируют введение тканевого активатора плазминогена, неотложное снижение АД рекомендуется при систолическом артериальном давлении (САД) > 185 мм рт.ст. и/или диастолическом (ДАД) — более 110 мм рт.ст., поскольку превышение этих уровней является противопоказанием к введению тромболитического препарата. У остальных пациентов показанием к антигипертензивной терапии является уровень САД > 220 мм рт.ст., ДАД > 120 мм рт.ст. Снижение АД необходимо осуществлять очень осторожно, чтобы предотвратить усиление неврологической симптоматики за счет ухудшения внутримозговой гемодинамики. Целесообразным считается снижение АД на 10–15 % за 2–3 часа и на 15–25 % за сутки. Выбор антигипертензивного препарата зависит от показателей его фармакокинетики, возможных побочных эффектов и влияния на внутримозговое кровообращение. На сегодня с целью снижения АД у пациентов с ОИИ рекомендовано применение лабеталола, урапидила. Учитывая отсутствие негативного влияния на внутримозговое кровообращение в целом и на кровообращение в периинфарктной зоне при ОИИ, Европейской организацией инсульта для коррекции АД при остром нарушении мозгового кровообращения рекомендован урапидил. Нитропруссид натрия и нифедипин повышают уровень внутричерепного давления и нарушают ауторегуляцию внутримозгового кровообращения, поэтому их использование при ОИИ противопоказано.
Коррекция АД у больных с ОГИ проводится согласно рекомендациям междисциплинарного консенсуса по вопросам диагностики и лечения гипертонических кризов Ассоциации кардиологов Украины и Научно-практического общества неврологов, психиатров и наркологов Украины (2011). При САД > 200 мм рт.ст. или среднем АД > 150 мм рт.ст. необходимы интенсивное снижение АД с помощью инфузии и мониторинг его уровня каждые 5 минут. При САД > 180 мм рт.ст. или среднем АД > 130 мм рт.ст. с повышением или подозрением на повышение внутричерепного давления рекомендовано мониторирование последнего и снижение АД с помощью прерывистой или длительной инфузии и поддержанием перфузионного давления головного мозга на уровне 60–80 мм рт.ст. Если при таких же цифрах АД повышения внутричерепного давления нет, АД следует снижать умеренно с помощью прерывистой или длительной инфузии при контроле уровня АД каждые 15 минут.
Для контролируемого снижения артериального давления в периоперационном периоде используется эбрантил.
В случае артериальной гипотензии (АД < 100/70 мм рт.ст.) необходимо установить и устранить причину ее возникновения. Основными факторами гипотензии могут быть гиповолемия, диссекция аорты, кровотечение и уменьшение сердечного выброса из-за сердечной недостаточности, ишемии миокарда или аритмии. Для повышения АД в таком случае используют добутамин, допамин, норадреналин в дозировке 0,1–0,3 мкг/кг/мин.
Специфическая терапия при ОИИ включает в себя антитромбоцитарные средства, тромболитики, а также лечение отека головного мозга и коррекцию внутричерепного давления медикаментозно или хирургическим путем. Специфическая терапия при ОГИ заключается в контроле нарушений коагуляционных свойств крови. С целью коррекции гемостаза у пациентов, которые принимают антикоагуляционные и антитромбоцитарные средства и имеют повышенное международное нормализованное отношение, необходимо отменить эти медикаменты одновременно с назначением препаратов витамина К внутривенно, концентрата протромбинового комплекса, свежезамороженной плазмы и тромбоцитарной массы.
Лежачим больным с 1–4-го дня назначают низкомолекулярный или нефракционированный гепарин в низкой дозировке при условии остановки внутримозгового кровотечения, подтвержденной отсутствием увеличения размеров гематомы по данным КТ или МРТ в динамике. Пациентам с высоким риском тромбоэмболии при наличии постоянной или персистирующей формы фибрилляции предсердий у лиц старше 60 лет, с сопутствующим сахарным диабетом, артериальной гипертензией, сердечной недостаточностью возобновляют прием варфарина с 7–14-го дня при отсутствии источника диагностированного кровотечения.
При субарахноидальном кровоизлиянии необходимо проведение мероприятий по устранению вазоспазма. Это обеспечивается восстановлением нормоволемии, применением нимодипина под контролем АД, проведением аналгоседации у пациентов, находящихся на искусственной вентиляции легких, а также использованием при необходимости нейрохирургических эндоваскулярных методов лечения.
Важный аспект лечения ОНМК — нейропротекция, целью которой является метаболическая защита клеток головного мозга. Основные направления нейропротективной терапии: коррекция энергетического обмена путем снижения повреждающего действия гипоксии и уменьшения энергетических потребностей нейронов, стимуляция окислительно-восстановительных процессов и усиление утилизации глюкозы, торможение высвобождения возбуждающего медиатора глутамата, обладающего эксайтотоксическим действием, а также стимуляция систем нейротрансмиссии и нейромодуляции. Холинергическая система, тесно взаимодействуя с дофаминергической, глутаматергической, ГАМКергической системами, обеспечивает нормальный уровень cознания, спонтанную двигательную активность, эмоциональное поведение, память и волевые акты, поэтому влияние на нее имеет важное значение в нейропротективной терапии. Препарат Глиатилин — центральное пресинаптическое холинергическое средство, восстанавливающее когнитивную, двигательную и сенситивную функции. Он проникает через гематоэнцефалический барьер, обладает тропностью к мускариновым М1-рецепторам центральной нервной системы, что обусловливает его центральное холиномиметическое действие. Механизмы нейропротективного эффекта при острой церебральной ишемии заключаются в прямой репарации нейрональных мембран, уменьшении дегенерации свободных жирных кислот. Глиатилин содержит 40,5 % холина и увеличивает синтез ацетилхолина, а также, будучи предшественником фосфатидилхолина, участвует в синтезе этого мембранного фосфолипида. Способность нормализовать синтез ацетилхолина, медиаторное действие, а также участие в процессе восстановления клеточных мембран обусловливают нейротрофический эффект препарата Глиатилин. В экспериментальных исследованиях показано, что Глиатилин стимулирует дозозависимое выделение ацетилхолина в физиологических условиях нейротрансмиссии.
Эффекты этого препарата обусловливают его использование при различной патологии, как показано на рис. 1.
Способность препарата Глиатилин восстанавливать мембранную пластичность, функции рецепторов, улучшать нейротрансмиссию позволяет использовать его не только в остром и восстановительном периодах ОНМК, но и при хронической патологии — деменциях различного генеза, хронической цереброваскулярной недостаточности.
С докладом «Холинергическая нейротрансмиссия и когнитивная деятельность у пациентов с дисциркуляторной энцефалопатией и метаболическим синдромом» выступила сотрудник ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины» О.О. Копчак.
Когнитивные нарушения у людей старшего возраста являются одной из наиболее актуальных проблем современной нейрогериатрии в связи с высоким уровнем инвалидизации населения пожилого и старческого возраста на фоне развития деменции. По статистике, в мире насчитывается 24,3 млн людей с деменцией, и ежегодно регистрируется 4,6 млн новых случаев этой патологии. По данным Всемирной организации здравоохранения (ВОЗ), к 2020 году количество пациентов с деменцией увеличится вдвое, а к 2050 году — почти втрое и превысит 115 млн человек, 70 % из которых будут составлять жители развивающихся стран. Деменция становится тяжелым экономическим бременем для общества. В США ежегодно на лечение и реабилитацию больных с деменцией тратится 604 млрд долларов, что составляет 1 % ВВП. Лечение одного пациента стоит от 18 500 до 27 000 долларов в год. Патофизиологической основой когнитивных нарушений, с одной стороны, являются возрастные изменения — уменьшение плотности синапсов, потеря кортикальных нейронов и, соответственно, аксонов, что приводит к атрофии фронтальной коры и гиппокампа со снижением массы мозга; с другой стороны, заболевания, приводящие к когнитивному дефициту, усугубляют имеющиеся возрастные нарушения и, как следствие, усиливают атрофические процессы и снижают метаболизм мозговой ткани. Наиболее часто развитие деменции может быть вызвано болезнью Альцгеймера (БА), которая в структуре заболеваний, сопровождающихся деменцией, составляет 70 %. Значительно реже, в 20 % случаев, возникает сосудистая деменция. Эти заболевания имеют общие факторы риска, предрасполагающие к их развитию. Пожилой возраст, инсульт в анамнезе, артериальная гипертензия, сахарный диабет 2-го типа, дислипидемия, сердечная недостаточность, курение, стресс, депрессия, метаболический синдром, гипергомоцистеинемия, низкая физическая активность — все это факторы, приводящие к развитию обоих заболеваний. Генетическая предрасположенность, отягощенный семейный анамнез, травма головы и уровень образования играют важную роль в развитии БА. Фибрилляция предсердий, атеротромбоз, коагулопатии, полицитемия и артериальная диссекция, в свою очередь, обусловливают возникновение сосудистой деменции. Инсульт может быть триггером быстрого когнитивного снижения, провоцируя дегенеративный процесс в дополнение к первичной дегенерации, имеющейся до возникновения инсульта. У 30–40 % пациентов с деменцией отмечается комбинация нейродегенеративных и сосудистых изменений, что особенно актуально после перенесенного инсульта. В отличие от БА, при которой в первую очередь страдает память, при сосудистой деменции нарушаются другие когнитивные процессы — функция праксиса и скорость мышления. Это важно учитывать при определении диагностических критериев и подборе нейропсихологических тестов.
Синдром значительных когнитивных нарушений диагностируется при наличии определенных критериев, существующих с 2004 года. К ним относятся наличие когнитивных нарушений у пациента с его слов или со слов близких родственников, признаки ухудшения когнитивных способностей по сравнению с индивидуальной нормой у данного индивида, которые возникли в последнее время. Объективными критериями диагноза являются нейропсихологические тесты, свидетельствующие о снижении результата не менее чем на 1,5 стандартного отклонения от среднестатистической возрастной нормы. Характерно также отсутствие нарушения обычных для пациента форм повседневной активности при наличии трудностей в выполнении более сложных видов деятельности. Можно говорить об отсутствии деменции, если результат по данным шкалы MMSE составляет не менее 24 баллов.
Говоря о развитии когнитивных нарушений, нельзя не сказать о метаболических нарушениях. В последние десятилетия ученые и клиницисты стали комплексно рассматривать различные метаболические нарушения и заболевания, связанные с ожирением. В результате они пришли к выводу, что эти патологические процессы имеют общие проявления, и объединили их под названием «метаболический синдром». Охарактеризовать его можно как изменения в организме, приводящие к глубокому нарушению обмена веществ, развитие которых обусловлено неправильным питанием и малоподвижным образом жизни. Впервые на данную проблему обратил внимание профессор Равен в 1988 году и предложил назвать ее синдромом Х. Ученый провел собственные исследования и доказал, что сочетание ожирения, гипертонии, повышенного уровня холестерина и сахара в крови — кратчайший путь к инфаркту и инсульту. Распространенность метаболического синдрома постоянно растет и затрагивает 40 % взрослого населения развитых стран. Согласно данным ВОЗ, в мире насчитывается около 300 млн людей с избыточной массой тела, 30 % населения планеты страдает ожирением, и эти цифры стойко растут, в большой степени за счет молодых людей. Наличие ожирения приводит к повышению риска развития сахарного диабета и артериальной гипертензии в 3–6 раз, к увеличению частоты сердечно-сосудистых заболеваний и смертности в 2–3 раза.
Докладчик представила диагностические признаки данной патологии. Метаболический синдром диагностируют при наличии у пациента трех или более из следующих критериев: артериальная гипертензия (АД > 130/85 мм рт.ст.) или использование антигипертензивных препаратов; ожирение (окружность талии > 94 см у мужчин и > 80 см у женщин); дислипидемия (повышение уровня триглицеридов сыворотки крови ≥ 1,7 ммоль/л, снижение холестерина липопротеинов высокой плотности < 1 ммоль/л у мужчин и < 1,3 ммоль/л у женщин); повышение уровня глюкозы крови ≥ 5,6 ммоль/л и снижение толерантности к глюкозе (уровень сахара через 2 часа после нагрузки глюкозой в пределах 7,8–11,1 ммоль/л).
В 2013 году ожирение было выделено как основной критерий, остальные стали считать дополнительными, однако общий принцип диагностики по наличию трех или более признаков сохранился прежним.
В настоящее время существуют данные о связи проявлений метаболического синдрома с развитием сосудистых когнитивных нарушений (СКН) у пациентов пожилого и старческого возраста. Таким образом, адекватная и своевременная терапия составляющих метаболического синдрома — нормализация АД, уровня триглицеридов крови — способствует уменьшению выраженности когнитивного дефицита.
Основная цель эффективной фармакологической терапии сосудистых когнитивных нарушений заключается в замедлении скорости их нарастания, уменьшении степени тяжести существующего дефицита и вторичной профилактике когнитивных расстройств.
Направления терапии сосудистых когнитивных нарушений: влияние на основной патологический процесс — лечение цереброваскулярных заболеваний; выявление и коррекция сосудистых факторов риска: артериальной гипертензии, гипер- и дислипидемии, гипергликемии, ожирения, гипергомоцистеинемии; использование антиагрегантов и антикоагулянтов для предотвращения ишемических эпизодов; лечение сопутствующей патологии; адекватная физическая нагрузка и умственная деятельность; применение препаратов, улучшающих когнитивные функции. Для лечения сосудистых когнитивных расстройств используют средства, действующие на нейротрансмиттерные системы, обладающие нейротрофическим, нейрометаболическим и вазоактивным действием.
Центральная холинергическая система играет важную роль в процессе обучения и памяти и взаимодействует с другими нейромедиаторными системами. Снижение выработки ацетилхолина и блокада синтеза фосфатидилхолина может вызывать гибель клетки. Потеря 10 % клеточной мембраны небезопасна для жизнеспособности клеток.
В основе холинергической недостаточности лежит недостаточность продукции ацетилхолина, нарушение баланса холинергических энзимов, потеря холинергических нейронов. Преодоление холинергической недостаточности достигается путем использования препарата, который непосредственно пополняет дефицит ацетилхолина, — Глиатилина, являющегося прекурсором ацетилхолина, проникающим через гематоэнцефалический барьер. Также используются ингибиторы ацетилхолинэстеразы (донепезил, ривастигмин, галантамин).
Механизм действия препарата Глиатилин заключается в том, что холина альфосцерат является предшественником ацетилхолина и фосфатидилхолина. При попадании в организм холина альфосцерат расщепляется под действием ферментов на холин и глицерофосфат. Холин принимает участие в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения, который играет ключевую роль в формировании интегративных когнитивных функций. Глицерофосфат, являющийся предшественником фосфатидилхолина мембран нейронов, играет, таким образом, нейропротекторную и мембраностабилизирующую роль. Кроме того, доказано, что Глиатилин положительно влияет на функциональное состояние микроструктур клеток, нормализует передачу нервных импульсов, потенцирует анаболические процессы в нейронах.
Докладчик привела данные метаанализа ряда исследований, согласно которым эффективность препарата Глиатилин в лечении мягкой и умеренной сосудистой и дегенеративной деменции была аналогичной таковой ингибиторов холинэстеразы. Однако при использовании препарата Глиатилин не наблюдалось побочных эффектов, свойственных последним (синкопе, нарушения сердечного ритма и др.).
В опубликованном анализе проведенных 13 рандомизированных клинических исследований с участием 4054 пациентов доказана эффективность препарата Глиатилин в лечении дегенеративной и сосудистой деменции, острой и цереброваскулярной патологии. На фоне терапии препаратом Глиатилин отмечено достоверно лучшее, чем при стандартном лечении и приеме плацебо, восстановление когнитивных функций (память, внимание), эмоционального фона, наблюдалась положительная динамика поведенческих расстройств у больных и уменьшение функционального ограничения повседневной деятельности.
В Европе проведено двойное слепое многоцентровое клиническое исследование ASCOMALVA, в котором оценивалась эффективность комбинированного применения ингибитора холинэстеразы донепезила и холинергического предшественника холина альфосцерата у пациентов, страдающих БА, при наличии ишемических очагов поражения в головном мозге по данным МРТ. Исследование проходило на базе специализированных клинических центров Италии с участием 210 пациентов. По промежуточным результатам, представленным после года терапии, авторы сделали вывод о том, что терапия на основе холина альфосцерата, максимально устраняя холинергический дефицит, имеет выраженный клинический эффект в восстановлении когнитивных и двигательных функций, способности к самообслуживанию. Промежуточные и окончательные результаты исследования ASCOMALVA также продемонстрировали, что комбинированное использование холина альфосцерата и донепезила замедляет прогрессирующее снижение терапевтического ответа, что является распространенной проблемой в случае длительной терапии ингибиторами ацетилхолинэстеразы.
Также О.О. Копчак рассказала о результатах собственного исследования, проведенного с участием 80 пациентов среднего и преклонного возраста (62,3 ± 4,7 года) с хронической недостаточностью мозгового кровообращения и метаболическим синдромом. Во всех случаях диагностировалась дисциркуляторная энцефалопатия атеросклеротической, гипертонической, дисметаболической (смешанной) этиологии. Пациенты были разделены на две группы, включающие по 40 больных каждая и равнозначные по полу, уровню образования, степени когнитивных нарушений и неврологического дефицита. Когнитивный статус у всех больных соответствовал СКН по данным MMSE: основная группа — 25,10 ± 0,76 балла, контрольная группа — 24,70 ± 0,73 балла. Пациенты основной группы получали Глиатилин по 4 мл внутривенно струйно на протяжении 9 дней, с последующим переходом на пероральный прием по 400 мг 2 раза в сутки в течение 1 месяца. Кроме того, пациенты как основной, так и контрольной группы получали базисную терапию, включающую гипотензивные и сахароснижающие препараты, статины, антиагреганты, вазоактивные средства, витамины группы В. Терапия продолжалась в течение шести недель.
Методы обследования больных включали: клинико-неврологическое обследование, лабораторные тесты (общий анализ крови, общий анализ мочи, биохимический анализ крови, липидограмма, гормоны щитовидной железы); инструментальные (ЭКГ, электроэнцефалография, КТ и/или МРТ головного мозга); для оценки степени когнитивных нарушений использовали краткую шкалу оценки психического статуса MMSE; экспериментально-психологическое тестирование (методика заучивания слов, таблицы Шульте, тест заучивания парных взаимосвязанных слов, тест цвето-словесного взаимодействия).
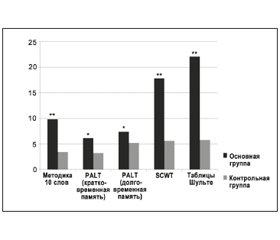
При проведении анализа полученных результатов было установлено, что лечение с использованием препарата Глиатилин на фоне базисной терапии позитивно влияло на общее состояние пациентов (рис. 2).
В основной группе отмечено значительное улучшение показателей экспериментально-психологических тестов по сравнению с контрольной группой (p < 0,05; p < 0,001). Уменьшилась выраженность когнитивного дефицита по данным MMSE, улучшились процессы запоминания, скорость обработки и воспроизведения информации, немедленная и отсроченная распознавательная память, уровень умственной работоспособности и внимания, темп сенсомоторных реакций (рис. 3, 4). Кроме того, отсутствие побочных эффектов свидетельствовало о хорошей переносимости препарата Глиатилин.
/110.jpg)
Таким образом, Глиатилин является на сегодняшний день препаратом с доказанной эффективностью в отношении терапии двигательных и умственных расстройств у больных с острой и хронической патологией головного мозга. Он способствует восстановлению неврологических и когнитивных функций при острых нарушениях мозгового кровообращения, уменьшает степень инвалидизации пациентов в восстановительном периоде острого инсульта. Использование препарата при хронических цереброваскулярных и дегенеративных заболеваниях предотвращает развитие деменции.
/107.jpg)
/110.jpg)

/109.jpg)