Статья опубликована на с. 17-24
Хронический гастрит, проходя этапы предраковых заболеваний кишечника — кишечной метаплазии и интраэпителиальной неоплазии, может перерождаться в рак желудка.
Для оценки прогрессирования хронического гастрита, помимо клинической симптоматики и оценки степени поражения слизистой оболочки желудка, может применяться каудальный гомеобоксный ген 2, кодирующий фактор транскрипции (CDX2) и фактор трилистника 3 (TFF3).
Лечение ребамипидом в дозе 0,1 г три раза в сутки в течение 26 недель значительно уменьшало клинические проявления, степень поражения слизистой оболочки желудка, воспаления, показатели кишечной метаплазии и интраэпителиальной неоплазии низкой степени. Уровень маркеров CDX2 и TFF3, отражающих состояние клеток слизистой оболочки желудка, значительно снизился после приема ребамипида в сравнении с исходными значениями до лечения.
Доля клеток слизистой оболочки желудка, экспрессирующих CDX2 и TFF3, значительно уменьшилась в сравнении с исходным уровнем после лечения ребамипидом.
1. Введение
Хронический гастрит диагностируется у 80–90 % пациентов, которым проводится эндоскопия верхних отделов ЖКТ. Основной причиной хронического гастрита и последующего развития рака желудка является Helicobacter рylori, которая, согласно сообщениям, вызывает активное воспаление, а также образование свободных радикалов кислорода, которые приводят к повреждению ДНК [1, 2]. В более раннем 5-летнем обсервационном исследовании было отмечено, что успешная эрадикация H.pylori снижала степень атрофии тела и антрального отдела желудка, а также уровень метаплазии [3]. Впоследствии было выдвинуто предположение о том, что наиболее эффективным вмешательством в рамках профилактики развития предраковых заболеваний является лечение инфекции, вызванной H.pylori [4]. Развитие рака желудка начинается в нормальной слизистой оболочке в виде поверхностного гастрита с последующим прогрессированием до атрофического гастрита, кишечной метаплазии и кишечной дисплазии желудка, которая в итоге заканчивается раком желудка. В последнее время термин «кишечная дисплазия желудка» был заменен «интраэпителиальной неоплазией» и вместе с кишечной метаплазией это понятие определяется как предраковое заболевание желудка [5, 6]. Существует несколько маркеров для выявления патологических клеток в желудке. Эктопическая экспрессия каудального гомеобоксного гена 2, кодирующего фактор транскрипции (CDX2), наблюдается только в слизистой оболочке желудка с кишечной метаплазией [7–9], и, поскольку кишечную метаплазию предложили рассматривать в качестве предракового заболевания желудка, было отмечено, что повышенная экспрессия CDX2 может выступать в качестве потенциального маркера рака желудка [10–12]. Другой маркер рака желудка — сывороточный фактор трилистника (TFF) 3 [13, 14]. Будучи протектором слизистой оболочки желудка, ребамипид ингибирует активацию лейкоцитов [15], утилизирует свободные радикалы [16], а также повышает секрецию слизистой оболочки желудка [17] и уровни простагландина [18].
В этом рандомизированном контролируемом исследовании мы оценили эффективность ребамипида в лечении хронического гастрита, сосредоточившись на потенциале улучшения симптомов, снижения степени поражения слизистой оболочки желудка, а также изменений экспрессии CDX2 и TFF3.
2. Пациенты и методы
2.1. Пациенты
Пациенты, соответствующие критериям участия в исследовании, должны были иметь установленный с помощью эндоскопии диагноз хронического гастрита в пределах 1 недели до начала исследования, а также не менее двух из следующих симптомов: боль в верхней части живота; вздутие; кислотный рефлюкс; отрыжка; потеря аппетита; тошнота и рвота [19]. Критерии исключения были следующими: другие заболевания желудочно-кишечного тракта, такие как язвенная болезнь или злокачественное новообразование (в том числе интраэпителиальная неоплазия низкой степени); тяжелые нарушения функции сердца, печени или почек, а также злокачественные и доброкачественные новообразования в анамнезе; прием таких препаратов, как ингибиторы протонной помпы (ИПП), антагонисты H2-рецепторов гистамина, гастропротекторы или антибиотики, за 2 недели до начала исследования; прием аминосалициловой кислоты (аспирин), нестероидных противовоспалительных препаратов (НПВП) или антикоагулянтов; психические заболевания, алкогольная или наркотическая зависимость, а также аллергия или гиперчувствительность к исследуемому препарату в анамнезе; для женщин — беременность или кормление грудью.
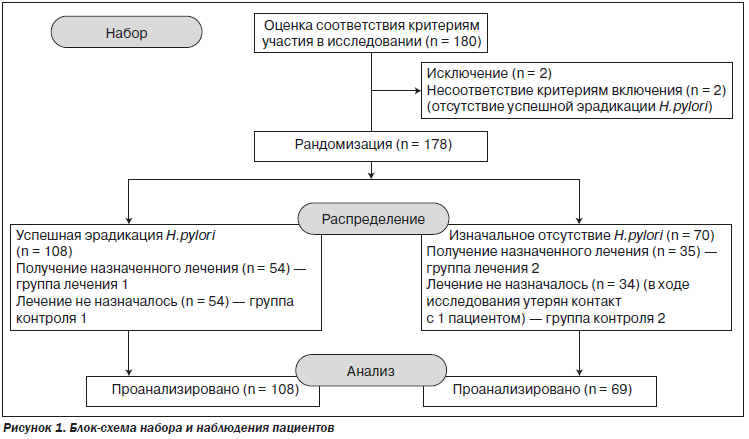
Для участия в исследовании было отобрано 180 пациентов, из них 178 были включены и приняли дальнейшее участие в рандомизированном контролируемом исследовании. Инфекция H.pylori была диагностирована у 110 участников, и у 108 имела место успешная эрадикация. Эти пациенты были разделены на две группы: группу лечения 1 (n = 54) и группу контроля 1 (n = 54). Другие 70 участников, без наличия инфекции H.pylori в анамнезе, были рандомизированы в группу лечения 2 (n = 35) и группу контроля 2, однако с одним пациентом из контрольной группы 2 в ходе исследования был утерян контакт (n = 34) (рис. 1).
2.2. Выявление и лечение инфекции Helicobacter pylori
Статус Helicobacter рylori определялся с помощью уреазного дыхательного теста [20]. Пациенты с инфекцией H.pylori получали комбинацию эзомепразола 20 мг, коллоидного висмут-пектина 200 мг, кларитромицина 500 мг, амоксициллина 1000 мг два раза в сутки в течение 14 дней. Пациенты, у которых не удавалось достичь эрадикации H.pylori по результатам первого курса лечения, получали дополнительный 2-недельный курс лечения, состоявший из левофлоксацина 500 мг, фуразолидона 100 мг, стандартной дозы ИПП и висмута.
2.3. Лечение ребамипидом
Пациенты в группах лечения получали в открытом режиме ребамипид в дозе 100 мг (Zhejiang Otsuka Pharmaceutical Co. Ltd.) перорально три раза в сутки в течение 26 недель. Пациентам всех групп было рекомендовано избегать употребления алкоголя, табака и острой пищи в течение всего периода лечения, что подтверждалось в устной форме во время визитов.
2.4. Оценка симптомов
Оценка таких симптомов, как боль в верхней части живота, вздутие, кислотный рефлюкс, отрыжка, потеря аппетита, тошнота и рвота, проводилась до и после лечения с помощью вопросников. Все эти симптомы оценивались пациентами по визуальной аналоговой шкале от 0 (отсутствует) до 3 (очень тяжелый) баллов [21].
2.5. Эндоскопическая оценка
Состояние слизистой оболочки оценивали с помощью эндоскопии по модифицированной шкале Lanza (MLS) [22] по степеням 0–5: степень 0 — отсутствие эрозий или кровоизлияний; степень 1 — эрозия и кровоизлияние, локализованные на одном участке, < 2 очагов; степень 2 — эрозия и кровоизлияние, локализованные на одном участке, 3–5 очагов; степень 3 — эрозия и кровоизлияние на двух участках, > 6 очагов на одном участке и < 10 очагов на весь желудок; 4-я степень — эрозия и кровоизлияние на трех и более участках; 5-я степень — язва желудка.
2.6. Гистологическая оценка
Биоптаты брались из наиболее тяжело пораженных участков (из того же участка, что и при наборе в исследование) спустя 26 недель терапии. После нарезки залитой в парафин ткани срезы толщиной в 4 мкм депарафинировали, обезвоживали, а затем окрашивали гематоксилином и эозином. Все образцы оценивали и классифицировали согласно модифицированной сиднейской системе (USSS) по мононуклеарным клеткам, характерным для хронического воспаления, активности нейтрофилов и кишечной метаплазии: 0 — норма, 1 — легкая степень, 2 — умеренная степень, 3 — тяжелая степень [23]. Полученные показатели использовали для оценки улучшения клинических симптомов. Лечение считалось эффективным при переходе интраэпителиальной неоплазии низкой степени в гистологически нормальное состояние. Для оценки улучшений в отношении интраэпителиальной неоплазии низкой степени были использованы межгрупповые различия в эффективности.
2.7. Иммуногистохимическая оценка
Образцы, полученные от пациентов из групп лечения до и после терапии, обрабатывали по стандартной методике. Перед иммуногистохимическим исследованием депарафинированные срезы помещали в 0,01 М цитратного буфера (95 °С) на 15–20 мин и промывали в фосфатно-буферном растворе несколько раз после естественного охлаждения. Затем срезы помещали в блокирующий раствор (10% фосфатно-буферный раствор нормальной козьей сыворотки) на 10 мин, а затем инкубировали с кроличьими поликлональными антителами к CDX2 в разведении 1 : 400 (Abcam, Шанхай, Китай) или кроличьими поликлональными антителами к TFF3 в разведении 1 : 200 (Abcam, Шанхай, Китай), оставляя на ночь при 4–8 °С. Для определения экспрессии CDX2 и TFF3 применялся стрептавидин-пероксидазный метод. Клетки с положительным окрашиванием характеризовались желтой или темно-коричневой окраской в ядре (CDX2) или в цитоплазме (TFF3). Уровень клеток с положительным окрашиванием рассчитывали исходя из количества положительных клеток при увеличении (× 400): 0 баллов при ≤ 5 %; 1 балл при 5–25 %; 2 балла при 25–50 %; 3 балла при 50–75 %; 4 балла при ≥ 75 %. Глубину окраски положительных клеток рассчитывали следующим образом: 0 баллов при отсутствии окраски, 1 балл при желтой окраске; 2 балла при коричневой окраске и 3 балла при темно-коричневой окраске. Оба показателя затем умножали, и если произведение составляло 0, результат определяли как отрицательный (–); если произведение составляло 1–4 балла, результат определяли как слабо положительный (+); если произведение составляло 5–8 баллов, результат определяли как умеренно положительный (++); и если произведение составляло 9–12 баллов, результат определяли как выраженно положительный (+++).
2.8. Статистический анализ
Для всех статистических расчетов было использовано программное обеспечение SPSS® (SPSS Inc., Чикаго, Иллинойс, США) версии 17.0 для ОС Windows. Для анализа нормально распределенных данных был использован t-критерий Стьюдента. Для ненормально распределенных данных применялся критерий Вилкоксона. Все значения определялись как среднее ± стандартное отклонение. Статистическая значимость была определена на уровне Р < 0,05.
3. Результаты
3.1. Характеристики пациентов
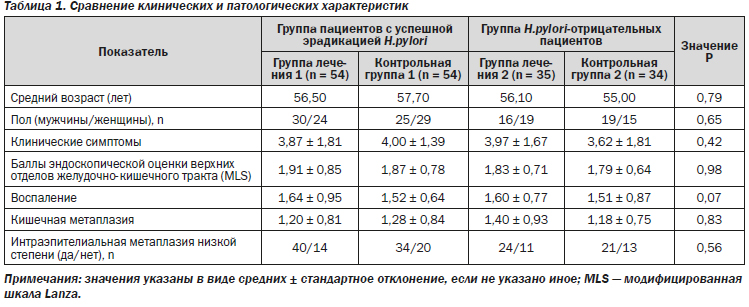
Сравнение демографических характеристик показало отсутствие каких-либо существенных различий между четырьмя группами по возрасту, полу, клиническим и патологическим данным (табл. 1).
3.2. Влияние ребамипида на клиническую симптоматику
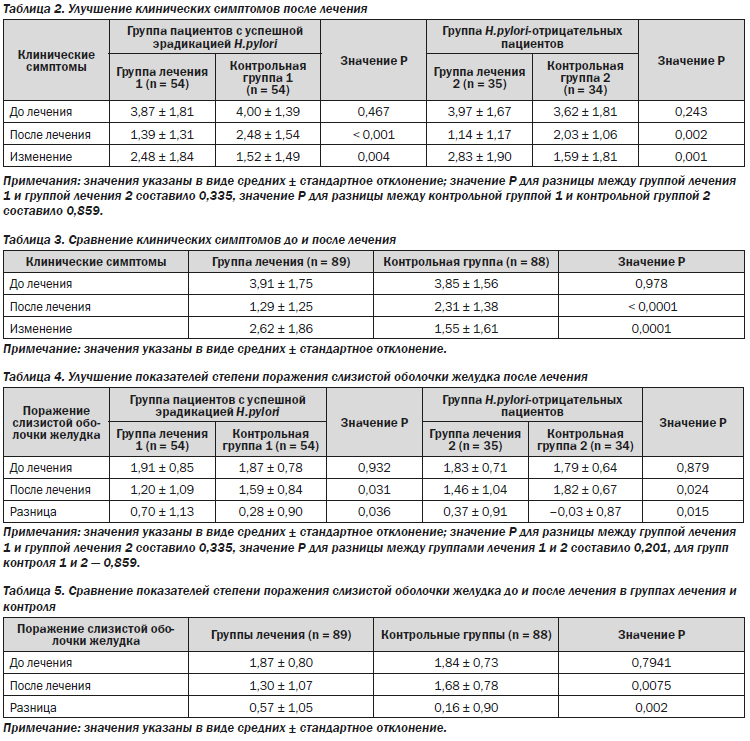
Различия в клинической симптоматике до и после лечения между группой лечения 1 и группой контроля 1 в группе успешной эрадикации H.pylori составили 2,48 ± 1,84 и 1,52 ± 1,81 (P = 0,004) соответственно. Различия в клинической симптоматике до и после лечения между группой лечения 2 и группой контроля 2 в группе пациентов без H.pylori на исходном уровне составили 2,83 ± 1,90 и 1,59 ± 1,81 (P = 0,001) соответственно. Различия в клинической симптоматике между группой лечения и группой контроля составили 2,62 ± 1,86 и 1,55 ± 1,61 (P = 0,0001) соответственно (табл. 2, 3).
3.3. Сравнение улучшения состояния слизистой оболочки желудка
Все пациенты группировались согласно результатам эндоскопической оценки по MLS до и после лечения. По сравнению с контрольными группами как в группе успешной предшествующей эрадикации H.pylori, так и в группе H.pylori-отрицательных пациентов наблюдалось значительное улучшение эндоскопической оценки после 26 недель (0,70 ± 1,12 против 0,28 ± 0,90, Р = 0,036; и 0,37 ± 0,91 против –0,03 ± 0,87, P = 0,015 соответственно) (табл. 4). При сравнении всех пациентов, получавших лечение, со всеми пациентами контрольной группы показатели поражения слизистой оболочки желудка значительно улучшились в группах лечения (Р = 0,002) (табл. 5).
3.4. Гистологические изменения
У пациентов с хроническим гастритом всегда наблюдалась различной степени инфильтрация нейтрофилами и мононуклеарными клетками. В конце исследования более значительное снижение нейтрофильной инфильтрации было достигнуто в группах лечения 1 и 2 (0,44 ± 1,08 против 0,04 ± 0,88, P = 0,037; и 0,40 ± 0,77 против –0,04 ± 0,36, P = 0,006 соответственно) в сравнении с контрольными группами 1 и 2. Очевидное снижение наблюдалось в контрольной группе 1, но эффект не достиг статистической значимости, в то время как снижения в контрольной группе 2 не наблюдалось. Кроме того, оценивалась воспалительная реакция и кишечная метаплазия до и после лечения: в группах лечения наблюдалось очевидное снижение показателей, но без статистической значимости (табл. 6).
Далее мы исследовали показатели положительных результатов кишечной метаплазии и интраэпителиальной неоплазии низкой степени до и после лечения; оба показателя значительно снизились в группе ребамипида в сравнении с контрольной группой (P = 0,017 и P = 0,005 соответственно) (табл. 7).
3.5. Изменения экспрессии CDX2 и TFF3
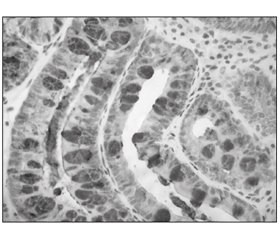
Для исследования влияния ребамипида на эпителиальные клетки слизистой оболочки желудка с кишечной метаплазией определяли экспрессию CDX2 и TFF3 в образцах, полученных у 89 пациентов в группе лечения ребамипидом до и после терапии.
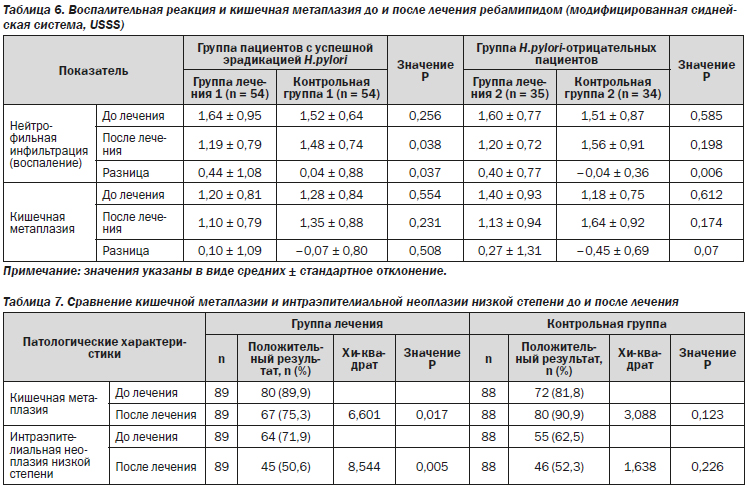
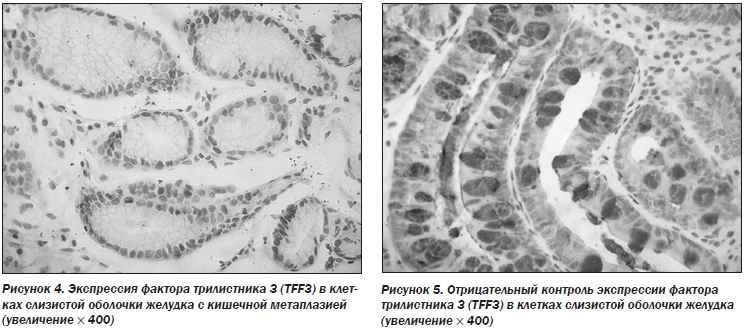
Результаты иммуногистохимического анализа показали, что доля клеток с положительным окрашиванием на CDX2 и TFF3 значительно изменилась после 26 недель терапии (точный критерий Фишера: 31,5 против 15,7 %, Р = 0,021 для CDX2 и 44,9 против 25,8 %, Р = 0,012 для TFF3) (рис. 2–5; табл. 8).
4. Обсуждение
У 61 % наших пациентов была выявлена инфекция H.pylori; это указывает на то, что данная бактерия является одним из основных факторов, способствующих развитию хронического гастрита. Рак желудка напрямую связывают с инфекцией H.pylori [24, 25], однако другие авторы считают, что H.pylori может лишь способствовать созданию благоприятных условий для канцерогенеза, в том числе взаимодействуя с такими факторами, как образ жизни и окружающая среда [26, 27].
Поскольку эрадикация H.pylori стала общепринятой мерой по снижению заболеваемости раком желудка, возник вопрос о том, обратима ли кишечная метаплазия желудка [28]. Предыдущее исследование показало, что эрадикация сама по себе не позволяет полностью предотвратить рак желудка и что данный подход может быть эффективен только у пациентов без атрофического гастрита или кишечной метаплазии [29]. Таким образом, необходимы препараты, которые позволят восстановить нормальную клеточную структуру желудка при хроническом гастрите.
Ребамипид является аминокислотой, производной 2-хинолинона; как было показано, препарат осуществляет свое действие посредством нескольких механизмов. Помимо ингибирования активных форм кислорода, ребамипид стимулирует простагландин и рецептор EP4 простагландина, что приводит к уменьшению секреции кислоты в желудке и повышению синтеза гликопротеина слизи. Кроме того, ребамипид обладает противовоспалительными свойствами, снижая уровни воспалительных цитокинов и хемокинов в дополнение к ингибированию активации нейтрофилов [30]. Нужно отметить, что ребамипид увеличивает экспрессию эндотелиального фактора роста (ЭФР) и рецептора ЭФР –(ЭФР-Р) в слизистой оболочке желудка крыс, тем самым способствуя пролиферации клеток и реэпителизации [31], и восстанавливает активность сигнального пути sonic hedgehog, который способствует обратимости атрофии клеток желудка [32]. Другие эффекты ребамипида заключались в нормализации окислительных процессов и нитрования тирозина в сигнальном пути ERK в слизистой оболочке желудка при портальной гипертензии, что способствует заживлению и восстановлению слизистой [33], а также запуску процесса васкуляризации за счет индукции проангиогенных генов [34]. В нашем исследовании в качестве иммуногистохимических показателей степени кишечной метаплазии были выбраны CDX2 и TFF3. Считается, что прогрессирующее уменьшение активности TFF1 и TFF2 наряду с индукцией TFF3 характерно для ранних этапов многостадийного процесса канцерогенеза в желудке [35]. CDX2 является маркером кишечной метаплазии [7–9]; уровни обоих маркеров значительно понизились в группах лечения ребамипидом (табл. 8), что указывает на уменьшение кишечной метаплазии и интраэпителиальной неоплазии низкой степени. Кроме того, в группах лечения ребамипидом значительно уменьшилась степень воспалительной реакции, о чем свидетельствует меньшая видимая нейтрофильная инфильтрация (табл. 6).
5. Выводы
Эрадикационная терапия Helicobacter рylori, а также терапия, направленная на восстановление слизистой оболочки желудка, совместно с регулярным наблюдением и периодическим выполнением эндоскопии верхних отделов желудочно-кишечного тракта являются эффективными методами лечения и профилактики у пациентов с хроническим гастритом. Ребамипид является эффективным препаратом для восстановления слизистой оболочки при хроническом гастрите.
Перевод с англ. Е. Куща
Список литературы
1. Chang C.S., Chen W.N., Lin H.H., Wu C.C., Wang C.J. Increased oxidative DNA damage, inducible nitric oxide synthase, nuclear factor kappaB expression and enhanced antiapoptosis-related proteins in Helicobacter Pylori-infected non-cardiac gastric adenocarcinoma // World J. Gastroenterol. — 2004. — 10. — 2232-40.
2. Farinati F., Cardin R., Degan P., Rugge M., Mario F.D., Bonvicini P. et al. Oxidative DNA damage accumulation in gastric carcinogenesis // Gut. — 1998. — 42. — 351-6.
3. Ito M., Haruma K., Kamada T., Mihara M., Kim S., Kitadai Y. et al. Helicobacter Pylori eradication therapy improves atrophic gastritis and intestinal metaplasia: a 5-year prospective study of patients with atrophic gastritis // Aliment. Pharmacol. Ther. — 2002. — 16. — 1449-56.
4. Malfertheiner P., Megraud F., O’Morain C., Baz–zoli F., El-Omar E., Graham D. et al. Current concepts in the management of Helicobacter Pylori infection: the Maastricht III Consensus Report // Gut. — 2007. — 56. — 772-81.
5. Rugge M., Capelle L.G., Cappellesso R., Nitti D., Kuipers E.J. Precancerous lesions in the stomach: from biology to clinical patient management // Best Pract. Res. Clin. Gastroenterol. — 2013. — 27. — 205-23.
6. Yakirevich E., Resnick M.B. Pathology of gastric cancer and its precursor lesions // Gastroenterol. Clin. N. Am. — 2013. — 42. — 261-84.
7. Almeida R., Silva E., Santos-Silva F., Silberg D.G., Wang J., De Bolos C. et al. Expression of intestine-specific transcription factors, CDX1 and CDX2, in intestinal metaplasia and gastric carcinomas // J. Pathol. — 2003. — 199. — 36-40.
8. Bai Y.Q., Yamamoto H., Akiyama Y., Tanaka H., Takizawa T., Koike M. et al. Ectopic expression of homeodomain protein CDX2 in intestinal metaplasia and carcinomas of the stomach // Cancer. Lett. — 2002. — 176. — 47-55.
9. Bornschein J., Wex T., Peitz U., Kuester D., Roessner A., Malfertheiner P. The combined presence of H. pylori infection and gastro-oesophageal reflux disease leads to an up-regulation of CDX2 gene expression in antrum and cardia // J. Clin Pathol. — 2009. — 62. — 254-9.
10. Xiao Z.Y., Ru Y., Sun J.T., Gao S.G., Wang Y.F., Wang L.D. et al. Expression of CDX2 and villin in gastric cardiac intestinal metaplasia and the relation with gastric cardiac carcinogenesis // Asian Pac. J. Cancer Prev. — 2012. — 13. — 247-50.
11. Shiotani A., Iishi H., Uedo N., Ishihara R., Ishi–guro S., Tatsuta M. et al. Helicobacter Pylori-induced atrophic gastritis progressing to gastric cancer exhibits sonic hedgehog loss and aberrant CDX2 expression // Aliment. Pharmacol. Ther. — 2006. — 24 (Suppl. 4). — 71-80.
12. Mutoh H., Sakurai S., Satoh K., Tamada K., Kita H., Osawa H. et al. Development of gastric carcinoma from intestinal metaplasia in Cdx2-transgenic mice // Cancer. Res. — 2004. — 64. — 7740-7.
13. Huang Z., Zhang X., Lu H., Wu L., Wang D., Zhang Q. et al. Serum trefoil factor 3 is a promising non-invasive biomarker for gastric cancer screening: a monocentric cohort study in China // BMC Gastroenterol. — 2014. — 14. — 74.
14. Aikou S., Ohmoto Y., Gunji T., Matsuhashi N., Ohtsu H., Miura H. et al. Tests for serum levels of trefoil factor family proteins can improve gastric cancer screening // Gastroenterology. — 2011. — 141 (837-45). — e1-7.
15. Kim J.S., Kim J.M., Jung H.C., Song I.S. Expression of cyclooxygenase-2 in human neutrophils activated by Helicobacter Pylori water-soluble proteins: possible involvement of NF-kappaB and MAP kinase signaling pathway // Dig. Dis. Sci. — 2001. — 46. — 2277-84.
16. Sakurai K., Sasabe H., Koga T., Konishi T. Mechanism of hydroxyl radical scavenging by rebamipide: identification of mono-hydroxylated rebamipide as a major reaction product // Free Radic. Res. — 2004. — 38. — 487-94.
17. Iijima K., Ichikawa T., Okada S., Ogawa M., Koike T., Ohara S. et al. Rebamipide, a cytoprotective drug, increases gastric mucus secretion in human: evaluations with endoscopic gastrin test // Dig. Dis. Sci. — 2009. — 54. — 1500-7.
18. Qi Z., Jie L., Haixia C., Xiaoying Z. Effect of rebamipide on quality of peptic ulcer healing in rat // Dig. Dis. Sci. — 2009. — 54. — 1876-83.
19. Du Y., Bai Y., Xie P., Fang J., Wang X., Hou X. et al. Chronic gastritis in China: a national multi-center survey // BMC Gastroenterol. — 2014. — 14. — 21.
20. Di Rienzo T.A., D’Angelo G., Ojetti V., Campanale M.C., Tortora A., Cesario V. et al. 13C-Urea breath test for the diagnosis of Helicobacter Pylori infection // Eur. Rev. Med. Pharmacol. Sci. — 2013. — 17 (Suppl. 2). — 51-8.
21. Naito Y., Yoshikawa T., Iinuma S., Yagi N., Matsuyama K., Boku Y. et al. Rebamipide protects against indomethacin-induced gastric mucosal injury in healthy volunteers in a double-blind, placebo-controlled study // Dig. Dis. Sci. — 1998. — 43. — 83S-9S.
22. Lanza F.L., Royer G.L. Jr., Nelson R.S. Endoscopic evaluation of the effects of aspirin, buffered aspirin, and enteric-coated aspirin on gastric and duodenal mucosa // N. Engl. J. Med. — 1980. — 303. — 136-8.
23. Chitapanarux T., Praisontarangkul O.A., Lertprasertsuke N. An open-labeled study of rebamipide treatment in chronic gastritis patients with dyspeptic symptoms refractory to proton pump inhibitors // Dig. Dis. Sci. — 2008. — 53. — 2896-903.
24. Sakaki N., Kozawa H., Egawa N., Tu Y., Sanaka M. Ten-year prospective follow-up study on the relationship between Helicobacter Pylori infection and progression of atrophic gastritis, particularly assessed by endoscopic findings // Aliment. Pharmacol. Ther. — 2002. — 16 (Suppl. 2). — 198-203.
25. Asaka M., Sugiyama T., Nobuta A., Kato M., Takeda H., Graham D.Y. Atrophic gastritis and intestinal metaplasia in Japan: results of a large multicenter study // Helicobacter. — 2001. — 6. — 294-9.
26. Crew K.D., Neugut A.I. Epidemiology of gastric cancer // World J. Gastroenterol. — 2006. — 12. — 354-62.
27. Peek R.M. Jr., Blaser M.J. Helicobacter Pylori and gastrointestinal tract adenocarcinomas // Nat. Rev. Cancer. — 2002. — 2. — 28-37.
28. Walker M.M. Is intestinal metaplasia of the sto–mach reversible? // Gut. — 2003. — 52. — 1-4.
29. Cheung T.K., Xia H.H., Wong B.C. Helicobacter Pylori eradication for gastric cancer prevention // J. Gastroenterol. — 2007. — 42 (Suppl. 17). — 10-5.
30. Arakawa T., Higuchi K., Fujiwara Y., Watanabe T., Tominaga K., Sasaki E. et al. 15th anniversary of rebamipide: looking ahead to the new mechanisms and new applications // Dig. Dis. Sci. — 2005. — 50 (Suppl. 1). — S3-11.
31. Tarnawski A., Arakawa T., Kobayashi K. Rebamipide treatment activates epidermal growth factor and its receptor expression in normal and ulcerated gastric mucosa in rats: one mechanism for its ulcer healing action? // Dig. Dis. Sci. — 1998. — 43. — 90S-8S.
32. Nishizawa T., Suzuki H., Nakagawa I., Minegishi Y., Masaoka T., Iwasaki E. et al. Rebamipide-promoted restoration of gastric mucosal sonic hedgehog expression after early Helicobacter Pylori eradication // Digestion. — 2009. — 79. — 259-62.
33. Kinjo N., Kawanaka H., Akahoshi T., Yamaguchi S., Yoshida D., Anegawa G. et al. Significance of ERK nitration in portal hypertensive gastropathy and its therapeutic implications // Am. J. Physiol. Gastrointest. Liver Physiol. — 2008. — 295. — G1016-24.
34. Tarnawski A.S., Chai J., Pai R., Chiou S.K. Rebamipide activates genes encoding angiogenic growth factors and Cox2 and stimulates angiogenesis: a key to its ulcer healing action? // Dig. Dis. Sci. — 2004. — 49. — 202-9.
35. Leung W.K., Yu J., Chan F.K., To K.F., Chan M.W., Ebert M.P. et al. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues // J. Pathol. — 2002. — 197. — 582-8.