Статья опубликована на с. 27-31
Традиционными возбудителями острого вирусного гепатита принято считать вирусы гепатита А–Е. Однако существует немало других причин, которые могут привести к развитию острого воспаления печени. Среди инфекционных следует выделить группу герпесвирусов, которые, пожалуй, являются второй по частоте причиной вирусных поражений печени после классических гепатотропных вирусов.
Семейство Нerpesviridae представлено крупными оболочечными ДНК-содержащими вирусами, 8 из которых являются патогенными для человека. Последние могут быть классифицированы на три подсемейства согласно гомологичности генома, тропизму к некоторым клеткам и организму хозяина. К альфа-герпесвирусам относят вирусы простого герпеса 1-го и 2-го типов (HSV1/2), вирус опоясывающего лишая (VZV); к бета-герпесвирусам — цитомегаловирус (CMV), человеческие герпесвирусы 6–7-го типов (HHV-6, -7); к гамма-герпесвирусам — вирус Эпштейна — Барр (EBV), человеческий герпесвирус 8-го типа (HHV-8).
Герпесвирусы поражают различные типы клеток, включая эпителиальные и нервные, фибробласты и лимфоциты. После стадии первичной инфекции развивается латентная фаза болезни. Вирус персистирует или в интегрированном в геном хозяина виде (ковалентная циркулярно замкнутая ДНК), или в низкорепликативной форме. Латенция поддерживается в определенных, «иммунологически-привилегированных» объектах: сенсорных нервных ганглиях, железистой ткани, В- или Т-лимфоцитах. Герпесвирусы взаимодействуют с главным комплексом гистосовместимости и мешают распознаванию инфицированных клеток и их деструкции, опосредованной Т-лимфоцитами. Реактивация, которая ведет к рецидиву заболевания, может быть индуцирована иммуносупрессией или другими стимулами, природа которых сейчас не очень ясна. Вирусы могут индуцировать заболевание путем прямого цитотоксического действия или иммуноопосредованно — путем цитолиза или неопластической трансформации.
Все перечисленные выше вирусы могут быть причиной острого гепатита, однако если CMV и EBV можно отнести к частым возбудителям, то остальные вызывают развитие заболевания гораздо реже. К примеру, у иммунокомпетентных лиц гепатиты, вызванные HSV1/2 и VZV, скорее можно отнести к казуистическим случаям, поэтому возникают сложности в клинической диагностике заболевания. В то же время у больных с иммуносупрессией герпесвирусы всегда должны рассматриваться как возможная причина поражения печени.
Все вышеперечисленное делает проблему диагностики гепатитов, вызванных герпетическими вирусами, весьма актуальной, особенно с учетом того, что спектр их клинических проявлений может варьировать от субклинических до фульминантных форм, с одной стороны, с другой — мы имеем противовирусные препараты, назначение которых может предотвратить у большинства больных неблагоприятный сценарий развития заболевания.
Цитомегаловирусная инфекция
Цитомегаловирусная инфекция (ЦМВ-инфекция) чрезвычайно широко распространена. В Украине около 80–90 % взрослых имеют антитела к вирусу.
Первичная инфекция может быть следствием попадания вируса в организм со слюной больного, половым путем, посредством гемотрансфузии или трансплантации донорских органов. Врожденная инфекция встречается в 40–45 % случаев, если первичная инфекция развивается у будущей матери во время первого триместра беременности и только у 8 % — если инфицирование с последующим развитием инфекции произошло незадолго до зачатия [1]. Первичная инфекция чаще встречается среди подростков, а частота врожденной инфекции выше у младенцев, матери которых моложе 20 лет [2].
После первичной инфекции вирус персистирует в основном в лейкоцитах, клетках миелоидного ряда и эндотелиальных клетках, которые могут быть источником реактивации инфекции [3].
Возврат инфекции определяется как обнаружение ЦМВ-инфекции у пациента с ранее документально подтвержденной инфекцией, у которого вирус не определялся по крайней мере в течение 4 недель наблюдения.
Возврат инфекции может быть следствием реактивации латентной инфекции или реинфицирования.
Реинфекция определяется как инфицирование другим штаммом CMV и должна быть документирована секвенированием вирусного генома.
У иммунокомпетентных лиц первичная инфекция, равно как и реактивация или реинфекция, обычно бессимптомна. Однако имеются сообщения о тяжелом течении с летальными исходами у ранее здоровых детей и взрослых.
У иммунокомпрометированных больных частота и тяжесть CMV-индуцированного заболевания тесно коррелируют со степенью клеточной иммунной дисфункции [4]. У реципиентов донорских органов тяжелые случаи, как правило, развиваются вследствие первичной инфекции, но могут быть и результатом реактивации или реинфекции [5].
Клиника ЦМВ-инфекции
Клинические проявления ЦМВ-инфекции зависят от возраста, в котором происходит инфицирование, и от состояния иммунной системы пациента.
При интранатальном инфицировании гепатит является одним из проявлений врожденной СMV-инфекции, которая характеризуется желтухой, гепатоспленомегалией, тромбоцитопенической пурпурой и тяжелыми неврологическими симптомами. Если ребенок не умирает (летальность около 10 %), симптомы поражения печени могут регрессировать, однако неврологический дефицит, нарушения психического развития, как правило, персистируют [6–9].
Вследствие перинатальной (в результате контакта с шейкой матери во время родов) или постнатальной (при грудном вскармливании) трансмиссии вируса обычно развивается клиника мононуклеоза с возможным вовлечением печени, но без поражения ЦНС, что свойственно интранатальному инфицированию. Может развиваться гепатит, который самоизлечивается обычно в течение первого года жизни [10, 11].
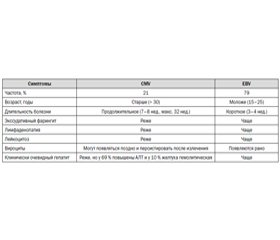
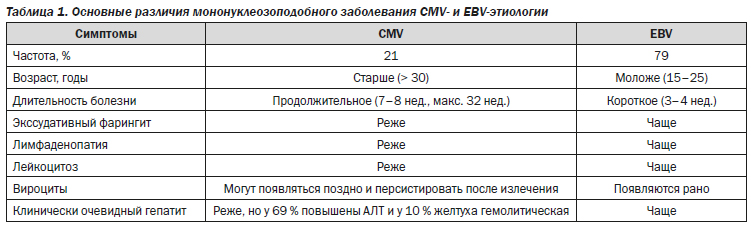
У иммунокомпетентных детей и взрослых ЦМВ-инфекция обычно имеет субклиническое течение, но иногда может вызывать заболевание, напоминающее мононуклеозоподобный синдром при Эпштейна — Барр-инфекции (EBV), однако со своими особенностями (табл. 1) [12].
Цитомегаловирусный гепатит
При интранатальном инфицировании в печени выявляются множественные мультифокальные некрозы со специфическими включениями в виде «совиного глаза», воспалительная инфильтрация и значимый холестаз. Как уже отмечено выше, летальность составляет около 10 %. В случае благополучного исхода симптомы поражения печени регрессируют бесследно [6–9].
При мононуклеозоподобном заболевании CMV-этиологии нарушение функции печени встречается примерно у 70 % больных в виде легко протекающего гепатита [13]. Гепатоспленомегалия и нарушение печеночных функциональных тестов являются типичными проявлениями болезни. Повышение активности АЛТ встречается у 88 %, а ЩФ — у 64 % пациентов и обычно не столь значительно, как у пациентов с острым вирусным гепатитом А–Е [14]. Редкими проявлениями CMV-гепатита являются гепатомегалия, гранулематозный (выявляется при биопсии) или холестатический гепатит, а также острый гепатит с массивным некрозом печени [15]. Причиной желтухи может быть также гемолиз (встречается приблизительно у 10 % больных) [1, 16].
У пациентов с ослабленным клеточным иммунитетом диссеминированная ЦМВ-инфекция представляет собой тяжелое, угрожающее жизни заболевание. У больных со СПИДом это одна из частых оппортунистических инфекций с поражением ЦНС, всех отделов желудочно-кишечного тракта, инвалидизирующим ретинитом. У них могут развиваться тяжелый гепатит, панкреатит и острый бескаменный гангренозный холецистит [17, 18]. Было замечено, что наличие цитомегаловирусного ретинита, гатроинтестинальных поражений, CMV-виремии увеличивает риск развития папиллярного стеноза, склерозирующего холангита, рефрактерных к антиретровирусной терапии [19].
У реципиентов донорских органов возможность развития заболевания зависит от серологического статуса донора и реципиента. Наибольший риск представляет ситуация, когда донор был инфицирован CMV, а реципиент — нет [20]. В этом случае без эффективной профилактики инфекция развивается в 50–75 % случаев [21]. Если донор органа был серонегативный, инфицирование чаще всего происходит при переливании крови и ее продуктов во время операции или после нее, в связи с чем необходим тщательный отбор донорский крови. Риск заболевания, вызванного CMV, зависит от возраста реципиента (частота у взрослых составляет 5–16 %, у детей — 6 %) и того, какой орган пересажен. Последнее определяет выбор иммуносупрессивной терапии, а значит, и шансы развития ЦМВ-инфекции.
Стероиды, моноклональные ОКТ-3 антитела и поликлональный антилимфоцитарный иммуноглобулин, используемые для иммуносупрессии, увеличивают риск ЦМВ-инфекции, в то время как циклоспорин, такролимус — нет. Некоторые авторы утверждают, что важны не столько используемые иммуносупрессанты, сколько степень индуцированной ими иммуносупрессии [22]. Более высокая или быстро возрастающая вирусная нагрузка являются предиктором высокого риска развития ЦМВ-инфекции/заболевания с отторжением трансплантата или его хронической дисфункцией [23].
Гепатит — наиболее частое проявление ЦМВ-инфекции после трансплантации печени. Высокий риск ЦМВ-инфекции обусловлен как особенностями иммунитета реципиента, так и возможностью заражения от донора. В выборке из 253 пациентов гепатит этой этиологии был зарегистрирован у 11 %; частота его была выше среди серонегативных (26 %), чем серопозитивных реципиентов (9 %), и большинство случаев (70 %) были результатом реактивации, а не первичной инфекции. При наличии ЦМВ-инфекции достаточно сложно отличить гепатит вирусной этиологии от реакции острого отторжения трансплантата. Наличие баллонной дистрофии гепатоцитов, значимая реакция купферовских клеток и микроабсцессы типичны для цитомегаловирусного гепатита. Портальная лимфоцитарная инфильтрация, эндотелиит и холестаз могут быть неотличимы от мягких форм отторжения трансплантата. Это может вести к потенцированию терапии, направленной против отторжения трансплантата, то есть к еще более тяжелой иммуносупрессии. В то же время не следует забывать, что ЦМВ-инфекция может быть только триггерным фактором отторжения [24].
Некоторые исследователи указывают, что СМV может быть причиной цирроза и дисфункции трансплантата печени, а также способствовать более агрессивному течению гепатита С у этих пациентов. Сам по себе СМV может индуцировать иммунную супрессию и увеличивать риск оппортунистических, особенно грибковых инфекций [24]. Отдаленного влияния на исходы трансплантации ЦМВ-инфекция не оказывает, но билиарные осложнения являются частыми [24].
Лабораторная диагностика ЦМВ-инфекции
Следует различать инфицированность СMV и болезнь, вызываемую вирусом. Например, наличие антител класса IgG к СMV у больного гепатитом не может быть доказательством его цитомегаловирусной этиологии. Наиболее надежным следует считать выделение возбудителя из ткани печени, полученной посредством биопсии или при патологоанатомическом исследовании. Это малоприменимо в рутинной практике, и, к счастью, существуют способы избежать проведения биопсии у части больных.
У иммунокомпетентных детей и взрослых при наличии мононуклеозоподобного заболевания и гепатита необходимо лишь подтвердить их цитомегаловирусную этиологию.
На острую инфекцию указывают наличие IgМ к СMV в высоком титре (более 300 Ед/мл), отсутствие, а затем появление IgG к СMV (сероконверсия), снижение со временем титра IgМ и увеличение — IgG, а также низкая авидность IgG в начале заболевания [3]. Вирусная нагрузка, выявляемая при ПЦР-исследовании, не коррелирует с тяжестью острой ЦМВ-инфекции и может быть низкой в пик заболевания. То же можно сказать и о CMV pp65-антигенемии, которая мало помогает в диагностике ЦМВ-заболевания у иммунокомпетентных пациентов, поскольку обладает низкой чувствительностью (около 50 %).
Гораздо более сложным является определение ЦМВ-заболевания у пациентов с иммуносупрессией. В этом случае возможна как острая инфекция, так и реактивация, реинфекция или суперинфекция (см. выше).
Серологические исследования в этом случае однозначно характеризуют статус больного (инфицирован или нет). Это чрезвычайно важно, например, в трансплантологии, при подборе донора и реципиента. Желательно, чтобы донор серонегативного реципиента также не имел бы маркеров ЦМВ-инфекции.
На острую инфекцию, реинфекцию и суперинфекцию указывает наличие специфических IgM. Однако они присутствуют далеко не всегда, особенно у пациентов с иммунодефицитом. У последних о недавнем инфицировании могут говорить появление IgG (сероконверсия или замена серонегативного статуса на серопозитивный) и их низкая авидность [13].
Также можно доказать инфицированность путем изоляции вируса из содержимого цервикального канала, семени здоровых лиц, равно как и из смывов из носоглотки, мочи пациентов с бессимптомной инфекцией или реконвалесцентов после острой первичной инфекции.
Определение вирусной нагрузки методом ПЦР может быть использовано для доказательства связи между виремией и цитомегаловирусным поражением конечных органов-мишеней у больных с иммуносупрессией. В трансплантологии ПЦР-диагностика используется для мониторинга реактивации ЦМВ-инфекции и при оценке эффективности противовирусной терапии [25–27]. Точность диагностики увеличивается при анализе динамики вирусной нагрузки, причем ее первоначальный уровень может быть использован как независимый предиктор риска заболевания [28]. Например, после трансплантации риск CMV-заболевания увеличивается при вирусной нагрузке 5000 копий/мл и выше (чувствительность — 85,7 %, специфичность — 86,8 %) [29]. Как указывалось выше, у иммунокомпетентных больных связь между вирусной нагрузкой и заболеванием не столь однозначная. Известно, что больные с острой ЦМВ-инфекцией могут иметь низкую виремию.
Если ситуация не столь однозначна и отличается от описанной выше, доказать связь между ЦМВ-инфекцией и поражением отдельных органов или систем можно исключительно путем выявления вируса в тканях пораженного органа. Это особенно важно у пациентов с иммуносупрессией.
Выделение вируса на культуре фибробластов требует больших затрат времени и малопригодно для диагностики острой инфекции. Современные методики культивирования могут дать результат уже через сутки [30]. Виремия, выявляемая методом культивирования, высокоинформативна для подтверждения ЦМВ-инфекции у иммунокомпрометированных лиц. Однако выделение возбудителя из мочи, бронхоальвеолярного лаважа часто наблюдается у этой категории лиц при отсутствии инвазивной ЦМВ-инфекции.
Как и виремия, CMV-антигенемия имеет важное значение в подтверждении инфекции у иммунокомпрометированных пациентов. У них антигенемия часто является следствием рецидива ЦМВ-инфекции независимо от наличия/отсутствия клинических проявлений и не может указывать на связь поражения тех или иных органов с ЦМВ-инфекцией. Однако число антиген-несущих клеток коррелирует как с виремией, так и c уровнем CMV-мРНК в лейкоцитах, поэтому число рр65-позитивных клеток, превышающее 6 на 200 000 гранулоцитов, указывает на возможную этиологическую роль CMV в развитии заболевания [31].
Гистологическое исследование имеет важное значение в диагностике инвазивного заболевания, поскольку позволяет как выделить вирус из образца тканей, так и увидеть большие внутриядерные и цитоплазматические включения. Их иногда называют «совиным глазом». Появление таких клеток — ответная реакция на размножающийся в них вирус и развивающееся в ответ воспаление. Гигантские клетки локализуются преимущественно в эпителии желчных протоков в печени, но могут быть обнаружены в гепатоцитах и купферовских клетках [32]. Данные гистологические изменения являются наиболее надежным маркером, связывающим ЦМВ-инфекцию с поражением конечных органов-мишеней. К сожалению, встречаются они не часто (не более чем в 10–15 % исследованных биоптатов).
Для идентификации CMV в биоптате могут быть использованы и иммуногистохимические методы с применением моноклональных антител или гибридизацией in situ.
Лечение ЦМВ-инфекции
Противовирусная терапия не показана иммунокомпетентным больным с ЦМВ-инфекцией. Однако при тяжелом течении и у больных с иммунодефицитом она может сохранить жизнь пациенту.
Для лечения системной цитомегаловирусной инфекции используются ганцикловир, фоскарнет и цидофовир. Ганциковир является препаратом первой линии [33]. Это нуклеозидный аналог гуанозина, гомологичен ацикловиру, однако с большим внутриклеточным периодом полужизни [34].
Обычная продолжительность лечения ганцикловиром составляет 2–4 недели, а иногда и больше. В этом случае исключительно внутривенное введение ганцикловира не имеет доказанных преимуществ перед его заменой на прием препарата внутрь. После 14-дневной индукционной внутривенной терапии ганцикловиром пациенты могут быть переведены на долговременный прием препаратов per os (например, валганцикловиром) [20, 35]. В сравниваемых группах больных — CMV-серонегативных реципиентов печени от серопозитивного донора не было случаев летальных исходов как среди пациентов, получавших ганцикловир только внутривенно, так и среди тех, кто получал препарат как внутривенно, так и per os. Переносимость терапии в обеих группах была хорошей.
Установленный риск рецидива при лечении ганцикловиром составляет 25–30 % [35]. Такие факторы, как серологический статус донора/реципиента, наличие мультисистемного заболевания, необходимость предупреждения и лечения начавшегося отторжения трансплантата, а также выраженность индуцированной иммуносупресии (например, антилимфоцитарная терапия), могут увеличивать риск рецидива.
Пациенты с рецидивом имели более высокую исходную вирусную нагрузку, более низкую частоту клиренса CMV и определяемую ДНК в периферической крови или плазме к концу терапии [36]. Таким образом, вирусная кинетика является как ранним предиктором развития CMV-заболевания, которое ассоциировано с быстрым нарастанием вирусной нагрузки, так и хорошим ответом на ПВТ, который ассоциируется с быстрым снижением вирусной нагрузки (в 2 раза — за 3,2 дня в сравнении с 8,8 у больных с рецидивом) [29].
Вопросы, касающиеся дозирования препаратов, представляют особый интерес, поскольку субтерапевтический уровень ганцикловира на фоне высокой вирусной нагрузки увеличивает риск резистентности. Справедливости ради надо отметить, что большинство задокументированных случаев рецидивов связано с неполной супрессией вируса, а не с развитием резистентности.
Фоскарнет и цидофовир являются альтернативной терапией, которая используется при развитии резистентности [37]. Последняя может развиваться и при лечении этими препаратами. Перекрестная резистентность к цидофовиру может диктовать необходимость более продолжительного лечения ганцикловиром. Наличие резистентности может быть подтверждено секвенированием вируса или возрастанием/появлением после исчезновения вирусной нагрузки [38]. Фоскарнет и цидофовир обладают ярко выраженным нефротоксическим эффектом, если используются в комбинации с циклоспорином. Ацикловир при ЦМВ-инфекции неэффективен [34].
Список литературы
1. Picone O., Vauloup-Fellous C., Cordier A.G. et al. A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome // Prenat. Diagn. — 2013 Aug. — 33(8). — 751-8.
2. Pass R.F. A key role for adolescents in the epidemiology of cytomegalovirus and genital herpes infection // Clin. Infect. Dis. — 2004. — 39. — 1439-1440.
3. Gandhi M.K., Khanna R. Human cytomegalovirus: clinical aspects, immune regulation, and emerging treatments // Lancet Infect. Dis. — 2004. — 4. — 725-738.
4. Bernard S., Germi R., Lupo J., Laverrière M.H. et al. Symptomatic cytomegalovirus gastrointestinal infection with positive quantitative real-time PCR findings in apparently immunocompetent patients: a case series // Clin. Microbiol. Infect. — 2015 Dec. — 21(12). — 1121.
5. Kytö V., Vuorinen T., Saukko P. et al. Cytomegalovirus infection of the heart is common in patients with fatal myocarditis // Clin. Infect. Dis. — 2005. — 40. — 683-688.
6. Stagno S., Pass R., Dworsky M. et al. Congenital cytomegalovirus infection: The relative importance of primary and recurrent maternal infection // N. Engl. J. Med. — 1982. — 306. — 945-949.
7. Stagno S., Whitley R. Herpesvirus infections of pregnancy. Part I: Cytomegalovirus and Epstein — Barr virus infections // N. Engl. J. Med. — 1985. — 313. — 1270-1274.
8. Hui L., Wood G. Perinatal outcome after maternal primary cytomegalovirus infection in the first trimester: a practical update and counseling aid // Prenat. Diagn. — 2015 Jan. — 35(1). — 1-7.
9. Crumpacker C.S., Wadhwa S. Cytomegalovirus / Ed. by Mandell G.J., Bennett J.E., Dolin R. // mandell, Douglas and Bennett’s Principles and Practice of Infectious Diseases. — 6th edn. — Philadelphia, PA: Elsevier, 2005. — Р. 1786-1800.
10. Gallegos-Orozco J.F., Rakela-Brödner J. Hepatitis viruses: not always what it seems to be // Rev. Med. Chil. — 2010 Oct. — 138(10). — 1302-11.
11. Yaghobi R., Zamani S., Gramizadeh B., Rahsaz M. Etio–logy of DNA virus infections in liver transplant recipients with neonatal hepatitis // Transplant Proc. — 2010 Apr. — 42(3). — 837-8.
12. Watanabe S., Arima K., Nishioka M., Yoshino S., Hasui H., Fujikawa M. Comparison between sporadic cytomegalovirus hepatitis and Epstein-Barr virus hepatitis in previously healthy adults // Liver. — 1997. — 17. — 63-9.
13. Wreghitt T.G., Teare E.L., Sule O. et al. Cytomegalovirus infection in immunocompetent patients // Clin. Infect. Dis. — 2003. — 37. — 1603-1606.
14. Kunno A., Abe M., Yamada M. et al. Clinical and histological features of cytomegalovirus hepatitis in previously healthy adults // Liver. — 1997. — 17. — 129-132.
15. Mosley J.W., Redeker A.G., Feinstone S.M. et al. Mutliple hepatitis viruses in multiple attacks of acute viral hepatitis // N. Engl. J. Med. — 1977. — 296. — 75-78.
16. Amory J.K., Rosen H., Sukut C. et al. Clinical problem-solving. A jaundiced eye // N. Engl. J. Med. — 2006. — 354. — 1516-1520.
17. Tonolini M., Bianco R. HIV-related/AIDS cholangiopathy: pictorial review with emphasis on MRCP findings and differential diagnosis // Clin. Imaging. — 2013 Mar — Apr. — 37(2). — 219-26.
18. Blumberg R., Kelsey P., Perrone T., Dickersin R., Laquaglia M., Ferruci J. Cytomegalovirus- and Cryptosporidium-associated acalculous gangrenous cholecystitis // Am. J. Med. — 1984. — 76. — 1118-23.
19. Jacobson M., Cello J., Sande M. Cholestasis and disseminated cytomegalovirus disease in patients with the acquired immunodeficiency syndrome // Am. J. Med. — 1988. — 84. — 218-224.
20. Winston D.J., Busuttil R.W. Randomized controlled trial of sequential intravenous and oral ganciclovir versus prolonged intra- venous ganciclovir for long-term prophylaxis of cytomegalovirus disease in high-risk cytomegalovirus-seronegative liver transplant recipients with cytomegalovirus-seropositive donors // Transplantation. — 2004. — 77. — 305-308.
21. Paya C.V. Prevention of cytomegalovirus disease in recipients of solid-organ transplants // Clin. Infect. Dis. — 2001. — 32. — 596-603.
22. Preiksaitis J.K., Brennan D.C., Fishman J. et al. Canadian society of transplantation consensus workshop on cytomegalovirus management in solid organ transplantation final report // Am. J. Transplant. — 2005. — 5. — 218-227.
23. Cope A.V., Sabin C., Burroughs A. et al. Interrelationships among quantity of human cytomegalovirus (HCMV) DNA in blood, donor-recipient serostatus, and administration of methylprednisolone as risk factors for HCMV disease following liver transplantation // J. Infect. Dis. — 1997. — 176. — 1484-1490.
24. Lautenschlager I., Halme L., Hockerstedt K. et al. Cytomegalovirus infection of the liver transplant: virological, his- tological, immunological, and clinical observations // Transpl. Infect. Dis. — 2006. — 8. — 21-30.
25. Shinkai M., Bozzette S.A., Powderly W. et al. Utility of urine and leukocyte cultures and plasma DNA polymerase chain reaction for identification of AIDS patients at risk for developing human cytomegalovirus disease // J. Infect. Dis. — 1997. — 175. — 302-308.
26. Imbert-Marcille B.M., Cantarovich D., Ferre-Aubineau V. et al. Usefulness of DNA viral load quantification for cytomegalovirus disease monitoring in renal and pancreas/renal transplant recipients // Transplantation. — 1997. — 63. — 1476-1481.
27. Flexman J., Kay I., Fonte R. et al. Differences between the quantitative antigenemia assay and the cobas amplicor monitor quantitative PCR assay for detecting CMV viraemia in bone marrow and solid organ transplant patients // J. Med. Virol. — 2001. — 64. — 275-282.
28. Emery V.C., Sabin C.A., Cope A.V. et al. Application of viral-load kinetics to identify patients who develop cytomegalovirus disease after transplantation // Lancet. — 2000. — 355. — 2032-2036.
29. Piiparinen H., Hockerstedt K., Lappalainen M. et al. Monitoring of viral load by quantitative plasma PCR during active cytomegalovirus infection of individual liver transplant patients // J. Clin. Microbiol. — 2002. — 40. — 2945-2952.
30. Martin W.I., Smith T. Rapid detection of cytomegalovirus in bronchoalveolar lavage specimens by a monoclonal antibody method // J. Clin. Microbiol. — 1986. — 23. — 1006-1008.
31. Humar A., Gregson D., Caliendo A.M. et al. Clinical utility of quantitative cytomegalovirus viral load determination for predicting cytomegalovirus disease in liver transplant recipients // Transplantation. — 1999. — 68. — 1305-1311.
32. Espy M., Paya C., Holley K., Ludwig J., Hermans P.F., Wiesner R.H. et al. Diagnosis of cytomegalovirus hepatitis by histopathology and in situ hybridization in liver transplantation // Diag. Microbiol. Infect. Dis. — 1991.
33. Plotkin S., Starr S., Bryan C. In vitro and in vivo responses of cytomegalovirus to acyclovir // Am. J. Med. — 1982. — 73. — 257-261.
34. Razonable R.R. Cytomegalovirus infection after liver transplantation: current concepts and challenges // W. J. Gastroenterol. — 2008. — 14. — 4849-60.
35. Falagas M.E., Snydman D.R., Griffith J. et al. Clinical and epidemiological predictors of recurrent cytomegalovirus disease in orthotopic liver transplant recipients. Boston Center for Liver Transplantation CMVIG Study Group // Clin. Infect. Dis. — 1997. — 25. — 314-317.
36. Sia I.G., Wilson J.A., Groettum C.M. et al. Cytomegalovirus (CMV) DNA load predicts relapsing CMV infection after solid organ transplantation // J. Infect. Dis. — 2000. — 181. — 717-720.
37. Delice S., Gökahmetoğlu S., Kaynar L., Karakükcü M. Investigation of ganciclovir resistance in CMV UL54 and UL97 gene regions in immunocompromised patients receiving gancyclovir treatment // Mikrobiyol. Bul. — 2015 Jul. — 49(3). — 393-402.
38. Lurain N.S., Bhorade S.M., Pursell K.J. et al. Analysis and characterization of antiviral drug-resistant cytomegalovirus isolates from solid organ transplant recipients // Clin. Infect. Dis. — 2002. — 186. — 760-768.