Журнал «Почки» 1 (15) 2016
Вернуться к номеру
Гипоксия — ведущий фактор прогрессирования хронической болезни почек
Авторы: Лисянская О.Ю. - Киевская областная клиническая больница
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Современные данные свидетельствуют об участии гипоксии в процессе формирования фиброза в почках и прогрессирования хронической болезни почек. Одним из основных факторов в цепочке повреждения при тканевом дефиците кислорода является индуцированный гипоксией фактор. Понимание процесса повреждения почки при гипоксии может дополнить представление о нефропротекции пациентов с хронической болезнью почек, даст возможность улучшить рекомендации по ведению данной группы больных.
Сучасні дані свідчать про участь гіпоксії в процесі формування фіброзу в нирках і прогресування хронічної хвороби нирок. Одним з основних факторів у ланцюжку пошкодження при тканинному дефіциті кисню є індукований гіпоксією фактор. Розуміння процесу пошкодження нирки при гіпоксії може доповнити уявлення про нефропротекцію пацієнтів із хронічною хворобою нирок, дасть можливість поліпшити рекомендації щодо ведення даної групи хворих.
Recent data indicate the involvement of hypoxia in the formation of kidney fibrosis and progression of chronic renal disease. One of the main factors in the chain of damage in the tissue oxygen deficiency is a hypoxia-induced factor. Understanding the process of kidney damage during hypoxia can complement the concept of nephroprotection in patients with chronic kidney disease, will provide an opportunity to improve the guidelines on the management of this group of patients.
гипоксия, хроническая болезнь почки, фиброз, индуцированный гипоксией фактор.
гіпоксія, хронічна хвороба нирок, фіброз, індукований гіпоксією фактор.
hypoxia, chronic kidney disease, fibrosis, hypoxia-induced factor.
Статья опубликована на с. 64-66
Достаточное снабжение кислородом клеток и тканей — неотъемлемое условие для нормального функционирования организма. Нарушение баланса между потребностью клеток и доставкой кислорода приводит к развитию гипоксии.
Физиологическая гипоксия почки. Особенности строения
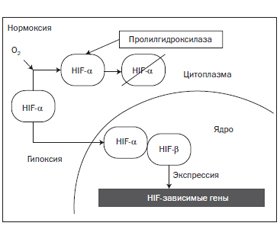
Гипоксия и индуцированный гипоксией фактор
HIF в условиях гипоксии и нормоксии
Порочный круг: гипоксия — повреждение почки — гипоксия
Выводы
1. Birguel Kurt, Katharina Gerl. Chronic Hypoxia-Inducible Transcription Factor-2 Activation Stably Transforms Juxtaglomerular Renin Cells into Fibroblast-Like Cells In Vivo // J. Am. Soc. Nephrol. — Mar 1, 2015. — № 26. — Р. 587-596.
2. Gunnar Schley, Bernd Klanke, Johannes Schцdel, Frauke Forstreuter, Deepa Shukla, Armin Kurtz, Kerstin Amann, Michael S. Wiesener, Seymour Rosen, Kai-Uwe Eckardt, Patrick H. Maxwell, Carsten Willam. Hypoxia-Inducible Transcription Factors Stabilization in the Thick Ascending Limb Protects against Ischemic Acute Kidney Injury // Journal of the American Society of Nephrology. — 2010. — № 22. — Р. 2004-2015.
3. Haase Dr. Volker H. Mechanisms of Hypoxia Responses in Renal Tissue // Journal of the american society of nephrology. — April 2013. — № 24. — Р. 537-541.
4. Kaelin W.G. Jr, Ratcliffe P.J. Oxygen sensing by metazoans: the central role of the HIF hydroxylase pathway // Molecular Cell. — 2008. — № 4. — Р. 393-402.
5. Eckardt K.-U., Rosenberger C., Jьrgensen J.S. Wiesener Role of Hypoxia in the Pathogenesis of Renal Disease // Blood Purification. — 2003. — № 3. — Р. 253-257.
6. Malou Friederich-Persson, Patrik Persson, Angelica Fasching, Peter Hansell, Lina Nordquist, Fredrik Palm. Increased kidney metabolism as a pathway to kidney tissue hypoxia and damage: effects of triiodothyronine and dinitrophenol in normoglycemic rats // Аdvanced experimental medical biology. — 2013. — № 789. — Р. 9-14.
7. Mei Yee Koh, Garth Powis. Passing the baton: The HIF switch // Trends in Biochemical Sciences. — 2012. — № 37. — Р. 364-372.
8. Nanduri R. Prabhakar, Gregg L. Semenza. Oxygen Sen–sing and Homeostasis // Physiology Published. — 2015. — № 30. — Р. 340-348.
9. Núria M. Pastor-Soler, Muc1 is protective during kidney ischemia-reperfusion injury // J. Am. Soc. Renal Physiol. — Jun 15, 2015. — № 308. — Р. 452-462.
10. Peter Carmeliet, Yuval Dor, Jean-Marc Herbert, Dai Fukumura, Koen Brusselmans, Mieke Dewerchin, Michal Neeman, Franзoise Bono, Rinat Abramovitch, Patrick Maxwell, Cameron J. Koch, Peter Ratcliffe, Lieve Moons, Rakesh K. Jain, Dйsirй Collen. Role of HIF-1alpha in hypoxia-mediated apoptosis, cell proliferation and tumour angiogenesis // Nature. — 1998. — № 394. — Р. 485-497.
11. Roger G. Evans, Bruce S. Gardiner, David W. Smith, Paul M. O’Connor. Intrarenal oxygenation: unique challenges and the biophysical basis of homeostasis // American Journal of Physiology — Renal Physiolog. — 2008. — № 295. — Р. 59-70.
12. Schönenberger D., Harlander S., Rajski M., Jacobs R.A., Lundby A.K., Adlesic M., Hejhal T., Wild P.J., Lundby C., Frew I.J. Formation of renal cysts and tumors in Vhl/Trp53-deficient mice requires HIF-1α and HIF-2α // Cancer research. — 2016. — № 1. — Published Online First.
13. Qingdong Ke, Max Costa. Hypoxia-Inducible Factor-1 (HIF-1) // Molecular Pharmacology. — 2006. — Vol. 70. — Р. 69-80.
14. Xiaofang Yu Yi Fang, Hong Liu, Jiaming Zhu, Jianzhou Zou, Xunhui Xu, Suhua Jiang, Xiaoqiang Ding. The balance of beneficial and deleterious effects of hypoxia-inducible factor activation by prolyl hydroxylase inhibitor in rat remnant kidney depends on the timing of administration // Nephrol. Dial. Transplant. — 2012. — № 27. — Р. 110-119.
15. Xuan Li, Hideki Kimura, Kiichi Hirota. Hypoxia reduces the expression and anti-inflammatory effects of peroxisome proliferator-activated receptor-γ in human proximal renal tubular cells // Nephrol. Dial. Transplant. — 2007. — № 22. — Р. 41-51.
16. Левина А.А. Регуляция гомеостаза кислорода, фактор, индуцированный гипоксией (HIF), и его значение в гомеостазе кислорода // Педиатрия. — 2009. — Т. 87, № 4. — С. 92-97.
17. Овсянников В.Г. Патологическая физиология, типовые патологические процессы. — Ростовский медицинский университет, 1987. — 192 с.
18. Серебровская Т.В. Гипоксия-индуцибельный фактор: роль в патофизиологии дыхания // Украинский пульмонологический журнал. — 2005. — № 3. — С. 77-81.

/65.jpg)