Статтю опубліковано на с. 81-86
Синдром полікістозних яєчників (СПКЯ) — поліморфна патологія з надмірною варіабельністю клінічної картини, що ускладнює діагностику даного захворювання та деколи викликає сумніви в можливості виділення його в самостійну нозологічну форму. Із сучасних позицій основними клінічними проявами СПКЯ є гіперандрогенія, овуляторна дисфункція та кістозні зміни в яєчниках. Синдром асоціюється з високим ризиком безпліддя, цукрового діабету (ЦД) та метаболічних порушень, які, у свою чергу, є факторами ризику серцево-судинної патології.
Протягом останніх трьох десятиліть виявлено зв’язок СПКЯ з інсулінорезистентністю (ІР), що дозволило по-новому поглянути на деякі питання патогенезу СПКЯ [1]. Встановлено, що для СПКЯ зниження чутливості до інсуліну є типовим дефектом, який обумовлений генетично, тобто не залежить від ступеня ожиріння, гормональних і клінічних особливостей [2]. ІР та компенсаторна гіперінсулінемія (ГІ) спостерігаються в 65–70 % хворих зі СПКЯ, серед яких 70–80 % жінок мають надлишкову вагу, а 25–35 % — нормальну масу тіла [3]. ІР та вторинна ГІ впливають на всю палітру порушень, асоційованих зі СПКЯ, однак точна послідовність ініціації порушень та механізм їх розвитку залишаються нез’ясованими. Дотепер найбільш досліджуваним і суперечливим фрагментом патогенезу СПКЯ є встановлення впливу інсуліну на розвиток порушення овуляції, посилення синтезу андрогенів із формуванням структури оваріальної тканини [4].
На сьогодні препаратом, що найчастіше використовується при лікуванні репродуктивної патології у жінок зі СПКЯ на тлі ІР, є метформін [5]. Основна метаболічна дія метформіну полягає в зниженні рівня глюкози в сироватці крові завдяки вторинному впливу на метаболізм інсуліну, пригніченню в печінці глюконеогенезу та підвищенню чутливості периферичних тканин до інсуліну, що чинить позитивний метаболічний вплив на інсулінозалежні тканини, а саме скелетні м’язи, жирову тканину, ендотелій судин та яєчники [6]. Метформін може впливати на яєчники опосередковано або прямим шляхом, через вплив на стероїдогенез і фолікулогенез [7]. Висловлюють припущення, що через пряму дію на яєчники можливе відновлення менструального циклу, збільшення частоти овуляції та настання вагітності [8]. Відомо, що інсулін стимулює ряд ферментів, які беруть участь у стероїдогенезі в яєчниках, а саме ген CYP17, 3-бета-гідроксистероїддегідрогеназу (3β-HSD) та стероїдогенний гострий регуляторний білок (StAR-протеїн). Позитивний ефект метформіну при СПКЯ обумовлений безпосередньою дією на яєчник та пом’якшенням впливу надлишку інсуліну. Покращуючи чутливість до інсуліну, метформін знижує активність CYP17. Крім того, метформін пригнічує продукцію андростендіону за рахунок безпосередньої дії в тека-клітинах яєчників, також знижує активність 3β-HSD, StAR-протеїну, гена CYP11A1 у клітинах гранульози жінок зі СПКЯ (що супроводжується зниженням рівня естрадіолу й прогестерону). Молекулярні механізми дії метформіну на яєчник залишаються остаточно не з’ясованими, проте в останніх дослідженнях було показано, що метформін збільшує активність 5-АМФ-активованої протеїнкінази в клітинах гранульози щурів, призводячи тим самим до зниження синтезу стероїдів [9]. Незважаючи на те, що механізм його дії при СПКЯ до кінця не вивчено, метформін широко застосовується у хворих зі СПКЯ з метою регулювання циклу та індукції овуляції. Однак у літературі все частіше з’являються повідомлення, які вказують на те, що метформін призводить до підвищення сироваткового рівня гомоцистеїну (ГЦ) навіть після короткого періоду лікування [10].
У даний час активно вивчається роль гіпергомоцистеїнемії (ГГЦ) у хворих зі СПКЯ як одного з факторів формування ендотеліальної дисункції, цукрового діабету, серцево-судинної патології та порушення репродуктивної функції. Класична ГГЦ характеризується як накопичення ГЦ через дефекти ферментних шляхів. Трансформація ГЦ у процесі метаболізму потребує участі фолієвої кислоти (ФК), вітамінів В6 і В12 як коферментів або субстратів ферментів. Вважається, що в 75 % випадків причиною ГГЦ є дефіцит саме ФК та вітамінів В6 і В12 [11].
У літературі є дані про підвищену частоту ГГЦ у хворих зі СПКЯ [10] та вказується на зв’язок ГГЦ з дисліпідемією, ожирінням і гіперандрогенією. Існує багато суперечок щодо взаємозв’язку ГЦ з ІР [12]. M.F. McCarty оцінює інсулін як фактор модуляції ГЦ за рахунок пригнічення інсуліном печінкової цистатіон-β-синтетази [13]. У деяких клінічних роботах виявили позитивний зв’язок підвищеного рівня ГЦ з рівнем інсуліну [14], у той час як інші дослідники заперечують його існування. H. Bar-On та співавт. вказують на наявність негативної кореляції між інсуліном та ГЦ. Інші автори виявили значну негативну кореляцію між рівнем ГЦ та ІР, але не можуть цього пояснити і припускають, що ГГЦ та ІР існують окремо, не потенціюючи один одного [15].
У проспективному рандомізованому плацебо-контрольованому дослідженні S. Carlsen і співавт. не виявили збільшення рівня ГЦ під час терапії метформіном як у невагітних, так і у вагітних жінок зі СПКЯ. Однак при цьому в групі невагітних жінок відзначалося зниження рівня фолату й вітаміну В12 у сироватці крові на тлі проведеної терапії. Передбачається, що прийом метформіну впливає на функцію шлунково-кишкового тракту, призводить до мальабсорбції вітаміну В12 і фолатів у кишечнику [16], однак цьому можна запобігти додатковим прийомом фолатів.
Дослідники прийшли до єдиної думки, що похідні ФК — фолати беруть участь у безлічі обмінних процесів та є кофакторами багатьох ферментативних реакцій синтезу амінокислот, таких як метіонін, серин, гліцин, нуклеїнові кислоти, пурини, піримідини, вітаміни. ФК опосередковано впливає на метаболізм катехоламінів, сприяє утворенню серотоніну в головному мозку, тобто чинить антидепресивний вплив. Крім того, ФК підвищує вміст холіну, що перешкоджає жировій інфільтрації печінки й покращує функціонування кишечника [17].
Фолати також беруть участь в реакціях метилювання білків, гормонів, ліпідів, нейромедіаторів та інших субстратів обміну речовин [18].
Недостатність ФК формує малі симтомокомплекси, що значно знижують якість життя й погіршують самопочуття жінки (підвищена стомлюваність, погіршення пам’яті, слабкість, головний біль, блідість шкіри та слизових оболонок; порушення еритропоезу, пригнічення секреторної ланки імунної системи). Сьогодні дефіцит фолатів пов’язують з ризиком розвитку гострих коронарних синдромів та інсультів. Вважається, що ФК забезпечує профілактику глибоких венозних тромбозів та емболій. ФК є важливою для нормальних процесів росту, розвитку й проліферації тканин, у тому числі й для ембріогенезу [19].
Останніми роками доведено, що дефіцит фолатів та асоційований з ним підвищений вміст ГЦ у сироватці крові та фолікулярній рідині призводить до порушення розвитку фолікула й дозрівання яйцеклітини, порушення оваріального резерву й настання вагітності [20].
Також дослідники дійшли єдиного висновку, що субклінічні порушення метаболізму фолатів поза вагітністю в більшості випадків яскраво маніфестують при її настанні. Недостатність фолатів в організмі жінки репродуктивного віку значно підвищує вірогідність вад розвитку плода [21].
Отже, дефіцит ФК, що виникає під час прийому метформіну, може погіршити результат лікування.
Дані літератури свідчать про значну роль ФК і ГЦ у збереженні соматичного здоров’я та репродуктивної функції жінок. У той же час вплив метформіну на рівень фолатів та концентрацію ГЦ у хворих зі СПКЯ має суперечливий характер, і нерідко дослідники отримують різні результати. Отже, зважаючи на неоднозначність результатів світових досліджень, необхідно зосередитися на виявленні умов, за яких втручання буде більш виправданим [3].
Мета дослідження — оцінити вплив монотерапії метформіном та метформіном у поєднанні з фолатами на рівень ФК та ГЦ у сироватці крові хворих зі СПКЯ.
Матеріал і методи
У межах цієї роботи обстежено 40 жінок, які звернулися до клініки ДУ «ІПЕП» з 2013 по 2015 р., яким на підставі критеріїв Роттердамського консенсусу 2003 року (хронічна ановуляція, гіперандрогенія, ехографічні ознаки полікістозних яєчників) поставлено діагноз СПКЯ [22], а після додаткового обстеження виявлені ГІ та ІР.
Контрольну групу становили 20 здорових жінок із нормальною менструальною функцією, які звернулися до клініки для уточнення стану репродуктивної системи перед плануванням вагітності.
Індекс маси тіла (ІМТ) за G. Brey розраховували за формулою: маса тіла (кг)/довжина тіла (м2). Оцінка метаболічного статусу включала визначення рівня інсуліну в сироватці крові натще, показник понад 12 мкОД/мл розцінювався як ГІ. ІР оцінювали шляхом визначення індексу НОМА-IR, що розраховували за формулою: рівень інсуліну сироватки натще (мкОД/мл) × глюкоза плазми натще (ммоль/л)/22,5. Показник НОМА-IR вище за 2,5 розцінювався як об’єктивний критерій ІР. Для визначення гормонального стану за допомогою наборів для імуноферментного аналізу досліджували базальні рівні лютеїнізуючого (ЛГ), фолікулостимулюючого (ФСГ) гормонів, загального тестостерону (Т) (набори фірми «Алкор Био», РФ), естрадіолу (Е2), імунореактивного інсуліну (ІРІ), глобуліну, що зв’язує статеві гормони (ГЗСГ) (набори фірми DRG, США), та розраховували індекс вільних андрогенів (ІВА) за формулою: (Т/ГЗСГ) × 100 %. Вимірювання рівня секреції гормонів проводили в сироватці крові на 2–3-й день менструального циклу на аналізаторі Stat Fax 3100 виробництва США. Уміст загального холестерину (ХС) та тригліцеридів (ТГ) у сироватці крові визначали колориметричним методом з використаням наборів «Спайн–Лаб» виробництва України.
Визначення рівня ГЦ у сироватці крові проводили з використанням наборів Architect system (Німеччина). Дотепер існують розбіжності у визначенні норми концентрації ГЦ. Дані літератури свідчать, що нормальна концентрація ГЦ у крові жінок репродуктивного віку (18–40 років) не повинна перевищувати 8–10 мкмоль/л [23]. У подальшій роботі концентрацію в крові ГЦ 10 мкмоль/л розглядали як верхню межу норми.
Визначення концентрації в сироватці крові ФК проводили фотометричним методом на спектрофотометрі СФ-46. Референтні значення ФК становили 52,5–119,5 ммоль/л.
На сьогодні для досягнення тієї чи іншої мети у хворих зі СПКЯ відсутній алгоритм вибору оптимальної добової дози метформіну залежно від ІМТ та ступеня ІР. У той же час при оцінці терапевтичної ефективності метформіну для лікування ановуляторного безпліддя у всіх рандомізованих плацебо-контрольованих дослідженнях застосовуються досить низькі та неоптимальні дози метформіну [24]. У зв’язку з цим у своїй роботі всім пацієнткам зі СПКЯ ми призначали метформін у дозі 1700 мг на добу. Залежно від виду терапії (комбінована або монотерапія) всі пацієнтки були розділені на дві групи: першу становили 20 жінок, які протягом шести місяців отримували метформін (Сіофор, «Берлін Хемі АГ») по 850 мг двічі на добу; другу — 20 пацієнток, які крім метформіну приймали ФК в дозі 5 мг на добу. Обстеження проводили до початку та через 6 місяців лікування.
Пацієнтки обох груп були порівнянні за віком та масою тіла. Серед жінок першої групи нормальну масу тіла мали 10 пацієнток (50 %), надлишкову — 6 (30 %), ожиріння — 4 (20 %), у другій групі — 10 (50 %), 5 (25 %) і 5 (25 %) відповідно.
Проведені дослідження відповідають морально-етичним нормам та принципам Гельсінської декларації, Конвенції Ради Європи та відповідним законам України щодо дотримання прав людини.
Статистична обробка одержаних даних проводилася методами варіаційної статистики за допомогою стандартного пакета статистичних розрахунків Statistica 6.0. Розраховували середнє арифметичне значення та похибку середнього арифметичного (–x ± S–x). Вірогідність розбіжностей середніх величин визначали за t-критерієм Стьюдента. Розбіжності вважалися значущими при р < 0,05. Для вивчення зв’язку між показниками застосовували метод кореляції з визначенням коефіцієнтів кореляції Пірсона (r) і встановленням його значущості за t-критерієм з 95% рівнем надійності (р < 0,05). Дані наведені як (–x ± S–x).
Результати дослідження
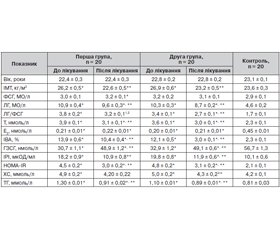
Аналіз отриманих даних показав, що пацієнтки обох груп мали характерні для СПКЯ гормональні порушення. У 12 (60 %) обстежених першої та 11 (55 %) хворих другої груп рівень ЛГ перевищував 10 МО/л та в середньому був вірогідно вищим (р < 0,001), ніж у контролі, при цьому рівень ФСГ перебував у межах норми. Гіперандрогенія виявлялася підвищенням секреції загального тестостерону у 18 (90 %) жінок першої та у 17 (85 %) — другої групи обстежених, зниженням (р < 0,001) рівня Е2, що супроводжувалося вірогідним підвищенням (р < 0,001) співвідношення Т/Е2. Разом з цим середній рівень ГЗСГ був нижчим (р < 0,001) порівняно з показниками здорових жінок, що призводило до значного підвищення ІВА в обох групах.
У всіх хворих зі СПКЯ відзначалася компенсаторна ГІ, а у 36 (90 %) спостерігалося порушення толерантності до вуглеводів. Відмінностей між групами за середніми показниками вуглеводного обміну не встановлено.
У 30 (75 %) хворих зі СПКЯ виявлена дисліпідемія. У структурі ліпідних порушень в обох групах домінувала ізольована гіперхолестеринемія, майже в кожної другої пацієнтки (18 осіб, 45 %) відзначалось підвищення рівнів тригліцеридів. Результати наведені в табл. 1.
Вихідні середні рівні ГЦ у обстежених зі СПКЯ були вірогідно (р < 0,001) вищими за показники контрольної групи. У 20 (50 %) жінок першої та у 21 (52 %) — другої групи виявлена ГГЦ; істотної різниці в рівнях ГЦ між групами не виявлено. За даними дослідження не встановлено зв’язку між ГЦ та ІМТ (r = 0,19, р > 0,05), ІРІ (r = 0,16, р > 0,05), НОМА-IR (r = 0,24, р > 0,05).
Вихідний середній рівень ФК в плазмі крові у хворих обох груп був значно (р < 0,001) нижчим за середні показники здорових жінок. У 8 (40 %) пацієнток першої та 10 (50 %) — другої групи рівень ФК у плазмі крові був нижче від референтних значень норми і в середньому становив 47,40 ± 1,03 ммоль/л і 45,90 ± 1,02 ммоль/л відповідно. У решти хворих вміст ФК у плазмі був у межах референтних значень норми, проте її середній показник в обох групах (53,90 ± 1,03 ммоль/л і 55,60 ± 1,03 ммоль/л відповідно) залишався (р < 0,001) нижчим за показник контролю.
Нами не встановлено зв’язку між ФК та ІМТ (r = 0,11, р > 0,05), ІРІ (r = 0,19, р > 0,05), індексом НОМА-IR (r = 0,21, р > 0,05), Т (r = 0,17, р > 0,05), однак виявлено позитивну кореляційну залежність із ГЗСГ (r = 0,51, р < 0,05) та негативну кореляційну залежність з ГЦ (r = –0,49, р < 0,05).
На тлі терапії метформіном спостерігалися істотні зміни метаболічних і гормональних показників, хоча вірогідна різниця між групами була відсутня. Насамперед лікування супроводжувалось зниженням індексу НОМА-IR на 34 % (р < 0,001), базального рівня ІРІ — на понад 39 % (р < 0,001), холестерину — на 14,3 % (р < 0,01) та тригліцеридів — до 30 % (р < 0,001) рівною мірою в обох групах. Показники ЛГ вірогідно (р < 0,02) знижувалися в обох групах, показники ФСГ не змінювались (р > 0,05), а співвідношення ЛГ/ФСГ відповідно зменшувалось. Паралельно відбувалося зниження загального тестостерону (р < 0,001), хоча його рівень зберігався значно вищим за норму. За рахунок зменшення рівня тестостерону та підвищення ГЗСГ спостерігалось зниження ІВА до 25 % (р < 0,001) (табл. 1).
Обговорення результатів дослідження
У даному дослідженні після шести місяців терапії метформіном виявлено, що середній рівень ФК майже не змінювався (р > 0,05) та залишався зниженим відносно показників здорових жінок. У той же час середній рівень ГЦ в плазмі зростав на 18,3 % (з 11,5 ± 0,4 мкмоль/л дo 13,6 ± 0,5 мкмоль/л; р < 0,02). Зазначений ефект не залежав від зниження ІРІ, індексу НОМА-IR та концентрації ФК і свідчив про те, що зростання рівня ГЦ може бути пов’язане з факторами, які діють додатково до лікування метформіном.
Комбінована терапія призводила до змін метаболічних та гормональних показників подібно до монотерапії, однак крім цього спостерігалось ще й підвищення рівня ФК з 52,3 ± 1,1 ммоль/л до 58,6 ± 1,1 ммоль/л (р < 0,001), тобто в середньому на 12,04 %. Найбільше підвищення ФК відзначалося в пацієнток з вихідним рівнем ФК у межах референтних значень норми. Середній рівень ГЦ знижувався з 11,9 ± 0,4 мкмоль/л до 10,2 ± 0,4 мкмоль/л (р < 0,002), на 14,3 %.
Отже, отримані нами результати перегукуються з даними деяких авторів [25], що вказують на збільшення концентрації ГЦ на тлі прийому метформіну у хворих зі СПКЯ. Додавання ФК до терапії метформіном призводить до підвищення рівня ФК та зниження концентрації ГЦ.
Відомо, що підвищений рівень ГЦ пов’язаний зі зростанням ризику багатьох ускладнень соматичного та репродуктивного здоров’я. Тому зниження ГЦ на тлі терапії метформіном з додаванням ФК має позитивне значення, хоча механізм, що лежить в його підґрунті, залишається невстановленим. Припускають, що, можливо, має значення добре відомий фізіологічний ефект зниження ГЦ при підвищенні концентрації ФК. Однак у реалізацію цих ефектів можуть також включатися й інші невідомі механізми.
Висновки
Терапія метформіном протягом шести місяців призводить у жінок зі СПКЯ до зниження ІРІ, індексу НОМА-IR, позитивно впливає на рівні ліпідів, має помірний антиандрогенний ефект, однак супроводжується ще більшим зростанням рівня ГЦ — майже на 18,3 %, при цьому середній рівень ФК залишається практично незмінним.
Поєднання застосування метформіну та фолієвої кислоти впродовж шести місяців у хворих зі СПКЯ не посилює терапевтичного впливу на вуглеводний обмін та гормональні показники, але призводить до підвищення вмісту фолатів на 12,4 % і зниження рівня гомоцистеїну в плазмі понад 14,3 % порівняно з вихідними значеннями.
Список литературы
1. Metabolic syndrome and polycystic ovary syndrome: an intriguing overlapping [Text] / D. Caserta, G. Adducchio, S. Picchia [et al.] // Gynecol. Endocrinol. — 2014. — Vol. 30, № 6. — Р. 347-402.
2. Diamanti-Kandarakis E. Insulin resitance and the polycystic ovary syndrome revisited: an updata on mechanisms and implications [Text] / Е. Diamanti-Kandarakis, А. Dunaif // Endocrin. Rev. — 2012. — Vol. 33, № 6. — Р. 981-1030.
3. Marshall J.C. Аll women with PCOS should be treated for insulin resistance [Text] / J.C. Marshall, A. Dunaif // Fertil. Steril. — 2012. — Vol. 97, № 1. — Р. 18-22.
4. Bertoldo M. Impact of metformin on reproductive tissues: an overview from gametogenesis to gestation [Text] / M. Bertoldo, M. Faure, J. Dupont, P. Froment // Ann. Transl. Med. — 2014. — Vol. 2, № 6. — Р. 1-33.
5. Diamanti-Kandarakis E. Metformin in polycystic ovary syndrome [Text] / E. Diamanti-Kandarakis, F. Economou, S. Palimeri, C. Christakou // Ann. N. Y. Acad. Sci. — 2010. — Vol. 1205. — Р. 192-198.
6. Simmons D. Metformin treatment for Type 2 diabetes in pregnancy? [Text] / D. Simmons // Best Pract. Res. Clin. Endocrinol. Metab. — 2010. — Vol. 24, № 4. — Р. 625-634.
7. Palomba S. Systemic and local effects of metformin administration in patients with polycystic ovary syndrome (PCOS): relationship to the ovulatory response [Text] / S. Palomba, A. Falbo, T. Russo, F. Orio // Hum. Reprod. — 2010. — Vol. 25, № 4. — Р. 1005-1013.
8. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database of Systematic Reviews [Text] / T. Tang, J.M. Lord, R.J. Norman [et al.] // Cochrane Library. — 2012. — № 5. — CD003053.
9. Cellular and molecular mechanisms of metformin: an overview [Text] / B. Viollet, B. Guigas, N. Sanz Garcia [et al.] // Clin. Sci. (Lond). — 2012. — Vol. 122, № 6. — Р. 253-270.
10. Manzor-al-ajdad O. Evaluation of homocystein levels in patients with polycystic ovary syndrome [Text] / O. Manzor-al-ajdad, E.N. Samani, A. Abadi // Int. J. Fertil. and Sterilly. — 2011. — Vol. 4, № 4. — Р. 168-171.
11. Increased homocysteine levels in polycystic ovary syndrome [Text] / de la M. Calle, T. Gallardo, M. D. Diestro [et al.] // Clinical Medicine. — 2007. — Vol. 129, № 8. — Р. 292-294.
12. Correlation between elevated homocysteine levels and insulin resistance in infertile women with or without polycystic ovary syndrome in North Indian Population [Text] / S. Rekha, M.L. Palet, G. Pooja [et al.] // Intern. J. Medicine and Medical Sciences. — 2013. — Vol. 5, № 3. — Р. 116-23.
13. McCarty M.F. Increased homocysteine associated with smoking, chronic inflammation, and ageing may reflect acute-phase induction of pyridoxal phosphatase activity [Text] / M.F. McCarty // Med. Hypoth. — 2000. — Vol. 55. — Р. 289-293.
14. Plasma homocysteine in polycystic ovary syndrome: does it correlate with insulin resistance and ethnicity? [Text] / C.N. Wijeyaratne, K. Nirantharakumar, A.H. Balen [et al.] // Clinical Endocrinol. — 2004. — Vol. 60, № 5. — Р. 560-567.
15. Homocysteine levels in women with polycystic ovary syndrome treated with metformin versur rosiglitazone: a randomized study [Text] / E.B. Kilicdag, T. Bagis, H.B. Zeyneloglu [et al.] // Hum. Reprod. — 2005. — Vol. 20, № 4. — Р. 894-899.
16. Vitamin B12 status in metformin treated patients: systematic review [Text] / Q. Liu, S. Li, H. Quan, J. Li // PLoS One. — 2014. — Vol. 9, № 6. — e100379.
17. Pietrzik K. Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics [Text] / K. Pietrzik, L. Bailey, B. Shane // Clin. Pharmacokinet. — 2010. — Vol. 49, № 8. — Р. 535-548.
18. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate’s role [Text] / K.S. Crider, T.P. Yang, R.J. Berry [et al.] // Adv. Nutr. — 2012. — Vol. 3, № 1. — Р. 21-38.
19. Do folates have an impact of fertility? [Text] / T. Forges, H. Pellanda, C. Divigent [et al.] // Gynecol. Obstet. — 2008. — Vol. 36, № 9. — Р. 936-939.
20. Hyperhomocysteinemia: a risk factor in unexplained infertility [Text] / P. Dubey, N. Gupta, S. Dwivedi [et al.] // Contracept. Obstet. Gynecol. — 2013. — Vol. 2, № 2. — Р. 165-171.
21. Роль фолатов в репродукции. Медицинский форум [Текст] / Л.И. Малышева, И.Н. Фетисова, Н.С. Фетисов, А.В. Гордива // Медицинский форум. — 2015. — Т. 2, № 1. — С. 52-56.
22. The Rotterdam ESHRE/ ASRM- sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteriaand long-term health risks related to polycystic ovary syndrome (PCOS) [Text] // Hum. Reprod. — 2004. — Vol. 19, № 1. — P. 41-47.
23. Levels of lipoprotein and homocystein in non-obese and obese patients with polycystic ovary syndrome [Text] / M. Yilmaz, A. Biri, N. Bukan [et al.] // Gynecol. Endocrinol. — 2005. — Vol. 20, № 5. — Р. 258-263.
24. Bruno R.V., Comparison of two doses of metformin (2.5 and 1.5 g/day) for the treatment of PCOS and their effect on body mass index and waist circumference [Text] / R.V. Bruno, M.A. de Avila, F.B. Neves // Fertil. Steril. — 2007. — Vol. 88. — Р. 510-512.
25. Khalil I.A.M. The Effect of Vitamin B and Folic Acid Supplementation on Plasma Homocystiene Levels in Women with Polycystic Ovary Syndrome Treated with Metformin. A Randomized Controlled Trial [Text] / I.A.M. Khalil // Austin J. Reprod. Med. Infertil. — 2015. — Vol. 2, № 2. — Р. 1013-1017.
1. Caserta D, Adducchio G, Picchia S, et al. Gynecol Endocrinol 2014; 30(6): 347-402.
2. Diamanti-Kandarakis Е, Dunaif А. Endocrin Rev 2012; 33 (6): 981-1030.
3. Marshall JC, Dunaif A. Fertil Steril 2012; 97(1): 18-22.
4. Bertoldo M, Faure M, Dupont J, Froment P. Ann Transl Med 2014; 2(6): 1-33.
5. Diamanti-Kandarakis E, Economou F, Palimeri S, Christakou C. Ann N Y Acad Sci 2010; 1205: 192-198.
6. Simmons D. Best Pract Res Clin Endocrinol Metab 2010; 24(4): 625-634.
7. Palomba S, Falbo A, Russo T, Orio F. Hum Reprod 2010; 25(4): 1005-1013.
8. Tang T, Lord JM, Norman RJ et al. Cochrane Library 2012; 5: CD003053.
9. Viollet B, Guigas B, Sanz Garcia N, et al. Clin Sci (Lond) 2012; 122(6): 253-270.
10. Manzor-al-ajdad O, Samani EN, Abadi A. Int J Fertil and Sterilly 2011; 4(4): 168-171.
11. Calle de la M, Gallardo T, Diestro MD, et al. Clinical Medicine 2007; 129(8): 292-294.
12. Rekha S, Palet ML, Pooja G, et al. Intern J Medicine and Medical Sciences 2013; 5(3): 116-123.
13. McCarty MF. Med Hypoth 2000; 55: 289-293.
14. Wijeyaratne CN, Nirantharakumar K, Balen AH, et al. Clinical Endocrinol 2004; 60(5): 560-567.
15. Kilicdag EB, Bagis T, Zeyneloglu HB, et al. Hum Reprod 2005; 20(4): 894-899.
16. Liu Q, Li S, Quan H, Li J. PLoS One 2014(6): e100379.
17. Pietrzik K, Bailey L, Shane B. Clin Pharmacokinet 2010; 49(8): 535-548.
18. Crider KS, Yang TP, Berry RJ, et al. Adv Nutr 2012; 3(1): 21-38.
19. Forges T, Pellanda H, Divigent C, et al. Gynecol Obstet 2008; 36(9): 936-939.
20. Dubey P, Gupta N, Dwivedi S, et al. Contracept Obstet Gynecol 2013; 2(2): 165-171.
21.Maluhsevа LI, Fetisova IN, Fetisov NS, Gordiva AV. Medical Forum 2015; 2(1): 52-56.
22. The Rotterdam ESHRE/ ASRM- sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteriaand long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod 2004; 19(1): 41-47.
23. Yilmaz M, Biri A, Bukan N, et al. Gynecol Endocrinol 2005; 20(5): 258-263.
24. Bruno RV, . de Avila MA, Neves FB. Fertil Steril 2007; 88: 510-512.
25. Khalil IAM. Austin J Reprod Med Infertil 2015; 2(2): 1013-1017.

/83.jpg)
/84.jpg)