Статья опубликована на с. 29-34
Учет факторов риска
Знание факторов риска головной боли часто позволяет ее избежать.
Факторы риска, зависящие от пациента, мы устранить не можем, но у пациентов высокого риска следует либо выбрать другой метод анестезии, либо избежать факторов риска, связанных с иглой и техникой выполнения, — и то и другое в наших руках. Молодым пациентам без сопутствующих заболеваний можно смелее проводить общую анестезию, а где возможно — блокады периферических нервов. Это же касается худых женщин и лиц с головными болями в анамнезе. Для обезболивания вагинальных родов (минимум три фактора риска: молодость, женский пол и беременность, а иногда еще и худоба) можно применять эпидуральное обезболивание, паравертебральную блокаду, комбинированную спинально-эпидуральную аналгезию, причем с меньшим риском головной боли, чем только спинальную [2].
Факторы риска, связанные с иглой, вполне устранимы. Качество игл, зависящее от производителя, мало отражается на цене: лучшая их шлифовка не требует особых расходов при крупносерийном производстве. Модель, к сожалению, влияет на цену: иглы с карандашевидным кончиком (pencil-point) сложнее и дороже в изготовлении, но риск головной боли, особенно у рожениц, требует применения либо таких, либо самых тонких игл Квинке [1]. Калибр не зависит от стоимости, но очень влияет на риск головной боли [2]. Самые тонкие (G27 или G29) иглы менее практично использовать при небольшом опыте: они больше изгибаются по пути к оболочкам, приходится долго ждать появления капли ликвора. Но в акушерстве лучше не использовать иглы толще G25 (и уж точно не толще G22), а у остальных пациентов вполне годится G22, у больных пожилого возраста — даже G20. Напротив, в неврологии и нейрохирургии диагностическая пункция требует взятия достаточного объема ликвора для исследования, поэтому при такой пункции используют иглы не тоньше G22, а для снижения риска головной боли лучше использовать иглы pencil-point.
Факторы риска, зависящие от врача, в наших руках.
Преинфузия
Преинфузия (англ. prehydration, preloading — «преднагрузка инфузией») до спинальной пункции, по данным большинства авторов, не влияет на частоту головной боли [2]. Корреляция выявлена лишь в двух исследованиях [5, 7].
Медикаментозная профилактика
Медикаментозная профилактика головной боли кофеином, эуфиллином, магнием, индометацином согласно результатам большинства исследований бесполезна [2]. Однако анестезиологи из Шираза (Иран), вводившие внутривенно эуфиллин в дозе 1 мг/кг после пережатия пуповины при плановых кесаревых сечениях под спинальной анестезией (иглы G23), отметили снижение частоты головных болей с 23 до 5 %, а тяжелых головных болей — с 11 до 3 % [14].
В последние годы изучается дексаметазон, снижающий риск не только послеоперационной тошноты и рвоты [2], но и, по данным иранских авторов [8], существенно уменьшающий частоту головной боли после спинальной анестезии при кесаревом сечении. Однако другие авторы из Ирана [6], вводившие 8 мг дексаметазона внутривенно перед спинальной анестезией во время ортопедических операций на нижних конечностях, не выявили статистически значительного снижения частоты головной боли, хотя ее интенсивность была ниже после использования дексаметазона. Напротив, еще одна группа исследователей [19] из Тегерана (Иран) при внутривенном введении 8 мг дексаметазона сразу после пережатия пуповины при кесаревом сечении под спинальной анестезией не обнаружила снижения частоты послеоперационной тошноты и рвоты, но выявила увеличение частоты и интенсивности головной боли.
Анестезиологи из иранского города Исфахан [12] при спинальной анестезии (иглы Квинке G23) во время операций на нижних конечностях вводили профилактически внутривенно либо эуфиллин (1,5 мг/кг), либо дексаметазон (0,1 мг/кг), либо эуфиллин и дексаметазон, либо плацебо; после применения плацебо головная боль отмечалась у 43 % пациентов, эуфиллина — у 21 %, дексаметазона — у 17 %, обоих препаратов — лишь у 6 %.
Выбор местного анестетика
В одном исследовании обнаружена зависимость от местного анестетика. В Бостоне (США) проспективно изучено 2511 спинальных анестезий (иглы Квинке G26, срез кончика — параллельно продольной оси тела) при кесаревом сечении. В одной группе использовался 5% лидокаин в 7,5% глюкозе, в другой — 0,75% бупивакаин в 8,25% глюкозе, в третьей — 1% тетракаин в равном объеме 10% прокаина, объем инъектата варьировал от 1,2 до 1,8 мл. Выбор анестетика основывался на ожидаемой длительности операции: «быстрые» хирурги использовали лидокаин, «самые медлительные» — тетракаин. Головная боль после применения лидокаина наблюдалась у 9,54 % больных, бупивакаина — у 7,64 %, тетракаина — лишь у 5,85 %. Авторы [13] сами не знали, чем это объяснить: то ли различием амидных и эстерных местных анестетиков, то ли примесью концентрированной глюкозы к амидным анестетикам. В более поздних исследованиях (на меньшем материале) такая разница не подтверждена [11].
Поза пациента
Хорошо согнутая в пояснице спина не только облегчает спинальную пункцию, но и снижает риск головной боли. В момент пункции отверстия в твердой и паутинной оболочках, очевидно, совпадают (рис. 1).
А при выпрямлении спины после пункции эти оболочки смещаются по-разному, отверстия могут не совпадать, непроколотая паутинная оболочка может, по крайней мере частично, закрывать отверстие в твердой оболочке (рис. 2).
Доступ: лучше околосрединный
Парамедианный (околосрединный) доступ реже приводит к головной боли, чем медианный (срединный) [2]. Это объясняют несовпадением отверстий в твердой и паутинной оболочках (из-за косого хода иглы) и меньшим истечением ликвора (рис. 3).
Парамедианный доступ имеет и другие преимущества: 1) удается избежать плотной, иногда окостеневшей надостистой связки [4]; 2) концевой нити спинного мозга [4]; 3) выше успешность, особенно при деформациях позвоночника [2]; 4) не обязательно сгибание спины [2]; 5) реже бывают парестезии [2].
Военные врачи из Карачи [16], сравнив медианный и парамедианный (на 2 см латеральнее нижнего края вышележащего остистого отростка) доступы иглами Квинке при спинальной анестезии во время операций внизу живота и на нижних конечностях у 100 пациентов, отметили при парамедианном доступе больший уровень успешности при меньшем числе попыток и парестезий (табл. 1).
Недостатки: 1) игла проходит большее расстояние; 2) новичку труднее представить направление иглы; 3) новичку легче задеть корешок или корешковую артерию; 4) чаще появляется кровь из иглы, что объясняется большим числом эпидуральных вен по бокам от срединной плоскости [16]; 5) описан один случай забрюшинной гематомы [2]; 6) из-за трудностей с ориентирами такой доступ, возможно, опаснее при рискованных пункциях выше L2. Кстати, выше поясничного уровня (где можно задеть спинной мозг) С.С. Юдин использовал строго срединный доступ [4].
Место прокола кожи, по данным разных источников, — от 6 мм до 3 см (чаще всего на один поперечный палец — примерно 2 см) вбок от срединной линии, напротив избранного промежутка или несколько ниже (каудальнее): напротив верхнего края или напротив середины остистого отростка нижележащего позвонка.
Игла, направленная кпереди и немного (около 15°) медиально и немного (около 15°) краниально, последовательно проходит кожу, подкожную жировую клетчатку, желтую связку, эпидуральное пространство, твердую оболочку, субдуральное пространство, паутинную оболочку и входит в подпаутинное пространство.
Надостистую и межостистую связки игла не затрагивает. Цель — пройти через очень васкуляризованное эпидуральное пространство (на глубине около 5 см) в центре межостистого промежутка, где меньше кровеносных сосудов. Точно выбрать нужное направление трудно без значительного опыта в спинальной анестезии, поэтому этот доступ — не для начинающих.
Направление среза иглы Квинке
Срез кончика Квинке (Quincke-point) всегда должен находиться латерально (к боку пациента): тогда значительно ниже риск постпункционной головной боли (рис. 4).
При срединном (медианном) доступе неважно, к какому боку пациента будет обращен этот срез. Хотя некоторые анестезиологи поворачивают его в сторону оперируемой области, то есть вправо, перед аппендэктомией или перед операцией на правой ноге.
Но при околосрединном (парамедианном) доступе этот срез лучше повернуть к боку и животу пациента, к боку пациента и анестезиологу. То есть срез надо повернуть от себя, а не на себя. Это влияет на форму лоскута, «вырезанного» иглой Квинке в твердой оболочке.
В экспериментах с твердой мозговой оболочкой спинного мозга трупов [9] и с моделями из эластичного пластика [9] показано, что перпендикулярный (как при срединном доступе) прокол оболочек иглой Квинке образует лоскут, способный открываться в обе стороны (рис. 5, позиция А), а косой (как при околосрединном доступе) — лишь в одну сторону. Если срез иглы обращен к анестезиологу и срединной плоскости пациента (рис. 5, позиция Б, и рис. 6), лоскут способен открываться лишь наружу, способствуя утечке ликвора. Если же срез иглы обращен латерально и к пациенту (рис. 5, позиция В, и рис. 7) — лишь вовнутрь, препятствуя утечке ликвора.
/32.jpg)
Такое «самозакрывающееся» (под напором ликвора) отверстие в дуральном мешке объясняет отсутствие головных болей даже у рожениц после спинальной анестезии с применением довольно толстых дешевых игл с кончиком Квинке по методике умершего в 2008 году доктора Bela Hatfalvi, доцента одного из университетов США, web-страница (http://www.go-aps.com/spinal/index.htm) которого до сих пор поддерживается его учениками.
За 20 лет (1954–1973) он и его резиденты (интерны) выполнили 4465 спинальных анестезий иглами калибра G20 («желтыми») с кончиком Квинке (рис. 7) без единого случая головной боли, хотя всем пациентам разрешали ходить и не рекомендовали водной нагрузки [9].
Мандрен должен находиться в игле при проколе ею оболочек, а после инъекции местного анестетика — снова вводиться в иглу до отказа перед ее извлечением. Почему — будет видно далее.
Извлечение иглы
Возможны три варианта: вместе со шприцем, после отсоединения шприца либо после плотного вставления мандрена.
Извлечение иглы вместе со шприцем — самый быстрый вариант. Казалось бы, никаких сдвигов жидкостей не должно быть. Но, как показано на рис. 8, при завершении введения анестетика немного ликвора входит в иглу.
Извлечение иглы без шприца — как после диагностической спинальной пункции — тем более сопровождается истечением ликвора, даже в момент выхода иглы из подпаутинного пространства (рис. 9).
Введение мандрена (до упора) перед извлечением иглы гарантирует наименьший риск постпункционной головной боли (рис. 10).
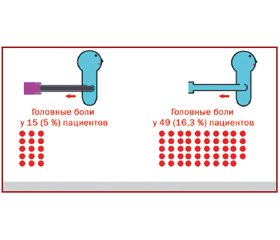
Неврологи из Мюнхена [17] изучили частоту головных болей после диагностических спинальных пункций иглами G21 с кончиком Шпротте, то есть с отверстием сбоку от острия (рис. 11).
Все пациенты случайным образом были разделены на две группы по 300 человек: в одной перед извлечением иглы в нее вводили мандрен, в другой — не вводили (рис. 12).
После предварительного введения мандрена головные боли отмечались значительно (р < 0,005) реже (в 5 % случаев), чем после извлечения иглы без мандрена (в 16,3 % случаев) (рис. 10). Это объясняют тем, что при других вариантах трабекула паутины субарахноидального пространства может попасть в просвет иглы и, как хирургическая нить, протягиваться через твердую мозговую оболочку (рис. 13).
Такая подпаутинная трабекула, как фитиль, «помогает» ликвору долго вытекать в эпидуральное пространство, что приводит к головной боли (рис. 14).
Поэтому и в неврологии, и в анестезиологии рекомендуется перед извлечением спинальной иглы вставлять в нее мандрен [17, 18].
Но турецкие анестезиологи [15] в недавнем исследовании 630 плановых спинальных анестезий иглами Квинке G25 («оранжевыми») не выявили разницы в частоте головных болей при извлечении иглы с предварительным возвращением в нее мандрена и без него; они объясняют отличие своих результатов и закономерности, выявленной мюнхенскими неврологами [17], меньшим диаметром своих игл и «заталкиванием» трабекул в подпаутинное пространство вводимым в него анестетиком. По нашему мнению, менее эластичные поршни дешевых шприцев могут не вызывать обратного тока ликвора в иглу (рис. 8).
После пункции
Постельный режим как профилактическое средство бесполезен [2]. Хотя понятно, что если голова уже заболела — лучше лежать. Обильное питье (или инфузия при неспособности много пить) с профилактической целью оказалось не эффективным [2], однако ограничивать прием жидкости не следует.
Прогноз
В большинстве случаев постпункционная головная боль проходит без последствий, как при лечении, так и без него, но иногда может стать хронической, затянувшись на месяцы и даже годы [2]. Уже поэтому ее надо лечить сразу и следить за ее характером, особенно нетипичным, дабы вовремя выявить редкое, но крайне опасное внутричерепное кровоизлияние.
Список литературы
1. Запорожан В.Н., Тарабрин О.А., Басенко И.Л., Ткаченко Р.А., Буднюк А.А., Бутенко О.Л., Николаев О.К. Спинальная анестезия при оперативном родоразрешении. — К.: Старт, 2013. — 320 с.
2. Суслов В.В., Фесенко У.А., Фесенко В.С. Спинальная анестезия и аналгезия: Руководство для врачей. — Харьков: СИМ, 2013. — 544 с.
3. Шифман Е.М. Сто лет головной боли. Клиническая физиология постпункционной головной боли: Пособие для врачей. — 2-е изд., испр. — М.: МежЭкспертПресс; Петрозаводск: ИнтелТек, 2004. — 64 с.
4. Юдин С.С. Спинномозговая анестезия: История, основания, техника и клиническая оценка метода и его применения. — Серпухов, 1925. — 348 c.
5. Chong Y.F.V., Tan K. A survey of lumbar puncture complications and their risk factors: the influence of height, intravenous hydration and systolic blood pressure on post-dural puncture headache // Neurology. — 2012. — Vol. 78, Meeting Abstracts 1. — P04.250.
6. Doroudian M.R., Norouzi M., Esmailie M., Tanhaeivash R. Dexamethasone in preventing post-dural puncture headache: a randomized, double-blind, placebo-controlled trial // Acta Anaesthesiol. Belg. — 2011. — Vol. 62, № 3. — P. 143-146.
7. Fesenko U., Sharlay K. Risk factors for postpuncture headache // Anestezjologia Intensywna Terapia. — 2014. — Vol. 46, Suрpl. 1. — P. 21.
8. Hamzei A., Basiri-Moghadam M., Pasban-Noghabi S. Effect of dexamethasone on incidence of headache after spinal anesthesia in cesarean section. A single blind randomized controlled trial // Saudi Med. J. — 2012. — Vol. 33, № 9. — P. 948-953.
9. Hatfalvi B.I. Postulated mechanisms for postdural puncture headache and review of laboratory models: clinical experience // Reg. Anesth. — 1995. — Vol. 20, № 4. — P. 329-336.
10. Jones R.J. The role of recumbency in the prevention and treatment of postspinal headache // Anesth. Analg. — 1974. — Vol. 53, № 5. — P. 788-796.
11. Morewood G.H. A rational approach to the cause, prevention and treatment of postdural puncture headache // Can. Med. Assoc. J. — 1993. — Vol. 149, № 8. — P. 1087-1093.
12. Naghibi K., Hamidi M. Prophylactic administration of aminophylline plus dexamethasone reduces post-dural puncture headache better than using either drug alone in patients undergoing lower extremity surgery // Adv. Biomed. Res. — 2014. — Vol. 3. — P. 5.
13. Naulty J.S., Hertwig L., Hunt C.O., Datta S., Ostheimer G.W., Weiss J.B. Influence of local anesthetic solution on postdural puncture headache // Anesthesiology. — 1990. — Vol. 72, № 3. — P. 450-454.
14. Sadeghi S.E., Abdollahifard G., Nasabi N.A., Mehrabi M., Safarpour A.R. Effectiveness of single dose intravenous aminophylline administration on prevention of post dural puncture headache in patients who received spinal anesthesia for elective cesarean section // World J. Med. Sci. — 2012. — Vol. 7, № 1. — P. 13-16.
15. Sinikoglu N.S., Yeter H., Gumus F., Belli E., Alagol A., Turan N. Reinsertion of the stylet does not affect incidence of post dural puncture headaches (PDPH) after spinal anesthesia // Rev. Bras. Anestesiol. — 2013. — Vol. 63, № 2. — P. 188-192.
16. Sohail B., Imran-ul-Haq, Ameer K., Iqbal R., Adnan A. Comparison of median and paramedian techniques of spinal anaesthesia // Pakistan Armed Forces Med. J. — 2011. — № 2.
17. Strupp M., Brandt T., Müller A. Incidence of post-lumbar puncture syndrome reduced by reinserting the stylet: a randomized prospective study of 600 patients // J. Neurol. — 1998. — Vol. 245, № 9. — P. 589-592.
18. Tilakaratna P. «Reverse flow» during spinal anaesthesia injections // Anaesthesia. — 2012. — Vol. 67, № 8. — P. 930-931.
19. Yousefshahi F., Dahmardeh A.R., Khajavi M., Najafi A., Khashayar P., Barkhordari K. Effect of dexamethasone on the frequency of postdural puncture headache after spinal anesthesia for cesarean section: a double-blind randomized clinical trial // Acta Neurol. Belg. — 2012. — Vol. 112, № 4. — P. 345-350.
/34.jpg)

/30.jpg)
/31_2.jpg)
/31.jpg)
/32.jpg)
/33.jpg)